Electron Microscopic Observation and Ultrastructural Analysis of Outer Membrane Vesicles Released by the Endophyte within Azolla microphylla
-
摘要: 前人研究表明,自然界中独立生活或纯培养的细菌等原核微生物会分泌外膜泡囊,这些泡囊在多个生物学过程中有着重要的作用。本研究用扫描和透射电镜对水生植物满江红体内的共生蓝细菌和内生细菌(合称内生菌)产生的泡囊进行了观察和超微结构特征分析。结果显示,这些内生菌不仅在活跃的营养生长期,而且在有性繁殖阶段均会释放泡囊,甚至在濒临死亡时也会排出泡囊。根据这些外膜泡囊的超微结构特征,将之分成5种类型,即中透型、内膜型、单核型、多核型和多泡型。通过对泡囊产生过程中超微结构变化的分析,认为本研究材料的内生菌周质层中的肽聚糖参与外膜泡囊的生成与释放。这一结果对阐明原核生物泡囊的发生机制具有普遍意义。本研究还对电镜图像的判读进行了讨论,以避免由于样品前处理等人为干预产生的假象而导致误判。Abstract: Previous studies have revealed that the free-living or purely cultured prokaryotes produce outer membrane vesicles (OMVs) which play a critical role in biological processes. In this study, the OMVs secreted by the symbiotic cyanobacterium and other endophytic bacteria (together referred to as endophyte) within a small water fern, Azolla-cyanobacterium association, were investigated by using scanning and transmission electron microscopies (EM). The results demonstrated that the vesiculation of both the cyanobacterium and the bacteria occurs not only at the stage of active vegetative growth, but their reproductive stages and even in dying process. Based on the ultrastructural characteristics, the OMVs discovered in the materials we used could be divided to five types:bilayer-couple with a central transparent area, outer-inner membranes, bilayer-couple with a core, bilayer-couple with multi-cores and bilayer-couple with multi-bulbs. Analyzing the changes of the cellular ultrastructure has led to a suggestion that peptidoglycan in periplasmic space is involved in formation and discharge of OMVs, which seems to have a universal significance to illuminate the mechanism for biogenesis of OMVs. In this paper, the interpretation of the EM images is also discussed, so as to avoid the misinterpretation caused by the artifacts due to the sample pretreatment.
-
Keywords:
- outer membrane vesicle /
- cyanobacterium /
- bacterium /
- electron microscopy /
- ultrastructure
-
几乎所有的真核生物、古细菌和真细菌都会产生和释放外膜泡囊(outer membrane vesicles,OMVs), 或称胞外泡囊(exocellular vesicles),外泌体(exosome)[1]。对于细菌OMVs的研究始于20世纪90年代,但只是近些年才引起普遍重视。研究表明,OMVs的产生并非偶发事件,而是生物细胞的一种常态,是对內部压力和外部逆境反应的产物。其产生的水平受温度、氧压、营养及多种理化、生物信号等因子的影响[2-3]。近年来随着测序技术的快速发展和DNA、RNA和蛋白质等生物大分子作为OMVs内含物的相继发现,以及它们在细胞通讯、基因水平转移、蛋白质转运、病原菌毒素释放、抗菌素抗性基因传递,以及与宿/寄主相互作用的阐明,尤其是作为抗癌疫苗、药物载体潜在可能性激发的研究热情,使有关微生物OMVs的研究正在成为微生物学研究的一个热点领域。CNS(Cell, Nature和Science)等世界顶级科技刊物近年来均有多篇综述和研究报告[1-6]。
一般认为,OMVs是由脂质双层膜(bilayer-couple)包裹的圆球形小膜泡,其直径在20~300 nm,是普通光学显微镜难以分辨的微小结构。而电子显微镜(扫描、透射;超薄切片和负染等)则被认为是揭示OMVs发生、释放和吸收的最佳研究工具之一[4-6]。然而,迄今为止,大部分有关OMVs的研究取材于自然界独立生活的或模式生物纯培养的样品。有关生物活体内共生或内生微生物的OMVs研究由于技术困难,迄今鲜有报道。
本研究以一种微型的水生蕨类植物满江红为研究材料。满江红Azolla,俗称红萍,是蕨类与固氮蓝细菌(又称蓝藻,cyanobacterium)的共生体[7]。它繁殖快,易培养。该共生体的奇妙之处在于两者不仅互惠互利,而且同步发育,世代相伴。在满江红的营养生长阶段,共生蓝细菌栖息在满江红细小的叶腔(长轴约1 mm)内;而在满江红的有性生殖过程中,蓝细菌进入宿主的孢子果(sporocarp)果腔内(直径约0.3 mm)并分化为厚垣孢子[7-8]。因此它是研究植物-微生物相互作用理想的模式生物。本课题组之前的研究表明,除了共生蓝细菌外,满江红体内还有多种细菌等微生物伴生[9]。本文将共生蓝细菌和伴生细菌统称为内生菌(endophyte)。本研究以扫描和透射电镜揭示满江红内生菌外膜泡囊的发生和超微结构特征及其类型,分析其潜在的功能;并对如何判读扫描和透射电镜图像进行了讨论,以避免由于人为因素产生的假象而导致误判。
1. 材料与方法
1.1 供试材料及其培养
供试材料为小叶满江红Azolla microphilla,原产北美洲,系20世纪80年代从国际水稻研究所引进。材料经表面灭菌后,在实验室用改良的IRRI培养液进行纯培养,以排除外源污染和干扰。培养温度为(25±2)℃,每日连续光照8 h(光强3 000 lx)。
1.2 扫描电镜样品制备与观察
选取上述植物的营养体或结孢萍体,在解剖镜下细心去除根系后,将剥离的萍体或孢子果用2.5%戊二醛溶液(0.1 mol·L-1磷酸缓冲液,pH 7.2)在室温下固定4 h,用同样的磷酸缓冲液洗涤3次后,用2%锇酸在4℃下固定2 h,又经磷酸缓冲液充分洗涤后,用乙醇逐级脱水,并经环氧丙烷替换两次。试样用HCP-2型临界点干燥器干燥,经干燥的样品黏附于铜台上,在高倍解剖镜下用细针解剖,使满江红叶腔内的共生蓝细菌和内生细菌充分暴露,再用IB-5型离子溅射仪喷镀金钯。用JEOL JSM-6380lv型扫描电子显微镜观察并拍片。加速电压15 kV。
1.3 透射电镜样品制备与观察
将上述经环氧丙烷置换的部分样品包埋于Epon-812环氧树脂,后用LKB-Ⅳ型切片机切成0.05 μm的薄片,醋酸铀和柠檬酸铅双重染色;负染样品则是将培养的新鲜满江红个体在解剖镜下剖开叶腔,用细针挑取腔内汁液,涂抹于铜网上,用3%磷钨酸(pH6.0)染色、风干。用Zeiss EM-906型透射电镜观察并拍片。加速电压80 kV。
2. 结果与分析
2.1 扫描电镜揭示内生菌OMVs的发生
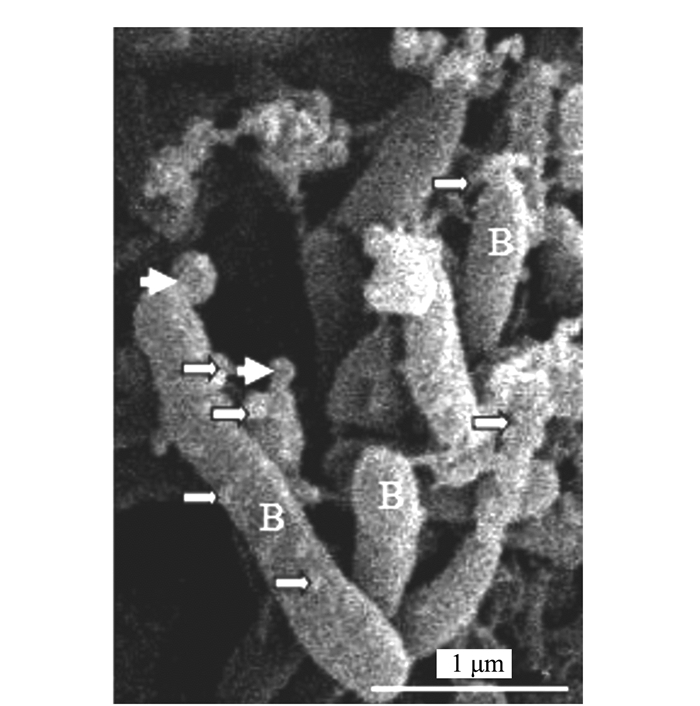
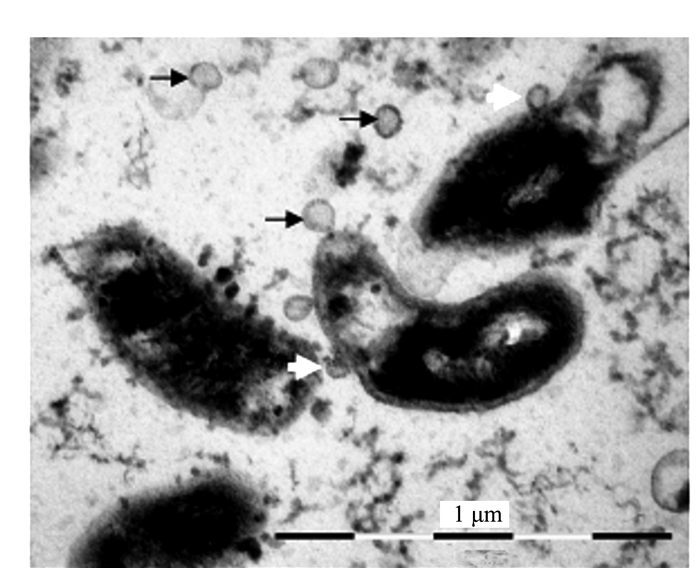
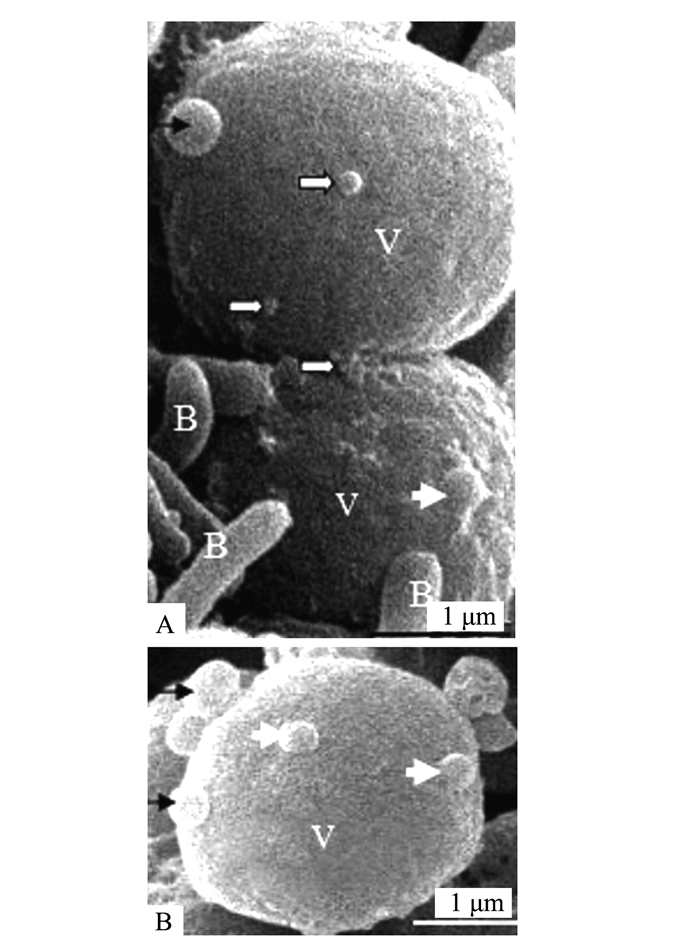
共生蓝细菌是由多个近似椭圆形细胞组成的丝状体。扫描电镜观察表明,共生蓝细菌的营养细胞(V)和内生细菌(B)表面(图 1)均可见到直径为20~100 μm大小不等的细小突起(图 1、2中的细长白箭头),此为OMVs(即外膜泡囊,下简称泡囊)发生的初始阶段,或第一阶段。共生蓝细菌细胞产生不同大小的膜外泡囊,显示泡囊处于不同的发育阶段。这些突起物随后“出芽(budding)”长成微球形结构(图 1、2中的短粗白箭头)。这些微球体的外部表面结构与大多数细菌产生泡囊(OMVs)的形态特征大体相似[1, 5]。图 2杆状细菌表面出现的大小不等的突起物,表明该菌正活跃分泌泡囊。应该指出的是图 3中圆球形结构(B)与泡囊也很相似,但是否予以认定,将在讨论部分进一步阐述。
2.2 用透射电镜揭示泡囊的发生过程
蓝细菌的细胞结构具有革兰氏阴性细菌的特征,即由外膜(outer membrane, OM)和内膜(inner membrane, IM; 即细胞质膜, plasm membrane)组成,外膜和内膜之间为由肽聚糖(peptidoglycan, PG)层和周质蛋白(periplasmic protein)构成的周质层(periplasmic space或periplasma, PP)。PG为网状结构,借助锚定蛋白与OM和IM形成共价链接[1, 6]。而外膜和肽聚糖层即通常所称的细胞壁。
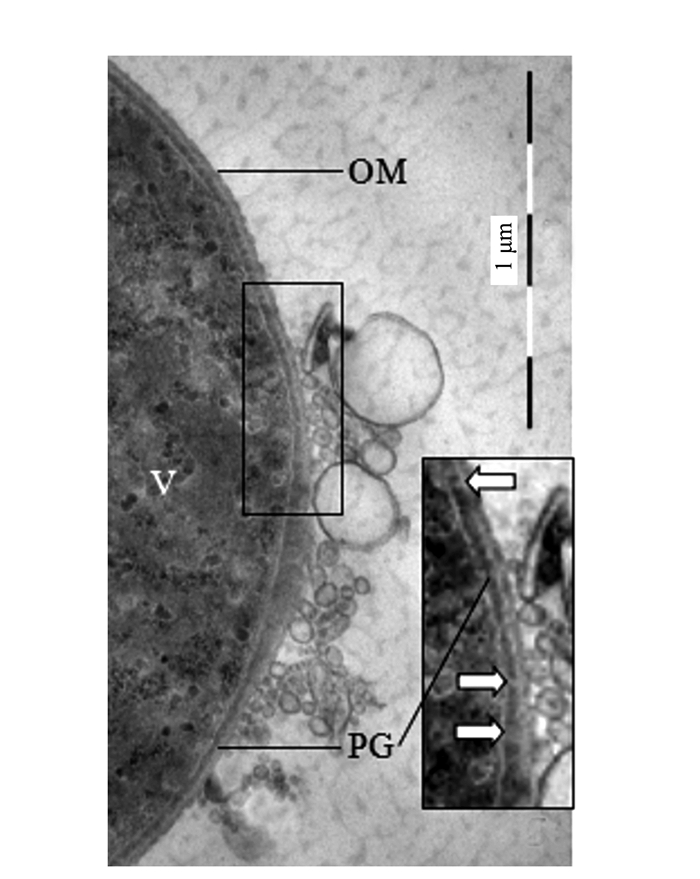
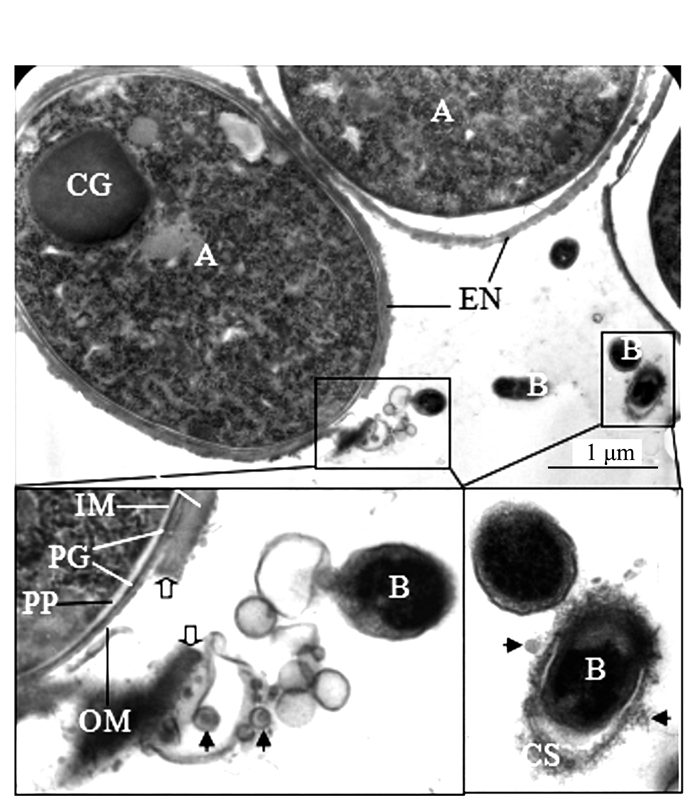
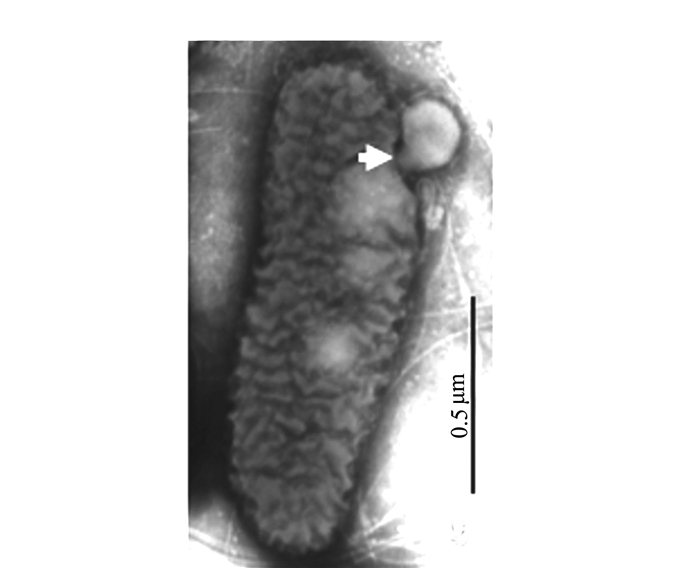
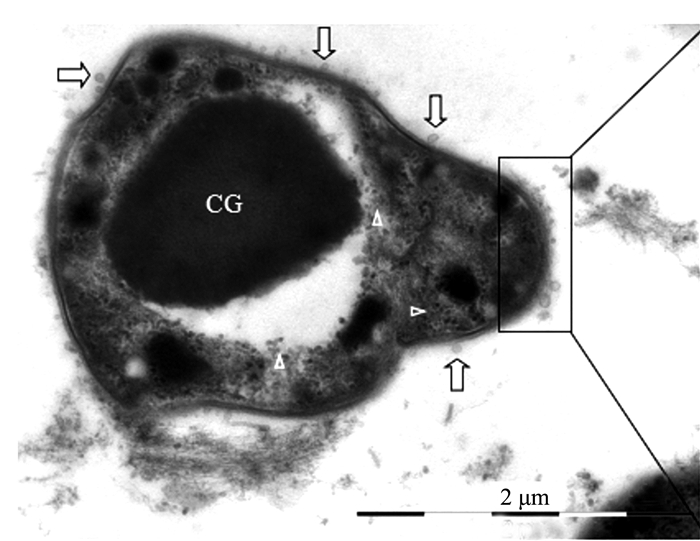
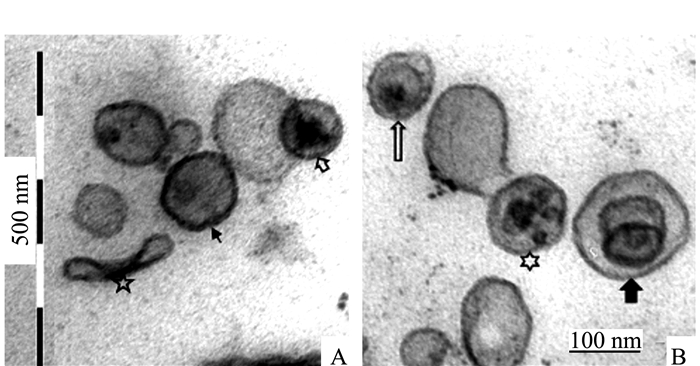
透射电镜观察的结果为揭示和确认泡囊的发生提供了更为直接的证据。图 4、5显示,满江红的共生蓝细菌正向周围分泌大小不等、形态各异的泡囊。图 4系满江红叶腔中蓝细菌的营养细胞(V)右边框的放大区域显示该菌细胞壁周质中的肽聚糖层出现的断裂与缺口(白箭头)并释放出泡囊,此为初始阶段。图 5为进入满江红孢子果的蓝细菌的厚垣孢子(A)和细菌细胞(B)。厚垣孢子内有较大的藻蓝素颗粒(cyanophycine granule, CG), 外有被膜(envelop, EN)包裹。该图下方的两个放大框分别显示两者均分泌不同类型的泡囊。图 5下方左侧放大框中厚垣孢子的部分外包膜已断裂外移(白箭头)。泡囊分泌过程亦如图 6所示,该泡囊正在释放过程中,尚未脱离菌体。菌体右侧中部的外膜和内膜外延并隆起呈近似的微球形结构,其基部有通道(bubble tube,图 6、7中的短粗白箭头)与周质层(PP, 图 5)相通。这也为负染试验结果所印证(图 7)。随后微球体进一步膨大,但仍未脱离母体细胞(图 8中短粗白箭头所示),此为中期或第二阶段;当微球体膨大到一定程度,在某种张力的作用下与母体细胞分离,外延的外膜和内膜也同时闭合,微球体即为成熟的泡囊,并游离于胞外空间,此为第三阶段(图 1、5、8中的黑色箭头所示)。
2.3 满江红有性繁殖阶段内生菌外膜泡囊的释放
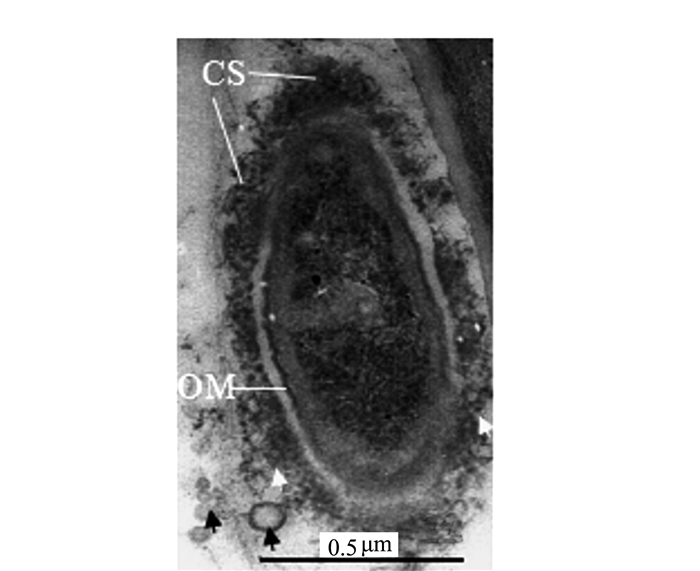
在满江红的有性繁殖阶段,进入满江红孢子果内的蓝细菌将分化成为厚垣孢子,其主要特征是细胞体积明显增大,其细胞壁被一层厚的外包膜(envelope,EN)所包裹(图 5左框放大部分),在分化为厚垣孢子的过程中会释放泡囊(图 5)。濒临死亡的蓝细菌也会大量释放泡囊。图 9中原来的椭圆形蓝细菌细胞(图 1)皱縮成不规则的形状,其外膜和内膜开始内陷,但其细胞膜系统和内含物(如藻蓝素颗粒(CG)仍较完整,是一个具有类似凋亡(apoptosis-like)早中期特征的蓝细菌细胞[10-11],该细胞内有不少颗粒样的泡囊(图 9中的白色三角形所示),其大小和紧靠外膜的胞外泡囊(图 10白色长箭头)相近。值得注意的是, 图 10为图 9中右框的放大部分,该放大框显示,与释放到胞外的泡囊相对应的肽聚糖层(PG)都出现断裂或缺口(放大框内白箭头指向, 图 4放大框)。
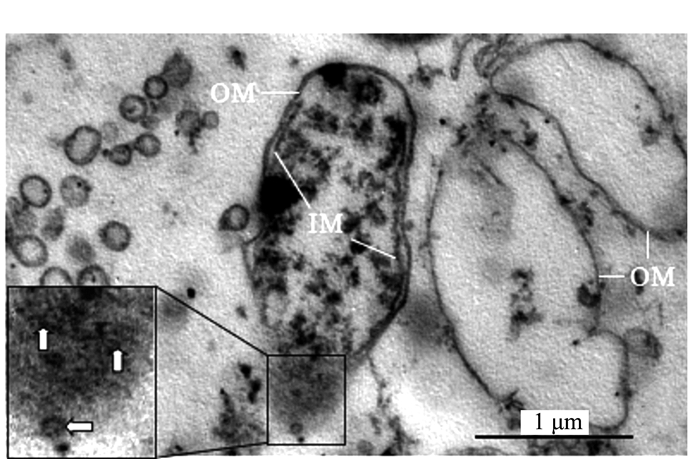
而在满江红孢子果内的部分细菌也同步分化产生厚层荚膜(capsule, CS)以度过休眠期或抵御逆境。正如图 11、12所示,与营养生长期的内生细菌一样,它们在荚膜形成期也会将泡囊分泌到胞外空间(图 5右框放大部分)。图 12显示,满江红叶腔内的处于类似坏死性死亡(necrosis-like)中后期的内生细菌[10-11],左侧菌体的细胞膜系统已经破裂,内膜(IM)已不完整,随着泡囊的向外释放,其细胞质大多流失。而图中右侧两个菌体细胞质已完全流失,剩下躯壳(外膜, OM)。
2.4 内生菌外膜泡囊的超微结构特征
除图 3外,所有各图均展示出大小不等的OMVs。就结构而言,它们大多为两层单位膜包裹的圆球形颗粒体,直径在20~300 nm,大小差异之大以图 4为甚。但也有个别扁平或椭圆形的泡囊(图 13)。除了图 5中个别泡囊含有一个“核”外,图 4~12中大部分的泡囊内部均为电子透明区域。然而图 13则显示出不同的结构。有的有两个或两个以上的“核”,有的则含有闭合或套叠的实心或空心膜泡。
3. 讨论与结论
3.1 关于内生菌OMVs的发生
2009年,本课题组曾描述了共生蓝细菌在满江红孢子果内转化为厚垣孢子(akinete)并分泌含有DNA的泡囊的过程[8]。这一结果也在本研究中进一步证实。本研究还发现,在满江红的营养生长阶段,共生蓝细菌或内生细菌也能释放OMVs,其释放过程大致可以分为3个阶段,这与Sapna Jain等引述的泡囊形成三部曲基本相同[12]。尤其应当强调的是,即将死亡的内生菌,无论是蓝细菌或真细菌,都会释放出泡囊。
不同生长期的内生菌释放泡囊可能用于满江红体内微生物菌落内的细胞通讯、物质交换和生物被膜(biofilm)构建等[9]。而上述内生菌的死亡类似于细胞程序性死亡(program cell death)。它们通过牺牲自身,并在细胞解体前释放OMVs,为其他健在的内生菌提供营养,以保证种群本身的延续,维护满江红内生微生物群落的生态平衡[9-10]。
3.2 内生菌OMVs的超微结构分型
根据OMVs的超微结构特征,本研究所观察到的OMVs至少可以分为如下类型:①内透型,即泡囊内为电子透明区域,未见电子密度高的内含物。图 4~12中大部分的泡囊属于这一类型,其脂质双层膜可能由原细胞的外膜外凸,弯曲,接合而成;②单“核”型,即泡囊内或中央有一规则或不规则的电子致密区域,如图 5左放大框中的黑箭头和图 13-A白箭头所示;③内膜型,即泡囊内还有一由双层膜包裹的电子密度较高的核心。Carla Perez-Cruz等将之称为内外膜泡囊(outer-inner membrane vesicles),认为它们是由原细胞的外膜和内膜同步外凸后演变而成[13-14], 如图 13-B中长白箭头和图 5中黑箭头所示;④多“核”型,即泡囊内有多个实心或空心颗粒,如图 13-A中的黑箭头和图 13-B中的六角形所示;⑤多泡型,即泡囊内有两个或以上的闭合或套叠的实心或空心膜泡,如图 15中黑箭头所示。2、4、5型泡囊目前未见报道。
3.3 关于OMVs的产生和释放机制
根据文献报道,迄今有如下4种假设的模式:①由于细菌细胞壁中与肽聚糖层相对应的外膜生长过快,导致两者间的共价链接中断,致使外膜向外突出,进而形成泡囊(图 6、7);②由于周质层(图 5)中的蛋白质或肽聚糖片段错误折叠,过度表达并累积,形成的膨压而致使外膜膨出而成;③由于某种诱导弯曲分子的诱导或某种酶的作用使得肽聚糖层断裂、缺口,引起外膜的不均匀外延所致;④某种超分子蛋白质将内膜与外膜片段绑结在一起,在周质层内包装成形后释出[1, 6-7, 12, 15-17]。尽管上述4种生物力学模型还缺乏分子水平的有力证据,但普遍认为,肽聚糖层(PG)、周质层(PP)和内、外膜(IM,OM)的变化与泡囊的形成密切相关。本研究结果也表明,肽聚糖很可能参与了泡囊的形成。如图 4和图 10的放大框所示,与释放到胞外的泡囊相对应的肽聚糖层(PG)都出现断裂或缺口。鉴于不少研究者从泡囊中检出含有肽聚糖的周质层复合物[17-19],表明肽聚糖在OMVs形成中具有重要作用。
一般认为,泡囊的内含物和细菌分泌到胞外的蛋白质等分泌物一样,大多在周质层中合成、折叠或包装[6, 17-18, 20]。但从图 9看到,正处于凋亡早中期的蓝细菌细胞内已有不少颗粒样的泡囊。这似乎表明,这些泡囊在细胞质内已经形成或开始形成,并经由细胞壁间隙(肽聚糖层的缺口处)释放到胞外。也就是说,濒临死亡的细胞其泡囊形成和释放机制与健康细胞可能有所不同。
3.4 OMVs图像的判读
比起光学显微镜,电子显微镜在观察诸如OMVs之类的微小对象的形态结构方面具有无可比拟的优势。但由于样品经过一系列的前处理后,难免有人工干预的痕迹,不可能百分百再现原貌。所以在对结果进行判断或定性时,必须十分谨慎。扫描电镜可以窥探微生物表面的细微末节,展现生动的“立体”形象。但对于生物材料,其分辨率仍受到一定限制,而且仅限于表面形态,很难对大小相同,表观相似的形体进行定性分析。如图 3的蓝细菌表面有4个形态大小与泡囊十分相似的结构,但不能因此就断定这些结构是该蓝细菌分泌的OMVs。这是基于以下考虑:①图 3没有像图 1和图 2那样有大小不同的胞外泡囊。而图 4、5、9~13展示的信息表明,满江红的共生蓝细菌和内生细菌分泌的胞外泡囊直径变幅很大;②即使有些细菌释放的泡囊大小相近(图 8),但也有部分“发芽”的泡囊,其基部与母体细胞相连(图 1、8白箭头,图 6、7),说明该颗粒体源自该细胞;③如前所述,泡囊的发生与细胞“出芽”部位多因内侧胞浆膨压增大,而表面隆起。而图 3中的两个颗粒形结构所处的细胞表面反而下陷。经我们多次比较观察,认定这些颗粒结构是一种球形细菌而非泡囊。应当指出的是,用扫描电镜观察到的类似泡囊的结构,最好要用透射电镜的观察结果予以确认,即提供“脂质双层膜包裹的微球体”的证据。
在只有单一菌种存在的微环境中,用透射电镜观察泡囊发生是一种比较可靠的方法。但在有两种以上的细菌群落中观察到的OMVs,它们的归属有时难以判断。需要注意的是,图 5中白箭头所示的是一蓝细菌外包膜(EN)片段裂口,很可能是超薄切片过程中造成的机械损伤,致使该断裂片段外移。原先靠近包膜的泡囊也随之漂移。这就又一次提示我们,在进行电镜图像判读时,应排除人为干预所产生的假象,从而得出符合真实的结论。
总之,OMVs研究目前还处于幼年期,揭示其生物发生和功能的分子机制,有待新技术的开发应用和不会产生OMVs突变体的发现与获得。
-
-
[1] CARMEN S, META J K. Outer-membrane vesicles from Gram-negative bacteria:biogenesis and functions[J]. Nature reviews microbiology, 2015, (13):605-620. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ025687427/
[2] IVAPRIYA K V, ASHLEY J R, BHARAT B, et al. Bacterial outer membrane vesicles mediate cytosolic localization of LPS and caspase-11 activation.[J]. Cell, 2016, 165(5):1106-1119. DOI: 10.1016/j.cell.2016.04.015
[3] BILLER S J, SCHUBOTZ F, ROGGENSACK S E, et al. Bacterial vesicles in marine ecosystems.[J]. Science, 2014, 343:183-186. DOI: 10.1126/science.1243457
[4] SYBREN L N M, XANDRA O B, ALISSA M. Weaver. Extracellular Vesicles:Unique Intercellular Delivery Vehicles.[J]. Trend in Cell Biology, 2017, 27(3):172-188. DOI: 10.1016/j.tcb.2016.11.003
[5] HYUNJIN Y. Bacterial Outer Membrane Vesicles as a Delivery System for Virulence Regulation[J]. J Microbiol Biotechnol, 2016, 26(8):1343-1347. DOI: 10.4014/jmb.1604.04080
[6] SANDRO R, FRANZ G Z, FATIH C, et al. Bacterial outer membrane vesicle biogenesis:a new mechanism and its implications[J]. Microbial Cell, 2016, 3(6):257-259. DOI: 10.15698/mic
[7] WEIWEN ZHENG, LIANG RANG, BIRGITTA B. Structural Characteristics of the cyanobacterium-Azolla symbioses[M]]//Katharina Pawlowski (editor). Prokaryotic Symbionts in Plants. Heidelberg, Germany[J]. Springer, 2009, 235-264.
[8] 郑斯平, 陈彬, 关雄, 等.小叶满江红(Azollamicrophylla)内生细菌多样性的PCR-DGGE及电子显微镜分析[J].农业生物技术学报, 2008, 16(3):508-514. DOI: 10.3969/j.issn.1674-7968.2008.03.025 [9] ZHENG W, BERGMAN B, CHEN B, et al. Cellular responses in the cyanobacterial symbiont during its vertical transfer between plant generations in the Azollamicrophylla symbiosis[J]. New Phytol, 2009, 181:53-61. DOI: 10.1111/j.1469-8137.2008.02644.x
[10] GALLUZZI L, AARONSON S A, ABRAMS J, et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes[J]. Cell Death Differ, 2009, 16:1093-1107. DOI: 10.1038/cdd.2009.44
[11] ZHENG W, RASMUSSEN U, ZHENG S, et al. Multiple Modes of Cell Death Discovered in a Prokaryotic (Cyanobacterial) Endosymbiont[J]. PLoS ONE, 2013, 8(6):e66147. DOI: 10.1371/journal.pone.0066147
[12] SAPNA J, JONATHAN P. Bacterial membrane vesicles as novel nanosystems for drug delivery[J]. Int J Nanomedicine, 2017, (12):6329-6341. http://europepmc.org/abstract/MED/28919737
[13] CARLA PÉREZ-CRUZ, ORNELLA CARRIÓ N, LIDIA DELGADO, et al. Elena Mercade. New Type of Outer Membrane Vesicle Produced by the Gram-Negative Bacterium Shewanellavesiculosa M7T:Implications for DNA Content[J]. Appl Environ Microbiol, 2013, 79(6):1874-1881. DOI: 10.1128/AEM.03657-12
[14] CARLA PÉREZ-CRUZ, LIDIA DELGADO, CARMEN LÓPEZ-IGLESIAS, et al. Outer-Inner Membrane Vesicles Naturally Secreted by Gram-Negative Pathogenic Bacteria[J]. PLoS ONE, 2015, 10(1):e0116896. DOI: 10.1371/journal.pone.0116896
[15] CARMEN S, CLARETTA J S, META J K. Envelope Control of Outer Membrane Vesicle Production in Gram-negative Bacteria[J]. Biochemistry, 2013, 52(18):3031-3040. DOI: 10.1021/bi400164t
[16] ROIER S, ZINGL F G, CAKAR F, et al. A novel mechanism for the biogenesis of outer membrane vesicles in Gram-negative bacteria[J]. Nat Communication, 2016, (7):10515.
[17] ADAM KULP, META J K. Biological Functions and Biogenesis of Secreted Bacterial Outer Membrane Vesicles[J]. Annu Rev Microbiol, 2010, 64:163-184. DOI: 10.1146/annurev.micro.091208.073413
[18] MCBROOM A J, KUEHN M J. Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response[J]. Mol Microbiol, 2007, 63(2):545-558. DOI: 10.1111/j.1365-2958.2006.05522.x
[19] SCHERTZER J W, WHITELEY M. A bilayer-couple model of bacterial outer membrane vesicles biogenesis[J]. MBio, 2012, 3(2):e297-e311. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3312216
[20] JULIA I T, LEIDY X L, PETTER L, et al. Comparative Analysis of Membrane Vesicles from Three Piscirickettsiasalmonis Isolates Reveals Differences in Vesicle Characteristics[J]. PLoS ONE, 2016, 11(10):e0165099. DOI: 10.1371/journal.pone.0165099




 下载:
下载: