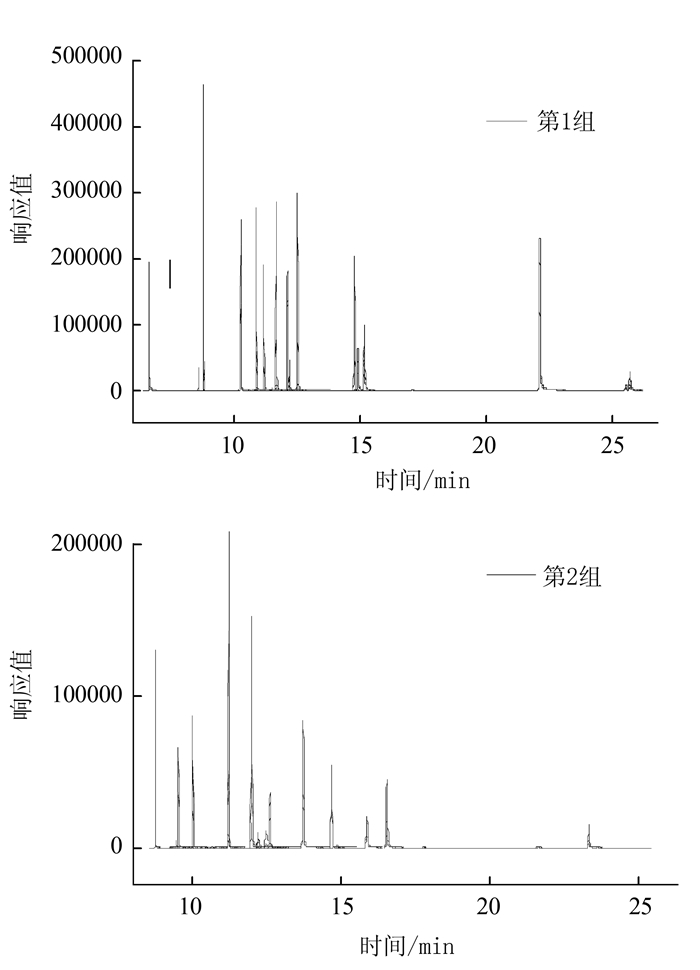
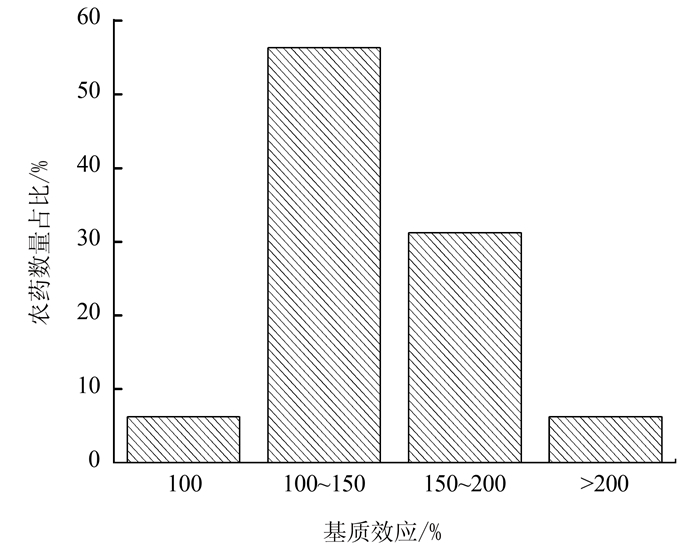
Determination of 32 Fungicide Residues in Tea by Gas Chromatography-Tandem Mass Spectrometry
-
摘要: 建立了茶叶中32种杀菌剂类农药残留的气相色谱-串联质谱(GC-MS/MS)测定方法。样品经乙腈高速匀浆提取后,以N-丙基乙二胺(PSA)、石墨化碳(GCB)、C18为净化剂进行净化,在GC-MS/MS多反应离子监测(MRM)模式下进行测定,空白基质匹配标准曲线外标法定量。结果表明:27种杀菌剂在10~1 000 μg·L-1,5种杀菌剂在20~1 000 μg·L-1范围内具有良好线性关系,相关系数(R2)均大于0.99。方法检出限(S/N≥3)为0.1~8.1 μg·L-1,定量限(S/N≥10)为0.4~23.4 μg·L-1,平均添加回收率范围为70.4%~109.1%,相对标准偏差(RSD)3.4%~10.3%。该方法样品前处理操作简单、净化效果好、灵敏度高,具有良好的适用性,能够满足茶叶中多种杀菌剂残留测定分析的要求。Abstract: A gas chromatography-tandem mass spectrometry (GC-MS/MS) method was developed for detecting 32 fungicide residues in teas.The samples were extracted by acetonitrile under high-speed homogenization, purified with PSA, GCB, C18, and determined by GC-MS/MS in multi-reaction ion monitoring mode. Pesticide contents were determined by using the standard curves constructed with solutions of respective external standards. Linearity of the curves for 27 pesticides ranged from 10 μg·L-1 to 1 000 μg·L-1, and from 20 μg·L-1 to 1 000 μg·L-1 for the remaining 5 pesticides, with correlation coefficients greater than 0.99. The limits of detection were 0.1-8.1 μg·L-1 (S/N ≥ 3); and, those of quantification, 0.4-23.4 μg·L-1 (S/N ≥ 10). The average recovery rates were 70.4%-109.1%; and RSD (n=6) 3.4%-10.3%. The newly developed highly sensitive methodology that required simple pre-treatment and effective purification procedures appeared to be appropriate for the detection of fungicide residues in teas.
-
Keywords:
- fungicides /
- tea /
- GC-MS/MS
-
多花黄精Polygonatum cyrtonema Hua.是百合科黄精属多年生草本植物,是2015版《中华人民共和国药典》收载中药黄精的3个基源品种之一,其干燥根茎入药[1]。《本草纲目》言其“补气益肾,除风湿,安五脏。补五涝七伤,助筋骨,耐寒暑,润心肺。无毒,久服轻身延年不饥”。多花黄精既是常用补益类中药,亦是久负盛名的保健食品[2]。近年来,随着黄精产品市场需求不断增大,人工栽培是解决多花黄精野生资源日趋匮乏和实现多花黄精产业可持续发展的有效途径。黄精野生驯化栽培和育种已有不少探索和研究[3-5],但黄精的高产、优质栽培技术研究深度还不够[6]。福建为多花黄精的主产区,黄精药材资源蕴含量丰富,应用历史悠久[7],全省均有分布,被列为福建省“福九味”重点发展品种之一。福建省八山一水一分田,65.95%的森林覆盖率居全国之首,多花黄精是发展林下经济的常见中药材。福建省目前多花黄精的栽培方式以林下起垄栽培为主,有部分的林下限耕容器栽培,多花黄精的生长状况和产量参差不齐,需研究制定规范的栽培技术,以提高其产量和品质。栽培模式通过影响土壤、水分、微生态等环境条件,对植物的生物量、成分起到重要的影响作用[4]。本文针对福建省林下起垄栽培和限耕容器栽培多花黄精现状,通过对林下不同栽培模式的土壤养分、多花黄精生长和药典成分含量的研究,试图进一步从栽培模式的角度探索如何提高多花黄精种植效益,为多花黄精规范高效种植提供理论支撑。
1. 材料与方法
1.1 试验材料
采自福建承天农林科技发展有限公司多花黄精栽培基地的2年生健壮、无病虫害种苗,经福建省农业科学院农业生态研究所陈敏健副研究员和福建省食品药品质量检验研究院鉴定为多花黄精Polygonatum cyrtonema Hua。
1.2 栽培管理
试验在福建省南平市光泽县福建承天农林科技发展有限公司多花黄精栽培基地进行,栽培时间从2014年3月至2017年11月。
林下起垄栽培:杉树林下,红壤土,清杂、整地、施腐熟有机肥15 000 kg·hm-2做畦,畦宽50~60 cm,畦高20~25 cm,沟宽20 cm。选取长势一致的多花黄精根茎300株单行种植,株行距30 cm×50 cm。
林下限耕容器栽培:杉树林下,红壤土(与起垄栽培同一地块),清杂、放容器(直径50 cm、高45 cm),每667 m2用腐熟有机肥1 000 kg与就地红壤土拌匀,加入容器,选取长势一致的多花黄精根茎300株,每个容器里种植3株。
管理措施:统一常规管理,5月份中耕除草结合追肥,每300株施2.5 kg复合肥,10月份地上部枯黄后,清园。
1.3 形态指标的测定
2017年11月,每个处理梅花点采挖30株,分别测定总根状茎长和直径、新生根状茎长和直径、根系长度、分支数,不同部位鲜重,烘干箱60℃烘至恒重,测定干重。
1.4 土壤样品及营养元素测定
2014年2月,下底肥前,采取耕作层0~25 cm的土样,采样方法为梅花点取样,5个点混合土1 kg左右。2017年11月采挖时,两个处理取植株时并取根际10 cm范围内,耕作层0~25 cm土样,各1 kg混合土样,待测。
用酸度计测土壤pH值,凯氏定氮法测定全氮,采用硫酸-高氯酸消煮法测定全磷,采用NaOH熔融火焰光度法测定全钾,土壤有效硼的测定采用分光度法[3,8]。
1.5 多花黄精成分检测方法
水分、总灰分、浸出物、黄精多糖含量的测定[1]依据2015年版《中国药典》一部黄精项目下检测方法。
1.6 数据分析
试验数据统计分析采用Excel 2013、SPSS16.0数据处理软件。
2. 结果与分析
2.1 不同栽培模式对多花黄精生长及干物质积累的影响
不同栽培模式对多花黄精总根茎长、根茎分支数、根长影响不大,总根茎直径、根系数量、总根茎鲜重、总根系鲜重、总根茎干重表现为林下限耕容器栽培平均值大于林下起垄地栽的平均值,其中,根系数量、总根茎鲜重、总根茎干重的差异达到极显著水平,总根茎长达差异显著水平(表 1)。当年新生根茎鲜干重及折干率为林下起垄地栽的平均值更高。限耕容器栽培多花黄精根系多,但较细,含水量高,有机肥和追肥都在容器范围内操作,而且水肥流失少,土壤较疏松,可能是影响根茎生长的主要因素。
表 1 不同栽培模式多花黄精生长及干物质积累Table 1. Growth and dry matter accumulation of P. cyrtonema raised by different cultivation methods栽培模式 总根茎长/cm 总根茎直径/cm 根茎分支数 根数 根长/cm 总根茎鲜重/g 新生根茎鲜重/g 总根系鲜重/g 总根茎干重/g 新生根茎干重/g 总根系干重/g 总根茎折干率/% 林下起垄地栽 21.1Ab 17.1Ab 4Aa 102.6Bb 20.6Aa 293.9Bb 133.1Aa 11.2Ab 90.5Bb 37.0Aa 3.37Aa 30.8Aa 林下限耕容器 22.3Aa 20.5Aa 5Aa 127.4Aa 20.2Aa 348.9Aa 121.6Ab 13.9Aa 99.4Aa 34.1Bb 3.41Aa 28.5Aa 注:同列数值后面不同大、小写字母表示差异达极差著(P<0.01)和显著水平(P<0.05)。表 4、5同。 表 4 不同栽培模式土壤养分Table 4. Nutrients in soils of different cultivation methods检测项目 pH 全氮/% 全磷/% 全钾/% 土壤本底 5.1 Cc 0.140 Aa 0.037 B 3.10 Cc 起垄地栽 5.6 Bb 0.143 Aa 0.142 Ab 3.25 Bb 限耕容器 6.2 Aa 0.143 Aa 0.150 Aa 3.74 Aa 表 5 不同栽培模式多花黄精品质测定Table 5. Quality of P. cyrtonema raised by different cultivation methods(单位/%) 测定项目 水分 总灰分 浸出物 黄精多糖 2015年版中国药典 < 18.0 < 4.0 > 45.0 > 7.0 限耕容器 8.7Aa 3.3 Bb 88.1 Ab 10.0 Aa 起垄地栽 7.6Bb 3.9 Aa 93.9 Aa 9.4 Bb 2.2 多花黄精根茎生长性状的相关性
起垄地栽多花黄精根茎生长过程根数与根茎其他性状为正相关(表 2),其中,与总根茎直径呈极显著正相关(r = 0.975**),与总根茎鲜重呈显著正相关(r = 0.808*);总根茎直径与总根茎鲜重、新生根茎鲜重都呈显著正相关;总根茎鲜重与新生根茎鲜重呈极显著正相关。限耕容器栽培多花黄精根茎生长过程,总根茎长与总根茎鲜重呈显著正相关,新生根茎鲜重与根系数量、根系鲜重和总根茎鲜重均呈显著正相关(表 3)。因此,多花黄精根系生长状况是决定根茎生长、产量的重要因素,生产上应采取促进根系生长的措施,新生根茎的生长也是决定产量的关键因子,起垄地栽多花黄精根茎直径对总根茎鲜重影响更大,而在限耕容器栽培根茎长的影响因素更大。
表 2 起垄地栽多花黄精根茎生长性状的相关性(n = 30)Table 2. Correlation among growth characteristics of P. cyrtonema rhizome grown on ridges (n = 30)项目 总根茎长 总根茎直径 根茎分支数 根数 根长 总根茎鲜重 新生根茎鲜重 根系鲜重 总根茎长 1.000 总根茎直径 0.116 1.000 根茎分支数 0.589 0.749 1.000 根数 0.082 0.975** 0.779 1.000 根长 -0.374 0.653 0.460 0.659 1.000 总根茎鲜重 0.541 0.831* 0.600 0.808* 0.130 1.000 新生根茎鲜重 0.123 0.760* 0.350 0.710 0.092 0.953** 1.000 根系鲜重 -0.413 0.530 -0.145 0.422 0.246 0.555 0.766 1.000 注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。表 3、6同。 表 3 限耕容器栽培多花黄精根茎生长性状的相关性(n = 30)Table 3. Correlations among growth characteristics of P. cyrtonema rhizomes in root-restricting containers (n = 30)项目 总根茎长 总根茎直径 根茎分支数 根数 根长 总根茎鲜重 新生根茎鲜重 根系鲜重 总根茎长 1 总根茎直径 -0.484 1.000 根茎分支数 0.090 0.226 1.000 根数 0.371 0.196 0.353 1.000 根长 0.105 -0.252 0.218 -0.094 1.000 总根茎鲜重 0.582* 0.229 0.307 0.527 0.170 1.000 新生根茎鲜重 0.387 0.069 0.628 0.607* 0.274 0.622* 1.000 根系鲜重 0.363 -0.030 0.376 0.643** -0.026 0.419 0.519* 1.000 表 6 土壤养分与多花黄精品质的相关性Table 6. Correlation between nutrients in soil and quality of P. cyrtonemapH 全氮 全磷 全钾 总灰分 浸出物 黄精多糖 pH 1.000 全氮 0.297 1.000 全磷 0.975** 0.500 1.000 全钾 0.997** 0.220 0.955** 1.000 总灰分 -0.883** 0.186 -0.758* -0.917** 1.000 浸出物 -0.723* 0.444 -0.554 -0.776* 0.963** 1.000 黄精多糖 0.985** 0.455 0.999** 0.969** -0.790 -0.595 1.000 2.3 不同栽培模式对土壤养分的影响
由表 4可知,人工种植干预后,改变了土壤养分和酸碱度,限耕容器栽培土壤pH值、全磷、全钾含量较起垄地栽高,两种模式土壤全氮含量一样,结合土壤理化性状,限耕容器有机肥与土壤拌匀后栽培多花黄精能中和土壤pH值、改良土壤。
2.4 不同栽培模式多花黄精品质比较
经福建省食品药品质量检验研究院检测,福建承天农林科技发展有限公司基地不同模式种植3年多花黄精成分符合2015年版中国药典要求,黄精多糖含量超过药典25%以上,浸出物超过药典45%以上。限耕容器栽培多花黄精含水量高于起垄地栽1.1%,黄精多糖含量高出0.6%,呈极显著差异,而总灰分少0.6%,但起垄地栽多花黄精的浸出物高于限耕容器栽培(表 5)。
2.5 土壤养分与多花黄精品质相关性分析
如表 6所示,土壤pH值对土壤养分和多花黄精成分的影响很大,呈显著或极显著相关;土壤全磷和全钾含量与黄精多糖含量为极显著正相关,但与总灰分和浸出物为负相关,在一定范围内土壤pH值、磷和钾含量的提升,有利于黄精多糖含量的积累。
3. 讨论与结论
植物生物量的积累和成分含量状况体现了植物对水分、养分和光能的利用率[9],地下部分生物量积累和成分含量状况则是反映植物对土壤养分和水分的吸收能力[10]。综合多花黄精生物量积累及其品质分析,限耕容器栽培的多花黄精根茎生长量和多糖含量均高于起垄栽培,通过不同栽培模式多花黄精根茎生长性状的相关性分析、土壤养分与其品质相关性分析,人工不同栽培多花黄精根茎生长量和品质的差异,可能是不同栽培模式对土壤的水分、物理性状、营养元素等方面的影响,进而影响根系生长,导致多花黄精生物量和品质积累产生不同。贾向荣等[3]研究不同土壤水分含量对黄精生长及多糖含量影响发现,土壤水分能够促进黄精根状茎的生长和黄精多糖含量的积累,其他药材也有研究表明,土壤水分对多种药用植物有效成分积累有促进作用[11-13]。限耕容器栽培更能防止水土流失,保持土壤水分,这也可能是多花黄精产量和多糖含量较高的一个因素。土壤水分与多花黄精生长和有效成分积累的临界关系值得进一步探索。土壤全钾、全磷含量与黄精多糖含量呈显著正相关,这与多种药材成分研究结果相似[14-15],如土壤全K含量与滇重楼根茎中总皂苷含量、多糖含量呈显著正相关[16],但红景天药材4种酚类成分含量与氮肥相关性最大[17]。限耕容器为3株多花黄精的一个小生境气候,土壤结构改善,中和土壤pH值,土壤水分和营养成分的保持对多花黄精的产量和品质具有重要的影响,限耕容器更为适合种植多花黄精。
当前多花黄精栽培管理普遍比较粗放,试验结果表明良好的根系生长有利于多花黄精产量和品质的提高,鉴于土壤养分对多花黄精根茎生长和品质的影响,应进一步开展土壤pH值、土壤水分和养分对多花黄精生长影响的深入研究,指导建立多花黄精更为优化的栽培模式。福建省有大量的林地资源可供利用,可选择土壤肥沃的适生区发展多花黄精,提高种植的经济效益同时保护多花黄精资源。
-
表 1 32种杀菌剂质谱信息
Table 1 Information on mass spectrum for 32 pesticides

表 2 不同提取溶剂对茶叶中32种杀菌剂的添加回收率
Table 2 Recovery rates on spiked 32 pesticides extracted with various solvents from tea

表 3 32种农药回收率及其检出限(LOD)、定量限(LOQ)、相对标准偏差(RSD)(n=6)
Table 3 Recoveries, limits of detection (LOD), limits of quantification (LOQ), and relative standard deviations (RSD) of 32 pesticides (n=6)

-
[1] 刘长令.世界农药大全:杀菌剂卷[M].北京:化学工业出版社, 2005. [2] 陈佳鹏, 林刚, 周宝森.农药暴露与女性乳腺癌的相关性研究[J].中国公共卫生, 2004, 20(3):289-290. DOI: 10.11847/zgggws2004-20-03-19 [3] 孔庆喜, 姚宝玉, 胡翠清.农药的致癌性评价[J].农药科学与管理, 2005, 26(7):26-28. http://www.cnki.com.cn/Article/CJFDTOTAL-NYKG200507009.htm [4] 李凤珍, 王捷, 姚宝玉, 等.氟吗啉原药大鼠慢性毒性与致癌实验[J].毒理学杂志, 2005, 19(3):260. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGDV200509001183.htm [5] PAN U K. A catalogue of lists of Pesticides identifying those associated with Particularly harmful health or enviromental impacts[J].Briefing Paper, 2005, (1):3.
[6] 吴洁珊, 冯家望, 任永霞, 等.气相色谱测定柑橘中多种甲氧基丙烯酸酯类杀菌剂的残留量[J].农药, 2011, 50(10):754-766. DOI: 10.3969/j.issn.1006-0413.2011.10.018 [7] YANG C, SALVADOR L, DOUGLAS G, et al. Determination of Multiresidue Pesticides in Botanical Dietary Supplements Using Gas Chromatography Triple-Quadrupole Mass Spectrometry (GC-MS/MS)[J].Journal of Agricultural and Food Chemistry, 2016, 64(31), 6125-6132. DOI: 10.1021/acs.jafc.6b00746
[8] ANGIONI A, PORCU L, DEDOLA F. Determination of famoxadone, fenamidone, fenhexamid and iprodione residues in greenhouse tomatos[J]. Pest Management Science, 2012, 68(4):543-547. DOI: 10.1002/ps.2287
[9] 丁立平, 蔡春平, 王丹红.改进的QuEChERS-气相色谱-质谱联用法测定蔬菜中的氟吗啉和烯酰吗啉残留[J].色谱, 2014, 32(8):849-854. http://www.cnki.com.cn/Article/CJFDTOTAL-SPZZ201408011.htm [10] LAGUNAS-ALLUE L, SANZ-ASENSIO J, MARTINEZ-SORIA M T.Comparison of four extraction methods for the determination of fungicide residues in grapes through gas chromatography mass spectrometry[J]. Journal of Chromatography A, 2012, 12(70):62-71. https://www.researchgate.net/publication/233772194_Comparison_of_four_extraction_methods_for_the_determination_of_fungicide_residues_in_grapes_through_gas_chromatography-mass_spectrometry
[11] LI J J, LI Y Y, XU D L, et al. Determination of metrafenone in vegetables by matrix solid-phase dispersion and HPLC-UV method[J].Food Chemistry, 2017, 214(1):77-81. https://www.researchgate.net/publication/305275565_Determination_of_metrafenone_in_vegetables_by_matrix_solid-phase_dispersion_and_HPLC-UV_method
[12] 周晓, 李小兰, 陈志燕, 等.高效液相色谱法测定水基胶黏剂中3种异噻唑啉酮类杀菌剂[J].色谱, 2015, 33(1):75-79. http://www.cnki.com.cn/Article/CJFDTOTAL-SPZZ201501015.htm [13] 李慧思, 黄超群, 蒋沁婷, 等.在线净化-液相色谱-串联质谱法测定茶叶中5种烟碱类农药残留[J].色谱, 2016, 34(3):263-269. http://www.cnki.com.cn/Article/CJFDTOTAL-SPZZ201603008.htm [14] 孙亚米, 吕燕, 吴银良.液相色谱-串联质谱法快速测定果蔬中16种新型酰胺类杀菌剂残留量[J].食品科学, 2015, 36(12):230-236. DOI: 10.7506/spkx1002-6630-201512044 [15] DONG F S, CHEN X, LIU X G, et al. Simultaneous determination of five pyrazole fungicides in cereals, vegetables and fruits using 1iquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2012, 12(62):98-106. https://www.researchgate.net/publication/256742265_Simultaneous_determination_of_five_pyrazole_fungicides_in_cereals_vegetables_and_fruits_using_liquid_chromatographytandem_mass_spectrometry
[16] ANNA G, IGNAZ J B, THOMAS P. Online solid phase extraction LC MS/MS method for the analysis of succinate dehydrogenase inhibitor fungicides and its applicability to surface water samples[J]. Analytical and Bioanalytical Chemistry, 2014, 406(25):6419-6427. DOI: 10.1007/s00216-014-8073-4
[17] 王敬, 艾连峰, 马育松, 等.气相色谱-三重四极杆串联质谱法测定牛奶及奶粉中213种农药多残留[J].色谱, 2015, 33(11):1175-1185. http://www.cnki.com.cn/Article/CJFDTOTAL-SPZZ201511017.htm -
期刊类型引用(10)
1. 吴国华,叶建华,周众灵,刘跃钧. 不同生境和套种模式对多花黄精根茎主要成分含量的影响. 浙江林业科技. 2024(01): 19-24 .  百度学术
百度学术
2. 陈炬烽,钟起尧,郭志鹏,林燕华. 人工生态种植对土壤理化性质、多花黄精产量及品质的影响. 中药材. 2023(07): 1613-1616 .  百度学术
百度学术
3. 钟子龙,张小辉,王洪根,吴灵芝,吴焱,范伟青. 栽培基质对多花黄精生长的影响. 湖北林业科技. 2022(02): 24-27 .  百度学术
百度学术
4. 韩凤,章文伟,李巧玲,杨晓玉,林茂祥. 多花黄精根腐病对根际土壤细菌微生态的影响. 现代中药研究与实践. 2022(05): 6-11 .  百度学术
百度学术
5. 周先治,高晖,孙新涛. 华重楼根茎腐烂病发病情况调查与病因分析. 福建农业科技. 2021(02): 37-40 .  百度学术
百度学术
6. 伍贤进,李胜华,贺安娜,何述金. 多花黄精林下轻简化生态种植技术. 湖南林业科技. 2021(04): 128-130 .  百度学术
百度学术
7. 闫莉,刘玉翠,王晓光,庄鑫,郭俊杰,李婧,贺立鹏,肖井雷. 适度干旱和低养分投入促进黄精生长发育与黄精多糖累积. 植物营养与肥料学报. 2021(08): 1468-1476 .  百度学术
百度学术
8. 高嫣. 多花黄精的活性成分及药理作用研究进展. 福建农业科技. 2021(08): 39-44 .  百度学术
百度学术
9. 钟子龙,李军飞,陈建民,罗怿,刘跃均,周智峰. 不同限耕容器对毛竹林下种植多花黄精的影响. 南方林业科学. 2020(01): 13-16 .  百度学术
百度学术
10. 李俊南,刘恒鹏,熊新武,梁林波,侯敏,陈勤,习学良. 滇黄精在薄壳山核桃林下的生长表现. 西部林业科学. 2020(05): 42-46 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: