Double Antibody Sandwich ELISA for Detection of Porcine Epidemic Diarrhea Virus
-
摘要: 采用特异性好的鼠源抗猪流行性腹泻病毒(PEDV)单克隆抗体为捕获抗体,兔源多克隆抗体为检测抗体,建立PEDV双抗体夹心ELISA检测方法。结果显示,该方法的最佳反应条件为:抗PEDV单克隆抗体E1包被质量浓度4.40 μg·mL-1,37℃包被2 h,采用5% BSA封闭液封闭1 h,兔抗PEDV抗体工作质量浓度为5.91 μg·mL-1,酶标二抗稀释度为1:2000,以OD450nm ≥ 0.381作为阳性判定标准。该ELISA方法对猪轮状病毒和猪传染性胃肠炎病毒无交叉反应。敏感度可达30 μg·mL-1(5×103.12);重复性变异系数小于10%。采用该方法和RT-PCR方法同时检测临床样品42份,阳性样品符合率为92.30%,表明建立的PEDV双抗体夹心ELISA检测方法具有特异性好、敏感性高和方便快捷等优点,可用于PEDV快速检测。
-
关键词:
- 猪流行性腹泻病毒 /
- 单克隆抗体 /
- 双抗体夹心ELISA
Abstract: A double antibody sandwich ELISA (DAS-ELISA) was developed using the high specificity, mouse-derived monoclonal antibody (Mab) as the capture antibody and the rabbit-derived polyclonal antibody against porcine epidemic diarrhea virus (PEDV) as the detecting antibody. The optimal reaction conditions for DAS-ELISA was determined to include a coating concentration of 4.40 g·mL-1 for PEDV MAb E1 with 1 h incubation at 37℃, the use of 5% BSA solution for blocking for 1 h, an application of 5.91 μg·mL-1 in concentration of rabbit polyclonal antibodies against PEDV, a 2 000×dilution of HRP, and the positive OD equal or greater than 0.381 at 450 nm wave length on the spectrophotometer measurement. The developed method showed no cross-reaction between porcine rotavirus and transmissible gastroenteritis virus. The detection sensitivity of the method was 30 g·mL-1(5×103.12); and, the coefficient variation of repetition, less than 10%. Furthermore, a total of 42 clinical samples were positively detected by the method in conjunction with RT-PCR at a rate of 92.30%. Consequently, it was concluded that the newly developed DAS-ELISA methodology was highly specific, sensitive, rapid, and hence, applicable for PEDV detection. -
猪流行性腹泻(Porcine epidemc diarrhea,PED)由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起猪群发生呕吐、腹泻、脱水以及哺乳仔猪高死亡率为特征[1]的高度传染性疾病。所有不同阶段的猪均可感染。该病在许多养猪业发达的国家都已有爆发的报道, 并导致造成了重大的经济损失[2]。
PED首次是在1971年于英国报道[3],1978年在比利时和英国首次得到鉴定[4],我国于1984年证实该疾病的存在[5]。近年来,由于PEDV发生了变异,导致广泛流行,尤其以韩国、日本、中国、泰国和越南等国家发病严重[6-9]。自2010年秋以来, 首先我国部分省份出现了严重的仔猪流行性腹泻, 后蔓延至全国,发病情况比先前更为凶猛,造成仔大量的哺乳仔猪死亡,尤其是7日龄以内的仔猪死亡率高达100%,给养殖户造成了巨大的经济损失,并已成为影响我国养猪业健康发展的重要疫病之一。由于PED与猪传染性胃肠炎(TGE)等其他腹泻疾病在流行病学、临床症状等变化上非常相似,加上病毒变异,这给该病的快速诊断与防治都带来了一定困难。本研究通过采用单克隆抗体制备技术,制备获得特异性强和滴度高的PEDV单克隆抗体,对建立该病的快速诊断与防控技术具有重要意义, 更为今后开展PEDV抗原表位识别及病毒蛋白研究奠定良好基础。
1. 材料与方法
1.1 试验动物、细胞和病毒
6~8周龄SPF级Babl/C小鼠,购自吴氏实验动物有限责任公司,Vero细胞、小鼠骨髓瘤细胞(SP2/0) 由本实验室保存,猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪传染性胃肠炎病毒(TGEV)均由本实验室分离保存,猪流行性腹泻病毒(PEDV)由本实验室通过空斑纯化技术获得保存。
1.2 试剂与培养液
DMEM、弗氏完全佐剂、弗氏不完全佐剂、羊抗鼠IgG辣根过氧化物酶、HAT、HT选择培养基均购自Sigma公司;羊抗鼠FITC购自武汉博士德生物工程有限公司;新生牛血清购自浙江天杭生物科技有限公司。NAbTMSpin Kits试剂盒和单克隆抗体亚级份检测试剂盒购自Thermo公司。
1.3 PEDV培养与纯化
将PEDV接种于Vero细胞单层,于37℃感作45 min,加维持液,培养2~3 d,当细胞病变达85%以上时,收集冻融3次,收获细胞毒。细胞毒经超声裂解后,10 000 r·min-1离心60 min,取上清液,45 000 r·min-1离心180 min,用0.01 mol·L-1PBS(pH 7.2) 悬浮沉淀,即为粗提病毒;取粗提病毒铺依次垫于30%~60%蔗糖-PBS,33 000 r·min-1离心180 min,收集条带病毒,PBS重悬,40 000 r·min-1离心180 min洗脱蔗糖,PBS重悬沉淀即为纯化的病毒抗原。同时以未接种病毒的Vero细胞同样处理,作为阴性抗原。
1.4 蛋白浓度的测定
蛋白浓度测定采用NaNodrop2000仪器, 其方法按说明书进行。
1.5 间接ELISA方法
病毒抗原用pH 9.6的碳酸盐缓冲液稀释,包被于ELISA板条,100 μL·孔-1,置37℃孵育2 h或4℃过夜,0.01 mmol·L-1 PBST洗涤液洗涤3次,用1.5%BSA-PBST封闭,300 μL·孔-1,37℃ 2 h,洗涤同上,加入杂交瘤细胞培养上清液,100 μL·孔-1,37℃反应60 min,同上洗涤,加1:40000稀释的羊抗鼠IgG辣根过氧化物酶,100 μL·孔-1,37℃反应45 min,同上洗涤后,加入OPD 100 μL·孔-1,37℃避光显色15 min,2 mol·L-1 H2SO4终止反应,在自动酶联检测仪上测定各孔的OD490值,以P:N≥2.1时,判断为杂交瘤细胞分泌抗体阳性。
1.6 杂交瘤细胞株的建立
1.6.1 Balb/c小鼠的免疫
将纯化PEDV抗原(4 mg·mL-1)与等体积弗氏完全佐剂乳化后,皮下多点注射6周龄Babl/C鼠4只,0.2 mL·只-1。于初次免疫后第14、28、42 d,取病毒抗原与弗氏不完全佐剂等量混匀乳化,进行二免、三免和四免,于融合前3 d用等量病毒经尾静脉加强免疫。
1.6.2 细胞融合
无菌取免疫小鼠脾脏,分散脾淋巴细胞,1 000 r·mim-1离心10 min, 将细胞疏松后加10 mL 0.17 mmol·L-1 NH4CL,冰浴10 min,同上离心,疏松、重悬于10 mL DMEM, 同时收集SP2/0细胞,按脾细胞和SP2/O细胞按8:1的比例混合,1 000 r·min-1离心5 min,疏松后1 min内缓缓加入1 mL 37℃预热的PEG进行细胞融合,缓慢加入DMEM 20 mL,同上离心,疏松细胞后,重悬杂交瘤细胞于含20%牛血清的HAT-DMEM培养基中,调节脾细胞数量,加到96孔细胞培养板,0.1 mL·孔-1,置37℃,5%CO2培养箱中培养,第5 d补加0.1 mL含15%牛血清的HT-DMEM,观察生长情况,待细胞长至孔底的1/3,或培养液变黄时,上清进行抗体检测。
1.6.3 阳性杂交瘤细胞的筛选
用间接ELISA筛选杂交瘤细胞生长孔特异性抗体,从检出的阳性孔中,挑选OD值高、细胞形态好生长旺盛且不与正常细胞培养物交叉的阳性孔,进行有限稀释法克隆。
1.6.4 饲养层细胞的制备
取8周龄左右的Babl/C小鼠,腹腔注射10 mL DMEM,轻揉小鼠腹腔数次,用灭菌针头在超净台内引出注入的DMEM。计数后调整细胞浓度加入96孔细胞培养板,100 μL·孔-1,置37℃,5%CO2培养箱中。
1.6.5 阳性细胞的克隆
采用有限稀释法,取经ELISA初筛为阳性细胞,用含20%牛血清的HT-DMEM逐步稀释至每毫升20个细胞,加到含饲养层细胞的96孔培养板中,每孔滴加1滴,置37℃,5%CO2培养箱中培养。5 d后观察克隆细胞生长情况,挑选只含一个细胞克隆的孔待细胞克隆生长至1/3孔底或上清液变黄时,取上清用间接ELISA检测。连续克隆直至克隆孔阳性率达100.0%。
1.7 腹水制备
1.7.1 Babl/C小鼠诱导
8周龄Balb/c小鼠腹腔注射灭菌的液体石蜡进行诱导,分笼饲养7 d。取对数生长期的杂交瘤细胞,经1 500 r·min-1离心5 min沉淀细胞,用不含血清的DMEM约1 mL重悬,腹腔注射石蜡诱导的Babl/C鼠,每只小鼠注射0.8×106杂交瘤细胞。
1.7.2 收集腹水
约7~10 d后观察小鼠腹部,有产生腹水的小鼠腹部会明显膨大。此时采用引流收集腹水,1 000 r·min-1,离心15 min,收集上层淡黄色腹水,用Thermo公司生产的NAbTMSpin Kits试剂盒进行纯化,测定效价,做好标记,冻于-70℃备用。
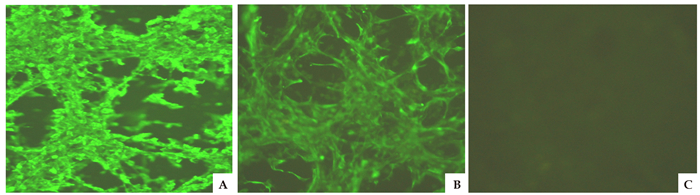
1.8 PEDV感染细胞的制备及免疫荧光试验(IFA)
将PEDV接种于已长成单层的Vero 96孔细胞板,培养至30%细胞出现病变时,弃上清,PBS洗涤1次,每孔加入预冷甲醇100 μL,4℃固定30 min,弃甲醇,PBS洗涤1次,晾干后,-30℃冻存备用。同样处理不接毒的Vero细胞用于阴性对照。IFA检测时,于上述细胞板中每孔加入30 μL杂交瘤细胞培养上清液于37℃作用30 min,用生理盐水洗涤3次,每次5 min,加FITC每孔50 μL,37℃作用30 min,洗涤同上,甩干,加50%PBS-甘油,每孔30 μL。于倒置荧光显微镜下观察。
1.9 单克隆抗体特性分析
1.9.1 单克隆抗体亚级份的测定
按照单克隆抗体分型试剂盒说明书进行。
1.9.2 单克隆抗体中和能力测定
参考文献[10]进行。采用固定病毒稀释抗体的方法测定各株单抗对PEDV的中和能力。将克隆抗体腹水10-1开始进行10倍比稀释至10-6,取各稀释度的单克隆抗体与等体积病毒液混合,37℃感作45 min,然后接种单层Vero细胞。试验设正常细胞对照、阴性腹水对照和病毒对照。接种24 h后观察细胞病变(CPE),连续观察96 h,按Karber法计算中和效价。
1.9.3 细胞株稳定性试验
将具有分泌特性的杂交瘤细胞体外连续培养2个月,每2周检测其上清液的抗体效价;将液氮冻存的阳性杂交瘤细胞每个月复苏1次,连续2个月,测定上清抗体效价。
1.9.4 单克隆抗体特异性的测定
应用间接ELISA和IFA方法检测腹水与Vero细胞、PRRSV、TGEV和CSFV的交叉反应性。
1.9.5 单克隆抗体ELISA效价测定
应用间接ELISA检测杂交瘤培养上清液和腹水抗体的效价,腹水用抗体稀释液按10倍稀释成10-8~10-1,杂交瘤细胞上清液用抗体稀释液稀释成2-10~2-1 ,测定OD490值,以P:N≥2.1时的最高稀释度为抗体的ELISA效价。
1.9.6 单克隆抗体荧光效价测定
应用间接免疫荧光法测定杂交瘤培养上清液和腹水的荧光特性,杂交瘤细胞上清液用抗体稀释液稀释成2-10~2-1 ,腹水用抗体稀释液按10倍稀释成10-8~10-2,以出现特异荧光的最高稀释度为单抗的IFA效价。
1.9.7 Western bloting试验
参照文献[10]方法, 分别以PEDV抗原和Vero细胞抗原进行SDS-PAGE电泳。转印至NC膜用TBS-T封闭, 4℃过夜, TBS-T洗膜3次, 加1:100倍稀释的腹水单克隆抗体, 37℃作用2 h,洗涤, 加入羊抗鼠IgG碱性磷酸酶标记抗体(1:10 000), 室温反应2 h, 同上洗涤, 显色。
2. 结果与分析
2.1 PEDV的培养、纯化及浓度测定
将PEDV接种于Vero细胞单层3 d后细胞病变达85%(图 1、2),经冻融、裂解及蔗糖-PBS梯度离心后,收集30%~40%病毒条带,经鉴定为PEDV后,测定蛋白质量浓度为4 mg·mL-1。
2.2 PEDV单克隆抗体的制备
2.2.1 ELISA筛选方法的建立
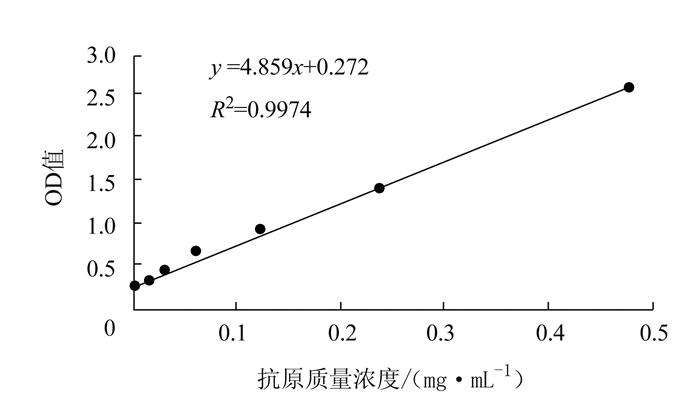
经方阵滴定法测定,当每孔抗原包被质量浓度为25 μg·mL-1、血清稀释度为1:2 000或每孔抗原包被质量浓度为35 μg·mL-1、血清稀释度为1:4 000时,阳性血清OD490值均达1.0,阴性血清的OD490 值较小,在0.08以下,最终确定最佳每孔抗原包被质量浓度为25~35 μg·mL-1。
2.2.2 杂交瘤细胞株的建立
融合8块96孔细胞板,获得256个融合阳性孔, 阳性率为33.3%,其中抗体分泌较强阳性的细胞孔36株。经多次有限稀释后,获得2株能稳定分泌抗PEDV抗体的杂交瘤细胞株,分别命名为E1和H6。这2株细胞在体外连续培2个月,能稳定分泌抗体,经液氮冻存、复苏后,细胞生长良好,且上清液抗体效价不变。
2.3 单克隆抗体特性分析
2.3.1 单克隆抗体Ig类别和亚类
经过抗体亚型试剂盒鉴定,2株单克隆抗体在亚类鉴定中E1属于IgG2a,H6株属于IgM。
2.3.2 单克隆抗体的中和活性
E1株和H6株单克隆抗体都不能抑制病毒的增殖,说明2株单克隆抗体无中和病毒的活性。
2.3.3 单克隆抗体ELISA和IFA效价
E1和H6单克隆抗体的培养上清液的ELISA效价分别为26和24,腹水抗体效价分别为105和104(图 3)。
2.3.4 单克隆抗体特异性鉴定
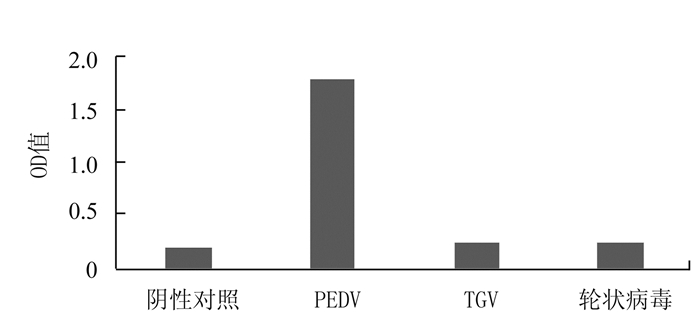
ELISA结果表明:2株单抗均能识别PEDV毒株;间接免疫荧光试验(IFA)结果表明:单抗都不与Vero细胞、TGEV、PRRSV和CSFV发生反应,说明单克隆抗体的特异性好。
2.3.5 Western bloting试验
本试验获得的2株单克隆抗体,其中E1株能识别PEDV中约31 ku蛋白(M蛋白),H6株能识别PEDV中约56 ku蛋白(N蛋白), 而不识别其他蛋白, 说明1株是针对M蛋白,另外1株是针对N蛋白。
3. 讨论
猪流行性腹泻病毒属于套式病毒目冠状病毒科冠状病毒属[11],主要的结构蛋白包括:纤突蛋白(S)、膜蛋白(M)和核衣壳蛋白(N),其中M蛋白在PEDV毒株间具有高度的保守性[12],在补体存在的条件下, 它可诱导机体产生中和抗体。N蛋白位于病毒粒子的内部,与病毒基因组RNA相互缠绕构成病毒的核衣壳,在同种病毒间也具有高度的保守性,参与病毒的复制, 其介导的特异性细胞免疫对于病毒的感染十分重要[13]。另外,PEDV的细胞培养与其他冠状病毒比, 在体外培养难, 细胞病变不明显, 抗体滴度也不高,这给抗原分离培养带来较大困难。基于PEDV的较难培养特性,丁壮[14]等通过PEDV猪体内的传代毒和人工感染猪的粪便中纯化出病毒,制备了抗PEDV的杂交瘤细胞株,另外,还有许多学者[15-16]利用体外表达病毒结构蛋白作为抗原,制备抗猪流行性腹泻病毒克隆抗体。
本研究利用从猪传染性胃肠炎-猪流行性腹泻-轮状病毒的三联弱毒疫苗中,通过空斑纯化技术,纯化获得PEDV弱毒,该病毒能在Vero细胞中稳定高效增殖,其TCID50/100 μL达到10-6.0;通过蔗糖梯度差速离心纯化,利用纯化抗原免疫小鼠,脾细胞与SP2/0细胞进行杂交融合,获得2株抗体效价高、特异性强、稳定性好的抗PEDV单克隆抗体,其中1株为IgG2a亚型,能识别PEDV的M蛋白, 另外1株为IgM,能识别PEDV的N蛋白。研究表明,PEDV的M蛋白和N蛋白在病毒的进化过程中都是比较保守稳定的蛋白,研制出相应的单克隆抗体,能为PEDV的早期诊断、防控、病毒免疫靶标识别及蛋白质组学的研究奠定良好基础。
本试验在单克隆抗体的制备过程中,曾疑使用PEDV弱毒株能否制备出效价高的单克隆抗体,但经过实践表明,SPF级Balb/c小鼠经过多次免疫,在杂交瘤细胞制备过程中注重无菌操作,把握融合时间,能获得高效价的单克隆抗体。本研究虽然筛选到能分泌阳性抗体的杂交瘤细胞数量较少,阳性率不是很高,但经过多次有限稀释克隆和特异性筛选,最终获得2株抗体效价高的单克隆抗体E1和H6株,这说明PEDV弱毒株经高度浓缩纯化后,仍具有很好的免疫原性,能刺激小鼠产生高效免疫应答,这为今后制备单克隆抗体的过程中,选择抗原方面提供了一个新思路。
-
表 1 批内和批间重复试验结果(n=5)
Table 1 Intra-and inter-batch reproducibility test results on DAS-ELISA
样品 批内重复试验 批间重复试验 平均数 方差 变异系数
/%平均数 方差 变异系数
/%1 1.050 0.021 2.003 0.778 0.023 2.998 2 0.655 0.020 3.128 0.897 0.036 4.056 3 0.774 0.031 4.007 0.920 0.033 3.588 4 0.589 0.018 3.122 0.691 0.020 2.975 5 1.255 0.058 4.589 1.320 0.049 3.745 -
[1] MARTELLⅡ P, LAVAZZA A, NIGRELLI A D, et al. Epidemic of diarrhea caused by porcine epidemic diarrhea virus in Italy[J]. Vet Rec, 2008, 162:307-310. DOI: 10.1136/vr.162.10.307
[2] LUO Y, ZHANG J, DENG X, et al. Complete genome sequence of a highly prevalent isolate of porcine epidemic diarrhea virus in South China[J]. J Virol, 2012, 86(17):9551. DOI: 10.1128/JVI.01455-12
[3] VLASOVA A N, MARTHALER D, WANG Q, et al. Distinct characteristics and complex evolution of PEDV strains, North America, May 2013 February 2014[J]. Emerg Infect, 2014, 20(10):1620-1628. http://pubmedcentralcanada.ca/pmcc/articles/PMC4193278/
[4] 王隆柏, 林裕胜, 车勇良, 等.猪流行性腹泻病毒S、N和ORF3基因的遗传变异分析[J].畜牧兽医学报, 2014, 45(11):1830-1836. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=xmsy201411013&dbname=CJFD&dbcode=CJFQ [5] 王隆柏, 王晨燕, 林裕胜, 等.猪流行性腹泻病毒E和M基因的克隆及变异分析[J].福建农业学报, 2015, 30(6):533-538. http://www.fjnyxb.cn/CN/abstract/abstract2697.shtml [6] 毛雅元, 张桂红, 葛俊伟, 等.猪流行性腹泻病毒地方株LJB/03分离及培养特性[J].病毒学报, 2010, 26(6):483-489. http://www.cnki.com.cn/Article/CJFDTOTAL-BDXB201006010.htm [7] 孙秀萍, 宋晗星, 苏高莉, 等.水泡性口炎病毒双抗体夹心ELISA检测方法的建立[J].中国预防兽医学报, 2012, 34(8):637-641. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017156743.htm [8] CHANG S H, BAE J L, KANG T J, et al. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J]. Cells, 2002, 14:295-299. http://www.ncbi.nlm.nih.gov/pubmed/12442904
[9] 吴玉璐, 朱建平, 杨莘, 等.猪流行性腹泻病毒N基因的表达及抗原性分析[J].动物预防学报, 2013, 35(4):299-303. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zgxq201304013&dbname=CJFD&dbcode=CJFQ [10] HUTCHINGS G H, FERRIS N P. Indirect sandwich ELISA for antigen detection of African swine fever virus:comparison of polyclonal and monoclonal antibodies[J]. J Virol Methods, 2006, 131(2):213-217. DOI: 10.1016/j.jviromet.2005.08.009
[11] PANADERO R, VAZQUEZ L, COLWELL D D, et al. Evaluation of an antigen capture ELISA for the early diagnosis of Hypoderma lineatum in cattle under field conditions[J]. Vet Parasitol, 2007, 147(3-4):297-302. DOI: 10.1016/j.vetpar.2007.04.004
[12] 张小兵, 邸祿芹, 吴萌, 等.单克隆抗体与多克隆抗体配对ELISA方法比较[J].生物技术通报, 2009, (11):125-129. http://www.cnki.com.cn/Article/CJFDTOTAL-SWJT200911031.htm [13] 李一经, 刘博, 姜艳平, 等.双抗体夹心ELISA检测排泄物PEDV[J].东北农业大学学报, 2015, 46(2):1-10. http://www.cnki.com.cn/Article/CJFDTOTAL-DBDN201502001.htm [14] 张清真, 陶洁, 殷秀辰, 等.猪流行性腹泻病毒双抗体夹心ELISA方法的建立[J].上海农业学报, 2017, 33(1):134-137. http://www.cnki.com.cn/Article/CJFDTOTAL-SHLB201701024.htm -
期刊类型引用(6)
1. 李虎林,颜仁和,陈泽典,仇珍珍,李堪贺,马曼欣,毛莹莹,李建军,吕宗吉,李红卫. 基于哺乳动物细胞表达S1蛋白的猪流行性腹泻病毒单克隆抗体. 分子诊断与治疗杂志. 2023(04): 694-698 .  百度学术
百度学术
2. 张志榜,彭维祺. 猪流行性腹泻病毒单克隆抗体及其抗原表位的研究进展. 病毒学报. 2022(01): 235-245 .  百度学术
百度学术
3. 李洁森,孙荣航,邝燕齐,陈路漫,刘青,郭霄峰. 猪流行性腹泻病毒S1D蛋白的优化表达及其单克隆抗体的制备. 中国畜牧兽医. 2021(12): 4641-4651 .  百度学术
百度学术
4. 赵洪哲,范峻豪,李新培,王昊,关平原,温永俊. 牛病毒性腹泻病毒单克隆抗体的制备及其应用. 中国兽医科学. 2019(03): 287-293 .  百度学术
百度学术
5. 张庆桥,王一鹏,魏艳秋,米建华,赵雪,孙立旦,宋勤叶. 猪流行性腹泻病毒N蛋白单克隆抗体的制备与鉴定. 中国兽医杂志. 2019(01): 31-35+3 .  百度学术
百度学术
6. 马宇聪,刘增素,王书博,周晗,姜艳萍,崔文,王丽,乔薪瑗,唐丽杰,徐义刚,李一经. PEDV双抗体夹心ELISA检测方法的建立. 中国兽医科学. 2019(09): 1152-1159 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载: