Isolation and Identification of Duck Plague Virus
-
摘要: 采集疑似鸭瘟病毒自然感染的病死番鸭的肝脾等组织,应用番鸭胚成纤维细胞(MDEF)进行病毒分离,通过对分离毒的血凝特性(HA)测定、间接免疫荧光试验(IFA)荧光定量PCR、PCR产物测序和动物回归试验等初步鉴定。结果显示:通过MDEF从疑似病料中分离到4株病毒(DPVfj1、DPVfj2、DPVfj3、DPVfj4),均不能凝集鸽红细胞;IFA结果排除了分离毒为鹅细小病毒、番鸭细小病毒、鸭呼肠孤病毒、鸭副粘病毒和禽坦布苏病毒;鸭瘟病毒荧光PCR试剂盒检测分离毒核酸均为鸭瘟阳性;鸭瘟病毒(JQ673560)gJ蛋白基因序列特异引物进行PCR扩增均为阳性,且PCR产物序列与鸭瘟病毒参考株gJ蛋白基因序列相似度均大于99%;动物回归试验显示,分离毒人工感染30日龄番鸭和同居感染5日龄雏番鸭均可复制出与自然感染一致的临床表现及病理变化,并能回收到病毒。上述结果表明4株分离毒均为鸭瘟病毒强毒株。Abstract: Tissue samples of liver and spleen from the Muscovy ducks that were suspected to have died from the duck plague were collected for this study.Viruses were isolated from the Muscovy duck embryo fibroblasts (MDEF) for a preliminary identification using hemagglutination assay(HA), immunofluorescence analysis(IFA), qPCR, PCR product sequencing, and animal infection test. Four virus strains, DPVfj1, DPVfj2, DPVfj3 and DPVfj4, were thus identified for further investigation. Subsequently, it was found that these strains (a) would not cause red blood cell agglutination on pigeon erythrocytes; (b) were tested negative on IFA with goose parvovirus, Muscovy duck parvovirus, duck reovirus, duck paramyxovirus, and Tembusu virus; (c) showed positive on test with fluorescence RT-PCR kit; (d) had a positive result on their PCR-amplified pair of primers from the specific fragment of gJ protein gene, JQ673560, and a homologygreater than 99% on the sequence of the fragment with that of the duck plague virus(DPV) gJ protein gene; (e)infected 30-day-old ducks by injection and 5-day-old ducklings by co-habitation showing exactly the same clinical symptoms and postmortem signsas in the natural cases; and, (f)were recovered from the diseased birds. The results seemed to verify the fact that DPV caused the duck plaque in natural environment, and that the isolated strains possessed the virulent nature in question.
-
Keywords:
- duck plague virus /
- isolation /
- identification
-
鸭瘟(Duck plague,DP),又名鸭病毒性肠炎(Duck viral enteritis,DVE),是由鸭瘟病毒(duck plague virus,DPV)引起的鸭、鹅、雁及其他雁形目禽类的急性、败血性、高度致死性传染病,是危害养鸭业的重要疾病之一,该病流行广泛,传播迅速,发病率和死亡率高,曾给世界各国造成巨大的经济损失[1-3]。
2015年以来,福建省不同日龄未免疫鸭瘟疫苗的番鸭群均不同程度发生疑似鸭瘟疫情,病程急、病鸭流泪、肿头、拉黄绿色稀便,剖检见肝脏肿大质脆边缘坏死、肠黏膜及淋巴环出血、食道和泄殖腔出血等,为明确其病原并采取有效控制措施减少损失,本课题组采集60~120日龄疑似鸭瘟病死番鸭的肝脾胰等组织进行病原分离,应用单抗间接免疫荧光抗体技术,PCR技术和动物回归试验等鉴定,现将结果报道如下。
1. 材料与方法
1.1 禽胚及细胞
番鸭胚和番鸭均购自福州山区健康番鸭场,番鸭胚成纤维细胞(MDEF)的制备按文献[1]的方法进行。
1.2 单克隆抗体及试剂盒
抗鹅细小病毒(GPV)单抗、抗雏番鸭细小病毒(MPV)单抗、抗鸭呼肠孤病毒(MDRV)单抗、抗鸭源副粘病毒(DPMV)和禽坦布苏病毒(TUMV)单抗等均为本课题组制备并保存;鸭瘟病毒荧光PCR检测试剂盒购于北京生科尚仪科技有限公司。
1.3 病料来源及处理
取疑似病死番鸭的肝、脾、胰腺等组织,剪碎研磨,以Hank′s液制成1:5匀浆,加双抗各1 000 U,4℃过夜,低温冻融3次,7 000 r·min-1离心10 min,将上清液经直径为0.22 μm的微孔滤膜过滤,收集滤液供病毒分离和核酸抽提用。
1.4 病毒分离
取长成单层的MDEF细胞,弃去营养液,接种上述病料滤液,37℃吸附1 h,倾去吸附液,以灭菌Hank′s冲洗3次后,加足量维持液(0.5%HL-2%小牛血清)。并设置未接种病料的细胞对照组,37℃继续培养,逐日观察细胞病变至7 d,置-20℃冻融3次,收获细胞。如上反复传代,观察病变情况。
1.5 病毒鉴定
1.5.1 血凝特性(HA)测定
按殷震法[1]进行,在37℃、pH 7.2的PBS缓冲液中测定分离毒对鸡、鸽红细胞的血凝性。
1.5.2 间接免疫荧光试验(IFA)鉴定
(1) 冰冻切片制备:取临床自然病鸭或人工感染病死鸭肝、脾、胰腺等组织在冰冻切片机中切成6 μm厚的薄片,冷丙酮固定15 min,晾干备用。
(2) 感染病毒的细胞板制备:将分离毒DP1d3适当稀释后接种于已成长单层的MDEF 96孔细胞培养板,于37℃、6%CO2培养,当细胞病变达30%时,弃去培养液,甩干。每孔加100 μL甲醇(预置-20℃)于4℃固定30 min,弃甲醇,用0.85%生理盐水洗涤3次,每孔100 μL, 每次5 min,甩干,置-20℃保存供IFA试验。
(3) IFA染色及观察:取上述冰冻切片或感染病毒的细胞板,按常规方法[4]分别以抗GPV、MPV、DRV、DPMV和TUMV单抗为一抗、羊抗鼠IgG-FITC为二抗进行间接荧光抗体试验检测,置荧光显微镜下观察,以出现亮绿色特异性荧光判为阳性。
1.5.3 荧光定量PCR鉴定
4份第3代细胞分离毒(DPVfj1、DPVfj2、DPVfj3、DPVfj4) 用DNA提取试剂盒提取病毒核酸,按照鸭瘟病毒荧光PCR检测试剂盒说明书操作,在实时荧光定量PCR仪(eppendorf公司)进行检测。并设阴阳性对照。
1.5.4 PCR及产物序列鉴定
第3代细胞毒(DP1d3) 提取核酸。根据已发表的鸭瘟病毒(JQ673560) gJ蛋白基因序列,设计了如下引物:gJ1:5′-atgtatacag acgttacggtc-3′,gJ2:5′-tcatac catacaaaggcatag-3′。利用TAKARA公司试剂进行PCR扩增,将回收的PCR产物与pMD-18T载体连接后转化到感受态细胞,进行重组质粒的筛选。鉴定后的重组质粒由TAKARA公司进行序列测定,应用分析软件对gJ基因进行分析和比较。
1.5.5 动物回归试验
30日龄健康雏番鸭15羽随机分为2组,其中健康对照组5羽,每羽腿肌注射正常MDEF细胞0.1 mL;攻毒组10羽,每羽腿部肌肉注射第3代细胞培养毒(DP1d3)0.1 mL。隔离饲养,每天观察并记录试验鸭发病和死亡情况,并从病死鸭中分离病毒。
1.5.6 番鸭同居感染试验
在1.5.2动物回归试验中,当攻毒组人工感染后第4 d出现死亡鸭时,移入10羽5日龄健康番鸭与攻毒组鸭同居饲养,每天观察并记录试验鸭发病和死亡情况,并从病死鸭中分离回收病毒。
1.5.7 病毒对鹅的致病性试验
将DP1d3经口服和腿部肌肉注射途径人工感染17日龄健康雏鹅6羽,0.8 mL·羽-1,每天观察并记录感染鹅发病和死亡情况,并从病死鹅中分离病毒。
2. 结果与分析
2.1 病毒分离结果
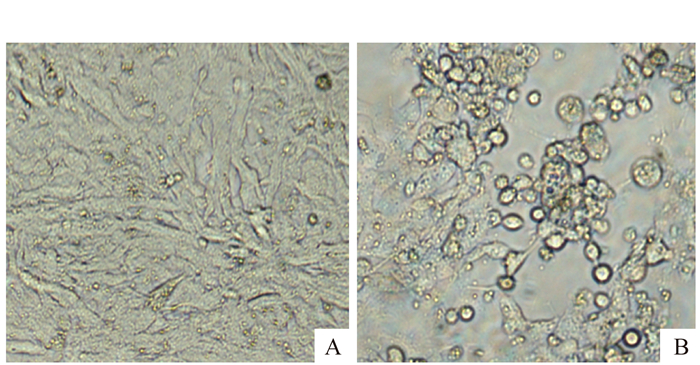
6份65~120日龄疑似病死番鸭肝脾组织匀浆上清,接种MDEF单层细胞培养并盲传至第3代,其中4份出现细胞病变,表现为局灶性细胞圆缩、随后病变范围逐渐扩大并脱落,部分细胞融合形成巨融合细胞(图 1)。随着传代代次增加,出现病变的时间亦随之缩短。暂将这4株病毒命名为DPVfj1、DPVfj2、DPVfj3、DPVfj4。
2.2 病毒鉴定结果
2.2.1 血凝性测定结果
血凝试验显示分离毒不能凝集鸡、鸽红细胞,提示分离毒无血凝特性。
2.2.2 IFA试验
人工病死番鸭肝、脾、胰腺等组织的冰冻切片和感染病毒的细胞板分别经抗GPV、MPV、MDRV、DPMV和TUMV单抗的IFA,均未出现特异性荧光,结果均为阴性。
2.2.3 荧光定量PCR鉴定结果
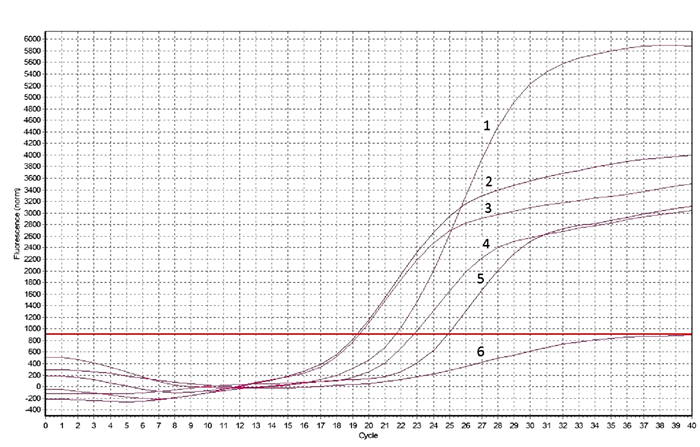
4份分离毒应用鸭瘟病毒荧光PCR检测试剂盒进行鉴定,扩增曲线如图 2所示,分离毒DPVfj1、DPVfj2、DPVfj3、DPVfj4、阳性对照、阴性对照CT值分别为19.32、19.45、24.9、22.8、21.71、none,判定4份分离毒均为鸭瘟病毒核酸阳性。
2.2.4 PCR及产物序列鉴定结果
对PCR产物的阳性重组质粒进行正、反向测序,得到长度为1 173 bp鸭瘟病毒gJ基因部分序列。经BLAST分析,该序列与多株鸭瘟病毒gJ蛋白基因序列(KJ549663、KF693236、JQ673560、KF487736、JQ647509、EU082088、FJ222443、JF999965、KF263690) 相似度均大于99%(图 3)。PCR产物序列进一步证实分离毒为鸭瘟病毒。
2.2.5 动物回归试验结果
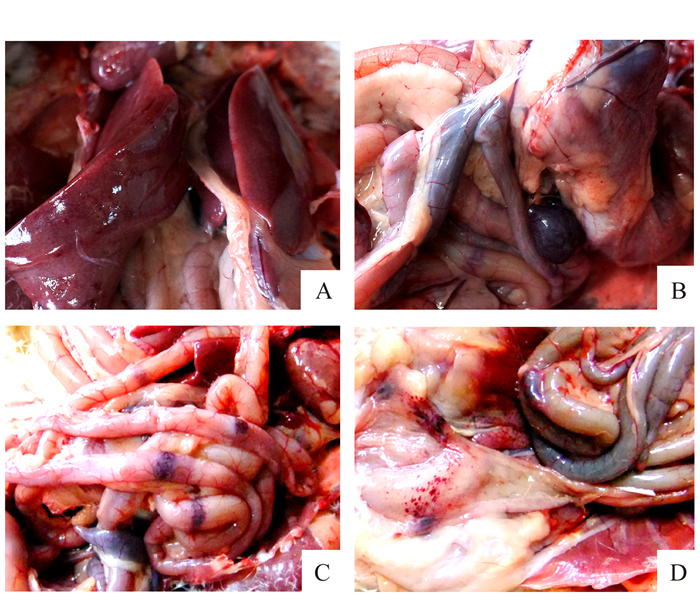
人工感染组番鸭于接种分离毒后3 d出现精神沉郁,食欲废绝,渴欲增加,行走迟缓、喜卧等症状,第4 d出现死亡,10羽番鸭死亡6羽,第5 d接种鸭全部死亡,发病率和死亡率均为100%。剖检病死鸭出现与临床自然感染一致的病变,肝脏略肿大质脆出血、脾脏略肿大呈瘀黑色,特征性病变表现为肠黏膜出血环及出血点和泄殖腔出血点(图 4),并从病死鸭肝脾匀浆中分离到病毒。动物回归试验表明分离毒是该病的病原。
2.2.6 番鸭同居感染试验结果
5日龄番鸭与病鸭同居后第4 d开始发病,第6 d出现死亡,至第8 d 10羽番鸭死亡3羽,继续观察到25 d,发病率和死亡率均为30%,并从病死鸭肝脾匀浆中分离到病毒。同居感染试验结果表明直接接触是该病传播途径之一。
2.2.7 对鹅的致病性试验结果
17日龄健康雏鹅以细胞毒原液DP1d3(0.8 mL·羽-1)经口服和肌注途径人工感染后,每天观察至28 d,结果人工感染鹅未出现临床症状且生长发育良好,初步表明该分离毒对鹅不易感,无致病性。
3. 讨论
鸭瘟由Baudet于1923年首次在荷兰发现,随后陆续在许多养鸭国家暴发和流行[1-4]。该病病原是鸭瘟病毒,属疱疹病毒科a疱疹病毒亚科,核酸为线状双股DNA。在我国该病多见于成年种鸭和蛋鸭,其临床特征性症状是流泪,眼睑肿胀,两脚发软不能站立,下痢,头颈部肿大,俗称“大头瘟”,剖检可见食道和泄殖腔黏膜出血并伴有黄褐色假膜覆盖[4]。至今全国各地均有鸭瘟流行的报道,鸭瘟仍然是目前阻碍我国养鸭业发展的重要传染病之一[5-10]。
本研究应用MDEF从疑似鸭瘟病毒自然感染病死番鸭中分离到病毒,分离毒无血凝活性,能致MDEF产生细胞病变,经荧光定量PCR、gJ蛋白基因PCR及其产物序列测定均证实分离毒属于鸭瘟病毒,人工感染对鹅不易感,无致病性;对雏番鸭具有很强的致病性,发病率和死亡率均高达100%,动物回归能复制出与自然感染一致的病症,并能回收到病毒。提示该分离毒为鸭瘟病毒强毒株,但其全基因序列还有待进一步测定。
由于我省有十多年未发生鸭瘟疫情,养殖企业也不同程度忽视了鸭瘟疫苗免疫。然而2015年以来,我省不同日龄不同品种未免疫鸭瘟疫苗的鸭群均不同程度发生该病,发病率和病死率高,给养鸭业敲响了警钟。建议在加强日常饲养管理和生物安全措施的同时,应对鸭瘟疫苗的免疫予以足够重视,可根据疫区流行情况适当调整免疫程序(如疫源地在10日龄首免、间隔20 d加强免疫1次)。
-
-
[1] DAVISON S, CONVERSE K A, HAMIR A N, et al.Duck viral enteritis in Muscovy ducks in Pennsylvania[J].Avian Dis, 1993, 37:1142-1146. DOI: 10.2307/1591927
[2] 殷震, 刘景华.动物病毒学:第2版[M].北京:科技出版社, 1997:1073-1077. [3] ARAVIND S, NITIN M K, SATISH S G, et al. Adaptation and growth kinetics study of an Indian isolate of virulent duck enteritis virus in vero cells[J]. Microbial Pathogennesis, 2015, 78:14-19. DOI: 10.1016/j.micpath.2014.11.008
[4] 甘孟侯.中国禽病学[M].北京:中国农业出版社, 1999:107-119. [5] 魏笑笑, 高亚东, 刘志杰, 等.一株鸭瘟病毒GM株的分离与鉴定[J].中国家禽, 2015, 37(6):63-65. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGJQ201506020.htm [6] 王红海, 胡薛英, 苏敬良, 等.商品肉鸭鸭瘟病毒的分离与鉴定[J].中国预防兽医学报, 2006, 28(1):105-108. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGXQ200601028.htm [7] 马秀丽, 宋敏训, 艾武.山东省鸭瘟病jh株的分离鉴定[J].中国畜牧兽医, 2005, 32(9):47-49. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gwxk200509017&dbname=CJFD&dbcode=CJFQ [8] 孟刚, 王经满, 曹瑞兵.2株鸭瘟病毒强毒株的分离鉴定[J].畜牧与兽医, 2012, 44(4):59-62. http://www.cnki.com.cn/Article/CJFDTOTAL-XMYS201204019.htm [9] 付书林, 陈夏冰, 钱运国, 等.一株鸭瘟病毒的分离与鉴定[J].湖北农业科学, 2014, 53(19):4644-4646. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGJQ201506020.htm [10] 马圣利.一株鸭瘟病毒的分离与鉴定[J].现代农业科技, 2016, (8):261-262. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGJQ201506020.htm -
期刊类型引用(4)
1. 廖素凤,罗进凤,兰孜怡,黄婷婷,熊钒,杨志坚,许明,郑金贵. 基于UPLC-MS/MS的豆瓣菜酚酸类组分分析. 天然产物研究与开发. 2024(11): 1874-1888 .  百度学术
百度学术
2. 张今君,夏慧丽,方如意. 超高效液相色谱-串联质谱法测定红美人中8种酚酸化合物. 食品研究与开发. 2022(09): 169-175 .  百度学术
百度学术
3. 卢专,黄永桥,于以竹,毛敏霞,简银池,吴新文. UPLC-MS/MS分析绿茶中12种酚酸类物质. 食品安全导刊. 2022(15): 53-56+61 .  百度学术
百度学术
4. 姚娜,黄燕明,汪静,李雪银,陈桂生,王斌,康志英. 麸炒白术配方颗粒HPLC指纹图谱研究. 亚太传统医药. 2020(12): 78-83 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: