Differentiation between Reciprocal-crossed Hybrids of Dendrobium officinale and D.huoshanense Using SSR Markers
-
摘要: 以铁皮石斛与霍山石斛的正、反交F1代共63株为试验材料,利用SSR标记鉴定杂种真实性。结果表明,在21对石斛基因组引物中,筛选出双亲多态性引物3对,多态性引物占比为14.3%。用此3对引物可鉴定出铁皮石斛×霍山石斛杂交苗中25株真杂种,比例为78.1%,可鉴定出霍山石斛×铁皮石斛杂交苗中28株真杂种,比例为90.3%。Abstract: The authenticity of hybrids created by reciprocal crossing between Dendrobium officinale and D. huoshanense was not always apparent. To resolve the confusion, this study applied SSR markers to differentiate them among 63 F1 generation of the hybrids. Three out of 21 pairs of the SSR primers were found to have polymorphic bands, i.e., 14.3% of all, in the parental lines. By using these 3 pairs of primers, 25 out of 32 known (D. officinale×D. huoshanense) hybrids were correctly identified rendering a positive identification rate of 78.1%; while, 28 out of 31 known (D. huoshanense×D. officinale) hybrids were positively identified with a rate of 90.3%.
-
Keywords:
- Dendrobium officinale /
- Dendrobium huoshanense /
- reciprocal cross /
- SSR /
- hybrid identification
-
0. 引言
【研究意义】真菌是土壤中一类重要的微生物,具有降解有机质、驱动养分循环[1]、促进植物生长[2]、参与植物病虫害生物防治[3]等功能,是评价土壤质量的生物指标。因此,研究根际土壤真菌多样性对马铃薯土传病害防控和土壤微环境改良具有重要意义。【前人研究进展】根际土壤真菌的多样性在维持土壤生态系统平衡和土壤质量方面起到了重要的作用,根际土壤是直接受植物根系及其分泌物影响的土壤区域,是土壤微生物与植物相互作用的重要场所,植物通过根系活动影响根际土壤的养分含量和土壤理化性状,并改变根际微生物群落组成和多样性[4]。同时,根际土壤微生物多样性和优势菌属的变化,也会在一定程度上反映出土壤肥力和质量的变化趋势[5]。传统的土壤真菌研究方法,如平板培养法可以得到少部分的可培养真菌,但无法获得其真菌群落结构组成和功能等信息。高通量测序作为第二代测序技术,具有操作简单、成本低、结果可信度高等优势,能够一次并行地对几百万条,甚至上千万条的DNA序列分别进行测序[6],有助于准确分析环境中微生物的组成和分布,能够深入了解微生物群落组分在科、属和OTU(Operational Taxonomic Units,指分类研究的个体,真菌分类中一般是指菌株)水平上的变化[7]。徐雪雪等[8]采用ⅠlluminaMiseq方法,对不同沟垄覆膜种植模式下马铃薯连作的根际土壤真菌多样性进行研究,认为采用全膜垄播种植处理的土壤真菌多样性最高,半膜垄播种植对镰孢菌引起的马铃薯病害有一定的防治作用。张国青等[9]基于真菌ITS1高通量测序,证明环保肥料增效剂可明显改善土壤真菌的种群结构。姜晓芳[10]通过高通量测序方法对全生育期马铃薯根际土壤微生物群落多样性进行研究,结果表明:稻草包芯栽培模式可不同程度改变土壤的细菌和真菌群落结构,提高土壤细菌群落多样性,降低土壤真菌多样性,在马铃薯生育关键期可通过提高土壤抑菌性真菌丰度来抑制某些病原菌的增长。【本研究切入点】目前,采用高通量测序分析技术对南方冬作区马铃薯不同覆盖栽培模式下微生物多样性的研究鲜有报道。【拟解决的关键问题】揭示不同覆盖栽培模式下冬作马铃薯根际土壤真菌物种多样性和群落结构的变化规律,探讨在不同栽培模式下马铃薯全生育期根际土壤真菌多样性的变化规律。
1. 材料与方法
1.1 试验地概况
试验在广西农业科学院武鸣里建科研基地内进行。该地区海拔117 m,年均降水量1 233.4 mm,年平均气温21.9℃,无霜期360 d。试验地前茬作物为玉米,土壤为砖红壤,0~20 cm土层的基本理化性质:pH值5.1,含速效氮120 mg·kg−1、速效磷39 mg·kg−1、速效钾106 mg·kg−1、有机质30.4 g·kg−1。
1.2 试验设计
供试马铃薯品种为华薯1号,由华中农业大学提供,一级原种。田间试验采用单因素随机区组设计,设3个处理,分别为:处理A,黑地膜覆盖;处理B,稻草覆盖;处理C(CK),无覆盖的常规栽培,作为对照。各处理3次重复,共9个小区,小区面积24 m2(每小区4行)。马铃薯采用单垄双行种植,株距25 cm。于2018年11月24日种植,2019年3月成熟收获。
1.3 样品采集
分别在马铃薯苗期(12月24日)、块茎形成期(1月24日)、块茎膨大期(2月9日)、淀粉积累期(2月24日)、块茎成熟期(3月24日)采集土样。采用五点取样法在每个小区每隔4株间取样,5个点的土样混合均匀后为该小区的土样。取样时将马铃薯整株挖出,注意不伤到根系,轻轻抖落根系上较大土块,用消毒过的毛刷刷下根系表面(约2~3 mm)的土作为根际土壤样品,土样封装到无菌封口袋中,用冰盒带回实验室置于−80℃冰箱保存,用于土壤微生物DNA提取及后续测定。
1.4 根际土壤总DNA提取及测序
将采集的土壤样品送到北京百迈克生物科技有限公司进行ⅠlluminaMisep 2500高通量测序。利用前向引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和反向引物ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS1区进行PCR扩增,PCR反应采用20μL体系。PCR扩增条件为 1×(5 min、95℃);35×(1 min、95℃,1 min、50℃,1 min、72℃);1×(7 min、72℃);4℃保存。
1.5 数据分析与处理
根据PE Reads之间的Overlap关系,将测序得到的双端序列数据拼接成一条序列Tags,同时对Reads的质量和拼接效果进行质控过滤。主要步骤:(1)使用FLASHv12.7软件,通过Overlap对每个样品的Reads进行拼接,得到的拼接序列即原始Tags数据。(2)使用TrimmomaticV0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据。(3)使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags)。信息分析内容:划分OTU,进行多样性及差异显著性分析。
2. 结果与分析
2.1 测序数据质量评估及OTU聚类分析
对15个样品ITS2区测序的原始数据进行PEReads拼接,Tags过滤和去嵌合体后,共得到1 032 153条有效序列,平均每个样品有68 810条有效序列,其中:处理A平均有效序列73 157条、处理B平均有效序列73 453条、处理C平均有效序列73 021条,每条序列平均长度249 bp、有效率达91.4%,具体见表1。
表 1 样本测序数据统计结果Table 1. Sequencing of soil samples处理
Treatment有效序列数
Effective Tags样品长度
AvgLen/bp有效序列数
百分比
Effective/%测序深度指数
Coverage/%A1 73 725 249 91.99 99.97 A2 73 708 250 92.08 99.95 A3 71 870 245 89.82 99.94 A4 72 707 240 91.01 99.96 A5 73 774 240 92.04 99.93 B1 72 440 248 90.87 99.93 B2 73 058 251 91.62 99.95 B3 74 061 278 92.43 99.94 B4 7 862 283 92.0 99.95 B5 73 842 248 91.95 99.92 C1 73 199 255 91.42 99.96 C2 73 334 237 91.27 99.95 C3 73 179 240 91.23 99.97 C4 73 357 243 91.34 99.95 C5 72 037 235 89.98 99.93 注:A1~A5依次为黑地膜覆盖栽培的苗期、块茎形成期、块茎膨大期、淀粉积累期、成熟期,B1~B5依次为稻草覆盖栽培的苗期、块茎形成期、块茎膨大期、淀粉积累期、成熟期,C1~C5依次为露地栽培的苗期、块茎形成期、块茎膨大期、淀粉积累期、成熟期,下同。
Note: A1~A5 is seeding, tuber initiation stage, bulking stage, starch accumulation stage, maturationstage of black film mulching; B1~B5 is seeding, tuber initiation stage, bulking stage, starch accumulation stage, maturation stage of rice straw mulching; C1~C5 is seeding, tuber initiation stage, bulking stage, starch accumulation stage, maturation stageofconventionalculture.the same as below.图1是相似度为0.97条件下各土壤样品的稀释曲线,利用稀释曲线可了解样本间的物种多样性和丰富程度,以及样本取样深度情况。图1的横坐标为样本中随机抽取的测序条数,纵坐标为该测序条数聚类得到的OTU数量,每条曲线代表表1的1个样品,随着测序条数的加大,曲线趋于平缓,表示此环境中的物种并不会随着测序数量的增加而显著增多,所有样本文库的测序深度指数在99.92%~99.97%。说明取样合理,环境中真菌群落结构的置信度高,能够真实反映土壤样本的真菌群落。
2.2 不同栽培模式冬作马铃薯根际土壤真菌群落多样性分析
通过多样性分析可以反映单个样品物种多样性和物种丰度,常用衡量指标有:ACE、Chao1、Shannon和Simpson,ACE和Chao1为物种丰富度指数,Shannon和Simpson为物种多样性指数。ACE和Chao1指数越大,说明物种数量越多;Shannon指数越大,Simpson指数越小,说明样品的物种多样性越高[11-13]。由表2看出,各处理的根际土壤真菌丰富度指数ACE排序为:处理C>处理B>处理A,丰富度指数Chaol排序为:处理C>处理A>处理B,3个处理之间的丰富度指数Chaol差异均达显著水平;多样性指数Simpson排序为:处理B>处理C>处理A,多样性指数Shannon排序为:处理A>处理C>处理B,其中处理A与处理B的Simpson指数差异达显著水平。由此可知,处理C马铃薯根际真菌丰富度最高,处理A马铃薯根际土壤真菌多样性指数最高。
表 2 不同栽培模式马铃薯根际土壤真菌群落多样性Table 2. Diversity of fungal communities in rhizosphere soils on grounds under different cultivation practices处理 Treatment 数目 OTU 丰富度指数 ACE 丰富度指数 Chao1 多样性指数 Simpson 多样性指数 Shannon A1 352 364.33±5.81 cde 373.00±6.25 bcd 0.06±0.02 c 4.04±0.22 a A2 311 333.17±7.51 fg 346.06±5.51 def 0.11±0.01 bc 3.30±0.32 ab A3 336 362.02±2.08 def 359.43±9.16 cd 0.05±0.03 c 3.70±0.06 ab A4 363 376.37±2.00 abcd 382.89±1.10 abc 0.04±0.02 c 3.94±0.21 ab A5 297 334.80±2.11 efg 346.04±5.75 def 0.08±0.02 c 3.24±0.41 ab B1 249 394.80±3.98 abc 322.67±2.90 f 0.08±0.01 c 3.69±0.12 ab B2 376 397.94±4.85 ab 404.33±7.54 a 0.05±0.01 c 3.80±0.32 ab B3 339 367.40±3.73 bcd 371.34±1.85 bcd 0.21±0.02 ab 2.74±0.18 ab B4 307 328.59±5.02 g 326.69±5.58 ef 0.10±0.02 c 3.14±0.50 ab B5 290 329.51±7.33 g 323.00±5.51 f 0.24±0.03 a 2.34±0.34 b C1 348 361.80±2.32 def 363.12±4.00 cd 0.14±0.02 abc 3.20±0.23 ab C2 361 379.03±5.23 abcd 396.00±4.16 ab 0.06±0.02 c 3.72±0.38 ab C3 350 357.21±2.61 defg 358.14±1.39 cd 0.10±0.01 c 3.51±0.26 ab C4 348 366.62±10.75 cd 372.39±5.48 bcd 0.04±0.01 c 3.94±0.42 ab C5 370 401.10±8.72 a 400.49±6.64 ab 0.14±0.03 abc 3.25±0.28 ab A(总计/平均) 1659 354.14±2.98 a 361.49±1.09 b 0.07±0.01 b 3.64±0.16 a B(总计/平均) 1561 363.65±4.85 a 349.61±2.97 c 0.14±0.01 a 3.14±0.08 a C(总计/平均) 1777 373.15±4.31 a 373.03±0.59 a 0.10±0.01 ab 3.53±0.28 a 注:表中同列数据后的小写字母反映的是不同处理间在0.05水平上的差异显著性。
Note: The lowercase letters after the same column in the table represent difference significant between different treatment at 0.05 level.不同栽培模式处理的马铃薯全生育期根际真菌多样性变化规律不同,处理A真菌多样性指数Shannon表现为随着生育进程呈先降低后升高再降低的趋势,而处理B和处理C均表现为呈先升高后降低再升高最后又降低的趋势。处理A3多样性指数Simpson与处理B3差异达显著水平,说明黑地膜覆盖栽培比稻草覆盖栽培可提高马铃薯块茎膨大期根际土壤的真菌多样性;与对照处理(C3、C4)相比,处理A(A3、A4)显著提高了马铃薯块茎膨大期到淀粉积累期真菌群落的物种丰富度指数;与处理B(B4、B5)相比,处理A(A4、A5)提高了马铃薯淀粉积累期到成熟期真菌群落的物种丰富度指数,但差异不显著。
2.3 不同栽培模式冬作马铃薯根际土壤真菌群落结构多样性分析
由图2可知,在门分类水平上不同处理间真菌群落结构相似,主要有子囊菌门(Ascomycota)、被孢菌门(Mortierellomycota)、担子菌门(Basidiomycota)、丝足虫类(Cercozoa),以及其他未分类真菌(Fungi-unclassified),其中:子囊菌门是优势菌门,处理A占比最高(76%),处理C占比69%,处理B占比58%;次优势菌门为被孢菌门,处理C占比最高(16%),处理A、处理B占比均为11%。担子菌门比例以处理B最高(20%),而且处理A和处理C担子菌门比例均为3%;处理B的丝足虫类相对丰度比其他处理高,属于特异菌门。
通过对马铃薯不同生育期门分类水平真菌群落结构相对丰度的分析结果可知,处理A和处理C的子囊菌门相对丰度随着马铃薯生育期推进变化不大,处理B的子囊菌门变化较明显。处理A3子囊菌门在块茎膨大期相对丰度分别比处理B3、处理C3提高95%、38%,处理A4子囊菌门在淀粉积累期相对丰度比处理B4提高147%,处理A1担子菌门在苗期相对丰度分别比处理B1、处理C1提高50%、89%,处理A5担子菌门在块茎成熟期相对丰度分别比处理B5、处理C5提高67%、40%,处理A4担子菌门相对丰度在淀粉积累期分别比处理B4、处理C4提高33%、300%。
由图3可知,不同覆盖栽培模式在属分类水平上主要有被孢霉属Mortierella、小不整球壳菌Plectosphaerella、头束霉属Cephalotrichum、假裸囊菌属Pseudogymnoascus、粉红粘帚霉属Clonostachys、田头菇属Agrocybe,所占比例均在4%~16%范围。此外,还有镰孢菌属Fusarium、赤霉菌薯Gibberella、Mariannaea、毛壳菌属Chaetomium所占比例较低,均在1%~3%之间。通过真菌群落丰度比例可知,处理A的优势属为:头束霉属(相对丰度13%),次优势属依次为被孢霉属(相对丰度12%)、小不整球壳菌(相对丰度10%)、假裸囊菌属(相对丰度6%)、粉红粘帚霉属(相对丰度5%)、镰孢菌属(相对丰度3%);处理B优势属为:田头菇属(相对丰度15%),其他菌属依次为小不整球壳菌(相对丰度12%)、被孢霉属(相对丰度11%)、头束霉属(相对丰度6%)、假裸囊菌属(相对丰度6%);对照处理C优势属为:被孢霉属(相对丰度16%),次优势属依次为小不整球壳菌(相对丰度10%)、假裸囊菌属(相对丰度7%)、头束霉属(相对丰度4%)。由此可见,不同栽培模式根际土壤真菌群落优势菌株种类和丰度存在较大差异,处理A和处理B的物种多样性比处理C(对照)丰富。
通过对马铃薯不同生育期属分类水平真菌群落结构相对丰度的分析结果可知,在块茎成熟期,处理A5被孢霉属相对丰度比处理B5、处理C5分别提高467%、89%;在块茎形成期,处理A2被孢霉属相对丰度分别比处理B2、处理C2降低33%、50%。在块茎膨大期,处理A3小不整球壳菌属相对丰度比处理C3提高120%;在淀粉积累期,处理A4小不整球壳属相对丰度比处理C4提高100%;在块茎成熟期,处理A5小不整球壳菌属相对丰度比处理C5降低40%;在块茎形成期,处理A2头束霉属的相对丰度比处理B2、处理C2分别提高275%、500%;在块茎膨大期,处理A3头束霉属的相对丰度比处理C3提高125%。
2.4 不同栽培模式冬作马铃薯根际土壤真菌群落热图分析
根据OTU丰度进行聚类,将高丰度、低丰度的物种模块聚集,通过颜色变化与相似程度来直观反映不同样品在属水平上群落结构的差异性和相似性,热图能够较为直观反应不同处理样品间真菌群落中物种组成相似性、差异性、物种聚类关系等情况。由图4可知:在马铃薯的苗期,处理A的优势菌属为Edenia、Lectera、llyonectria,处理B优势菌属为Ochroconis、Chaetomiun、Wallemia、Kurtzmanomyces;在块茎形成期,处理A的优势菌属为Parasola、Sallozyma、Tetracladium,处理B的优势菌属为Coprinellus、Collarina、Hydropisonaera,处理C的优势菌属为Corynascella、Arthrographis;在块茎膨大期,处理A的优势菌属为Acremonium,处理B的优势菌属为Agrocybe、Psathyrella,处理C的优势菌属为Tetragoniomyces、Hirsutella;在淀粉积累期,处理A的优势菌属为Fusicolla、Amaurodon、Latorua,处理B的优势菌属为Polyschema、Coprinopsis、Pseudopithomyces、Coniophora,处理C优势菌属为Microdochium、Zopllella、Campyiocarpon;在成熟期,处理A的优势菌属为Clonostachys,处理B的优势菌属为Panaeolus、Immersiella,处理C的优势菌属为Trichoderma、Sparassis、Volutella。
热图聚类结果(图4)中,颜色代表物种丰度,纵向聚类表示不同物种在各处理间丰度的相似情况,两物种间距离越近,枝长越短,说明这两个物种在各样品间的丰度越相似;横向聚类表示不同处理间物种丰度的相似情况,与纵向聚类一样,两样品距离越近,枝长越短,说明这两个样品的各物种丰度越相似。由聚类树可知,在马铃薯块茎形成期、成熟期,处理A与处理C的物种丰度存在明显差异;在块茎膨大期,处理A与处理B的物种丰度比较相似;在块茎形成期,处理B和处理C物种丰度较为相似。
3. 讨论与结论
3.1 不同栽培模式对冬作马铃薯根际土壤真菌多样性的影响
土壤真菌数量巨大、种类繁多,与宿主植物相互作用,在有机质分解、养分循环及交换中发挥着基础作用,因此土壤真菌多样性可作为评价土壤生态系统等功能变化的重要指标[12]。ACE和Chao1指数侧重于体现群落丰富度,而Shannon和Simpson多样性指数则兼顾丰富度和均匀度,更能体现真菌群落的多样性,在相同物种丰度的情况下,群落中各物种具有越大的均匀度,群落就具有越大的多样性[13]。本研究结果表明,处理A物种多样性指数最高,黑地膜覆盖栽培处理Simpson指数与稻草覆盖栽培差异达显著水平,说明黑地膜覆盖栽培可提高土壤真菌群落多样性。前人的研究结果也证明,黑地膜全膜覆盖栽培可增加土壤贮水量,改善土壤理化性状,有利于提高土壤微生物多样性[8,14]。
不同栽培模式可影响到马铃薯根际真菌多样性随生育进程的变化规律。本研究结果表明,处理A的真菌多样性指数(Shannon)表现为先降低后升高再降低的趋势,而处理B和处理C的变化趋势都表现 为先升高后降低再升高最后降低。马铃薯在块茎形成期后,从以地上部茎叶生长为中心逐渐转向地上茎叶生长与地下块茎形成同时进行,这是决定单株结薯数量的关键时期,此时是马铃薯需水、需肥量最大的时期[15]。此期马铃薯根系吸收养分的能力增强,与微生物竞争养分的结果使得微生物的同化作用减弱,导致微生物多样性降低[16]。处理A多样性指数最低值出现时间比处理B和处理C提前,这可能与用黑地膜覆盖栽培的土壤温度和含水量均比用稻草覆盖和常规栽培的更高有关[17]。前人研究结果也表明,黑地膜覆盖栽培可促进马铃薯物候期提前,明显加快马铃薯的生长发育进程[18]。本研究结果表明的在成熟期根际真菌多样性指标均降低,与前人研究结果并不一致[19],具体原因有待于进一步研究。
3.2 不同栽培模式对冬作马铃薯根际土壤真菌群落结构和功能的影响
土壤真菌多样性及其群落结构组成对维护生态系统平衡起着重要的作用。子囊菌门是常见的土壤腐生菌,是土壤中重要的分解者,可以分解难降解的有机质,在养分循环方面起着重要作用[20],头束霉属存在于有机质含量丰富的土壤中。被孢霉属是土壤习居菌,它可以通过合成并分泌草酸来溶解多种类型土壤中的矿物磷,释放到土壤中,并具有较强分解纤维素的能力,能有效促进土壤碳循环,保持土壤的健康状况[21]。本研究结果表明,不同栽培模式中子囊菌门均为最优势真菌门,其中处理A的子囊菌门相对丰度比处理B和处理C更高,处理A比处理C提高了块茎膨大期到成熟期的头束霉属的丰度,说明黑地膜覆盖栽培比其他栽培方式更有利于土壤有机质分解转化[22];与处理C相比,处理A苗期和块茎膨大期的被孢霉属丰度较低,但从块茎淀粉积累期到成熟期,处理A被孢霉属丰度逐渐提高,说明黑地膜覆盖栽培通过提高薯块生长后期解磷真菌的丰度来提高该时期土壤有效磷的含量,可有效延缓土壤养分的释放,有利于保证马铃薯后期地下部分生长对养分的需求。处理A与处理B、处理C相比,均提高了粉红粘帚霉属丰度,粉红粘帚霉属是一种重寄生菌,具有繁殖速度快、寄主范围广、寄生能力强、拮抗机制多样等优点,是目前已发现的拮抗微生物中极具潜力的生防因子之一[23]。由物种丰度热图可知,块茎膨大期处理A的优势菌属为枝顶孢属,枝顶孢属是一类能够分泌某些酶或者其他物质来抑制细菌和真菌生长繁殖的抑菌微生物,这与前人的研究结果中黑地膜覆盖栽培可以提高块茎形成关键时期土壤抑菌属丰度[24]吻合。镰孢菌属是常见的土壤习居菌,可分解纤维素、降解有机质,同时也是多种植物病原菌之一,可引起马铃薯枯萎病和干腐病[25]。本研究表明,随着马铃薯生育进程,处理B镰孢菌属相对丰度逐渐降低,到成熟期土壤中已检测不到镰孢菌属,说明稻草覆盖栽培在一定程度上抑制了镰孢菌的繁殖,可以缓解镰孢菌引起的马铃薯土传病害,这与前人的研究结果相似[10]。
综上所述,黑地膜覆盖栽培处理的根际土壤真菌多样性比稻草覆盖栽培和常规栽培处理的丰富,黑地膜覆盖栽培主要通过提高马铃薯块茎生长后期土壤修复真菌(被孢霉属、头束霉属),改善土壤真菌群落结构,有利于土壤有机质降解,提高土壤肥力,为马铃薯生长提供更充足的养分条件;同时通过增加抑菌属(粉红粘帚霉属、枝顶孢属)的丰度,抑制土壤中病原菌繁殖,有利于有益微生物生长,降低马铃薯发病风险。
-
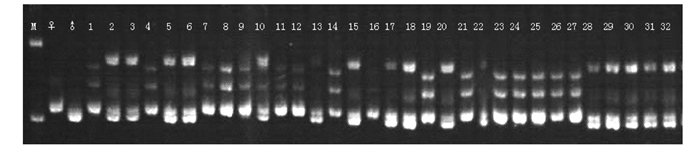
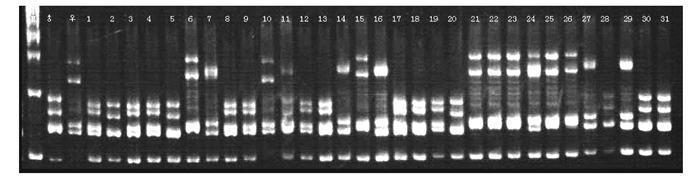
图 1 引物DM199对霍山石斛×铁皮石斛杂种苗扩增结果
注:M为Mark; ♀为霍山石斛; ♂为铁皮石斛; 1~32为杂交实生苗。图 2同。
Figure 1. Amplification of primer DM199 in F1 (D. huoshanense×D. officinale) hybrid
表 1 用于SSR标记的引物序列
Table 1 Sequences of SSR primers
引物名称 上游引物
(5′-3′)下游引物
(5′-3′)目标片段长度
/bpDR31 AGAGGGAGAGTGCAAGAG CGCTATTTCCATCCCTCC 219~230 OA07 CCTATCCGAGGAGAACCATAA AAGCTTTGAGATTCTTTTGTGACT 160~174 OA08 AGGCAAAATATAACATACCTCAAT AATCAAGCCATTTATCTCCTCT 166~180 OA12 GCATTCTTTTGCCTAATTCAGGAA TCCACCCTTTCATCCAAATACTTC 163~287 OA15 ACAGCGTTAACATAAACCATAAGC CTGCCCGCAGATTCAGC 221~277 OA18 GGAACGGAGAAGATTAAGACAACC TGCCCTCACATGCCGTATT 179~217 OA20 CATATATTAGCCACTTCACTCTC ATGTCCACCTCCCTAAAATAGTA 222~266 OA24 GAGCAACGGGAGGGATAGAGATAT ACCTCTGTCTCCCTCTTGTCCATC 313~351 OA25 GGAAGGGCCTAAGTGGATG GCGTACCATGCTTAACATTCA 139~181 S122 GTGACTCGAGCCTTGGAATACG ACGCCGGTGAAAGAAGAAGAG 187~205 S130 CTCATGCATAAATTTAGGGTAGA ACAACACGAACAAGTAGTCATC 310~328 DM2 GAGTCGTAAGAGGCGAGTTGT AATGGATGGTATCTATGTCCGTAT 276~310 DM3 CTCCGGCGCTAGCTGTTGC TCACTTGCGGATGGGGAGC 178~200 DM88 AGCATTTTGAGATGGGATGATC ATTGTCCTCGCCGATATGAGTA 190~230 DM81 CTCCAATACCGATATGCTG TCGGCTACAGGTAAGTGG 100~115 DM123 ATAGTGGGATAAAGGCTTG ATCAGTATCCACAACATTTA 180~210 DM137 CTGACTGAGGTGCAGAGGTTTG CCTGATGATGAGTATGAAGAGCC 130~160 DM178 TCCTCCAGCTTAACACCATCA CGCCACCCTACACTAAGAAAA 290~310 DM186 GCCTTCTACAGCACGGGTCT GGAATCTGAAACCAGGAGGC 180~280 DM198 AAAAGCACTCAAAGACAAAATCAA GATGAGTGAGGGATGGGTGC 210~270 DM199 GTGTCTGCCCGAGTAAAAGC AGCTCACGGTTACCAGGTCT 216~235 表 2 可扩增具有父本特征SSR引物
Table 2 SSR markers with special bands from male parent
杂交组合 引物 总株数 具有父本特征的株数 真杂种率/% 霍山石斛铁×皮石斛 DM178 32 14 43.8 Dendrobium huoshanense×Dendrobium officinale DM186 32 12 37.5 DM199 32 23 71.9 小计 32 25 78.1 铁皮石斛×霍山石斛 DM178 31 15 48.4 Dendrobium officinale×Dendrobium huoshanense DM186 31 12 38.7 DM199 31 23 74.2 小计 31 28 90.3 -
[1] 吴庆生.中药霍山石斛的微量元素分析及TE图谱鉴定[J].微量元素与健康研究, 1995, (12):31-32. http://www.cnki.com.cn/Article/CJFDTOTAL-WYJK501.016.htm [2] 李秀芳. 霍山石斛和四种药典石斛多糖降血糖活性比较研究[D]. 合肥: 合肥工业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10359-1012520909.htm [3] 吴胡琦, 罗建平.霍山石斛的研究进展[J].时珍国医国药, 2010, (1):208-211. http://www.cnki.com.cn/Article/CJFDTOTAL-SZGY201001103.htm [4] LUO J, HOU B W, NIU Z T, et al. Comparative chloroplast genomes of photosynthetic orchids:insights into evolution of the Orchidaceae and development of molecular markers for phylogenetic applications[J]. PLoS One, 2014, 9(6):e99016. DOI: 10.1371/journal.pone.0099016
[5] 何伯伟, 潘慧锋.浙江铁皮石斛产业提升发展的实施措施与建议[J].浙江农业科学, 2014, (2):152-155. http://www.cnki.com.cn/Article/CJFDTOTAL-ZJNX201402003.htm [6] 樊秀彩, 张颖, 姜建福.SSR分子标记鉴定山葡萄和河岸葡萄种间杂种[J].西北植物学报, 2012, 32(11):2195-2200. DOI: 10.3969/j.issn.1000-4025.2012.11.008 [7] 朱骏驰, 郭印山, 刘镇东.利用SSR分子标记鉴定葡萄F1代杂种[J].沈阳农业大学学报, 2016, 47(2):148-152. http://www.cnki.com.cn/Article/CJFDTOTAL-SYNY201602005.htm [8] 吴妙丹, 董方娟, 汤定软. 4个丛生杂种竹的SSR分子鉴定[J].分子植物育种, 2009, 7(5):959-965. http://www.cnki.com.cn/Article/CJFDTOTAL-FZZW200905026.htm [9] 李晓辉, 李新海, 高文伟, 等.玉米杂交种DNA指纹图谱及其在亲子鉴定中的应用[J].作物学报, 2005, 31(3):386-391. http://www.cnki.com.cn/Article/CJFDTOTAL-XBZW200503018.htm [10] 邱道寿, 郑希龙, 蔡时可, 等.石斛SSR标记的开发及可转移性分析[J].植物科学学报, 2013, 3(5):500-509. http://www.cnki.com.cn/Article/CJFDTOTAL-WZXY201305010.htm [11] 任羽, 王呈丹, 徐世.石斛兰亲缘关系的SSR分析[J].热带作物学报, 2013, 34(7):1252-1256. http://www.cnki.com.cn/Article/CJFDTOTAL-RDZX201307011.htm [12] 刘昔辉, 方锋学, 高铁静, 等.斑茅割手密杂种后代真实性鉴定及遗传分析[J].作物学报, 2012, 38(5):914-920. http://www.cnki.com.cn/Article/CJFDTOTAL-XBZW201205024.htm [13] 张婧, 黄琳凯, ZHAO B-Y, 等.SPAR与SSR分子标记在柳枝稷杂种鉴定中的比较分析[J].草业学报, 2012, 21(5):128-133. DOI: 10.11686/cyxb20120516 [14] 房经贵, 章镇, 马正强, 等, AFLP标记在两个芒果品种间杂交Fl代的多态性及分离方式[J].中国农业科学, 2000, 33(3):19-24. http://www.cnki.com.cn/Article/CJFDTOTAL-ZNYK200003003.htm [15] 韩国辉, 向素琼, 汪卫星, 等.沙田柚杂交后代群体的SSR鉴定与遗传多样性分析[J].中国农业科学, 2010.43(22):4678-4686. DOI: 10.3864/j.issn.0578-1752.2010.22.015 -
期刊类型引用(5)
1. 陈梦妮,李永山,王慧,范巧兰,郭振威,席吉龙,张建诚. 麦田土壤真菌多样性对麦玉轮作长期秸秆还田和配施有机肥的响应. 微生物学通报. 2023(06): 2481-2496 .  百度学术
百度学术
2. 徐菊祯,张梦璐,何文清,隋鹏,陈源泉,崔吉晓. 中国马铃薯地膜覆盖增产效应及其影响因素的Meta分析. 中国农业科学. 2023(15): 2895-2906 .  百度学术
百度学术
3. 常芳娟,张贵云,张丽萍,吕贝贝,刘珍,范巧兰,姚众. 生物熏蒸配施微生物菌剂对西瓜连作土壤真菌群落结构的影响. 中国生态农业学报(中英文). 2022(02): 248-257 .  百度学术
百度学术
4. 冯翠,衣政伟,钱巍,姜小三,刘慧颖,李成忠. 不同种植模式下番茄根际土壤养分和真菌多样性分析. 江苏农业学报. 2022(02): 462-468 .  百度学术
百度学术
5. 潘梦诗,郭文阳,周留柱,邓丽,苗建利,徐宏光,张宗源,亓兰达. 贝莱斯芽孢杆菌菌剂对花生白绢病的田间防效及作用机理研究. 中国农业科技导报. 2022(11): 130-136 .  百度学术
百度学术
其他类型引用(7)




 下载:
下载: