Compositions and Antioxidant Activities of Oolong Tea Extracts Made by Two Processing Methods
-
摘要: 以清香乌龙茶为原料,采用先65%醇洗+后水提和先水提+后65%醇沉等2种提取方式制得粗茶叶多糖(TPs-水提和TPs-醇沉)及相应的附属产物(TPs-A、TPs-B和TPs-C),分析比较其组成含量、还原力及DPPH清除活性变化。结果表明,先65%醇洗+后水提制得的粗茶多糖中多糖含量最高,可溶性蛋白含量最低。其他组分来看,乙醚浸提茶叶有助于茶多酚/儿茶素类、总黄酮类、咖啡碱等小分子物质的浸出,水提醇沉则对茶叶内含成分的分离富集效果较差。抗氧化活性试验表明,2种提取方式制备的粗茶多糖TPs-水提和TPs-醇沉的还原力及DPPH清除活性显著弱于附属产物TPs-A、TPs-B和TPs-C。相关性分析表明,粗茶多糖的抗氧化活性表达与茶多酚中的儿茶素类,尤其是酯型儿茶素呈显著正相关,而与茶多糖、总黄酮和咖啡碱则呈正相关。结果表明,茶多糖具有抗氧化作用,其活性弱于茶叶中的多酚类。Abstract: An aromatic oolong tea was used as the raw material to extract polysaccharides (TPs) and other constituents (TPs-A, TPs-B and TPs-C) using two processing methods. The chemical compositions, reducing power, and DPPH scavenging capacities of the extracts were determined. The results showed that the method applying 65% ethanol for pre-soaking followed by a water extraction (E-W) produced more TPs and less soluble protein than the process employing a water extraction before precipitation by 65% ethanol (W-E). E-W promoted the extractions of polyphenols, catechins, flavonoids and caffeine; while, W-E was less efficient in separating or concentrating the components. On the antioxidant activity, TPs obtained by both methods were significantly lower on the reducing power and DPPH scavenging capacity than those of TPs-A, TPs-B and TPs-C. The correlation analysis suggested that the antioxidant activity of TPs was significantly related to the contents of polyphenols, catechins, and particularly ester catechins in the extract.There was also a synergism among TPs, total flavonoid and caffeine. It appeared that as antioxidants, TPs exhibited significantly lower activity than the phenolic compounds in the tea.
-
Keywords:
- tea polysaccharides /
- extraction /
- components /
- antioxidant activity
-
茶多糖(Tea Polysaccharides, TPs)是一类茶叶中含有的杂多糖复合物,构象繁杂,具有多种生物学活性,如抗氧化、降血糖等[1-3]。其提取制备在传统方法诸如酸碱法、水提醇沉法的基础上,常采用柱层析法纯化,成本高,得率低,限制其产业化推广[4-6]。大量研究报道已经证实,乙醇具有分级纯化富集植物多糖的特性,诸如黄芪[7]、香薷[8]、桑叶[9]等,且易实现工业化生产,成本低廉。
茶叶多糖多采用水提醇沉法制得。前期本课题组研究发现,乙醇可用于辅助提取制备茶叶多糖,即茶叶原料先通过一定浓度的乙醇提取后,实现茶多酚、蛋白质等物质的高浸出,而茶多糖则低浸出,醇提茶渣进一步再通过水相浸提达到茶叶多糖的富集[10]。因此,本研究以清香乌龙茶为原料,通过小规模中试分析比较先65%醇洗+后水提和常规法先水提+后醇沉2种提取方式,以期探究2种制备工艺条件下茶叶多糖与其他物质的分离富集特性,以及粗茶多糖的生物学活性变化,从而为茶叶多糖的工业化量产奠定理论基础。
1. 材料与方法
1.1 材料与设备
清香乌龙茶系福建省农业科学院茶叶研究所自制;粗茶多糖及其分离物在大闽食品(漳州)有限公司制备完成;福林酚(北京索莱宝科技有限公司);儿茶素单体(EGC、EC、C、EGCG、ECG)及咖啡因,纯度均大于98%(阿拉丁生化科技有限公司);芦丁,纯度≥98%(UV)(成都曼思特生物科技有限公司);1, 1-二苯基-2-三硝基苯肼(DPPH,纯度>97.0%) (东京化成工业株式会社);无水乙醇、蒽酮、浓硫酸、葡萄糖等均为分析纯试剂(国药集团上海试剂有限公司)。
T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);BioSpec-nano超微量分光光度计(岛津公司);Agilent1260型液相色谱系统及色谱柱Zorbax SB-C18(美国安捷伦科技有限公司);ACD-0502-U实验室超纯水系统(重庆颐洋企业发展有限公司);DK-8D型电热恒温水浴槽(上海一恒科学仪器有限公司);DHC-9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 试验方法
1.2.1 粗茶多糖及其分离物的提取制备
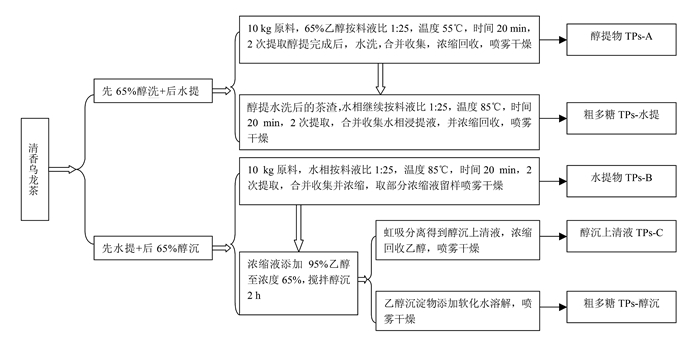
以自制清香乌龙茶为原料,单批次提取投料量10 kg,参照相关文献报道[10],分别使用2种工艺制备茶叶多糖及分离物(图 1)。工艺1:采用先65%醇洗+后水提的制备方式,分别制得65%乙醇洗取物“TPs-A”,以及醇洗茶渣的水提物粗多糖“TPs-水提”;工艺2:茶叶水提物经浓缩及喷雾干燥得“TPs-B”;水提物经65%乙醇沉淀处理,上清液经浓缩及喷雾干燥,制得“TPs-C”,醇沉物(粗多糖)经分离,制得“TPs-醇沉”。分别称取上述各样品0.100 g,溶于50 mL超纯水后进行茶多糖、蛋白质等项目的定量检测。
1.2.2 茶多糖含量的测定
采用蒽酮-硫酸法[11]测定粗茶多糖及其分离物水溶液中的茶多糖含量。
1.2.3 可溶性蛋白含量的检测[11]
准确移取配制的粗茶多糖及其附属产物水溶液4.0 μL,滴加于BioSpec-nano超微量分光光度(以Cy3标记蛋白)检测位置,设光程0.7 mm、波长280 nm检测可溶性蛋白含量。
1.2.4 茶多酚含量的检测
参照国标GB/T 8313-2008中的福林酚法检测配制的粗茶多糖及其分离物水溶液中的茶多酚含量。
1.2.5 儿茶素及咖啡因的测定
儿茶素及咖啡因的测定采用HPLC法[12],采用TSKgel ODS-100Z色谱柱,流动相为2‰甲酸水溶液(A相)和甲醇(B相),洗脱方式为83%A(0 min)→75%A(5 min)→73%A(7 min)→58%A(16 min)→83%A(18 min),柱温40℃,流速1.0 mL·min-1,检测波长280 nm。
1.2.6 总黄酮含量的检测
采用三氯化铝法[11],分别吸取0.1 mg·mL-1芦丁标准液(50%乙醇配制)0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL于25 mL容量瓶中,加50%乙醇至总体积10.0 mL,依次加入1.5%的AlCl3溶液8.0 mL和醋酸-醋酸钠的缓冲液(0.1 mol·L-1,pH5.5)4.0 mL,并用50%乙醇水溶液定容至25 mL,摇匀,静置30 min后,于415 nm比色测定吸光度值。以吸光度值为纵坐标,以显色液中的芦丁质量(mg)为横坐标,绘制标准曲线并计算线性回归方程。准确移取不同样品液1.0 mL于25 mL容量瓶中,其余步骤按照上述程序添加反应后,415 nm处比色测定。
1.2.7 还原力测定
采用普鲁士蓝法[13],具体步骤有所改进,方法如下:取不同质量浓度(4、8、12、16、20 μg·mL-1)试验样品2.0 mL于试管中,其余步骤参照文献[11]依次加入0.2 mol·L-1磷酸盐缓冲液、1%铁氰化钾溶液、10%的三氯乙酸溶液和0.1%氯化铁溶液,静置反应后于700 nm检测吸光度值的变化。
1.2.8 DPPH自由基清除率测定[14]
取不同质量浓度样品液0.5 mL于试管中,添加无水乙醇至3.0 mL,使其最终质量浓度为4、8、12、16、20 μg·mL-1,然后再加入0.1 mmol·L-1的DPPH溶液3.0 mL,总体积为6.0 mL,混匀静置反应30 min,于517 nm处比色测定吸光值。其中,对照为3.0 mL无水乙醇与3.0 mL的DPPH溶液静置反应后的吸光度数值。DPPH自由基清除率计算公式为:
DPPH自由基清除率/%=[(A对照−A样品)/A对照]×100% 式中:A对照为未加样品的DPPH自由基吸光度;A样品为加入样品反应后的DPPH自由基吸光度。
1.3 数据分析
采用Origin 7.5和SPSS 19.0软件进行数据分析。试验结果描述为“平均值±标准偏差”。不同小写字母表示差异显著水平(P<0.05)。
2. 结果与分析
2.1 茶多糖及其分离物组分分析
2种提取工艺粗茶叶多糖提取物的理化组成见表 1。结果表明,相较于先水提+后醇沉的提取方式,采用先醇洗+后水提制得的粗茶多糖TPs-水提中多糖含量显著提高,而先水提+后醇沉分离茶多糖,纯化富集效果并不明显。植物粗多糖中含有一定量的蛋白质,可影响改变多糖的结构和功效,故而脱除杂蛋白十分重要。采用2种提取方式制得的粗茶多糖TPs-水提和TPs-醇沉中,可溶性蛋白含量皆显著降低,尤以先醇洗+后水提效果更佳。综合来看,采用先醇洗+后水提制得粗茶多糖TPs-水提中多糖纯度高,且蛋白质杂质含量低,更易于粗多糖的后续纯化工作。
表 1 茶多糖及分离物的组分含量Table 1. Components of TPs and other constituents组分
/(μg·mL-1)先醇洗+后水提 先水提+后醇沉 TPs-水提 TPs-A TPs-醇沉 TPs-B TPs-C 茶多糖 329.55±1.92a 200.32±1.61b 252.95±4.18b 267.27±3.21b 275.45±4.50b 可溶性蛋白 65.58±1.43c 184.10±6.24a 154.17±1.79b 190.81±1.70a 202.00±1.61a 茶多酚 281.50±9.19b 546.15±1.36a 241.83±12.92b 554.81±4.08a 612.02±3.40a 总黄酮 38.82±0.71b 63.33±0.52a 34.65±0.35b 49.78±1.04b 50.51±0.52b 儿茶素总量 184.31±1.21c 383.32±5.74a 52.33±1.63d 280.43±3.76b 288.66±5.10b 表没食子儿茶素(ECG) 52.70±1.60c 118.40±9.72a 20.71±2.03d 78.26±1.25b 81.07±2.00b 儿茶素(C) 8.29±0.76c 2.90±0.42d 2.98±0.22d 10.04±0.37b 12.17±0.24a 表没食子儿茶素没食子酸酯(EGCG) 89.51±1.78c 199.96±3.59a 17.01±1.01d 141.18±2.28b 144.26±3.14b 表儿茶素(EC) 8.63±0.20c 17.42±0.19a 3.16±0.17d 13.82±0.94b 14.09±0.44b 表儿茶素没食子酸酯(ECG) 25.19±0.38c 44.64±0.65a 8.48±0.80d 37.13±0.50b 37.07±0.26b 咖啡碱 15.72±1.62d 89.25±1.82b 72.24±1.60c 98.20±2.92b 108.97±2.68a 注:儿茶素总量为EGC、C、EGCG、EC、ECG之和。 相较于TPs-A、TPs-B和TPs-C,粗茶多糖TPs-水提和TPs-醇沉中茶多酚/儿茶素类、总黄酮类、咖啡碱等物质含量显著降低。具体来看,粗茶多糖TPs-水提中可溶性蛋白和咖啡碱含量最低,而TPs-醇沉中茶多酚/儿茶素类和总黄酮类含量最低。茶多酚及咖啡碱以醇沉上清液TPs-C中含量最高,而儿茶素类及其单体和总黄酮类则是醇提茶叶TPs-A中含量最高,表明采用先65%醇洗+后水提的提取方式,有助于茶叶中小分子类物质如儿茶素类、总黄酮类、咖啡碱等物质的浸出富集。
2.2 抗氧化活性比较
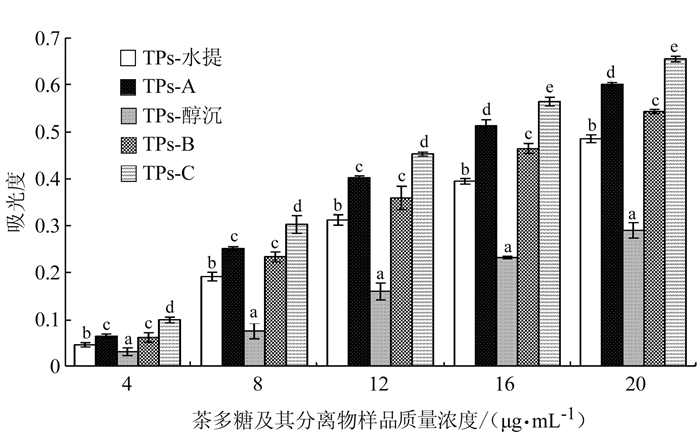
2.2.1 粗茶多糖及其分离物的还原力表达
抗氧化剂的还原力分析结果(图 2)表明,等同剂量下,茶叶多糖及其分离样品的还原力变化趋势为TPs-C>TPs-A>TPs-B>TPs-水提>TPs-醇沉,表明抗氧化性依次减弱。研究结果来看,不同提取方式制备的粗茶多糖抗氧化活性不尽相同,采用先醇洗+后水提制备的粗茶多糖TPs-水提抗氧化活性较强。与其相应的分离物TPs-A、TPs-B和TPs-C比较来看,粗茶多糖抗氧化活性较弱。
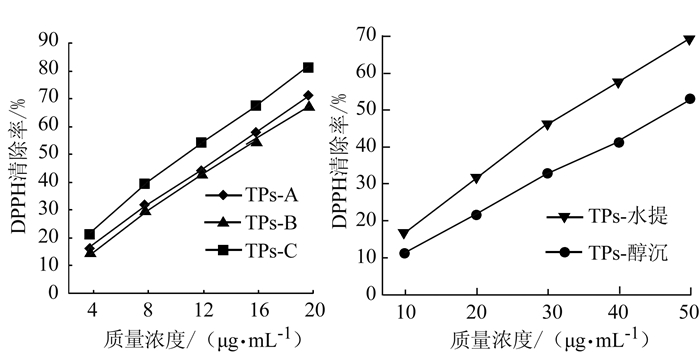
2.2.2 粗茶多糖及其分离物的DPPH清除活性变化
DPPH自由基稳定,结构简单,已广泛用于各种植提物质的抗氧化活性评价。预试验表明,2种提取工艺制备的粗茶多糖TPs-水提和TPs-醇沉的DPPH清除率显著低于其分离物TPs-A、TPs-B和TPs-C(数据未在文中体现),由此选取合适浓度来评价茶多糖及其分离物对DPPH的清除率变化,结果(图 3)可见,DPPH清除率变化趋势与茶多糖及其分离物的质量浓度呈剂量依赖效应,逐渐升高。不同质量浓度剂量处理时,可见线性良好的DPPH清除率变化曲线,其DPPH清除率IC50值分别为TPs-水提34.41 μg·mL-1、TPs-醇沉47.70 μg·mL-1、TPs-A 13.75 μg·mL-1、TPs-B 14.45 μg·mL-1和TPs-C 11.29 μg·mL-1。与还原力变化趋势类似,采用先65%醇洗+后水提制备的粗茶叶多糖TPs-水提DPPH清除活性高于水提醇沉法制备的粗多糖TPs-醇沉,然而两者的DPPH清除活性皆低于TPs-A、TPs-B和TPs-C。
2.3 相关性分析
粗茶多糖及其分离物的还原力变化和DPPH清除活性表达,与其含有的抗氧化组分密切相关。结果(表 2)表明,茶多糖、茶多酚、总黄酮类、咖啡碱等组分与其DPPH清除活性和还原力变化呈正向相关,尤以茶多酚/儿茶素呈显著性相关(P<0.05)。综合来看,2种粗茶多糖及其分离物的抗氧化活性表达的主要活性成分为茶多酚,而又以儿茶素类的酯型儿茶素作用活性强。而茶多糖、总黄酮类及咖啡碱具有一定的抗氧化作用,然而抗氧化活性弱于茶多酚。
表 2 抗氧化成分与DPPH清除活性及还原力变化的相关分析Table 2. Effects of antioxidants on DPPH scavenging capacity and reducing power项目 Pearson相关性 茶多糖 茶多酚 儿茶素类 EGC C EGCG EC ECG 咖啡因 总黄酮 DPPH清除率 0.599 0.991* 0.856* 0.813 0.520 0.857* 0.890* 0.878* 0.751 0.821 还原力 0.625 0.893* 0.900* 0.852 0.569 0.893* 0.914* 0.926* 0.447 0.858* 注:*表示显著相关。 3. 讨论与结论
乙醇可用于植物多糖的分级纯化,成本低廉,易于实现规模化生产[15-18]。研究表明,50%乙醇浸提茶叶各品质成分的浸出率较常规水提显著提高,尤其是茶多酚、氨基酸等小分子物质[19],这可能与乙醇水溶液的介电常数的高低变化相关。高浓度乙醇时,水溶液介电常数变低,蛋白质、鞣质、多糖、色素等大分子物质反而不易浸出。由此,乙醇可用于沉淀多糖、蛋白质等大分子物质。研究表明,不同用量乙醇对茶多糖及蛋白质具有不同的沉淀效应,80%乙醇为沉淀析出可溶性蛋白质的最佳浓度,而茶叶多糖在乙醇超过50%时即有较好的沉淀特性[20]。进一步通过单因素试验和正交试验研究发现,选取65%乙醇预处理茶叶时,茶多酚(尤其是其中的儿茶素类)、咖啡碱、总黄酮类等小分子物质和可溶性蛋白质的浸出量显著提高,而茶叶多糖仅低量浸出,因此茶叶物料经醇洗后再进行水提,茶叶多糖的纯度大大提高[10]。
本研究以清香乌龙茶为原料,通过中试规模生产分析比较“先65%醇洗+后水提”和“先水提+后65%醇沉”2种方式提取的茶叶粗多糖及其相应分离物质,并检测了其构成物质的含量变化情况。结果表明,相较于“水相提取”和“水提醇沉法”,采用“先65%醇洗+后水提”工艺制备的粗茶多糖(即TPs-水提)中茶多糖含量最高,可溶性蛋白含量最低。其他组分来看,醇洗茶叶物TPs-A中儿茶素类、总黄酮类等小分子物质含量最高,分析认为与其易于小分子物质浸出有关。醇沉分离多糖时,粗茶多糖TPs-醇沉中茶多酚/儿茶素类、总黄酮类、咖啡碱等物质含量较低,推测可能与乙醇浓度或添加顺序(本研究中乙醇添加于多糖浓缩液中)相关,具体机制有待进一步研究。
茶多糖尤以抗氧化和降血糖活性最为突出,能清除多种自由基[21-23]。然而针对其抗氧化活性的研究结论不一致,有研究分析比较了粗茶多糖和纯化茶多糖的抗氧化活性,发现纯茶多糖片段的DPPH自由基清除率极低,且基本无变化[24]。王黎明等[25]的研究也发现,茶多糖纯度越高对羟基自由基和氧自由基清除能力越弱。本研究结果表明,粗茶多糖TPs-水提和TPs-醇沉的还原力和DPPH清除活性皆显著弱于分离产物,TPs-醇沉活性最弱。茶叶富含有多种可清除自由基活性的物质[26-27]。相关性分析表明,各抗氧化组分与粗茶多糖及其分离产物抗氧化活性表达之间Pearson系数呈正相关,茶多酚/儿茶素类呈显著正相关。进一步研究发现,酯型儿茶素EGCG和ECG与其抗氧化活性表达之间呈显著相关,揭示粗茶多糖及其分离产物中抗氧化活性表达主要影响因素为茶多酚,尤其是儿茶素类中酯型儿茶素活性,而茶多糖、总黄酮类、咖啡碱等物质的抗氧化活性弱于茶多酚。这一定程度上印证了Wang Y L[24]、王黎明等[25]的研究结论。
综上所述,采用先65%醇洗+后水提的浸提方式,可实现茶叶多糖的富集,且可溶性蛋白含量低,该工艺制得的粗茶多糖可视为醇洗茶叶产物的副产品,由此可实现茶叶的综合提取分离,使得粗茶多糖的工业化生产简单可行,成本低廉。同时,茶叶多糖具有一定的抗氧化活性,然而活性弱于茶叶多酚类。粗茶叶多糖的抗氧化活性表达的主要活性成分为茶多酚,尤其是儿茶素类中的酯型儿茶素,而茶多糖的抗氧化活性则弱于茶多酚。
-
表 1 茶多糖及分离物的组分含量
Table 1 Components of TPs and other constituents
组分
/(μg·mL-1)先醇洗+后水提 先水提+后醇沉 TPs-水提 TPs-A TPs-醇沉 TPs-B TPs-C 茶多糖 329.55±1.92a 200.32±1.61b 252.95±4.18b 267.27±3.21b 275.45±4.50b 可溶性蛋白 65.58±1.43c 184.10±6.24a 154.17±1.79b 190.81±1.70a 202.00±1.61a 茶多酚 281.50±9.19b 546.15±1.36a 241.83±12.92b 554.81±4.08a 612.02±3.40a 总黄酮 38.82±0.71b 63.33±0.52a 34.65±0.35b 49.78±1.04b 50.51±0.52b 儿茶素总量 184.31±1.21c 383.32±5.74a 52.33±1.63d 280.43±3.76b 288.66±5.10b 表没食子儿茶素(ECG) 52.70±1.60c 118.40±9.72a 20.71±2.03d 78.26±1.25b 81.07±2.00b 儿茶素(C) 8.29±0.76c 2.90±0.42d 2.98±0.22d 10.04±0.37b 12.17±0.24a 表没食子儿茶素没食子酸酯(EGCG) 89.51±1.78c 199.96±3.59a 17.01±1.01d 141.18±2.28b 144.26±3.14b 表儿茶素(EC) 8.63±0.20c 17.42±0.19a 3.16±0.17d 13.82±0.94b 14.09±0.44b 表儿茶素没食子酸酯(ECG) 25.19±0.38c 44.64±0.65a 8.48±0.80d 37.13±0.50b 37.07±0.26b 咖啡碱 15.72±1.62d 89.25±1.82b 72.24±1.60c 98.20±2.92b 108.97±2.68a 注:儿茶素总量为EGC、C、EGCG、EC、ECG之和。 表 2 抗氧化成分与DPPH清除活性及还原力变化的相关分析
Table 2 Effects of antioxidants on DPPH scavenging capacity and reducing power
项目 Pearson相关性 茶多糖 茶多酚 儿茶素类 EGC C EGCG EC ECG 咖啡因 总黄酮 DPPH清除率 0.599 0.991* 0.856* 0.813 0.520 0.857* 0.890* 0.878* 0.751 0.821 还原力 0.625 0.893* 0.900* 0.852 0.569 0.893* 0.914* 0.926* 0.447 0.858* 注:*表示显著相关。 -
[1] CAO H. Polysaccharides from Chinese tea:recent advance on bioactivity and function[J]. International Journal of Biological Macromolecules, 2013, 62:76-79. DOI: 10.1016/j.ijbiomac.2013.08.033
[2] 杨军国, 陈泉宾, 王秀萍, 等.茶多糖组成结构及其降血糖作用研究进展[J].福建农业学报, 2014, 29(12):1260-1264. DOI: 10.3969/j.issn.1008-0384.2014.12.021 [3] CHEN G J, YUAN Q X, SAEEDUDDIN M, et al. Recent advances in tea polysacchzrides:Extraction, purification, physicochemical characterization and bioactivities[J]. Carbohydrate Polymers, 2016, 153:663-678. DOI: 10.1016/j.carbpol.2016.08.022
[4] 王忠雷, 杨丽燕, 曾详伟, 等.新技术在中药多糖提取工艺中的单独及协同应用[J].世界科学技术:中医药现代化, 2013, 15(6):1441-1446. http://www.cnki.com.cn/Article/CJFDTOTAL-SJKX201306037.htm [5] 任小盈, 李静, 马存强, 等.茶多糖的提取与分离纯化技术研究新进展[J].安徽农业科学, 2014, 42(23):7993-7995, 7999. DOI: 10.3969/j.issn.0517-6611.2014.23.105 [6] 石奇.植物多糖的新型提取分离技术应用进展[J].西安文理学院学报:自然科学版, 2015, 18(3):50-54. http://youxian.cnki.com.cn/yxdetail.aspx?filename=ZGZY20170927003&dbname=CAPJ2015 [7] 王淑萍, 李晓静, 张桂珍.黄芪多糖提取分离纯化工艺的优化研究[J].分子科学学报(中、英文), 2008, 24(1):60-64. http://www.cnki.com.cn/Article/CJFDTOTAL-FZKB200801014.htm [8] 李卷梅, 聂少平, 李景恩, 等.香薷多糖的乙醇分级纯化及其性质[J].食品科学, 2010, 31(9):182-185. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201019040.htm [9] 陆广富, 陈晓兰, 黄亚奇, 等.桑叶粗多糖最佳提取工艺研究[J].中国畜牧兽医, 2016, 43(7):1922-1927. http://www.cnki.com.cn/Article/CJFDTOTAL-GWXK201607040.htm [10] 杨军国, 王丽丽, 陈键, 等.乙醇在茶叶多糖提取中的应用研究[J].茶叶学报, 2016, 57(4):192-196. http://www.cnki.com.cn/Article/CJFDTOTAL-CYKJ201604008.htm [11] 杨军国, 陈键, 王丽丽, 等.乙醇法沉淀茶多糖的抗氧化活性评价[J].福建农业学报, 2016, 31(2):199-204. http://www.fjnyxb.cn/CN/abstract/abstract2877.shtml [12] 王丽丽, 陈键, 宋振硕, 等.茶叶中没食子酸、儿茶素类和生物碱的HPLC检测方法研究[J].福建农业学报, 2014, 29(10):987-994. DOI: 10.3969/j.issn.1008-0384.2014.10.011 [13] BERKER K I, GVLVK, TOR I, et al. Total antioxidant capacity assay using optimized ferricyanide/Prussian blue method[J]. Food Analytical Methods, 2010, 3(3):154-168. DOI: 10.1007/s12161-009-9117-9
[14] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9):317-322. DOI: 10.7506/spkx1002-6630-201409062 [15] 李卷梅, 聂少平, 李景恩, 等.香薷多糖的乙醇分级纯化及其性质[J].食品科学, 2010, 31(19):182-185. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201019040.htm [16] 张宁, 武永福.黄花菜粗多糖梯度乙醇提取工艺及其抗氧化活性研究[J].中国食物与营养, 2014, 20(11):60-62. DOI: 10.3969/j.issn.1006-9577.2014.11.015 [17] 邹胜, 徐溢, 张庆.天然植物多糖分离纯化技术研究现状和进展[J].天然产物研究与开发, 2015, 27(8):1501-1509. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW201508032.htm [18] 李红法, 郭松波, 满淑丽, 等.乙醇分级沉淀提取黄芪多糖及其理化性质和抗氧化活性研究[J].中国中药杂志, 2015, 40(11):2112-2116. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201511009.htm [19] 萧力争, 胡祥文, 蔡金娥, 等.绿茶乙醇浸提技术研究[J].天然产物研究与开发, 2006, 18(4):634-636. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW200604025.htm [20] 杨军国, 陈键, 王丽丽, 等.醇沉分级粗茶多糖的抗氧化活性比较及变化机制[J].食品工业科技, 2016, 37(17):96-100, 105. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ201617018.htm [21] CHEN H X, WANG Z S, QU Z S, et al. Physicochemical characterization and antioxidant activity of a polysaccharide isolated from oolong tea[J]. European Food Research and Technology, 2009, 229(4):629-635. DOI: 10.1007/s00217-009-1088-y
[22] 于淑池, 侯金鑫.龙井茶多糖对自由基和NO2--清除作用研究[J].食品研究与开发, 2012, 33(4):28-31. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=spyk201204011&dbname=CJFD&dbcode=CJFQ [23] 何念武, 李丹.商洛绿茶多糖的分离纯化及体外抗氧化和抗肿瘤活性研究[J].食品发酵与工业, 2015, 41(8):79-83. http://www.cnki.com.cn/Article/CJFDTOTAL-SPFX201508015.htm [24] WANG Y L, ZHAO Y, MAROBELA K A, et al. Tea polysaccharides as food antioxidants:an old women's tale?[J]. Food Chemistry, 2013, 138(2-3):1923-1927. DOI: 10.1016/j.foodchem.2012.09.145
[25] 王黎明, 夏文水.茶多糖降血糖机制的体外研究[J].食品与生物技术学报, 2010, (3):354-358. http://www.cnki.com.cn/Article/CJFDTOTAL-WXQG201003009.htm [26] 李娟, 活泼, 杨海燕.茶叶功效成分研究进展[J].浙江科技学院学报, 2005, 17(4):285-289. http://youxian.cnki.com.cn/yxdetail.aspx?filename=ASSF20170713001&dbname=CAPJ2015 [27] 申雯, 黄建安, 李勤, 等.茶叶主要活性成分的保健功能与作用机制研究进展[J].茶叶通讯, 2016, 43(1):8-13. http://www.cnki.com.cn/Article/CJFDTOTAL-CYTX201601004.htm -
期刊类型引用(8)
1. 姜业硕,曹孟飞,班秋艳,王文利,梁丽云. 茶叶抗氧化CNKI文献计量及研究热点分析. 茶叶. 2022(02): 69-74 .  百度学术
百度学术
2. 练珊珊,陈佳,吕立堂. 15个茶树品种多糖、纤维素、木质素含量的分析. 广东茶业. 2021(01): 15-20 .  百度学术
百度学术
3. 王丽,官小倩,余能煌,林芷青. 不同焙火程度对武夷肉桂品质与抗氧化活性的影响. 茶叶通讯. 2020(02): 282-286 .  百度学术
百度学术
4. 许陆达,黄苏萍,杨柳媛. 茶多糖的组成及其对糖代谢的作用机制探讨. 广东茶业. 2020(06): 25-31 .  百度学术
百度学术
5. 宋振硕,杨军国,张磊,林清霞. 烘焙类茶食品的研究进展. 食品工业科技. 2019(01): 321-325 .  百度学术
百度学术
6. 杨军国,宋振硕,陈键,王丽丽,林清霞,陈林. 粗茶多糖的膜-纤维素柱色谱分离过程的抗氧化活性研究. 茶叶学报. 2018(02): 71-76 .  百度学术
百度学术
7. 杨军国. 功能型速溶茶及其加工工艺探讨. 福建茶叶. 2018(08): 6-8 .  百度学术
百度学术
8. 袁勇,尹钟,谭月萍,周重旺. 茶多糖的提取分离及生物活性研究进展. 茶叶通讯. 2018(03): 8-12 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: