Functions of CpG-ODN 2006 on Resistance of Zebra Fish against Vibrio vulnificus
-
摘要: 为创建环境友好的免疫预防技术,分析CpG-ODN对斑马鱼抗创伤弧菌感染的作用,采用PBS(对照)和人工合成的CpG-ODN 2006(试验组)序列分别注射斑马鱼,48 h后创伤弧菌FJ03-X2进行攻毒,收集斑马鱼的肠道和肾脏组织提取RNA,逆转录成cDNA,通过Real-time RT-PCR检测相关基因的表达。结果表明,24 h后CpG-ODN 2006组的免疫保护率高达70.0%;相关免疫基因表达检测结果发现CpG-ODN 2006组肠道中lysozyme、Myd88、tlrs和tnf的mRNA水平显著下调,而il1b和il10则显著上调;肾脏中的基因表达差异更为明显:lysozyme显著上调,il1b、myd88、tnf、ifng1-2、il10、il22均显著下调。结果表明CpG-ODN 2006通过调节斑马鱼肾脏及肠道中非特异性免疫相关基因的表达,维持免疫系统的平衡,增强抗创伤弧菌FJ03-X2感染的能力。Abstract: Groups of zebra fish were injected with either PBS as controlor synthetic CpG-ODN 2006 for treatment, and 48 hours later, challenged by Vibrio vulnificus FJ03-X2 infection in this study. The immune protection of the treatment group reached a rate of 70.0% in 24 hours.RNA was extracted from the intestinal and kidney tissues and then reverse transcribed into cDNA. The mRNAs of lysozyme, Myd88, tlrs and tnf in the guts of the treated fish were significantly downregulated, while those of il1b and il10, significantly upregulated, as detected by Real-time RT-PCR.The differences on gene expression in kidney were even more apparent as the expression of lysozyme significantly upregulated, and those of il1b, myd88, tnf, ifng1-2, il10 and il22 significantly downregulated. It appeared that the CpG-ODN 2006 injection afforded the zebra fish to vitalize its immune system through regulating the expressions of non-specific immunity-related genes in the kidney and intestinesto ward off the viral attack.
-
Keywords:
- zebra fish /
- CpG-ODNs /
- Vibrio vulnificus /
- non-specific immunity
-
近年来,由于养殖环境、养殖方式、品种种质等多种因素,水产养殖病害较为严重,尤其是细菌性疾病,发病率高、用药频繁,不但造成了严重的经济损失,同时也产生了养殖产品质量安全、细菌抗药性等诸多问题,严重制约了水产养殖业的健康发展。寻求环境友好的免疫预防技术已成为水产养殖业病害防治的研究重点[1]。研究证实,人工合成的CpG-ODN(CpG containing oligodeoxynucleotid,含有未甲基化CpG基序的寡聚脱氧核苷酸片段)可模拟细菌DNA[2],对人和动物起到强烈的免疫刺激作用[3-4]。它能促进B细胞分化,提高其对抗原刺激的敏感性,并分泌IL-10等相关细胞因子,刺激IgM的合成[5];能上调B细胞表面主要组织相容性抗原和协同刺激分子的表达,促进抗原提呈作用;能直接激活单核细胞、巨噬细胞和树突状细胞,分泌多种Th1型细胞因子,增强机体的免疫应答[6];还能增强NK细胞的杀伤能力,刺激其分泌IFN-γ[7]。CpG-ODN具有高效低毒、性质稳定、易于合成等优点,作为一种新型免疫增强剂引起广泛关注。
CpG-ODN在人类和高等脊椎动物中的研究已较为成熟,在水产动物中的免疫增强作用已逐渐被证实,使其成为水产疾病防治研究的重要内容。但目前鱼类CpG-ODN的具体作用机制仍不清楚。
创伤弧菌Vibrio vulnificus是一种嗜盐性革兰氏阴性病原菌[8],广泛分布在海水、浮游生物、海底沉积物及水产品中[9]。它能引起原发性败血症和软组织感染,曾导致日本和欧美等国鳗鲡产业的巨大经济损失[10]。创伤弧菌是人兽共患病的重要致病菌,能导致人与鳗鲡产生败血症和严重伤口感染。近年来,创伤弧菌开始在福建沿海水产养殖中流行,给养殖业造成巨大的经济损失。
斑马鱼Danio rerio是国际认可的试验用鱼。它具有个体小、易养殖、发育快、繁殖能力强、遗传背景清楚等诸多特点,成为功能基因组时代生命科学研究中的重要模式动物之一[11]。本课题组于2003年在福建省长乐某欧鳗养殖场分离到1株鳗源创伤弧菌FJ03-X2菌株,该菌株具有毒力强、免疫原性好、广适性优等特点[12]。本试验利用该菌株建立斑马鱼创伤弧菌感染模型,选用CpG-ODN 2006作为免疫增强剂,确定安全的免疫剂量、免疫时间及免疫方式,采用Real-time RT-PCR等技术检测免疫后相关基因的表达,分析CpG-ODNs对斑马鱼免疫反应的影响,为重要经济鱼类的疫苗开发及病害预防奠定基础。
1. 材料与方法
1.1 试验动物
野生型AB系斑马鱼购自国家斑马鱼资源中心,平均体重约为0.2 g。饲养于15cm×25 cm×40 cm的自动循环控温养殖缸中,注水至箱深的3/4处,每个水族箱放养斑马鱼20尾,控制水温(28±1)℃。循环水源为过滤自来水暴气24 h,盐度0.05%。斑马鱼每天喂2次市售颗粒饲料(德国喜瑞孔雀鱼特级颗粒饲料),投饵量为体重的1%,试验前1 d禁食。
1.2 菌株
创伤弧菌FJ03-X2由福建省农业科学院生物技术研究所鱼病研究室分离自欧洲鳗鲡,保存于-80℃。
1.3 主要试剂
CpG-ODN 2006粉剂(序列5′-TCG TCG TTT TGT CGT TTT GTC GTT -3′)由大连宝生物工程有限公司(TaKaRa)合成;培养基TSA、TSB均购自广东环凯微生物科技有限公司;0.1%DEPC处理水;氯仿;异丙醇;无水乙醇;Trizol试剂(Invitrogen,Cat. No. 15596026);试剂盒PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)和SYBR Premix Ex Taq Ⅱ(RR820A)均购自大连宝生物工程有限公司(TaKaRa);Real-time RT-PCR引物由上海生工生物工程有限公司合成(表 1)。
表 1 PCR引物序列Table 1. PCR primer sequence目的基因 正向引物序列(5′-3′) 反向引物序列(5′-3′) actb1 CACTTCACGCCGACTCAAAC TCGGGGATGCTTATTTGCCA tlr9 CTGGGGACTTTAGAGAGCCG TCTCATTTCCAGGCCATGTT tnfa2 GCCAACCCATTTCAGCGATTG GGCATGTGATGAAGCCAAACGAA tlr21 TTGCAGGACGTTAGCTTGGT ATTGCCCCAGTATCACACGG ifng1-2 GCCGTCTCTTGCGTTCTTTA AGCGAAAGGCTTTGTTTGAG tlr1 GTGGCAGAGGCTCCAGAAGA CAGAGCGAATGGTGCCACTAT tlr3 TGATGCCCATGCCTGTAAGA TGGAGCATCACAGGGATAAAGA lysozyme CCGTAGTCCTTCCCCGTATCA GATTTGAGGGATTCTCCATTGG il10 CCTCTTGCATTTCACCATATCC TCACGTCATGAACGAGATCC il22 CACGAGCACAGCAAAGCAAT CATCGAGGAACAACGGTGTACA il26 TTTCCCCAATATCCGATGGA TGGACTTCGCAGCACAAAATG il1b CACTTCACGCTCTTGGATGA TGGACTTCGCAGCACAAAATG tlr4a TCCACAAGAACAAGCCTTTG TGTCAAGATGCCACATCAGA myd88 TCGTCATCTAAAATTTCTTTGAGC TCCGAAAGAAACTGGGTCTG 1.4 创伤弧菌感染对斑马鱼的半致死计量
创伤弧菌FJ03-X2的培养、复苏及活化参考文献[13]进行。将得到的菌液用生理盐水调至适当的OD595nm值,取一部分进行倍比稀释后以10-6~10-4浓度梯度进行涂板计数;余下的菌液分别稀释400倍、700倍、1 000倍,分组进行攻毒试验,每天观察记录死亡情况,拣除死鱼,试验持续7 d。
活菌数(cfu/mL)=菌落个数/涂布所用菌液体积×梯度稀释的倍数,再计算各浓度下斑马鱼的死亡率,即可获得创伤弧菌对斑马鱼半致死计量。
1.5 CpG-ODN的免疫保护试验
免疫斑马鱼:将健康斑马鱼随机分成2组,每组3次重复,每组约23尾。MS-222麻醉鱼体后,分别以PBS(对照组)和CpG-ODN 2006(1 μg·尾-1,试验组)腹腔注射。免疫48 h后,以上述半致死量创伤弧菌进行攻毒。腹腔注射及创伤弧菌攻毒过程中1 h之内出现死亡或者明显出现游动困难的鱼,排除在外,不记入后续试验。每天观察记录死亡情况,试验持续7 d,统计保护率。
保护率/%=[(对照组死亡率-试验组死亡率)/对照组死亡率]×100%
提取RNA:按Trizol法进行总RNA的提取。于攻毒24 h后,每组随机选取5尾解剖取肠道和肾脏组织,提取RNA。利用NanoDrop Spectrophotometer ND-1000对获得的RNA进行浓度测定。
逆转录cDNA:利用PrimeScript RT reagent Kit with gDNA Eraser试剂盒将总RNA逆转录为cDNA,严格按照说明书进行操作,整个过程均在冰上进行。获得的cDNA冻存于-80℃。
1.6 SYBR Green Real-time RT-PCR
采用SYBR GreenⅠ染料法,按说明书配制反应体系,并对内参基因β-actin及其他引物的荧光定量PCR条件进行优化。PCR反应条件为:95℃预变性30 s;95℃变性5 s、60℃34 s,该步设置荧光,40个循环,最后一个循环结束后,进行熔解曲线反应60~95℃,以检测PCR扩增特异性;95℃ 15 s,60℃ 60 s,95℃ 15 s。每个样品3次重复。根据各个样品PCR反应的Ct值进行相对定量。每份样品目的基因的表达强度用其对应的内参基因β-actin的量进行矫正,即△Ct为目的基因相对于内参基因的表达强度,△Ct=Ct(目的基因)-Ct(β-actin基因)。目的基因在试验组中相对于对照组的表达差异倍数用2-△△Ct计算表示,而-△△Ct=-(△Ct试验组-△Ct对照组)。
1.7 数据分析
应用Excel 2010和SPSS 16.0软件对数据进行统计分析。
2. 结果与分析
2.1 创伤弧菌对斑马鱼的半致死量
创伤弧菌攻毒12 h后,部分斑马鱼开始出现典型的败血症症状:腹水,腮、腹部、尾鳍出血等,随后陆续死亡(图 1)。24 h后分别记录各组斑马鱼死亡率,结果显示,菌液稀释400倍、700倍、1 000倍后攻毒的死亡率分别为75%、50%和20%(试验观察到攻毒后1~7 d斑马鱼都未再出现死亡,免疫及攻毒试验情况相同)。结合TSA平板上的菌落数,计算出攻毒所用的菌液浓度,测得创伤弧菌FJ03-X2对斑马鱼的半致死量约为3.68×104cfu·g-1。
2.2 CpG-ODN的免疫保护试验
对照组(PBS组)的死亡率为53.7%,接近半致死量。试验组(CpG-ODN 2006组)的平均死亡率为16.1%,保护率高达70.0%(表 2)。说明CpG-ODN 2006具有保护效力,能够有效提高斑马鱼的抗创伤弧菌能力。
表 2 CpG-ODN 2006免疫保护试验Table 2. CpG-ODN 2006 immunity protection test组别 攻毒尾数 死亡尾数 24 h死亡率/% 免疫保护率(RPS)/% 对照组(PBS组) 67 36 53.7 0 试验组(CpG-ODN 2006组) 62 10 16.1 70.0 2.3 相关免疫因子在斑马鱼肠道中的表达
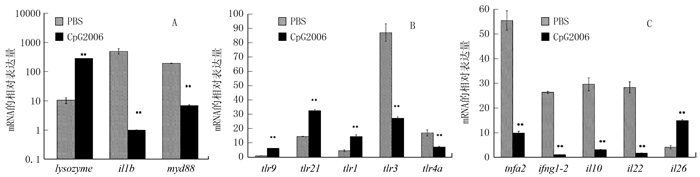
PBS组和CpG-ODN 2006组斑马鱼肠道中lysozyme、il1b和myd88的mRNA水平如图 2-A所示。CpG-ODN 2006组肠道中il1b显著上调,约为PBS组的7.69倍,而lysozyme和myd88显著下调。
![]() 图 2 Real-time RT-PCR检测创伤弧菌感染后斑马鱼肠道中的mRNA表达水平注:A为lysozyme、il1b和myd88的mRNA水平,B为tlr9、tlr21、tlr1、tlr3和tlr4a的mRNA水平,C为tnfa2、ifng1-2、il10、il22和il26的mRNA水平。**表示与对照组相比试验组存在极显著性差异P < 0.01。图 3同。Figure 2. RT-PCR detection of mRNA in intestinal tract of V. vulnificus-infected zebra fish
图 2 Real-time RT-PCR检测创伤弧菌感染后斑马鱼肠道中的mRNA表达水平注:A为lysozyme、il1b和myd88的mRNA水平,B为tlr9、tlr21、tlr1、tlr3和tlr4a的mRNA水平,C为tnfa2、ifng1-2、il10、il22和il26的mRNA水平。**表示与对照组相比试验组存在极显著性差异P < 0.01。图 3同。Figure 2. RT-PCR detection of mRNA in intestinal tract of V. vulnificus-infected zebra fish两组斑马鱼肠道中tlr9、tlr21、tlr1、tlr3和tlr4a的mRNA水平如图 2-B。发现经CpG-ODN 2006免疫后,斑马鱼肠道中的5种tlr基因的mRNA水平均出现下调。其中tlr1、tlr21、tlr3、tlr4a尤为明显,与对照相比,分别下调了79.6%、83.1%、74.1%、55.6%。
两组斑马鱼肠道中tnfa2、ifng1-2、il10、il22和il26的mRNA水平如图 2-C。结果显示,CpG-ODN 2006组的il10和il26表达量出现上调,而tnfa2、ifng1-2以及il22均下调,其中tnfa2最为显著,表达量仅为PBS组的1/4。
2.4 相关免疫因子在斑马鱼肾脏中的表达
在斑马鱼肾脏中,PBS组和CpG-ODN 2006组lysozyme、il1b和myd88的mRNA水平如图 3-A所示。发现3个基因在肾脏中的表达量差异极为显著,试验组的lysozyme较对照组上调了275倍,而il1b和myd88分别下调了99.8%和96.4%。
图 3-B为两组斑马鱼肾脏中tlr9、tlr21、tlr1、tlr3和tlr4a的mRNA水平。结果显示,CpG-ODN 2006组的tlr9、tlr21和tlr1均出现上调,而tlr3和tlr4a则出现下调。
斑马鱼肾脏中tnfa2、ifng1-2、il10、il22和il26的mRNA水平如图 3-C所示。经CpG-ODN 2006免疫后,斑马鱼肾脏中的5种基因除il26外,均显著下调。
3. 讨论与结论
CpG-ODN 2006在哺乳动物中的研究较为深入,但是在鱼类中研究较少,以之作为斑马鱼免疫增强剂还未见报道。本试验采用PBS和CpG-ODN 2006分别腹腔注射斑马鱼,24 h后以创伤弧菌强毒株FJ03-X2进行攻毒,研究CpG-ODN 2006对斑马鱼抵抗创伤弧菌感染能力的影响。结果显示注射CpG-ODN 2006对斑马鱼创伤弧菌感染的保护率达70.0%,说明CpG-ODN 2006作为免疫增强剂,对斑马鱼起到了一定的免疫保护作用。
肠道是鱼类病原菌的首要入侵部位之一,也是重要的免疫器官,是鱼类抵抗外来病原菌的第一道屏障,对机体的非特异性免疫调节具有重要作用[14]。肾脏是鱼类最重要的免疫器官,有研究表明创伤弧菌对鱼类肾脏组织有很强的侵染性,它能产生溶细胞毒素,破坏正常的肾脏细胞结构,使其迅速裂解死亡,对肾功能造成严重损害,从而引起代谢功能障碍[15]。本研究选取攻毒后存活下来的斑马鱼肠道和肾脏作为主要研究对象,通过荧光定量PCR技术,检测组织中免疫相关基因lysozyme、il1b、il10、myd88、tnfa2、ifng1-2和trls等的表达情况。
溶菌酶(Lysozyme)是鱼类防护病原体入侵的重要免疫因子,其活性是衡量机体非特异性免疫状态的重要指标之一,常被用来评价免疫增强剂的作用[16]。本试验中Lysozyme在CpG-ODN 2006组的肾脏中高表达,说明CpG-ODN 2006是一种优良的免疫增强剂,但CpG-ODN提高斑马鱼中Lysozyme表达的机理仍有待后续深入研究。IL1B作为一种多效促炎细胞因子,在局部低浓度时能够调节鱼类免疫反应,协同刺激T细胞活化,促进B细胞增殖和分泌抗体参与免疫调节反应,在炎症过程中起重要作用[17]。本研究中CpG-ODN 2006组肠道IL1B的表达水平较对照组极显著升高(P < 0.01),说明CpG-ODN 2006可在病原菌感染时迅速调节肠道中的IL1B,增强鱼体抗菌能力。然而IL1B作为一种促炎介质,其长时间的高表达导致炎症的发生,造成组织损伤。试验观察到CpG-ODN 2006组肾脏中,IL1B的表达水平极显著低于对照组(P < 0.01),推测在创伤弧菌急性感染期,肾脏中的IL1B可能过量表达,而CpG-ODN 2006能够通过适量调节IL1B的表达量,避免对机体的损伤。
肿瘤坏死因子(TNF)是一种重要的炎症因子,具有抗感染的作用,但高浓度的TNF将直接损伤血管内皮细胞,促进免疫炎症瀑布样连锁反应发生,刺激其他细胞因子如IL-6、血小板活化因子的产生,引起多器官功能损害,最终导致败血性休克死亡[17]。试验中CpG-ODN 2006组肠道和肾脏的TNF表达量均比对照组低(P < 0.01),提示CpG-ODN 2006可能调节TNF的过量表达,从而对机体起到保护作用。
Toll样受体家族是一类介导非特异性免疫的模式识别受体家族,可识别微生物的特异性成分,并通过接头蛋白髓样分化因子(MYD88)将信号传递给NF-κB或MAPK,从而产生TNF-α和IFN-γ等细胞因子参与免疫调节[18-19]。斑马鱼的TLR分子相对于哺乳动物要丰富得多,其中TLR1、2、4是细胞表面亚家族的成员,可识别微生物的脂类、糖类、蛋白质类成分;TLR3、9是核酸敏感的亚家族成员,TLR3不仅能够识别病毒,也能对细菌的PAMPs发生应答。斑马鱼的TLR21受体家族是鱼类特有的TLRs成员,与TLR9有相同的表达谱,共同介导对CpG-ODN的抗菌活性,但二者识别的CpG基序不同[20-21]。本试验结果显示,免疫CpG-ODN 2006后,斑马鱼肠道组织中的TLRs的mRNA表达量显著下调(P < 0.01),相较而言TLRs在肾脏中的表达差异并不明显。CpG-ODN 2006组肾脏MYD88的表达量同IL-1β、TNF一致,均出现显著下调。此外,荧光定量PCR分析发现,不同的基因在斑马鱼肠道和肾脏中的表达有差异,说明病原菌的入侵启动了机体非特异性免疫反应,而不同组织对免疫反应的调节作用不尽相同。
综上所述,本试验通过研究CpG-ODN 2006作为免疫增强剂对斑马鱼免疫反应的影响,分析不同组织中免疫相关基因的表达变化。结果显示CpG-ODN 2006使斑马鱼肠道中lysozyme、Myd88、tlrs和tnf的mRNA水平显著下调,而il1b和il10则显著上调;肾脏中lysozyme显著上调,il1b、myd88、tnf、ifng1-2、il10、il22则均显著下调。表明CpG-ODN 2006作为一种有效的佐剂,可以通过调节斑马鱼的免疫系统,提高其对抗创伤弧菌感染的能力。该研究为进一步了解鱼类非特异性免疫系统提供思路,还可为研发创伤弧菌疫苗提供数据,也为CpG-ODN在水产养殖中的开发应用提供参考。
-
图 2 Real-time RT-PCR检测创伤弧菌感染后斑马鱼肠道中的mRNA表达水平
注:A为lysozyme、il1b和myd88的mRNA水平,B为tlr9、tlr21、tlr1、tlr3和tlr4a的mRNA水平,C为tnfa2、ifng1-2、il10、il22和il26的mRNA水平。**表示与对照组相比试验组存在极显著性差异P < 0.01。图 3同。
Figure 2. RT-PCR detection of mRNA in intestinal tract of V. vulnificus-infected zebra fish
表 1 PCR引物序列
Table 1 PCR primer sequence
目的基因 正向引物序列(5′-3′) 反向引物序列(5′-3′) actb1 CACTTCACGCCGACTCAAAC TCGGGGATGCTTATTTGCCA tlr9 CTGGGGACTTTAGAGAGCCG TCTCATTTCCAGGCCATGTT tnfa2 GCCAACCCATTTCAGCGATTG GGCATGTGATGAAGCCAAACGAA tlr21 TTGCAGGACGTTAGCTTGGT ATTGCCCCAGTATCACACGG ifng1-2 GCCGTCTCTTGCGTTCTTTA AGCGAAAGGCTTTGTTTGAG tlr1 GTGGCAGAGGCTCCAGAAGA CAGAGCGAATGGTGCCACTAT tlr3 TGATGCCCATGCCTGTAAGA TGGAGCATCACAGGGATAAAGA lysozyme CCGTAGTCCTTCCCCGTATCA GATTTGAGGGATTCTCCATTGG il10 CCTCTTGCATTTCACCATATCC TCACGTCATGAACGAGATCC il22 CACGAGCACAGCAAAGCAAT CATCGAGGAACAACGGTGTACA il26 TTTCCCCAATATCCGATGGA TGGACTTCGCAGCACAAAATG il1b CACTTCACGCTCTTGGATGA TGGACTTCGCAGCACAAAATG tlr4a TCCACAAGAACAAGCCTTTG TGTCAAGATGCCACATCAGA myd88 TCGTCATCTAAAATTTCTTTGAGC TCCGAAAGAAACTGGGTCTG 表 2 CpG-ODN 2006免疫保护试验
Table 2 CpG-ODN 2006 immunity protection test
组别 攻毒尾数 死亡尾数 24 h死亡率/% 免疫保护率(RPS)/% 对照组(PBS组) 67 36 53.7 0 试验组(CpG-ODN 2006组) 62 10 16.1 70.0 -
[1] 廉超, 雒敏义, 宫瑞.浅析我国渔药研发、管理现状及未来发展趋势[J].水产学杂志, 2012, 25(1):30-33. http://edu.wanfangdata.com.cn/Periodical/Detail/qgsj201433257 [2] 陈俊鹏, 林树育, 吴群彬, 等.分子佐剂CpG DNA的研究进展及应用概况[J].现代农业科技, 2012, (24):269-270. DOI: 10.3969/j.issn.1007-5739.2012.24.177 [3] 李娜, 孙志伟, 俞炜源. CpG免疫刺激DNA序列及其在疫苗佐剂中的应用[J].生物技术通讯, 2008, (4):572-575. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=swjstx200804027 [4] 廖文勇, 盛长忠, 金永杰, 等. CpG寡核苷酸链作为新型佐剂的研究进展[J].中国医药生物技术, 2007, 2(4):299-301. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgyyswjs200704013 [5] 赵俊杰, 付承英.CpG-ODN生物学活性和免疫作用的研究进展[J].现代免疫学, 2011, 31(2):168-171. http://mall.cnki.net/magazine/Article/SHMY201102018.htm [6] BROWN G D.Dectin-1:a signalling non-TLR pattern-recognition receptor[J].Nat Rev, 2006, 6(1):33-43. http://www.nature.com/articles/doi:10.1038%2Fnri1745
[7] 曹丽萍, 丁炜东, 张柳, 等.不同CpG-DNA序列对异育银鲫离体培养免疫细胞活性影响的研究[J].云南农业大学学报, 2010, 25(5):629-635. http://www.cnki.com.cn/Article/CJFDTotal-YNDX201005009.htm [8] FARMER J J.Vibrio("Beneckea") vulnificus, the bacterium associated with sepsis, septicaemia and the sea[J].Lancet, 1979, 2:903. http://linkinghub.elsevier.com/retrieve/pii/S0140673679927156
[9] MICHEAL P, DOYLE. Foodbome bacterial pathogens[M].London:Food Trade Press, 1989:578.
[10] BIOSCA E G, AMARO C, ESTEVE C, et al.First record of Vibrio vulnificus biotype 2 from diseased European eel, Anguilla anguilla[J].J Fish Dis, 1991, 14:103-109. DOI: 10.1111/jfd.1991.14.issue-1
[11] 张力, 谢英, 周昕. Baff转基因斑马鱼的构建及相关基因表达检测[J].四川动物, 2013, 32(3):343-347. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-IGSQ201209001068.htm [12] 许斌福, 龚辉, 李素一, 等.鳗源创伤弧菌的鉴定与血清型分析[J].渔业研究, 2016, 38(5):351-356. http://www.cnki.com.cn/Article/CJFDTotal-FJSC201605001.htm [13] 许斌福, 林天龙, 董传甫, 等.鳗鲡创伤弧菌的分子鉴定[J].中国人兽共患病学报, 2005, 21(11):995-997. DOI: 10.3969/j.issn.1002-2694.2005.11.017 [14] 姚一琳. 斑马鱼肠道微细结构及肠黏膜屏障的研究[D]. 南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012268716.htm [15] 荣换玲. 创伤弧菌感染致死机制及抗生素治疗的实验研究[D]. 新乡: 河南师范大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1571846 [16] 王光锋, 张士璀.补体和溶菌酶在清除文昌鱼体内细菌中的作用[J].水产科学, 2013, 32(9):497-502. http://www.cnki.com.cn/Article/CJFDTOTAL-CHAN201309001.htm [17] 陈传悦. 微囊藻毒素microcystin-LR对斑马鱼组织病理损伤和免疫调节的影响[D]. 武汉: 华中农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10504-1016155406.htm [18] 王秀丽, 王辉, 薛方民. TLRs在硬骨鱼中的研究进展[J].山东工业技术, 2014, (20):252-25. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=sdgyjs201420219 [19] 姚志刚, 冯建军, 王艺磊, 等.欧洲鳗鲡MYD88基因的克隆及其免疫功能分析[J].水产学报, 2015, 39(3):305-317. http://www.cnki.com.cn/Article/CJFDTOTAL-SCKX201503001.htm [20] 刘艳卉. 斑马鱼TLR信号通路TIRAP与MYD88分子的克隆表达及功能研究[D]. 广州: 中山大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1478213 [21] 赵德志. 斑马鱼Toll样受体及RLHs下游接头分子的进化与功能研究[D]. 广州: 中山大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1691053 -
期刊类型引用(2)
1. 陈华,林晨韬,陈曦,葛均青. 斑马鱼g型溶菌酶基因序列分析及其原核表达. 南方农业学报. 2022(01): 229-237 .  百度学术
百度学术
2. 陈华,张丽娟,李素一,柯翎,陈叙,林晨韬. 饲料中添加裂殖壶菌对斑马鱼抗创伤弧菌感染的影响. 福建农业学报. 2019(10): 1117-1123 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载: