Antimicrobial Activities of Nerium indicum Mill Extracts on Fungal Pathogens
-
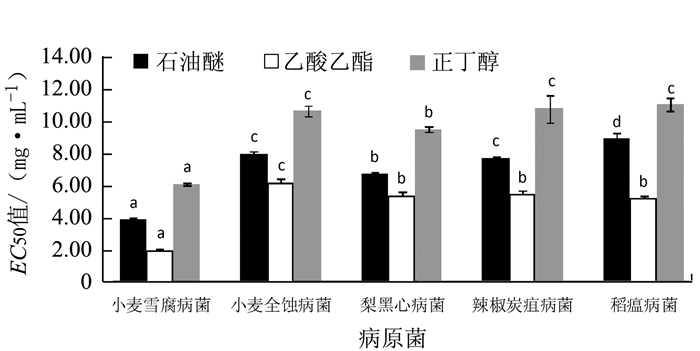
摘要: 以红花夹竹桃Nerium indicum Mill枝叶为试验材料,分别用石油醚、乙酸乙酯、正丁醇对夹竹桃枝叶提取物进行萃取,采用生长速率法测定不同萃取物对5种病原真菌(小麦雪腐病菌、小麦全蚀病菌、梨黑星病菌、辣椒炭疽病菌、稻瘟病菌)的抑菌活性,计算3种萃取物对5种病原真菌的毒力回归方程和半抑制率(EC50)。结果显示:3种萃取物对5种病原真菌的菌丝体生长均有一定的抑制作用,且抑制率随着萃取物浓度的上升而增大。乙酸乙酯萃取物对供试病原菌的抑制效果最好,质量浓度为10.0 mg·mL-1时,乙酸乙酯萃取物对5种病原真菌的抑制率均大于65.0%,尤其对小麦雪腐病原真菌的抑制效果最为显著,最大抑制率达85.7%,半抑制浓度(EC50)为2.03 mg·mL-1;石油醚萃取物其次,正丁醇萃取物抑制效果最差。3种萃取物对小麦雪腐病原菌的抑制作用均较强,半抑制浓度(EC50)均小于6.28 mg·mL-1,与其余4种植物病原菌的EC50值相比,抑制效果显著。说明红花夹竹桃乙酸乙酯萃取物能够抑制5种病原菌的正常生长,其中对小麦雪腐病原菌的抑制效果最好。Abstract: The branches and leaves of Nerium indicum Mill plants were extracted using petroleum ether, ethyl acetate or nbutanol in this study. The antimicrobial activities of the extracts against 5 pathogenic fungi on plants (i.e., Gerlachia nivalis, Gaeumannomyces graminis, Venturia nashicola, Colletotrichum capsici, and Magnaporthe oryzae) were determined based on the fungal growth rates under the treatments. From the data, regression equations were obtained, and EC50 calculated. It was found that the extracts exhibited varying inhibitory rates, which increased with increasing concentration of the extract. The ethyl acetate extract showed the greatest inhibitory effects on the pathogens. At a concentration of 10 mg·mL-1, the extract demonstrated an inhibition rate exceeded 65.0% against all 5 fungi, especially G. nivalis, which reached 85.7% with an EC50 of 2.04 mg·mL-1. The petroleum ether extract and the nbutanol extract followed in that order on the inhibition effect. All 3 extracts retarded the growths of G. nivalis with an EC50 below 6.28 mg·mL-1, which was significantly lower than the EC50 on other fungi tested.
-
Keywords:
- Nerium indicum Mill /
- pathogenic fungi /
- antimicrobial activity
-
0. 引言
【研究意义】绵羊肺炎支原体(Mycoplasma ovipneumoniae, Mo)是引起绵羊和山羊支原体性肺炎(Mycoplasma pneumonia of goats and sheep, MPGS)的一种经呼吸道传染的病原[1]。MPGS患病羊主要表现为肺炎、咳嗽、流鼻涕、体温升高、摄食量下降、腹泻便秘、精神状态恶化和生长发育迟缓等症状[2-3]。该病一年四季都会发生,冬春季节多发,发病率30%~50%[4-7],主要在甘肃、安徽、山东、四川、贵州、福建等地流行[8]。山羊伪结核棒状杆菌(Corynebacterium pseudotuberculosis, CP)是山羊伪结核病的病原,山羊伪结核病是一种人畜共患的接触性传染病[9],也称为干酪样淋巴结炎(Caseous lymphadenitis, CLA)。患病羊主要表现为消瘦、体温升高、食欲减退、生产性能降低,孕畜出现流产、死胎、畸胎等现象[10]。其发病率一般在8.36%~30%[11-12],一年四季均可发病[13],且患病率随年龄增大而升高[14]。目前在世界范围内广泛流行,我国内蒙古、陕西、贵州、新疆、云南和广东等地区均有该病发生的报道[15-16]。但是,临床上内脏型山羊伪结核病临床症状不明显,容易被忽视从而耽误治疗。为了解临床上是否存在Mo和CP混合感染,建立一种同时检测两种病原的PCR方法对上述两种病的监测和防控具有重要意义。【前人研究进展】在Mo和CP两种病原的检测方面,已经建立的方法有PCR、荧光定量PCR、血清学检测方法等。韩瑞鑫等[17]建立了检测Mo的TaqMan实时荧光定量PCR;林裕胜等[18]建立了Mo RPA;王娟等[19]建立了Mo恒温热隔绝式PCR;张双翔等[20]建立了Mo LAMP;赵萍等[21]建立了Mo间接ELISA;马玉馨等[13]建立了CP TaqMan荧光定量PCR;许国洋等[22]建立了CP PMA-PCR;郑敏等[23]、韦志锋等[24]和朱伟英等[25]建立CP PCR;王韡等[26]建立了CP ELISA。【本研究切入点】以上检测方法均为Mo或CP的单一检测方法,相比于同时检测CP和Mo病原的方法效率低。但国内尚未见同时检测CP和Mo 的双重PCR方法相关研究。【拟解决的关键问题】本研究建立Mo和CP双重PCR检测方法可用于临床样品中Mo和CP单一或混合感染的快速检测,为MPGS和羊伪结核病的快速诊断及流行病学调查提供实用方法。
1. 材料与方法
1.1 菌株及临床样品
大肠杆菌(Escherichia coli, Ec)、沙门氏杆菌(Salmonella enteriditis, SE)、金黄色葡萄球菌(Staphylococcus aureus, SA)由福建省农业科学院畜牧兽医研究所禽病研究室和猪病研究室馈赠;山羊支原体山羊亚种(Mycoplasma capricolum subsp. capricolum, Mcc)、山羊支原体山羊肺炎亚种(Mycoplasma capricolum subsp. capripneumoniae, Mccp)由中国农业科学院兰州兽医研究所馈赠;伪结核棒状杆菌(Corynebacterium pseudotuberculosis, CP)[27]、绵羊肺炎支原体(Mycoplasma ovipneumoniae, Mo)[28]、丝状支原体山羊亚种(Mycoplasma mycoides subsp. Capri, Mmc)[29]、山羊莱氏无胆甾原体(Acholeplasma laidlawii, AL)[30]、牛支原体(Mycoplasma bovis, Mb)[31]为本研究室分离、鉴定、保存。70份临床样品于2018年4月至2019年7月采集自福建省三明市(鼻拭子10份、肺组织9份)、宁德市(鼻拭子13份、肺组织7份)和福州市(鼻拭子20份、肺组织11份)的临床上有不同程度流鼻涕、咳嗽、消瘦的病羊。
1.2 主要试剂
LB培养基和DNA提取试剂盒购于生工生物工程(上海)有限公司;改良Frey氏培养基为青岛高科技园海博生物技术有限公司产品;Premix Taq(Ex Taq Version 2.0 plus dye)、DL2000 Marker等购自宝生物工程(大连)有限公司。
1.3 引物设计
Mo特异性引物F1/R1参照林裕胜等[32]设计;CP特异性引物F2/R2的设计参照许国洋等[22],由铂尚生物技术(上海)有限公司合成,其序列如表1。
表 1 引物序列Table 1. Primer sequence靶基因
Target gene引物名称
Primer name引物序列(5′→ 3′)
Primer sequence(5′→ 3′)扩增片段大小
Amplified fragment size/bpP80基因 F1 GCCTTGGGGTTGGAATTCCTTTGTCTTATTC 705 R1 CATTTGATGCTGAGGTCGGATTTGGACTAAC PLD基因 F2 GTGAGAAGAACCCCGGTATAAG 291 R2 TACCGCACTTATTCTGACACTG 1.4 细菌和支原体核酸的提取
细菌DNA和支原体DNA的提取及浓度测定参考林裕胜等[32]的方法。
1.5 单一PCR反应体系的建立及克隆测序
Mo和CP的单一PCR扩增体系均为20 μL:Premix Taq(Ex Taq Version 2.0 plus dye)10 μL,上、下游引物(10 μmol·L−1)各1 μL,DNA模板2 μL,ddH2O补足至20 μL。PCR反应程序为:94℃预变性5 min;94℃变性45 s,55℃退火45 s,72℃延伸1 min,30个循环;72℃终延伸10 min,4℃保存。经1%琼脂糖凝胶电泳检测PCR产物大小。将Mo和CP的单一PCR扩增产物交铂尚生物技术(上海)有限公司进行克隆测序,将获得的DNA序列与GenBank中的基因序列进行比对。
1.6 双重PCR体系优化
在Mo和CP单一PCR反应的基础上,分别对双重PCR体系中的引物浓度和退火温度进行优化。以Mo和CP混合DNA为模板。优化引物浓度时:两对特异性引物浓度均为10 μmol·L−1,双重 PCR 反应体系20 μL:Premix Taq(Ex Taq Version 2.0 plus dye)10 μL,混合DNA模板2 μL,引物分别为0.7、0.8、0.9、1.0、1.1、1.2 和1.3 μL,ddH2O补足至20 μL;PCR反应程序为:94℃预变性5 min;94℃变性45 s,55℃退火45 s,72℃延伸45 s,30个循环;72℃终延伸10 min,对PCR产物进行1%琼脂糖电泳分析,以确定最佳引物浓度。优化退火浓度时:设置7个温度:51、53、55、57、59、61和63℃,每个温度组加入已优化的引物量,其余条件固定不变进行双重PCR反应,反应结束后经1%琼脂糖凝胶电泳观察结果,以确定最佳退火温度。
1.7 双重PCR特异性试验
分别以Mo+CP、CP、Mo、Mmc、Mcc、Mccp、AL、Mb、SE、Ec、SA的DNA为模板,以ddH2O作为空白对照,按照优化后的双重PCR反应条件进行检测。反应结束后进行1%琼脂糖凝胶电泳观察结果。
1.8 双重PCR灵敏性试验
将已测定浓度的Mo和CP DNA,用ddH2O进行梯度稀释,稀释倍数分别为101、102、103、104、105、106、107、108。分别取2 μL各稀释度的Mo、CP 和Mo+CP的DNA进行单一和双重PCR反应,扩增体系和扩增条件同1.5和1.7,测定该方法的灵敏性。
1.9 双重PCR重复性试验
组内重复试验:取1份Mo+CP、4份Mo、5份CP的DNA样品,以Mccp、Mmc、AL、Ec、SA、SE的DNA样品各1份作阴性对照,以ddH2O作空白对照,每一份样品3个重复,进行双重PCR 扩增试验,扩增体系和扩增条件同1.7;组间重复试验:以上17份样品每间隔3 d分别用双重PCR方法检测1次,共检测3次,PCR扩增体系和扩增条件均同1.7。
1.10 临床样品检测试验
以DNA抽提试剂盒提取70份自福建省不同地区采集的临床样品的DNA,以此DNA为模板进行CP、Mo、Mo+CP检测,重复3次,具体试验方法参考林裕胜等[32]方法。
2. 结果与分析
2.1 Mo和CP单一PCR扩增及扩增产物的鉴定
应用基于Mo的P80基因和CP的PLD基因所设计的2对特异性引物,按照单一PCR反应体系分别进行PCR反应,将扩增得到的目的片段经1%琼脂糖凝胶电泳。电泳结果显示,Mo仅扩增出一条约700 bp左右的目的片段(图略),CP仅扩增出一条约290 bp左右的目的片段(图略),二者均与预期片段大小相符。克隆测序结果显示,所克隆的Mo序列为705 bp,与参考株(GenBank No. KF703747.1)序列同源性为100%;克隆的CP序列为291 bp,与GenBank中收录的山羊(GenBank No. CP039866.1)和绵羊(GenBank No. CP001829.1)伪结核棒状杆菌同源性均为100%。
2.2 双重PCR体系优化结果
经过双重PCR体系优化,确定最佳反应体系为:总体积20 μL,Premix Taq(Ex Taq Version 2.0 plus dye)10 μL,上、下游两对特异性引物(10 μmol·L−1)各1 μL,Mo和CP的DNA混合模板2 μL,ddH2O补足至20 μL;最佳反应程序为:94℃ 5 min;94℃ 45 s,61℃ 45 s,72℃ 45 s,30个循环;72℃ 10 min。以Mo+CP、Mo、CP的 DNA为模板,以Mccp为阴性对照,进行双重PCR扩增。电泳结果显示,Mo+CP混合DNA样品同时扩增出与预期大小相符的约700 bp和290 bp的两个片段,Mo和CP单一DNA分别扩增出约为700 bp和290 bp的单一片段,而阴性对照无条带(图1)。
2.3 双重PCR特异性试验结果
采用优化的双重PCR扩增条件,以Mo+CP、CP、Mo、Mmc、Mcc、Mccp、AL、Mb、SE、Ec、SA的DNA为模板进行PCR扩增,以ddH2O作为空白对照。结果显示,只有Mo+CP、CP、Mo的DNA样品扩增出与预期大小一致的特异性片段,而Mmc、Mcc、Mccp、AL、Mb、SE、Ec、SA、和ddH2O均未扩增出目的片段(图2),表明本研究建立的双重PCR方法特异性好。
2.4 双重PCR灵敏性试验结果
对Mo和CP的DNA进行浓度测定,Mo的DNA质量浓度约为153 ng·μL−1,CP的DNA质量浓度约为35 ng·μL−1。分别以101、102、103、104、105、106、107、108倍稀释,将稀释后的DNA作为模板进行双重PCR扩增。结果显示,当Mo和CP DNA稀释倍数达104和105时,双重PCR仍能扩增出约700 bp和290 bp的两个目的条带(图3),即Mo的检测下限为1 530 pg·μL−1、CP的检测下限为3 500 pg·μL−1,表明该方法的敏感性较高。而单一PCR检测结果显示(图4),Mo的检测灵敏度为15.3 pg·μL−1,CP的检测灵敏度为350 pg·μL−1,分别比双重PCR灵敏低100倍和10倍。
![]() 图 3 双重PCR灵敏性试验注:M: 2 000 DNA Ladder;1: Mo+CP阳性对照;2–9: 分别为101、102、103、104、105、106、107、108倍稀释的含Mo和CP的阳性样本;10: 阴性对照。Figure 3. Sensitivity of multiplex PCRNote:M: 2 000 DNA Ladder; 1: Mo and CP positive control; 2–9: positive specimens containing Mo and CP diluted 101, 102, 103, 104, 105, 106, 107, 108 times, respectively; 10: negative control.
图 3 双重PCR灵敏性试验注:M: 2 000 DNA Ladder;1: Mo+CP阳性对照;2–9: 分别为101、102、103、104、105、106、107、108倍稀释的含Mo和CP的阳性样本;10: 阴性对照。Figure 3. Sensitivity of multiplex PCRNote:M: 2 000 DNA Ladder; 1: Mo and CP positive control; 2–9: positive specimens containing Mo and CP diluted 101, 102, 103, 104, 105, 106, 107, 108 times, respectively; 10: negative control.![]() 图 4 单一PCR灵敏性试验注:A中,M: 2 000 DNA Ladder;1: Mo阳性对照;2–9: 分别为101、102、103、104、105、106、107、108倍稀释的含Mo的阳性样本;10: 阴性对照;B中,M: 2 000 DNA Ladder;1: CP 阳性对照;2–9分别为101、102、103、104、105、106、107、108倍稀释的含CP 的阳性样本;10: 阴性对照。Figure 4. Sensitivity of single PCRNote:A:M: 2 000 DNA Ladder; 1: Mo positive control; 2–9: positive specimens containing Mo diluted 101,102,103,104,105,106,107,108 times, respectively; 10: negative control; B: M: 2 000 DNA Ladder; 1: CP positive control; 2–9: positive specimens containing CP diluted 101,102,103,104,105,106,107,108 times, respectively; 10: negative control.
图 4 单一PCR灵敏性试验注:A中,M: 2 000 DNA Ladder;1: Mo阳性对照;2–9: 分别为101、102、103、104、105、106、107、108倍稀释的含Mo的阳性样本;10: 阴性对照;B中,M: 2 000 DNA Ladder;1: CP 阳性对照;2–9分别为101、102、103、104、105、106、107、108倍稀释的含CP 的阳性样本;10: 阴性对照。Figure 4. Sensitivity of single PCRNote:A:M: 2 000 DNA Ladder; 1: Mo positive control; 2–9: positive specimens containing Mo diluted 101,102,103,104,105,106,107,108 times, respectively; 10: negative control; B: M: 2 000 DNA Ladder; 1: CP positive control; 2–9: positive specimens containing CP diluted 101,102,103,104,105,106,107,108 times, respectively; 10: negative control.2.5 双重PCR重复性试验结果
采用本试验建立的双重PCR方法对Mo + CP、Mo、CP、Mccp、Mmc、AL、Ec、SA、SE的DNA 样品进行3次组内重复试验。结果显示,Mo + CP的DNA样品均扩增出大小约为700 bp和290 bp的2个特异性片段,4份Mo DNA均扩增出大小约为700 bp的特异性片段,5份CP DNA都扩增出大小约为290 bp的特异性片段,其余样品和ddH2O均无扩增片段(图5);组间重复试验结果显示,3次PCR检测结果相同:Mo + CP、Mo、CP的DNA均有目的条带(图略),其余样品均无目的条带,表明该双重PCR重复性好。
2.6 双重PCR临床样品检测结果
应用Mo和CP单一PCR及本研究建立的双重PCR方法分别对来自福州市等不同地区的鼻腔棉拭子样品43份、肺组织27份进行检测。结果显示(表2),Mo和CP单一PCR与双重PCR检测结果完全一致,2种方法的符合率为100%。其中18份为Mo感染,13份为CP感染,5份为Mo和CP的混合感染,且应用Mo和CP单一PCR和双重PCR进行的3次检测结果相同。表明本研究建立的Mo、CP双重 PCR 检测方法可应用于临床样品的快速检测。
表 2 临床样品检测结果Table 2. Detection of pathogens on clinical specimens样品名称
Sample nameMo阳性率
Mo positive rate/%CP阳性率
CP positive rate/%Mo + CP阳性率
Mo + CP positive rate/%鼻拭子
Nasal cotton swab18.60 11.63 4.65 肺组织
Lung tissue37.04 29.63 11.11 所有样品
All samples25.71 18.57 7.14 3. 讨论与结论
随着养羊业的快速发展,羊的疾病日趋复杂化,单一病原引起的感染越来越少,混合感染呈现出上升趋势,对羊病的有效防控难度增加,给养羊业带来了严重的经济损失,已引起广大兽医工作者的关注[33-35]。为了解福建省Mo和CP混合感染情况,有效防治羊病,本研究应用Mo和CP的两对特异性引物,通过优化反应体系和条件以及特异性和灵敏性等试验,建立了Mo和CP的双重PCR检测技术。
双重PCR是指将多对引物同在一个反应体系里,扩增出多个不同大小产物的技术,广泛应用于病原微生物检测与鉴定[36]。双重PCR反应受众多因素的影响,其中影响较大的是退火温度和引物浓度。本试验就引物浓度和退火温度进行优化。优化引物浓度时,设置7个引物梯度(0.7、0.8、0.9、1.0、1.1、1.2 和1.3 μL),其他条件不变,最终确定Mo和CP的最佳引物浓度是上、下游引物(10 μmol·L−1)各1 μL;优化退火温度时,设置7个退火温度(51、53、55、57、59、61和63℃),用最佳引物浓度进行PCR,确定其最佳退火温度为61℃。采用所优化的双重PCR体系仅对Mo和CP有特异性扩增,而对Mmc、Mcc、Mccp、AL、Mb、SE、Ec、SA等病原体的扩增结果均为阴性,与侯宏艳等[37]、张洁[38]、王璇等[39]、李文杨等[9]一般的分离培养鉴定法相比,其特异性更好。该双重PCR方法对Mo和CP的最低检测限分别为1 530 pg·μL−1和3 500 pg·μL−1,表明该方法灵敏度较高;同时具有良好的重复性,可对病原体含量较低的样品进行快速检测。
为了验证该技术的实用效果,采用此方法和单一PCR分别对临床采集的70份样品进行检测。结果检出Mo阳性样品18份(阳性率为25.71%),CP阳性样品13份(阳性率为18.57%),同时感染Mo和CP的阳性样品5份(阳性率为7.14%),Mo、CP单一和双重PCR检测方法的符合率为100%,表明该方法的准确性好,可应用于临床样品的准确快速检测。同时,本次检测结果提示,福建省羊场存在Mo和CP共感染的现象,这与Thomas[40]和许国洋等[41]等的报道相似,应在今后羊病防控工作中引起重视。
-
表 1 不同萃取物对5种病原菌的抑制效果
Table 1 Inhibitory effects of 3 extracts on 5 fungi
萃取物 质量浓度/(mg·mL-1) 小麦雪腐病菌 小麦全蚀病菌 梨黑星病菌 辣椒炭疽病菌 稻瘟病菌 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 石油醚 0.0 8.60±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 0.5 8.60±0.00Aa 0.00±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Ba 0.00 ±0.00Aa 1.5 7.25±0.13Bb 15.67 ±1.53Bb 7.97 ±0.06Bb 7.37 ±0.64Bb 7.88 ±0.10Bb 8.33 ±1.19Ab 8.22 ±0.10Bb 4.83 ±1.19Ab 8.25 ±0.05Bb 4.10 ±0.6Ab 2.5 5.25 ±0.05Bc 38.80 ±0.61Bc 6.93 ±0.10Bc 19.27 ±1.17Bc 7.03 ±0.06Bc 18.20 ±0.69Bc 7.30 ±0.10Bc 15.17 ±1.2Bc 7.87 ±0.06Bc 8.50 ±0.69Bc 5.0 3.27 ±0.06Bd 62.00 ±0.69Bd 5.0 ±0.09Ad 42.43 ±0.98Bd 5.15 ±0.15Bd 40.13 ±1.75Bd 5.17 ±0.06Bd 39.90±0.69Bd 5.68 ±0.08Bd 33.90 ±0.92Bd 10.0 1.97 ±0.08Be 77.13 ±0.86Be 4.29 ±0.01Be 50.07 ±0.12Be 3.23 ±0.08Be 62.40 ±0.92Be 3.93 ±0.08Be 54.27 ±0.86Be 4.30 ±0.11Be 50.27 ±1.25Be 乙酸乙酯 0.0 8.60±0.00Aa 0.00±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.0 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 0.00 ±0.00Aa 0.00 ±0.00Aa 0.5 6.83 ±0.06Bb 20.53 ±0.64Bb 7.97 ±0.15Ab 7.37 ±1.78Bb 8.00 ±0.30Ab 7.00 ±3.50Bb 7.72 ±0.10Ab 10.27 ±1.19Bb 7.67 ±0.15Ab 10.87 ±1.78Bb 1.5 4.90 ±0.10Ac 43.47 ±1.36Cc 7.00 ±0.26Ac 18.60 ±3.08Cc 7.17 ±0.15Ac 16.67 ±1.78Bc 7.17 ±0.06Ac 16.67 ±0.64Bc 6.98 ±0.28Ac 18.77 ±3.19Bc 2.5 3.87 ±0.0A6d 55.07 ±0.64Cd 6.52 ±0.10Ad 24.23 ±1.21Cd 6.50 ±0.17Ad 24.43 ±2.02Cd 6.60 ±0.10Ad 23.27 ±1.15Cd 6.40 ±0.20Ad 25.60 ±2.30Cd 5.0 2.81 ±0.04Ae 67.73 ±0.85Ce 4.92 ±0.08Ae 42.83 ±0.86Be 4.33 ±0.15Ae 49.63 ±1.78Ce 4.63 ±0.21Ae 46.10 ±2.40Ce 4.17 ±0.25Ae 51.57 ±1.33Ce 10.0 1.28 ±0.08Af 85.07 ±0.86Cf 3.07 ±0.15Af 64.37 ±1.78Cf 2.75 ±0.15Af 68.03 ±1.75Cf 2.53 ±0.15Af 70.53 ±1.78Cf 2.77 ±0.12Af 67.83 ±2.90Cf 正丁醇 0.0 8.60± 0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 0.5 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 1.5 8.37 ±0.15Cb 2.73 ±1.79Ab 8.33 ±0.06Cb 3.10 ±0.69Ab 7.90 ±0.10Bb 8.13 ±1.15Ab 8.07 ±0.12Bb 6.23 ±1.33Ab 8.10 ±0.10Bb 5.83 ±1.15Ab 2.5 7.43 ±0.16Cc 13.57 ±1.79Ac 7.97 ±0.06Cc 7.37 ±0.64Ac 7.60 ±0.10Cc 11.63 ±1.15Ac 7.77 ±0.06Cc 9.70 ±0.69Ac 7.55 ±0.05Cc 12.20 ±0.60Ac 5.0 5.27 ±0.06Cd 38.77 ±0.64Ad 6.57 ±0.06Bd 23.67 ±0.64Ad 6.48 ±0.13Cd 24.63 ±1.46Ad 7.07 ±0.12Cd 17.83 ±1.33Ad 6.80 ±0.10Cd 20.93 ±1.15Ad 10.0 2.35 ±0.09Ce 74.30 ±1.04Ae 4.73 ±0.15Ce 44.93 ±1.78Ae 4.10 ±0.10Ce 52.33 ±1.15Ae 4.37 ±0.21Ce 49.23 ±2.44Ae 4.50 ±0.20Be 47.67 ±2.35Ae 注:表中不同大写字母表示同一质量浓度不同萃取物的抑菌率在0.05水平上差异显著,不同小写字母表示同一种萃取物不同质量浓度的抑菌率在0.05水平上差异显著。 表 2 不同萃取物对5种病原菌的毒力回归方程分析
Table 2 Toxicity regression equations of 5 fungi affected by 3 extracts
萃取物 供试菌株 毒力回归方程 χ2 χ0.052 dfa P 石油醚 小麦雪腐病菌 y=2.262x-1.360 6.417 7.815 3 0.093 小麦全蚀病菌 y=1.948x-1.720 4.729 7.815 3 0.193 梨黑星病菌 y=2.037x-1.757 1.856 7.815 3 0.603 辣椒炭疽病菌 y=2.064x-1.894 4.732 7.815 3 0.193 稻瘟菌病菌 y=2.129x-2.088 3.817 7.815 3 0.282 乙酸乙酯 小麦雪腐病菌 y=3.031x-2.380 0.429 7.815 3 0.934 小麦全蚀病菌 y=2.207x-2.029 0.314 7.815 3 0.957 梨黑星病菌 y=1.949x-1.939 2.689 7.815 3 0.441 辣椒炭疽病菌 y=1.999x-2.111 4.167 7.815 3 0.244 稻瘟菌病菌 y=1.910x-2.010 2.033 7.815 3 0.566 正丁醇 小麦雪腐病菌 y=1.411x-0.438 0.8 7.815 3 0.85 小麦全蚀病菌 y=1.554x-1.172 4.071 7.815 3 0.252 梨黑星病菌 y=1.828x-1.231 6.676 7.815 3 0.083 辣椒炭疽病菌 y=1.399x-1.101 5.634 7.815 3 0.131 稻瘟菌病菌 y=1.694x-1.149 5.079 7.815 3 0.166 注:表中“χ2”为卡方值,“χ0.052”为临界值,(dfa)为自由度,“P”为5%显著性差异。 -
[1] 文静, 袁小红, 刘卓.夹竹桃叶的化学成分研究[J].安徽农业科学, 2015, 43(9):65-67. DOI: 10.3969/j.issn.0517-6611.2015.09.027 [2] 方访.夹竹桃枝叶化学成分研究[D].合肥: 安徽农业大学, 2013. [3] 徐凯宏.基于植物源提取绿色农药的研究现状与发展[J].林业科技, 2009, 34(3):38-40. http://d.old.wanfangdata.com.cn/Periodical/lykj200903013 [4] 翟兴礼.夹竹桃叶片水提液对细菌的抑制作用[J].山丘师范学院学报, 2014, 30(3):80-85. http://d.old.wanfangdata.com.cn/Periodical/sqsfxyxb201403018 [5] 郭春雨.夹竹桃叶中的甾体类化学成分及其细胞毒活性的研究[D].上海: 华东理工大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1777202 [6] 郑许松, 俞小平, 吕仲贤, 等.夹竹桃叶提取物对茭白二化螟的生物活性[J].浙江农业学报, 2003, 15(3):167-171. DOI: 10.3969/j.issn.1004-1524.2003.03.012 [7] 吴建璋.夹竹桃多糖分离纯化及抗肿瘤活性的研究[D].福州: 福建师范大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10394-2010034887.htm [8] 陆宁海, 吴利民, 李晓红, 等.夹竹桃抑菌活性的初步研究[J].湖北农业科学, 2007, 46(6):934-935. DOI: 10.3969/j.issn.0439-8114.2007.06.031 [9] 王猛.夹竹桃提取物对松材线虫致死性的研究[J].湖南林业科技, 2006, 33(3):7-8. DOI: 10.3969/j.issn.1003-5710.2006.03.003 [10] 吴文君.植物化学保护实验技术导论[M].西安:陕西科学技术出版社, 1988. [11] 魏朝霞, 杨彩波, 和慧, 等.大蓟提取物对植物病原真菌的抑制活性[J].云南农业大学学报, 2014, 29(1):140-143. DOI: 10.3969/j.issn.1004-390X(n).2014.01.026 [12] 丘麒, 罗建军, 郝卫宁, 等.21种植物提取物对番茄早疫病菌等3种病原菌抑菌活性的初步研究[J].安徽农业科学, 2008, 36(17):7306-7311. DOI: 10.3969/j.issn.0517-6611.2008.17.110 [13] 武怀恒, 万鹏, 黄民松.毒力回归计算方法及相应软件使用介绍[J].安徽农业科学, 2014, 42(24):9335-9338. http://d.old.wanfangdata.com.cn/Periodical/ahnykx201427030 [14] 谭宏亮, 黎鹄志.夹竹桃叶水提取物抑菌作用研究[J].宜春学院学报(自然科学版), 2007, 29(4):70-71. http://d.old.wanfangdata.com.cn/Periodical/ycxyxb200704030 [15] 李昌灵, 牛友芽, 刘胜贵.夹竹桃叶提取物的抑菌作用研究[J].徽农业科学, 2008, 36(2):575-577. DOI: 10.3969/j.issn.0517-6611.2008.02.083 [16] 李萍, 谭芸, 龚枕, 等.夹竹桃叶提取液的抑菌作用研究[J].湖南农业科学, 2009(11):94-95. DOI: 10.3969/j.issn.1006-060X.2009.11.030 -
期刊类型引用(4)
1. 杨帅,段宏伟,吕建树,曾建林,闫振兴,胡俊杰,张勇,赵兴绪. 甘肃省庆阳地区湖羊皮下脓肿病的流行病学调查及病原体分析. 核农学报. 2023(12): 2510-2517 .  百度学术
百度学术
2. 杨鹏,吴燕,岳筠,陈静,李梅,王慧,张双翔,文明,程振涛. 绵羊肺炎支原体P113蛋白C末端基因真核表达载体的构建及其小鼠免疫应答. 中国兽医学报. 2022(03): 496-501+521 .  百度学术
百度学术
3. 杨鹏,杨源,岳筠,陈静,王慧,朱二鹏,张双翔,文明,程振涛. 绵羊肺炎支原体感染对贵州不同品种山羊肺脏和血液Toll样受体基因转录水平的影响. 动物医学进展. 2022(12): 1-9 .  百度学术
百度学术
4. 尹峥,刘刚,王晶晶,李晨露,徐海玲,张琪,许信刚. 基于PLD蛋白的伪结核棒状杆菌血清抗体间接ELISA检测方法的建立与应用. 中国兽医科学. 2021(01): 9-16 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: