Starch Metabolism of Repeated-bolting Lily Bulbs
-
摘要:目的 研究百合种球反季节繁育二次抽薹过程中的淀粉代谢机制,为精确种球反季节繁育的收储期,促进国产种球繁育提供理论依据。方法 通过测量百合抽薹前后不同发育时期,鳞茎中的淀粉、还原糖含量,使用扫描电镜观察鳞片细胞中的淀粉颗粒形态内容变化,定量分析不同发育时期种球的淀粉酶基因的表达情况。结果 百合鳞茎二次抽薹过程中,淀粉和还原糖含量在萌动期出现显著性变化,淀粉含量下降4.98%,还原糖含量增加3.23%。扫描电镜(SEM)观察结果表明:百合鳞片抽薹过程中淀粉粒有A、B、C(大、中、小)3 种类型。在膨大期和成熟期包含A型和B型淀粉粒;萌动期C型淀粉粒出现,A型淀粉粒出现异形、凹陷或是拉伸,长短轴比(L/S)达最大1.77,淀粉颗粒被逐渐拆分;抽薹期A型淀粉粒消失,B、C型颗粒表面出现大量泡状突起,小颗粒可见以“出芽”的方式长出。不同发育时期淀粉酶基因的实时荧光定量多聚核苷酸链式反应(qRT-PCR)结果显示:淀粉分解酶基因AMY在不同发育时期均有表达,在膨大期和成熟期表达量较低,在萌动期和抽薹期高度表达;淀粉合成酶相关基因SSS、SBE在不同发育时期均有表达,在膨大期和成熟期表达量较高,在萌动期和抽薹期表达量较低;淀粉分解酶和合成酶相关基因在种球不同发育时期表达情况与淀粉含量的变化情况相符。结论 百合种球反季节繁育过程中,二次抽薹导致种球大量的淀粉被消耗,将影响商品球质量以及鲜切花的品质,为消除此不利因素,繁育过程中应当在种球进入成熟期后及时进行收储。Abstract:Objective Starch metabolism at time of repeated bolting was studied to determine the optimum time for bulb-harvesting in propagation of out-of-season lilies.Method Contents of starch and reducing sugars as well as images of starch granules under scanning electron microscope of the lily bulbs at various developmental stages were examined. Expressions of amylase-related genes of the bulbs were obtained by qRT-PCR.Result The starch and reducing sugars in the bulbs underwent significant changes at germination stage, as the starch content decreased by 4.98% and reducing sugars increased by 3.23%. The
SEM images of the starch granules were of A-, B- and C-types, or, large, medium and small in sizes. They were mainly A- and B-types in the expanding and mature bulbs. Upon germinating, the granules began to separate from one another with the appearances of C-type and deformed A-type that showed depressions or were stretched to an L/S ratio as high as 1.77. At bolting, the A-type granules disappeared while the B- and C-types appeared with bubbles and tiny " bud-like” growth on their surfaces. The qRT-PCR analysis indicated that the AMY gene in the bulbs expressed at a high-level during germination and bolting stages, while SSS and SBE at expanding and mature stages, and that the variations paralleled the contents of starch and reducing sugars. Conclusion A large amount of starch was consumed during repeated bolting of the bulbs. Thus, to reduce the ill-effects on the quality of the bulbs and lily flowers, bulb-harvesting at the mature stage was recommended.-
Keywords:
- lily /
- bulb /
- starch matabolism /
- bolting
-
0. 引言
【研究意义】百合Lilium是多年生鳞茎植物,其切花商品价值高,市场需求量大。目前我国百合切花所需种球均从荷兰等国进口,每年种球进口量达2亿余头,且需求仍在不断增加。种球依赖进口导致切花成本居高不下,且市场抗风险能力弱,因此百合种球国产化繁育势在必行。基于亚热带平原地区的气候资源禀赋,采用反季节繁育技术可创制高品质的商品球,而繁育过程中经常出现种球二次抽薹的异常现象,对此异常现象的形成机制进行深入分析并采取科学的技术措施消除不利影响对实现百合种球国产化繁育具有重大意义。【前人研究进展】为了解决百合原种问题,打破花卉大国的控制,近年来国内陆续开展了相关种球繁育研究。主要集中在组培快繁[1-3]、鳞片扦插[4-6]、冷藏春化[7-8]、栽培技术[9-10]等几个方面,而抽薹通常是作为冷藏春化是否完全的验收指标,而本研究所涉及的二次抽薹现象是基于亚热带平原地区种球反季节繁育方式所形成的独特现象,其形成原因在于栽种的种球经历了冬春季节的低温诱导形成了生理分化,到了夏季春化完全后诱发种球出现二次抽薹现象。【本研究切入点】百合鳞茎作为多年生的地下贮藏器官,在其生长发育过程中经历了多次源、库功能上的转换,淀粉是百合鳞茎细胞内碳水化合物的主要贮藏形式,其代谢作用直接关系到鳞茎及植株的发育。针对形成二次抽薹现象的生物学机制研究仍未见报道。【拟解决的关键问题】本研究拟通过对不同发育时期种球的淀粉代谢机制进行研究,探讨百合种球二次抽薹前后不同发育时期,鳞茎中淀粉形态内容物变化以及淀粉酶基因的活性变化情况,以深入了解二次抽薹现象的形成情况,揭示形成二次抽薹现象的生物学机制并提出解决措施,为实现种球国产化繁育提供了理论依据。
1. 材料与方法
1.1 试验材料
试验于2018年4-6月在福州吴凤百合基地进行。选用东方百合西伯利亚品种分4次进行取样,4月24日取第一次样品,5月4日第二次取样,5月23日(鳞茎内部已观察到拔节),6月5日(鳞茎已抽薹8 cm),以下笔者把这4个时期分别称为膨大期、成熟期、萌动期、抽薹期。
1.2 试验方法
1.2.1 取样及养分含量测定
4次取样,每次取10个鳞茎,重复3次,洗净烘干后打成粉末,混合取样。用蒽酮比色法测定鳞片的淀粉、还原糖含量。
1.2.2 扫描电镜观察
分别取不同时期中层、外层鳞片进行切片观察,切取鳞片中心部位薄片1 cm×1 cm,用5%的戍二醛固定样品4h,磷酸缓冲液清洗样品3遍(各15 min),1%锇酸固定4 h,蒸馏水清洗3遍(各15 min),50%~100%酒精逐级脱水(各15 min,其中100%置换3次),环氧丙烷置换2遍,用日立(HITACHI)HCP-2型临界点干燥仪干燥,将样品用IB-5离子溅射仪喷铂金后,用日本电子(JEOL) JSM-6380LV型扫描电子显微镜观察。
1.2.3 总RNA提取和cDNA的合成
利用RNAprep pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,TIANGEN)提取百合鳞茎总RNA,1.2%琼脂糖凝胶电泳检测RNA质量。以各样品100 ng总RNA为模板,利用RevertAid First Strand cDNA Synthesis Kit#K1622(赛默飞世尔科技公司,Thermo Scientific)反转录合成cDNA第一链,存于−80℃储藏备用。
1.2.4 淀粉分解与合成关键酶基因表达分析
应用Applied Biosystems® QuantStudio®荧光定量PCR仪进行荧光检测,qRT-PCR的反应体系为2×ChamQ SYBR qPCR Master Mix 5 μL,各样品的cDNA 11 μL,Forward Primer和Reverse Primer(浓度10 μmol·L−1)各0.4 μL,用ddH2O补足体积至20 μL。qRT-PCR的反应程序为:95℃ 30 s;95℃ 10 s;60℃ 30 s, 40个循环。实验设计3个技术重复,数据读取由仪器自动完成,通过溶解曲线分析确定扩增产物的特异性。
根据百合已登录序列采用Primer 6.0分别设计AMY、SSS、SBE 3个基因的特异性引物序列(表1),由福州白鲸生物科技有限公司合成,以ACTIN为内参基因。采用2−ΔΔCT法[11]进行数据的相对定量分析。
表 1 引物序列及内参基因信息Table 1. Genes and primer sets used in qRT-PCR analysis基因名称
Gene name引物序列(5′–3′)
Primer sequence长度 Length/bp AMY F: GGGATATTCAGCAGAAATGGCGAAG 130 R: GCGGTTGGCATCTTGATTGTAGAGT SSS F: GTCAACGATTGGCACGCAAGTCT 171 R: ACCATACCACTCAGAGGGCAAGC SBE F: AGCAGCGGAGCGTCGTTAATCT 213 R: CCTGAGAGTCTTCAGCAGCCACT ACTIN F: GTCTGCGACAATGGTACTGGAATG 149 R: GCCTCATCACCAACATAAGCATCTT 注:F:正向引物;R:反向引物。
Note: F, forward primer; R, reverse primer.1.3 统计分析
利用Image Pro-Plus软件对扫描电镜的淀粉粒进行几何特征分析;试验数据采用Excel软件进行计算和处理,利用DPS软件进行差异显著性分析。
2. 结果与分析
2.1 不同发育时期鳞茎的养分含量变化
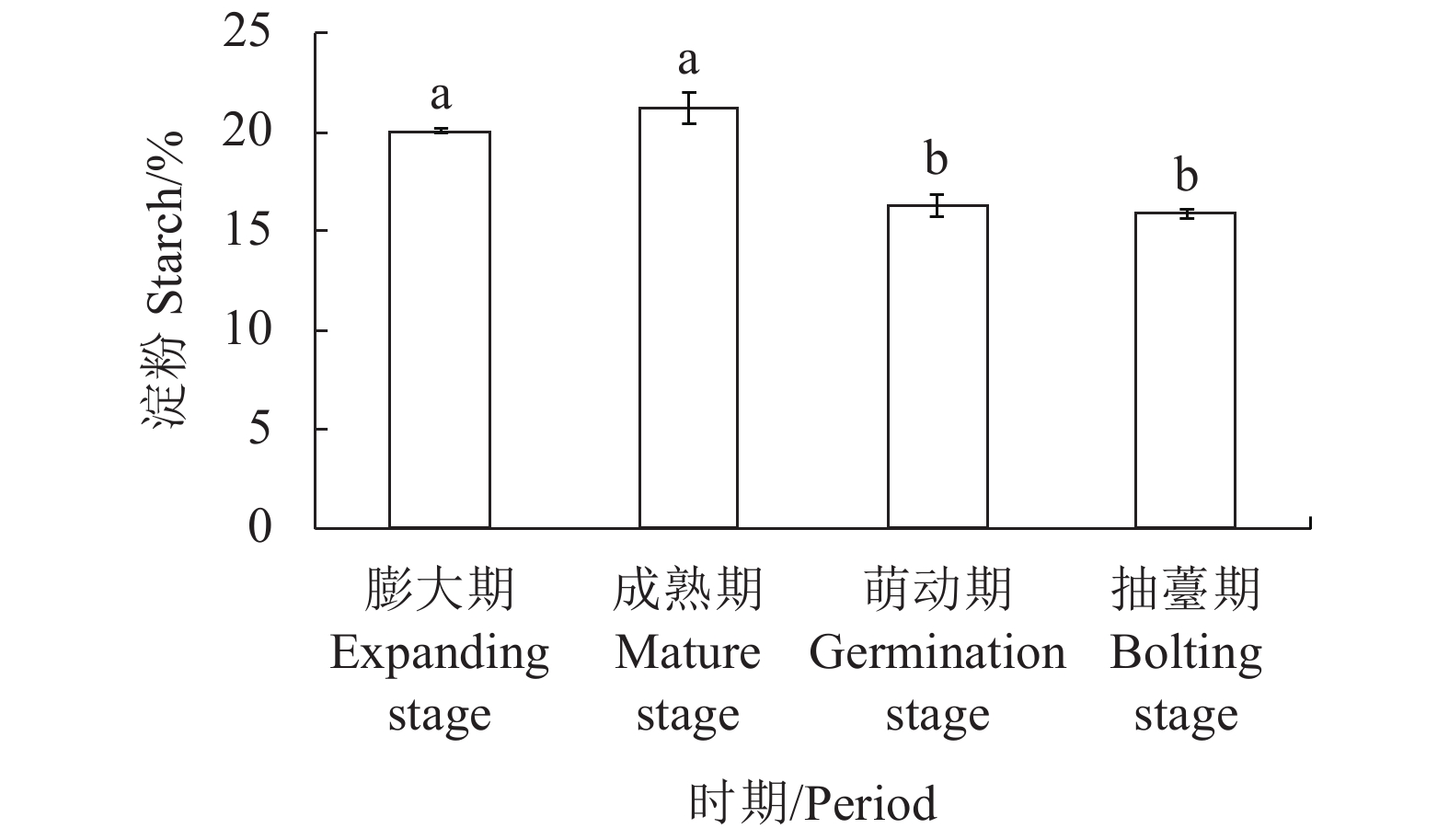
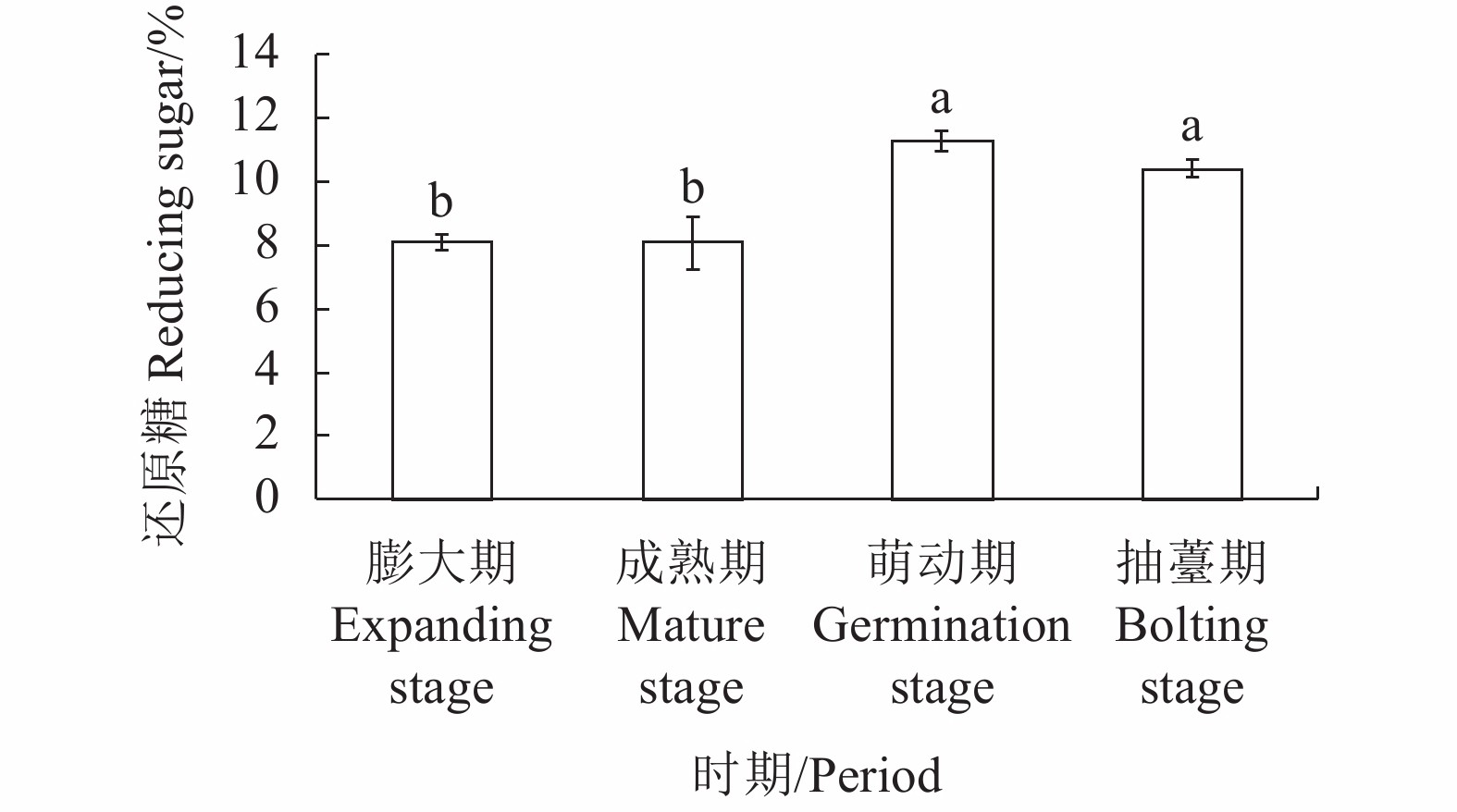
在4个不同的发育期中,百合淀粉含量总体呈先上升后下降趋势(图1),前期栽种的百合种球虽然地上植株已陆续开始黄化,但地下部仍在膨大贮藏养分,淀粉含量也从20.08%上升至21.26%,但到后期淀粉含量迅速下降,尤其在萌动期,淀粉含量相对之前下降了4.98%,而到了抽薹期,淀粉消耗相对趋缓。因此,在出现二次抽薹现象的过程中,百合的大部分能量用于内部初始拔节。而还原糖的增长也主要集中在萌动期(图2),增加了3.23%,之后缓慢下降,也就是说随着百合鳞茎内部拔节的发生,还原糖含量明显增加,表明鳞片的代谢性养分供给加速,这与此时鳞片中淀粉含量大幅下降是相关联的。
2.2 不同发育时期鳞茎的淀粉粒扫描电镜比较研究
在百合4个时期取鳞茎的中层鳞片,用扫描电镜观察百合鳞片中细胞的亚显微结构,可清楚地看到淀粉粒形态和分布变化。从图3(1-4)可以看出中层鳞片维管束细胞中淀粉粒的整体状态,栽种期的鳞茎有部分淀粉粒游离在细胞腔内,并且有絮状物包裹。随着鳞茎的生长发育,淀粉颗粒变大,开始逐步充满整个细胞腔,絮状物减少。到了拔节期,淀粉颗粒出现各种变形、凹陷、脱落,而抽薹期腔体空隙变大,小颗粒增多,颗粒表面及腔体内壁均出现大量泡状突起或是絮状物。
![]() 图 3 百合鳞茎抽薹过程中淀粉粒的SEM图像注:1~4. 膨大期(1)、成熟期(2)、萌动期(6)、抽薹期(4)百合中层鳞片淀粉粒的整体状态(×150);5. 膨大期鳞片淀粉粒与絮状物共存(×500);6. 成熟期鳞片淀粉粒(×500);7. 萌动期鳞片淀粉粒出现形态变异(×500);8. 抽薹期鳞片淀粉颗粒表面及腔体内壁出现大量泡状突起(×500);9. 成熟期鳞片单个淀粉粒(×2 000);10. 萌动期鳞片单个淀粉粒(×1 500); 11. 抽薹期鳞片单个淀粉粒(×4 500);12. 抽薹期鳞片出现淀粉粒呈撕裂状(×500)。Figure 3. SEM images of starch granules in bolting lily budsNote: 1-4. Whole starch granules in mid-layer scales of lily bulb at expanding stage (1), mature stage (2), germination stage (3), and bolting stage (4) (×150); 5. Starch granules and flocs at expanding stage (×500); 6. Starch granules at mature stage (×500); 7. Morphological variations of starch granules at germination stage (×500); 8. Surface and vesicular protuberances on surface and inner wall of starch granules at bolting stage (×500); 9. Individual starch granule at mature stage (×2 000); 10. Individual starch granule at germination stage (×1 500); 11. Individual starch granule at bolting stage (×4 500); 12. Torn starch granules at bolting stage (×500).
图 3 百合鳞茎抽薹过程中淀粉粒的SEM图像注:1~4. 膨大期(1)、成熟期(2)、萌动期(6)、抽薹期(4)百合中层鳞片淀粉粒的整体状态(×150);5. 膨大期鳞片淀粉粒与絮状物共存(×500);6. 成熟期鳞片淀粉粒(×500);7. 萌动期鳞片淀粉粒出现形态变异(×500);8. 抽薹期鳞片淀粉颗粒表面及腔体内壁出现大量泡状突起(×500);9. 成熟期鳞片单个淀粉粒(×2 000);10. 萌动期鳞片单个淀粉粒(×1 500); 11. 抽薹期鳞片单个淀粉粒(×4 500);12. 抽薹期鳞片出现淀粉粒呈撕裂状(×500)。Figure 3. SEM images of starch granules in bolting lily budsNote: 1-4. Whole starch granules in mid-layer scales of lily bulb at expanding stage (1), mature stage (2), germination stage (3), and bolting stage (4) (×150); 5. Starch granules and flocs at expanding stage (×500); 6. Starch granules at mature stage (×500); 7. Morphological variations of starch granules at germination stage (×500); 8. Surface and vesicular protuberances on surface and inner wall of starch granules at bolting stage (×500); 9. Individual starch granule at mature stage (×2 000); 10. Individual starch granule at germination stage (×1 500); 11. Individual starch granule at bolting stage (×4 500); 12. Torn starch granules at bolting stage (×500).同时,研究发现百合鳞茎细胞含有3种淀粉粒:A型(大粒)淀粉粒长轴直径≥50 μm,B型(中粒)20 μm≤长轴直径<50 μm,C型(小粒)长轴直径<20 μm(图3,5-12,表2)。
表 2 百合抽薹过程中淀粉粒特性比较Table 2. Characteristics of starch granules of bolting lily bulbs时期
Period淀粉粒类型
Type of starch granule长轴
Long axis(L)短轴
Short axis(S)L/S 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 膨大期
Expanding stageA 52.81-58.94 55.87 c 36.14-37.42 36.78 b 1.46-1.58 1.52 b B 31.15-39.58 35.03 a 17.86-33.32 24.22 ab 1.16-1.88 1.45 a 成熟期
Mature stageA 52.28-63.40 58.34 b 36.33-49.42 43.00 a 1.24-1.63 1.37 c B 21.08-48.68 35.60 a 14.01-36.52 25.37 a 1.21-2.25 1.50 a 萌动期
Germination stageA 53.03-68.90 61.48 a 24.79-43.30 35.98 b 1.47-2.42 1.77 a B 22.00-49.66 29.49 b 17.28-35.92 21.59 b 1.19-1.59 1.36 b C 16.74-18.34 17.54 b 13.96-14.42 14.19 a 1.20-1.27 1.24 a 抽薹期
Bolting stageB 23.20-46.43 34.29 ab 19.70-34.40 25.82 a 1.15-1.61 1.33 b C 17.62-19.58 18.60 a 13.82-15.50 14.66 a 1.26-1.28 1.27 a 注:不同类型淀粉粒进行方差分析,不同小写字母表示差异显著(P<0.05),相同字母者表示差异不显著(P>0.05)。
Note: Variance analysis of different types of starch grains, different lowercase letters indicate significant differences(P <0.05), the same letters indicate that the difference is not significant(P >0.05).(1)膨大期:包含A型和B型淀粉粒。A型淀粉粒平均大小为55.87 μm×36.78 μm,淀粉颗粒较大,呈椭圆型,淀粉粒表面粘连着丰富的絮状粘丝。在A型淀粉粒周围有部分B型淀粉粒分布,淀粉粒之间有空隙,排列较松散,平均大小为35.03 μm×24.22 μm。
(2)成熟期:包含A型和B型淀粉粒。A型淀粉粒排列较为紧密,呈菱形和椭圆型,颗粒间絮状粘丝减少,淀粉粒平均为58.34 μm×43.00 μm,B型淀粉粒少量游离于A型淀粉粒周边,平均为35.60 μm×25.37 μm。相比膨大期A型淀粉颗粒增幅显著,颗粒变大,且数量增多,这与淀粉含量测定结果相符。
(3)萌动期:包含A、B、C3种类型淀粉粒,C型小粒开始出现。腔体内淀粉颗粒总体排列松散,A型淀粉粒出现异形、凹陷或是拉伸(图3-7、10),长短轴比(L/S)达最大(1.77),淀粉粒大小平均为61.48 μm×35.98 μm,因此在萌动期淀粉大颗粒长轴被拉伸,短轴减小,淀粉颗粒被逐渐拆分。B型淀粉粒多为圆型或椭圆型,平均为29.49 μm×21.59 μm,淀粒颗粒显著减小。与此同时,近圆型的C型颗粒少量出现,平均为17.54 μm×14.19 μm,长短轴比(L/S)达最小(1.24)。此时的淀粉含量测定也发现萌动期百合鳞片中的淀粉含量相比膨大期和成熟期显著下降,淀粉不断被降解。
(4)抽薹期:包含B型和C型淀粉粒,A型淀粉粒消失。腔体内排列着较为紧密的B型淀粉粒,平均为34.29 μm×25.82 μm,C型淀粉粒在其周围游离分布,平均为18.60 μm×14.66 μm。B、C型颗粒表面均出现大量泡状突起,小颗粒可见以这种“出芽”(图3-11)的方式长出。抽薹期A型淀粉粒消失,B型淀粉粒相比萌动期显著增大,可以判断百合鳞茎抽薹过程中A型淀粉粒被分解为B型淀粉粒,为百合抽薹提供能量。同时,笔者在抽薹期还发现部分大量包裹絮状物的淀粉粒,观察发现其中1个C型淀粉粒呈撕裂状(图3-12)。并伴有絮状物,且极小淀粉粒形成之初都有大量絮状物包裹(图3-13),因此淀粉粒形成是否与絮状物有关,絮状物是何成分有待进一步研究。
2.3 淀粉分解与合成关键酶基因表达分析
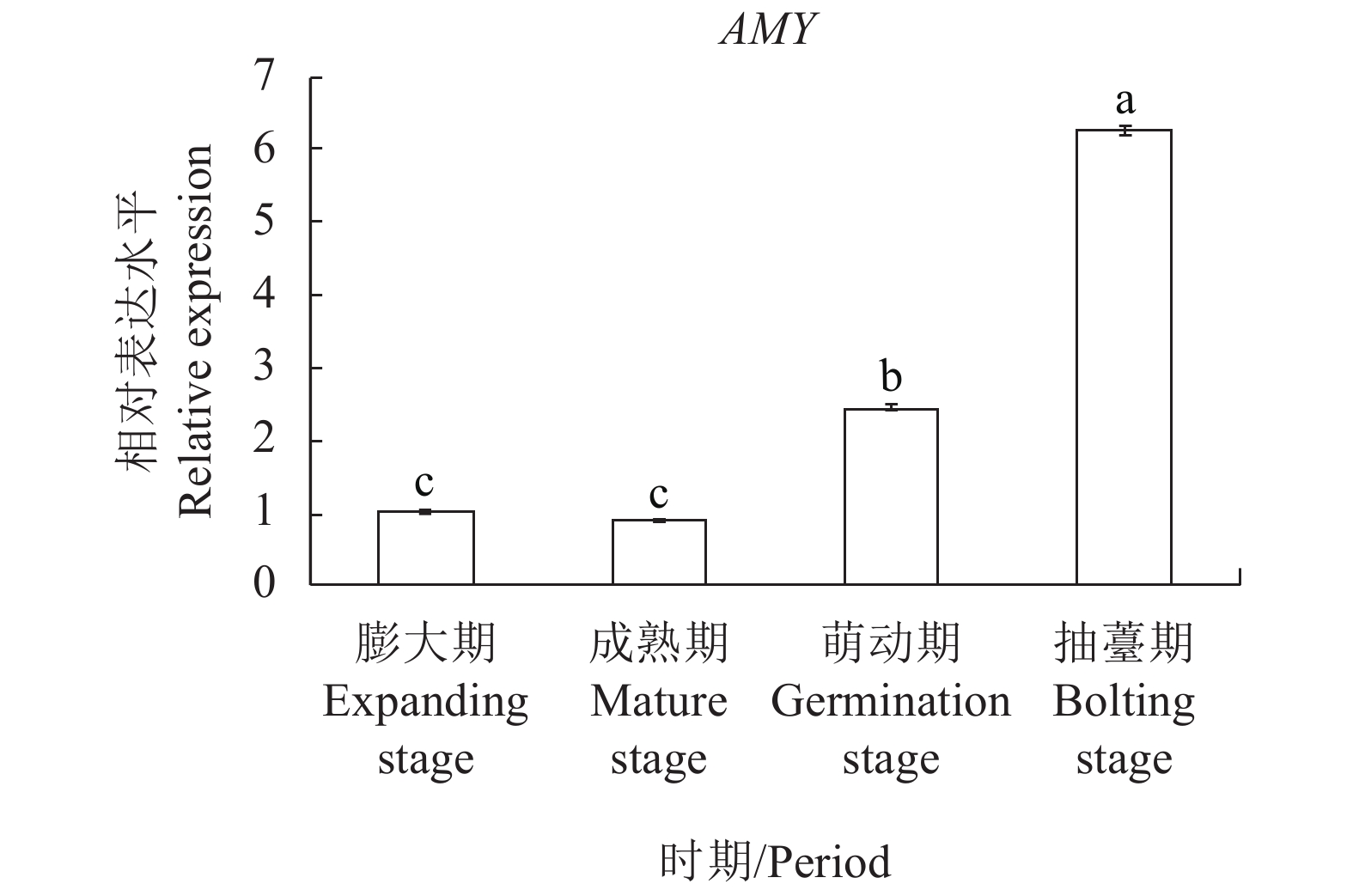
由图4可知,百合鳞茎淀粉分解酶基因AMY在成熟期的表达量与膨大期并无显著性差异且略有下调,萌动期与抽薹期的AMY基因高度表达,分别约为膨大期的2.4倍和6.2倍,该结果与不同时期的百合淀粉含量与还原糖含量变化趋势相符。淀粉分解酶基因AMY集中在萌动期与抽薹期高度表达,α-淀粉酶将大量淀粉分解为还原糖和蔗糖,为百合种球二次抽薹的启动提供能量来源。
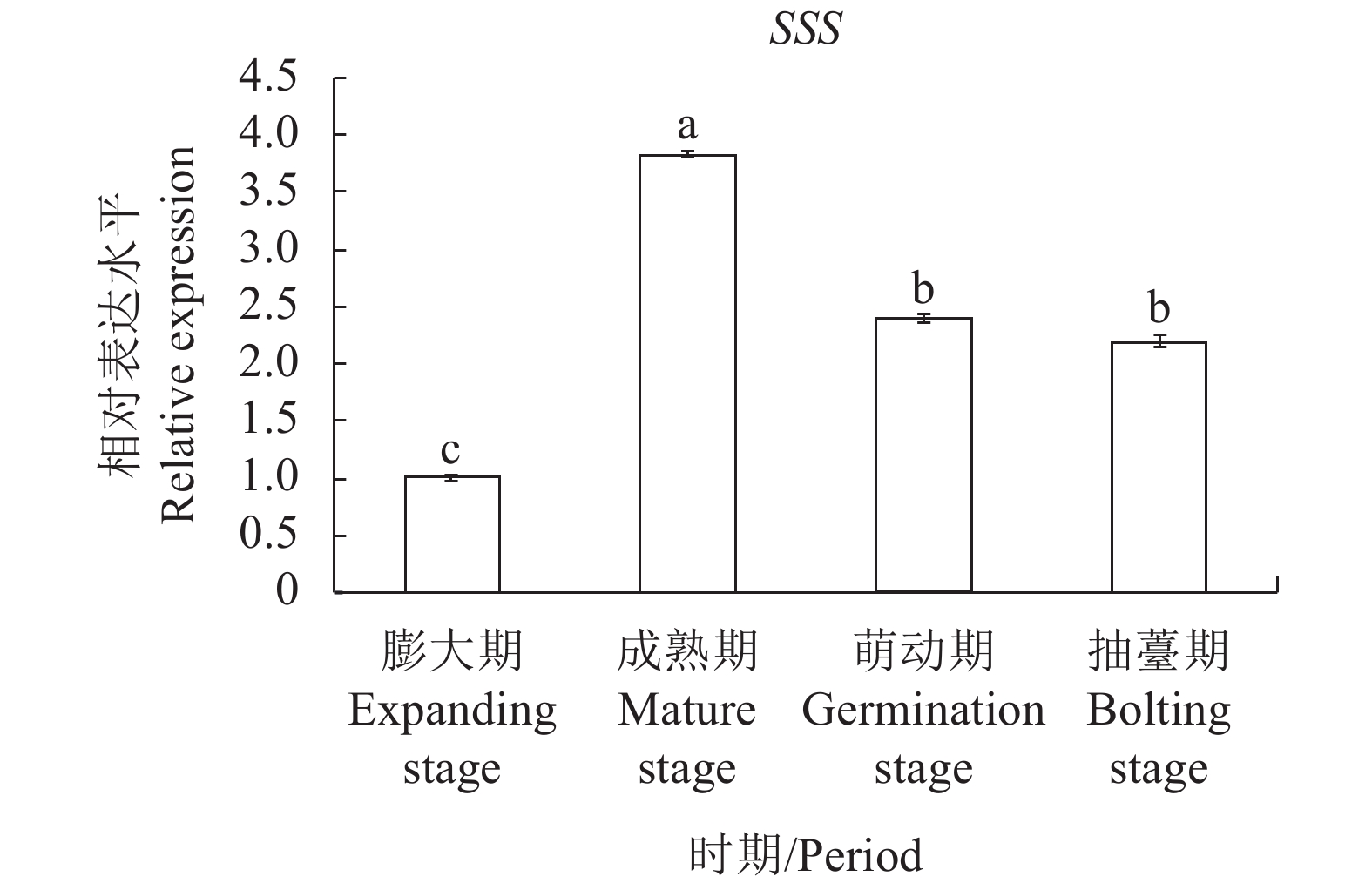
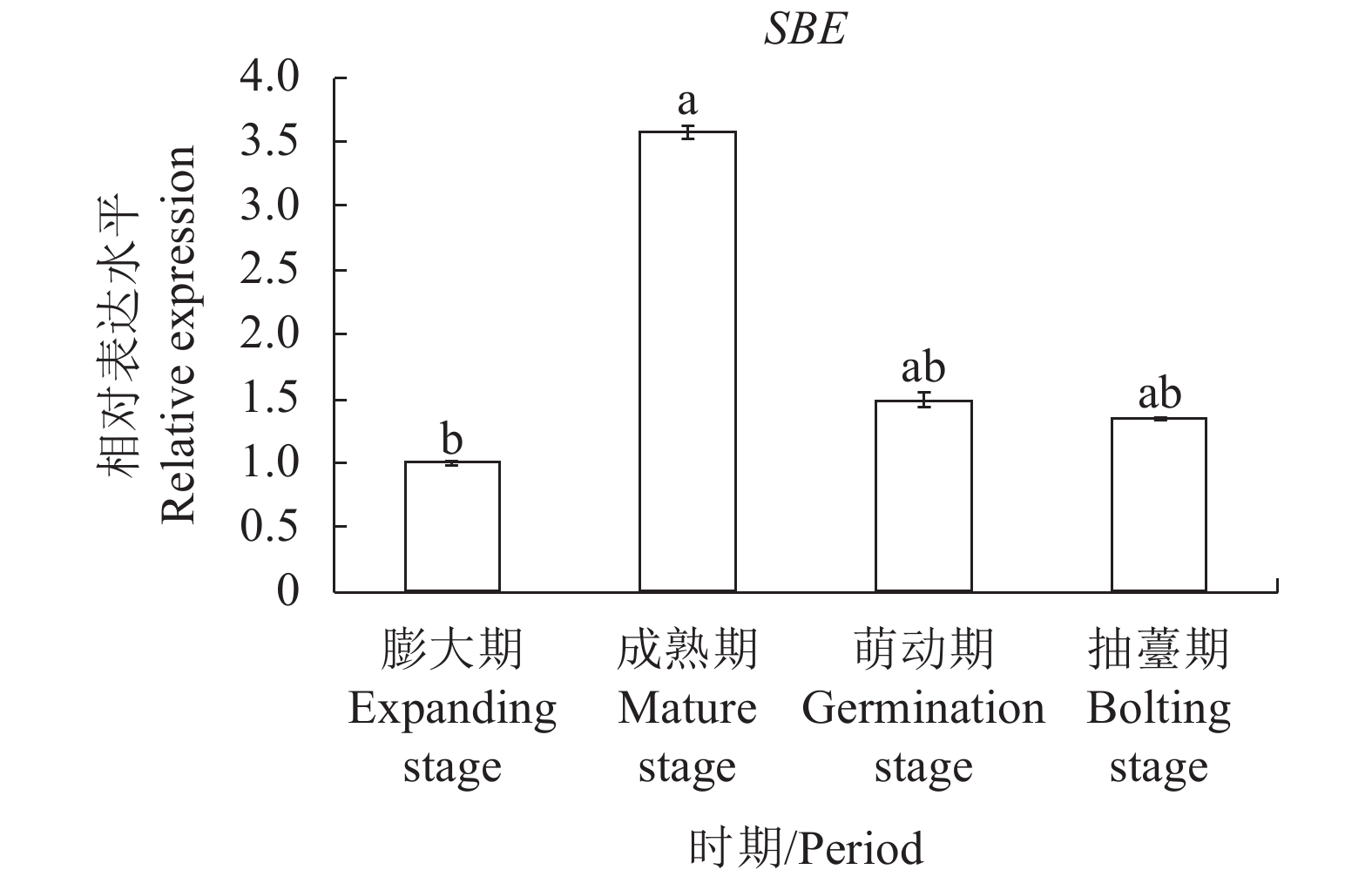
由图5-6可知,百合鳞茎淀粉合成酶关键酶基因SSS和SBE在成熟期表达水平最高,进入萌动期后表达强度出现显著性逐渐减弱,基因表达水平变化趋势与不同时期的百合淀粉含量变化趋势一致。在种球成熟期阶段,淀粉合成酶关键基因SSS和SBE高度表达,该时期百合种球内部大量养分以合成淀粉的形式进行储藏。
3. 讨论
3.1 淀粉和还原糖含量与百合抽薹的关系
孙红梅等[12]研究发现,亚洲系‘精粹’百合和兰州百合在出苗阶段淀粉含量下降,而在花后期达最大值,分别为28.64%和21.70%;还原糖含量则在花后期出现最小值。霍昱璟[13]证明,东方百合鳞茎在花芽分化时期中淀粉含量变化显著,其含量随着花芽分化的过程逐渐降低;夏宜平等[14]测定表明,从栽种期到含苞期,东方百合淀粉含量均下降,至盛花期后逐渐上升,而去花苞处理的淀粉含量高于未去花苞的处理。本研究针对百合种球二次抽薹现象前后不同时期中的淀粉和还原糖进行测定,结果表明,在萌动期百合淀粉含量迅速下降了4.98%,与之相对,还原糖含量显著增加,达11.3%。萌动期淀粉和还原糖含量的变化与前人的研究相符,当百合鳞茎发生形态变化时,内部淀粉分解为糖类,参于新陈代谢,为植株提供能量来源。
3.2 淀粉粒的形态特征变化以及与百合抽薹代谢的关系
近几年,对百合淀粉粒的研究主要有关花芽分化[15]、低温贮藏[16-17]、鳞茎更新发育[14]和不同培养方式[18],其中对淀粉粒显微结构变化的描述较为笼统,未进行几何特性的系统分析和分类,因而对百合形态变化过程中淀粉粒的分化、产生以及形态变异阐述不清晰。本研究对百合抽薹过程中的淀粉粒进行分析发现,百合鳞茎细胞含有3种淀粉粒:A型(大粒)淀粉粒长轴直径≥50 μm,B型(中粒)20 μm≤长轴直径<50 μm,C型(小粒)长轴直径<20 μm。膨大期和成熟期包含A型和B型淀粉粒,C型小淀粉粒在萌动期开始出现,而到了抽薹期A型大淀粉粒消失。萌动期A型淀粉粒出现异形、凹陷或是拉伸,长短轴比(L/S)达最大(1.77),变异度显著增大,而抽薹期A型淀粉粒消失不见,取而代之的是大量的B型和C型淀粉粒,且B型淀粉粒相比萌动期显著增大,可以判断百合鳞茎抽薹期中的部分B型淀粉粒是由A型淀粉粒分解而来,淀粉粒的分解为百合抽薹提供能量,这与前面的淀粉和还原糖含量变化测定结果一致。韦存虚等[19]对小麦胚乳淀粉粒的结构观察表明大淀粉粒的淀粉体通过缢缩进行增殖和分化,而百合鳞茎中是成熟的籽粒,不存在淀粉体,大淀粉粒很可能是以自身的拉伸变形来完成增殖和分化。邢世岩等[20]对叶籽银杏淀粉粒特性进行研究发现其中粒和小粒淀粉粒明显可见以“出芽”方式从大淀粉粒上长出。本研究结果显示,抽薹期B、C型颗粒表面均出现大量泡状突起似“出芽”,而其中一个C型淀粉粒又呈撕裂状,极小淀粉粒形成之初都有大量絮状物包裹,因此,小颗粒是以这种“出芽”的方式从大淀粉粒上长出或是通过拉伸撕裂的方式产生尚不明确。
3.3 淀粉代谢相关酶与百合鳞茎生长发育的关系
碳水化合物是植物体内非常重要的物质,一方面它是植物体内非常重要的组成成分,另一方面它参与新陈代谢,为植物提供能量来源,其组成形式及含量的变化影响着植物的生长发育[21]。淀粉作为百合鳞茎内主要的贮藏物质,百合的整个生长发育过程其实就是淀粉代谢的过程[22]。淀粉酶活性的强弱反应了植物体内碳水化合物的代谢状况,与植物生长发育密切相关。吴沙沙[23]的研究指出淀粉合成酶(可溶性淀粉合成酶)SSS可以作为百合鳞茎源或库功能的指标。杨春起[24]通过高通量转录组测序技术揭示了α-淀粉酶参与了种球的休眠解除。李雪艳等[25]对小鳞茎形成与发育转录组进行分析表明在生物学代谢过程中参与的基因最多,其中主要是淀粉-蔗糖代谢,并且验证了淀粉合成酶(可溶性淀粉合成酶)基因SSS、淀粉分支酶基因SBE等参与了小鳞茎生长发育的过程。结合前人的研究,用淀粉合成酶基因SSS、SBE和淀粉分解酶基因AMY针对反季节种球繁育过程中出现的二次抽薹现象进行表达量相对分析,能够直观反映出该过程淀粉酶活性变化,同时揭示二次抽薹现象出现的过程中,前期淀粉以合成为主储藏养分于种球之中,后期淀粉以分解为主,为二次抽薹提供能量来源。
4. 结论
本研究结果表明,百合种球反季节繁育过程中出现二次抽薹的现象,其能量来源于种球内部淀粉的消解。在种球膨大期到成熟期之间,测量的淀粉含量呈上升趋势,还原糖含量呈下降趋势,电镜观察显示A型淀粉颗粒增幅显著,颗粒变大,且数量增多,淀粉合成酶SSS、SBE高度表达,淀粉代谢形式以合成为主,种球汲取大量养分;在种球成熟期到萌动期之间,测定的淀粉含量大幅下降,还原糖含量大幅上升,电镜观察显示C型淀粉粒出现,A型淀粉粒被拆分,B型淀粉粒颗粒变小,淀粉分解酶基因AMY高度表达,淀粉代谢形式以消解为主,种球贮藏的养分被释放;在种球萌动期到抽薹期之间,测定的淀粉含量呈下降趋势,还原糖含量呈上升趋势,电镜观察显示A型淀粉粒消失,淀粉分解酶基因AMY表达水平提高,淀粉代谢形式以消解为主,种球贮藏的养分被充分释放。二次抽薹现象的出现消耗了种球内部大量的养分不利于种球下一季的生长,对商品球的质量和鲜切花的品质造成不利影响。为消解此现象带来的不利因素,种球反季节繁育过程当中应注重把握成熟种球的收储时间,以亚热带平原地区的气候条件为参考,夏季5月份上旬为成熟期种球的最佳采收时间。
-
图 3 百合鳞茎抽薹过程中淀粉粒的SEM图像
注:1~4. 膨大期(1)、成熟期(2)、萌动期(6)、抽薹期(4)百合中层鳞片淀粉粒的整体状态(×150);5. 膨大期鳞片淀粉粒与絮状物共存(×500);6. 成熟期鳞片淀粉粒(×500);7. 萌动期鳞片淀粉粒出现形态变异(×500);8. 抽薹期鳞片淀粉颗粒表面及腔体内壁出现大量泡状突起(×500);9. 成熟期鳞片单个淀粉粒(×2 000);10. 萌动期鳞片单个淀粉粒(×1 500); 11. 抽薹期鳞片单个淀粉粒(×4 500);12. 抽薹期鳞片出现淀粉粒呈撕裂状(×500)。
Figure 3. SEM images of starch granules in bolting lily buds
Note: 1-4. Whole starch granules in mid-layer scales of lily bulb at expanding stage (1), mature stage (2), germination stage (3), and bolting stage (4) (×150); 5. Starch granules and flocs at expanding stage (×500); 6. Starch granules at mature stage (×500); 7. Morphological variations of starch granules at germination stage (×500); 8. Surface and vesicular protuberances on surface and inner wall of starch granules at bolting stage (×500); 9. Individual starch granule at mature stage (×2 000); 10. Individual starch granule at germination stage (×1 500); 11. Individual starch granule at bolting stage (×4 500); 12. Torn starch granules at bolting stage (×500).
表 1 引物序列及内参基因信息
Table 1 Genes and primer sets used in qRT-PCR analysis
基因名称
Gene name引物序列(5′–3′)
Primer sequence长度 Length/bp AMY F: GGGATATTCAGCAGAAATGGCGAAG 130 R: GCGGTTGGCATCTTGATTGTAGAGT SSS F: GTCAACGATTGGCACGCAAGTCT 171 R: ACCATACCACTCAGAGGGCAAGC SBE F: AGCAGCGGAGCGTCGTTAATCT 213 R: CCTGAGAGTCTTCAGCAGCCACT ACTIN F: GTCTGCGACAATGGTACTGGAATG 149 R: GCCTCATCACCAACATAAGCATCTT 注:F:正向引物;R:反向引物。
Note: F, forward primer; R, reverse primer.表 2 百合抽薹过程中淀粉粒特性比较
Table 2 Characteristics of starch granules of bolting lily bulbs
时期
Period淀粉粒类型
Type of starch granule长轴
Long axis(L)短轴
Short axis(S)L/S 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 膨大期
Expanding stageA 52.81-58.94 55.87 c 36.14-37.42 36.78 b 1.46-1.58 1.52 b B 31.15-39.58 35.03 a 17.86-33.32 24.22 ab 1.16-1.88 1.45 a 成熟期
Mature stageA 52.28-63.40 58.34 b 36.33-49.42 43.00 a 1.24-1.63 1.37 c B 21.08-48.68 35.60 a 14.01-36.52 25.37 a 1.21-2.25 1.50 a 萌动期
Germination stageA 53.03-68.90 61.48 a 24.79-43.30 35.98 b 1.47-2.42 1.77 a B 22.00-49.66 29.49 b 17.28-35.92 21.59 b 1.19-1.59 1.36 b C 16.74-18.34 17.54 b 13.96-14.42 14.19 a 1.20-1.27 1.24 a 抽薹期
Bolting stageB 23.20-46.43 34.29 ab 19.70-34.40 25.82 a 1.15-1.61 1.33 b C 17.62-19.58 18.60 a 13.82-15.50 14.66 a 1.26-1.28 1.27 a 注:不同类型淀粉粒进行方差分析,不同小写字母表示差异显著(P<0.05),相同字母者表示差异不显著(P>0.05)。
Note: Variance analysis of different types of starch grains, different lowercase letters indicate significant differences(P <0.05), the same letters indicate that the difference is not significant(P >0.05). -
[1] 王超, 王文和, 赵祥云, 等. 百合病毒脱除技术研究 [J]. 北京农学院学报, 2012, 27(4):25−28. DOI: 10.3969/j.issn.1002-3186.2012.04.008 WANG C, WANG W H, ZHAO X Y, et al. Virus elimination of lily [J]. Journal of Beijing University of Agriculture, 2012, 27(4): 25−28.(in Chinese) DOI: 10.3969/j.issn.1002-3186.2012.04.008
[2] 钟海丰, 黄宇翔, 邓朝生, 等. 东方百合快繁培养基优化与脱毒技术研究 [J]. 中国农学通报, 2009, 25(17):168−173. ZHONG H F, HUANG Y X, DENG Z S, et al. Medium optimization of rapid propagation and viruses elimination techniques of oriental lily [J]. Chinese Agricultural Science Bulletin, 2009, 25(17): 168−173.(in Chinese)
[3] 朱志国. 百合试管鳞茎诱导技术研究 [J]. 浙江农业学报, 2013, 25(5):971−974. DOI: 10.3969/j.issn.1004-1524.2013.05.11 ZHU Z G. Induction technology of lily bulb in tube [J]. Acta Agricultura Zhejiangensis, 2013, 25(5): 971−974.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2013.05.11
[4] 王亚婷, 王有兵, 铁筱睿, 等. IBA、B12及纵切对东方百合‘索邦’鳞片扦插繁殖的影响 [J]. 中国农学通报, 2014, 30(25):231−234. DOI: 10.11924/j.issn.1000-6850.2014-0970 WANG Y T, WANG Y B, TIE X R, et al. Effects of IBA, B12 and cutting ways on the cutting propagation of Lilium oriental hybrids 'Sorbonne' [J]. Chinese Agricultural Science Bulletin, 2014, 30(25): 231−234.(in Chinese) DOI: 10.11924/j.issn.1000-6850.2014-0970
[5] 黄宇翔, 陈华, 刘金燕, 等. 东方百合鳞片扦插繁殖研究 [J]. 中国农学通报, 2005, 21(10):273−275. DOI: 10.3969/j.issn.1000-6850.2005.10.076 HUANG Y X, CHEN H, LIU J Y, et al. Study on cutting propagation of bud scale of oriental hybrid lily [J]. Chinese Agricultural Science Bulletin, 2005, 21(10): 273−275.(in Chinese) DOI: 10.3969/j.issn.1000-6850.2005.10.076
[6] 孙红梅, 秦琦, 谢佳, 等. 激素和变温处理对东方百合扦插鳞片中糖含量的影响 [J]. 沈阳农业大学学报, 2012, 43(2):153−158. DOI: 10.3969/j.issn.1000-1700.2012.02.005 SUN H M, QIN Q, XIE J, et al. Effect of plant regulators and alternating temperature treatment on carbohydrate content during scale cutting in Lilium oriental hybrid [J]. Journal of Shenyang Agricultural University, 2012, 43(2): 153−158.(in Chinese) DOI: 10.3969/j.issn.1000-1700.2012.02.005
[7] 黄彦玮, 师桂英, 李谋强, 等. 外源GA3、ABA对低温冷藏兰州百合种球萌发的促抑效应及种球碳水化合物变化研究 [J]. 甘肃农业大学学报, 2016, 51(1):55−61. DOI: 10.3969/j.issn.1003-4315.2016.01.011 HUANG Y W, SHI G Y, LI M Q, et al. Effect of exogenous GA3, ABA on bulb germination of Lanzhou lily bulbs and its carbohydrate changes during cool storage [J]. Journal of Gansu Agricultural University, 2016, 51(1): 55−61.(in Chinese) DOI: 10.3969/j.issn.1003-4315.2016.01.011
[8] 侯玲玲, 夏宜平, 何桂芳. 低温作用影响百合鳞茎休眠的研究进展 [J]. 青海大学学报(自然科学版), 2006, 24(5):60−62. DOI: 10.3969/j.issn.1006-8996.2006.05.019 HOU L L, XIA Y P, HE G F. Advances in effects of low temperature on bulb dormancy in Lilium spp [J]. Journal of Qinghai University, 2006, 24(5): 60−62.(in Chinese) DOI: 10.3969/j.issn.1006-8996.2006.05.019
[9] 王莹, 王良桂, 黄成名, 等. 露地栽培条件下百合的生长规律及种球繁殖技术 [J]. 中国农业科学, 2014, 47(8):1558−1566. DOI: 10.3864/j.issn.0578-1752.2014.08.012 WANG Y, WANG L G, HUANG C M, et al. Growth regularity and bulb propagation techniques of lilies in open field [J]. Scientia Agricultura Sinica, 2014, 47(8): 1558−1566.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2014.08.012
[10] 苗振, 缑辉, 钱振权, 等. 温度对百合种球催芽生根的影响 [J]. 西南林业大学学报, 2014, 34(3):32−35. DOI: 10.3969/j.issn.2095-1914.2014.03.006 MIAO Z, GOU H, QIAN Z Q, et al. Effects of temperature on root-forcing and budding treatment of lily bulbs [J]. Journal of Southwest Forestry University, 2014, 34(3): 32−35.(in Chinese) DOI: 10.3969/j.issn.2095-1914.2014.03.006
[11] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔC T method [J]. Methods, 2001, 25(4): 402−408. DOI: 10.1006/meth.2001.1262
[12] 孙红梅, 李天来, 李云飞. 百合鳞茎发育过程中碳水化合物含量及淀粉酶活性变化 [J]. 植物研究, 2005, 25(1):59−63. DOI: 10.3969/j.issn.1673-5102.2005.01.019 SUN H M, LI T L, LI Y F. Changes of carbohydrate and amylase in lily bulb during bulb development [J]. Bulletin of Botanical Research, 2005, 25(1): 59−63.(in Chinese) DOI: 10.3969/j.issn.1673-5102.2005.01.019
[13] 霍昱璟. 东方百合的花芽分化机理研究[D]. 福州: 福建农林大学, 2014. HUO Y J. Study on the flower bud differentiation mechanism of oriental lily[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. (in Chinese)
[14] 夏宜平, 郑慧俊, 黄春辉, 等. 东方百合鳞茎更新发育的碳同化物积累与分配 [J]. 核农学报, 2006, 20(5):417−422. DOI: 10.3969/j.issn.1000-8551.2006.05.018 XIA Y P, ZHENG H J, HUANG C H, et al. Accumulation and distribution of C14 photosynthate during bulb development of lilium oriental hybrid [J]. Journal of Nuclear Agricultural Sciences, 2006, 20(5): 417−422.(in Chinese) DOI: 10.3969/j.issn.1000-8551.2006.05.018
[15] 宁云芬, 龙明华, 陶劲, 等. 百合低温贮藏和花芽分化过程中鳞片细胞淀粉粒的显微观察 [J]. 园艺学报, 2011, 38(9):1770−1774. NING Y F, LONG M H, TAO J, et al. Microscopic observation of starch grains in the middle scales of Lilium formolongi during low temperature storage and flower bud differentiation [J]. Acta Horticulturae Sinica, 2011, 38(9): 1770−1774.(in Chinese)
[16] 张月, 孙红梅, 沈向群, 等. 百合鳞茎发育和低温贮藏过程中淀粉粒亚显微结构的变化 [J]. 园艺学报, 2007, 34(3):699−704. DOI: 10.3321/j.issn:0513-353x.2007.03.029 ZHANG Y, SUN H M, SHEN X Q, et al. Changes in ultra-structure of starch granule in the middle scales of Lilium davidii var. unicolor during the bulb development and storage at low temperature [J]. Acta Horticulturae Sinica, 2007, 34(3): 699−704.(in Chinese) DOI: 10.3321/j.issn:0513-353x.2007.03.029
[17] 刘芳, 田忠平, 蔡英杰, 等. 细叶百合低温解除休眠过程中鳞茎细胞淀粉粒及花芽分化的变化 [J]. 草业学报, 2015, 24(9):154−162. DOI: 10.11686/cyxb2014428 LIU F, TIAN Z P, CAI Y J, et al. Change in starch grains and flower bud differentiation of Lilium pumilum bulbs during breaking of dormancy under refrigerated conditions [J]. Acta Prataculturae Sinica, 2015, 24(9): 154−162.(in Chinese) DOI: 10.11686/cyxb2014428
[18] 蔡宣梅, 郭文杰, 欧阳桐娇, 等. 东方百合不同培养方式鳞茎淀粉粒亚显微结构比较研究 [J]. 中国农学通报, 2014, 30(4):148−151. DOI: 10.11924/j.issn.1000-6850.2013-1657 CAI X M, GUO W J, OUYANG T J, et al. Comparison of different culture methods in ultra-structure of starch granules of oriental hybrid lily [J]. Chinese Agricultural Science Bulletin, 2014, 30(4): 148−151.(in Chinese) DOI: 10.11924/j.issn.1000-6850.2013-1657
[19] 韦存虚, 张军, 周卫东, 等. 小麦胚乳小淀粉粒是复粒淀粉的结构观察 [J]. 麦类作物学报, 2008, 28(5):804−810. WEI C X, ZHANG J, ZHOU W D, et al. Ultrastructural observation on the development of small starch granule (compound starch granule) of wheat endosperm [J]. Journal of Triticeae Crops, 2008, 28(5): 804−810.(in Chinese)
[20] 邢世岩, 李士美, 韩晨静, 等. 叶籽银杏胚乳淀粉特性及其系统学意义 [J]. 园艺学报, 2010, 37(3):345−354. XING S Y, LI S M, HAN C J, et al. Comparison on starch characters in endosperm of Ginkgo biloba var. epiphylla mak. and its systematic significance [J]. Acta Horticulturae Sinica, 2010, 37(3): 345−354.(in Chinese)
[21] CLEMENT C, BURRUS M, AUDRAN J C. Floral organ growth and carbohydrate content during pollen development in lilium [J]. American Journal of Botany, 1996, 83(4): 459. DOI: 10.1002/j.1537-2197.1996.tb12727.x
[22] 王祥宁, 熊丽, 吴学尉, 等. 淀粉糖化与东方百合鳞片分生小鳞茎的关系 [J]. 西南农业学报, 2007, 20(1):115−119. DOI: 10.3969/j.issn.1001-4829.2007.01.028 WANG X N, XIONG L, WU X W, et al. Relationship between starch saccharification and propagation of bulblets from scales in oriental hybrid Lily(Lilium L.) [J]. Southwest China Journal of Agricultural Sciences, 2007, 20(1): 115−119.(in Chinese) DOI: 10.3969/j.issn.1001-4829.2007.01.028
[23] 吴沙沙. 东方百合‘索邦’鳞茎源-库转换规律研究[D]. 北京: 北京林业大学, 2012. WU S S. Rules of source-sink exchange of the bulb of oriental lily 'Sorbonne'[D]. Beijing: Beijing Forestry University, 2012. (in Chinese)
[24] 杨春起. 百合种球生产关键技术与休眠解除中碳水化合物代谢机理研究[D]. 北京: 中国农业大学, 2016. YANG C Q. Study on key technology of bulb production and role of carbohydrate metabolism in bulb dormancy release in lily[D]. Beijing: China Agricultural University, 2016. (in Chinese)
[25] LI X Y, WANG C X, CHENG J Y, et al. Transcriptome analysis of carbohydrate metabolism during bulblet formation and development in Lilium davidii var. unicolor [J]. BMC Plant Biology, 2014, 14: 358. DOI: 10.1186/s12870-014-0358-4
-
期刊类型引用(1)
1. 青亚林,侯炳豪,张宇航,曾珊珊,高婷,叶乃兴. 茶树GATA基因家族的全基因组鉴定及表达分析. 江苏农业科学. 2024(09): 42-50 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: