Microbial Community and Diversity in Specialty Teas from Fujian
-
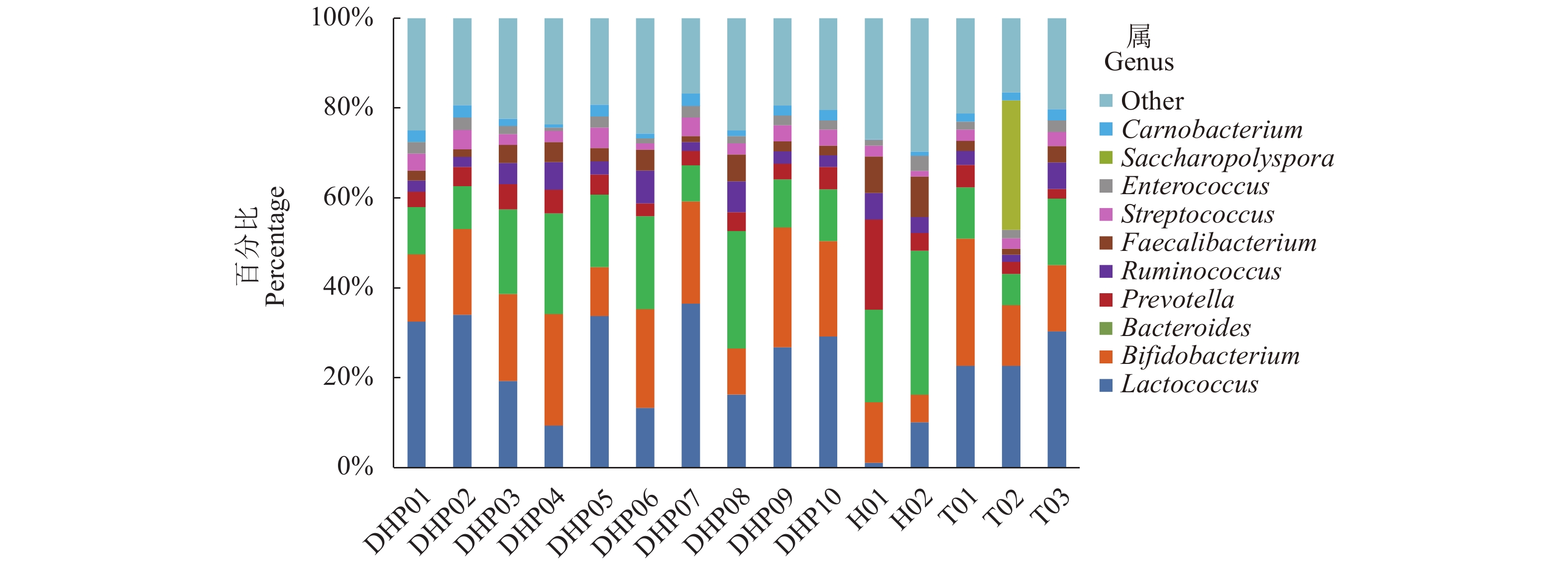
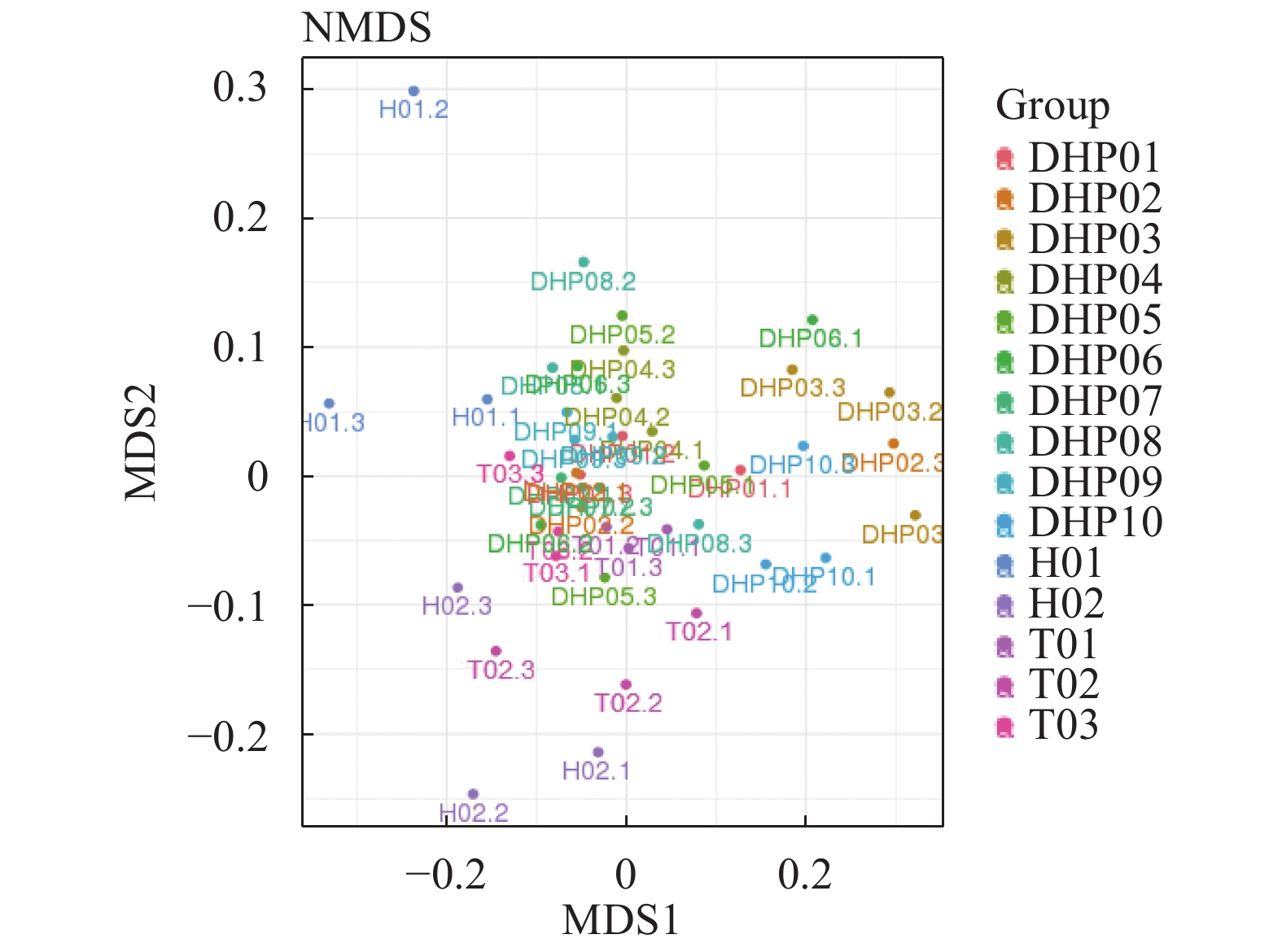
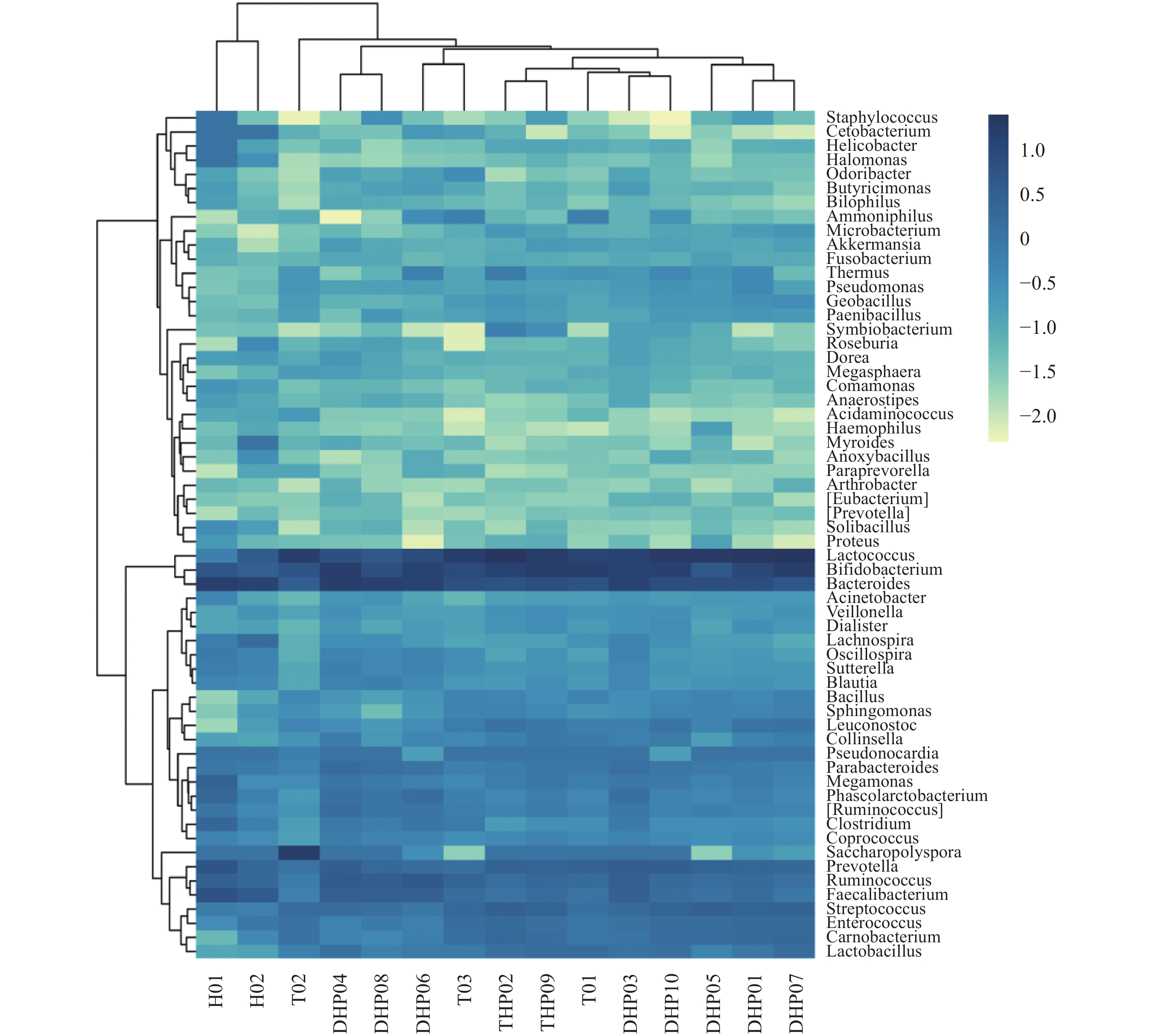
摘要:目的 探明福建特色茶叶中的细菌群落结构特征,以及细菌群落结构在不同种类茶叶间的分布情况。方法 采集福建特色茶叶大红袍、铁观音、花茶共15组样品,通过16S rRNA高通量测序,对不同种类茶叶中细菌的群落结构进行解析。结果 经过高通量测序以及统计分析,最终共获得11 472个OTU,包括37个门,95个纲,150个目,207个科,277个属。比较3种茶叶,发现大红袍在物种丰度上要高于铁观音与花茶,花茶的物种多样性要高于大红袍与铁观音,且同为乌龙茶的大红袍与铁观音在细菌群落结构上更为相似。在属水平上,10组大红袍样本中共有的优势属为乳球菌属、双歧杆菌属及拟杆菌属,2组花茶样本中共有的优势属为拟杆菌属,3组铁观音中共有的优势菌属为乳球菌属与双歧杆菌属。其中,丰度前10的优势属中有5个为乳酸菌。通过共现网络分析,表明乳酸菌与其显著相关的大部分物种呈互利生长的关系。结论 大红袍与铁观音的优势菌纲为芽孢杆菌纲和放线菌纲,花茶的优势菌纲为梭状芽胞杆菌纲与拟杆菌纲。比较3种茶叶的细菌群落结构,发现茶叶种类可能是影响细菌群落结构变化的重要因素之一,且乳酸菌在3种茶叶中均为主要优势细菌。Abstract:Objective Diversity and distribution of the microbial communities in the specialty teas produced in Fujian were studied.Method Fifteen groups of well-known local teas in the province were collected for an analysis based on the high-throughput sequencing targeting 16S rRNA gene.Result A total of 11 472 OTUs encompassing 37 phyla, 95 classes, 150 orders, 207 families, and 277 genera were isolated from the specimens. In the 3 categories, Dahongpao had the greatest richness on species; the Huacha was the most diversified; and, as oolong teas, Dahongpao and Tieguanyin had a similar microbial structure. In 10 groups of Dahongpao samples, the dominant genera were Lactococcus, Bifidobacterium, and Bacteroides; that in 2 groups of Huacha, Bacteroides; and those in 3 groups of Tieguanyin, Lactococcus and Bifidobacterium. Five of the top 10 dominant genera in the teas were lactic acid bacteria. According to the co-occurrence analysis on network, the lactic acid bacteria exhibited a synergistic growth relationship with most of the other significantly associated species.Conclusion Bacilli and Actinobacteria were the predominant bacteria found in Dahongpao and Tieguanyin, while Clostridia and Bacteroidia in Huacha. A bacterial taxonomy analysis indicated that tea category differentiated the structure of their bacterial communities. Overall, lactic acid bacteria dominantly existed in these teas produced in Fujian.
-
Keywords:
- tea /
- microbial community structure /
- 16S rRNA /
- high throughput sequencing
-
茶多糖(Tea Polysaccharides, TPs)是一类茶叶中含有的杂多糖复合物,构象繁杂,具有多种生物学活性,如抗氧化、降血糖等[1-3]。其提取制备在传统方法诸如酸碱法、水提醇沉法的基础上,常采用柱层析法纯化,成本高,得率低,限制其产业化推广[4-6]。大量研究报道已经证实,乙醇具有分级纯化富集植物多糖的特性,诸如黄芪[7]、香薷[8]、桑叶[9]等,且易实现工业化生产,成本低廉。
茶叶多糖多采用水提醇沉法制得。前期本课题组研究发现,乙醇可用于辅助提取制备茶叶多糖,即茶叶原料先通过一定浓度的乙醇提取后,实现茶多酚、蛋白质等物质的高浸出,而茶多糖则低浸出,醇提茶渣进一步再通过水相浸提达到茶叶多糖的富集[10]。因此,本研究以清香乌龙茶为原料,通过小规模中试分析比较先65%醇洗+后水提和常规法先水提+后醇沉2种提取方式,以期探究2种制备工艺条件下茶叶多糖与其他物质的分离富集特性,以及粗茶多糖的生物学活性变化,从而为茶叶多糖的工业化量产奠定理论基础。
1. 材料与方法
1.1 材料与设备
清香乌龙茶系福建省农业科学院茶叶研究所自制;粗茶多糖及其分离物在大闽食品(漳州)有限公司制备完成;福林酚(北京索莱宝科技有限公司);儿茶素单体(EGC、EC、C、EGCG、ECG)及咖啡因,纯度均大于98%(阿拉丁生化科技有限公司);芦丁,纯度≥98%(UV)(成都曼思特生物科技有限公司);1, 1-二苯基-2-三硝基苯肼(DPPH,纯度>97.0%) (东京化成工业株式会社);无水乙醇、蒽酮、浓硫酸、葡萄糖等均为分析纯试剂(国药集团上海试剂有限公司)。
T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);BioSpec-nano超微量分光光度计(岛津公司);Agilent1260型液相色谱系统及色谱柱Zorbax SB-C18(美国安捷伦科技有限公司);ACD-0502-U实验室超纯水系统(重庆颐洋企业发展有限公司);DK-8D型电热恒温水浴槽(上海一恒科学仪器有限公司);DHC-9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 试验方法
1.2.1 粗茶多糖及其分离物的提取制备
以自制清香乌龙茶为原料,单批次提取投料量10 kg,参照相关文献报道[10],分别使用2种工艺制备茶叶多糖及分离物(图 1)。工艺1:采用先65%醇洗+后水提的制备方式,分别制得65%乙醇洗取物“TPs-A”,以及醇洗茶渣的水提物粗多糖“TPs-水提”;工艺2:茶叶水提物经浓缩及喷雾干燥得“TPs-B”;水提物经65%乙醇沉淀处理,上清液经浓缩及喷雾干燥,制得“TPs-C”,醇沉物(粗多糖)经分离,制得“TPs-醇沉”。分别称取上述各样品0.100 g,溶于50 mL超纯水后进行茶多糖、蛋白质等项目的定量检测。
1.2.2 茶多糖含量的测定
采用蒽酮-硫酸法[11]测定粗茶多糖及其分离物水溶液中的茶多糖含量。
1.2.3 可溶性蛋白含量的检测[11]
准确移取配制的粗茶多糖及其附属产物水溶液4.0 μL,滴加于BioSpec-nano超微量分光光度(以Cy3标记蛋白)检测位置,设光程0.7 mm、波长280 nm检测可溶性蛋白含量。
1.2.4 茶多酚含量的检测
参照国标GB/T 8313-2008中的福林酚法检测配制的粗茶多糖及其分离物水溶液中的茶多酚含量。
1.2.5 儿茶素及咖啡因的测定
儿茶素及咖啡因的测定采用HPLC法[12],采用TSKgel ODS-100Z色谱柱,流动相为2‰甲酸水溶液(A相)和甲醇(B相),洗脱方式为83%A(0 min)→75%A(5 min)→73%A(7 min)→58%A(16 min)→83%A(18 min),柱温40℃,流速1.0 mL·min-1,检测波长280 nm。
1.2.6 总黄酮含量的检测
采用三氯化铝法[11],分别吸取0.1 mg·mL-1芦丁标准液(50%乙醇配制)0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL于25 mL容量瓶中,加50%乙醇至总体积10.0 mL,依次加入1.5%的AlCl3溶液8.0 mL和醋酸-醋酸钠的缓冲液(0.1 mol·L-1,pH5.5)4.0 mL,并用50%乙醇水溶液定容至25 mL,摇匀,静置30 min后,于415 nm比色测定吸光度值。以吸光度值为纵坐标,以显色液中的芦丁质量(mg)为横坐标,绘制标准曲线并计算线性回归方程。准确移取不同样品液1.0 mL于25 mL容量瓶中,其余步骤按照上述程序添加反应后,415 nm处比色测定。
1.2.7 还原力测定
采用普鲁士蓝法[13],具体步骤有所改进,方法如下:取不同质量浓度(4、8、12、16、20 μg·mL-1)试验样品2.0 mL于试管中,其余步骤参照文献[11]依次加入0.2 mol·L-1磷酸盐缓冲液、1%铁氰化钾溶液、10%的三氯乙酸溶液和0.1%氯化铁溶液,静置反应后于700 nm检测吸光度值的变化。
1.2.8 DPPH自由基清除率测定[14]
取不同质量浓度样品液0.5 mL于试管中,添加无水乙醇至3.0 mL,使其最终质量浓度为4、8、12、16、20 μg·mL-1,然后再加入0.1 mmol·L-1的DPPH溶液3.0 mL,总体积为6.0 mL,混匀静置反应30 min,于517 nm处比色测定吸光值。其中,对照为3.0 mL无水乙醇与3.0 mL的DPPH溶液静置反应后的吸光度数值。DPPH自由基清除率计算公式为:
DPPH自由基清除率/%=[(A对照−A样品)/A对照]×100% 式中:A对照为未加样品的DPPH自由基吸光度;A样品为加入样品反应后的DPPH自由基吸光度。
1.3 数据分析
采用Origin 7.5和SPSS 19.0软件进行数据分析。试验结果描述为“平均值±标准偏差”。不同小写字母表示差异显著水平(P<0.05)。
2. 结果与分析
2.1 茶多糖及其分离物组分分析
2种提取工艺粗茶叶多糖提取物的理化组成见表 1。结果表明,相较于先水提+后醇沉的提取方式,采用先醇洗+后水提制得的粗茶多糖TPs-水提中多糖含量显著提高,而先水提+后醇沉分离茶多糖,纯化富集效果并不明显。植物粗多糖中含有一定量的蛋白质,可影响改变多糖的结构和功效,故而脱除杂蛋白十分重要。采用2种提取方式制得的粗茶多糖TPs-水提和TPs-醇沉中,可溶性蛋白含量皆显著降低,尤以先醇洗+后水提效果更佳。综合来看,采用先醇洗+后水提制得粗茶多糖TPs-水提中多糖纯度高,且蛋白质杂质含量低,更易于粗多糖的后续纯化工作。
表 1 茶多糖及分离物的组分含量Table 1. Components of TPs and other constituents组分
/(μg·mL-1)先醇洗+后水提 先水提+后醇沉 TPs-水提 TPs-A TPs-醇沉 TPs-B TPs-C 茶多糖 329.55±1.92a 200.32±1.61b 252.95±4.18b 267.27±3.21b 275.45±4.50b 可溶性蛋白 65.58±1.43c 184.10±6.24a 154.17±1.79b 190.81±1.70a 202.00±1.61a 茶多酚 281.50±9.19b 546.15±1.36a 241.83±12.92b 554.81±4.08a 612.02±3.40a 总黄酮 38.82±0.71b 63.33±0.52a 34.65±0.35b 49.78±1.04b 50.51±0.52b 儿茶素总量 184.31±1.21c 383.32±5.74a 52.33±1.63d 280.43±3.76b 288.66±5.10b 表没食子儿茶素(ECG) 52.70±1.60c 118.40±9.72a 20.71±2.03d 78.26±1.25b 81.07±2.00b 儿茶素(C) 8.29±0.76c 2.90±0.42d 2.98±0.22d 10.04±0.37b 12.17±0.24a 表没食子儿茶素没食子酸酯(EGCG) 89.51±1.78c 199.96±3.59a 17.01±1.01d 141.18±2.28b 144.26±3.14b 表儿茶素(EC) 8.63±0.20c 17.42±0.19a 3.16±0.17d 13.82±0.94b 14.09±0.44b 表儿茶素没食子酸酯(ECG) 25.19±0.38c 44.64±0.65a 8.48±0.80d 37.13±0.50b 37.07±0.26b 咖啡碱 15.72±1.62d 89.25±1.82b 72.24±1.60c 98.20±2.92b 108.97±2.68a 注:儿茶素总量为EGC、C、EGCG、EC、ECG之和。 相较于TPs-A、TPs-B和TPs-C,粗茶多糖TPs-水提和TPs-醇沉中茶多酚/儿茶素类、总黄酮类、咖啡碱等物质含量显著降低。具体来看,粗茶多糖TPs-水提中可溶性蛋白和咖啡碱含量最低,而TPs-醇沉中茶多酚/儿茶素类和总黄酮类含量最低。茶多酚及咖啡碱以醇沉上清液TPs-C中含量最高,而儿茶素类及其单体和总黄酮类则是醇提茶叶TPs-A中含量最高,表明采用先65%醇洗+后水提的提取方式,有助于茶叶中小分子类物质如儿茶素类、总黄酮类、咖啡碱等物质的浸出富集。
2.2 抗氧化活性比较
2.2.1 粗茶多糖及其分离物的还原力表达
抗氧化剂的还原力分析结果(图 2)表明,等同剂量下,茶叶多糖及其分离样品的还原力变化趋势为TPs-C>TPs-A>TPs-B>TPs-水提>TPs-醇沉,表明抗氧化性依次减弱。研究结果来看,不同提取方式制备的粗茶多糖抗氧化活性不尽相同,采用先醇洗+后水提制备的粗茶多糖TPs-水提抗氧化活性较强。与其相应的分离物TPs-A、TPs-B和TPs-C比较来看,粗茶多糖抗氧化活性较弱。
2.2.2 粗茶多糖及其分离物的DPPH清除活性变化
DPPH自由基稳定,结构简单,已广泛用于各种植提物质的抗氧化活性评价。预试验表明,2种提取工艺制备的粗茶多糖TPs-水提和TPs-醇沉的DPPH清除率显著低于其分离物TPs-A、TPs-B和TPs-C(数据未在文中体现),由此选取合适浓度来评价茶多糖及其分离物对DPPH的清除率变化,结果(图 3)可见,DPPH清除率变化趋势与茶多糖及其分离物的质量浓度呈剂量依赖效应,逐渐升高。不同质量浓度剂量处理时,可见线性良好的DPPH清除率变化曲线,其DPPH清除率IC50值分别为TPs-水提34.41 μg·mL-1、TPs-醇沉47.70 μg·mL-1、TPs-A 13.75 μg·mL-1、TPs-B 14.45 μg·mL-1和TPs-C 11.29 μg·mL-1。与还原力变化趋势类似,采用先65%醇洗+后水提制备的粗茶叶多糖TPs-水提DPPH清除活性高于水提醇沉法制备的粗多糖TPs-醇沉,然而两者的DPPH清除活性皆低于TPs-A、TPs-B和TPs-C。
2.3 相关性分析
粗茶多糖及其分离物的还原力变化和DPPH清除活性表达,与其含有的抗氧化组分密切相关。结果(表 2)表明,茶多糖、茶多酚、总黄酮类、咖啡碱等组分与其DPPH清除活性和还原力变化呈正向相关,尤以茶多酚/儿茶素呈显著性相关(P<0.05)。综合来看,2种粗茶多糖及其分离物的抗氧化活性表达的主要活性成分为茶多酚,而又以儿茶素类的酯型儿茶素作用活性强。而茶多糖、总黄酮类及咖啡碱具有一定的抗氧化作用,然而抗氧化活性弱于茶多酚。
表 2 抗氧化成分与DPPH清除活性及还原力变化的相关分析Table 2. Effects of antioxidants on DPPH scavenging capacity and reducing power项目 Pearson相关性 茶多糖 茶多酚 儿茶素类 EGC C EGCG EC ECG 咖啡因 总黄酮 DPPH清除率 0.599 0.991* 0.856* 0.813 0.520 0.857* 0.890* 0.878* 0.751 0.821 还原力 0.625 0.893* 0.900* 0.852 0.569 0.893* 0.914* 0.926* 0.447 0.858* 注:*表示显著相关。 3. 讨论与结论
乙醇可用于植物多糖的分级纯化,成本低廉,易于实现规模化生产[15-18]。研究表明,50%乙醇浸提茶叶各品质成分的浸出率较常规水提显著提高,尤其是茶多酚、氨基酸等小分子物质[19],这可能与乙醇水溶液的介电常数的高低变化相关。高浓度乙醇时,水溶液介电常数变低,蛋白质、鞣质、多糖、色素等大分子物质反而不易浸出。由此,乙醇可用于沉淀多糖、蛋白质等大分子物质。研究表明,不同用量乙醇对茶多糖及蛋白质具有不同的沉淀效应,80%乙醇为沉淀析出可溶性蛋白质的最佳浓度,而茶叶多糖在乙醇超过50%时即有较好的沉淀特性[20]。进一步通过单因素试验和正交试验研究发现,选取65%乙醇预处理茶叶时,茶多酚(尤其是其中的儿茶素类)、咖啡碱、总黄酮类等小分子物质和可溶性蛋白质的浸出量显著提高,而茶叶多糖仅低量浸出,因此茶叶物料经醇洗后再进行水提,茶叶多糖的纯度大大提高[10]。
本研究以清香乌龙茶为原料,通过中试规模生产分析比较“先65%醇洗+后水提”和“先水提+后65%醇沉”2种方式提取的茶叶粗多糖及其相应分离物质,并检测了其构成物质的含量变化情况。结果表明,相较于“水相提取”和“水提醇沉法”,采用“先65%醇洗+后水提”工艺制备的粗茶多糖(即TPs-水提)中茶多糖含量最高,可溶性蛋白含量最低。其他组分来看,醇洗茶叶物TPs-A中儿茶素类、总黄酮类等小分子物质含量最高,分析认为与其易于小分子物质浸出有关。醇沉分离多糖时,粗茶多糖TPs-醇沉中茶多酚/儿茶素类、总黄酮类、咖啡碱等物质含量较低,推测可能与乙醇浓度或添加顺序(本研究中乙醇添加于多糖浓缩液中)相关,具体机制有待进一步研究。
茶多糖尤以抗氧化和降血糖活性最为突出,能清除多种自由基[21-23]。然而针对其抗氧化活性的研究结论不一致,有研究分析比较了粗茶多糖和纯化茶多糖的抗氧化活性,发现纯茶多糖片段的DPPH自由基清除率极低,且基本无变化[24]。王黎明等[25]的研究也发现,茶多糖纯度越高对羟基自由基和氧自由基清除能力越弱。本研究结果表明,粗茶多糖TPs-水提和TPs-醇沉的还原力和DPPH清除活性皆显著弱于分离产物,TPs-醇沉活性最弱。茶叶富含有多种可清除自由基活性的物质[26-27]。相关性分析表明,各抗氧化组分与粗茶多糖及其分离产物抗氧化活性表达之间Pearson系数呈正相关,茶多酚/儿茶素类呈显著正相关。进一步研究发现,酯型儿茶素EGCG和ECG与其抗氧化活性表达之间呈显著相关,揭示粗茶多糖及其分离产物中抗氧化活性表达主要影响因素为茶多酚,尤其是儿茶素类中酯型儿茶素活性,而茶多糖、总黄酮类、咖啡碱等物质的抗氧化活性弱于茶多酚。这一定程度上印证了Wang Y L[24]、王黎明等[25]的研究结论。
综上所述,采用先65%醇洗+后水提的浸提方式,可实现茶叶多糖的富集,且可溶性蛋白含量低,该工艺制得的粗茶多糖可视为醇洗茶叶产物的副产品,由此可实现茶叶的综合提取分离,使得粗茶多糖的工业化生产简单可行,成本低廉。同时,茶叶多糖具有一定的抗氧化活性,然而活性弱于茶叶多酚类。粗茶叶多糖的抗氧化活性表达的主要活性成分为茶多酚,尤其是儿茶素类中的酯型儿茶素,而茶多糖的抗氧化活性则弱于茶多酚。
-
表 1 15组样品的测序统计结果与Alpha多样性指数
Table 1 Statistics on sequencing and alpha diversity indices of 15 tea sample groups
样品
SampleOTUs 统计结果 OTUs statistics 多样性指数 Diversity index 样品序列数
Sample SizeOTUs数目
OTUs No.OTUs序列数
OTUs Seq香农指数
Shannon辛普森指数
SimpsonChao1指数
Chao1物种丰富度
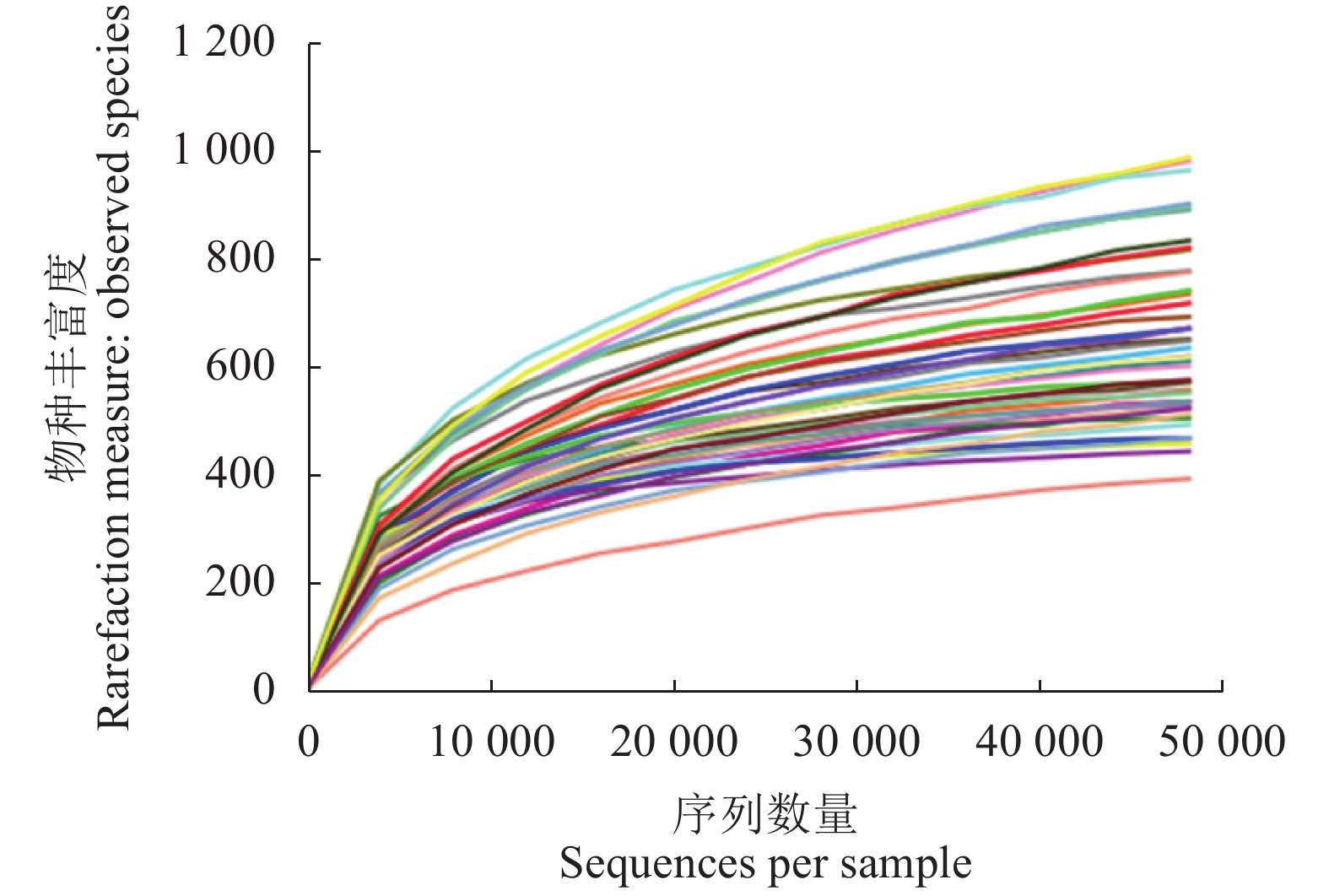
Observed Species覆盖度 Good's Coverage/% DHP01 135 571 786 120 856 4.812 a 0.881 a 764.350 a 566.333 a 99.4 a DHP02 137 093 840 120 902 4.674 a 0.869 a 826.814 a 590.667 a 99.3 a DHP03 131 607 1 154 116 546 5.834 a 0.940 a 1 160.929 a 821.667 a 99.0 a DHP04 135 649 868 120 950 5.921 a 0.947 a 821.182 a 642.333 a 99.4 a DHP05 137 637 922 121 189 4.941 a 0.873 a 918.760 a 625.667 a 99.3 a DHP06 130 334 830 115 224 5.548 a 0.936 a 786.825 a 590.667 a 99.4 a DHP07 134 957 698 120 356 4.468 a 0.856 a 626.202 a 500.333 a 99.5 a DHP08 114 134 804 95 325 5.621 a 0.920 a 778.539 a 624.000 a 99.4 a DHP09 123 240 672 108 448 4.873 a 0.883 a 650.761 a 522.333 a 99.5 a DHP10 137 220 947 122 884 5.077 a 0.895 a 910.136 a 679.333 a 99.2 a H01 119 468 628 86 562 5.867 a 0.948 a 587.594 a 517.667 a 99.7 a H02 117 039 513 104 593 5.366 a 0.908 a 505.416 a 437.667 a 99.8 a T01 114 298 642 98 978 4.682 a 0.875 a 601.000 a 507.667 a 99.6 a T02 110 810 613 89 148 4.992 a 0.913 a 614.176 a 486.000 a 99.6 a T03 103 525 555 77 016 4.894 a 0.888 a 554.331 a 468.667 a 99.7 a 注:表中的OTUs是相似性大于97%的有效OTUs,且已经注释;不同小写字母表示不同样品间达到显著性差异(P<0.05)。
Note: OTUs are valid and annotated OTUs with similarity greater than 97%; and data with different lowercase letters indicate significant difference between samples (P<0.05). -
[1] ZHANG L, HO C T, ZHOU J, et al. Chemistry and Biological Activities of Processed Camellia sinensis Teas: A Comprehensive Review [J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(5): 1474−1495. DOI: 10.1111/1541-4337.12479
[2] WEI C, YANG H, WANG S, et al. Draft genome sequence of Camellia sinensis var. sinensis provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences, 2018, 115(18): E4151−E4158. DOI: 10.1073/pnas.1719622115
[3] 马存强, 杨超, 周斌星, 等. 微生物对茶叶中嘌呤生物碱代谢的研究进展 [J]. 食品科学, 2014, 35(21):292−296. DOI: 10.7506/spkx1002-6630-201421057 MA C Q, YANG C, ZHOU B X, et al. Recent progress in microbial metabolism of purine alkaloids in fermented tea [J]. Food science, 2014, 35(21): 292−296.(in Chinese) DOI: 10.7506/spkx1002-6630-201421057
[4] 陈林, 项丽慧, 王丽丽, 等. 乌龙茶和绿茶品种茶鲜叶儿茶素类和嘌呤碱HPLC指纹图谱特征比较 [J]. 福建农业学报, 2018, 33(1):21−28. CHEN L, XIANG L H, WANG L L, et al. HPLC Profiling of Catechins and Purine Alkaloids in Leaves of Oolong and Green Tea Cultivars [J]. Fujian Journal of Agricultural Sciences, 2018, 33(1): 21−28.(in Chinese)
[5] LI H L, JAYAWARDENA R S, XU W, et al. Lasiodiplodia theobromae and L. pseudotheobromae causing leaf necrosis on Camellia sinensis in Fujian Province, China [J]. Canadian Journal of Plant Pathology, 2019, 41(2): 277−284. DOI: 10.1080/07060661.2019.1569559
[6] 姚清华, 张居德, 苏德森, 等. 福建省茶叶主产区茶叶质量安全管理与隐患点比较分析 [J]. 福建农业学报, 2014, 29(4):393−397. DOI: 10.3969/j.issn.1008-0384.2014.04.018 YAO Q H, ZHANG J D, SU D S, et al. Quality and Safety Management on Tea in Fujian [J]. Fujian Journal of Agricultural Sciences, 2014, 29(4): 393−397.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2014.04.018
[7] 许凌, 周卫龙, 宿迷菊. 茶叶微生物指标的现状与展望 [J]. 中国茶叶, 2012(7):14−16. DOI: 10.3969/j.issn.1000-3150.2012.07.008 XU L, ZHOU W L, SU M J. Present situation and prospect of microbial indicators of tea [J]. China tea, 2012(7): 14−16.(in Chinese) DOI: 10.3969/j.issn.1000-3150.2012.07.008
[8] BORAH A, DAS R, MAZUMDAR R, et al. Culturable endophytic bacteria of Camellia species endowed with plant growth promoting characteristics [J]. Journal of Applied Microbiology, 2019, 127(3): 825−844. DOI: 10.1111/jam.14356
[9] MADHAB M, BHATTACHARYYA P N, BEGUM R, et al. Microbial distribution and contamination in black tea [J]. Two and a Bud, 2019, 64(1): 26−31.
[10] 谌滢, 李适, 刘仲华, 等. 黑茶陈化机制研究进展 [J]. 湖南农业科学, 2016(12):118−122. CHEN Y, LI S, LIU Z H, et al. Research progress on the aging mechanism of black tea [J]. Hunan Agricultural Sciences, 2016(12): 118−122.(in Chinese)
[11] 徐正刚, 吴良, 刘石泉, 等. 黑茶发酵过程中微生物多样性研究进展 [J]. 生物学杂志, 2019, 36(3):92−95. DOI: 10.3969/j.issn.2095-1736.2019.03.092 XU Z G, WU L, LIU S Q, et al. Review for development of microbial diversity during dark tea fermentation period [J]. Journal of Biology, 2019, 36(3): 92−95.(in Chinese) DOI: 10.3969/j.issn.2095-1736.2019.03.092
[12] 罗红玉, 钟应富, 袁林颖, 等. 微生物在传统茶加工中的应用研究进展 [J]. 福建茶叶, 2013, 35(1):13−16. DOI: 10.3969/j.issn.1005-2291.2013.01.004 LUO H Y, ZHONG Y F, YUAN L Y, et al. Research progress on the application of microorganisms in traditional tea processing [J]. Tea in Fujian, 2013, 35(1): 13−16.(in Chinese) DOI: 10.3969/j.issn.1005-2291.2013.01.004
[13] TIAN J, ZHU Z, WU B, et al. Bacterial and Fungal Communities in Pu’er Tea Samples of Different Ages [J]. Journal of Food Science, 2013, 78(8): M1249−M1256. DOI: 10.1111/1750-3841.12218
[14] 刘石泉, 胡治远, 赵运林. 基于DGGE技术的茯砖茶发花过程细菌群变化分析 [J]. 生态学报, 2014, 34(11):3007−3015. LIU S Q, HU Z Y, ZHAO Y L. Analysis of bacterial flora during the fahua fermentation process of fuzhuan brick tea production based on DGGE technology [J]. Acta Ecologica Sinica, 2014, 34(11): 3007−3015.(in Chinese)
[15] RUI Y, WAN P, CHEN G, et al. Analysis of bacterial and fungal communities by Illumina MiSeq platforms and characterization of Aspergillus cristatus in Fuzhuan brick tea [J]. LWT, 2019, 110: 168−174. DOI: 10.1016/j.lwt.2019.04.092
[16] LI Q, CHAI S, LI Y D, et al. Biochemical components associated with microbial community shift during the pile-fermentation of primary dark tea [J]. Frontiers in Microbiology, 2018, 9: 1509. DOI: 10.3389/fmicb.2018.01509
[17] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010, 7(5): 335−336. DOI: 10.1038/nmeth.f.303
[18] ROGNES T, FLOURI T, NICHOLS B, et al. VSEARCH: a versatile open source tool for metagenomics [J]. PeerJ, 2016, 4: e2584. DOI: 10.7717/peerj.2584
[19] SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation [J]. Genome Biology, 2011, 12(6): R60. DOI: 10.1186/gb-2011-12-6-r60
[20] 李艳春, 林忠宁, 陆烝, 等. 茶园间作灵芝对土壤细菌多样性和群落结构的影响 [J]. 福建农业学报, 2019, 34(6):690−696. LI Y C, LIN Z N, LU Z, et al. Microbial Diversity and Community Structure in Soil under Tea Bushes-Ganoderma lucidum Intercropping [J]. Fujian Journal of Agricultural Sciences, 2019, 34(6): 690−696.(in Chinese)
[21] ALOTAIBI K, RAYWARD-SMITH V, IGLESIA B D L. Nonmetric multidimensional scaling: A perturbation model for privacy-preserving data clustering [J]. Statistical Analysis & Data Mining the Asa Data Science Journal, 2014, 7(3): 175−193.
[22] DHARIWAL A, CHONG J, HABIB S, et al. MicrobiomeAnalyst: a web-based tool for comprehensive statistical, visual and meta-analysis of microbiome data [J]. Nucleic Acids Research, 2017, 45(W1): W180−W188. DOI: 10.1093/nar/gkx295
[23] FAUST K, RAES J. Microbial interactions: from networks to models [J]. Nature Reviews Microbiology, 2012, 10(8): 538−550. DOI: 10.1038/nrmicro2832
[24] FUHRMAN J A, CRAM J A, NEEDHAM D M. Marine microbial community dynamics and their ecological interpretation [J]. Nature Reviews Microbiology, 2015, 13(3): 133−146. DOI: 10.1038/nrmicro3417
[25] MOLLOY S. Environmental microbiology: disentangling syntrophy [J]. Nature Reviews Microbiology, 2014, 12(1): 7.
[26] HIBBING M E, FUQUA C, PARSEK M R, et al. Bacterial competition: surviving and thriving in the microbial jungle [J]. Nature Reviews Microbiology, 2010, 8(1): 15−25. DOI: 10.1038/nrmicro2259
[27] LI H, LI M, YANG X, et al. Microbial diversity and component variation in Xiaguan Tuo Tea during pile fermentation [J]. PLoS ONE, 2018, 13(2): e0190318. DOI: 10.1371/journal.pone.0190318
[28] XU Q, SUN M, NING J, et al. The Core Role of Bacillus subtilis and Aspergillus fumigatus in Pile-Fermentation Processing of Qingzhuan Brick Tea [J]. Indian Journal of Microbiology, 2019, 59(3): 288−294. DOI: 10.1007/s12088-019-00802-4
[29] XU A, WANG Y, WEN J, et al. Fungal community associated with fermentation and storage of Fuzhuan brick-tea [J]. International Journal of Food Microbiology, 2011, 146(1): 14−22. DOI: 10.1016/j.ijfoodmicro.2011.01.024
[30] MAO Y, WEI B Y, TENG J W, et al. Analyses of fungal community by Illumina MiSeq platforms and characterization of Eurotium species on Liupao tea, a distinctive post-fermented tea from China [J]. Food Research International, 2017, 99: 641−649. DOI: 10.1016/j.foodres.2017.06.032
[31] ZHANG W, YANG R, FANG W, et al. Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea [J]. International Journal of Food Microbiology, 2016, 227: 29−33. DOI: 10.1016/j.ijfoodmicro.2016.03.025
[32] 赵仁亮, 胥伟, 吴丹, 等. 基于Illumina MiSeq技术分析不同地域加工的茯砖茶中微生物群落多样性 [J]. 生态学杂志, 2017, 36(7):1865−1876. ZHAO R L, XU W, WU D, et al. Microbial community diversity of Fu brick tea produced in different regions by Illumina MiSeq technology [J]. Chinese Journal of Ecology, 2017, 36(7): 1865−1876.(in Chinese)
[33] FU J Y, LV H P, CHEN F. Diversity and Variation of Bacterial Community Revealed by MiSeq Sequencing in Chinese Dark Teas [J]. PLoS ONE, 2016, 11(9): e0162719. DOI: 10.1371/journal.pone.0162719
[34] 宁伟泽, 徐军. 金花普洱茶微生物组成谱的ITS和16sRNA基因文库研究 [J]. 中国茶叶, 2018, 40(5):63−66. DOI: 10.3969/j.issn.1000-3150.2018.05.010 NING W Z, XU J. Study on ITS and 16sRNA gene library of microbial composition spectrum of jinhua puer tea [J]. China Tea, 2018, 40(5): 63−66.(in Chinese) DOI: 10.3969/j.issn.1000-3150.2018.05.010
[35] MUDAU F N, SALEHI B, SHARIFI-RAD M, et al. Understanding Camellia sinensis using Omics technologies along with endophytic bacteria and environmental roles on metabolism: A review [J]. Applied Sciences (Switzerland), 2019, 9(2): 281. DOI: 10.3390/app9020281
[36] AZAM M W, KHAN A U. Updates on the pathogenicity status of Pseudomonas aeruginosa [J]. Drug Discovery Today, 2019, 24(1): 350−359. DOI: 10.1016/j.drudis.2018.07.003
[37] SHARMA A K, PANDIT J, GAUTAM V, et al. Optimization of culture conditions for maximizing Extracellular Organophosphorus hydrolase activity in pseudomonas strains with Chlorpyrifos degradation potential [J]. Journal of Pharmacognosy and Phytochemistry, 2019, SP1: 322−326.
[38] WALLACE R L, HIRKALA D L, NELSON L M. Postharvest biological control of blue mold of apple by Pseudomonas fluorescens during commercial storage and potential modes of action [J]. Postharvest Biology & Technology, 2017, 133: 1−11.
[39] CHEN H, HAO Z, WANG Q, et al. Occurrence and risk assessment of organophosphorus pesticide residues in Chinese tea [J]. Human and Ecological Risk Assessment: An International Journal, 2016, 22(1): 28−38. DOI: 10.1080/10807039.2015.1046420
[40] SHARMA A, PANDIT J, SHARMA R, et al. Biodegradation of Chlorpyrifos by Pseudomonas Resinovarans Strain AST2. 2 Isolated from Enriched Cultures [J]. Current World Environment, 2016, 11(1): 267−278. DOI: 10.12944/CWE.11.1.33
[41] DONG J, BIAN Y, LIU F, et al. Storage stability improvement of organophosphorus insecticide residues on representative fruit and vegetable samples for analysis [J]. Journal of Food Processing and Preservation, 2019: e14048.
[42] 王小军, 张绵松, 袁文鹏, 等. 液态发酵茶饮料菌株分离鉴定及发酵特征研究 [J]. 农产品加工(学刊), 2010(8):30−35. WANG X J, ZHANG M S, YUAN W P, et al. Isolation and identification and fermentation characteristic of microorganism used for liquid fermented tea drink [J]. The Processing of Agricultural Products, 2010(8): 30−35.(in Chinese)
[43] SONG A A L, IN L L A, LIM S H E, et al. A review on Lactococcus lactis: from food to factory [J]. Microbial cell factories, 2017, 16(1): 55. DOI: 10.1186/s12934-017-0669-x
[44] 杨浩, 杨晓妮, 张国珍, 等. 窖水中微生物降解污染物的关键细菌 [J]. 环境科学, 2018, 39(10):376−387. YANG H, YANG X N, ZHANG G Z, et al. Key bacteria for microbial degradation of pollutants in cellar water [J]. Environmental Science, 2018, 39(10): 376−387.(in Chinese)
[45] CHEN Y, LI Q, XIA C, et al. Effect of selenium supplements on the antioxidant activity and nitrite degradation of lactic acid bacteria [J]. World Journal of Microbiology and Biotechnology, 2019, 35(4): 61. DOI: 10.1007/s11274-019-2609-x
[46] YUE X, YU G, LU Y, et al. Effect of dissolved oxygen on nitrogen removal and the microbial community of the completely autotrophic nitrogen removal over nitrite process in a submerged aerated biological filter [J]. Bioresource Technology, 2018, 254: 67−74. DOI: 10.1016/j.biortech.2018.01.044
[47] XU S, LU W J, MUSTAFA M F, et al. Co-existence of anaerobic ammonium oxidation bacteria and denitrifying anaerobic methane oxidation bacteria in sewage sludge: community diversity and seasonal dynamics [J]. Microbial Ecology, 2017, 74(4): 832−840.
-
期刊类型引用(8)
1. 姜业硕,曹孟飞,班秋艳,王文利,梁丽云. 茶叶抗氧化CNKI文献计量及研究热点分析. 茶叶. 2022(02): 69-74 .  百度学术
百度学术
2. 练珊珊,陈佳,吕立堂. 15个茶树品种多糖、纤维素、木质素含量的分析. 广东茶业. 2021(01): 15-20 .  百度学术
百度学术
3. 王丽,官小倩,余能煌,林芷青. 不同焙火程度对武夷肉桂品质与抗氧化活性的影响. 茶叶通讯. 2020(02): 282-286 .  百度学术
百度学术
4. 许陆达,黄苏萍,杨柳媛. 茶多糖的组成及其对糖代谢的作用机制探讨. 广东茶业. 2020(06): 25-31 .  百度学术
百度学术
5. 宋振硕,杨军国,张磊,林清霞. 烘焙类茶食品的研究进展. 食品工业科技. 2019(01): 321-325 .  百度学术
百度学术
6. 杨军国,宋振硕,陈键,王丽丽,林清霞,陈林. 粗茶多糖的膜-纤维素柱色谱分离过程的抗氧化活性研究. 茶叶学报. 2018(02): 71-76 .  百度学术
百度学术
7. 杨军国. 功能型速溶茶及其加工工艺探讨. 福建茶叶. 2018(08): 6-8 .  百度学术
百度学术
8. 袁勇,尹钟,谭月萍,周重旺. 茶多糖的提取分离及生物活性研究进展. 茶叶通讯. 2018(03): 8-12 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载: