Cloning and Expression of Squalene Monooxygenase Genes of Dendrobium officinale
-
摘要:目的 克隆铁皮石斛(Dendrobium officinale)甾醇类化合物合成关键酶鲨烯单加氧酶(Squalene Monooxygenase,SQE)基因,并对其进行生物信息学分析和不同营养生长期茎和叶中的表达模式分析。方法 根据铁皮石斛转录组测序获得带5’末端的SQE基因片段,设计DoSQE1与DoSQE2基因的3’RACE引物,克隆全长cDNA,利用生物信息学分析软件对DoSQE1与DoSQE2基因及其编码蛋白序列进行分析。运用实时荧光定量PCR检测DoSQE1与DoSQE2基因在铁皮石斛营养生长期的8月、10月、12月茎和叶中的表达模式。结果 DoSQE1基因cDNA序列全长1 796 bp(GenBank 登录号MT160182),含有1个1 554 bp的ORF,编码517个氨基酸;DoSQE2基因cDNA序列全长1 963 bp(GenBank 登录号MT160183),含有1个1 578 bp的ORF,编码525个氨基酸。DoSQE1具有2个跨膜区,分别在4~22 aa和55~72 aa;DoSQE2只有在5~23 aa的1个跨膜区。DoSQE1蛋白在204~476 aa、DoSQE2蛋白在211~484 aa处含有鲨烯环氧酶结构域。系统进化分析表明,DoSQE1与姬蝴蝶兰SQE(XP_020599860.1)的亲缘关系最近,DoSQE2与姬蝴蝶兰SQE(XP_020579136.1)的亲缘关系最近。qRT-PCR检测结果表明,茎和叶中都能检测到2个基因的表达,叶的表达量显著高于茎。DoSQE1基因在8月份表达量最高,DoSQE2基因在10月份表达量最高。结论 本研究克隆得到DoSQE1和DoSQE2基因,发现DoSQE1和DoSQE2基因的表达模式存在差异,该结果为进一步研究铁皮石斛甾醇类化合物生物合成机理及代谢调控奠定基础。Abstract:Objective The SQE genes of Dendrobium officinale associated with the key enzyme involving in the sterol biosynthesis, squalene monooxygenase, were cloned for bioinformatics analysis and determination of their expressions in the stems and leaves of the orchid plant at different growth stages.Method The 3'RACE primers of DoSQE1 and DoSQE2 were designed based on SQE fragment with the 5' terminal from the transcriptome data of D. officinale. The full lengths cDNAs of DoSQE1 and DoSQE2 were cloned and a bioinformatics analysis carried out. Expressions of the genes in the stems and leaves in August, October and December were detected by qRT-PCR.Result The full-length of DoSQE1 was 1 796bp (GenBank accession MT160182) containing an 1 554 bp ORF encoding 517 amino acids (aa) and that of DoSQE2 1 963 bp (GenBank accession MT160183) containing an 1 578 bp ORF encoding 525 aa. DoSQE1 had two transmembrane regions at 4–22 aa and 55–72 aa, while DoSQE2 had only one transmembrane region at 5–23 aa. DoSQE1 contained a squalene epoxidase domain at 204–476 aa, and DoSQE2 at 211–484 aa. The phylogenetic analysis showed DoSQE1 to be closely related to SQE of Phalaenopsis equestris (XP_020599860.1), and DoSQE2 to that of Phalaenopsis equestris (XP_020579136.1). Their gene expressions were detected in the stems as well as the leaves by qRT-PCR with the expression in the leaves significantly higher than that in the stems. And, the expression of DoSQE1 peaked in August, whereas, that of DoSQE2 in October.Conclusion DoSQE1 and DoSQE2 were successfully cloned for the study that showed differences in their expressions. The information obtained would lead to further investigation on the biosynthesis mechanism and metabolic regulation of sterols in D. officinale.
-
Keywords:
- Dendrobium officinale /
- squalene monooxygenase /
- bioinformatics analysis /
- qRT-PCR
-
0. 引 言
【研究意义】 植物甾醇是一类生物活性成分,具有抗氧化、抗肿瘤、预防和治疗心脑血管疾病等作用[1-3]。铁皮石斛(Dendrobium officinale)是名贵中药材,具有增强免疫力、降血糖和抗肿瘤等生理活性[4-5]。已有研究表明铁皮石斛含有豆甾醇、β谷甾醇、γ-谷甾醇和油菜甾醇等植物甾醇类次生代谢产物[6-7]。鲨烯单加氧酶(Squalene Monooxygenase,SQE)又称鲨烯环氧酶(Squalene epoxidase, SE),催化角鲨烯生成2,3-氧化鲨烯[8-9]。环阿屯醇合酶(Cycloartenol synthase, CAS)催化2,3-氧化鲨烯形成环阿屯醇,代谢流向植物甾醇;羽扇豆醇合成酶(Lupeol synthase, LS)、β-香树脂醇合成酶(β-amyrin synthase, β-AS)和达玛烯二醇合成酶(Dammarenediol synthase, DS)催化2,3-氧化鲨烯形成羽扇豆醇、β-香树脂醇和达玛烯二醇,代谢转向三萜类生物合成通道[10-13]。因此,SQE是植物甾醇和三萜类物质合成途径的一个关键限速酶。开展铁皮石斛SQE基因的克隆及表达模式分析,对探讨铁皮石斛植物甾醇生物合成分子机制及代谢调控具有重要的意义。【前人研究进展】 孙蓉等[14]克隆了金龙胆草(Conyza blinii H. Lev)CbSQE基因,编码525个氨基酸,构建了原核表达载体,并在大肠杆菌BL21中成功诱导表达。祝传书等[15]克隆了雷公藤(Tripterygium wilfordii Hook. f.)TwSE1和TwSE2基因,具76.18%相似性,TwSE1基因在花中表达量最高,TwSE2基因在花和嫩叶中的表达量最高,均受MeJA诱导上调表达,上调幅度TwSE1基因高于TwSE2基因。王学方等[16]对17种大戟科(Euphorbiaceae)植物的SE分析发现只有蓖麻(Ricinus communis)4和木薯(Manihot esculenta)1的SQE具有信号肽;5个没有跨膜结构域,7个只在N末端有跨膜结构域,5个N末端和C末端都有跨膜结构域。此外,在人参(Panax ginseng)[17]、绞股蓝(Gynostemma pentaphyllum)[18]、野三七(Panax vietnamensis var. fuscidiscus)[19]、金铁锁(Psammosilene tunicoides)[20]等药用植物也开展了SQE基因的克隆研究。【本研究切入点】目前,未见铁皮石斛SQE基因的相关研究报道。【拟解决的关键问题】本课题组通过铁皮石斛茎和叶的转录组测序,分析了植物甾醇的生物合成途径相关基因[21],获得2个带5′末端的SQE基因片段,以此为基础开展全长cDNA及ORF克隆和表达模式分析。本研究通过已获得2个带5′末端的SQE基因片段设计3′RACE引物,克隆基因全长cDNA序列和ORF,并分析2个基因在不同营养生长期铁皮石斛茎和叶中的表达模式,以期为进一步研究铁皮石斛SQE基因功能及植物甾醇生物合成分子机制和代谢调控奠定基础。
1. 材料与方法
1.1 材料
植物材料为福建冠豸山种源铁皮石斛,2017年种于亚热带农业研究所温室大棚,基质为松树皮,光照强度8 000~10 000 lx,空气相对湿度70%~90%。于不同营养生长期(2018年8月、10月、12月)取铁皮石斛的茎和叶,每个样品3重复,超低温冰箱−80℃保存,用于RNA提取。
1.2 方法
1.2.1 总RNA提取和cDNA合成
按照TaKaRa的RNAiso Plus说明提取铁皮石斛茎、叶的总RNA,检测RNA的质量和浓度。以提取的总RNA为模板,随机引物逆转录合成cDNA第l链。
1.2.2 DoSQE1与DoSQE2基因全长cDNA的克隆
根据已经获得的DoSQE1与DoSQE2基因信息设计用于3′RACE的引物及接头引物(表1)。取8月、10月、12月铁皮石斛茎和叶的cDNA各10 μL混合作为模板,用引物3DoSQE1F1和dT-adaptor、3DoSQE2F1和dT-adaptor分别进行PCR。把PCR产物稀释10倍作为模板,3DoSQE1F2和adaptor、3DoSQE2F2和adaptor进行巢式PCR。反应体系25 μL:ddH2O 8.5 μL,上下游引物(10 μmol·L−1)各1 μL,2×SanTaq PCR Mix 12.5 μL,模板2 μL。PCR反应程序为94℃预变性5 min,然后94℃变性30 s,52℃退火30 s,72℃延伸60 s,30个循环,最后72℃延伸10 min。PCR产物经电泳检测后,胶回收目的片段,与pMD19-T载体连接,转化大肠杆菌DH5α感受态细胞,复苏后涂LB平板(含100 mg·L−1氨苄青霉素),选择经菌落PCR鉴定的阳性克隆送上海生工生物工程技术服务有限公司测序。
表 1 PCR引物序列信息Table 1. Sequence of PCR primers引物名称
Primer name引物序列(5′-3′)
Primer sequence(5′-3′)引物用途
Primer usage3DoSQE1F1 CCTTCCATTGCTAACGGAGAGA DoSQE1基因 3′RACE引物3′RACE primers of DoSQE1 3DoSQE1F2 CCTGGAGCACTTCTAATGGGAG 3DoSQE2F1 CTCTTCCTACACCTGGAGCACT DoSQE2基因3′RACE引物 3′RACE primers of DoSQE2 3DoSQE2F2 TATACCTTGCGTAAGCCCGTTG dT-adaptor CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT 3′RACE接头引物 Adaptor primers of 3′RACE adaptor CTGATCTAGAGGTACCGGATCC DoSQE1F CGCGGTACCATGATGCTTCTCCAGTACA DoSQE1基因ORF克隆引物 primers of DoSQE1 ORF clone DoSQE1R CGCGTCGACGGAGTTCTCATTGTGTAGG DoSQE2F CGCGGTACCATGGTGATGCCACTTTCGTA DoSQE2基因ORF克隆引物 primers of DoSQE2 ORF clone DoSQE2R CGCGTCGACGTTGGAAGTTCACCCACGAG DoSQE1-F AGGACGCAAACAGCGAGAG DoSQE1基因表达分析引物 Expression analysis primers of DoSQE1 DoSQE1-R CACCAACGATTCTATGAGGC DoSQE2-F CCCCAGATACCGAGTCAG DoSQE2基因表达分析引物 Expression analysis primers of DoSQE2 DoSQE2-R CCCATCAGAAGTGCTCCAG DoACT-F AGGAAGGCGGCTTTGAATC 内参基因 Reference gene DoACT-R CCATGCCAACCATGACACC 注:下划线碱基为酶切位点。
Note:The ud bases were the enzyme site.1.2.3 DoSQE1与DoSQE2基因ORF的克隆
根据DoSQE1与DoSQE2基因全长cDNA序列设计DoSQE1基因的ORF克隆引物DoSQE1F(带Kpn Ⅰ酶切位点)与DoSQE1R(带Sal Ⅰ酶切位点)和DoSQE2基因的ORF克隆引物DoSQE2F(带Kpn Ⅰ酶切位点)与DoSQE2R(带Sal Ⅰ酶切位点),产物长度分别为1 579 bp和1 645 bp(表1)。以2 μL混合的cDNA为模板,PCR扩增体系和反应程序同上,延伸时间90 s。阳性克隆送去测序。
1.2.4 DoSQE1与DoSQE2基因的生物信息学分析
ProtParam(https://web.expasy.org/protparam/)分析DoSQE1与DoSQE2基因编码蛋白的理化性质,蛋白跨膜区预测利用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/),二级和三级结构预测使用在线工具SSPro(http://scratch.proteomics.ics.uci.edu/)和SWISS-MODEL(https://www.swissmodel.expasy.org/)。采用NCBI的BLAST P搜索DoSQE1与DoSQE2基因编码蛋白的同源序列及保守结构域,通过MEGA6.0(Neighbor Joining Tree, Bootstrap 1000)构建系统进化树[22]。
1.2.5 DoSQE1与DoSQE2基因的表达分析
设计DoSQE1基因引物DoSQE1-F和DoSQE1-R、DoSQE2基因引物DoSQE2-F和DoSQE2-R、内参Actin基因引物DoACT-F和DoACT-R(表1)用于荧光定量PCR。把不同月份茎和叶的cDNA浓度定量为200 ng·μL−1。用Roche LightCycler 96检测DoSQE1与DoSQE2基因在不同生长期铁皮石斛茎和叶中的表达量。反应体系为:TB GreenTMPremix Ex TaqTMⅡ(TliRNaseH Plus)10 μL,上、下游引物各1 μL,cDNA模板2 μL,ddH2O补足 20 μL。反应程序为:95℃ 30 s;95℃ 10 s,60℃ 20 s,45个循环;每个反应设置 3 个重复。利用2−∆∆CT法分析相对表达量[23],DPS数据处理软件对结果进行方差分析,多重比较采用新复极差法(Duncan法)。
2. 结果与分析
2.1 DoSQE1与DoSQE2基因全长cDNA的克隆
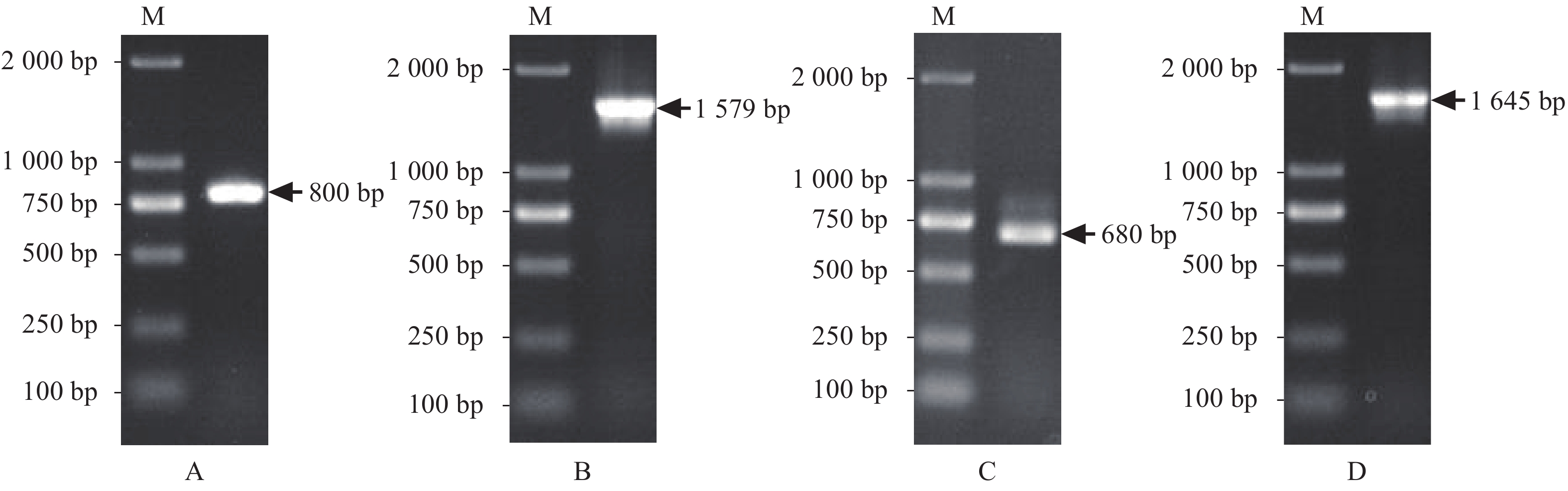
以不同生长期茎和叶的cDNA混合物作为模板,利用3′RACE引物进行巢式PCR扩增DoSQE1与DoSQE2基因3′末端,DoSQE1与DoSQE2基因分别得到1条特异条带,约800 bp和680 bp(图1-A、C),目的条带经过胶回收、连接、转化和克隆验证后送去测序、测序结果利用DNAMAN V6.0进行序列拼接及ORF预测,获得DoSQE1基因cDNA序列全长1 796 bp(GenBank 登录号MT160182),含有1个1 554 bp的ORF,编码517个氨基酸,5′末端非翻译区24 bp,3′末端非翻译区218 bp;DoSQE2基因cDNA序列全长1 963 bp(GenBank 登录号MT160183),含有1个1 578 bp的ORF,编码525个氨基酸,5′末端非翻译区127 bp,3′末端非翻译区258 bp。
2.2 DoSQE1与DoSQE2基因开放阅读框的克隆
以不同生长期茎和叶的cDNA混合物作为模板,利用扩增ORF的引物扩增DoSQE1与DoSQE2基因的ORF,电泳结果显示,DoSQE1与DoSQE2基因分别得到1条约1 579 bp和1 645 bp的特异条带(图1-B、D),大小与预测一致。PCR产物经过克隆及验证后送去测序,测序结果经DNAMAN V6.0比对,结果表明获得了DoSQE1与DoSQE2基因ORF,核苷酸序列相似度为79.78%,编码氨基酸相似度为80.95%。提取阳性克隆的质粒pMD19-T-DoSQE1和pMD19-T-DoSQE2超低温冰箱保存。
2.3 DoSQE1与DoSQE2蛋白基本性质分析
利用ProtParam tool在线分析DoSQE1与DoSQE2蛋白的理化性质。结果表明,DoSQE1蛋白的分子量为56.235 kD,理论等电点为8.96,负电荷的氨基酸残基数(Asp+Glu)为45,正电荷的氨基酸残基数(Arg+Lys)为55,不稳定系数是44.92,总平均疏水性是0.084,属于一种不稳定的疏水性蛋白。DoSQE2蛋白的分子量为56.541 kD,理论等电点为8.77,负电荷的氨基酸残基数(Asp+Glu)为46,正电荷的氨基酸残基数(Arg+Lys)为53,不稳定系数是39.66,总平均疏水性是0.137,属于一种稳定的疏水性蛋白。使用TMHMM Server v.2.0预测DoSQE1与DoSQE2蛋白跨膜区,结果显示(图2),DoSQE1具有2个跨膜区,分别在4~22 aa和55~72 aa;DoSQE2只有1个跨膜区,在5~23 aa。DoSQE1蛋白在204~476 aa、DoSQE2蛋白在211~484 aa处含有鲨烯环氧酶结构域,E值分别为1.32×10−157和3.04×10−154。
2.4 DoSQE1与DoSQE2蛋白空间结构分析
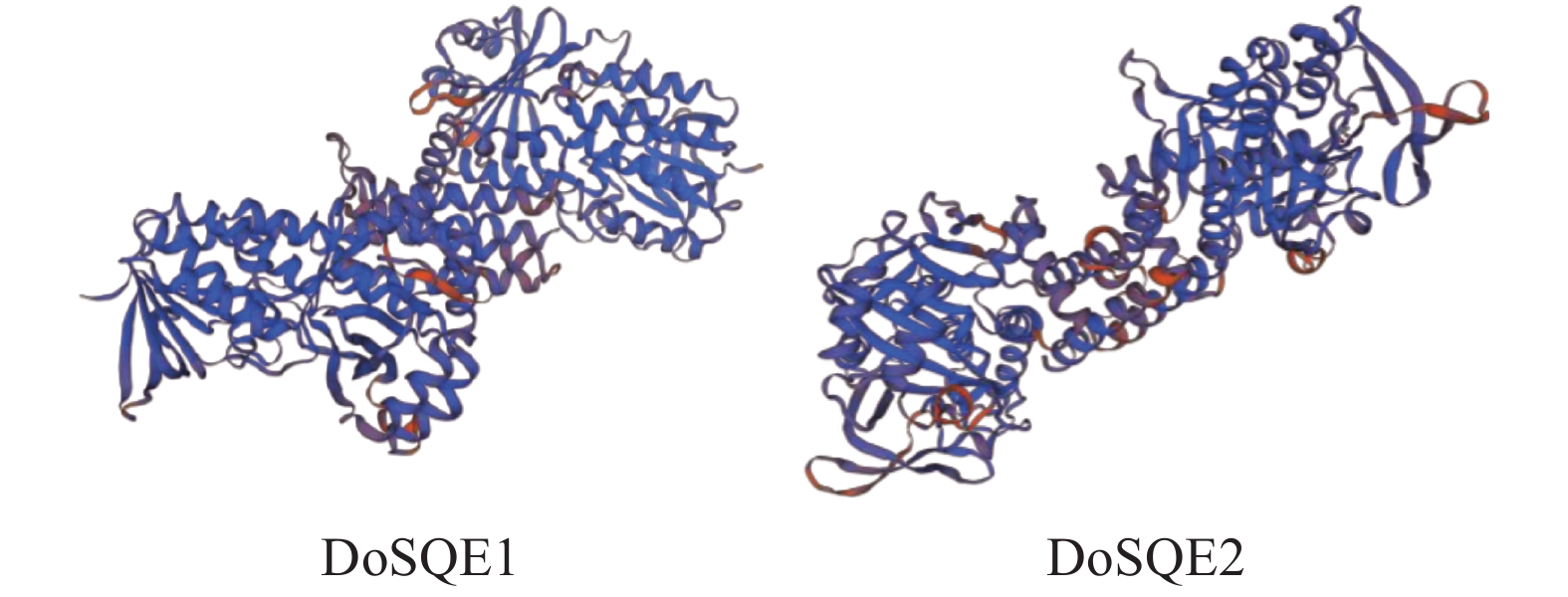
SSPro在线预测DoSQE1与DoSQE2蛋白二级结构结果(图3)表明,DoSQE1和DoSQE2形成无规则卷曲氨基酸残基分别有207(40%)和231(44%)个,形成α螺旋氨基酸残基分别为232(44.9%)个和216(41.1%)个,形成β折叠氨基酸残基都是78个,分别占15.1%和14.9%。通过SWISS-MODEL在线预测,DoSQE1与DoSQE2蛋白3D结构如图4,同源建模的模板都是6c6n.1.A,一致性分别为48.07%和47.37%,建模范围在51~496和78~504位氨基酸残基,覆盖率85%和80%。
![]() 图 3 铁皮石斛DoSQE1和DoSQE2蛋白的二级结构预测注:大写字母:氨基酸序列;小写字母:二级结构;c:无规则卷曲;h:α螺旋;e:β折叠。Figure 3. Predicted secondary structures of DoSQE1 and DoSQE2 from D. officinaleNote:capital letters show amino acid sequence; lowercase letters show amino acid chain structure, as c for random coil, h for α-helix, and e for β-extended form.
图 3 铁皮石斛DoSQE1和DoSQE2蛋白的二级结构预测注:大写字母:氨基酸序列;小写字母:二级结构;c:无规则卷曲;h:α螺旋;e:β折叠。Figure 3. Predicted secondary structures of DoSQE1 and DoSQE2 from D. officinaleNote:capital letters show amino acid sequence; lowercase letters show amino acid chain structure, as c for random coil, h for α-helix, and e for β-extended form.2.5 DoSQE1与DoSQE2蛋白同源性系统进化分析
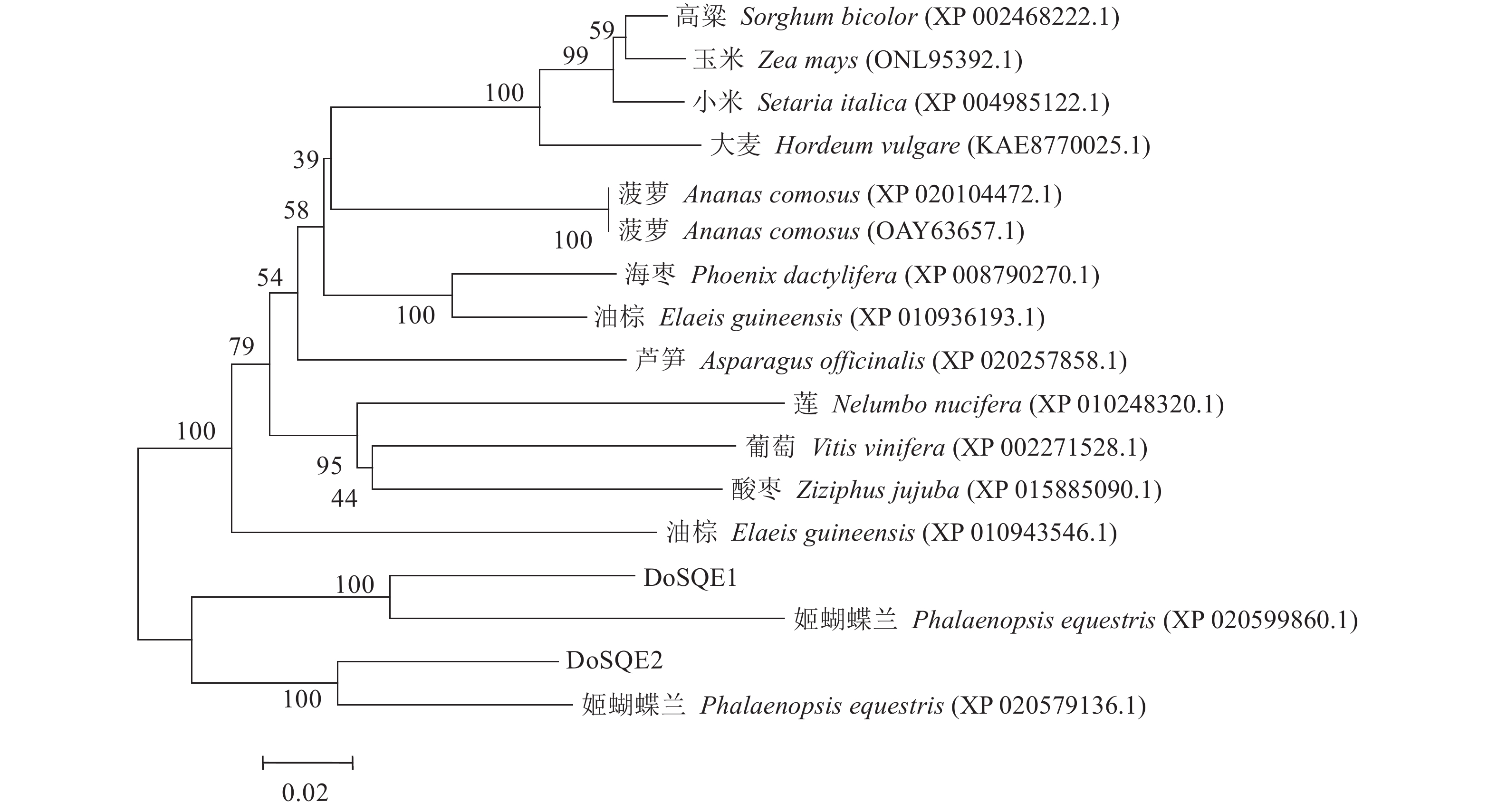
使用BLAST P检索DoSQE1与DoSQE2蛋白的同源序列,结果表明:DoSQE1蛋白的氨基酸与姬蝴蝶兰(Phalaenopsis equestris, XP_020599860.1)、高粱(Sorghum bicolor, XP_002468222.1)和油棕(Elaeis guineensis, XP_010936193.1)SQE氨基酸序列的相似度分别为86%、85%和84%。DoSQE2蛋白的氨基酸与姬蝴蝶兰(Phalaenopsis equestris, XP_020579136.1)、小米(Setaria italica, XP_004985122.1)和玉米(Zea mays, ONL95392.1)SQE氨基酸序列的相似度分别为87%、86%和86%。将DoSQE1与DoSQE2蛋白的氨基酸序列与其他15个物种的SQE氨基酸序列进行系统进化分析,结果(图5)显示,兰科植物的铁皮石斛和姬蝴蝶兰聚为一类,DoSQE1与姬蝴蝶兰的XP_020599860.1亲缘关系最近,DoSQE2与姬蝴蝶兰的XP_020579136.1亲缘关系最近。
2.6 DoSQE1与DoSQE2基因表达分析
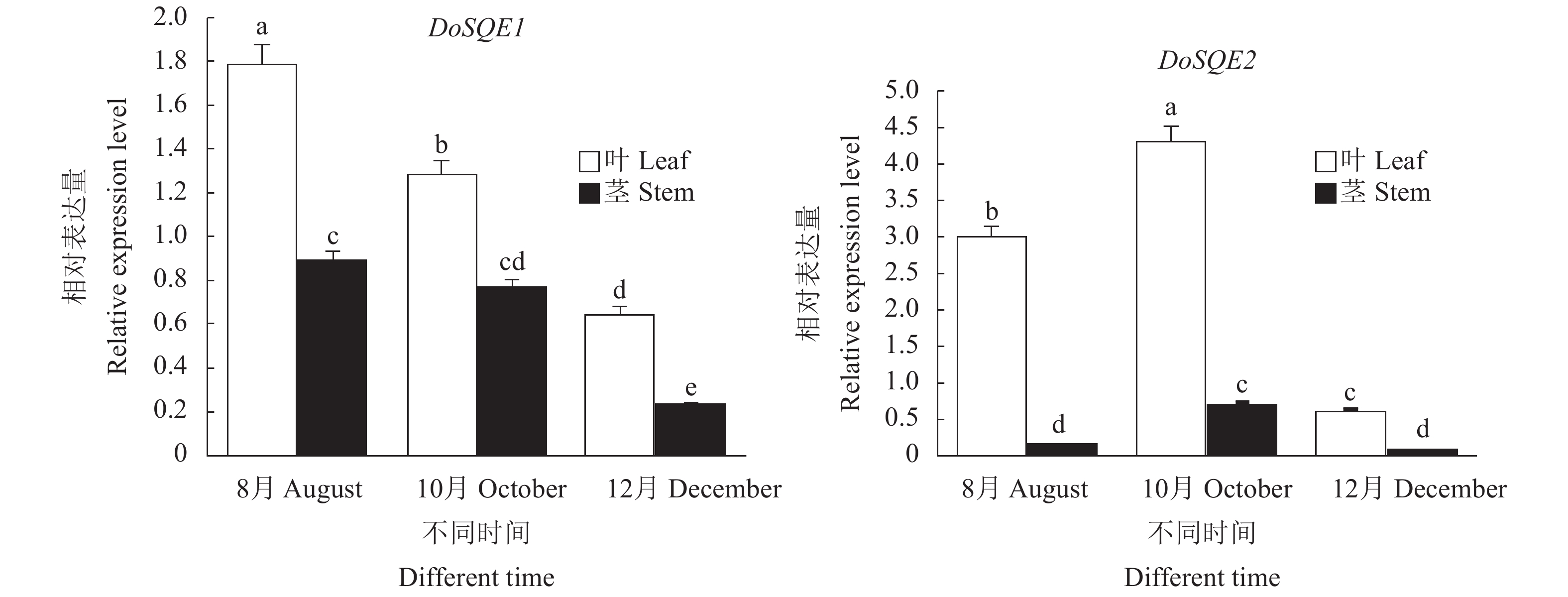
利用qRT-PCR检测DoSQE1和DoSQE2基因在铁皮石斛茎和叶中的表达模式,结果(图6)表明,茎和叶中都能检测到2个基因的表达,相同时间叶的表达量显著高于茎。DoSQE1基因在铁皮石斛茎和叶中的表达量8月份最高,10月份次之,12月份最低。DoSQE2基因在铁皮石斛茎和叶中的表达量10月份最高,8月份次之,12月份最低。
3. 讨论与结论
鲨烯单加氧酶是三萜类和甾醇类化合物生物合成关键酶。本研究克隆了铁皮石斛DoSQE1和DoSQE2基因,核苷酸序列相似度为79.78%,编码氨基酸相似度为80.95%,含有鲨烯环氧酶结构域。DoSQE1与野三七的PvfSE[19]一样具有2个跨膜区;DoSQE2与雷公藤的TwSE2[15]一样仅有1个跨膜区。由于DoSQE1和DoSQE2跨膜区个数不同,推测蛋白在膜内和膜外的结构不一样,催化活性也存在差异。
不同植物具有不同的SQE基因拷贝数[24],不同SQE基因组织表达模式也具有差异。雷公藤TwSE1基因表达量最高的是花,最低的是根;TwSE2基因表达量最高的是花和嫩叶,最低的是老叶[15]。DEVARENNE[25]等研究发现,提高或降低SQE基因的表达量,三萜皂苷的生成量也随之增加或减少。CHOI等[26]研究表明,茉莉酸甲酯(MeJA)诱导提高SQE基因的表达,增加了三萜的合成量。铁皮石斛DoSQE1和DoSQE2基因在茎和叶都有表达,叶的表达量显著高于茎。DoSQE1基因从8月份到12月份表达量逐渐降低。DoSQE2基因表达量从8月份到12月份是先升高后降低。DoSQE1和DoSQE2基因表达模式不同,推测两者在铁皮石斛营养生长过程的催化活性存在差异。
本研究克隆了铁皮石斛DoSQE1和DoSQE2基因,分析了营养生长期的表达模式,为进一步研究其在铁皮石斛甾醇类化合物生物合成中的功能奠定基础。
-
图 3 铁皮石斛DoSQE1和DoSQE2蛋白的二级结构预测
注:大写字母:氨基酸序列;小写字母:二级结构;c:无规则卷曲;h:α螺旋;e:β折叠。
Figure 3. Predicted secondary structures of DoSQE1 and DoSQE2 from D. officinale
Note:capital letters show amino acid sequence; lowercase letters show amino acid chain structure, as c for random coil, h for α-helix, and e for β-extended form.
表 1 PCR引物序列信息
Table 1 Sequence of PCR primers
引物名称
Primer name引物序列(5′-3′)
Primer sequence(5′-3′)引物用途
Primer usage3DoSQE1F1 CCTTCCATTGCTAACGGAGAGA DoSQE1基因 3′RACE引物3′RACE primers of DoSQE1 3DoSQE1F2 CCTGGAGCACTTCTAATGGGAG 3DoSQE2F1 CTCTTCCTACACCTGGAGCACT DoSQE2基因3′RACE引物 3′RACE primers of DoSQE2 3DoSQE2F2 TATACCTTGCGTAAGCCCGTTG dT-adaptor CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT 3′RACE接头引物 Adaptor primers of 3′RACE adaptor CTGATCTAGAGGTACCGGATCC DoSQE1F CGCGGTACCATGATGCTTCTCCAGTACA DoSQE1基因ORF克隆引物 primers of DoSQE1 ORF clone DoSQE1R CGCGTCGACGGAGTTCTCATTGTGTAGG DoSQE2F CGCGGTACCATGGTGATGCCACTTTCGTA DoSQE2基因ORF克隆引物 primers of DoSQE2 ORF clone DoSQE2R CGCGTCGACGTTGGAAGTTCACCCACGAG DoSQE1-F AGGACGCAAACAGCGAGAG DoSQE1基因表达分析引物 Expression analysis primers of DoSQE1 DoSQE1-R CACCAACGATTCTATGAGGC DoSQE2-F CCCCAGATACCGAGTCAG DoSQE2基因表达分析引物 Expression analysis primers of DoSQE2 DoSQE2-R CCCATCAGAAGTGCTCCAG DoACT-F AGGAAGGCGGCTTTGAATC 内参基因 Reference gene DoACT-R CCATGCCAACCATGACACC 注:下划线碱基为酶切位点。
Note:The ud bases were the enzyme site. -
[1] 吴时敏, 吴谋成, 马莉. 植物甾醇在菜籽高级烹调油中的抗氧化作用(Ⅱ): 高温下抗氧化作用的研究 [J]. 中国油脂, 2003, 28(5):32−33. DOI: 10.3321/j.issn:1003-7969.2003.05.012 WU S M, WU M C, MA L. Antioxidant effect of phytosterols in high grade rapeseed cooking oil(Ⅱ): antioxidant effect at high temperature [J]. China Oils and Fats, 2003, 28(5): 32−33.(in Chinese) DOI: 10.3321/j.issn:1003-7969.2003.05.012
[2] 曹玫, 欧阳露. 植物甾醇的抗肿瘤作用及其机制研究进展 [J]. 实用药物与临床, 2015, 18(9):1104−1107. CAO M, OUYANG L. Study on development of anti-tumor effect of phytosterols [J]. Practical Pharmacy and Clinical Remedies, 2015, 18(9): 1104−1107.(in Chinese)
[3] 张蕾, 陈庆森, 阎亚丽, 等. 植物甾醇对心血管疾病作用的研究现状 [J]. 食品科学, 2013, 34(23):344−350. ZHANG L, CHEN Q S, YAN Y L, et al. Phytosterols in the prevention and treatment of cardiovascular diseases [J]. Food Science, 2013, 34(23): 344−350.(in Chinese)
[4] 廖俊杰, 李文静, 李进进, 等. 铁皮石斛有效成分与功效研究进展 [J]. 广东轻工职业技术学院学报, 2015, 14(3):16−19, 26. DOI: 10.3969/j.issn.1672-1950.2015.03.004 LIAO J J, LI W J, LI J J, et al. Advances in the constituents and pharmacological effects of Dendrobium candidum Wall. Ex. Lind [J]. Journal of Guangdong Industry Technical College, 2015, 14(3): 16−19, 26.(in Chinese) DOI: 10.3969/j.issn.1672-1950.2015.03.004
[5] 孙恒, 胡强, 金航, 等. 铁皮石斛化学成分及药理活性研究进展 [J]. 中国实验方剂学杂志, 2017, 23(11):225−234. SUN H, HU Q, JIN H, et al. Research advances in chemical constituents and pharmacological activities of Dendrobii Officinalis Caulis [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(11): 225−234.(in Chinese)
[6] 杨柳, 刘守金, 胡江苗, 等. GC-MS法检测铁皮石斛茎中挥发性成分 [J]. 中国现代中药, 2013, 15(5):362−364. DOI: 10.3969/j.issn.1673-4890.2013.05.003 YANG L, LIU S J, HU J M, et al. Determination of volatile components from stem of Dendrobium officinale by GC-MS [J]. Modern Chinese Medicine, 2013, 15(5): 362−364.(in Chinese) DOI: 10.3969/j.issn.1673-4890.2013.05.003
[7] 仝晶晶, 虞泓, 曾文波, 等. 6个不同产地铁皮石斛功效成分的分析研究 [J]. 云南中医学院学报, 2017, 40(5):81−84. TONG J J, YU H, ZENG W B, et al. Study on functional components of Dendrobium officinale from different culturing areas [J]. Journal of Yunnan University of Traditional Chinese Medicine, 2017, 40(5): 81−84.(in Chinese)
[8] 尹艳, 关红雨, 张夏楠. 甾体皂苷生物合成相关酶及基因研究进展 [J]. 天然产物研究与开发, 2016, 28(8):1332−1336. YIN Y, GUAN H Y, ZHANG X N. Review on enzymes and genes related to the biosynthesis of steroidal saponins [J]. Natural Product Research and Development, 2016, 28(8): 1332−1336.(in Chinese)
[9] 刘强, 丛丽娜, 张宗申. 植物甾醇与三萜类皂苷生物合成基因调控的研究进展 [J]. 安徽农业科学, 2006, 34(19):4844−4846. DOI: 10.3969/j.issn.0517-6611.2006.19.012 LIU Q, CONG L N, ZHANG Z S. Research progress in genetic analysis of the biosynthesis of phytosterols and triterpene saponins [J]. Journal of Anhui Agricultural Sciences, 2006, 34(19): 4844−4846.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2006.19.012
[10] 李珍, 王东浩, 姚伟, 等. 丹参环阿屯醇合酶基因克隆及表达分析 [J]. 西北植物学报, 2013, 33(7):1285−1291. LI Z, WANG D H, YAO W, et al. Cloning and expression analysis of cycloartenol synthase gene from Salvia miltiorrhiza bunge [J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(7): 1285−1291.(in Chinese)
[11] YIN J, YANG J, MA H S, et al. Expression characteristics and function of CAS and a new beta-amyrin synthase in triterpenoid synthesis in birch (Betula platyphylla Suk.) [J]. Plant Science, 2020, 294: 110433. DOI: 10.1016/j.plantsci.2020.110433
[12] SRIVASTAVA G, SANDEEP, GARG A, et al. Transcriptome analysis and functional characterization of oxidosqualene cyclases of the Arjuna triterpene saponin pathway [J]. Plant Science, 2020, 292: 110382. DOI: 10.1016/j.plantsci.2019.110382
[13] HAN J Y, JO H J, KWON E K, et al. Cloning and characterization of oxidosqualene cyclases involved in taraxasterol, taraxerol and bauerenol triterpene biosynthesis in Taraxacum coreanum [J]. Plant and Cell Physiology, 2019, 60(7): 1595−1603. DOI: 10.1093/pcp/pcz062
[14] 孙蓉, 罗吉, 刘姗, 等. 金龙胆草鲨烯环氧酶基因的克隆及原核表达 [J]. 基因组学与应用生物学, 2016, 35(11):3141−3146. SUN R, LUO J, LIU S, et al. Cloning and prokaryotic expression of squalene epoxidase gene from Conyza blinii H.Lév [J]. Genomics and Applied Biology, 2016, 35(11): 3141−3146.(in Chinese)
[15] 祝传书, 刘艳, 陈蒙蒙, 等. 雷公藤鲨烯环氧酶基因克隆与表达分析 [J]. 西北植物学报, 2018, 38(5):785−791. DOI: 10.7606/j.issn.1000-4025.2018.05.0785 ZHU C S, LIU Y, CHEN M M, et al. Cloning and expression analysis of squalene epoxidase genes in Tripterygium wilfordii [J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(5): 785−791.(in Chinese) DOI: 10.7606/j.issn.1000-4025.2018.05.0785
[16] 王学方, 景炳年, 周雍, 等. 大戟科植物鲨烯环氧酶核苷酸及其编码氨基酸序列生物信息学分析 [J]. 河南科学, 2019, 37(7):1082−1089. DOI: 10.3969/j.issn.1004-3918.2019.07.009 WANG X F, JING B N, ZHOU Y, et al. Bioinformatics analysis of squalene epoxidase coding gene and amino acid sequence in Euphorbiaceae [J]. Henan Science, 2019, 37(7): 1082−1089.(in Chinese) DOI: 10.3969/j.issn.1004-3918.2019.07.009
[17] 胡薇, 刘宁, 田玉华, 等. 人参鲨烯环氧酶基因的克隆与原核表达 [J]. 西北农林科技大学学报(自然科学版), 2012, 40(10):207−212. HU W, LIU N, TIAN Y H, et al. Cloning, expression of squalene epoxidase from Panax ginseng [J]. Journal of Northwest A & F University(Natural Science Edition), 2012, 40(10): 207−212.(in Chinese)
[18] 蒋军富, 李雄英, 吴耀生, 等. 绞股蓝鲨烯环氧酶基因的克隆与序列分析 [J]. 西北植物学报, 2010, 30(8):1520−1526. JIANG J F, LI X Y, WU Y S, et al. Cloning and sequence analysis of squalene epoxidase gene from Gynostemma pentaphyllum [J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(8): 1520−1526.(in Chinese)
[19] 王宝婕, 朱灵英, 周青青, 等. 野三七鲨烯环氧酶基因的克隆及原核表达 [J]. 中国实验方剂学杂志, 2019, 25(22):147−153. WANG B J, ZHU L Y, ZHOU Q Q, et al. Cloning and prokaryotic expression of squalene epoxidase gene from Panax vietnamensis var. fuscidiscus [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(22): 147−153.(in Chinese)
[20] 李国栋, 韩丽君, 刘小莉, 等. 金铁锁鲨烯环氧酶基因的克隆与表达 [J]. 中药材, 2016, 39(10):2210−2216. LI G D, HAN L J, LIU X L, et al. Cloning, analysis and expression of squalene epoxidase gene in Psammosilene tunicoides [J]. Journal of Chinese Medicinal Materials, 2016, 39(10): 2210−2216.(in Chinese)
[21] 林江波, 王伟英, 邹晖, 等. 基于转录组测序的铁皮石斛植物甾醇生物合成相关基因分析 [J]. 热带亚热带植物学报, 2019, 27(6):693−701. DOI: 10.11926/jtsb.4025 LIN J B, WANG W Y, ZOU H, et al. Analysis of related genes in phytosterol biosynthesis in Dendrobium officinale based on transcriptome sequencing technology [J]. Journal of Tropical and Subtropical Botany, 2019, 27(6): 693−701.(in Chinese) DOI: 10.11926/jtsb.4025
[22] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 2013, 30(12): 2725−2729. DOI: 10.1093/molbev/mst197
[23] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method [J]. Nature Protocols, 2008, 3(6): 1101−1108. DOI: 10.1038/nprot.2008.73
[24] XING Z B, CAO L, CHEN L, et al. Cloning and sequence analysis on cDNA of squalene epoxidase gene in Eleutherococcus senticosus [J]. China Journal of Chinese Materia Medica, 2012, 37(2): 172−175.
[25] DEVARENNE T P, GHOSH A, CHAPPELL J. Regulation of squalene synthase, a key enzyme of sterol biosynthesis, in tobacco [J]. Plant Physiology, 2002, 129(3): 1095−1106. DOI: 10.1104/pp.001438
[26] CHOI D W, JUNG J, HA Y I, et al. Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites [J]. Plant Cell Reports, 2005, 23(8): 557−566. DOI: 10.1007/s00299-004-0845-4




 下载:
下载: