Effects of Spanish River Carbonatite on Soil and Bacterial Community at Tea Plantations
-
摘要:目的 探讨西班牙河碳酸盐岩(Spanish river carbonatite, SRC)对茶园土壤酸化、重金属以及土壤细菌多样性和群落结构的影响,为茶园土壤改良提供科学依据。方法 通过盆栽和大田试验,应用pH计、原子荧光法以及高通量测序技术分析施用SRC对茶园土壤pH、重金属含量以及细菌群落的影响。结果 大田和盆栽试验均表明添加SRC可提高茶树种植土壤的pH值,盆栽试验表明低浓度的SRC的施入量就可显著降低土壤中Cd、Cu的含量,大田试验表明SRC的施用可显著降低8种重金属的含量;盆栽试验表明SRC对土壤微生物的组成有显著影响,大田试验表明施用SRC可提高土壤养分。结论 施用SRC可显著改良茶园土壤,改良土壤重金属污染,增加茶园土壤的养分。Abstract:Objective Effects of Spanish river carbonatite (SRC) on acidification and metal elements in soil and structure and diversity of microbial community at tea plantations were investigated.Method Changes on pH, heavy metals, and microbial community in the soil under SRC application were monitored for evaluation.Result The field and pot culture experiments showed that SRC addition alleviated acidification and heavy mental pollution in the soil. In the pot culture, low concentration of SRC significantly reduced the contents of Cd and Cu in soil. Whereas, the field experiment showed significant reductions on all tested heavy metals. In comparison to control, SRC addition exerted a significant impact on the microbial community structure in the pot culture, and increased the nutrient contents facilitating the microbial growth in the field test.Conclusion Both field and pot experiments demonstrated the desirable rise on pH, decline on heavy metals content, and improvements on microbial diversity and community structure in the soil by the incorporation of SRC.
-
0. 引言
【研究意义】福建省是中国乌龙茶之乡,是名茶铁观音、武夷岩茶的发源地,位居中国重点产茶省份之首。土壤作为茶树生长赖以生存的营养来源,其酸化程度对茶树的生长及茶叶的品质有重要影响。然而,目前福建省土壤pH值适宜茶树生长的茶园比例还不足15%,pH值在4.5以下的茶园占比87%[1],茶园土壤酸化成为影响茶树生长、茶叶品质的关键因素。土壤酸化不仅造成钙离子、锰离子、钾离子等大量流失,大大降低土壤磷、钼和硼的有效性,致使土壤肥力显著下降[1-2],而且可导致重金属元素的活化[3],重金属在土壤中的不断积累,最终可通过茶叶危害人类健康,成为茶叶质量安全的主要限制因素[4-6]。除此之外,土壤酸化还会减少土壤中有益微生物的活性和数量,进而影响土壤中碳、氮、硫、磷等的循环[3],导致茶树根的发育受阻,阻止养分的吸收[7],最终影响茶树生长和茶叶品质。因此,有效缓解茶园土壤酸化进程,对提高茶叶品质和发展茶叶质量安全生产等具有重要的意义。【前人研究进展】茶树属于喜酸植物,但是由于长期施肥不合理以及茶树特性[2],导致我国茶园土壤酸化程度日益严重。土壤酸化可带来一系列问题,首先是土壤重金属的活化[8];茶园土壤酸度降低会导致土壤吸附重金属离子的能力降低,从而活化重金属,使重金属溶解性、移动性和有效性增加[9]。目前,我国农田重金属污染主要分为5种健康风险元素,包括Cd、As、Hg、Pb和Cr;以及3种生态风险元素,包括Ni、Cu和Zn[10]。鉴于茶园重金属污染主要暴露途径是通过茶叶对人体健康造成损害,因此茶园重金属污染主要检测上述5种健康风险元素,其中更以Cd为主[10]。钟晓兰等[11]的研究发现,土壤酸性增加能增强土壤活性态Cd的含量,且随着pH的降低,Cd活化能力增高,土壤Cd含量越高。其次,茶园土壤酸化可导致土壤有益微生物的活性降低和菌落组成减少[8, 12]。茶园微生物具有固氮、解磷、释钾、分解有机物和保持土壤保湿性等作用,可以有效调节茶园生态,促进茶的芽萌发,影响茶树次生代谢。除此之外,还可以帮助合成茶叶特殊的芳香物质,对茶树生长、茶叶品质提高具有积极的影响[12-13]。然而,随着近年来茶园集约化的高强度生产,福建省茶园土壤酸化呈加重趋势。因此,为了有效遏制土壤酸化、确保农产品的食品安全生产,需要找到快速、有效遏制的防治策略。西班牙河碳酸盐岩(Spanish river carbonatite, SRC)作为酸性土壤调理剂、草碳堆肥和矿物肥料,具有碱性强,微量元素高、有害元素低等优势,已在加拿大、俄罗斯等国家应用[14-15]。在我国,SRC已证明可以显著改良蔬菜种植土壤的酸性,例如,陈云峰等[15]采用大田和室内试验证明SRC对种植小白菜的土壤酸性具有明显的改良效果。【本研究切入点】然而,SRC对于茶园土壤酸化的改良效果还未可知,其在茶园的相关应用调查还未见报道。【拟解决的关键问题】为验证SRC在茶园土壤改良方面的应用潜力,采用盆栽和大田试验分别验证SRC对土壤酸性、土壤重金属及土壤微生物的影响,测定土壤pH值、重金属含量、并利用高通量测序技术检测微生物群落结构,评估SRC对茶园土壤理化性质改良和修复的情况,以有效减缓茶园土壤酸化进程,保障茶园可持续发展。
1. 材料与方法
1.1 室内试验设计
室内试验所用土壤为红壤,取自福建农林大学南区茶园温室土壤,pH 6.13。本研究在不施化肥条件下进行。新鲜土壤粉碎,去除枯枝落叶等杂质后,过3 cm筛子备用。取7份土壤,其中3份土壤(每份土壤重量不少于200 g)进行微生物多样性检测,并测定pH值及8种重金属(Cd、Pb、Cr、Cu和Zn、Ni、Hg、As)的含量[CK(2017)]。本研究所用的碳酸盐岩由博莱生态农业科技有限公司提供,主要成分 SiO2 24.6%、CaO 28.3%、N 0.30%、P2O5 3.13%、K2O 1.07%、pH 8.92,容重 1.52 g·cm−3,为颗粒状固体。剩余4份土壤分别按体积比土壤∶SRC=80∶20、90∶10、95∶5和99∶1进行混合(即分别对应为处理组20%SRC、10%SRC、5%SRC和1%SRC),同时留一组土壤不掺入SRC,作为对照。每个处理组或对照土壤分别装入3个花盆(45 cm×20 cm×15 cm,长×宽×高),每个花盆种植2年生毛蟹品种茶树苗10株。茶苗在室外恢复半月后移至室内条件,LED灯光照,光周期12 h∶12 h,温度(28±1)℃,相对湿度(70±5)%,生长至2018年6月12日[CK(2018)],每个花盆内取土约50 g进行微生物多样性检测分析以及pH值测定,并检测Cd、Pb、Cr、Cu和Zn、Ni、Hg、As等8种重金属的含量。
1.2 大田试验设计
试验地位于福建省泉州市安溪县西坪镇红星茶场内茶园(简称红星茶园,25°0′15.76″N,117°52′0.04″E; 海拔700~750 m)。茶园面积约40 000 m2,该茶园试验地为有机试验茶园,不施用化肥、农药等。该地区属于亚热带湿润季风气候,气温在16~19 ℃,年降水量在1 700~2 100 mm。茶园种植茶树品种为毛蟹,种植年限在50年以上,茶园土壤为红壤。2018年7月14日,在茶园内选择6块茶树地块,每块地面积约300 m2。在6块试验地利用5点取样法采取土样,采样部位选自茶树与施肥沟的中央位置,去除表面枯枝落叶层后0~20 cm的土层。利用工兵铲和锄头挖掘采样断面,用竹铲去除与工具接触的部分后,在整个断面层均衡取样,土壤样本混合均匀后分为3份,用于土壤微生物多样性检测、pH值测定,以及Cd、Pb、Cr、Cu、Zn、Ni、Hg和As等8种重金属的含量检测。随后,在6块试验地中随机选择3块,按1 120 kg·hm−2在茶树主干土壤附近撒施SRC。2019年10月14日,在6块试验地按上述方法取土壤进行微生物、pH值及重金属检测。
1.3 土壤pH、重金属含量分析
取土样10 g放入50 mL烧杯中,加入25 mL水,用玻璃棒剧烈搅动2 min,静置30 min,用台式pH计[型号:FF28,梅特勒-托利多仪器(上海)有限公司,METTLER TOLEDO]进行检测。
土样中Hg和As的含量使用原子荧光法进行测定,详细方法参照国家标准《土壤质量 总汞、总砷、总铅的测定 原子荧光法GB/T 22105.1—2008》;其他6种重金属采用原子吸收分光光度法进行检测,参考标准为《土壤质量 铅、镉的测定 石墨炉原子吸收分光光度法GB/T 17141—1997》、《土壤总铬的测定火焰原子吸收分光光度法HJ 491—2009》、《土壤质量锌、铜的测定 火焰原子吸收分光光度法GB/T 17138—1997》、《土壤质量镍的测定 火焰原子吸收分光光度法GB/T 17139—1997》。
1.4 土壤细菌DNA的提取和纯化
用DNeasy Power Soil Kit (QIAGEN, Inc., Netherlands)试剂盒进行微生物总DNA的提取,并将提取的DNA保存于−20 ℃冰箱内。分别用NanoDrop ND-1000核酸检测仪(Thermo Fisher Scientific,Waltham,MA,USA)和0.8%琼脂糖凝胶电泳对提取的DNA进行品质检测;同时采用紫外分光光度计对提取的DNA进行定量。
以细菌核糖体RNA等能够反映菌群组成和多样性的目标序列为靶点,以稀释后的DNA作为模板,应用带Barcode的特异引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌16S V4区进行PCR扩增,PCR采用25 μL反应体系:2×Phanta Max Buffer 12.5 μL,上下游引物各1 μL,DNA模板1 μL,Phanta Max Super-Fidelity DNA Polymerase 0.5 μL,dNTP Mix 0.5 μL, ddH2O 8.5 μL,使用PCR仪器是Bio-rad T100梯度PCR仪。程序设定为:98 ℃预变性2 min;25个循环(98 ℃变性15 s;55 ℃退火30 s;72 ℃延伸30 s);然后72 ℃延伸5 min。PCR产物使用1.2%的琼脂糖凝胶电泳检测。将PCR扩增产物用磁珠纯化回收。将纯化回收的PCR产物进行荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit,定量仪器为Microplate reader(BioTek,FLx800)。根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。
1.5 土壤细菌DNA多样性分析
依照Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库流程进行文库制备;通过2%琼脂糖凝胶电泳,对文库做最终的片段选择与纯化。上机测序前,需要先对文库在Agilent Bioanalyzer上进行质检,采用Agilent High Sensitivity DNA Kit。合格的文库有且只有单一的峰,且无接头,之后,采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol·L−1以上;将合格的各上机测序文库(Index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序;使用MiSeq测序仪进行双端测序。
通过质量初筛的原始序列按照index和barcode信息,进行文库和样本划分,并去除barcode序列。利用FLASH(v 1.2.7)对每个样本的reads进行拼接。本研究主要利用QIIME 和R(v3.2.0)包对数据进行分析。利用QIIME对细菌进行OUT聚类,并计算细菌的多样性指数,包括丰富度指数(CHAO1、ACE)、辛普森多样性指数(Simpson index)、香农多样性指数(Shannon diversity index)。利用R包进行细菌群落间差异性分析(t test以及Monte Carlo permutation test)。同时,为了降低噪音,利用R包(v3.2.0),选取了丰度前5%的菌落进行属水平的主成分分析(PCA)。并对所选取的丰度前5%的菌落,利用聚类分析(Hierarchical clustering)的方法,基于非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)评价不同土壤样本之间的相似度。
2. 结果与分析
2.1 SRC对室内盆栽茶树土壤pH及重金属的改良
与2017年处理前土样相比,2018年对照组土样pH值有降低,但是降低的并不显著(表1),说明较短时间(如一年内)种植茶树不能显著改变土壤pH。然而,种植茶树可显著影响土壤重金属的含量。如室内盆栽种植茶苗一年后,土壤中的重金属Cr、Pb、Ni、As、Zn的含量发生显著富集(表1)。为了探索SRC对土壤酸碱度、重金属的调节作用,分析了4种SRC浓度对土壤的改良效果,结果显示:与2018年对照组相比(5.93 ± 0.09),4组SRC处理对土壤的酸化均有调节作用,其中施入10% SRC对土壤酸碱度改良效果最为显著(6.60 ± 0.54)。从重金属上看,SRC效果显著,1% SRC的施入量就可显著降低土壤中Cd的含量。低浓度的SRC(1%~5%)施入对一些重金属含量的降低效果并不理想,甚至使有些重金属含量升高;说明必须要较高浓度的SRC施入量才可改良土壤的重金属含量,然而,高浓度的SRC施入(20%SRC)并不能有效降低Hg含量。同时,发现土壤的pH值并不能随着SRC浓度的升高而升高,例如,20% SRC施入量的土壤pH值低于10% SRC施入量的土壤pH值。这一结果与前人的研究相似,陈云峰等[15]在研究SRC对蔬菜种植土壤酸性改良中,发现土壤pH值提升效果与施用量并不存在正相关关系。因此,认为高浓度的SRC施入(>10%)对茶园土壤有一定的改良作用。
表 1 室内SRC处理对土壤pH值及重金属含量的影响Table 1. Effects of SRC on pH and heavy metals in pot soil指标 Index CK(2017) CK(2018) 1%SRC 5%SRC 10%SRC 20%SRC pH 6.13±0.09 b 5.93±0.09 b 6.23±0.19 ab 6.10±0.06 b 6.60±0.54 a 6.10±0.15 b Cd/(mg·kg−1) 0.29±0.02 b 0.35±0.034 ab 0.21±0.01 c 0.21±0.02 c 0.38±0.02 a 0.11±0.001 c Cr/(mg·kg−1) 40.30±1.55 b 54.20±4.84 a 51.70±1.24 a 55.40±2.66 a 50.70±0.29 a 39.90±3.89 b Pb/(mg·kg−1) 29.10±2.02 c 39.10±4.05 ab 33.00±0.75 b 45.60±1.12 a 34.70±3.07 b 25.50±1.70 c Cu/(mg·kg−1) 116.70±2.90 b 104.70±9.60 b 220.80±13.50 a 221.50±12.20 a 65.50±4.80 c 30.60±2.20 d Ni/(mg·kg−1) 18.70±0.88 b 36.80±3.77 a 32.20±1.09 a 34.40±2.03 a 32.80±3.13 a 17.60±2.50 b Zn/(mg·kg−1) 149.00±7.05 b 263.30±31.80 a 227.70±8.37 a 237.20±11.00 a 232.00±27.20 a 80.90±4.09 c Hg/(mg·kg−1) 0.05±0.01 c 0.04±0.001 c 0.09±0.01 b 0.09±0.01 b 0.04±0.00 c 0.13±0.00 a As/(mg·kg−1) 4.85±0.23 b 3.82±0.37 c 6.17±0.04 a 6.60±0.24 a 3.82±0.37 c 2.58±0.24 d 注:同行数据后不同小写字母表示处理间差异显著(P<0.05)。表3同。
Note: Data with different lowercase letters indicate significant difference among treatments at P<0.05. The same as Table 3.2.2 SRC对室内盆栽茶树土壤细菌多样性的影响
通过高通量测序数据,共得到802 020条有效序列,其中2017年室内种植茶树的土壤的平均有效数据为42 289,2018年室内种植茶树土壤的平均有效数据为44 959,4个处理组20%SRC、10%SRC、5%SRC和1%SRC的土壤样本平均有效数据分别是41 032、46 179、49 355以及43 525。经过数据库比对分析及注释后,基于QIIME软件,对物种进行了OUT聚类。结果显示,20%SRC处理组OTU数最大(1033.7),CK2017对照组最小(911.7),且两组OTU数目差异显著,表明SRC对于土壤细菌的物种数目具有显著影响。进一步对土壤细菌群落丰度指数(Chao1、ACE)以及多样性指数(Shannon、Simpson)进行调查,结果显示,施用SRC可一定程度上增加土壤细菌的种群丰度,但差异不显著(表2)。
表 2 室内SRC处理对土壤细菌多样性的影响Table 2. Effects of SRC on microbial diversity in pot soil样本 Samples Simpson Chao1 ACE Shannon CK(2017) 0.994 b 1 072.0 b 1 147.4 b 8.91 b CK(2018) 0.997 a 1 223.8 ab 1 339.8 ab 9.32 a 1%SRC 0.997 a 1 323.0 a 1 451.7 a 9.36 a 5%SRC 0.996 a 1 208.7 ab 1 333.1 ab 9.17 ab 10%SRC 0.997 a 1 264.1 a 1 404.5 a 9.28 a 20%SRC 0.997 a 1 334.3 a 1 464.7 a 9.38 a 注:同列数据后不同小写字母表示差异显著(P < 0.05)。表4同。
Note: Data with different lowercase letters indicate significant difference among treatments at P<0.05. The same as Table 4.2.3 SRC对室内茶树种植土壤细菌群落组成与结构的影响
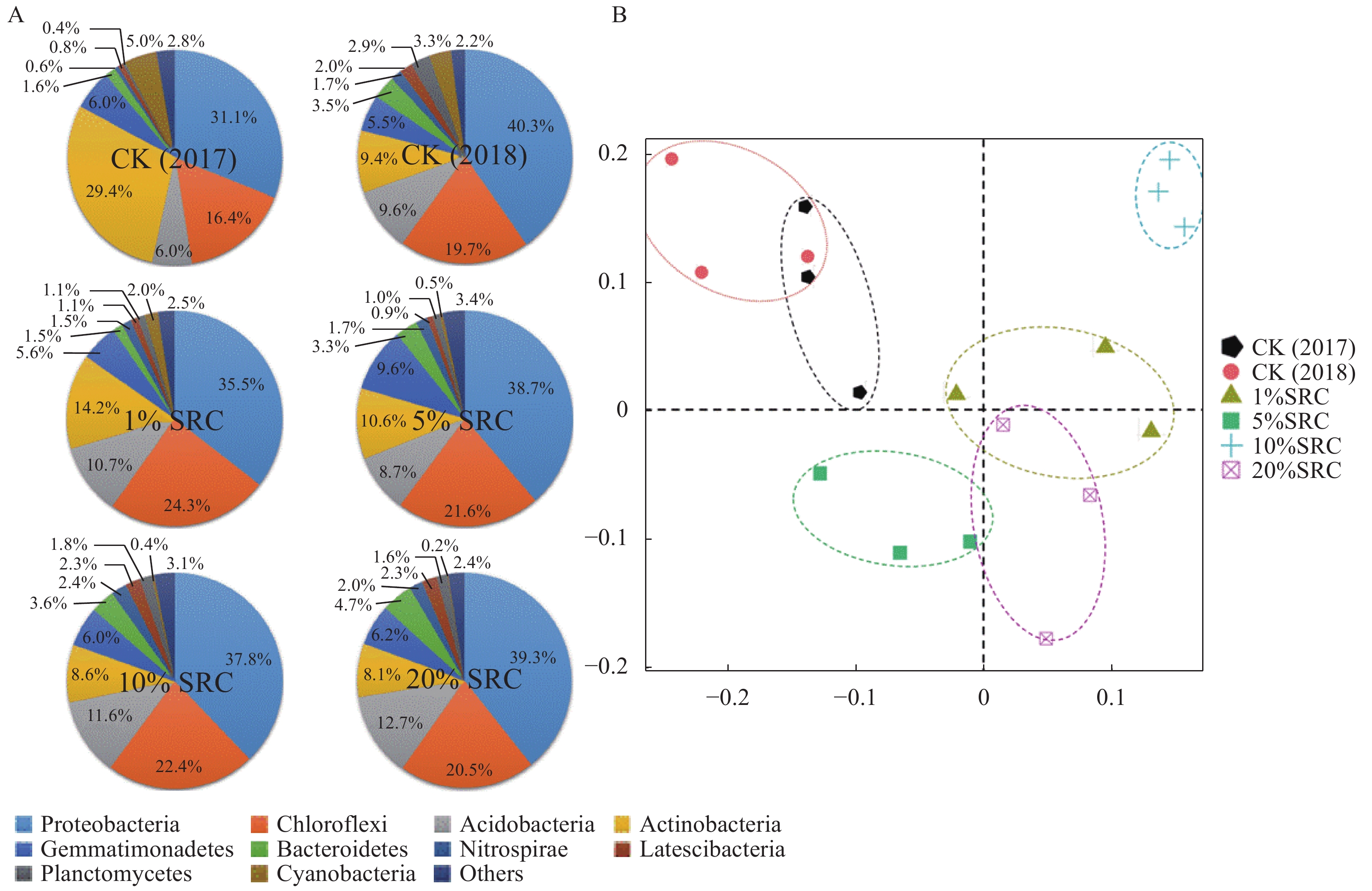
在门水平上,对照组与SRC处理组中的优势菌群均为变形菌门(Proteobacteria)、绿弯菌门(Choroflexi)以及放线菌门(Actinobacteria)。然而,结果显示,茶树的种植可影响土壤细菌群落组成和结构。相较于2017年,种植一年茶树后,其土壤变形菌门和绿弯菌门的比例升高,但是放线菌门的比例却明显降低(图1-A)。SRC处理后,这些优势菌群的结构也发生了明显的改变。土壤中的变形菌门比例降低,绿弯菌门的比例升高,且放线菌门的比例也发生了波动(图1-A);此外,各SRC处理组土壤中蓝藻菌(Cyanobacteria)比例下降明显,5%SRC、10%SRC和20%SRC处理组尤为显著,比例均在1%以下(对照为3.3%)。对丰度前5%的细菌群落,在属水平对群落组成结构进行PCA分析(图1-B),结果表明,SRC处理组土壤细菌的群落组成与对照组的差异较大。
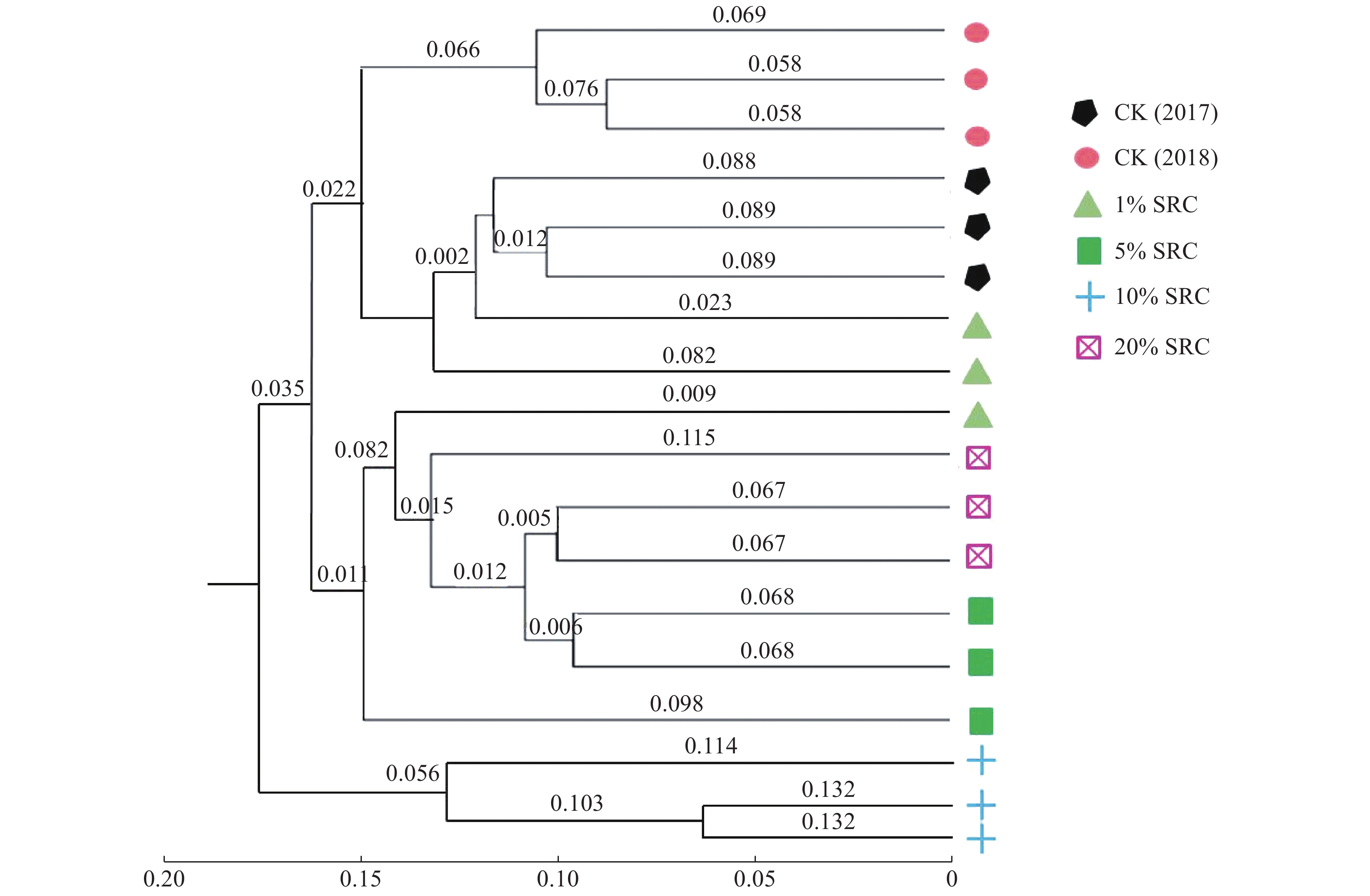
基于非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)评价不同土壤样本之间的相似度。发现10%SRC处理组土壤细菌群落组成聚为一类(图2)。同时,聚类分析也发现了1%SRC处理的土壤重复之间差异较大,这一结果与上述PCA结果相同,说明1%SRC处理所取土壤样本细菌不均一,后续研究可通过增加重复数目来进行改良。
2.4 SRC对茶园土壤pH及重金属的改良
结果显示,一年内茶树种植对茶园土壤的影响并不显著,土壤酸化或者重金属的含量变化不明显(表3)。然而,SRC却可以在短时间内影响茶园土壤,例如,SRC可以在一年内明显改良土壤酸化,使土壤pH值显著上升(表3);对重金属的改良也作用明显,结果显示,施用SRC后,8种土壤重金属含量均显著下降(表3),显示了SRC对茶园土壤改良的潜力。
表 3 SRC处理对茶园土壤pH值和重金属含量的影响Table 3. Effects of SRC on pH and heavy metals in soils at tea plantations指标 Index CK 2018 CK 2019 SRC pH 5.40±0.12 b 5.49±0.25 b 6.23±0.14 a Cd/(mg·kg−1) 0.16±0.01 a 0.17±0.01 a 0.10±0.01 b Cr/(mg·kg−1) 74.60±4.73 ab 78.30±5.31 a 63.30±2.65 b Pb/(mg·kg−1) 88.00±4.57 ab 102.10±10.41 a 82.20±2.90 b Cu/(mg·kg−1) 126.40±4.30 a 149.40±11.26 a 97.30±5.19 b Ni/(mg·kg−1) 83.20±4.16 a 84.90±10.45 a 68.18±6.13 b Zn/(mg·kg−1) 320.80±8.64 a 307.30±24.91 a 159.60±14.20 b Hg/(mg·kg−1) 0.06±0.01 a 0.06±0.01 a 0.04±0.01 b As/(mg·kg−1) 8.15±0.30 a 9.46±0.48 a 5.89±0.95 b 2.5 SRC对茶园土壤细菌群落组成与结构的影响
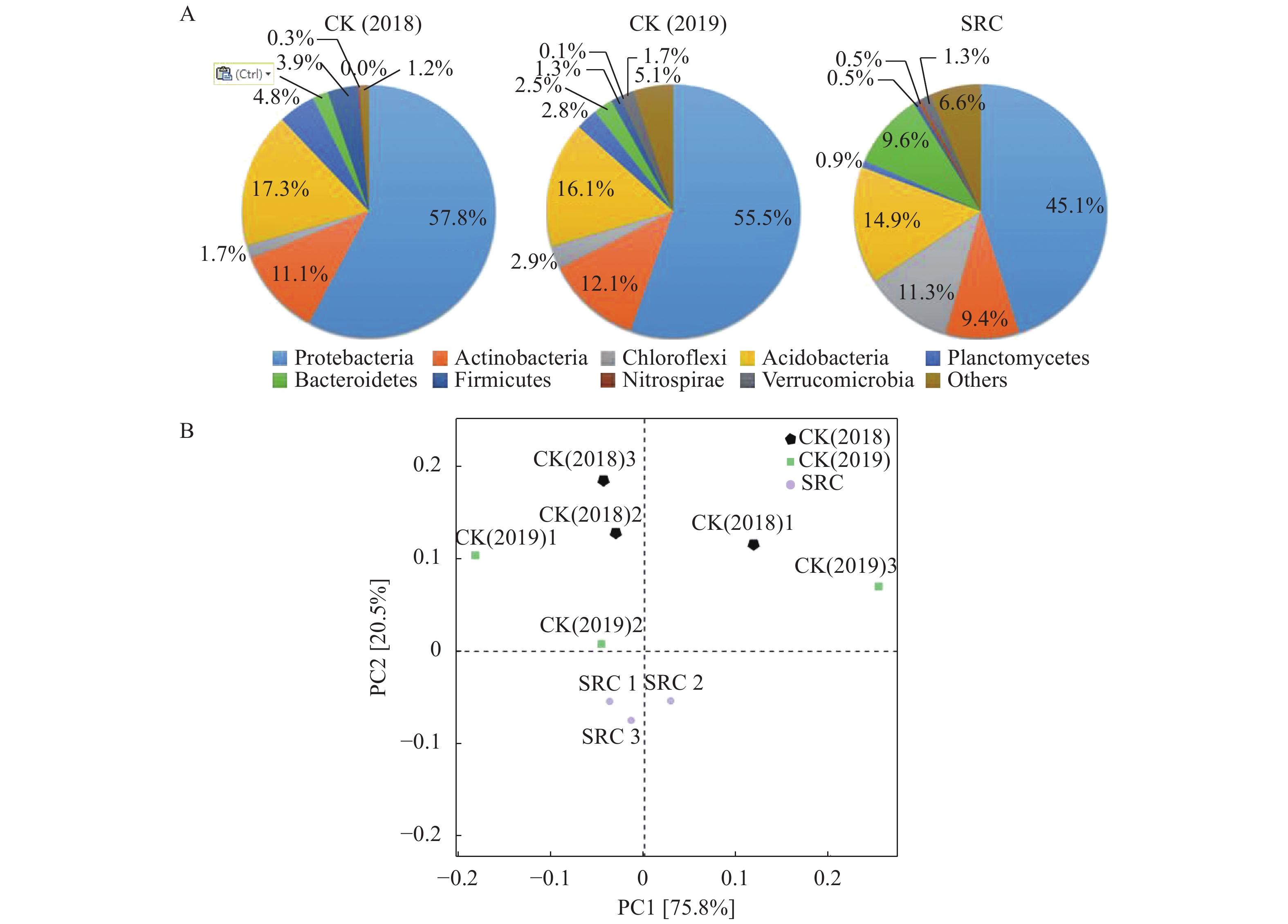
SRC处理后的茶园土壤细菌丰富度上升显著(表4)。从土壤细菌种类在门水平的分布上看(图3),土壤细菌分布比例最高为变形菌(Proteobacteria),两组对照(2018和2019)土壤中变形菌比例均高于55%,分别为57.8%和55.5%,但在SRC处理组中,这一比例降为45.1%(图3-A)。相比两个不同时间段的对照土样CK2018和CK2019,SRC处理组中酸杆菌(Acidobacteria)和厚壁菌(Firmicutes)比例同样下降明显。相反,拟杆菌(Bacteroidetes)和绿弯菌(Chloroflexi)比例上升显著,分别达到9.6%和11.3%。属水平的PCA主成分分析结果表明,SRC处理组土壤细菌群落结果与对照组差异显著(图3-B)。
表 4 SRC处理对茶园土壤细菌多样性的影响Table 4. Effects of SRC on microbial diversity in soils at tea plantations样本 Sample Simpson Chao1 Shannon CK 2018 0.954 a 482.5 c 6.33 c CK 2019 0.972 a 1699.7 b 7.64 b SRC 0.997 a 3077.0 a 9.89 a 3. 讨论与结论
在不施肥的前提下,大田和盆栽试验均表明SRC能明显提升土壤pH,说明SRC对于提升茶树种植土壤pH的效果较稳定,对土壤pH的提升效果不随施用方式不同而波动。SRC是一种火成岩,有害元素较低、碱性较强,磷、硅、钙、钾及微量元素较高,能对土壤酸度起到一定的中和作用[14-16]。盆栽试验中的SRC与土壤混合均匀,而大田试验中,本研究采取的是常用的条施方法,施用深度在20 cm左右。此外,盆栽试验说明,SRC对土壤pH的提升效果不与SRC施用浓度呈正比,10%SRC对土壤pH提升效果最好,这与陈云峰等[15]、James等[17]的研究结果一致。且SRC对于土壤酸化的改良效果已在其他多种经济作物上被验证,如在芦笋、大麦等[15]。综上所述,对于茶园土壤逐年酸化严重的问题,可以通过补施SRC来快速缓解土壤酸化问题。
本研究结果表明,茶园土壤中富集最多的重金属为锌和铜。根据颜明娟等[18]的调查显示,福建地区锌含量有超标现象。此外,叶琛等[19]发现,土壤中的铜、铬、镉含量与茶叶重金属含量具有较强的相关性。盆栽与大田试验发现,添加SRC对重金属污染的改良有一定的效果,盆栽试验表明低浓度SRC的施入量就可显著降低土壤中Cd含量,然而,低浓度的SRC(<10%)对于其他重金属含量的降低效果并不显著。因此,可通过增加碳酸盐岩施用量来解决这一问题。因此,本研究用大剂量的SRC施用量来进行大田试验(1 120 kg·hm−2左右),结果表明大剂量SRC的施用可显著降低8大重金属的含量。
微生物生物群落数量和活性是影响土壤肥力的重要因素[20],而土壤酸化可严重影响土壤微生物群落、结构,导致有益微生物种群大量减少,不利于茶园土壤中养分的转化[21]。部分研究学者提出细菌可分为富营养菌和寡营养菌[22-23],例如,酸杆菌门多生长于营养贫瘠的土壤环境中,因此属于寡营养细菌[23]。本研究发现,相较于未施用SRC的茶园,施用SRC的处理土壤中的酸杆菌门的相对丰度显著下降,这也说明施用SRC可提高土壤养分。
综上所述,在茶园内施用碳酸盐岩(SRC)可以降低土壤酸性、改良土壤重金属污染,提高茶园土壤养分。
-
表 1 室内SRC处理对土壤pH值及重金属含量的影响
Table 1 Effects of SRC on pH and heavy metals in pot soil
指标 Index CK(2017) CK(2018) 1%SRC 5%SRC 10%SRC 20%SRC pH 6.13±0.09 b 5.93±0.09 b 6.23±0.19 ab 6.10±0.06 b 6.60±0.54 a 6.10±0.15 b Cd/(mg·kg−1) 0.29±0.02 b 0.35±0.034 ab 0.21±0.01 c 0.21±0.02 c 0.38±0.02 a 0.11±0.001 c Cr/(mg·kg−1) 40.30±1.55 b 54.20±4.84 a 51.70±1.24 a 55.40±2.66 a 50.70±0.29 a 39.90±3.89 b Pb/(mg·kg−1) 29.10±2.02 c 39.10±4.05 ab 33.00±0.75 b 45.60±1.12 a 34.70±3.07 b 25.50±1.70 c Cu/(mg·kg−1) 116.70±2.90 b 104.70±9.60 b 220.80±13.50 a 221.50±12.20 a 65.50±4.80 c 30.60±2.20 d Ni/(mg·kg−1) 18.70±0.88 b 36.80±3.77 a 32.20±1.09 a 34.40±2.03 a 32.80±3.13 a 17.60±2.50 b Zn/(mg·kg−1) 149.00±7.05 b 263.30±31.80 a 227.70±8.37 a 237.20±11.00 a 232.00±27.20 a 80.90±4.09 c Hg/(mg·kg−1) 0.05±0.01 c 0.04±0.001 c 0.09±0.01 b 0.09±0.01 b 0.04±0.00 c 0.13±0.00 a As/(mg·kg−1) 4.85±0.23 b 3.82±0.37 c 6.17±0.04 a 6.60±0.24 a 3.82±0.37 c 2.58±0.24 d 注:同行数据后不同小写字母表示处理间差异显著(P<0.05)。表3同。
Note: Data with different lowercase letters indicate significant difference among treatments at P<0.05. The same as Table 3.表 2 室内SRC处理对土壤细菌多样性的影响
Table 2 Effects of SRC on microbial diversity in pot soil
样本 Samples Simpson Chao1 ACE Shannon CK(2017) 0.994 b 1 072.0 b 1 147.4 b 8.91 b CK(2018) 0.997 a 1 223.8 ab 1 339.8 ab 9.32 a 1%SRC 0.997 a 1 323.0 a 1 451.7 a 9.36 a 5%SRC 0.996 a 1 208.7 ab 1 333.1 ab 9.17 ab 10%SRC 0.997 a 1 264.1 a 1 404.5 a 9.28 a 20%SRC 0.997 a 1 334.3 a 1 464.7 a 9.38 a 注:同列数据后不同小写字母表示差异显著(P < 0.05)。表4同。
Note: Data with different lowercase letters indicate significant difference among treatments at P<0.05. The same as Table 4.表 3 SRC处理对茶园土壤pH值和重金属含量的影响
Table 3 Effects of SRC on pH and heavy metals in soils at tea plantations
指标 Index CK 2018 CK 2019 SRC pH 5.40±0.12 b 5.49±0.25 b 6.23±0.14 a Cd/(mg·kg−1) 0.16±0.01 a 0.17±0.01 a 0.10±0.01 b Cr/(mg·kg−1) 74.60±4.73 ab 78.30±5.31 a 63.30±2.65 b Pb/(mg·kg−1) 88.00±4.57 ab 102.10±10.41 a 82.20±2.90 b Cu/(mg·kg−1) 126.40±4.30 a 149.40±11.26 a 97.30±5.19 b Ni/(mg·kg−1) 83.20±4.16 a 84.90±10.45 a 68.18±6.13 b Zn/(mg·kg−1) 320.80±8.64 a 307.30±24.91 a 159.60±14.20 b Hg/(mg·kg−1) 0.06±0.01 a 0.06±0.01 a 0.04±0.01 b As/(mg·kg−1) 8.15±0.30 a 9.46±0.48 a 5.89±0.95 b 表 4 SRC处理对茶园土壤细菌多样性的影响
Table 4 Effects of SRC on microbial diversity in soils at tea plantations
样本 Sample Simpson Chao1 Shannon CK 2018 0.954 a 482.5 c 6.33 c CK 2019 0.972 a 1699.7 b 7.64 b SRC 0.997 a 3077.0 a 9.89 a -
[1] 杨向德, 石元值, 伊晓云, 等. 茶园土壤酸化研究现状和展望 [J]. 茶叶学报, 2015, 56(4):189−197. DOI: 10.3969/j.issn.1007-4872.2015.04.001 YANG X D, SHI Y Z, YI X Y, et al. Research progress and prospects on soil acidification at tea plantations [J]. Tea Science and Technology, 2015, 56(4): 189−197.(in Chinese DOI: 10.3969/j.issn.1007-4872.2015.04.001
[2] WANG H, XU R K, WANG N, et al. Soil acidification of alfisols as influenced by tea cultivation in Eastern China [J]. Pedosphere, 2010, 20(6): 799−806.
[3] 徐仁扣. 土壤酸化及其调控研究进展 [J]. 土壤, 2015, 47(2):238−244. XU R K. Research progresses in soil acidification and its control [J]. Soils, 2015, 47(2): 238−244.(in Chinese
[4] 周玉婵, 李明顺. 广西两茶园土壤-茶叶-茶汤系统重金属污染及其转移特征 [J]. 农业环境科学学报, 2008, 27(6):2151−2157. DOI: 10.3321/j.issn:1672-2043.2008.06.005 ZHOU Y C, LI M S. Heavy metal contamination and transportation in soil-tea leaf-tea liquor system in two tea gardens of Guangxi [J]. Journal of Agro-Environment Science, 2008, 27(6): 2151−2157.(in Chinese DOI: 10.3321/j.issn:1672-2043.2008.06.005
[5] 李云, 张进忠, 童华荣. 茶园土壤和茶叶中重金属的监测与污染评价 [J]. 环境科学与技术, 2008, 31(5):71−75. DOI: 10.3969/j.issn.1003-6504.2008.05.019 LI Y, ZHANG J Z, TONG H R. Monitoring and evaluation of heavy metals in soil of tea gardens and teas [J]. Environmental Science & Technology, 2008, 31(5): 71−75.(in Chinese DOI: 10.3969/j.issn.1003-6504.2008.05.019
[6] 江凌, 苏火贵, 王育平, 等. 施用有机肥后安溪茶园土壤中重金属含量及污染评价 [J]. 亚热带水土保持, 2019, 31(4):5−8. DOI: 10.3969/j.issn.1002-2651.2019.04.002 JIANG L, SU H G, WANG Y P, et al. Assessment of heavy metal content and pollution in tea garden soil of Anxi County after the application of organic manure [J]. Subtropical Soil and Water Conservation, 2019, 31(4): 5−8.(in Chinese DOI: 10.3969/j.issn.1002-2651.2019.04.002
[7] 章明奎, 方利平, 张履勤. 酸化和有机质积累对茶园土壤铅生物有效性的影响 [J]. 茶叶科学, 2005, 25(3):159−164. DOI: 10.3969/j.issn.1000-369X.2005.03.001 ZHANG M K, FANG L P, ZHANG L Q. Effects of acidification and organic matter accumulation on lead bio-availability in tea garden soils [J]. Journal of Tea Science, 2005, 25(3): 159−164.(in Chinese DOI: 10.3969/j.issn.1000-369X.2005.03.001
[8] 郑慧芬, 吴红慧, 翁伯琦, 等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性 [J]. 中国土壤与肥料, 2019(2):68−74. ZHENG H F, WU H H, WENG B Q, et al. Improved soil microbial characteristics and enzyme activities with wheat straw biochar addition to an acid tea plantation in red soil [J]. Soils and Fertilizers Sciences in China, 2019(2): 68−74.(in Chinese
[9] 樊战辉, 唐小军, 郑丹, 等. 茶园土壤酸化成因及改良措施研究和展望 [J]. 茶叶科学, 2020, 40(1):15−25. DOI: 10.3969/j.issn.1000-369X.2020.01.002 FAN Z H, TANG X J, ZHENG D, et al. Study and prospect of soil acidification causes and improvement measures in tea plantation [J]. Journal of Tea Science, 2020, 40(1): 15−25.(in Chinese DOI: 10.3969/j.issn.1000-369X.2020.01.002
[10] 陈世宝, 王萌, 李杉杉, 等. 中国农田土壤重金属污染防治现状与问题思考 [J]. 地学前缘, 2019, 26(6):35−41. CHEN S B, WANG M, LI S S, et al. Current status of and discussion on farmland heavy metal pollution pre-vention in China [J]. Earth Science Frontiers, 2019, 26(6): 35−41.(in Chinese
[11] 钟晓兰, 周生路, 李江涛, 等. 模拟酸雨对土壤重金属镉形态转化的影响 [J]. 土壤, 2009, 41(4):566−571. DOI: 10.3321/j.issn:0253-9829.2009.04.010 ZHONG X L, ZHOU S L, LI J T, et al. Effect of simulated acid rains on Cd form transformation in contaminated soil [J]. Soils, 2009, 41(4): 566−571.(in Chinese DOI: 10.3321/j.issn:0253-9829.2009.04.010
[12] 张帅, 户杉杉, 潘荣艺, 等. 茶园土壤酸化研究进展 [J]. 茶叶, 2019, 45(1):17−23. DOI: 10.3969/j.issn.0577-8921.2019.01.009 ZHANG S, HU S S, PAN R Y, et al. Research progress on soil acidification of tea garden [J]. Journal of Tea, 2019, 45(1): 17−23.(in Chinese DOI: 10.3969/j.issn.0577-8921.2019.01.009
[13] 周才碧, 陈文品. 茶园土壤微生物的研究进展 [J]. 中国茶叶, 2014, 36(3):14−15. DOI: 10.3969/j.issn.1000-3150.2014.03.005 ZHOU C B, CHEN W P. Research progress of soil microorganisms in tea gardens [J]. China Tea, 2014, 36(3): 14−15.(in Chinese DOI: 10.3969/j.issn.1000-3150.2014.03.005
[14] 郑寿龙. 施用有机肥对柑橘产量、品质及养分吸收的影响 [J]. 安徽农学通报, 2018, 24(12):46−47. DOI: 10.3969/j.issn.1007-7731.2018.12.022 ZHENG S L. Effects of organic manure application on yield, quality and nutrient absorption of Citrus [J]. Anhui Agricultural Science Bulletin, 2018, 24(12): 46−47.(in Chinese DOI: 10.3969/j.issn.1007-7731.2018.12.022
[15] 陈云峰, 丁鲁平, 舒湘林, 等. 西班牙河碳酸盐岩对蔬菜生长、产量及土壤酸性的影响 [J]. 湖北农业科学, 2019, 58(4):25−27, 31. CHEN Y F, DING L P, SHU X L, et al. Effects of Spanish river carbonatite on vegetable growth, yield and soil acidification [J]. Hubei Agricultural Sciences, 2019, 58(4): 25−27, 31.(in Chinese
[16] 金忠泽. “澄迈福橙” 优质丰产 “标准化” 种植技术 [J]. 中国热带农业, 2015(6):74−77. DOI: 10.3969/j.issn.1673-0658.2015.06.023 JIN Z Z. "Chengmai Fu Orange" high-quality and high-yield "standardized" planting technology [J]. China Tropical Agriculture, 2015(6): 74−77.(in Chinese DOI: 10.3969/j.issn.1673-0658.2015.06.023
[17] JAMES J. Spanish river carbonatite: Its benefits and potential use as a soil supplement in agriculture [D]. Ontario, Canada: Wifrid Laurier University, 2015.
[18] 颜明娟, 吴一群, 张辉, 等. 福建茶园土壤及茶叶重金属监测及污染评价 [J]. 茶叶学报, 2016, 57(2):71−75. DOI: 10.3969/j.issn.1007-4872.2016.02.003 YAN M J, WU Y Q, ZHANG H, et al. Heavy metal contaminations in plantation soils and tea products in Fujian [J]. Tea Science and Technology, 2016, 57(2): 71−75.(in Chinese DOI: 10.3969/j.issn.1007-4872.2016.02.003
[19] 叶琛, 李思悦, 张全发. 三峡库区消落区表层土壤重金属污染评价及源解析 [J]. 中国生态农业学报, 2011, 19(1):146−149. YE C, LI S Y, ZHANG Q F. Sources and assessment of heavy metal contamination in water-1evel fluctuation zone of the Three Gorges Reservoir, China [J]. Chinese Journal of Eco-Agriculture, 2011, 19(1): 146−149.(in Chinese
[20] 陆雅海, 张福锁. 根际微生物研究进展 [J]. 土壤, 2006, 38(2):113−121. DOI: 10.3321/j.issn:0253-9829.2006.02.001 LU Y H, ZHANG F S. The advances in rhizosphere microbiology [J]. Soils, 2006, 38(2): 113−121.(in Chinese DOI: 10.3321/j.issn:0253-9829.2006.02.001
[21] 王世强, 胡长玉, 程东华, 等. 调节茶园土壤pH对其土著微生物区系及生理群的影响 [J]. 土壤, 2011, 43(1):76−80. WANG S Q, HU C Y, CHENG D H, et al. Effects of adjusting pH of tea plantation soil on indigenous microbial fauna and physiological group [J]. Soils, 2011, 43(1): 76−80.(in Chinese
[22] YERGEAU E, BOKHORST S, KANG S, et al. Shifts in soil microorganisms in response to warming are consistent across a range of Antarctic environments [J]. The ISME Journal, 2012, 6(3): 692−702.
[23] 李艳春, 林忠宁, 陆烝, 等. 茶园间作灵芝对土壤细菌多样性和群落结构的影响 [J]. 福建农业学报, 2019, 34(6):690−696. LI Y C, LIN Z N, LU Z, et al. Microbial diversity and community structure in soil under tea bushes-Ganoderma lucidum intercropping [J]. Fujian Journal of Agricultural Sciences, 2019, 34(6): 690−696.(in Chinese
-
期刊类型引用(3)
1. 徐火忠,吴林土,李贵松,洪海清,王允祥,潘瑛洁. 茶园土壤酸化修复技术研究进展. 中国茶叶. 2023(01): 12-17 .  百度学术
百度学术
2. 傅玺豪,朱建强,范先鹏,张志毅,何绍华,倪承凡,吴茂前. 生物炭复配天然矿物对稻田土壤还原性物质的影响. 河南农业科学. 2023(11): 75-84 .  百度学术
百度学术
3. 郭建军,王津津,马强,周艺,李慧慧,武国华. 普定朵贝茶品质与土壤特性的关系研究. 福建农业学报. 2021(03): 296-304 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载: