Anti-peroxidation of Total Flavonoids from Fruits of Ligustrum obtusifolium on Lipids
-
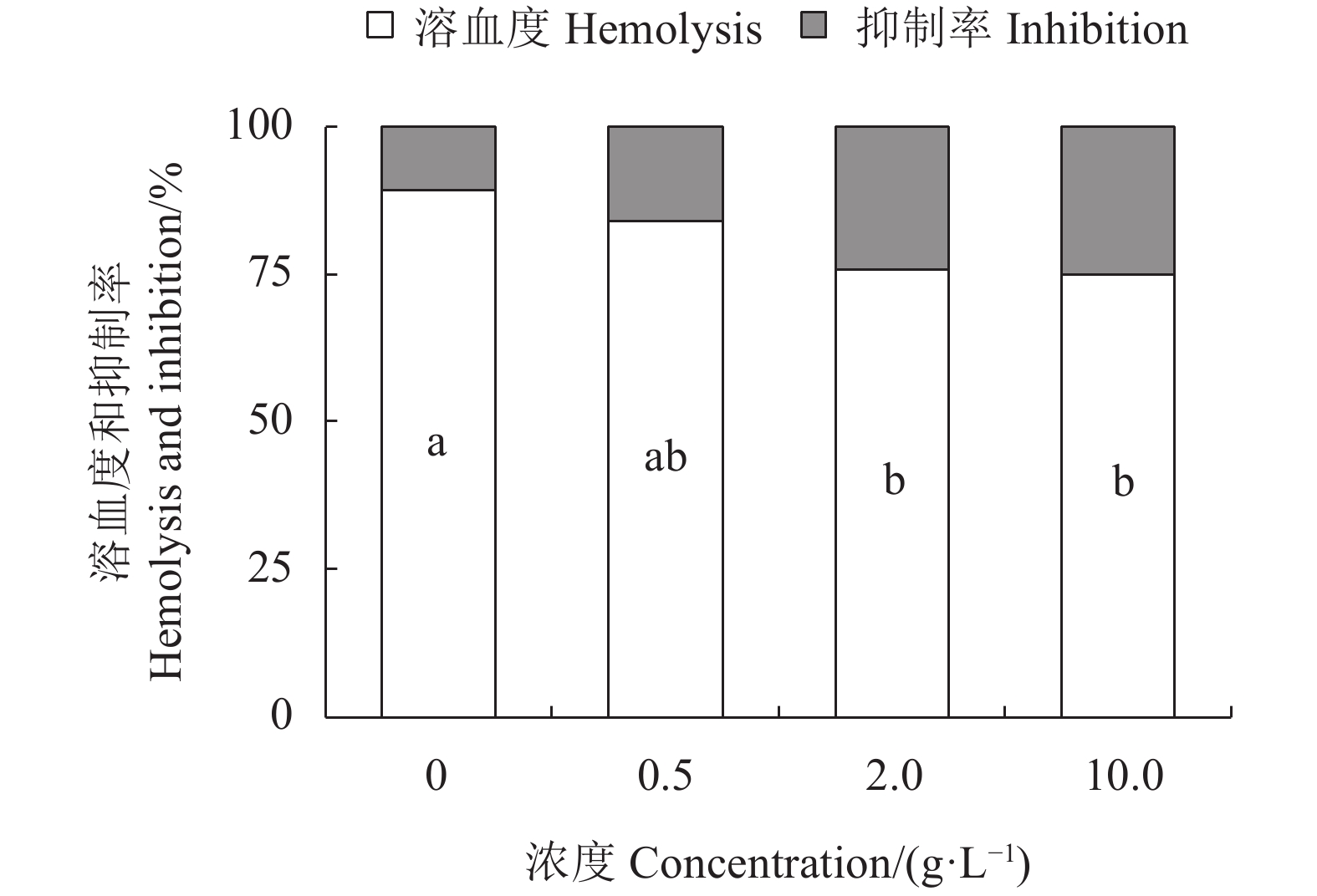
摘要:目的 初步探究水蜡树果实总黄酮的抗脂质过氧化作用。方法 用分光光度法测定水蜡树果实总黄酮对DPPH·自由基和羟自由基(·OH)的清除率,分析其对小鼠肝匀浆中自氧化和诱导(FeSO4和H2O2)生成的丙二醛(MDA)含量、Fe2+与抗坏血酸(Vc)诱导的小鼠肝线粒体肿胀度、H2O2诱导的小鼠红细胞氧化溶血、氧化氢酶(CAT)和谷胱甘肽过氧化氢酶(GSH-Px)活性及谷胱甘肽(GSH)含量的影响。结果 水蜡树果实总黄酮对DPPH·自由基和·OH自由基具有一定的清除能力,IC50分别为(0.45±0.01) g·L−1和(1.57±0.12 )g·L−1;1.0~6.0 g·L−1水蜡树果实总黄酮能抑制自氧化体系中MDA的生成;0.5~6.0 g·L−1总黄酮可降低FeSO4诱导条件下MDA的生成;2.0~6.0 g·L−1总黄酮可抑制H2O2诱导条件下MDA的生成;0.5~10.0 g·L−1总黄酮能明显减缓Fe2+与Vc诱导的肝线粒体悬液OD520值的下降,2.0~10.0 g·L−1总黄酮可明显减弱H2O2诱导红细胞的溶血度;0.6~4.0 g·L−1总黄酮可显著提高CAT和GSH-Px的活性及GSH的含量。结论 水蜡树果实总黄酮可减弱小鼠肝组织自发性过氧化和诱导脂质过氧化,抑制小鼠肝线粒体和红细胞的氧化损伤,提高抗氧化酶的活性及非酶抗氧化物的含量。本研究对水蜡树果实天然抗氧化剂的开发有一定的借鉴意义。Abstract:Objective Anti-peroxidation effect of the flavonoids extracted from fruits of Ligustrum obtusifolium on lipids was investigated.Method Scavenging capacities of the crude extract on DPPH· and hydroxyl (·OH) free radicals were tested using spectrophotometry. Effects of the flavonoids on the malondialdehyde (MDA) content in rat liver homogenate upon spontaneous oxidation or peroxidation by either FeSO4 or H2O2 induction and the mitochondrial swelling on rat liver induced by Fe2+ and ascorbic acid (Vc) as well as the hemolysis of red blood cells (RBCs) induced by H2O2 were assessed in vitro. And the activity of the catalase (CAT) and glutathione peroxidase (GSH-Px) and the level of the glutathione (GSH) were tested in vivo.Result The flavonoid extract exhibited abilities in scavenging DPPH· and ·OH free radicals with IC50 of (0.45±0.01) g·L−1 and (1.57±0.12) g·L−1, respectively. From the concentration of 1.0 g·L−1 to 6.0 g·L−1, the extract significantly reduced the in vitro MDA in rat liver homogenate under spontaneous oxidation; from 0.5 g·L−1 to 6.0 g·L−1, under FeSO4 induction; and, from 2.0 g·L−1 to 6.0 g·L−1 under H2O2 induction. From 0.5 g·L−1 to 10.0 g·L−1, the flavonoids also suppressed the liver mitochondrial swelling induced by Fe2+ and Vc; while, from 2.0 g·L−1 to 10.0 g·L−1, the RBC hemolysis induced by H2O2, and those from 0.6 g·L−1 to 4.0 g·L−1 could enhance the level of CAT, GSH, and GSH-Px.Conclusion The crude flavonoid extract from the fruits of L. obtusifolium significantly inhibited in vitro on both spontaneous and induced lipid peroxidation reducing the oxidative damage on the mitochondria and RBCs of rat liver, and enhance the acitivity of antioxidant enzymes and the content of non-enzyme antioxidants. The results suggested a promising potential in developing a natural antioxidant from the fruits.
-
Keywords:
- Ligustrum obtusifolium fruit /
- total flavonoids /
- antioxidation /
- lipid peroxidation
-
0. 引言
【研究意义】菌糠是栽培各种食用菌后剩下的培养基废料,每生产1 kg食用菌约产生3.25 kg菌糠[1]。我国是食用菌生产大国,随着我国对食用菌需求量的增多,每年产生的菌糠数量也随之增加[2]。随着食用菌产业生产规模的不断扩大,每年产生菌糠8.36×107t [3]。未经处理的菌糠因所含纤维比例较高,存在适口性较差和消化率偏低等问题。研究表明,经生物发酵和酶解作用的菌糠,其纤维素和木质素等成分都得到很大程度的降解,粗蛋白、粗脂肪含量都高于未经发酵的基质[4]。平菇作为我国栽培和消费量最大的菌种之一,栽培后产生的培养基废料量也相对较多。平菇菌糠中含有丰富的氨基酸、蛋白质、多糖、钙、镁及微量元素等[5],具有很大的开发潜力。因此,探讨添加乳酸菌对提高平菇菌糠发酵饲料品质和发酵进程的促进作用,具有重要的现实意义。【前人研究进展】李志香等[6]把多种饲料酵母加入由醋糟和棉籽壳构成的废弃菌糠中,对比分析原菌糠和发酵菌糠后,发现不同基质的菌糠发酵饲料的粗蛋白质含量均高于20%。曹启民等[7]在猪的基本饲料中加入20%的发酵灵芝菌糠后,发现对猪的生长并没有产生显著的影响,但每千克增重饲料成本下降5.19%,瘦肉率显著提高。罗茂春等[8]研究发现,白玉菇菌糠发酵后粗蛋白、无氮浸出物显著提高,粗纤维显著降低,pH值下降,乳酸含量升高,菌糠感官品质得到较大改善。菌糠经过某些微生物的发酵作用,粗纤维中的一些成分被不同程度地降解,同时产生多种糖类尤其是还原糖,提高了菌糠内营养物质的消化利用率[9]。郑有坤等[10]研究表明,微生物发酵处理会降低香菇菌糠的中性洗涤纤维、酸性洗涤纤维和可溶性碳水化合物含量,提高粗蛋白和氨基酸含量,以酵母菌和乳酸菌混合发酵处理的效果最好。同时,微生物还可产生有机酸类等营养物质,提高菌糠的饲用价值[11]。在发酵饲料中添加足够的乳酸菌,可使发酵过程中乳酸菌繁殖的启动时间更早、繁殖速度更快,从而占据主导地位,能有效抑制不良菌的繁殖,减少饲料消耗,提高发酵品质[12]。【本研究切入点】迄今为止,比较不同乳酸菌对平菇菌糠发酵饲料品质改善效果的研究鲜见报道。【拟解决的关键问题】探明不同乳酸菌对平菇菌糠发酵饲料品质和发酵进程的影响,为生产优质菌糠发酵饲料提供理论依据。
1. 材料与方法
1.1 试验原料
平菇菌糠:平菇培养基由73%五节芒、25%麸皮和2%石灰组成,含水率为60%左右。以福建农林大学国家菌草工程技术研究中心栽培平菇采收一茬后的菌糠作为本试验发酵原料。
乳酸菌:由华南农业大学草业科学系饲草加工与贮藏实验室提供的专利菌。其中乳酸菌CCZZ1(Lactic acid bacteria,CCZZ1)为耐低温乳酸菌株,乳酸菌HT1(Lactic acid bacteria,HT1)为耐高温乳酸菌株。
1.2 试验设计
试验设4个处理:添加乳酸菌CCZZ1处理(记为CCZZ1处理)、添加乳酸菌HT1处理(记为HT1处理)、添加乳酸菌CCZZ1+乳酸菌HT1处理(记为MIX处理),以不添加乳酸菌为空白对照(CK)。每个处理最初均设18个重复,装有约100 g菌糠的塑料袋为一个重复。分别在不同发酵天数(1、3、7、15、30、60 d)开封,每个处理的每个开封期均调查3个重复。乳酸菌CCZZ1和乳酸菌HT1单独添加处理的添加量均按每克发酵原料(鲜重)添加1×108 cfu进行;复合添加处理两种乳酸菌的添加量各半,均为5×107 cfu。
1.3 发酵饲料的调制
将收集的菌棒开包后去除其中霉变的部分,捣碎后混合均匀,分别称取300 g菌糠,装入塑料袋内并做好标记。对照处理喷洒蒸馏水5 mL,其余处理各喷洒配制好的添加剂和蒸馏水共计5 mL,混拌均匀后大致分为3等份作为同一天开封的重复处理。每个处理组制作18个这样的菌糠料,分别装入真空袋内并做好标记,用真空泵抽气使其真空后密封。室温下贮存,分别于发酵1、3、7、15、30、60 d后开袋检测。
1.4 项目的测定与检测方法
取代表性的样本20 g装入100 mL备有刻度的广口锥形瓶内,加入80 mL蒸馏水,放入4 ℃冰箱中,18 h后过滤,制浸提液,取50 mL浸提液测定pH值(pHS-3D型酸度计),检测浸提液的氨态氮(AN)含量(苯酚-次氯酸钠比色法) [13];采用岛津LC-20AT型高效液相色谱(色谱柱:Shodex Rspak KC-811 S-DVB gel Column 300×8 mm,检测器:SPD-M10AVp,流动相:3 mmol·L−1高氯酸)测定浸提液的乳酸(LA)、乙酸(AA)、丙酸(PA)、丁酸(BA)含量[14]。氨态氮(AN)用AN/TN的值表示,即测定的氨态氮(AN)占原料总氮(TN)的比例(苯酚-次氯酸钠比色法[13]检测)。乳酸(LA)、乙酸(AA)、丙酸(PA)和丁酸(BA)均用新鲜(FM)基础表示。
新鲜样本在65 ℃恒温箱中烘干48 h,放置常温回潮30 min后粉碎称重,计算含水率,并立即将烘干样粉碎装入密闭的棕色玻璃瓶中备用。采用常规法[15]测定干物质(DM)和粗蛋白质(CP)含量;采用Anthrone比色法[16]测定可溶性碳水化合物(WSC)含量;采用Van Soest 等[16]的方法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量;半纤维素(HC)含量通过测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量,计算二者的差值,即HC=中性洗涤纤维(NDF)–酸性洗涤纤维(ADF);粗灰分(Ash)含量采用灼烧法[17]测定。CP、WSC、NDF、ADF、HC和Ash用干物质(DM)基础表示。
参考傅彤[18]报道的方法测定原料的乳酸菌、细菌、酵母菌和霉菌数量。
1.5 数据分析
用Excel 2003软件初步处理原始数据后,再用SPSS 13.0统计软件对数据进行方差统计分析。相同发酵时间不同添加剂、相同添加剂不同发酵时间对菌糠发酵饲料品质所有项目的影响使用单因子方差分析。单因子方差分析采用Duncan’s多重比较法。
2. 结果与分析
2.1 平菇菌糠的化学成分和微生物组成
从表1看出,供试菌糠的pH值为5.42,呈弱酸性;可溶性碳水化合物含量较低,仅为3.63%;粗蛋白含量为9.62%;中性洗涤纤维和酸性洗涤纤维含量较高,分别为76.03%和64.01%;半纤维素含量为12.02%。
表 1 菌糠的化学成分Table 1. Chemical composition of spent mushroom culture substratepH DM/ % WSC/% CP /% NDF/% ADF/% HC/% 5.42 39.89 3.63 9.62 76.03 64.01 12.02 注:(1)表中营养成分均为菌糠干物质(DM)测定值;(2)WSC:可溶性碳水化合物,CP:粗蛋白,NDF:中性洗涤纤维,ADF:酸性洗涤纤维,HC:半纤维素。
Note:(1)all nutrients in the table are measured by bacterial bran dry matter(DM).(2)WSC: Soluble carbohydrate, CP: Crude protein, NDF: Neutral detergent fiber, ADF: Acid detergent fiber, HC:Hemicellulose.从表2看出,菌糠的微生物组成中好气性细菌数量较多,可与乳酸菌争夺养分,影响乳酸菌的生长繁殖。
表 2 菌糠的微生物组成及数量Table 2. Microorganisms and microbial counts in spent mushroom culture substrate[单位:lg(cfu·g−1)] 乳酸菌
Lactic acid bacteria好气性细菌
Aerobic bacteria酵母菌
Yeast霉菌
Mold2.23 4.98 2.35 1.23 2.2 乳酸菌对平菇菌糠发酵饲料品质和发酵进程的影响
由图1可知,总体而言,平菇菌糠发酵饲料的pH值随发酵时间的增加而降低。在发酵3~30 d的4个发酵时间点上,3个添加乳酸菌处理组(以下简称:添加组)的pH值均显著低于对照组(CK)(P<0.05),同一时间点均以MIX处理组的pH值最低,且在发酵15 d时复合添加组(MIX组)显著低于2个单独添加组(P<0.05);3个添加组的pH值在发酵7 d时均降到4.2以下(一般发酵饲料的pH值在4.2以下品质较优),而CK组的pH值在发酵30 d时才降到4.2以下。也就是说,3个添加组的pH值比CK组提前23 d下降到4.2以下,且以MIX组下降速度最快。
![]() 图 1 不同处理、不同发酵时间的菌糠发酵饲料pH值注:①图中每个时间点不同处理差异显著性标注从上到下依次是CK、CCZZI、HT1、MIX处理组;②( )内无相同字母表示同一时间点不同处理组间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05);( )外无相同字母表示同一处理组不同时间点间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05)。图2~3、表3~12同。Figure 1. Effect of treatments on pH of fermented feed materialNote:①The significant markers of different treatments at each time point in the figure from top to bottom are CK, CCZZI, HT1 and MIX treatment groups.(same as Figure1-3)②Different letters in "( )" indicate that there are significant differences among different treatment groups at the same time(P<0.05), the same letters or not marked letters show no significant difference(P>0.05).The different letters outside "( )" indicated that there were significant differences at different time points in the same treatment group(P<0.05), the same letters or not marked letters show no significant difference(P>0.05). Figure 2-3 and table 3-12 are the same.
图 1 不同处理、不同发酵时间的菌糠发酵饲料pH值注:①图中每个时间点不同处理差异显著性标注从上到下依次是CK、CCZZI、HT1、MIX处理组;②( )内无相同字母表示同一时间点不同处理组间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05);( )外无相同字母表示同一处理组不同时间点间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05)。图2~3、表3~12同。Figure 1. Effect of treatments on pH of fermented feed materialNote:①The significant markers of different treatments at each time point in the figure from top to bottom are CK, CCZZI, HT1 and MIX treatment groups.(same as Figure1-3)②Different letters in "( )" indicate that there are significant differences among different treatment groups at the same time(P<0.05), the same letters or not marked letters show no significant difference(P>0.05).The different letters outside "( )" indicated that there were significant differences at different time points in the same treatment group(P<0.05), the same letters or not marked letters show no significant difference(P>0.05). Figure 2-3 and table 3-12 are the same.由图2可知,在发酵7~30 d的3个发酵时间点上,3个添加组的LA含量均高于CK组(P<0.05);在发酵60 d时,3个添加组LA含量开始下降,3个添加组LA含量均显著低于CK组(P<0.05)。
由图3可知,在发酵1 d和3 d,CK组的AA含量均高于3个添加组,但差异不显著;在发酵7 d和30 d,CK组AA含量均显著低于3个添加组(P<0.05);在发酵的整个过程中,CCZZ1处理组的AA含量一直呈上升趋势。
由表3可知,从发酵3 d开始,平菇菌糠发酵饲料的AN含量随发酵天数的增加而升高。在发酵15 d及之后,CK组的AN含量一直最高;在发酵15 d和30 d时,MIX组的AN含量显著低于CK组(P<0.05);在发酵60 d时,3个添加组的AN含量均显著低于CK组(P<0.05)。
表 3 不同处理、不同发酵时间的菌糠发酵饲料氨态氮AN(AN/TN)含量Table 3. Effect of treatments on ammonia nitrogen AN (AN/TN) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.08±0.01(a)b 0.07±0.01(a)b 0.08±0.00(a)b 0.04±0.00(b)c 3 0.03±0.00(b)f 0.04±0.00(a)e 0.03±0.00(b)f 0.04±0.00(a)c 7 0.04±0.00(a)e 0.04±0.00(a)e 0.04±0.00(a)e 0.04±0.00(a)c 15 0.06±0.01(a)d 0.05±0.00(ab)d 0.05±0.01(ab)d 0.04±0.00(b)c 30 0.07±0.00(a)c 0.06±0.00(ab)c 0.06±0.00(ab)c 0.05±0.01(b)b 60 0.14±0.03(a)a 0.08±0.00(b)a 0.09±0.01(b)a 0.10±0.01(b)a 由表4可知,总体而言,平菇菌糠发酵饲料的PA含量随发酵天数的增加而升高。在发酵1~15 d时段,4个处理之间差异不显著(P>0.05);在发酵到30~60 d时,3个添加组的PA含量与之前相比显著增加(P<0.05),3个添加组处理间差异不显著(P>0.05)。
表 4 不同处理、不同发酵时间的菌糠发酵饲料丙酸PA(FM)含量Table 4. Effect of treatments on propionic acid PA (FM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.02±0.00(a)a 0.02±0.00(a)b 0.02±0.00(a)b 0.02±0.01(a)b 3 0.01±0.01(a)a 0.02±0.01(a)b 0.02±0.00(a)b 0.02±0.01(a)b 7 0.02±0.00(a)a 0.02±0.00(a)b 0.01±0.01(a)b 0.02±0.01(a)b 15 0.02±0.00(a)a 0.02±0.01(a)b 0.01±0.01(a)b 0.02±0.00(a)b 30 0.03±0.00(b)a 0.04±0.00(a)a 0.04±0.01(a)a 0.04±0.01(a)a 60 0.04±0.04(a)a 0.04±0.01(a)a 0.04±0.01(a)a 0.04±0.02(a)a 由表5可知,CCZZ1组的BA含量在发酵3 d时,显著低于CK组和MIX组(P<0.05);MIX组的BA含量在发酵的1~7 d显著高于15~60 d(P<0.05);在发酵60 d时,CCZZ1组的BA含量最高。
表 5 不同处理、不同发酵时间的菌糠发酵饲料丁酸BA(FM)含量Table 5. Effect of treatments on butyric acid BA (FM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.04±0.01(a)a 0.04±0.01(a)a 0.03±0.02(a)a 0.03±0.00(a)a 3 0.03±0.01(a)a 0.01±0.01(b)b 0.02±0.00(ab)a 0.03±0.01(a)a 7 0.01±0.00(a)b 0.01±0.01(a)b 0.02±0.02(a)a 0.03±0.02(a)a 15 0.01±0.01(a)b 0.03±0.02(a)ab 0.02±0.01(a)a 0.01±0.00(a)b 30 0.01±0.00(a)b 0.01±0.01(a)b 0.01±0.01(a)a 0.01±0.01(a)b 60 0.01±0.01(b)b 0.03±0.01(a)ab 0.02±0.01(ab)a 0.01±0.01(b)b 由表6可知,在发酵7 d 和15 d,CK组的DM含量均低于3个添加组;在发酵7 d时CK组的DM含量显著低于3个添加组(P<0.05);在发酵30 d和60 d,CK组DM含量显著高于3个添加组(P<0.05);在发酵60 d 时,2个单独添加组DM含量显著高于MIX组(P<0.05)。
表 6 不同处理、不同发酵时间的菌糠发酵饲料干物质DM含量Table 6. Effect of treatments on dry matters (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 36.09±0.72(a)c 36.18±0.61(a)b 36.10±0.32(a)bc 36.47±0.18(a)bc 3 35.91±0.35(a)c 35.34±0.25(a)c 36.04±0.76(a)c 36.32±0.21(a)cd 7 34.96±0.24(b)d 35.67±0.28(a)bc 35.96±0.44(a)c 35.69±0.44(a)d 15 37.05±0.21(a)b 37.39±0.71(a)a 37.38±1.39(a)ab 37.15±0.56(a)a 30 37.09±0.15(a)b 36.12±0.20(bc)b 36.39±0.23(b)bc 35.87±0.03(c)cd 60 40.25±0.66(a)a 38.06±0.15(b)a 38.20±0.02(b)a 37.04±0.33(c)ab 由表7可知,总体而言,随着发酵时间的增加,各处理组Ash含量的变化较小。发酵3~15 d,CK组、MIX组的Ash含量均低于2个单独添加组;在发酵7 d,MIX组的Ash含量显著低于2个单独添加组(P<0.05);在发酵60 d时,CK组Ash含量显著高于3个添加组(P<0.05)。
表 7 不同处理、不同发酵时间的菌糠发酵饲料粗灰分Ash含量Table 7. Effect of treatments on ash (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 11.87±0.07(b)b 12.08±0.16(ab)b 12.35±0.23(a)a 11.98±0.16(b)a 3 11.72±0.11(b)b 12.22±0.24(a)ab 12.69±0.08(a)a 11.85±0.05(b)a 7 11.78±0.29(c)b 12.31±0.06(b)ab 12.66±0.19(a)a 11.78±0.07(c)a 15 11.89±0.56(b)b 12.36±0.24(a)ab 12.56±0.14(a)a 11.76±0.30(b)a 30 12.30±0.38(ab)b 12.46±0.12(ab)a 12.70±0.30(a)a 11.98±0.28(b)a 60 14.02±0.70(a)a 10.94±0.08(b)c 10.52±0.19(b)b 11.23±0.19(b)b 由表8可知,在发酵7 d时,CCZZ1组CP含量最高。发酵15 d 后勤工作各处理的CP含量开始减少;在发酵15 d时CK组CP含量显著低于3个添加组(P<0.05);在发酵60 d时,CK组CP含量显著高于3个添加组(P<0.05)。
表 8 不同处理、不同发酵时间的菌糠发酵饲料粗蛋白CP含量Table 8. Effect of treatments on crude protein CP (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 7.01±0.09(a)ab 7.08±0.08(a)b 6.90±0.13(a)b 6.98±0.10b(a)b 3 6.81±0.11(a)bc 7.05±0.14(a)b 6.90±0.10(a)b 6.97±0.60(a)b 7 7.12±0.11(b)a 7.34±0.10(a)a 7.13±0.14(b)a 7.02±0.07(b)b 15 6.98±0.05(b)abc 7.17±0.07(a)b 7.15±0.08(a)a 7.27±0.03(a)a 30 6.79±0.11(a)c 6.86±0.07(a)c 6.80±0.14(a)b 6.81±0.11(a)c 60 6.79±0.19(a)c 6.37±0.11(b)d 6.38±0.08(b)c 6.20±0.01(b)d 由表9可知,在发酵15 d时,HT1组的WSC含量最低,显著低于MIX组(P<0.05);在发酵30 d和60 d时,MIX组的WSC含量显著低于其他3个处理组(P<0.05)。
表 9 不同处理、不同发酵时间的菌糠发酵饲料可溶性碳水化合物WSC含量Table 9. Effect of treatments on water soluble carbohydrate WSC (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.60±0.14(a)ab 0.48±0.04(a)b 0.49±0.05(a)bc 0.56±0.14(a)ab 3 0.68±0.12(a)a 0.67±0.18(a)a 0.69±0.32(a)a 0.66±0.07(a)a 7 0.53±0.06(a)ab 0.48±0.04(a)b 0.61±0.17(a)ab 0.48±0.02(a)bc 15 0.46±0.04(b)b 0.47±0.01(b)b 0.42±0.04(c)c 0.51±0.03(a)bc 30 0.58±0.04(a)ab 0.63±0.08(a)ab 0.60±0.02(a)ab 0.48±0.05(b)bc 60 0.57±0.11(a)ab 0.66±0.04(a)a 0.55±0.08(a)abc 0.38±0.01(b)c 由表10可知,总体而言,平菇菌糠发酵饲料的ADF含量随着发酵时间的增加而有所升高。在发酵3~15 d时段,同一时间点各处理组间的ADF含量差异不显著(P>0.05);在发酵30 d,CK组、MIX组的ADF含量显著低于HT1处理组(P<0.05);在发酵60 d时,CCZZ1组的ADF含量显著高于HT1处理组(P<0.05)。
表 10 不同处理、不同发酵时间的菌糠发酵饲料酸性洗涤纤维ADF含量Table 10. Effect of treatments on acid washing fiber ADF (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 49.30±1.67(b)b 49.97±3.33(b)e 55.53±2.23(a)cd 56.65±1.76(a)d 3 51.35±7.27(a)b 56.48±0.82(a)d 51.89±3.44(a)d 54.50±2.53(a)d 7 59.32±3.31(a)a 62.66±2.48(a)bc 60.36±4.26(a)bc 61.25±1.48(a)bc 15 61.12±2.06(a)a 58.94±1.64(a)cd 58.53±3.16(a)bc 59.71±0.82(a)c 30 63.34±0.77(b)a 64.70±2.02(ab)ab 66.59±1.16(a)a 62.92±1.67(b)ab 60 64.19±0.91(ab)a 66.84±1.69(a)a 63.77±1.92(b)ab 65.55±1.20(ab)a 由表11可知,在发酵1~15 d,各处理组之间差异不显著(P>0.05);在发酵30 d时,CK组、CCZZ1组的NDF含量均显著低于 HT1处理组(P<0.05);在发酵60 d时,CK组、HT1组的NDF含量显著低于CCZZ1组(P<0.05)。
表 11 不同处理、不同发酵时间菌糠发酵饲料的中性洗涤纤维NDF含量Table 11. Effect of treatments on neutral washing fiber NDF (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 60.56±4.86(a)c 61.05±4.11(a)c 66.96±4.26(a)c 62.37±0.92(a)d 3 67.00±3.47(a)b 71.17±1.18(a)b 67.18±5.35(a)c 67.50±2.44(a)c 7 76.61±0.85(a)a 78.25±2.12(a)a 74.95±2.93(a)ab 74.88±2.35(a)ab 15 75.10±2.13(a)a 70.88±3.98(a)b 72.22±3.51(a)bc 75.25±5.35(a)ab 30 75.47±1.58(b)a 75.64±2.05(b)ab 79.43±0.60(a)a 76.85±1.50(ab)a 60 69.93±1.59(b)b 72.95±1.43(a)b 69.44±1.28(b)bc 71.27±1.55(ab)bc 由表12可知,各处理组在发酵结束时的HC含量均最低。在发酵1 d时,MIX组的HC含量显著低于其他3组(P<0.05);在发酵3~60 d时段,同一时间点各处理组之间差异不显著(P>0.05);发酵60 d时,CK组、CCZZ1组和HT1组的HC含量均显著低于其他发酵时间点(P<0.05),MIX组的HC含量也显著低于3~30 d的4个发酵时间点。
表 12 不同处理、不同发酵时间的菌糠发酵饲料半纤维素HC含量Table 12. Effect of treatments on hemicellulose HC (DM) in fermented feed material(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 11.26±3.22(a)b 11.08±0.93(a)c 11.43±2.50(a)a 5.72±0.85(b)b 3 15.65±3.99(a)ab 14.68±0.59(a)ab 15.29±4.56(a)a 13.00±0.22(a)a 7 17.29±3.29(a)a 15.59±0.66(a)a 14.60±1.34(a)a 13.63±2.37(a)a 15 13.98±1.95(a)ab 11.93±3.00(a)bc 13.68±0.43(a)a 15.55±4.79(a)a 30 12.12±0.84(a)b 10.95±2.33(a)c 12.84±0.58(a)a 13.93±3.16(a)a 60 5.74±1.39(a)c 6.12±0.40(a)d 5.67±0.84(a)b 5.72±0.46(a)b 3. 讨论
3.1 菌糠的化学成分和微生物组成
供试材料平菇菌糠的pH值为5.42,偏酸性;中性洗涤纤维和酸性洗涤纤维所占比例偏高,分别为76.03 %和64.01 %;菌糠粗蛋白含量较高(9.62 %)。其纤维和粗蛋白含量与陆亚珍等[19]的测定结果相近,与中等质量粗饲料相当。食用菌的菌丝残体和通过食用菌生命活动产生的纤维素、半纤维素、木质素,以及丰富的矿物元素、氨基酸等营养物质,具有很高的营养价值[20]。采集食用菌子实体后,菌糠具有浓厚的芳香气味,更易粉碎,禽畜的适口性更好,可直接作为饲料喂养大型禽畜[21]。
由表2可知,平菇菌糠的微生物组成中乳酸菌数量(FM)为2.23 lg (cfu·g−1),好气性细菌数量(FM)为4.98 lg (cfu·g−1),酵母菌和霉菌数量(FM)分别为2.35 lg (cfu·g−1)和1.23 lg (cfu·g−1)。在发酵初期,酵母菌和霉菌会过多消耗饲料的营养物质,霉菌会使饲料发霉变质并产生酸败味,降低其品质。在平菇菌糠的微生物组成中乳酸菌数未占据优势地位,不能满足良好的乳酸发酵需要。在自然发酵条件下,附着在原材料上的乳酸菌数量会使发酵初期的pH值下降,菌糠附着的菌数量越多,pH值下降越快[22]。由于前人的研究大多过于笼统,为了更深入研究乳酸菌对菌糠发酵饲料品质的影响,本试验选用更适宜用作动物饲料开发的平菇菌糠,通过筛选不同菌糠发酵菌种和完善发酵工艺,对菌糠发酵不同时间各成分进行测定、分析和比较研究。本研究结果可为生产优质菌糠发酵饲料提供理论依据,为菌糠资源的合理利用开辟新途径。
3.2 乳酸菌对平菇菌糠发酵饲料品质和发酵进程的影响
3.2.1 乳酸菌对平菇菌糠发酵饲料品质的影响
平菇菌糠发酵过程中,随着乳酸菌发酵生产乳酸,pH值下降至4.2以下时,平菇菌糠内的微生物的活动会受到抑制,从而减少平菇菌糠内营养物质的损耗,3个添加乳酸菌的处理组pH值比CK组更快降到4.2以下,说明发酵前添加乳酸菌可增加发酵初期的乳酸菌数量,促进乳酸发酵,加快生成大量的乳酸,迅速降低pH值,抑制有害微生物的活性,从而减少发酵过程中营养物质的损失,这与 Mcdonald等[23]的试验结果一致。伴随着后期的进一步发酵,平菇菌糠饲料中氨态氮含量,以及乳酸、乙酸、丙酸的含量均呈上升趋势,pH值 呈下降趋势,这与陈鑫珠[24-25]的试验结果一致。但在发酵进程结束时,酸性洗涤纤维、中性洗涤纤维含量有所升高,粗蛋白含量有所下降。究其原因:①乳酸菌发酵到一定程度,由于发酵底物逐渐消耗,乳酸菌生长繁殖速度变慢,从而减弱了其对有害微生物的抑制作用,导致有害微生物异常发酵。②伴随着发酵的进程,菌糠内部温度升高,耐低温的乳酸菌活动减弱或停止,也使有害微生物活性增强并对菌糠中蛋白质产生降解作用。
3.2.2 乳酸菌对平菇菌糠发酵饲料发酵进程的影响
王英超等[22]的研究结果表明,平菇菌糠发酵初期,在菌糠上接种一定量的乳酸菌可加速发酵。在本试验的4个处理组中,添加乳酸菌的3个处理组在发酵7 d时pH值均降到4.2以下,而未添加乳酸菌的对照组则是在30 d时pH值才下降到4.2以下。4个处理组在发酵的1~30 d,菌糠的pH值持续降低,添加乳酸菌的3个处理组的pH值与未添加的对照组相比下降更明显,其中又以复合添加乳酸菌组pH值下降最快。这与侯建建[26] 对苜蓿青贮饲料的试验结果相似。说明,平菇菌糠中添加乳酸菌可以加快其pH值的下降,从而加快平菇菌糠的发酵进程。
4. 结论
单一或复合添加乳酸菌CCZZ1、HT1可使平菇菌糠发酵过程的pH值迅速降低,加快发酵进程,减少菌糠营养物质损失,对提升菌糠发酵品质有积极作用。在本试验条件下平菇菌糠在发酵第15 d开封效果最好。
-
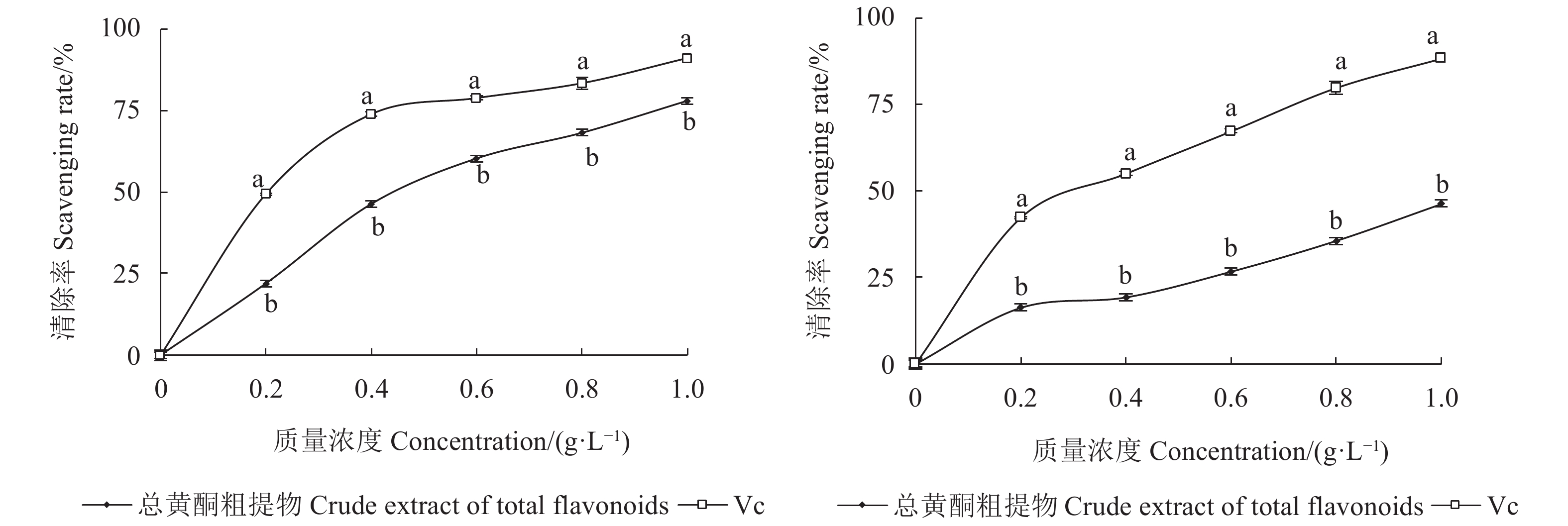
图 1 水蜡树果实总黄酮粗提物对DPPH·(左)和·OH(右)的清除率
注:同浓度上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 1. Scavenging capacities of crude flavonoid extract from L. obtusifolium fruit on DPPH· (A) and ·OH (B)
Note: Data with different letters on same concentration indicate significant difference at P<0.05 by Duncan’s new multiple range test.
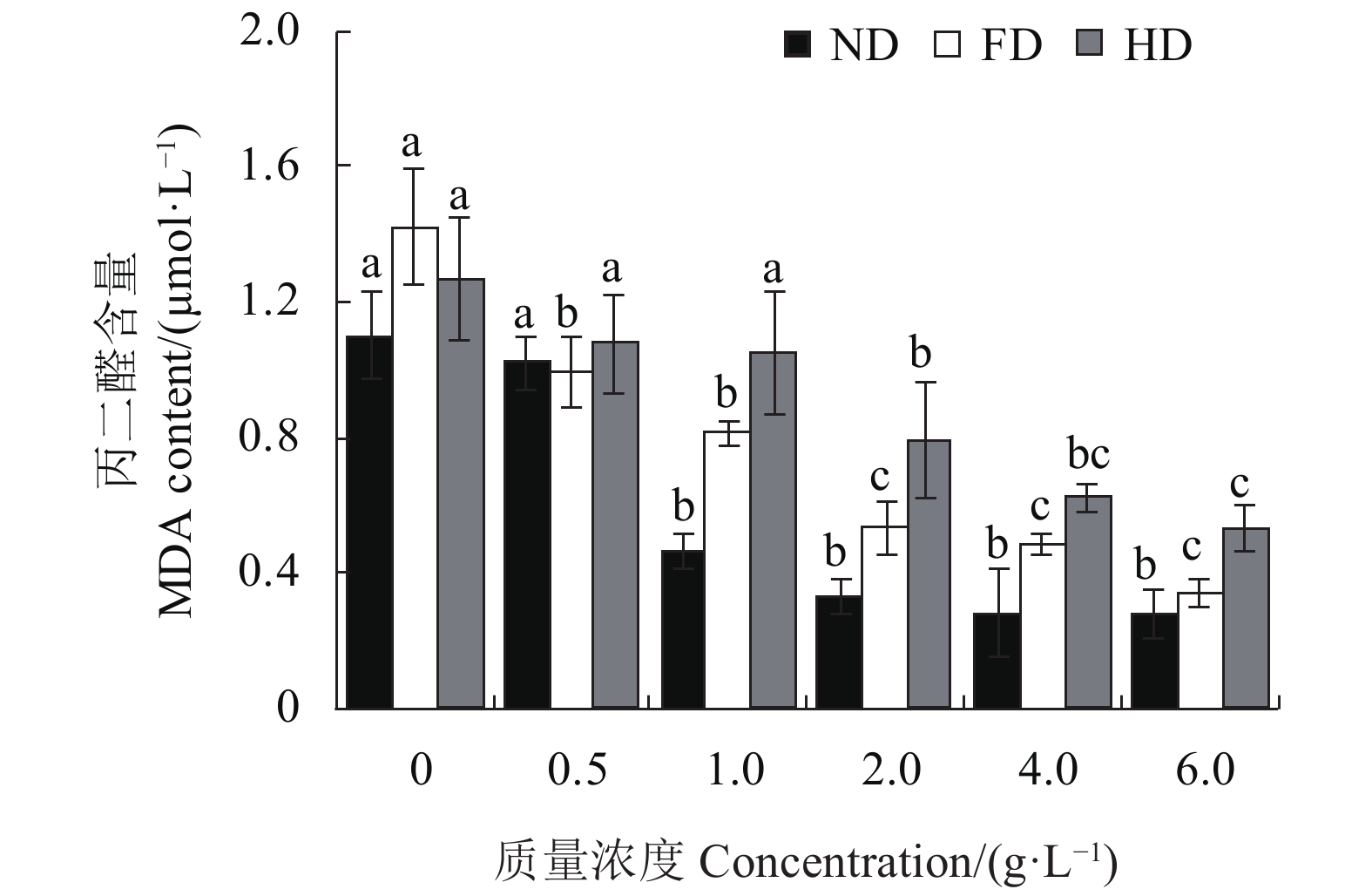
图 2 水蜡树果实总黄酮粗提物对小鼠肝匀浆生成MDA的影响
注:ND代表无诱导组,FD代表FeSO4诱导组,HD代表H2O2诱导组。同色柱上方不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 2. MDA contents in rat liver homogenate treated by flavonoid extract of L. obtusifolium fruits
Note: ND denotes no induction treatment; FD, induction by FeSO4; and, HD, induction by H2O2. Data with different letters on column of same color indicate significant difference at P<0.05 by Duncan’s new multiple range test.
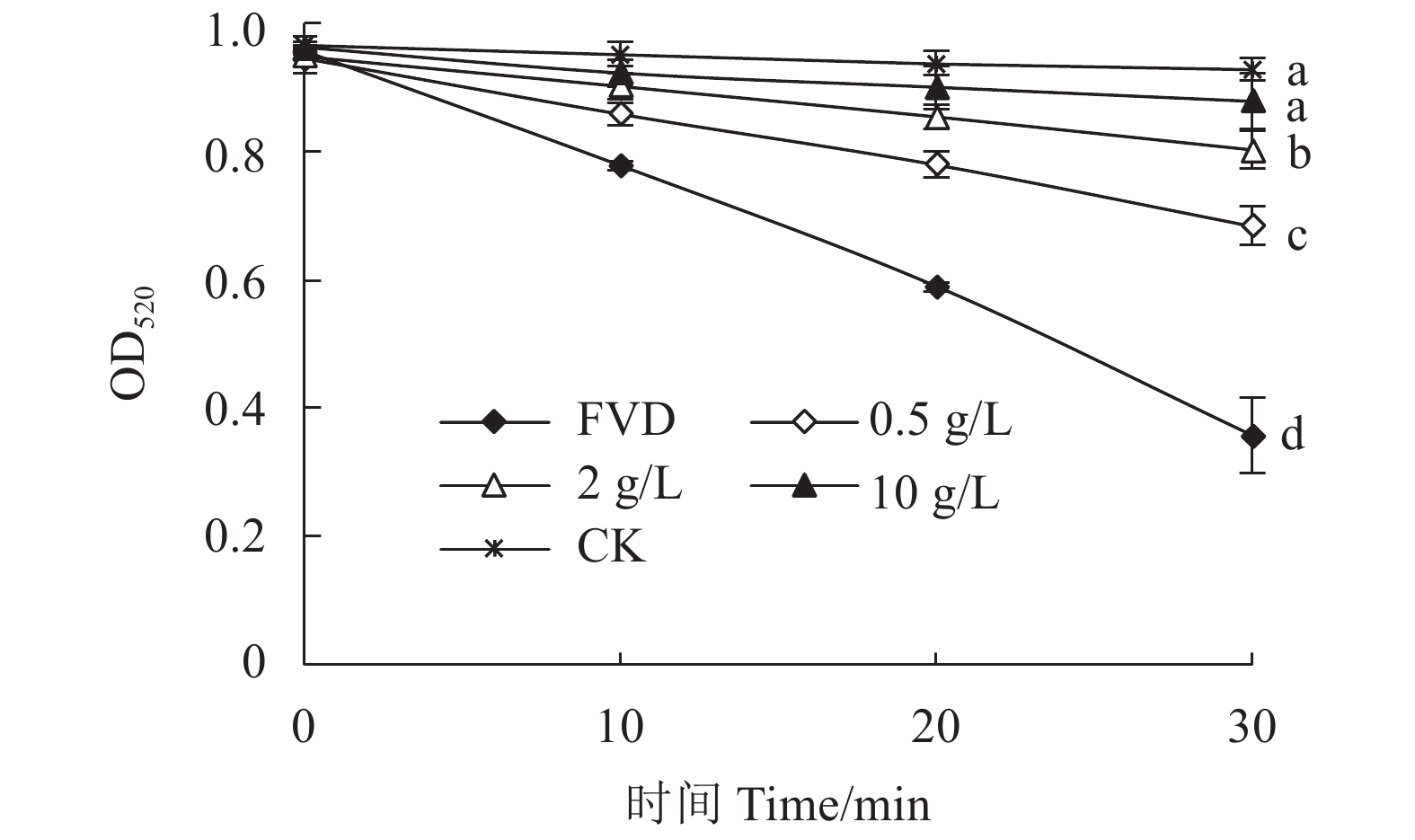
图 3 水蜡树果实总黄酮粗提物对小鼠肝线粒体肿胀度的影响
注:FVD代表FeSO4和Vc共同作用的诱导组,CK为对照。同一时间处理上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 3. Rat liver mitochondrial swelling induced by Fe2+ and Vc treated by flavonoid extract of L. obtusifolium fruits
Note: FVD denotes induction by FeSO4 and Vc; and, CK, control. Data with different letters on same time treatment indicate significant difference at P<0.05 by Duncan’s new multiple range test.
表 1 水蜡树果实总黄酮粗提物对小鼠肝组织中CAT、GSH和GSH-Px的影响
Table 1 Effect of crude extract of total flavonoids from L. obtusifolium fruit on CAT, GSH and GSH-Px in liver tissues of rats
组别 CAT/
(U·mgprot-1)GSH/
(μmol·gprot-1)GSH-Px/
(U·mgprot-1)C 20.53±0.47 d 50.78±0.99 d 82.54±0.84 d L 26.49±0.50 c 60.20±0.67 c 108.40±1.35 c M 30.84±0.95 b 71.46±1.30 b 123.44±0.90 b H 34.91±0.61 a 77.47±0.74 a 131.06±0.79 a 注:同列内不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Note: Different letters in the columns indicate significant difference at P<0.05 level by Duncan’s new multiple range test. -
[1] 余蕾. 水蜡果实色素的提取及色素性质的研究 [J]. 食品研究与开发, 2015, 36(21):72−74. DOI: 10.3969/j.issn.1005-6521.2015.21.019 YU L. Study on the properties and extraction of pigment from Ligustrum obtusifolium Sieb. et Zuce. [J]. Food Research and Development, 2015, 36(21): 72−74.(in Chinese) DOI: 10.3969/j.issn.1005-6521.2015.21.019
[2] 冯海华. 水蜡树的观赏特性及在城市绿化中的应用 [J]. 河北林业科技, 2013(4):92−93, 98. DOI: 10.3969/j.issn.1002-3356.2013.04.035 FENG H H. The ornamental characteristics of Ligustrum obtusifolium and their application in urban greening [J]. Journal of Hebei Forestry Science and Technology, 2013(4): 92−93, 98.(in Chinese) DOI: 10.3969/j.issn.1002-3356.2013.04.035
[3] CZERWIŃSKA M E, GRANICA S, KISS A K. Effects of an aqueous extract from leaves of Ligustrum vulgare on mediators of inflammation in a human neutrophils model [J]. Planta Medica, 2013, 79(11): 924−932. DOI: 10.1055/s-0032-1328718
[4] HAMDI H K, CASTELLON R. Oleuropein, a non-toxic olive iridoid, is an anti-tumor agent and cytoskeleton disruptor [J]. Biochemical and Biophysical Research Communications, 2005, 334(3): 769−778. DOI: 10.1016/j.bbrc.2005.06.161
[5] ANDREADOU I, ILIODROMITIS E K, MIKROS E, et al. The olive constituent oleuropein exhibits anti-ischemic, antioxidative, and hypolipidemic effects in anesthetized rabbits [J]. Journal of Nutrition, 2006, 136(8): 2213−2219. DOI: 10.1093/jn/136.8.2213
[6] AL-AZZAWIE H F, ALHAMDANI M S S. Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits [J]. Life Sciences, 2006, 78(12): 1371−1377. DOI: 10.1016/j.lfs.2005.07.029
[7] SUH W S, KWON O K, LEE T H, et al. Secoiridoid glycosides from the twigs of Ligustrum obtusifolium possess anti-inflammatory and neuroprotective effects [J]. Chemical and Pharmaceutical Bulletin, 2018, 66(1): 78−83.
[8] LEE S I, OH S H, PARK K Y, et al. Antihyperglycemic effects of fruits of privet (Ligustrum obtusifolium) in streptozotocin-induced diabetic rats fed a high fat diet [J]. Journal of Medicinal Food, 2009, 12(1): 109−117. DOI: 10.1089/jmf.2007.0000
[9] 何国鑫, 陈华国, 邓青芳, 等. 黄酮类化合物抗肝损伤的作用机制研究进展 [J]. 中国现代应用药学, 2019, 36(12):1583−1591. HE G X, CHEN H G, DENG Q F, et al. Research progress of hepatoprotective mechanism of flavonoids [J]. Chinese Journal of Modern Applied Pharmacy, 2019, 36(12): 1583−1591.(in Chinese)
[10] 赵美莲, 于春艳, 史晓晶. 水蜡树果实总黄酮提取工艺优化及其抗氧化活性 [J]. 福建农业学报, 2018, 33(2):206−211. ZHAO M L, YU C Y, SHI X J. Process optimization and antioxidant activity of flavonoids extracted from fruits of Ligustrum obtusifolium [J]. Fujian Journal of Agricultural Sciences, 2018, 33(2): 206−211.(in Chinese)
[11] 张素华, 王正云. 大孔树脂纯化芦笋黄酮工艺的研究 [J]. 食品科学, 2006, 27(2):182−186. DOI: 10.3321/j.issn:1002-6630.2006.02.039 ZHANG S H, WANG Z Y. Study on adsorption and separation by macroporous resin for asparagus flavonoids [J]. Food Science, 2006, 27(2): 182−186.(in Chinese) DOI: 10.3321/j.issn:1002-6630.2006.02.039
[12] 吴娜. 艾蒿黄酮的提取分离纯化、结构鉴定及其抗氧化性研究[D]. 武汉: 华中农业大学, 2008. WU N. Extraction, purification and antioxidation of flavonoids from Artemisia argyi[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
[13] 梅光明, 张小军, 郝强, 等. 酸提香菇多糖的抗氧化活性研究 [J]. 浙江海洋学院学报(自然科学版), 2014, 33(5):406−413. MEI G M, ZHANG X J, HAO Q, et al. Antioxidant activity of polysaccharide from Lentinus edodes extracted by acid solution [J]. Journal of Zhejiang Ocean University (Natural Science), 2014, 33(5): 406−413.(in Chinese)
[14] 冯博, 钱晔, 吴奇, 等. ABTS法研究高压脉冲电场对普洱熟茶抗氧化活性的影响 [J]. 云南农业大学学报(自然科学), 2019, 34(5):815−819. FENG B, QIAN Y, WU Q, et al. Study on effects of high voltage pulsed electric field on the activity of antioxidant of Pu'er ripe tea by ABTS assays [J]. Journal of Yunnan Agricultural University (Natural Science), 2019, 34(5): 815−819.(in Chinese)
[15] SANTOS C X C, NABEEBACCUS A A, SHAH A M, et al. Endoplasmic reticulum stress and nox-mediated reactive oxygen species signaling in the peripheral vasculature: potential role in hypertension [J]. Antioxidants and Redox Signaling, 2014, 20(1): 121−134.
[16] GÜLÇIN İ, ELIAS R, GEPDIREMEN A, et al. Antioxidant activity of bisbenzylisoquinoline alkaloids from Stephania rotunda: cepharanthine and fangchinoline [J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2010, 25(1): 44−53. DOI: 10.3109/14756360902932792
[17] GÜLÇIN İ, ELMASTAŞ M, ABOUL-ENEIN H Y. Antioxidant activity of clove oil: a powerful antioxidant source [J]. Arabian Journal of Chemistry, 2012, 5(4): 489−499. DOI: 10.1016/j.arabjc.2010.09.016
[18] 任薇, 包晓玮, 张志芳, 等. 沙棘多糖清除自由基及抗脂质过氧化作用研究 [J]. 食品工业科技, 2019, 40(8):272−277. REN W, BAO X W, ZHANG Z F, et al. Study on free radical scavenging and anti-lipid peroxidation of seabuckthorn polysaccharide [J]. Science and Technology of Food Industry, 2019, 40(8): 272−277.(in Chinese)
[19] GIL L, SIEMS W, MAZUREK B, et al. Age-associated analysis of oxidative stress parameters in human plasma and erythrocytes [J]. Free Radical Research, 2006, 40(5): 495−505. DOI: 10.1080/10715760600592962
[20] PARADIES G, PARADIES V, RUGGIERO F M, et al. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease [J]. World Journal of Gastroenterology, 2014, 20(39): 14205−14218. DOI: 10.3748/wjg.v20.i39.14205
[21] 马爱国, 刘四朝. 不同剂量维生素C对DNA氧化损伤影响的研究 [J]. 营养学报, 2001, 23(1):12−15. DOI: 10.3321/j.issn:0512-7955.2001.01.004 MA A G, LIU S C. Effect of different levels of ascorbic acid on DNA damage [J]. Acta Nutrimenta Sinica, 2001, 23(1): 12−15.(in Chinese) DOI: 10.3321/j.issn:0512-7955.2001.01.004
[22] NORDBERG J, ARNÉR E S J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system [J]. Free Radical Biology and Medicine, 2001, 31(11): 1287−1312. DOI: 10.1016/S0891-5849(01)00724-9
[23] ESPOSITO L A, KOKOSZKA J E, WAYMIRE K G, et al. Mitochondrial oxidative stress in mice lacking the glutathione peroxidase-1 gene [J]. Free Radical Biology and Medicine, 2000, 28(5): 754−766. DOI: 10.1016/S0891-5849(00)00161-1
[24] PASSARDI F, THEILER G, ZAMOCKY M, et al. PeroxiBase: the peroxidase database [J]. Phytochemistry, 2007, 68(12): 1605−1611. DOI: 10.1016/j.phytochem.2007.04.005
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载: