Growth and Nutrient Content of Dendrobium officinale as Affected by Epulorhiza Symbiosis
-
摘要:目的 了解瘤菌根菌与铁皮石斛建立共生关系后对植株地上部生长和营养物质积累的影响。方法 通过液体培养瘤菌根菌属菌株,浇灌无菌盆栽铁皮石斛苗的根部共培养,观察铁皮石斛植株的农艺性状的变化,并比较不同年限铁皮石斛鲜条的营养物质含量的变化。结果 接菌处理的铁皮石斛盆栽苗比未接菌的对照生长旺盛,叶色浓绿,植株健壮,1年条和2年条的有效茎杆数分别增加了65.67%和74.25%,单茎重分别增加了55.29%和51.45%,差异显著(P<0.05),提高了铁皮石斛的产量。接菌后还提高了粗多糖、石斛碱、粗蛋白和氨基酸的含量,其中接菌后1年条的粗多糖和粗蛋白含量较未接菌的对照分别提高了30.39%和18.7%,差异显著(P<0.05);接菌后1年条和2年条的氨基酸总量显著增加,分别增加了27%和30.25%;粗纤维和灰分的含量在接菌后减少,分别减少了17.76%和36.36%,差异显著(P<0.05)。结论 接入瘤菌根菌能够显著提高铁皮石斛的产量和营养成分的含量,说明增加产量与提高营养物质含量并不矛盾,这对铁皮石斛的有机菌肥的开发应用、人工栽培有机种植以及鲜条采收时间具有重要的指导意义。Abstract:Objective Effects of the symbiosis between Epulorhiza sp. and Dendrobium officinale in a liquid culture medium on the growth and nutrient content of the plant were analyzed.Method In a potted experimentation, the sterile D. officinale seedlings were irrigated with a liquid medium as control or one containing Epulorhiza sp. for the treatment. Agronomic characteristics and nutrient contents of the stems and leaves from one- and 2-year-old D. officinale plantlets were monitored.Result Showing dark green leaves and robust stems, the treatment plantlets grew more vigorously than control. In the presence of Epulorhiza sp., on average the girths of the productive stems of one- and 2-year-old plantlets significantly increased by 65.67% and 74.25%, respectively, and the single stem weight by 55.29% and 51.45%, respectively (P<0.05). The increases meant improved crop yield. Meanwhile, the contents of polysaccharides, dendrobine, crude protein, and amino acids increased as well. For the one-year-old plantlets, the crude polysaccharides rose significantly by 30.39%, and the crude protein 18.7% (P<0.05). For both one- and 2-year-old plantlets, the total amino acids significantly increased by 27% and 30.25%, respectively (P<0.05), while the crude fiber and ash significantly decreased by 17.76% and 36.36%, respectively (P<0.05).Conclusion Both crop yield and nutrient content of D. officinale could be significantly improved by the presence of Epulorhiza sp. in medium. It suggested the potential benefits of organic fungi-containing manure utilization, artificial greenhouse operation, and harvest time management for the cultivation of D. officinale.
-
Keywords:
- Dendrobium officinale /
- Epulorhiza sp. /
- nutritional composition
-
0. 引言
【研究意义】基因组作为特定生物全部染色体的遗传物质的总和,能反映物种全部和特定的遗传信息[1],其大小(C值)指单倍体细胞中全套染色体的DNA总量,基因组大小的度量一般以重量计算,以质量 (Picogram,pg)或碱基对数目(Million base pair,Mb)为单位,1 pg约等于978 Mb[2-3]。C值的测定不但能估测物种的DNA含量,还能为目标物种后续基因组测序、基因组学及进化生物学研究提供数据参考,除此之外也是生物学家进行物种分类和种群进化的重要依据[4-6]。朱砂根(A. crenata)隶属紫金牛科(Myrsinaceae)紫金牛属(Ardisia),是一种兼具药用和观赏价值的重要经济植物,朱砂根在分子生物学和基因组学层面的相关研究则刚刚起步,通过测定朱砂根种质资源的基因组大小,对后续开展朱砂根基因组学及其他相关研究具有重要意义。【前人研究进展】目前,植物DNA C值数据库(Plant DNA C-values Database;https://cvalues.science.kew.org/)的数据,已收录了12 273个物种的C值数据,其中包括10 770种被子植物。近年来朱砂根植物研究内容主要集中于药用价值[7-8]、栽培繁殖[9-11]、生理生化[12-13]以及遗传多样性[14-15]等方面,目前朱砂根在分子生物学和基因组学层面的研究主要集中在叶绿体基因组和特定功能基因等领域,例如刘雄伟等[16]通过对朱砂根和其变种红凉伞的叶绿体全基因组进行测序,解析两者的叶绿体基因组特征及差异,从而确定朱砂根在紫金牛属系统发育位置;刘畅等[17]通过对朱砂根AcGGPPS基因进行克隆测序研究了其生物学特性,为今后该基因功能的研究奠定基础,杨君[18]通过转录组测序,对朱砂根三萜皂苷合成的相关基因进行差异分析,发现了93个差异表达基因直接影响朱砂根三萜皂苷含量。【本研究切入点】有关朱砂根基因组大小测定方面的研究鲜见报道,一定程度上限制了朱砂根分子生物学及基因组学等研究领域进一步进展。【拟解决的关键问题】本研究以番茄(Lycopersicon esculentum)为内标,建立基于流式细胞术测定朱砂根基因组大小的测定方法和流程,估算24份朱砂根资源的基因组大小,以期为今后朱砂根基因组文库的建立、基因组全序列测定及其基因组学研究等工作的开展提供基础数据。
1. 材料与方法
1.1 试验材料
24份朱砂根材料见(表1),其中22份朱砂根是通过自然变异并经过多年人工选育,最终形成表型性状稳定遗传的栽培品种,6个获得新品种权,16个实地审查;而2份野生朱砂根种质由课题组骆亮等从武夷山收集并种植于福建农林大学森林兰苑苗圃。内参样本来自中国科学院昆明植物研究所,选取番茄种子萌发后1月的嫩叶作为试验材料。24份朱砂根试验材料的嫩叶取自福建农林大学苗圃中心,在中国西南野生生物种质资源库分子生物学实验平台对样品进行流式细胞仪检测。
表 1 24份朱砂根供试材料采样信息Table 1. Sampling of 24 A. crenata germplasms编号 No. 种质名称 Germplasm name 种质类别 Germplasm type 编号 No. 种质名称 Germplasm name 种质类别 Germplasm type Z-01 赤丹 Chi Dan 栽培品种 Cultivated variety Z-13 福株 Fu Zhu 栽培品种 Cultivated variety Z-02 锦绣 Jin Xiu 栽培品种 Cultivated variety Z-14 金边富贵 Jin Bian Fu Gui 栽培品种 Cultivated variety Z-03 绿翡翠 Green Jade 栽培品种 Cultivated variety Z-15 金玉满堂 Jin Yu Man Tang 栽培品种 Cultivated variety Z-04 粉佳人 Pink Beauty 栽培品种 Cultivated variety Z-16 竹叶富贵 Bamboo Leaf Fu Gui 栽培品种 Cultivated variety Z-05 平安富贵 Ping An Fu Gui 栽培品种 Cultivated variety Z-17 玛瑙红 Onyx Red 栽培品种 Cultivated variety Z-06 金冠 Golden Crown 栽培品种 Cultivated variety Z-18 碧珠 Bi Zhu 栽培品种 Cultivated variety Z-07 福满堂 Fu Man Tang 栽培品种 Cultivated variety Z-19 龙珠 Long Zhu 栽培品种 Cultivated variety Z-08 碧霞珠 Bixia Zhu 栽培品种 Cultivated variety Z-20 霞珠 Xia Zhu 栽培品种 Cultivated variety Z-09 金富贵 Jin Fu Gui 栽培品种 Cultivated variety Z-21 仙桃 Xian Tao 栽培品种 Cultivated variety Z-10 梁野富贵 Liang Ye Fu Gui 栽培品种 Cultivated variety Z-22 珠塔 Zhu Ta 栽培品种 Cultivated variety Z-11 赤玲珑 Red Lingerie 栽培品种 Cultivated variety Z-(A) 朱砂根A A. crenata A 野生种质 Wild germplasm Z-12 大富贵 Da Fu Gui 栽培品种 Cultivated variety Z-(B) 朱砂根B A. crenata B 野生种质 Wild germplasm 1.2 试验方法
1.2.1 细胞悬浮液制备
解离液的选择对于试验结果的准确性至关重要。本试验解离液选择的是mGb[45 mmol·L−1 MgCl2·6H2O,20 mmol·L−1 MOPS,30 mmol·L−1柠檬酸钠,1%(m/V)PVP-40,0.2%(V/V)TritonX-100,10 mmol·L−1 Na2EDTA,20 μL·mL−1β-巯基乙醇,pH 7.5[19]。
将样品置于0.8 mL预冷的mGb解离液中,用锋利的刀片将组织迅速垂直切碎,使其在解离液中冰上静置10 min,然后用40 μm孔径滤网过滤,即得到细胞核悬浮液。在细胞核悬液加入适当体积预冷的碘化丙啶(Propidium iodide,PI)(母液浓度1 mg·mL−1)和适当体积的RNAase溶液(母液浓度1 mg·mL−1),置于冰上避光染色0.5~1.0 h,并控制所有待测样品染色时间一致。PI染液和RNAase溶液的工作浓度均为50 μg·mL−1 [19-21]。
1.2.2 流式细胞仪检测
以番茄为内参,将待测样品的悬液和内参样品的悬液按适当比例混合,利用BD FACScalibur流式细胞仪对染色后的细胞核悬浮液样品上机检测。采用488 nm蓝光激发,检测PI的发射光荧光强度,每次检测收集10000个颗粒。变异系数(CV)控制在5%以内。
1.2.3 基因组大小计算
PI在着色过程中的嵌入量与DNA量呈正比关系,故荧光强度可以表示出基因组DNA的相对含量。观察待测样品和对照植物PI-DNA复合体的荧光峰值,即可得出2种植物DNA含量的比值,再乘以内参植物的C值,即可计算出待测植物的C值。计算公式如下:
待测样品DNA含量=内参DNA含量×待测样品的荧光强度/内参样品的荧光强度[19]。
1.3 数据分析
利用Excel2010、Modifit3.0分析软件作图分析。
2. 结果与分析
本研究采用流式细胞术对24份朱砂根的染色体DNA总量进行检测。对比番茄和24样品基因组单独测定的结果可见,番茄基因组的测定峰与朱砂根基因组测定峰两者无重叠(图1),具有良好的区分度,证明使用番茄作为内参样本具备可靠性。
选择的内参样本番茄基因组大小为900 Mbp,根据测定结果分析计算,得到了24份朱砂根样品的基因组大小(表2)。结果发现,大部分朱砂根种质资源的C值在1.8 Gb左右,24份朱砂根种质C值平均为1.87 Gb。栽培品种中,玛瑙红(Z-17)、霞珠(Z-20)、珠塔(Z-22)C值最小,均为1.77 Gb,赤丹C值最大,达到2.41 Gb,共有9个朱砂根品种的基因组大小均超过了2 Gb,高于平均C值;收集的2份野生朱砂根种质基因组大小别为1.79、1.80 Gb,接近平均C值。从24份基因组大小检测结果来看,朱砂根种内C值存在明显变异;同时朱砂根种质资源从野生到人工选育栽培过程中发生了基因组大小变异。
表 2 流式细胞术测定的24份朱砂根品种资源基因组大小Table 2. Genome sizes of 24 A. crenata determined by flow cytometry样品编号Sample No. 内参荧光强度Internal reference fluorescence intensity 待测样品荧光强度Fluorescence intensity of the sample to be measured 比值Ratio 基因组大小Genome/Gb 样品编号Sample No. 内参荧光强度Internal reference fluorescence intensity 待测样品荧光强度Fluorescence intensity of the sample to be measured 比值Ratio 基因组大小Genome/Gb Z-01 18.90 51.79 2.74 2.41 Z-13 26.61 63.08 2.37 2.09 Z-02 23.83 48.40 2.03 1.79 Z-14 27.09 65.13 2.40 2.12 Z-03 24.33 49.58 2.04 1.79 Z-15 27.22 64.87 2.38 2.10 Z-04 26.06 55.25 2.12 1.87 Z-16 26.68 55.70 2.09 1.84 Z-05 18.75 48.60 2.59 2.28 Z-17 26.63 53.53 2.01 1.77 Z-06 21.30 52.18 2.45 2.16 Z-18 27.19 55.46 2.04 1.79 Z-07 22.72 56.47 2.49 2.19 Z-19 27.61 55.73 2.02 1.78 Z-08 22.44 55.92 2.49 2.19 Z-20 28.26 56.70 2.01 1.77 Z-09 24.16 51.55 2.13 1.88 Z-21 28.56 58.22 2.04 1.79 Z-10 26.36 55.40 2.10 1.85 Z-22 28.34 56.89 2.01 1.77 Z-11 26.07 59.64 2.29 2.01 Z-(A) 28.77 58.62 2.04 1.79 Z-12 25.35 51.83 2.04 1.80 Z-(B) 28.54 58.29 2.04 1.80 3. 讨论
流式细胞术作为一种广泛应用于动植物生命科学各个领域的单细胞分选技术,融合了激光技术、半导体技术、流体力学、细胞化学等多学科知识,相较于孚耳根微显影法、基因组测序法更简便易行,检测结果更稳定可靠,已逐渐成为动植物基因组大小测定、倍性鉴定等研究的重要工具[22-24];并且流式细胞术可通过内参和外参法2种方式对物种进行核DNA含量检测,其中内参法可避免因样品的差异、机器的不稳定等因素造成的误差[25]。本研究首次以番茄作为内参样本对朱砂根种质资源基因组大小进行了测定,结果在所有混合组织匀浆处理中,DNA含量在上机检测时控制的变异系数CV均处于5%以内,内参样本和待测样本峰不重合且无杂峰,表明本次试验结果稳定可靠[26];排除了试验本身造成朱砂根种质资源基因组大小变异这一因素。
通常认为每个生物体的基因组大小是恒定数值,与生物体的进化水平及生物体复杂程度均无关,即所谓“C值悖论”[27];随后有学者认为基因组大小与植物体结构和功能的复杂程度呈正相关关系,但后期研究结果证明没有正相关关系[28]。如今随着基因组大小进化相关研究的不断深入,越来越多的研究表明物种C值与表型特征、核型特征、种子特征以及生态环境因子等众多因素密切相关[5,29-30]。而真核生物基因组长度的巨大差异主要归因于重复序列,其中种内不同种群间的基因组长度变异主要是由卫星DNA和转座子造成[31]。本次试验检测计算得到24份朱砂根基因组大小为1.77~2.41 Gb,平均为1.87 Gb,测定结果发现,部分朱砂根种质间C值存在明显变异,野生资源与部分栽培品种间也存在明显变异;结合24朱砂根实地观察以及前人研究,发现朱砂根品种间表型遗传丰富[14],居群间基因流动较密切且存在较高的遗传渗透[15]。因此,笔者推测朱砂根种内基因组大小变异的主要原因可能与其丰富的遗传变异或分子突变而导致种内重复序列的变化[32-33]。另外,有研究发现生物基因组大小的变异还与其多倍化现象有关[34]。但目前关于朱砂根种质资源倍性研究尚不清楚,因此不排除朱砂根中存在染色体非整倍化或多倍化现象,从而导致其种内基因组大小变异[32]。总之,影响朱砂根种内基因组大小因素很多,具体影响机制还需进一步研究。
4. 结论
本研究首次利用流式细胞技术对朱砂根基因组大小的测定方法进行了初步探索,并成功估测了24份朱砂根种质资源的基因组大小,丰富了朱砂根基因组基本信息。同时,通过测定朱砂根核DNA的含量,不仅为朱砂根的全基因组测序工作的前期预算评估和后期组装结果矫正提供数据指导,同时也为后续朱砂根基因组学和进化生物学研究提供参考。
-
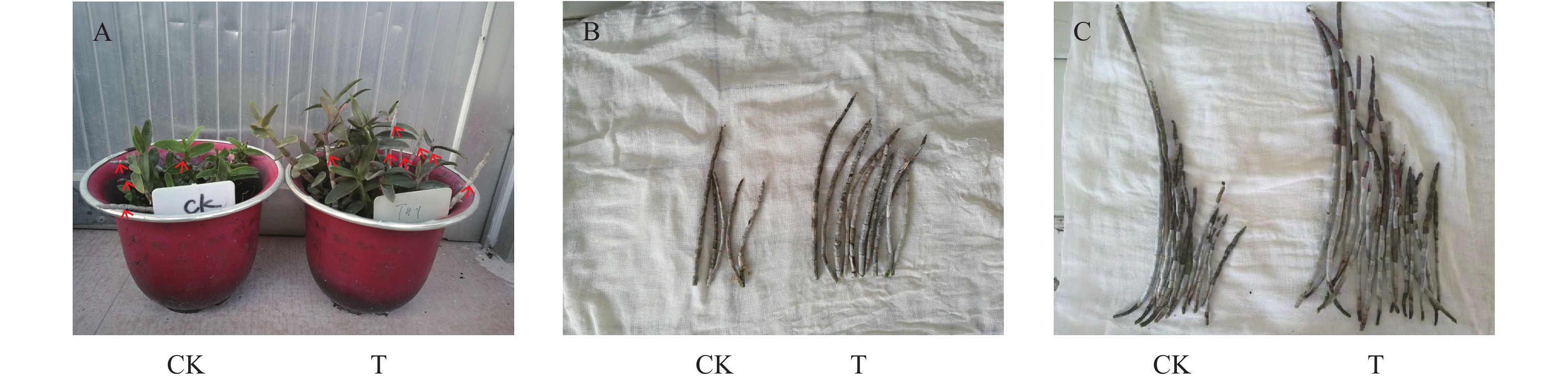
图 1 瘤菌根菌对不同生长年限铁皮石斛的农艺性状的影响
注:A.种植1 年后的封顶条和长出新芽苗,箭头标记为封顶条;B.2年条;C.1年条
Figure 1. Effect of Epulorhiza symbiosis on agronomic characteristics of one- and 2-year-old D. officinale plantlets
Note: A-capping strip (indicated by arrow) and sprouting seedlings a year after planting; B-stem from 2-year-old plantlet; C-stem from one-year-old plantlet.
表 1 瘤菌根菌对不同年限铁皮石斛的茎长、有效茎数、茎径、茎重的影响
Table 1 Effect of Epulorhiza symbiosis on length, viable stem count, diameter, and weight of one- and 2-year-old D. officinale stems
测定指标
Measurement index2年条(Stem of two years) 1年条(Stem of one year) CK T CK T 茎长 Stem length/cm 10.48±0.41 c 15.04±0.99 b 13.02±0.47 bc 19.25±0.62 a 有效茎数 Productive stem/stick 5.33±0.46 d 8.83±0.63 c 10.33±0.53 b 18.00±0.97 a 茎径 Stem diameter/cm 0.38±0.09 c 0.51±0.07 a 0.28±0.08 d 0.45±0.03 b 平均单茎重 Stem weight/g 2.08±0.54 b 3.23±0.43 a 2.06±0.42 b 3.12±0.45 a 注:表中数据为平均值±标准误差,同行数据后不同字母表示差异显著(P<0.05),表2~3下同。
Note:Data in the table represent average value±standard error,Date followed different letters within row indicate significant difference at 0.05 level. The same as table 2~3 .表 2 瘤菌根菌对不同年限铁皮石斛的主要营养成分的影响
Table 2 Effect of Epulorhiza symbiosis on major nutritional constituents in one- and 2-year-old D. officinale
(单位:%) 测定指标
Measurement index2年条 Stem of two years 1年条 Stem of one year CK T CK T 含水量 Water content 81.35±1.02 ab 83.12±1.85 a 73.93±1.63 c 80.05±1.84 b 粗蛋白质 Crude protein 1.26±0.06 b 1.19±0.03 b 1.23±0.01 b 1.46±0.08 a 粗纤维 Crude fiber 2.32±0.12 ab 2.18±0.15 b 2.59±0.13 a 2.13±0.14 b 灰分 Ash 0.38±0.02 a 0.23±0.05 b 0.44±0.06 a 0.28±0.04 b 粗多糖 Crude polysaccharides 12.33±0.26 a 12.17±0.14 a 8.528±0.42 c 11.12±0.36 b 石斛碱 Dendrobine 0.0321±0.001 a 0.0332±0.001 a 0.0327±0.001 a 0.0335±0.001 a 注:试验结果是以鲜重计。
Note: The results were calculated by fresh weight.表 3 瘤菌根菌对不同年限铁皮石斛的氨基酸组成的影响
Table 3 Effect of Epulorhiza symbiosis on amino acid composition of one- and 2-year-old D. officinale
(单位:%,以干基计) 氨基酸
Amino acid2年条 Stem of two years 1年条 Stem of one year CK T CK T 必需氨基酸 Essential amino acid 苏氨酸 Threonine 0.2584±0.023 b 0.3383±0.028 a 0.1988±0.018 c 0.2578±0.021 b 苯丙氨酸 Phenylalanine 0.2511±0.015 c 0.3478±0.014 a 0.2007±0.017 d 0.2715±0.018 b 赖氨酸 Lysine 0.3654±0.0233 b 0.4643±0.0188 a 0.2801±0.0245 c 0.3684±0.0164 b 缬草氨酸 Valine 0.2513±0.0151 b 0.3453±0.0135 a 0.2029±0.0166 c 0.2713±0.0173 b 蛋氨酸 Methionine 0.0348±0.0054 b 0.0294±0.0035 c 0.0419±0.0078 a 0.0357±0.0054 b 异亮氨酸 Isoleucine 0.2439±0.0233 b 0.3264±0.0114 a 0.1928±0.0164 c 0.2550±0.0135 b 亮氨酸 Isoleucine 0.5260±0.0236 b 0.6730±0.0295 a 0.4095±0.0216 c 0.5298±0.0303 b 非必需氨基酸 Nonessential amino acid 天门冬氨基酸 Aspartic acid 1.0619±0.1236 b 1.2087±0.0853 a 0.7014±0.0735 d 0.9148±0.0892 c 络氨酸 Tyrosine 0.1958±0.0191 b 0.3135±0.0253 a 0.1638±0.0128 c 0.1544±0.0142 c 丝氨酸 Serine 0.2054±0.0172 c 0.2923±0.0153 a 0.1697±0.0178 d 0.2340±0.0116 b 谷氨酸 Glutamic acid 0.7847±0.0895 b 1.0095±0.0617 a 0.5406±0.0591 c 0.7381±0.0453 b 甘氨酸 Glutamic acid 0.2707±0.0120 b 0.3641±0.0046 a 0.2102±0.0131 c 0.2786±0.087 b 丙氨酸 Alanine 0.2381±0.0106 c 0.3198±0.0107 a 0.1856±0.0238 d 0.2608±0.062 b 胱氨酸 Cystine 0.0386±0.0046 b 0.0500±0.0040 a 0.0215±0.0013 d 0.0262±0.0018 c 组氨酸 Histidine 0.0970±0.0054 c 0.1428±0.0036 a 0.0.813±0.0068 d 0.1099±0.0051 b 精氨酸 Arginine 0.4230±0.0082 b 0.4529±0.0112 a 0.2461±0.0043 d 0.2842±0.0103 c 脯氨酸 Proline 0.2157±0.0059 b 0.3186±0.0062 a 0.1630±0.0040 c 0.2195±0.0093 b 氨基酸总量 Total amino acid,EAA,TAA 5.4618±0.2426 b 6.9401±0.5769 a 4.0038±0.3163 c 5.2100±0.4216 b 必需氨基酸总量 Essential amino acid,EAA 1.9334±0.1581 b 2.5678±0.1834 a 1.5214±0.1735 c 1.9798±0.1088 b 非必需氨基酸总量 Nonessential amino acid,NEAA 3.5284±0.2193 b 4.3723±0.1532 a 2.4797±0.2353 c 3.2302±0.2014 b 必需氨基酸含量/氨基酸总量
Essential amino acid/ Total amino acid(EAA/TAA)0.35±0.01 b 0.37±0.01 a 0.38±0.01 a 0.38±0.01 a 必需氨基酸总量/非必需氨基酸总量
Essential amino acid/ Nonessential amino acid(EAA/NEAA)0.55±0.04 a 0.59±0.06 a 0.61±0.07 a 0.61±0.08 a -
[1] 谭青云, 袁永俊, 王丹, 等. 不同提取方式对铁皮石斛多糖及体外降血糖的影响 [J]. 食品科技, 2019, 44(6):202−206. TAN Q Y, YUAN Y J, WANG D, et al. Effects of different extraction methods on polysaccharide from Dendrobium candidum and hypoglycemic effect in vitro [J]. Food science and technology, 2019, 44(6): 202−206.(in Chinese)
[2] 汤志远, 周晓宇, 冯健, 等. 铁皮石斛多糖降血糖作用研究 [J]. 南京中医药大学学报, 2016, 32(6):566−570. TANG Z Y, ZHOU X Y, FENG J, et al. The hypoglycemic activity of homogeneous polysaccharides from Dendrobium officinale [J]. Journal of Nanjing University of Traditional Chinese Medicine (Natural Science), 2016, 32(6): 566−570.(in Chinese)
[3] XIA L J, LIU X F, GUO H Y, et al. Partial characterization and immunomodulatory activity of polysaccharides from the stem of Dendrobium officinale (Tiepishihu) in vitro [J]. Journal of Functional Foods, 2012, 4(1): 294−301. DOI: 10.1016/j.jff.2011.12.006
[4] 葛颖华, 王杰, 周萃, 等. 铁皮石斛中石斛碱、多糖的含量测定 [J]. 中国中医药科技, 2015, 22(5):527−528, 602. GE Y H, WANG J, ZHOU C, et al. Determination of dendrobine and polysaccharide in Dendrobium officinale [J]. Chinese Journal of Traditional Medical Science and Technology, 2015, 22(5): 527−528, 602.(in Chinese)
[5] 邵日凤, 胡粉青, 邹澄, 等. 石斛属植物化学成分和药理活性研究现状 [J]. 天然产物研究与开发, 2012, 24(B12):152−157, 121. SAO R F, HU F Q, ZOU C, et al. Advances on studies of chemical constituents and pharmacology of plants from Dendrobium sw [J]. Natural Product Research and Development, 2012, 24(B12): 152−157, 121.(in Chinese)
[6] 张爱莲, 魏涛, 斯金平, 等. 铁皮石斛中基本氨基酸含量变异规律 [J]. 中国中药杂志, 2011, 36(19):2632−2635. ZHANG A L, WEI T, SI J P, et al. Study on basic amino acid contents in Dendrobium officinale [J]. China Journal of Chinese Materia Medica, 2011, 36(19): 2632−2635.(in Chinese)
[7] 刘振鹏, 郭英英, 刘京晶, 等. 铁皮石斛品系与部位对氨基酸含量的影响 [J]. 中国中药杂志, 2015, 40(8):1468−1472. LIU Z P, GUO Y Y, LIU J J, et al. Effect of strains and parts on amino acids of Dendrobium officinale [J]. China Journal of Chinese Materia Medica, 2015, 40(8): 1468−1472.(in Chinese)
[8] 喻静, 蒋海侠, 张保钱, 等. 两株铁皮石斛内生真菌对组培苗和原球茎生长的影响 [J]. 植物病理学报, 2017, 47(4):541−550. YU J, JIANG H X, ZHANG B Q, et al. Characterization of endophytic fungi from Dendrobium officinale and study of their influence on growth of seedling and protocorm [J]. Acta Phytopathologica Sinica, 2017, 47(4): 541−550.(in Chinese)
[9] 李明. 兰科菌根的特点及其菌根真菌在兰花培育中的应用 [J]. 云南师范大学学报, 2001, 12(4):68−71. LI M. The characteristics of orchidaceous mycorrhiza and application of mycorrhizal fungi in orchid culture [J]. Journal of Yunnan Normal University, 2001, 12(4): 68−71.(in Chinese)
[10] 盖雪鸽, 邢晓科, 郭顺星. 兰科菌根的生态学研究进展 [J]. 菌物学报, 2014, 33(4):753−767. GAI X G, XING X K, GUO S X. Ecological research of orchid mycorrhizae: A review [J]. Mycosystema, 2014, 33(4): 753−767.(in Chinese)
[11] 王秋霞, 胡虹. 菌根共生对铁皮石斛生长发育的影响 [J]. 山东农业科学, 2019, 51(1):55−60. WANG Q X, HU H. Effects of mycorrhizal symbiosis on growth and development of Dendrobium officinale [J]. Shandong Agricultural Sciences, 2019, 51(1): 55−60.(in Chinese)
[12] WANG Q X, YAN N, JI D G, et al. Mycorrhizal fungi promote growth and nitrogen utilization by Dendrobium nobile (Orchidaceae) [J]. Journal of plant classification and resources, 2014, 36(3): 321−330.
[13] 金辉, 许忠祥, 陈金花, 等. 铁皮石斛组培苗与菌根真菌共培养过程中的相互作用 [J]. 植物生态学报, 2009, 33(3):433−441. DOI: 10.3773/j.issn.1005-264x.2009.03.002 JIN H, XU Z X, CHEN J H, et al. Interaction between tissue-cultured seedlings of den- drobium officinale and mycorrhizal fungus (Epulorhiza sp.) during symbiotic culture [J]. Chinese Journal of Plant Ecology, 2009, 33(3): 433−441.(in Chinese) DOI: 10.3773/j.issn.1005-264x.2009.03.002
[14] 龚记熠, 李菲, 孙威, 等. 内生真菌对营养亏缺下金钗石斛幼苗生长的影响 [J]. 云南农业大学学报: 自然科学, 2019, 34(1):110−115. GONG J Y, LI F, SUN W, et al. Effects of endophytic fungi on the seedling growth characteristics of Dendrobium nobile under nutritional deficiency [J]. Journal of Yunnan Agricultural University(Natural Science), 2019, 34(1): 110−115.(in Chinese)
[15] 闫浩利, 陈晓梅, 廖方华, 等. 菌根真菌对金钗石斛幼苗生长及石斛碱和多糖积累的影响 [J]. 中国药学杂志, 2016, 51(17):1450−1454. YAN H L, CHEN X M, LIAO F H, et al. Effects of mycorrhizal fungi on the growth and dendrobine and polysaccharide accumulation of Dendrobium nobile lindl seedlings [J]. Chinese Pharmaceutical Journal, 2016, 51(17): 1450−1454.(in Chinese)
[16] 朱波, 刘京晶, 斯金平, 等. 铁皮石斛内生真菌对宿主组培苗生长与代谢成分的影响 [J]. 中国中药杂志, 2016, 41(9):1602−1607. ZHU B, LIU J J, SI J P, et al. Effects of endophytic fungi from Dendrobium officinale on host growth and components metabolism of tissue culture seedlings [J]. China Journal of Chinese Materia Medica, 2016, 41(9): 1602−1607.(in Chinese)
[17] 王伟英, 邹晖, 戴艺民, 等. 一株铁皮石斛内生真菌的鉴定及对株型的影响 [J]. 福建农业学报, 2019, 34(7):837−841. WANG W Y, ZOU H, DAI Y M, et al. Identification and effection on the plant type of an endophytic fungus of Dendrobium officinale [J]. Fujian Journal of Agricultural Sciences, 2019, 34(7): 837−841.(in Chinese)
[18] 王伟英, 邹晖, 戴艺民, 等. 瘤菌根菌对铁皮石斛根系形态的影响及其共生关系的研究 [J]. 热带亚热带植物学报, 2020, 28(2):124−130. DOI: 10.11926/jtsb.4093 WANG W Y, ZOU H, DAI Y M, et al. Effect of Epulorhiza sp. on root morphology of Dendrobium officinale and their symbiotic relationship [J]. Journal of Tropical and Subtropical Botany, 2020, 28(2): 124−130.(in Chinese) DOI: 10.11926/jtsb.4093
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中水分的测定: GB 5009.3-2016[S]. 北京: 中国标准出版社, 2016. [20] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2016[S]. 北京: 中国标准出版社, 2017. [21] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中灰分的测定: GB 5009.4—2016[S]. 北京: 中国标准出版社, 2017. [22] 中华人民共和国卫生部, 中国国家标准化管理委员会. 植物类食品中粗纤维的测定: GB/T 5009.10—2003[S]. 北京: 中国标准出版社, 2004. [23] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中氨基酸的测定: GB 5009.124—2016[S]. 北京: 中国标准出版社, 2017. [24] 中华人民共和国国家质量监督检验检疫总局. 出口植物源食品中粗多糖的测定 苯酚-硫酸法: SN/T 4260—2015[S]. 北京: 中国标准出版社, 2016. [25] 申刚, 乙引, 张习敏, 等. HPLC法测定金钗石斛中石斛碱含量 [J]. 安徽农业科学, 2009, 37(31):15248−15249. DOI: 10.3969/j.issn.0517-6611.2009.31.069 SHEN G, YI Y, ZHANG X M, et al. Determination on dendrobine content in Dendrobium nobile by HPLC method [J]. Journal of Anhui Agricultural Sciences, 2009, 37(31): 15248−15249.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2009.31.069
[26] 国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2015: 92-93. [27] 谭嘉娜, 陈月桂, 罗剑飘, 等. 不同来源金线莲生长与品质对比分析 [J]. 热带农业科学, 2016, 36(6):62−65. TAN J N, CHEN Y G, LUO J P, et al. Comparision of Growth and Quality of Anoectochilus roxburghii from different regions [J]. Chinese Journal of Tropical Agriculture, 2016, 36(6): 62−65.(in Chinese)
[28] 俞婕, 赵凯鹏, 董飞, 等. 野生铁皮石斛内生菌的分离及促生作用研究 [J]. 现代农业科技, 2010(9):96−97. DOI: 10.3969/j.issn.1007-5739.2010.09.057 YU J, ZHAO K P, DONG F, et al. Separation and growth-promoting study of endophyte in wild Dendrobium candidum [J]. Xiandai Nongye Keji, 2010(9): 96−97.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2010.09.057
[29] 董金海, 王广林. 内生菌NL-215对霍山铁皮石斛试管苗生长的影响 [J]. 现代中药研究与实践, 2013, 27(3):11−13. DONG J H, WANG G L. Effects of the endophytic fungi NL-215 on tube plants growth of Dendrobium officinale kimura et migo from Huoshan [J]. Research and Practice on Chinese Medicines, 2013, 27(3): 11−13.(in Chinese)
[30] 帅红艳. 广西环江产铁皮石斛内生真菌的分离鉴定及其生物活性的研究[D]. 南宁: 广西大学, 2008: 3-8. SHUAI H Y. Studies on isolation, identification and bioactivity of endophytic fungi from Dendrobium candidum grew in Huanjiang of Guangxi[D]. Nanning: Guangxi University, 2008: 3-8. (in Chinese).
[31] 高川, 郭顺星, 张靖, 等. 福建金线莲与菌根真菌互作过程中的蛋白质组研究 [J]. 中国中药杂志, 2012, 37(24):3717−3722. GAO C, GUO S X, ZHANG J, et al. Proteome analysis on interaction between Anoectochilus roxburghii and Mycorrhizal fungus [J]. China Journal of Chinese Materia Medica, 2012, 37(24): 3717−3722.(in Chinese)
[32] 唐丽, 李菁, 龙华, 等. 不同生长龄铁皮石斛茎与叶中总多糖、总生物碱及总黄酮含量的差异 [J]. 广东农业科学, 2015, 42(8):17−21. DOI: 10.3969/j.issn.1004-874X.2015.08.004 TANG L, LI J, LONG H, et al. Content differences of total polysaccharides, total alkaloids and total flavonoids from stems and leaves of Dendrobium candidum at different growth ages [J]. Guangdong Agricultural Sciences, 2015, 42(8): 17−21.(in Chinese) DOI: 10.3969/j.issn.1004-874X.2015.08.004
[33] 吴经耀, 冯瑛. 不同采收期铁皮石斛主要成分含量测定及比较 [J]. 中国民族民间医药, 2019, 28(10):39−42. WU J Y, FENG Y. The determination and comparison of main components of Dendrobium officinale in different harvesting periods [J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2019, 28(10): 39−42.(in Chinese)
-
期刊类型引用(2)
1. 李玉洁. 南繁育种中种质资源基因漂移的知识产权问题与法律法规保护对策. 分子植物育种. 2024(13): 4500-4504 .  百度学术
百度学术
2. 周子琦,孙楠,严雅洁,杨志远,李良俊,冯凯. 慈姑基因组大小鉴定及核型分析. 西北植物学报. 2024(07): 1122-1128 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: