HPLC-MS/MS Determination of Melatonin in Brown Planthopper at Growth Stages
-
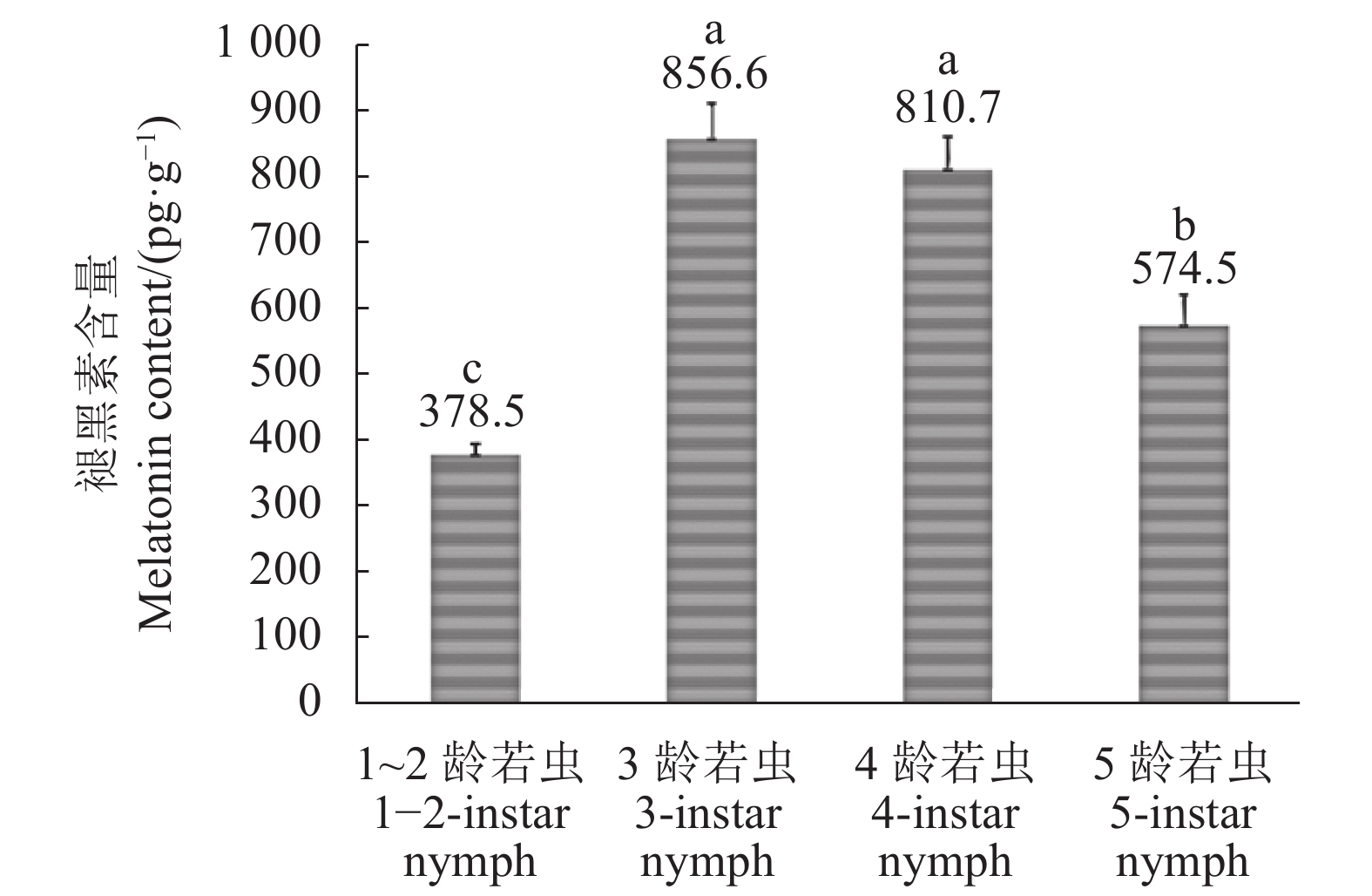
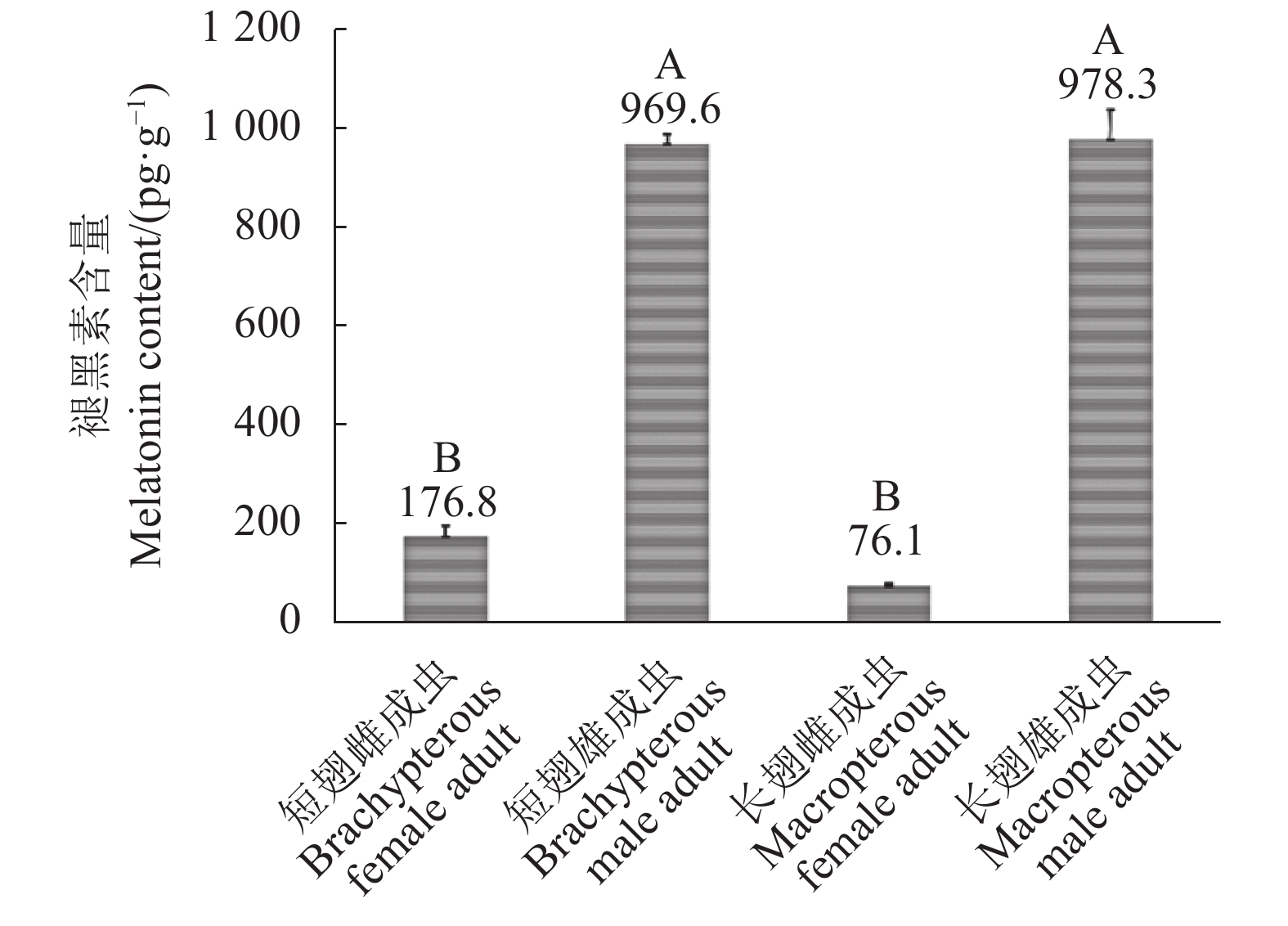
摘要:目的 明确褪黑素在褐飞虱各发育阶段的含量情况。方法 通过高效液相色谱-串联质谱技术(HPLC-MS/MS)对1~5龄若虫和两种翅型雌、雄成虫体内褪黑素含量进行测定和比较。结果 褐飞虱若虫期褪黑素含量在1~2龄若虫时期最低,平均为378.5 pg·g−1。3龄若虫褪黑素含量最高,为856.6 pg·g−1。4龄若虫褪黑素含量下降,为810.7 pg·g−1,与3龄无显著差异。5龄若虫褪黑素含量下降显著,为574.5 pg·g−1。褐飞虱成虫褪黑素含量与性别显著相关,但受翅型影响不明显。雌、雄成虫间的褪黑素水平有极显著差异,长、短翅雄性成虫的褪黑素含量分别为978.3 pg·g−1和969.6 pg·g−1,而长、短翅雌性的褪黑素含量仅为76.1 pg·g−1和176.8 pg·g−1,甚至低于1~2龄若虫时期。结论 初步明确了褐飞虱各发育阶段体内褪黑素含量变化特点,为后续研究褐飞虱褪黑素功能及机理奠定基础。Abstract:Objective Melatonin contents in brown planthopper,
Nilaparvata lugens (Stl), at various developmental stages were determined. Method HPLC-MS/MS was used to measure the melatonin contents in the 1st to the 5th instar nymphs as well as female and male macropterous and brachypterous adults of the insect.Result At nymph stage, N. lugens had the lowest average melatonin content of 378.5 pg·g−1 in the 1st and the 2nd instars, the highest of 856.6 pg·g−1 in the 3rd instar, 810.7 pg·g−1 in the 4th instar, and 574.5 pg·g−1 in the 5th instar. Adult N. lugens differed significantly on melatonin contents between male and female but not between the macropterous and brachypterous wing types. The male of macropterous and brachypterous wing types contained 978.3 pg·g−1 and 969.6 pg·g−1 melatonin, respectively, which were extremely significantly higher than the female counterparts at 76.1 pg·g−1 and 176.8 pg·g−1, respectively.Conclusion The melatonin contents in N. lugens as nymphs and adults were determined.-
Keywords:
- Nilaparvata lugens (Stål) /
- melatonin /
- endogenous hormone /
- sex difference /
- rice pest /
- wing type
-
0. 引言
【研究意义】果聚糖(Fructan)为水溶性非还原性多糖,是由蔗糖与1个或多个果糖基连接而成的聚合物[1]。果聚糖作为15%被子植物中主要的贮藏性碳水化合物,其代谢与渗透调节、源库关系调节、抗逆性等生理活动密切相关。目前已发现植物中的果聚糖主要有5种类型,其中大蒜果聚糖属于菊糖型果聚糖新生系列。果聚糖:果聚糖6G-果糖基转移酶(6G-FFT)是其合成过程所必需的酶,能够发生特异性反应,催化1-蔗果三糖生成新蔗果三糖[2]。植物转基因技术已广泛应用于基因工程育种,以改善作物品质、提高作物产量、培育植物新品种等。目前转基因技术最为广泛和成熟的方法主要是农杆菌介导法,但农杆菌所携带含有目的基因的T-DNA区域是随机插入受体植物基因组中,因而得到的转基因植株通常含有一个或多个拷贝的外源基因[3]。而转基因植物中外源基因的拷贝数是影响其表达水平及稳定遗传的关键因素,多拷贝的外源基因会直接导致基因沉默或不能稳定表达[4],因此,筛选单拷贝外源基因的转基因植株对后续遗传稳定性起关键性作用。【前人研究进展】近年来,对果聚糖代谢调控基因的功能研究已成为热点。在菊苣中转化洋葱6G-FFT基因后,发现菊苣中含有菊糖型果聚糖新生系列[5]。Gadegaard等[6]将洋葱中的6G-FFT转入黑麦草中,发现果聚糖积累量比对照高3倍。何娜等[7]克隆芦笋Ao6G-FFT基因,对其序列特征进行分析,发现其启动子区域存在响应非生物胁迫的元件。此外,前人研究检测外源基因拷贝数常采用Southern blot技术,但其价格昂贵、耗时较长、灵敏度较低[8]。近年来,研究人员开始利用实时荧光定量PCR技术检测外源基因拷贝数,如王育花等[9]通过实时荧光定量PCR检测了转基因水稻中外源基因拷贝数,在8株检测植株中,得到1株单拷贝的植株。裘劼人等[10]利用SYBR Green实时定量PCR法检测转基因拟南芥中外源基因拷贝数,发现该法计算所得拷贝数与传统高准确性的Southern blot法结果相符。苏慧慧等[11]利用实时荧光定量PCR技术检测转基因樱桃番茄中外源基因拷贝数,发现12株转基因植株内整合的拷贝数为0~20不等,且其中4株在普通PCR中存在假阳性。【本研究切入点】目前,方便快捷、灵敏性强、成本低的实时荧光定量PCR检测外源基因拷贝数的技术逐渐被广泛应用。但鲜见有关大蒜As6G-FFT基因转入烟草的研究报道。【拟解决的关键问题】本研究将从大蒜中克隆的As6G-FFT基因转入烟草中,获得转As6G-FFT基因烟草,然后分别提取测定14株转基因烟草叶片的DNA、RNA及果聚糖含量,以从DNA、RNA及生理水平鉴定阳性单拷贝As6G-FFT转基因烟草,以期为筛选单拷贝的转As6G-FFT基因烟草提供参考依据。
1. 材料与方法
1.1 试验材料与试剂
以组培苗移栽后生长30 d的野生型烟草K326和转As6G-FFT基因烟草为试验材料,取二者的幼嫩叶片速冻于液氮中,置于−80 ℃超低温冰箱中保存,用于基因组DNA和RNA的提取以及果聚糖含量测定。转As6G-FFT基因烟草和野生型烟草 K326均为青海省蔬菜遗传与生理重点实验室保存。
利用新型植物基因组DNA提取试剂盒和TRNzol Universal试剂(北京天根生化科技有限公司)进行总DNA和RNA的提取,采用Honor™ Ⅱ 1st Strand cDNA Synthesis SuperMix和Unique Aptamer™ qPCR SYBR® Green Master Mix(北京诺禾致源科技股份有限公司)进行qRT-PCR分析。
1.2 引物设计与合成
阳性转基因烟草鉴定和荧光定量分析所用引物均使用Primer 5软件设计,引物由上海生工生物工程有限公司合成,引物序列见表1。
表 1 引物序列Table 1. Primer sequence引物
Primer引物序列
(5′-3′) Primer sequence目的
PurposeAs6G-FFT-clone F: ATGGATGCTCAAGACATTGAG
TC阳性PCR检测
Positive PCR detectionR: TTAAAAATGATAAAAATCATTG
TAAGTGGAGTTCAs6G-FFT F: TGGCTCTTTACGCACTCA 实时荧光定量
PCR分析
qRT-PCR analysisR: TCGCACTCGTCCTACCTC NtACT F: AATGATCGGAATGGAAGCTG R: TGGTACCACCACTGAGGACA 1.3 转As6G-FFT基因烟草PCR检测
采用新型植物基因组DNA提取试剂盒提取1株野生型烟草K326和14株转As6G-FFT基因烟草叶片的基因组DNA,以其为模板,以As6G-FFT-clone为引物(表1),通过PCR扩增鉴定As6G-FFT基因是否导入烟草基因组。扩增产物长度约为1 839 bp,PCR反应体系为2×Taq PCR Mix 12.5 μL,cDNA模板1 μL,上下游引物各1 μL,ddH2O 9.5 μL;反应程序为94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min,扩增产物经1.0%琼脂糖凝胶电泳分析。
1.4 转As6G-FFT基因烟草表达量分析
为了分析As6G-FFT基因在RNA水平的表达情况,对经PCR鉴定呈阳性的转基因植株进行As6G-FFT转录水平分析。利用TRNzol Universal提取总RNA,检测RNA的质量和浓度后,检测合格的RNA样品利用Honor™ Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR反转录为cDNA。以测试烟草的cDNA为模板,以烟草Actin基因特异引物NtACT和大蒜6G-FFT基因特异引物As6G-FFT对各样本一起进行扩增,引物序列详见表1。反应体系为Unique Aptamer Green Matser Mix 10 μL,cDNA模板1 μL,上下游引物各0.6 μL,ddH2O 7.8 μL;反应程序为94 ℃预变性5 min;95 ℃ 30 s,56 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃延伸10 min,重复3次。
1.5 转As6G-FFT基因烟草果聚糖含量测定
果聚糖的提取及含量测定参考田洁等[12]的方法进行。利用高效液相色谱仪(日本岛津RID-10A)进行测定,采用Shodex SUGAR KS-801串KS-802色谱柱,示差检测器,以超纯水作为流动相,流速为1 mL·min−1,柱温箱温度为80 ℃,进样量为5 µL。通过碳水化合物组分的标准品及外标法进行定量分析,各组分含量单位以mg·g−1 DW表示。
1.6 As6G-FFT和NtACT基因标准曲线制作
选择烟草Actin基因[13]作为内源参照基因进行拷贝数估算,参照王盛等[14]的方法,利用SYBR Green 实时荧光定量PCR法检测转基因烟草植株中外源As6G-FFT基因的拷贝数。以野生型烟草K326的基因组DNA为内参基因标准品,紫外分光光度计测得质量浓度为0.040 6 μg·μL−1,将其进行5倍梯度稀释,稀释倍数分别为50、51、52、53和54,使用NtACT引物进行PCR扩增。同时以含有As6G-FFT基因的质粒为外源基因标准品,紫外分光光度计测得质量浓度为0.035 6 μg·μL−1,将其进行5倍梯度稀释,稀释倍数同上,后使用As6G-FFT引物进行PCR扩增。反应体系与程序同1.4,最后制作内参基因和外源基因实时荧光定量PCR的标准曲线。
1.7 转基因烟草中内参基因和外源基因的定量分析
以1株野生型烟草和14株PCR检测为阳性的转As6G-FFT基因烟草植株基因组DNA为模板,对转基因烟草中As6G-FFT基因表达进行定量分析。使用As6G-FFT引物进行PCR扩增,设1个空白对照,每个样品3次技术重复,同时,分别以14株转As6G-FFT基因烟草植株和1株WT烟草植株的基因组DNA为模板,对转基因烟草中内参基因表达进行定量分析。使用NtACT引物进行PCR扩增,设1个空白对照,每个样品3次技术重复。反应体系与程序同1.4。
2. 结果与分析
2.1 转As6G-FFT基因烟草PCR检测
选取转基因烟草幼嫩叶片进行基因组DNA的提取,经质检合格后,使用As6G-FFT基因克隆引物(表1)对其进行PCR扩增。结果显示14个转基因烟草叶片均能扩增出目的片段,而野生型烟草中未检测到目的条带(图1),说明14个转基因烟草株系中已成功转入目的基因As6G-FFT。
2.2 转As6G-FFT基因烟草表达量分析
为了分析转基因烟草中As6G-FFT基因的表达水平,以组培苗移栽后30 d烟草叶片为材料,提取14个转基因烟草株系和野生型烟草叶片的RNA并反转为cDNA,然后利用qRT-PCR技术分析As6G-FFT基因的表达量(图2)。结果显示,与WT相比,14个转基因株系中有7个株系(N3、N4、N5、N9、N10、N11、N14)表达量极其显著上升(P<0.001),其余7个株系均达到极显著上升水平(P<0.01)。总体而言,转基因株系中的As6G-FFT基因表达量比野生型高1.17~215.13倍。表明将大蒜As6G-FFT基因过表达转入烟草后转基因烟草株系中As6G-FFT基因表达量呈极显著水平上升。
2.3 转As6G-FFT基因烟草果聚糖含量测定
进一步测定14个转As6G-FFT基因烟草株系的果聚糖含量(图3)。结果发现,14个转基因株系的果聚糖含量都高于野生型烟草,其中有13个转基因株系的果聚糖含量呈极其显著升高(P<0.001),1个转基因株系(N7)的果聚糖含量显著升高(P<0.01),而野生型烟草中几乎没有果聚糖。转基因株系的果聚糖含量比野生型显著提高了1.51~10.47倍。以上结果表明转基因烟草中As6G-FFT催化了果聚糖的合成。
2.4 转基因烟草中As6G-FFT基因拷贝数测定
2.4.1 As6G-FFT和NtACT基因实时荧光定量PCR的标准曲线
转基因植物中外源基因的拷贝数是影响其表达水平及稳定遗传的关键。因此,本研究利用实时荧光定量PCR技术,以烟草Actin基因为内参,建立As6G-FFT基因拷贝数鉴定方程。根据Ct值与对应模板拷贝数对数值间的线性关系,以Ct值为横坐标、起始模板拷贝数的对数为纵坐标,分别获得内参基因和外源基因标准品实时荧光定量PCR的标准曲线(图4)。As6G-FFT基因实时荧光定量PCR的标准曲线为y=−0.290 7x+3.014 5(R2=1),NtACT基因实时荧光定量PCR的标准曲线为y=−0.281 3x+8.014 1(R2=1)。两个基因标准曲线相关系数均接近于1,表明检测样品所得的结果准确可信。
2.4.2 As6G-FFT和NtACT基因实时荧光定量PCR熔解曲线
As6G-FFT和NtACT基因实时荧光定量PCR熔解曲线如图5所示,As6G-FFT和NtACT基因熔点分别为83.70和80.17,熔解曲线均为单峰,说明引物特异性强,在反应中无引物二聚体等非特异性扩增,即测得的试验数据准确可信。
2.4.3 As6G-FFT和NtACT基因实时荧光定量PCR扩增曲线
外源基因As6G-FFT的扩增结果如图6-A所示,除空白对照未扩增出荧光曲线外,其余被测的烟草植株样品均扩增出荧光曲线,表明样品未被污染,检测结果可信。内参基因NtACT的扩增结果如图6-B所示,转基因烟草植株样品均扩增出荧光曲线,而野生型烟草植株和空白对照均未扩增出荧光曲线。
2.4.4 转基因烟草中As6G-FFT基因拷贝数计算
对14株PCR检测为阳性的转As6G-FFT基因烟草植株和1株野生型烟草植株的As6G-FFT和NtACT基因进行实时荧光定量PCR分析,所得Ct值和Tm值如表2所示。通过标准曲线计算Ct值对应模板浓度的对数值,再根据外源基因和内参基因模板浓度对数值的比值绝对值估算出外源基因的拷贝数,计算结果如表2所示,检测的14株转As6G-FFT基因烟草植株的最低拷贝数为1,最高拷贝数达到3个,其中1拷贝单株数5株,占总转基因株数的35.7%;2拷贝单株数7株,占总转基因株数的50%;3拷贝单株数2株,占总转基因株数的14.3%;而野生型烟草植株的As6G-FFT基因拷贝数为0。
表 2 转基因烟草中As6G-FFT基因拷贝数Table 2. Copy number of As6G-FFT in transgenic tobacco plants转基因烟草
Transgenic tobaccoAs6G-FFT基因
As6G-FFT geneNtACT基因
NtACT gene浓度对数值的比值
Log value ratio of concentration拷贝数
Copy numberCt 熔解温度
Tm浓度对数值
Log value of concentrationCt 熔解温度
Tm浓度对数值
Log value of concentrationN1 19.14 83.81 2.55 20.60 80.13 2.22 1.15 1 N2 20.44 83.67 2.93 23.40 80.12 1.43 2.04 2 N3 20.81 83.70 3.03 20.78 80.10 2.17 1.40 1 N4 21.08 83.79 3.11 20.62 80.25 2.21 1.41 1 N5 21.66 83.73 3.28 23.57 80.23 1.38 2.37 2 N6 20.62 83.60 2.98 21.76 80.04 1.89 1.57 2 N7 19.72 83.61 2.72 21.53 80.23 1.96 1.39 1 N8 18.98 83.78 2.50 21.33 80.38 2.01 1.24 1 N9 23.51 83.75 3.82 23.82 80.19 1.31 2.91 3 N10 22.48 83.66 3.52 22.39 80.08 1.71 2.05 2 N11 22.46 83.79 3.51 21.78 80.21 1.89 1.86 2 N12 21.80 83.84 3.32 22.60 80.29 1.66 2.01 2 N13 22.76 83.69 3.60 22.75 80.12 1.61 2.23 2 N14 22.72 83.66 3.59 23.42 80.03 1.43 2.52 3 3. 讨论与结论
植物遗传转化是农作物改良和基因功能研究的常用试验方法。本研究在课题组前期工作基础上,对转As6G-FFT基因烟草T0代进行了筛选与阳性鉴定,共获得14个阳性转基因烟草株系。研究表明过表达植株后代中外源基因拷贝数是影响目的基因表达水平和遗传稳定性的主要因素,拷贝数越低,遗传稳定性越高。因此,获得阳性转基因植株后,对其外源基因拷贝数进行检测分析具有重要意义。
实时荧光定量PCR检测外源基因拷贝数是近几年迅速发展起来的外源基因拷贝数检测新方法,目前已在柑橘、烟草、玉米、水稻等多种作物中应用[15-18],其中SYBR Green荧光染料由于成本低、简单易用、灵敏度高,而被广泛采用[10,19-20]。本研究利用SYBR Green法成功对14个转As6G-FFT基因烟草株系的As6G-FFT拷贝数进行了实时荧光定量PCR检测,得出了As6G-FFT基因的整合特点,其中具有1、2和3个拷贝的单株数分别占植株总数的35.7%、50.0%和14.3%,且1~2个拷贝的单株数占整个转基因植株的85.7%,这与文献报道中提到的,农杆菌介导转化,一般外源基因以低拷贝(1~2)整合为主(占70%以上)的结果一致。Tan等[21]检测15份转基因植株拷贝数,其中1~2拷贝的单株数占总数的86.6%;Wen等[22]对26株转基因柑橘进行拷贝数分析,结果表明1~2拷贝整合数量占整个转基因植株的73%;魏毅东等[23]对9个OsPIMT1转基因水稻T0代植株进行拷贝数检测,其中6个为单拷贝,3个为双拷贝;杜京尧等[24]采用实时荧光定量PCR技术检测OsRhoGDI2
转基因水稻中的外源基因拷贝数,结果显示OsRhoGDI2在过表达转基因水稻中均为单拷贝。由此说明采用实时荧光定量PCR检测转基因拷贝数具有简单、高效、方便、准确等优点。此外,烟草是植物基因功能研究的模式植物,应用该方法检测并筛选单拷贝数的转基因烟草,可为今后转基因拷贝数研究提供一种新的检测技术。 本研究首先采用基因组DNA扩增的方法,检测As6G-FFT基因是否均已稳定整合到烟草基因组中,进而采用定量PCR技术在转录水平检测As6G-FFT在转基因烟草中的表达水平。结果显示As6G-FFT基因表达量水平显著高于野生型;此外,分别提取了野生型和转基因烟草中的果聚糖含量,发现果聚糖含量在转基因烟草中的积累要显著高于野生型。以上对转基因烟草在基因水平、转录水平及生理水平的分析结果均一致表明,As6G-FFT过表达载体已整合到烟草基因组。最后通过实时荧光定量PCR法检测阳性转基因烟草中As6G-FFT的拷贝数,发现外源As6G-FFT基因整合到烟草中的低拷贝(1~2)单株数占整个转基因植株的85.7%。本研究分析鉴定了14个转As6G-FFT基因烟草株系,获得了低拷贝(1~2)的阳性转As6G-FFT基因烟草株系,为后续As6G-FFT基因功能分析提供稳定遗传材料,同时也为植物外源基因拷贝数分析提供技术支撑。
-
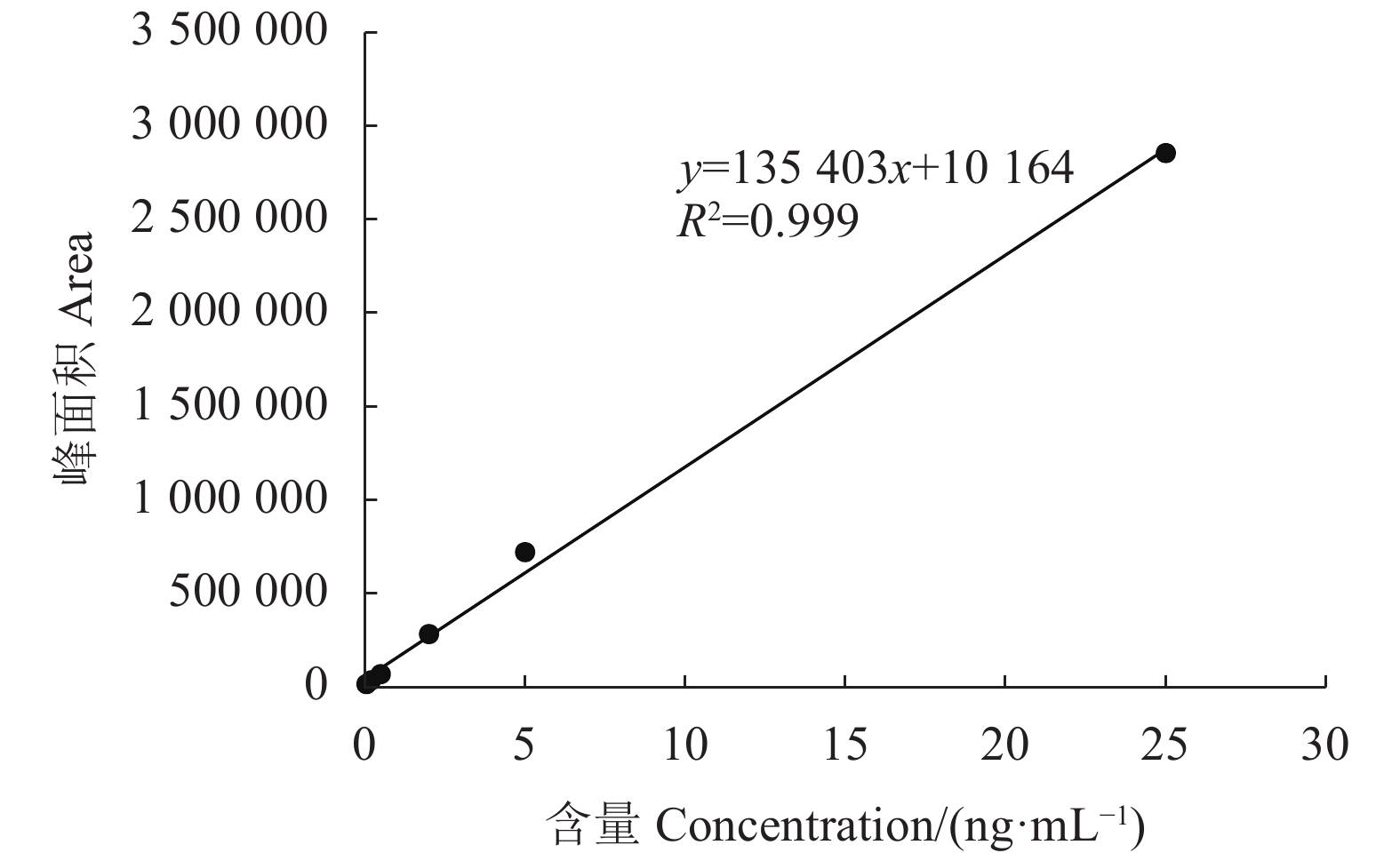
表 1 褪黑素质子化或去质子化的选择反应监测条件([M+H]+或[M-H]−)
Table 1 Conditions for monitoring protonated [M+H]+ or deprotonated [M-H]− melatonin reactions
物质名称 Compound name 极性 Polarity 母离子 Parent ion(m/z) 子离子 Daughter ion(m/z) 解簇电压 DP/ V 碰撞能量 CE/ V Melatonin + 233 174.1*/159.1/216.1 50 9/34/13 注:标记*的为定量离子。
Note: * Quantitative ion pair. -
[1] BYEON Y, BACK K. Melatonin synthesis in rice seedlings in vivo is enhanced at high temperatures and under dark conditions due to increased serotonin N-acetyltransferase and N-acetylserotonin methyltransferase activities [J]. Journal of Pineal Research, 2014, 56(2): 189−195. DOI: 10.1111/jpi.12111
[2] LEE K, BACK K. Melatonin-deficient rice plants show a common semidwarf phenotype either dependent or independent of brassinosteroid biosynthesis [J]. Journal of Pineal Research, 2019, 66(2): e12537. DOI: 10.1111/jpi.12537
[3] LU R F, LIU Z Y, SHAO Y D, et al. Melatonin is responsible for rice resistance to rice stripe virus infection through a nitric oxide-dependent pathway [J]. Virology Journal, 2019, 16(1): 141. DOI: 10.1186/s12985-019-1228-3
[4] LERNER A B, CASE J D, TAKAHASHI Y, et al. Isolation of melatonin, the pineal gland factor that lightens melanocytes1 [J]. Journal of the American Chemical Society, 1958, 80(10): 2587.
[5] TAN D X, MANCHESTER L C, HARDELAND R, et al. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin [J]. Journal of Pineal Research, 2003, 34(1): 75−78. DOI: 10.1034/j.1600-079X.2003.02111.x
[6] VIVIEN-ROELS B, PEVET P, BECK O, et al. Identification of melatonin in the compound eyes of an insect, the locust (Locusta migratoria), by radioimmunoassay and gas chromatography-mass spectrometry [J]. Neuroscience Letters, 1984, 49(1/2): 153−157.
[7] BLOCH G, HAZAN E, RAFAELI A. Circadian rhythms and endocrine functions in adult insects [J]. Journal of Insect Physiology, 2013, 59(1): 56−69. DOI: 10.1016/j.jinsphys.2012.10.012
[8] VIVIEN-ROELS B, PÉVET P. Melatonin: presence and formation in invertebrates [J]. Experientia, 1993, 49(8): 642−647. DOI: 10.1007/BF01923945
[9] ITOH M T, HATTORI A, NOMURA T, et al. Melatonin and arylalkylamine N-acetyltransferase activity in the silkworm, Bombyx mori [J]. Molecular and Cellular Endocrinology, 1995, 115(1): 59−64. DOI: 10.1016/0303-7207(95)03670-3
[10] ITOH M T, SUMI Y. Melatonin and serotonin N-acetyltransferase activity in developing eggs of the cricket Gryllus bimaculatus [J]. Brain Research, 1998, 781: 91−99. DOI: 10.1016/S0006-8993(97)01220-1
[11] RICHTER K, PESCHKE E, PESCHKE D. A neuroendocrine releasing effect of melatonin in the brain of an insect, Periplaneta americana (L.) [J]. Journal of Pineal Research, 2000, 28(3): 129−135.
[12] FINOCCHIARO L, CALLEBERT J, LAUNAY J M, et al. Melatonin biosynthesis in Drosophila: Its nature and its effects [J]. Journal of Neurochemistry, 1988, 50(2): 382−387. DOI: 10.1111/j.1471-4159.1988.tb02923.x
[13] ITOH M T, HATTORI A, SUMI Y, et al. Day-night changes in melatonin levels in different organs of the cricket (Gryllus bimaculatus) [J]. Journal of Pineal Research, 1995, 18(3): 165−169. DOI: 10.1111/j.1600-079X.1995.tb00156.x
[14] HARDIE J, GAO N. Melatonin and the pea aphid, Acyrthosiphon pisum [J]. Journal of Insect Physiology, 1997, 43(7): 615−620. DOI: 10.1016/S0022-1910(97)00015-2
[15] 李秀, 秦玉川, ZANCHARY YONG HUANG, 等. 蜜蜂褪黑素的测定方法 [J]. 应用昆虫学报, 2005, 42(1):99−102. DOI: 10.3969/j.issn.0452-8255.2005.01.029 LI X, QIN Y C, HUANG Z Y, et al. A testing method for melatonin of honeybee [J]. Chinese Journal of Applied Entomology, 2005, 42(1): 99−102.(in Chinese) DOI: 10.3969/j.issn.0452-8255.2005.01.029
[16] DURRANT J, MICHAELIDES E B, RUPASINGHE T, et al. Constant illumination reduces circulating melatonin and impairs immune function in the cricket Teleogryllus commodus [J]. PeerJ, 2015, 3: e1075. DOI: 10.7717/peerj.1075
[17] SUBALA S P R R, SHIVAKUMAR M S. Changes in light and dark periods affect the arylalkylamine N-acetyl transferase, melatonin activities and redox status in the head and hemolymph of nocturnal insect Spodoptera litura [J]. Biological Rhythm Research, 2018, 49(1): 13−28. DOI: 10.1080/09291016.2017.1325564
[18] 丁锦华, 胡春林, 傅强. 中国稻区常见飞虱原色图鉴[M]. 杭州: 浙江科学技术出版社, 2012. [19] YAMANO H, WATARI Y, ARAI T, et al. Melatonin in drinking water influences a circadian rhythm of locomotor activity in the house cricket, Acheta domesticus [J]. Journal of Insect Physiology, 2001, 47: 943−949. DOI: 10.1016/S0022-1910(01)00067-1
[20] 张志涛, 殷柏涛, 陈伦裕. 褐稻虱发声机理模型和雌虫鸣声的人工模拟 [J]. 中国水稻科学, 1991, 5(1):29−36. DOI: 10.3321/j.issn:1001-7216.1991.01.006 ZHANG Z T, YIN B T, CHEN L Y. The model of signal production and the simulation of female signals in rice brown planthopper, Nilaparvata lugens (Stål) (Homootera: Delphacidae) [J]. Chinese Journal of Rice Science, 1991, 5(1): 29−36.(in Chinese) DOI: 10.3321/j.issn:1001-7216.1991.01.006
[21] 施龙清, 林祁, 刘端华, 等. 水稻褐飞虱移动行为规律初探 [J]. 福建农业学报, 2019, 34(8):952−957. SHI L Q, LIN Q, LIU D H, et al. Moving behavior of adult brown planthoppers, Nilaparvata lugens [J]. Fujian Journal of Agricultural Sciences, 2019, 34(8): 952−957.(in Chinese)
[22] WURTMAN R J, AXELROD J, CHU E W. Effects of melatonin, a pineal substance: Effect on the rat ovary [J]. Science, 1963, 141: 277−278. DOI: 10.1126/science.141.3577.277
-
期刊类型引用(2)
1. 董晓静,夏启玉,降彦苗,刘国庆,程汝宏,赵辉. 两种PCR快速检测转基因糜子中外源基因的插入拷贝数. 热带农业科学. 2025(02): 55-63 .  百度学术
百度学术
2. 田春尧,冀慧玥,丁润月,郑乔木,周嘉裕,廖海. 转基因本氏烟草中CtDXR基因拷贝数及耐盐耐高温功能的初步分析. 生物学杂志. 2024(04): 17-23 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: