HPLC-MS/MS Determination of Melatonin in Brown Planthopper at Growth Stages
-
摘要:目的 明确褪黑素在褐飞虱各发育阶段的含量情况。方法 通过高效液相色谱-串联质谱技术(HPLC-MS/MS)对1~5龄若虫和两种翅型雌、雄成虫体内褪黑素含量进行测定和比较。结果 褐飞虱若虫期褪黑素含量在1~2龄若虫时期最低,平均为378.5 pg·g−1。3龄若虫褪黑素含量最高,为856.6 pg·g−1。4龄若虫褪黑素含量下降,为810.7 pg·g−1,与3龄无显著差异。5龄若虫褪黑素含量下降显著,为574.5 pg·g−1。褐飞虱成虫褪黑素含量与性别显著相关,但受翅型影响不明显。雌、雄成虫间的褪黑素水平有极显著差异,长、短翅雄性成虫的褪黑素含量分别为978.3 pg·g−1和969.6 pg·g−1,而长、短翅雌性的褪黑素含量仅为76.1 pg·g−1和176.8 pg·g−1,甚至低于1~2龄若虫时期。结论 初步明确了褐飞虱各发育阶段体内褪黑素含量变化特点,为后续研究褐飞虱褪黑素功能及机理奠定基础。Abstract:Objective Melatonin contents in brown planthopper,
Nilaparvata lugens (Stl), at various developmental stages were determined. Method HPLC-MS/MS was used to measure the melatonin contents in the 1st to the 5th instar nymphs as well as female and male macropterous and brachypterous adults of the insect.Result At nymph stage, N. lugens had the lowest average melatonin content of 378.5 pg·g−1 in the 1st and the 2nd instars, the highest of 856.6 pg·g−1 in the 3rd instar, 810.7 pg·g−1 in the 4th instar, and 574.5 pg·g−1 in the 5th instar. Adult N. lugens differed significantly on melatonin contents between male and female but not between the macropterous and brachypterous wing types. The male of macropterous and brachypterous wing types contained 978.3 pg·g−1 and 969.6 pg·g−1 melatonin, respectively, which were extremely significantly higher than the female counterparts at 76.1 pg·g−1 and 176.8 pg·g−1, respectively.Conclusion The melatonin contents in N. lugens as nymphs and adults were determined.-
Keywords:
- Nilaparvata lugens (Stål) /
- melatonin /
- endogenous hormone /
- sex difference /
- rice pest /
- wing type
-
0. 引言
【研究意义】褐飞虱Nilaparvata lugens (Stål)是水稻最主要害虫之一。作为专食性昆虫,一方面褐飞虱的若虫和成虫栖息在水稻茎基部刺吸汁液危害,另一方面雌虫交配后将卵排列产于稻株韧皮部内,破坏水稻疏导组织。危害严重时,稻株大面积枯萎倒伏塌陷,导致减产甚至绝收。已知褪黑素在水稻中含量相对较高,且在重要激素合成和水稻抗性方面具有重要作用[1-3]。【前人研究进展】褪黑素(melatonin),化学名称为N-乙酰5-甲氧基色氨,为血清素(serotonin,5-羟色氨)的衍生物,是一种吲哚类内分泌激素[4]。最早在牛的松果体中发现,后续研究证实所有脊椎动物体内均存在有褪黑素,并且除松果体外,其他器官如视网膜、晶状体、骨髓细胞、肠道及皮肤等也能够分泌褪黑素[5]。1984年,Vivien-Roel等利用放射免疫法(Radioimmunoassay,RIA)从蝗虫的复眼中检测到褪黑素,首次证明褪黑素同样存在于昆虫体内[6]。此后,陆续在半翅目(Hemiptera)、蜻蜓目(Odonata)、蜚蠊目(Blattodea)、直翅目(Orthoptera)、鳞翅目(Lepidoptera)、膜翅目(Hymenoptera)以及双翅目(Diptera)等昆虫中发现[7]。研究表明褪黑素在昆虫昼夜节律、胚胎发育、蜕皮和繁殖等重要生命活动中不可或缺[8-11]。以果蝇Drosophila melanogaster为例,在人为注射褪黑素后,其交配速度和产卵量均显著降低[12]。作为一种内源性激素,褪黑素在昆虫体内的含量极低,且主要集中于头部复眼内[7, 13]。如蝗虫Locusta migratoria单只复眼的褪黑素含量仅有10.5~26.5 pg[6],100 mg重量的豌豆蚜虫Acyrthosiphon pisum褪黑素含量为52.5~78.0 pg[14]。昆虫褪黑素检测的方法包括放射免疫测定法(radioimmunoassay,RIA)、高效液相色谱法(high performance liquid chromatography,HPLC)和酶联免疫法(euzymelinked immunosorbent assay,ELISA),以及高效液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS)等[15-17]。相对来讲,在这些方法中LC-MS检测具有灵敏度高、检测速度快、费用低、结果稳定等特点,逐步成为检测生物体褪黑素含量的主要方法。【本研究切入点】褐飞虱褪黑素的含量和作用机理尚待深入研究。【拟解决的关键问题】本研究通过高效液相色谱-串联质谱技术对1~5龄若虫和长短翅、雌雄成虫的褪黑素含量进行测定和比较,明确褪黑素在褐飞虱各发育阶段的含量情况,为后续褪黑素作用机理研究提供方向和数据支持。
1. 材料与方法
1.1 主要仪器与试剂
主要仪器:TG-16G 台式高速离心机(湖南凯达科学仪器有限公司),FA1204 电子天平(精确度0.1 mg,上海衡际科学仪器有限公司),AGLIENT1290 高效液相色谱仪(美国AGLIENT 公司),SCIEX-6500Qtrap质谱仪(MS/MS)(美国AB 公司),CHA-2气浴恒温摇床(苏州威尔实验用品公司),PS40A 超声清洗仪(深华泰科学仪器有限公司),水浴氮吹仪(上海那艾仪器有限公司)。
试剂:褪黑素(melatonin)标准品(美国Sigma 公司),甲醇、乙腈 (色谱级,德国默克医药生物科技公司)。
1.2 标曲溶液配制
取1 mg褪黑素标准品粉末,置于2 mL甲醇中,震荡溶解均匀,作为褪黑素标准品储备液。取甲醇998 μL 于1.5 mL 离心管,加入500 μg·mL−1 褪黑素标准品储备液2 μL,震荡均匀,配制1 μg·mL−1 的工作母液;母液继续用甲醇稀释至20.00、5.00、2.00、0.50、0.20、0.05 ng·mL−1系列标曲溶液。
1.3 褐飞虱饲养及样品收集
供试褐飞虱种源于2017年夏季取自从福建省农业科学院水稻研究所试验田,用台中1号(TN1)品种水稻苗在室内饲养,饲养条件为:每日5:00~18:59光照,光照周期14L∶10D;室内温度(28±1 )℃,相对湿度60%~70%。
收集同一批次羽化褐飞虱雌雄成虫各约50头放入一个新养虫笼内。笼内提供足量TN1水稻新苗供雌虫产卵。待卵孵化后,根据发育进程,并参照丁锦华等[18]对褐飞虱若虫龄期的鉴别方法,依次收集1~2龄若虫、3龄若虫、4龄若虫、5龄若虫、长翅雌性成虫、长翅雄性成虫、短翅雌性成虫和短翅雄性成虫共8个虫态褐飞虱,每个虫态取3份样,每份样品重量不低于100 mg,收集时间段均在14:00~15:00。虫样装于1.5 mL离心管后保存于−80 ℃超低温冰箱备用。
1.4 样品前处理
称取0.02 g样品,加入约10倍体积二氯甲烷,用一次性研磨棒研磨后在4 ℃下浸泡过夜,12 000 g、4 ℃离心5 min,取下层二氯甲烷相;上层物质取出后加入二氯甲烷再度浸泡过夜,离心取二氯甲烷相,合并两次提取的二氯甲烷相,氮气吹至近干,200 μL甲醇复溶后过0.22 μm有机相滤膜,定容至200 μL,−20 ℃保存待测。
1.5 HPLC-MS/MS检测条件
液相条件:色谱柱为poroshell 120 SB-C18 反相色谱柱(2.1×150,2.7 μm);柱温30 ℃。
流动相:A:B=(甲醇/0.1%甲酸):(水/0.1%甲酸);洗脱梯度: 0~1.0 min,50%;1.0~3.0 min,50%~80%;3.0~3.1 min,80%~50%;3.1~6.0 min,50%。流速300 μL·min−1;进样量2 μL;分析时间6 min。
质谱条件:电离方式采用ESI 正负离子模式分别监测;扫描类型MRM;气帘气25 psi;
喷雾电压:+3500 V;雾化气压力55 psi;辅助气压力65 psi;雾化温度450 ℃。
褪黑素反应监测条件见表1。褪黑素分子量为233,电喷雾电离正离子模式,质子化后母离子[M+H]+为233,选为定性离子。随后碰撞过程中会丢失NH4CO2,形成主要碎片m/z174.1,选为定性离子。褪黑素出峰保留时间为3.38 min。
表 1 褪黑素质子化或去质子化的选择反应监测条件([M+H]+或[M-H]−)Table 1. Conditions for monitoring protonated [M+H]+ or deprotonated [M-H]− melatonin reactions物质名称 Compound name 极性 Polarity 母离子 Parent ion(m/z) 子离子 Daughter ion(m/z) 解簇电压 DP/ V 碰撞能量 CE/ V Melatonin + 233 174.1*/159.1/216.1 50 9/34/13 注:标记*的为定量离子。
Note: * Quantitative ion pair.1.6 数据分析
仪器所测得含量为最终提取液的含量,经计算获得原样品中激素含量,计算方法如下:
样品中褪黑素含量(ng·g−1)=[检测含量(ng·mL−1)×稀释体积(mL)]/称取质量(g)
式中:稀释体积为样品最终溶解进样时所用的溶液体积;称取质量为提取时的取样质量;检测含量由待测物质峰面积代入标曲方程计算求得。
试验数据重复测定3次,取平均值。应用SPSS 22.0、Microsoft Excel 2010以及OriginPro 8.0软件进行数据分析。
2. 结果与分析
2.1 褪黑素标准曲线
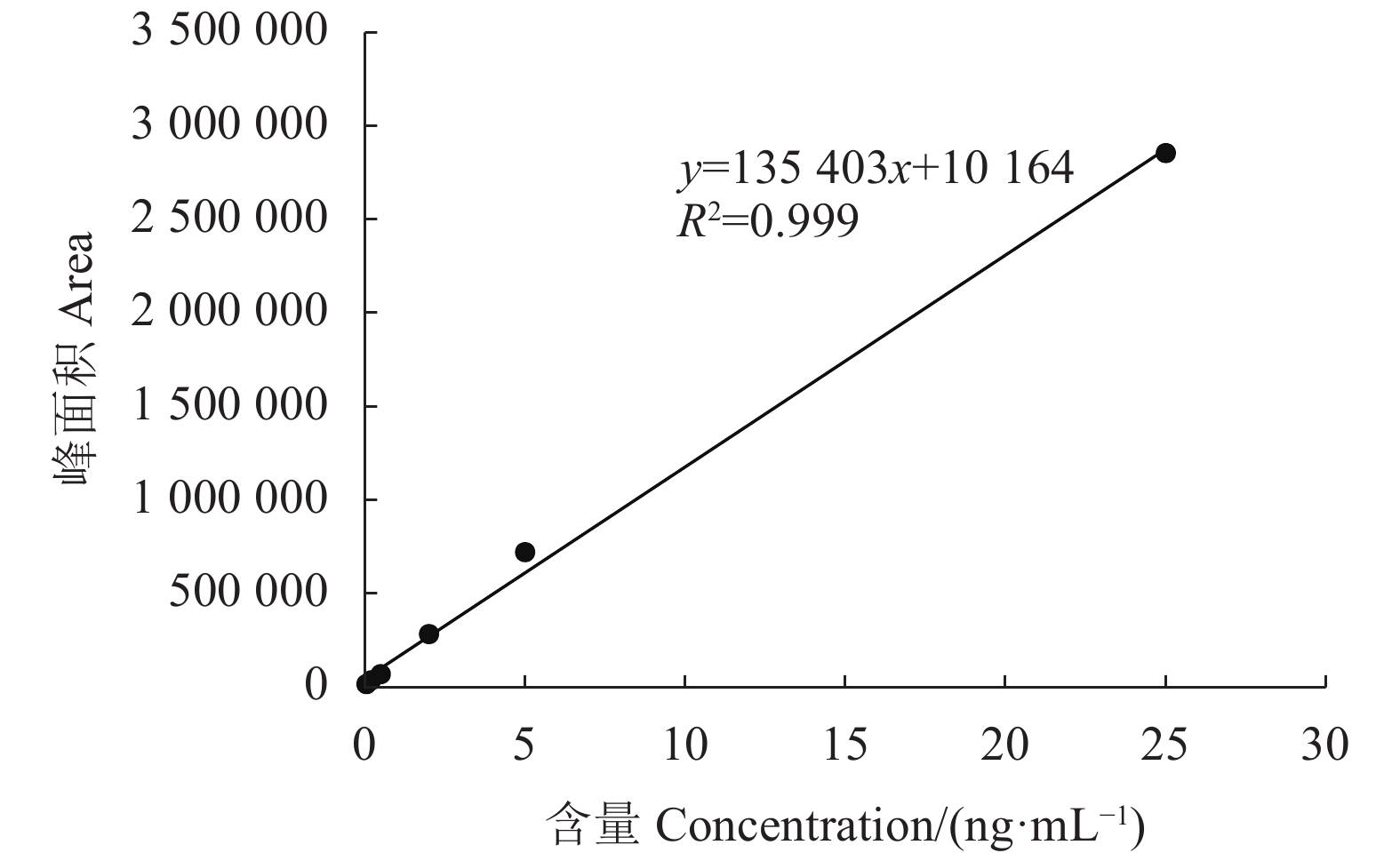
20.00、5.00、2.00、0.50、0.20、0.05 ng·mL−16个标曲溶液以平均峰面积为纵坐标(y),褪黑素标准品含量为横坐标(x),绘制标准曲线。得到线性回归方程y=135403x+10164,R2=0.999,峰面积与含量呈现出良好的线性关系,可用于定量分析(图1)。
2.2 各龄期褐飞虱若虫褪黑素含量比较
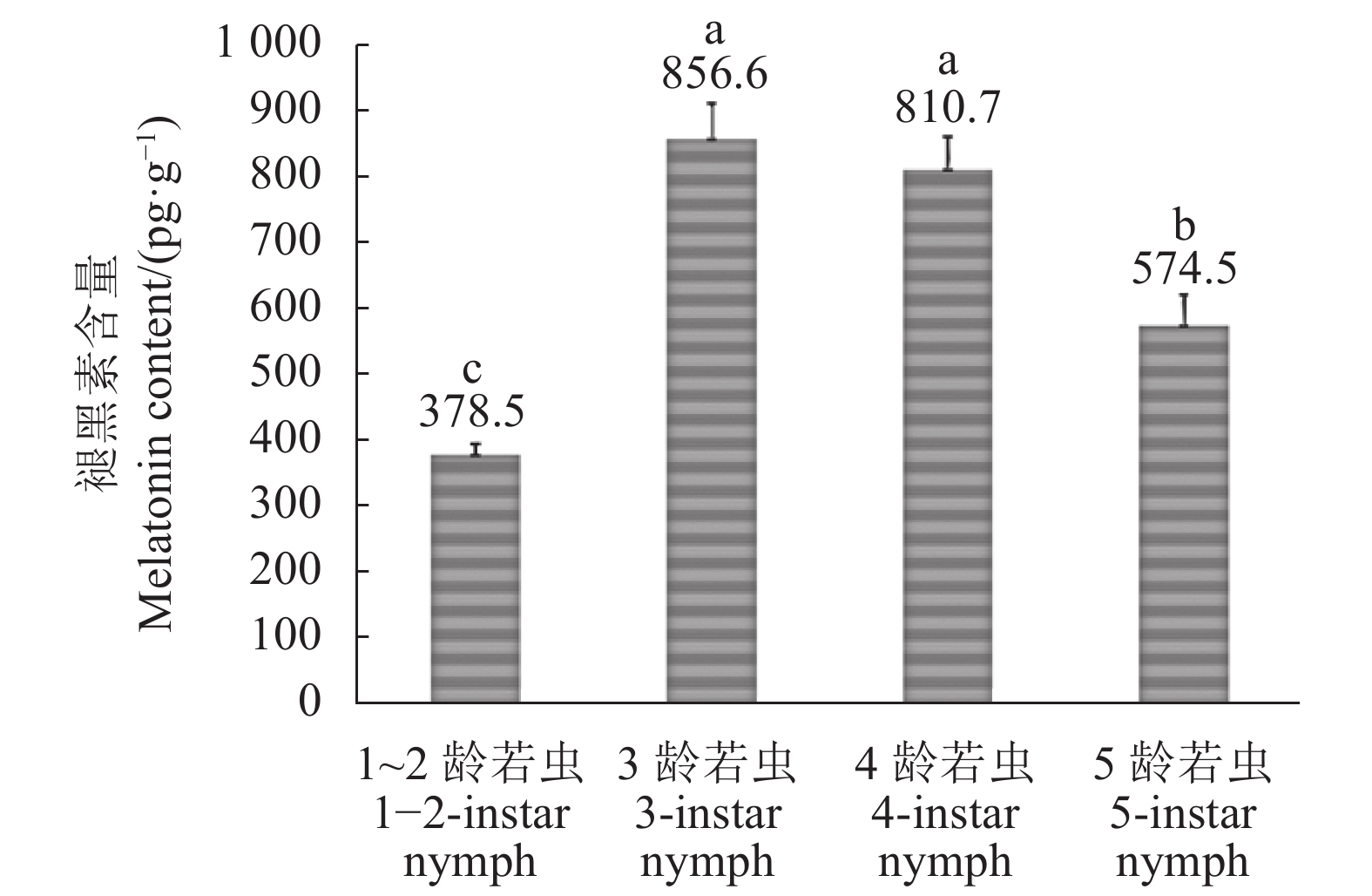
如图2所示,在若虫阶段,1~2龄褐飞虱若虫的褪黑素含量均值最低,为378.5 pg·g−1,进入3龄后褪黑素含量快速上升并达到若虫阶段的峰值(均值856.6 pg·g−1),4龄、5龄时褪黑素含量逐渐下降,均值分别为810.7 pg·g−1和574.5 pg·g−1,但5龄若虫褪黑素含量仍显著高于1~2龄。3龄和4龄若虫间褪黑素含量无显著差异,但显著高于1~2龄和5龄时期若虫褪黑素含量(图2)。
2.3 各龄期褐飞虱若虫褪黑素含量比较
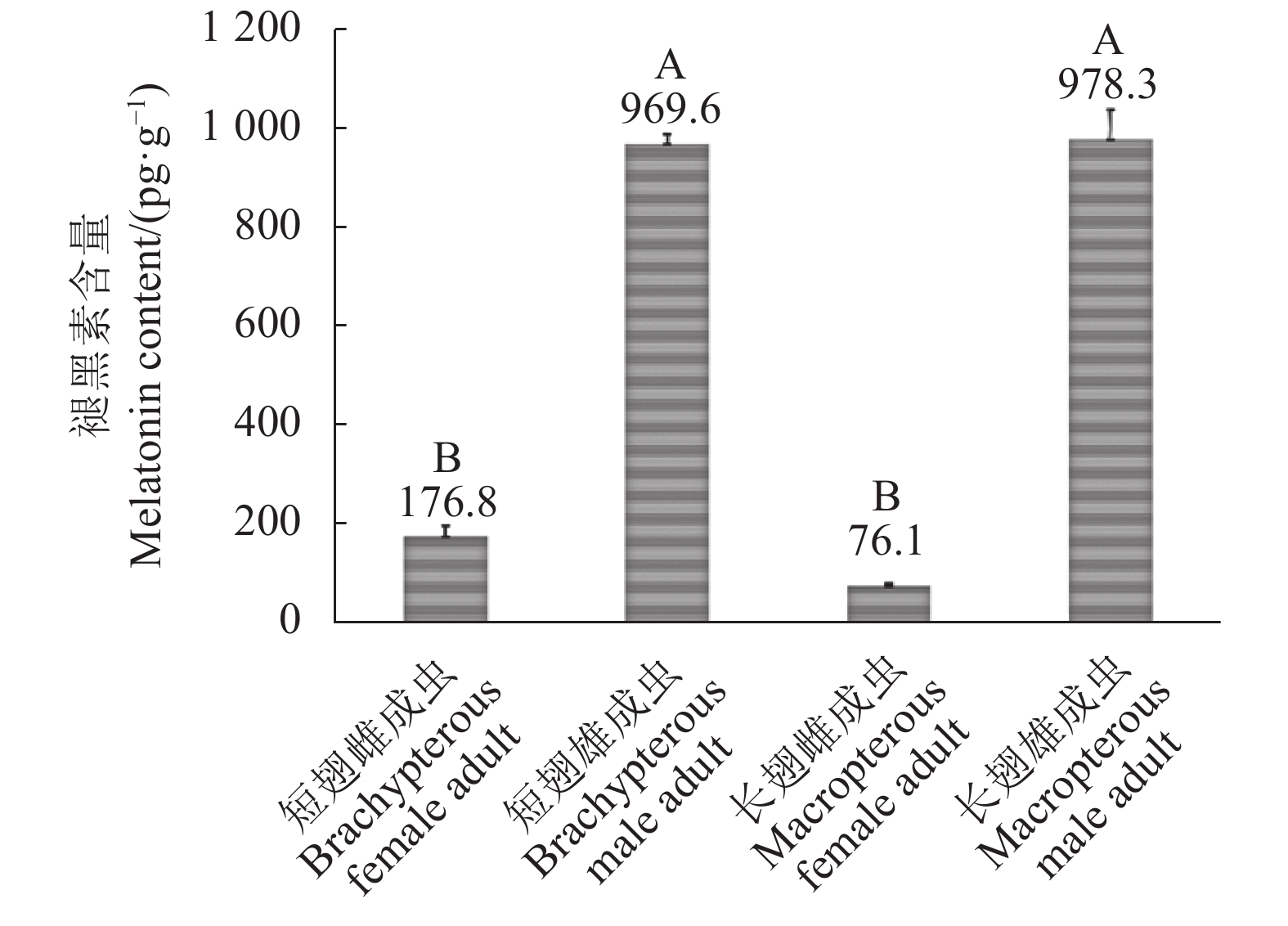
若虫羽化为成虫后,雌、雄褐飞虱的褪黑素含量出现极端分化(图3):以性别(雌、雄)和翅型(长翅、短翅)为变量,对成虫阶段褪黑素含量进行双因素方差分析(Two-way ANOVA)。结果表明,褐飞虱成虫雌雄间褪黑素含量差异显著(df=1,8;F=630.083;P<0.001),而长、短翅型间的差异不明显(df=1,8;F=1.854; P=0.210)。性别和翅型间的交互效应不显著(df=1,8;F=2.630; P=0.144)。长、短翅雄性成虫褪黑素含量上升明显,均值分别为978.3 pg·g−1和969.6 pg·g−1,高于若虫阶段褪黑素峰值(3龄若虫);长、短翅雌性成虫褪黑素含量则急剧下降,均值分别为76.1 pg·g−1和176.8 pg·g−1,不足雄性成虫的四分之一。单因素方差分析及LSD多重比较结果表明,雄性长、短翅成虫褪黑素含量无显著差异,与雌性两个翅型成虫相比差异极显著(P<0.01)(图3)。
3. 讨论与结论
本研究结果表明,褐飞虱整个生长发育期体内褪黑素含量范围在76.1~978.3 pg·g−1,若虫体内褪黑素含量的峰值为856.6 pg·g−1,出现在3龄后,随后逐渐下降,羽化后的成虫体内褪黑素含量受性别影响极端分化,雄虫体内所含褪黑素约是雌虫的5~12倍,分别为长翅雌虫76.1 pg·g−1、长翅雄虫978.3 pg·g−1、短翅雌虫176.8 pg·g−1、短翅雄虫969.6 pg·g−1,这表明褐飞虱体内的褪黑素含量具有显著的性别间差异。前人发现昆虫体内的褪黑素主要集中在头部[6, 12],且相较植物中的褪黑素含量,昆虫体内的褪黑素含量极少,更加难以检测。褐飞虱一二龄若虫个体微小,若仅针对其头部进行褪黑素测定,难度和误差均较大,因而本试验整体进行褪黑素的提取。
褐飞虱为半变态昆虫,若虫具有5个龄期,从若虫到成虫共经历5次蜕皮,而蜕皮激素是控制其蜕皮的关键因素[18]。已有的研究证实,褪黑素可促进美洲大蠊Periplaneta americana (L.)促前胸腺激素分泌,进而刺激蜕皮激素合成[11]。在本研究中,3~5龄褐飞虱若虫保持相对较高的褪黑素含量,这对蜕皮激素的合成有利。本研究另一个重要的发现是褐飞虱雌雄成虫间褪黑素的含量存在极显著差异。在对蟋蟀Acheta domesticus的研究中发现,褪黑素可以调控其移动行为规律[19]。褐飞虱的求偶交配过程遵循“call-fly”策略,即雄性成虫表现活跃,四处搜寻并发出振动信号通过寄主进行传递,雌性接收信号后静止不动并以特有振动信号进行回复,收到反馈的雄性对雌性进行定位并移动接近[20]。在前期的研究中也发现雄性褐飞虱的移动量显著高于雌性[21],推测褪黑素对褐飞虱成虫的移动行为起调控作用。另有研究指出,褪黑素对卵巢发育具有抑制作用[22],因此褐飞虱雌性成虫褪黑素含量低也有利于卵巢发育。后续我们将开展褪黑素对褐飞虱移动行为和卵巢发育的调控研究。
-
表 1 褪黑素质子化或去质子化的选择反应监测条件([M+H]+或[M-H]−)
Table 1 Conditions for monitoring protonated [M+H]+ or deprotonated [M-H]− melatonin reactions
物质名称 Compound name 极性 Polarity 母离子 Parent ion(m/z) 子离子 Daughter ion(m/z) 解簇电压 DP/ V 碰撞能量 CE/ V Melatonin + 233 174.1*/159.1/216.1 50 9/34/13 注:标记*的为定量离子。
Note: * Quantitative ion pair. -
[1] BYEON Y, BACK K. Melatonin synthesis in rice seedlings in vivo is enhanced at high temperatures and under dark conditions due to increased serotonin N-acetyltransferase and N-acetylserotonin methyltransferase activities [J]. Journal of Pineal Research, 2014, 56(2): 189−195. DOI: 10.1111/jpi.12111
[2] LEE K, BACK K. Melatonin-deficient rice plants show a common semidwarf phenotype either dependent or independent of brassinosteroid biosynthesis [J]. Journal of Pineal Research, 2019, 66(2): e12537. DOI: 10.1111/jpi.12537
[3] LU R F, LIU Z Y, SHAO Y D, et al. Melatonin is responsible for rice resistance to rice stripe virus infection through a nitric oxide-dependent pathway [J]. Virology Journal, 2019, 16(1): 141. DOI: 10.1186/s12985-019-1228-3
[4] LERNER A B, CASE J D, TAKAHASHI Y, et al. Isolation of melatonin, the pineal gland factor that lightens melanocytes1 [J]. Journal of the American Chemical Society, 1958, 80(10): 2587.
[5] TAN D X, MANCHESTER L C, HARDELAND R, et al. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin [J]. Journal of Pineal Research, 2003, 34(1): 75−78. DOI: 10.1034/j.1600-079X.2003.02111.x
[6] VIVIEN-ROELS B, PEVET P, BECK O, et al. Identification of melatonin in the compound eyes of an insect, the locust (Locusta migratoria), by radioimmunoassay and gas chromatography-mass spectrometry [J]. Neuroscience Letters, 1984, 49(1/2): 153−157.
[7] BLOCH G, HAZAN E, RAFAELI A. Circadian rhythms and endocrine functions in adult insects [J]. Journal of Insect Physiology, 2013, 59(1): 56−69. DOI: 10.1016/j.jinsphys.2012.10.012
[8] VIVIEN-ROELS B, PÉVET P. Melatonin: presence and formation in invertebrates [J]. Experientia, 1993, 49(8): 642−647. DOI: 10.1007/BF01923945
[9] ITOH M T, HATTORI A, NOMURA T, et al. Melatonin and arylalkylamine N-acetyltransferase activity in the silkworm, Bombyx mori [J]. Molecular and Cellular Endocrinology, 1995, 115(1): 59−64. DOI: 10.1016/0303-7207(95)03670-3
[10] ITOH M T, SUMI Y. Melatonin and serotonin N-acetyltransferase activity in developing eggs of the cricket Gryllus bimaculatus [J]. Brain Research, 1998, 781: 91−99. DOI: 10.1016/S0006-8993(97)01220-1
[11] RICHTER K, PESCHKE E, PESCHKE D. A neuroendocrine releasing effect of melatonin in the brain of an insect, Periplaneta americana (L.) [J]. Journal of Pineal Research, 2000, 28(3): 129−135.
[12] FINOCCHIARO L, CALLEBERT J, LAUNAY J M, et al. Melatonin biosynthesis in Drosophila: Its nature and its effects [J]. Journal of Neurochemistry, 1988, 50(2): 382−387. DOI: 10.1111/j.1471-4159.1988.tb02923.x
[13] ITOH M T, HATTORI A, SUMI Y, et al. Day-night changes in melatonin levels in different organs of the cricket (Gryllus bimaculatus) [J]. Journal of Pineal Research, 1995, 18(3): 165−169. DOI: 10.1111/j.1600-079X.1995.tb00156.x
[14] HARDIE J, GAO N. Melatonin and the pea aphid, Acyrthosiphon pisum [J]. Journal of Insect Physiology, 1997, 43(7): 615−620. DOI: 10.1016/S0022-1910(97)00015-2
[15] 李秀, 秦玉川, ZANCHARY YONG HUANG, 等. 蜜蜂褪黑素的测定方法 [J]. 应用昆虫学报, 2005, 42(1):99−102. DOI: 10.3969/j.issn.0452-8255.2005.01.029 LI X, QIN Y C, HUANG Z Y, et al. A testing method for melatonin of honeybee [J]. Chinese Journal of Applied Entomology, 2005, 42(1): 99−102.(in Chinese) DOI: 10.3969/j.issn.0452-8255.2005.01.029
[16] DURRANT J, MICHAELIDES E B, RUPASINGHE T, et al. Constant illumination reduces circulating melatonin and impairs immune function in the cricket Teleogryllus commodus [J]. PeerJ, 2015, 3: e1075. DOI: 10.7717/peerj.1075
[17] SUBALA S P R R, SHIVAKUMAR M S. Changes in light and dark periods affect the arylalkylamine N-acetyl transferase, melatonin activities and redox status in the head and hemolymph of nocturnal insect Spodoptera litura [J]. Biological Rhythm Research, 2018, 49(1): 13−28. DOI: 10.1080/09291016.2017.1325564
[18] 丁锦华, 胡春林, 傅强. 中国稻区常见飞虱原色图鉴[M]. 杭州: 浙江科学技术出版社, 2012. [19] YAMANO H, WATARI Y, ARAI T, et al. Melatonin in drinking water influences a circadian rhythm of locomotor activity in the house cricket, Acheta domesticus [J]. Journal of Insect Physiology, 2001, 47: 943−949. DOI: 10.1016/S0022-1910(01)00067-1
[20] 张志涛, 殷柏涛, 陈伦裕. 褐稻虱发声机理模型和雌虫鸣声的人工模拟 [J]. 中国水稻科学, 1991, 5(1):29−36. DOI: 10.3321/j.issn:1001-7216.1991.01.006 ZHANG Z T, YIN B T, CHEN L Y. The model of signal production and the simulation of female signals in rice brown planthopper, Nilaparvata lugens (Stål) (Homootera: Delphacidae) [J]. Chinese Journal of Rice Science, 1991, 5(1): 29−36.(in Chinese) DOI: 10.3321/j.issn:1001-7216.1991.01.006
[21] 施龙清, 林祁, 刘端华, 等. 水稻褐飞虱移动行为规律初探 [J]. 福建农业学报, 2019, 34(8):952−957. SHI L Q, LIN Q, LIU D H, et al. Moving behavior of adult brown planthoppers, Nilaparvata lugens [J]. Fujian Journal of Agricultural Sciences, 2019, 34(8): 952−957.(in Chinese)
[22] WURTMAN R J, AXELROD J, CHU E W. Effects of melatonin, a pineal substance: Effect on the rat ovary [J]. Science, 1963, 141: 277−278. DOI: 10.1126/science.141.3577.277
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载: