High-Throughput Sequencing on Fungal Diversity in Potato Rhizosphere Soil Infested by Root-knot Nematodes
-
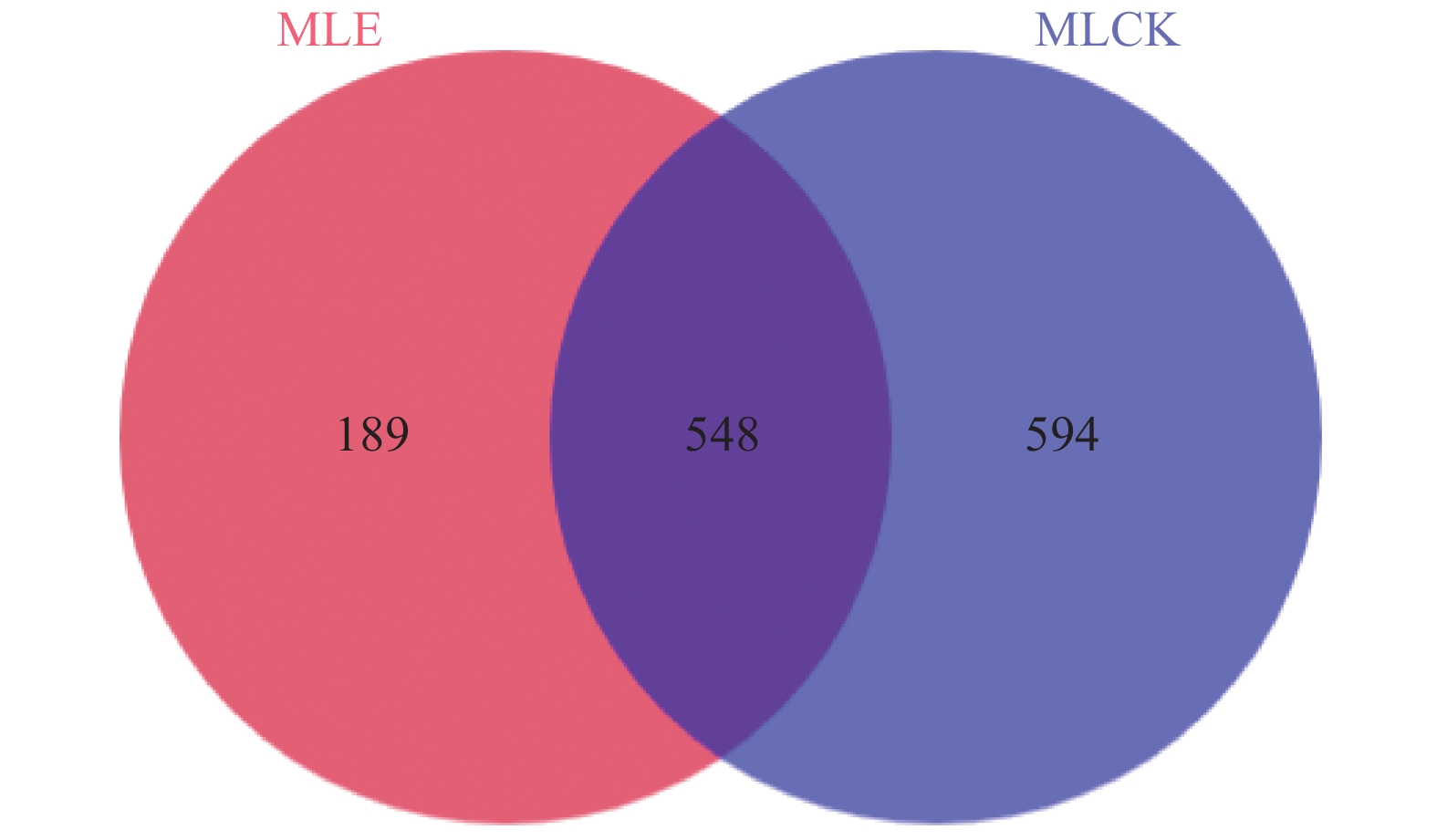
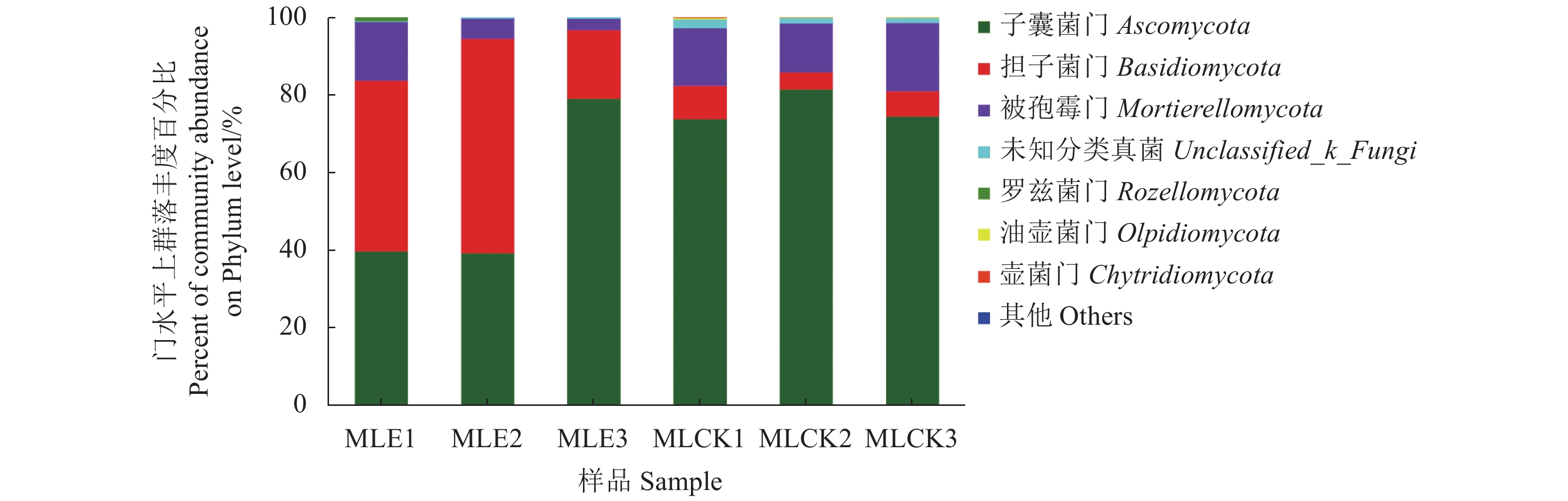
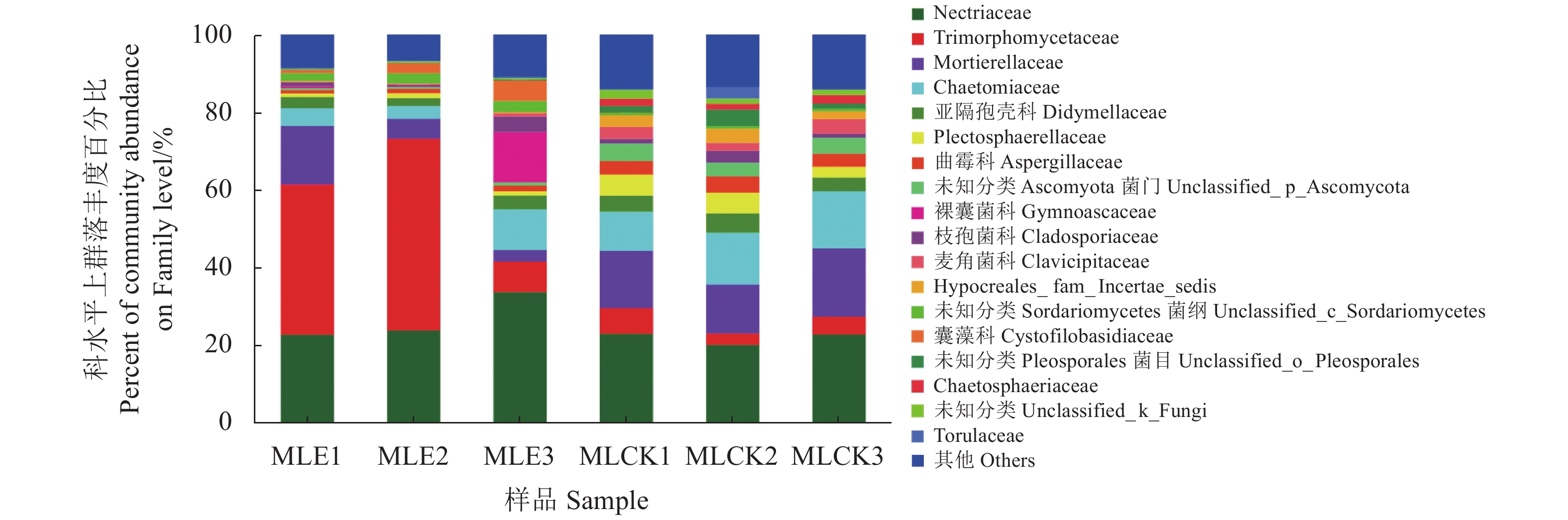
摘要:目的 分析根结线虫对马铃薯根际土壤真菌群落多样性的影响。方法 通过高通量测序技术、土壤性质测定及生物信息学技术分析感染根结线虫马铃薯和健康马铃薯根际土壤真菌群落多样性差异。结果 从6个土壤样品中共获得3界12门34纲77目171科332属526种的土壤真菌。对物种多样性指数分析后,发现感染根结线虫马铃薯病株与健康马铃薯植株的根际土壤真菌群落多样性和土壤性质均存在显著性差异。对6个样品进行物种组成分析后,在门水平中,感病植株根际土壤真菌Basidiomycota丰度较健康植株根际土壤真菌丰度高,Ascomycota丰度低于健康植株根际土壤;在科水平中,病株根际土壤丰度较高的菌群有Nectriaceae和Trimorphomycetaceae;在属水平中,健康植株根际土壤丰度较高的菌群为镰刀菌属Fusarium、被孢霉属Mortierella和未知分类毛壳菌科属unclassified_f_Chaetomiaceae。结论 感染根结线虫的马铃薯与健康马铃薯根际土壤真菌群落丰度在门、科和属水平上均存在差异,为进一步研究马铃薯根结线虫的发生和防治提供了新的思路。Abstract:Objective Diversity of the rhizosphere soil fungal community in potato field as affected by the presence of root-knot nematodes was investigated using high-throughput sequencing technique.Methods The properties and bioinformatics of rhizosphere soils surrounding healthy and infested potato plants were compared to analyze the possible effects of differential fungal community on the occurrence and control of the disease.Results There were 526 fungi species belonging to 332 genera, 171 families, 77 orders, 34 classes, 12 phyla, and 3 kingdoms identified from the 6 field specimens. Significantly differentiations on the fungal community diversity and properties of the rhizosphere soils on the healthy and infested potato lots were found. In the infected areas, Basidiomycota was the more abundant phylum, but Ascomycota less, than on the healthy lots. At family level, Nectriaceae and Trimorphomycetaceae were more abundantly found in the soil of diseased plants, while at genus level, Fusarium, Mortierella, and some unclassified Chaetomiaceae more richly in the soil of healthy plants.Conclusion Significant differences in the abundance of fungi in the rhizosphere soils of potatoes infested by the root-knot nematodes and the healthy counterparts were found at phylum, family, and genus levels. The information would aid further study on the occurrence and control of potato root-knot nematodes.
-
0. 引言
【研究意义】氮素是植物生长发育所必需的生命元素[1],对促进果树的生长、提高果树产量及果实品质具有重要的作用[2],过量施氮不仅会导致氮素利用率偏低,而且造成了土壤质量、果实品质的下降和水污染等一系列问题。因此,研究如何减少氮肥的施用,促进氮素科学高效利用,对以节本增效、减少环境污染为主要目标的农业绿色可持续发展具有重要意义[3]。【前人研究进展】前人研究发现,钼在植物的氮代谢过程中扮演着非常重要的角色,钼可以参与到硝酸盐还原、固氮作用以及含氮化合物的运输等过程中,适量施用钼肥可以显著促进作物对氮素的吸收[4,5]。缺钼会导致植物不能有效利用和转化养分,造成植物体内营养分布失衡[6]。钼是硝酸还原酶的重要组分之一,合理供钼可通过组成钼酶或辅助因子催化氧化还原反应,提高硝酸还原酶的活性,加速NO3−的还原,促进蛋白质合成,调控植物的碳、氮等生理代谢过程[7]。 适当施钼能够促进草莓幼苗对氮素的吸收,显著提高氮素利用率[8];施钼能显著提高玉米植株的钼含量,适宜的钼降低了植株的NO3−-N浓度而增加了NH4+-N浓度,因此植株体内钼的稳态平衡可以提高植株对氮的吸收利用[9]。将氮肥和钼肥配施可以提高氨基酸、蛋白质的含量,可以提高硝酸还原酶的活性,可以降低硝态氮含量,提高苗蒜产量[10]。同时施钼还能明显提高烟叶钾含量和改善烟叶油分,提高烟叶品质[11]。适量钼供应可以明显提高小白菜[12]、甜瓜[13]、云南烤烟[14]、花生[15]等作物的产量。当前,苹果产业氮素投入过多,而对钼的重视程度不足,钼的不合理施用可能是导致氮素利用率过低的原因之一。【本研究切入点】综合前人研究表明,施钼可以促进作物对氮素的吸收,但是有关钼对苹果氮吸收利用的研究相对较少。【拟解决的关键问题】本文以一年生苹果砧木新疆野苹果为试材,运用15N同位素示踪技术,研究了5个不同钼水平对苹果砧木生长及氮素吸收利用的影响,以期为生产上钼肥的合理施用、促进氮素高效利用提供理论依据。
1. 材料与方法
1.1 试材与设计
试验于2018年3–8月在山东农业大学园艺试验站完成。新疆野苹果(Malus sieversii)具有耐盐碱、抗旱、抗病虫、抗寒、耐瘠薄等特性[16],在我国西北地区作为苹果生产的砧木被广泛利用[17],笔者以一年生新疆野苹果为试验材料,于2018年3月初,将层积好的种子播在穴盘中,正常的温度湿度管理,当幼苗长出4~5片真叶时,将其移栽到装满石英砂的花盆中,石英砂在用前将其洗净晾干。移栽后缓苗1周,期间浇灌去离子水,缓苗后先用1/2浓度Hoagland营养液浇灌1周,随后每5 d浇1次Hoagland营养液,每次每盆500 ml。
试验设0.00(CK)、0.25(M1)、0.50(M2)、1.50(M3)、3.00(M4)μmol·L−1 H2MoO4·H2O,其他营养元素与正常Hoagland营养液相同,每个处理重复10盆,每盆4株幼苗,本试验在避雨棚内进行。待幼苗长至6~7片真叶时(5月20日),开始浇灌不同钼浓度的营养液。到试验结束时共浇灌营养液20次,每次500 ml。每次浇灌营养液前用去离子水冲洗3~5次,将上次残留营养液冲洗干净,再浇灌新的营养液。其中每隔1次向每盆加入0.01 g Ca(15NO3)2(共施入0.10 g,分10次加入,丰度为10.20%)用于15N标记。于2018年8月30日测定根系活力、根系形态和氮素的吸收利用、分配等指标。
1.2 测定项目
1.2.1 植株根系形态的测定
每个处理选取3株幼苗,根部经去离子水清洗后,平铺于透明塑料板上,在水中展开,用专业版WinRHIZO(2007版)根系分析软件进行根总表面积、根尖数、根系总长度扫描分析。
1.2.2 根系活力和叶片硝酸还原酶活性的测定
每个处理选取长势基本一致、无病虫害的3株幼苗,采用氯化三苯基四氮唑(TTC)法测定根系活力,用四氮唑的还原强度(μg·h−1·g−1)表示根系活力(鲜根)。硝酸还原酶(NR)活性参照李合生[18]的方法测定。
1.2.3 植株全氮和15N丰度的测量
每个处理选取3株幼苗,分为根、茎、叶3部分,然后放入烘箱于105 ℃杀青30 min,随后80 ℃烘干至恒重,用不锈钢电磨粉碎后过0.25 mm筛,测定器官全氮量和各器官的15N丰度。样品全氮用凯氏定氮法测定,15N丰度在中国农业科学院原子能研究所用MAT-251质谱仪测定。
1.3 数据处理
Ndff =(植物样品中15N丰度−自然丰度)/(肥料中15N丰度−自然丰度)×100%
器官15N吸收量 = Ndff×器官全氮量。
氮肥利用率=(Ndff×器官全氮量)/施肥量×100%
用Microsoft Excel 2007进行数据处理,用DPS数据处理系统进行单因素方差分析,LSR法进行差异显著性检验。
2. 结果与分析
2.1 不同供钼水平下新疆野苹果的生物量
由表1可以看出,M1、M2、M3和M4处理的各器官干重都显著高于无钼对照(CK)。在0~0.50 μmol·L−1 钼水平时,新疆野苹果根、茎、叶生物量均随着钼浓度增加显著增大,至M2(0.50 μmol·L−1)处理时达到最大,之后随着钼浓度的进一步增加,各器官生物量显著降低,M4处理的根、茎、叶和总生物量仅为M2处理的73.96 %、63.08%、79.17%和73.15%。说明适量施钼促进了幼苗的生长,而钼浓度的过高或过低均抑制了幼苗生长。
表 1 不同钼水平下的植株生物量Table 1. Biomass of M. hupehensis seedlings under Mo treatments处理
Treatment根干重
Dry weight of
root/g茎干重
Dry weight of
stem/g叶干重
Dry weight of
leaf /g总干重
Total dry
weight/gCK 0.62±0.03 e 0.39±0.02 d 0.63±0.02 e 1.63±0.03 e M1 0.82±0.01 b 0.48±0.04 c 0.71±0.03 d 2.01±0.06 c M2 0.96±0.03 a 0.65±0.01 a 0.96±0.03 a 2.57±0.06 a M3 0.76±0.02 c 0.56±0.01 b 0.82±0.01 b 2.14±0.03 b M4 0.71±0.02 d 0.41±0.02 d 0.76±0.01 c 1.88±0.04 d 同一列小写字母表示差异达0.05显著水平。表2~4同。 Data followed by lowercase letters on same column indicate significant difference at P<0.05. Same for Table 2–4. 2.2 不同供钼水平下新疆野苹果的根系形态指标和根系活力
供钼处理显著影响了新疆野苹果幼苗根系总长度、根系总面积、根尖个数及根系活力(表2)。随着供钼水平的提高,新疆野苹果幼苗根系长度、根系总面积、根尖数和根系活力均呈先升高后降低的趋势。与M2处理相比,当供钼水平增加到M3和M4水平时,新疆野苹果幼苗根系长度、根系总面积、根尖数和根系活力显著下降,其中M4处理的根系活力仅为M2处理的64.36%,但与CK处理间无显著差异,说明0.5 μmol·L−1钼酸处理能显著促进幼苗根系生长,提高其根系活力。
表 2 不同供钼水平下新疆野苹果的根系形态指标Table 2. Morphological indices of M. sieversii roots under Mo treatments处理
Treatment根系长度
Root Length/cm根系总表面积
Total root surface area/cm2根尖数
Number of root tips/个根系活力
Root activity/(μg·g−1·h−1)CK 269.52±13.95 e 105.64±11.75 d 2694.8±80.19 d 75.14±1.76 c M1 447.56±29.56 b 119.97±8.27 c 3011.6±101.59 c 85.14±2.09 b M2 576.17±14.06 a 188.09±7.29 a 4842.6±149.48 a 110.93±1.72 a M3 399.09±17.68 c 143.38±6.36 b 3424.2±152.93 b 83.77±0.60 b M4 340.76±18.24 d 128.65±2.21 c 3173.0±121.88 c 71.39±3.02 c 2.3 不同钼水平下植株各器官的Ndff值和叶片NR活性
Ndff是指植株器官从肥料15N中吸收分配到的15N量对该器官全氮量的贡献率,它反映了植株器官对肥料15N的吸收征调能力[19]。
由表3可以看出,不同钼水平下新疆野苹果幼苗各种器官的Ndff值差异显著。M2处理叶片、茎、根的Ndff值均最高,分别为CK的1.25倍、1.18倍和1.19倍,为M4处理的1.18倍、1.12倍和1.15倍。表明适量施钼可以促进苹果幼苗各器官对氮的吸收征调能力。
表 3 不同钼水平下植株各器官的Ndff值和叶片NR活性Table 3. Ndff of organs and NR activity of leaves under Mo treatments处理
TreatmentNdff/% NR活性
NR activity/
(μg·g−1·h−1)叶片
Leaves茎
Stems根
RootsCK 0.73±0.02 d 1.12±0.03 d 1.09±0.02 c 10.44±0.39 d M1 0.81±0.03 b 1.19±0.01 c 1.18±0.02 b 16.78±1.25 bc M2 0.91±0.02 a 1.33±0.03 a 1.30±0.07 a 22.52±2.55 a M3 0.78±0.02 bc 1.29±0.01 b 1.19±0.03 b 17.25±1.26 b M4 0.77±0.02 c 1.19±0.01 c 1.13±0.01 bc 14.29±1.05 c 与对照相比,所有供钼处理均显著提高了叶片NR活性(表3)。随着供钼水平的提高,叶片NR活性呈现先升高后降低的趋势,M2处理最高,其次是M3处理,M4处理最低。因此,幼苗叶片硝酸还原酶活性受到0.50 μmol·L−1钼酸处理的显著促进,受到低钼水平的显著抑制。
2.4 不同供钼水平的植株15N利用率
不同供钼水平之间氮肥利用率差异显著,M2处理最高,M3和M1处理,CK处理最低(图1)。与CK处理相比,M2处理氮肥利用率提高了123%,说明适量供钼可显著提高幼苗的15N利用率。
2.5 不同钼水平下植株的全氮量和15N吸收总量
表4显示,随着供钼水平的提高,新疆野苹果幼苗的全氮量和15N吸收总量呈先上升后下降的趋势。与对照相比,M2处理的全氮量增加的比例最大,M3和M1处理,M4处理最小;植株15N吸收总量也表现出同样的趋势。这表明适量供钼可提高植株全氮量的累积和对15N的吸收。
表 4 不同钼水平下植株的全氮量和15N吸收总量Table 4. Total N and 15N absorption of M. hupehensis seedlings under Mo treatments处理 Treatment 全氮量 Total N/mg 15N吸收总量 15N absorption/mg CK 29.53±0.34 e 0.27±0.01 e M1 37.44±0.76 c 0.39±0.01 c M2 53.56±0.86 a 0.62±0.02 a M3 41.74±0.47 b 0.43±0.01 b M4 35.44±0.96 d 0.35±0.01 d 3. 讨论与结论
本研究结果表明,当钼酸在0.50 μmol·L−1水平处理下根系活力处于最高水平,相对于CK处理能够显著促进根系的生长和根系活力的提高,与前人研究[20]结果一致;硝酸盐作为苹果氮素的重要来源,通过硝酸还原酶和亚硝酸还原酶的共同作用转变为铵,进入植物氮代谢途径,合成氨基酸和核苷酸等成分[21]。钼作为植物体内硝酸还原酶的重要组分,影响着植株体内硝态氮的转化。相关研究证明,钼和氮相互促进,缺钼会使硝态氮向铵态氮转化受阻,导致硝态氮积累而使植物出现缺氮症状,施钼可促进植物体内氮素营养吸收转化[22]。本研究中,与对照相比,各供钼处理的叶片中硝酸还原酶活性均显著增加,随着供钼水平的增高,硝酸还原酶活性呈现先提高后下降的趋势。随着叶片硝酸还原酶活性的提高,大量的硝态氮被还原,细胞质中的硝态氮浓度下降,与此同时硝酸还原酶活性相应下降,这可能与氮素的转化与运输趋于动态平衡有关。
前人研究发现,冬小麦低温期缺钼会产生黄化死苗现象,导致其产量严重降低,而施用钼肥则能促进冬小麦壮苗、壮蘖,并提高产量[23]。施钼肥明显降低大白菜硝酸盐的含量,促进氮素的吸收利用[24]。氮同位素示踪技术能深入研究施入氮肥的去向及在作物体内的分配利用,为作物氮肥运筹管理提供理论依据[25]。本试验利用15N示踪技术发现,0.50 μmol·L−1钼酸处理时新疆野苹果幼苗全氮量和15N吸收总量显著高于其他处理,这与适宜钼含量供应可以有效地促进小麦吸收更多的氮素结果一致[26]。本试验结果表明,缺钼处理和钼过量处理条件下,植株的全氮量和15N利用率均会显著下降,这可能是因为缺钼处理和钼过量处理均会抑制根系的生长和硝酸还原酶的活性,从而抑制了植株对氮素的吸收,降低了15N利用率。
刘利等[27]研究了平邑甜茶幼苗在不同含量钼酸处理下的15N吸收利用情况,其15N利用率最高为13.97%,略低于本试验的最适宜处理下的15N利用率,这可能是两方面的原因导致:一是所用试材不同,不同的苹果砧木幼苗对生产中不同的环境响应不同,平邑甜茶和新疆野苹果都是生产中较为常用的砧木,但平邑甜茶的根系对环境变化非常敏感[28],而新疆野苹果的抗逆性较强,在各种环境中均能表现出不错的营养生长能力[29-31],结合本文对根系形态指标的测定分析,因此新疆野苹果对氮素的吸收相对更强;另一方面是培养环境不同,刘利等[27]使用水培试验的方式,而本文采用砂培环境。通常苹果砧木幼苗的试验条件有3个,分别是水培、土培、砂培。水培的试验环境更为稳定,可以更精确的研究适宜的养分浓度,但是不适宜模拟土壤的物理环境。土壤的物理结构是影响植物根系乃至整株生长的重要原因之一,土培的环境比较接近生产,但是土壤养分含量复杂,很难调节到适宜的水平去进行试验,尤其是对于微量元素的研究更为困难,因此本文中设置的砂培环境,既有利于研究适宜的养分浓度,又可以模拟土壤物理条件,接近于生产环境,细砂模拟的土壤物理结构会刺激植物根系的生长,进一步增强了对氮素的吸收。
综上所述,0.50 μmol·L−1的钼酸处理,一方面有利于植株生长和根系发生,增强对氮素的吸收;另一方面提高了硝酸还原酶活性,通过推进氮还原的进程促进了氮素的利用。因此,在此浓度钼酸处理下幼苗15N利用率最高。
-
表 1 不同样品土壤性质
Table 1 Properties of soil specimens
样品编号
Sample IDpH 有机质
OM/(g·kg−1)速效磷
AP/(mg·kg−1)速效钾
AK/(mg·kg−1)速效氮
AN/(mg·kg−1)MLE1 4.72±0.05 b 1.33±0.20 b 277.37±0.78 c 423.51±0.32 bc 57.39±0.28 de MLE2 4.62±0.03 b 1.27±0.14 b 265.43±0.63 d 420.19±0.19 c 56.12±0.25 e MLE3 4.80±0.02 b 1.28±0.30 b 278.54±0.24 c 425.85±0.18 ab 60.44±0.19 cd MLCK1 5.13±0.13 a 2.33±0.33 a 286.83±0.56 b 426.92±0.45 ab 66.41±0.78 a MLCK2 5.30±0.32 a 2.82±0.18 a 293.35±0.36 a 427.32±0.67 ab 64.00±0.57 ab MLCK3 5.22±0.46 a 2.74±0.36 a 279.72±0.67 c 428.28±0.46 a 61.23±0.42 bc 注:同列数据后不同小写字母表示差异显著(P<0.05),表2同。
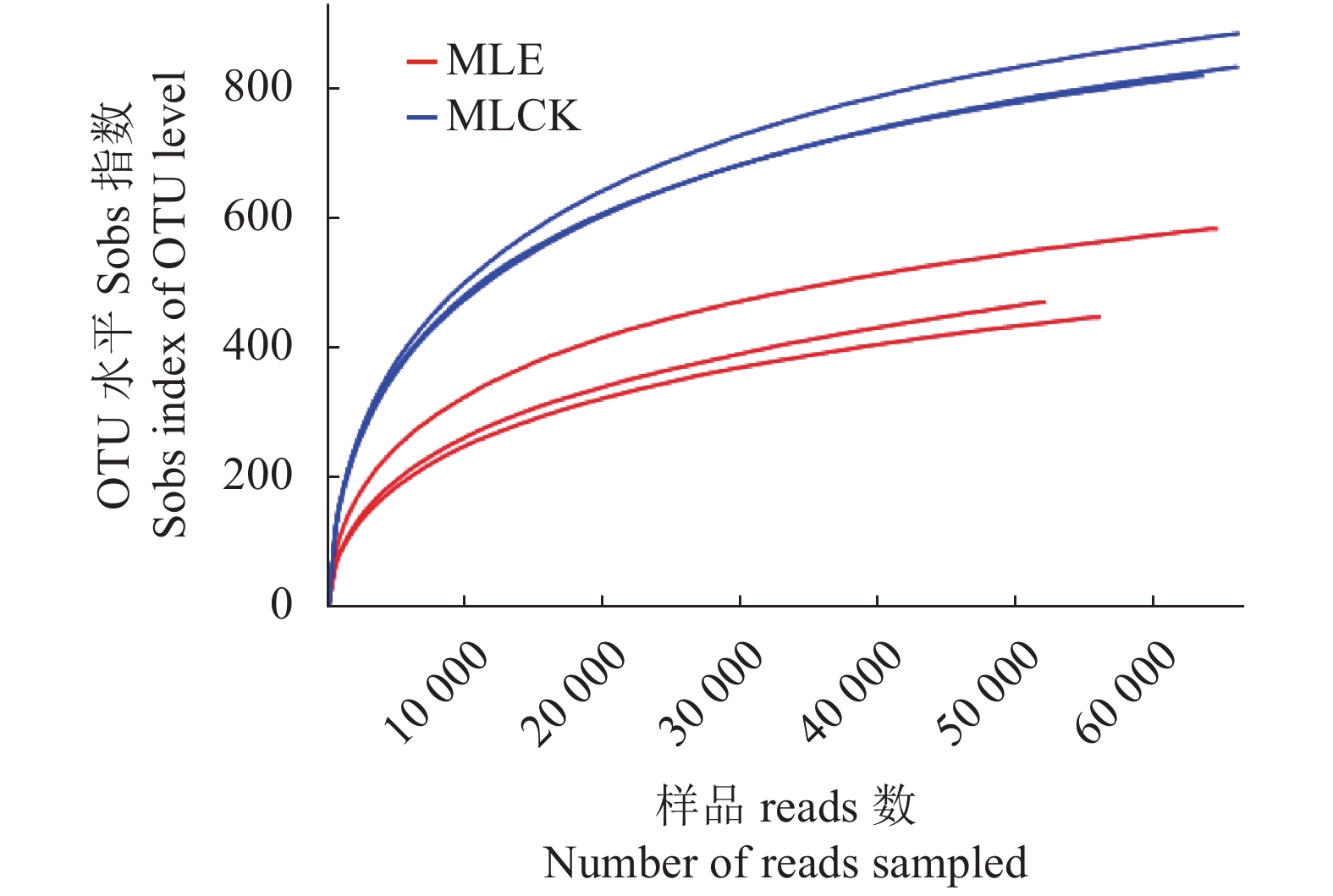
Note: Different uppercase letters in the same column represented significant difference(P<0.05), The same as Table 2.表 2 不同样品土壤真菌群落的多样性指数
Table 2 Diversity indices on fungal communities in soil specimens
样品编号
Sample ID原始序列
Original sequences有效序列
Effective sequences有效序列率
Effective data ratio多样性指数
Diversity index丰富度指数
Richness index覆盖率
CoverageShannon-Wiener指数
Shannon-Wiener
indexSimpson指数
Simpson
indexAce指数
Ace
indexChao指数
Chao
indexMLE1 52315 51714 0.989 2.83±0.10 c 0.18±0.04 b 744.88±0.42 d 677.05±0.78 d 0.997 MLE2 56393 55653 0.987 2.59±0.14 c 0.26±0.03 a 574.26±0.25 e 586.08±0.36 e 0.997 MLE3 65004 64006 0.985 3.64±0.32 b 0.06±0.01 c 731.93±0.12 d 763.33±0.25 c 0.997 MLCK1 64811 63193 0.975 4.13±0.05 a 0.06±0.01 c 960.73±0.36 c 975.25±0.65 b 0.997 MLCK2 68180 65857 0.966 4.09±0.23 a 0.05±0.01 c 977.19±0.83 b 978.84±0.45 b 0.997 MLCK3 68295 66066 0.967 4.04±0.14 a 0.06±0.02 c 1013.80±0.46 a 1024.59±0.88 a 0.997 注:数据后不同小写字母表示处理间差异达显著水平
Note:Data with different lowercase letters indicated significant difference (P<0.05). -
[1] MARKS R, BRODIE B. Potato cyst nematodes, biology, distribution and control [J]. Potato Cyst Nematodes Biology Distribution and Control, 1998, 5(2): 79−86.
[2] 徐春玲, 陈淳, 周春娜, 等. 马铃薯根际3种植物线虫种类记述 [J]. 华南农业大学学报, 2012, 33(2):167−170. DOI: 10.3969/j.issn.1001-411X.2012.02.010 XU C L, CHEN C, ZHOU C N, et al. Description of Three New Recorded Species of Plant Parasitic Nematodes Extracted from Rhizosphere of Potato in China [J]. Journal of South China Agricultural University, 2012, 33(2): 167−170.(in Chinese) DOI: 10.3969/j.issn.1001-411X.2012.02.010
[3] OKA Y, KOLTAI H, BAR-EYAL M, et al. New strategies for the control of plant-parasitic Nematodes [J]. Pest Management Science, 2000, 56(11): 983−988. DOI: 10.1002/1526-4998(200011)56:11<983::AID-PS233>3.0.CO;2-X
[4] DACKMAN C, NORDBRING-HERTZ B. Fungal parasites of the cereal cyst nematode Heterodera avenae in southern Sweden [J]. Journal of Nematology, 1985, 17(1): 50−55.
[5] KHAN T A, SAXENA S K. Effect of root-dip treatment with culture filtrates of soil fungi on multiplication of Meloidogyne javanica and yield of tomato [J]. Test of Agrochemical and Cultivars, 1997(18): 50−51.
[6] TOJU H, TANABE A S, SATO H. Network hubs in root-associated fungal metacommunities [J]. Microbiome, 2018, 6(1): 116. DOI: 10.1186/s40168-018-0497-1
[7] 杨树军, 雷丽萍, 祝明亮, 等. 烟草根结线虫生物防治方法应用研究 [J]. 西南农业学报, 2004, 17(S1):151−154. YANG S J, LEI L P, ZHU M L, et al. Screening of the parasitical fungi of root knot nematode in tobacco [J]. Southwestern China Journal of Agricultural Sciences, 2004, 17(S1): 151−154.(in Chinese)
[8] MENDES R, KRUIJT M, DE BRUIJN I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria [J]. Science, 2011, 332(6033): 1097−1100. DOI: 10.1126/science.1203980
[9] UROZ S, BUEEÉ M, MURAT C, et al. Pyrosequencing reveals a contrasted bacterial diversity between oak rhizosphere and surrounding soil [J]. Env Microbiol Rep, 2010, 2(2): 281−288. DOI: 10.1111/j.1758-2229.2009.00117.x
[10] WEINERT N, PICENO Y, DING G C, et al. PhyloChip hybridization uncovered an enormous bacterial diversity in the rhizosphere of different potato cultivars: Many common and few cultivar-dependent taxa [J]. FEMS Microbiology Ecology, 2011, 75(3): 497−506. DOI: 10.1111/j.1574-6941.2010.01025.x
[11] PIRES A C C, CLEARY D F R, ALMEIDA A, et al. Denaturing gradient gel electrophoresis and barcoded pyrosequencing reveal unprecedented archaeal diversity in mangrove sediment and rhizosphere samples [J]. Applied and Environmental Microbiology, 2012, 78(16): 5520−5528. DOI: 10.1128/AEM.00386-12
[12] BULGARELLI D, ROTT M, SCHLAEPPI K, et al. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota [J]. Nature, 2012, 488(7409): 91−95. DOI: 10.1038/nature11336
[13] 楼骏, 柳勇, 李延, 等. 高通量测序技术在土壤微生物多样性研究中的研究进展 [J]. 中国农学通报, 2014, 30(15):256−260. DOI: 10.11924/j.issn.1000-6850.2013-2513 LOU J, LIU Y, LI Y, et al. Review of High-throughput sequencing techniques in studies of soil microbial diversity [J]. Chinese Agricultural Science Bulletin, 2014, 30(15): 256−260.(in Chinese) DOI: 10.11924/j.issn.1000-6850.2013-2513
[14] 董艳辉, 于宇凤, 温鑫, 等. 基于高通量测序的藜麦连作根际土壤微生物多样性研究 [J]. 华北农学报, 2019, 34(2):205−211. DOI: 10.7668/hbnxb.201751218 DONG Y H, YU Y F, WEN X, et al. Studies on diversity of rhizosphere microorganism in quinoa continuous cropping Soil by High Throughput Sequencing [J]. Acta Agriculture Boreali-Sinica, 2019, 34(2): 205−211.(in Chinese) DOI: 10.7668/hbnxb.201751218
[15] 张骏达, 李素艳, 孙向阳, 等. 基于高通量测序技术的不同年代公园绿地土壤细菌多样性 [J]. 微生物学通报, 2019, 46(1):65−74. ZHANG J D, LI S Y, SUN X Y, et al. Analysis of soil bacterial diversity in urban parks with different ages by high throughput sequencing [J]. Microbiology China, 2019, 46(1): 65−74.(in Chinese)
[16] 汪娅婷, 付丽娜, 姬广海, 等. 基于高通量测序技术研究云南玉米根际微生物群落多样性 [J]. 江西农业大学学报, 2019, 41(3):491−500. WANG Y T, FU L N, JI G H, et al. A study of the microbial community diversity of corn rhizosphere in Yunnan province based on High-Throughput Sequencing Technique [J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(3): 491−500.(in Chinese)
[17] 王艳云, 郭笃发. 不同植物类型下土壤真菌群落研究 [J]. 基因组学与应用生物学, 2017, 36(2):696−701. WANG Y Y, GUO D F. Study on Soil Fungal Community under Different Plant Types [J]. Genomics and Applied Biology, 2017, 36(2): 696−701.(in Chinese)
[18] ADAMS R I, MILETTO M, TAYLOR J W, et al. Dispersal in microbes: fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances [J]. The ISME Journal, 2013, 7(7): 1262−1273. DOI: 10.1038/ismej.2013.28
[19] LAURENT P, VOIBLET C, TAGU D, et al. A novel class of ectomycorrhiza-regulated cell wall polpeptides in Pisolithus tinctorius [J]. Mol Plant Microbe, 1999, 12(10): 862−871. DOI: 10.1094/MPMI.1999.12.10.862
[20] HELGASON T, FITTER A H. Natural selection and the evolutionary ecology of the arbuscular mycorrhizal fungi (Phylum Glomeromycota) [J]. Journal of Experimental Botany, 2009, 60(9): 2465−2480. DOI: 10.1093/jxb/erp144
[21] NONAKA K, KANETA T, ŌMURA S, et al. Mariannaea macrochlamydospora, a new hyphomycete (Nectriaceae) from soil in the Bonin Islands, Japan [J]. Mycoscience, 2015, 56(1): 29−33. DOI: 10.1016/j.myc.2014.02.001
-
期刊类型引用(1)
1. 张明辉,时曼丽. 钼与氮形态对不同氮效率冬小麦氮吸收、代谢及根系发育的影响. 江苏农业科学. 2023(04): 114-121 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: