Effects of Magnesium on Chlorophyll Fluorescence and Metabolism of Citrullus lanatus
-
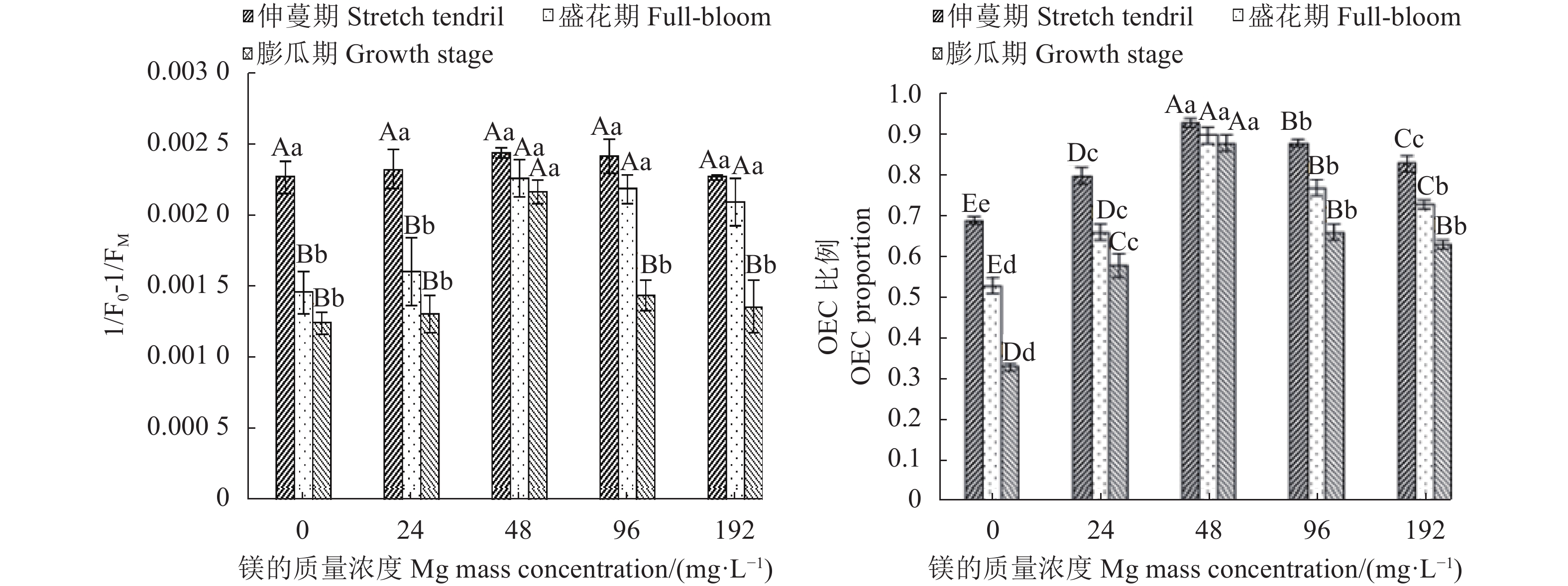
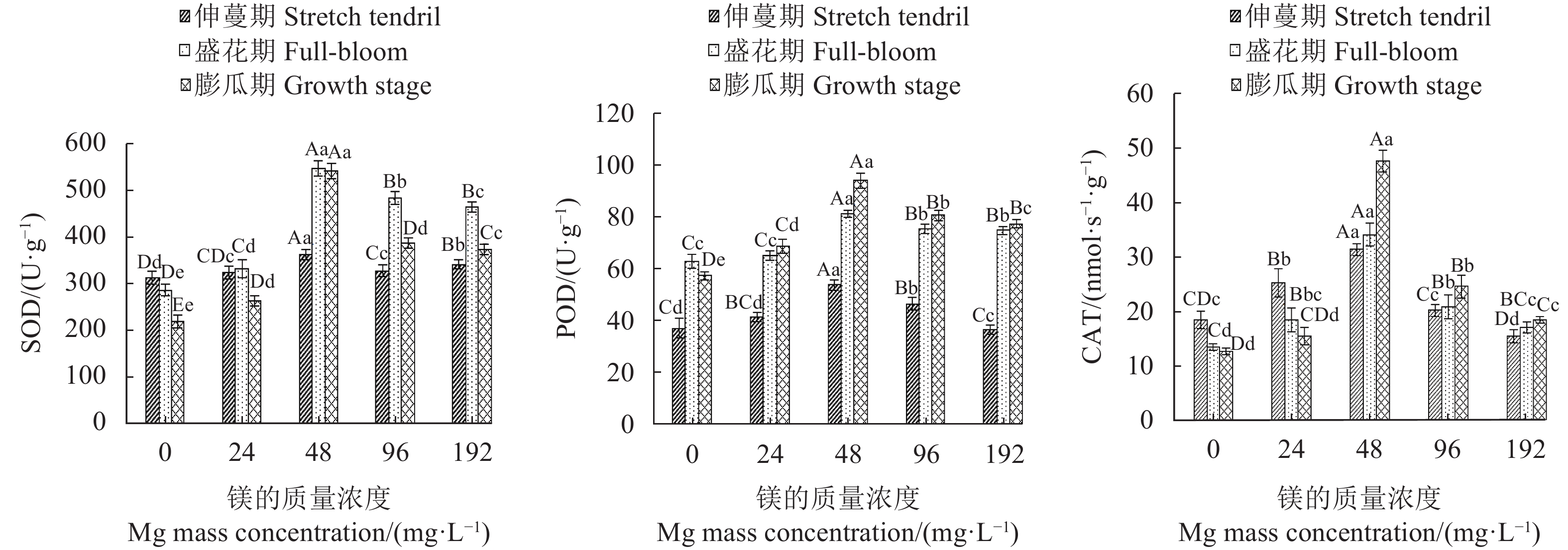
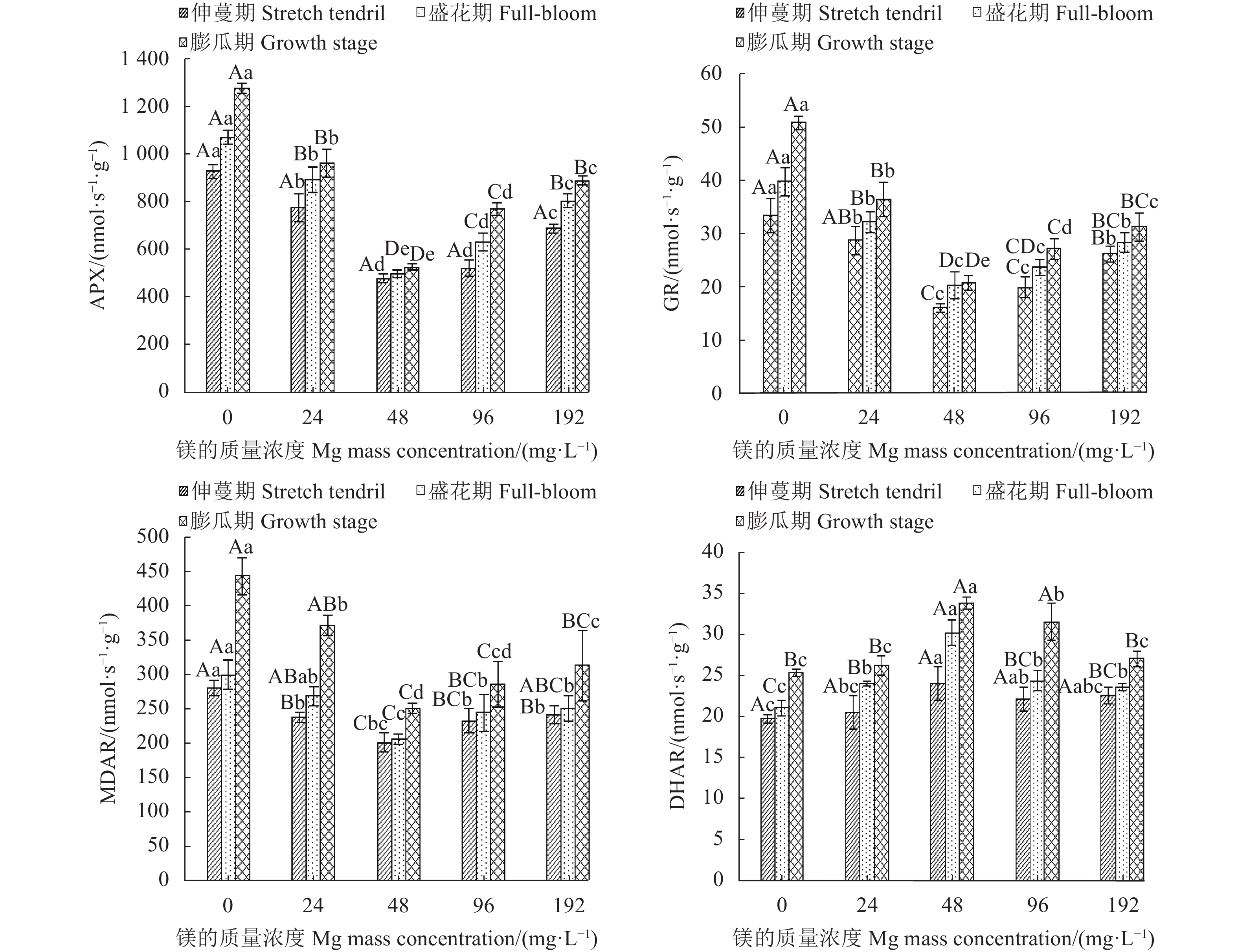
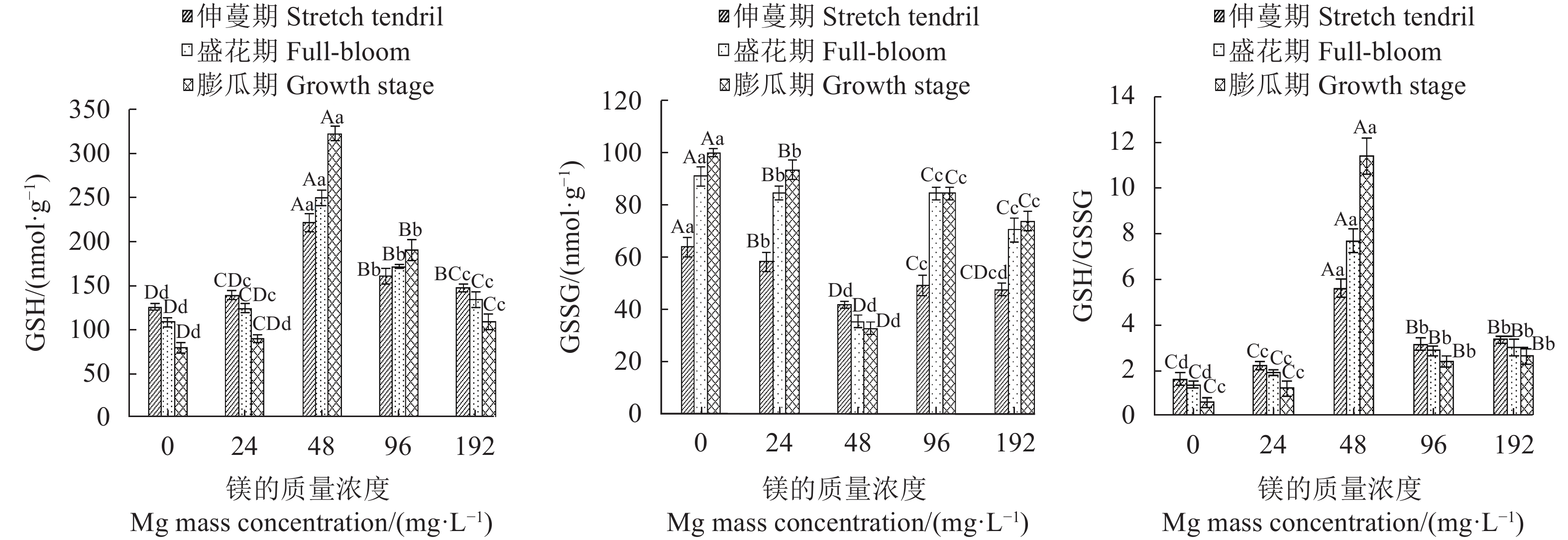
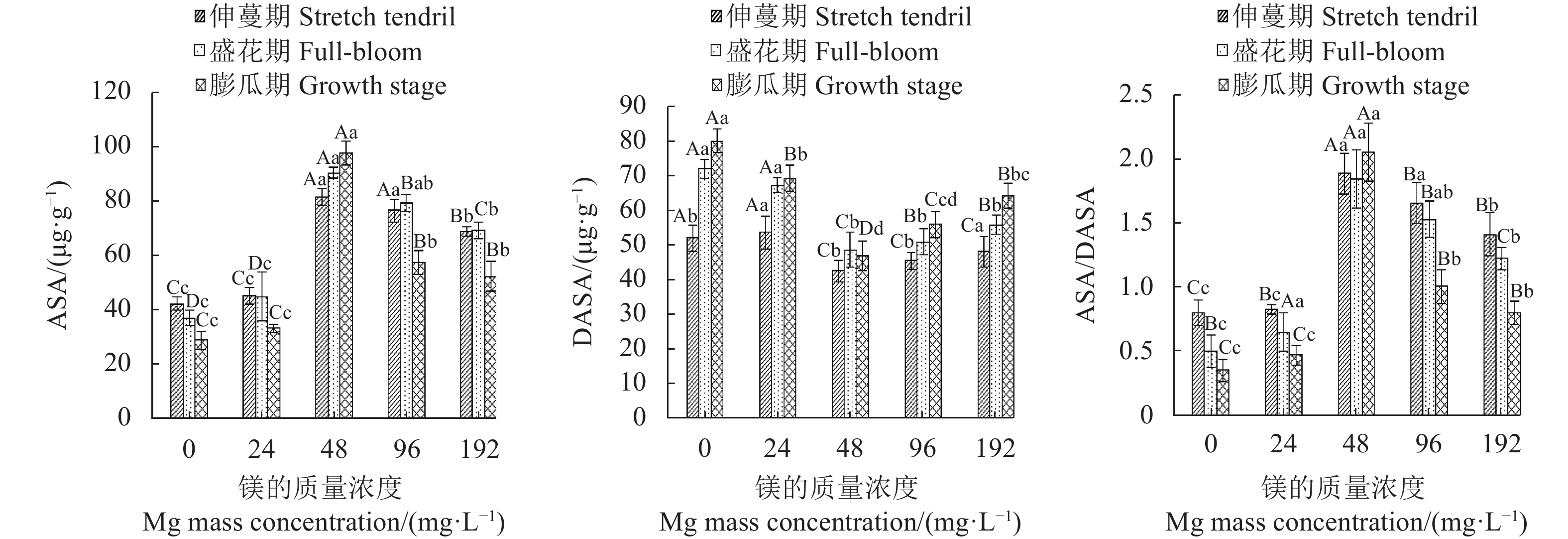
摘要:目的 探讨镁营养对西瓜(Citrullus lanatus)生长发育和生理代谢的影响,明确西瓜生长的适宜镁浓度范围。方法 采用砂培法,对西瓜进行5个施镁质量浓度(0 、24 、48、96 和192 mg·L−1)处理,并测定西瓜在不同施镁浓度下的生长特性(叶片和根系形态、生物量积累)、果实品质(维生素C、可溶性固形物、可溶性蛋白和可溶性糖含量)、叶绿素荧光特性和生理响应(渗透调节、膜伤害和抗氧化酶系统)。结果 用24 ~96 mg·L−1的镁素可以降低西瓜叶片膜伤害,提高光系统Ⅱ(PSII)活性,增加叶片抗氧化物质谷胱甘肽(glutathione, GSH)和还原型抗坏血酸(reduced ascorbic acid, AsA)含量,增强叶片抗氧化酶活性,包括过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, DHAR),降低叶片丙二醛(malondialdehyde, MDA)和脯氨酸(proline, Pro)含量以及细胞膜透性,促进AsA-GSH循环,增强光合作用,提高生物量积累,增加果实中维生素C、可溶性固形物、可溶性蛋白和可溶性糖含量。其中,48 mg·L−1镁处理对西瓜的生长发育增效最明显,而缺镁(0 mg·L−1)和镁过量(192 mg·L−1)胁迫下,西瓜叶片产生膜脂过氧化伤害,根系变短,叶绿素荧光参数放氧复合体(OEC)、电子传递量子产额(φEo) 、受体库容量(Sm)和单位面积反应中心数量(RC/CSo)降低,单位反应中心光能的吸收(ABS/RC)、耗散(DI0/RC) 、捕获(TR0/RC)及QA还原速率(Mo)增加,叶片光合机构完整性被破坏,光合作用减弱,西瓜生长受到明显抑制,其中缺镁影响最严重。结论 缺镁和镁过量处理降低西瓜PSII活性,抑制西瓜生长,而适量增施镁可有效提高西瓜的生理活性,PSII的结构和功能稳定,光合作用强,西瓜生长好,果实品质高,48 mg·L−1为西瓜栽培最适宜施镁质量浓度。Abstract:Objective Effects of magnesium on the growth, development, and metabolism of Citrullus lanatus were studied to determine the appropriate nutrient supply for the melon cultivation.Method At the concentrations of 0, 24, 48, 96, and 192 mg·L−1 on magnesium in sand culture, the growth characteristics (i.e., leaf and root morphology, chlorophyll fluorescence, and biomass accumulation), fruit quality (i.e., vitamin C, soluble solids, soluble protein, and soluble sugar), and physiological responses (i.e., osmoregulation, membrane damage, and antioxidases) of various C. lanatus varieties were compared.Result In the range of 24-96 mg·L−1, the application of magnesium reduced the vulnerability of leaf membrane to damages, increased the contents of antioxidant glutathione (GSH) and ascorbic acid (AsA) as well as the activities of photosystemⅡ (PSII), peroxidase (POD), superoxide dismutase (SOD), catalase (CAT), and monodehydroascorbate reductase (DHAR), while decreased the contents of malondialdehyde (MDA) and proline (Pro), and reduced the cell membrane permeability of the leaves. The addition also promoted the AsA-GSH cycle, photosynthesis, and the biomass accumulations on vitamin C, soluble solids, soluble protein, and soluble sugar. Among the treatments, the 48 mg·L−1 magnesium addition in the culture substrate rendered the most significant improvements on the growth and development of C. lanatus. Whereas, either a deficiency (at 0 mg·L−1) or an excess (e.g., at 192 mg·L−1) on the nutrient ill-affected the membrane lipid peroxidation and shortened the plant roots. Furthermore, the chlorophyll fluorescence declined as indicated by the lower oxygen evolution complex (OEC), quantum yield for electron transport (φEo), and receptor library capacity (Sm), the density of reaction centers (RC/CSo) decreased, the light energy absorption per unit reaction center (ABS/RC) lowered, and the dissipative (DI0/RC), capture (TR0/RC), and QA reduction rate (Mo) increased. Thus, either deprivation or over-supply of magnesium could significantly disrupt the normal photosynthetic function inhibiting the growth of C. lanatus.Conclusion Particularly in deficiency, but also in excess, magnesium in soil could diminish the PSII activity and retard the growth of C. lanatus. Appropriate application of the nutrient, such as at 48 mg·L−1 concentration in soil, could effectively improve the physiological activity, stabilize the structure and function of PSII, strengthen the leaf photosynthesis to result in healthy growth and high quality fruit production of C. lanatus.
-
0. 引言
【研究意义】猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种高度接触性肠道传染病。临床上以水样腹泻、呕吐、脱水、急性肠胃炎等为主要症状[1]。各年龄阶段的猪均可感染,其中以7 日龄以内的哺乳仔猪最易感,发病也最为严重,发病率和死亡率高达100%[2]。PEDV主要通过粪便-口腔途径传播,但经粪便-鼻腔途径的空气传播在疫病的传播中也起着十分重要的作用,当受污染的粪便排入环境时便可导致大规模的流行[3],增加该病的防控难度。随着PEDV变异株的出现,该病迅速蔓延至全球[4-5],给整个养猪业造成严重的经济损失。因此,及时了解猪群的抗体保护水平,可以为PED的有效防控提供重要依据。【前人研究进展】PEDV主要侵害小肠,肠道局部黏膜免疫和特异性SIgA抗体在抗感染过程中发挥重要作用[6]。研究表明初乳或常乳中特异性SIgA抗体是保护仔猪免受PEDV攻击的最有效方式[7]。对怀孕母猪进行免疫接种成为预防和控制猪流行性腹泻、降低哺乳仔猪死亡率的关键[8]。Poonsuk等[9]研究指出IgG抗体和SIgA都有助于保护猪只免受PEDV感染。IgG分子因其分子量大,对胃酸和消化酶的抵抗力较差,而难以穿过肠壁进入肠腔发挥免疫保护功能。而SIgA抗体因其分泌片(Secretory component,SC)的存在,可以抵御胃酸和消化酶的消化作用,进入肠道后黏附在胃肠道黏膜或吸收进入血液,在呼吸道、消化道黏膜等抵御病毒、细菌等病原微生物的入侵[10]。因此,在抗PEDV感染过程,SIgA抗体发挥着重要的作用。【本研究的切入点】虽然已有学者研究了有关PEDV抗体检测的技术[11-13],但针对特异性SIgA抗体检测方法的应用较少,其相关的试剂也相对匮乏,极大阻碍了该方法的使用。SC蛋白是区分IgA和SIgA的重要标志[14]。因此,采用SIgA特异性表位的SC分泌片,能够有效区分IgA和SIgA抗体。【拟解决的关键问题】通过SC重组蛋白多克隆抗体的制备获取相关的SIgA抗体,通过纯化、标记,建立PEDV 特异性SIgA抗体间接ELISA检测方法,为PED流行病学调查及猪群免疫后抗体评估奠定基础。
1. 材料与方法
1.1 试验材料
1.1.1 毒株、试验动物和样本
猪流行性腹泻病毒(ZJ08株)由兆丰华生物科技(福州)有限公司制备、扩繁及保存;猪轮状病毒(Porcine rotavirus ,PoRV)、猪传染性胃肠炎(Porcine transmissible gastroenteritis virus,TGEV )阳性乳汁、PEDV阴性乳汁(N)和PEDV阳性乳汁(P)由本公司保存;试验大兔品种为新西兰大兔(SPF级);样本:来源于福清市某规模化猪场免疫猪流行性腹泻活疫苗和灭活疫苗的母猪群乳汁样本。
1.1.2 主要试剂
BSA购自Biosharp;HRP标记试剂盒购自Biodragon公司;TMB显色液购自博士德生物工程有限公司;ELISA酶标板购自abcam;蔗糖、PEG4000购自国药集团化学试剂有限公司;transetta(DE3)、DH5a购自Takara;6×His标签抗体购自OriGene;快速转膜液购自NCM biotech:BeyoECLMoon购自碧云天生物技术有限公司:Ni-NTA his bind resin购自上海七海复泰生物科技有限公司;HRP标记试剂盒购自Biodragon;ProteinIso®Protein G Resin购自全式金生物技术有限公司。PEDV IgA抗体检测方法(IFA法)由本实验室自建。
1.2 SC蛋白多克隆抗体的制备及纯化
1.2.1 引物设计
根据NCBI公布的猪PIgR序列(登录号:NM_214159.1)设计SC基因片段引物,并送至福州尚亚生物技术有限公司进行合成。引物序列为F:5′-CGCGGAATTCAAGAGTCC CATATTCGGTCCC-3′;R:5′-CGACAAGCTTTTCACCATCCTTCACTGCTCT-3′。
1.2.2 PEDV纯化及浓度测定
将猪流行性腹泻病毒(ZJ08株)10000 r·min−1离心处理1 h,取上清,采用PEG4000过夜沉淀处理,10000 r·min−1离心1 h,弃上清,沉淀用适量的缓冲液重悬。参照文献[15]采用蔗糖密度梯度离心的方法进行精提纯,采用RT-PCR方法和Folin-酚试剂法分别对纯化后的病毒进行PEDV鉴定及蛋白浓度测定。
1.2.3 PET32a-SC原核表达及纯化
取猪肺脏组织的总RNA为模板进行SC基因的扩增。将测序验证正确的PET32a-SC转化至transetta(DE3)中,挑选单菌落,接种至LB液体培养基中(含氨苄青霉素),37 ℃、210 r·min−1培养过夜。次日按照1∶100比例进行扩大培养,待扩增菌液OD600值达0.6时,加入一定剂量的IPTG(终浓度0.2 mmol·L−1)37 ℃继续培养5 h。收集菌液,12000 r·min−1离心20 min,弃去上清液,用预冷的PBS洗涤2次后,超声破碎处理,离心后,沉淀用8 mol·L−1脲素完全溶解,按照Ni-NTA His Bind Resin柱说明书进行重组蛋白纯化与鉴定,并采用微量分光光度计进行纯化后蛋白浓度测定。
1.2.4 Western blotting分析
将上述纯化的蛋白经12.5% SDS-PAGE电泳后,湿转法(400 mA,30 min)转印到PVDF膜上,5%脱脂奶封闭2 h,4 ℃ 6×His标签抗体孵育过夜,TBST缓冲液洗涤3次,PVDF膜置于羊抗鼠HRP-IgG抗体中,室温孵育1 h;TBST 缓冲液洗涤3次,采用ECL显色液显色并观察拍照。
1.2.5 SC蛋白多克隆抗体的制备
将5只成年健康新西兰大兔(SPF级)随机分成2组,试验组3只,对照组2只。将纯化处理的一定量的SC重组蛋白与弗氏完全佐剂按照1∶1体积比进行混合乳化后,试验组颈背部皮下注射重组SC蛋白(1 mg·只−1),并于2周后进行二免,随后每隔两周免疫1次,每次免疫剂量在前一次免疫的基础上增加20%,对照组免疫相同剂量的生理盐水。免疫6 次后,心脏采血,分离血清,−80 ℃保存备用。
1.2.6 多克隆抗体的纯化和标记
将上述采集的血清经辛酸硫酸铵方法进行粗提纯后,参照Protein G Resin说明书进行抗体纯化,按照HRP标记试剂盒说明书对纯化后的多克隆抗体进行标记。
1.3 PEDV SIgA抗体间接ELISA检测方法的建立
1.3.1 最佳反应条件的确定
采用方阵滴定法分别对PEDV抗原包被浓度(1.2、0.6、0.3、0.15 μg·孔−1)、乳汁稀释比例(1∶5、1∶10、1∶20、1∶30)、包被条件(4 ℃过夜、37 ℃ 1 h、37 ℃ 2 h)、封闭浓度(5% BSA、2% BSA、1% BSA)、封闭时间(1、2、3 h)、一抗工作条件(37 ℃ 45 min、60 min、90 min)、二抗工作条件(稀释比例1∶50、1∶100、1∶200、1∶500;作用时间37 ℃ 45、60、90 min)和TMB显色时间(10、20、25 min)等进行优化,以阳性乳汁OD450 nm/阴性乳汁OD450 nm的最大比值为最佳的反应条件。
1.3.2 临界值的确定
采用上述优化的方法,对40 份已知PEDV SIgA抗体阴性乳汁样本进行测定,计算样本中OD450 nm平均值(
¯X )和标准差(SD)。根据统计学原理,当OD450 nm≥¯X +3SD时,判定为阳性。OD450 nm≤¯X +2SD时,判定为阴性,介于两者之间的判定为可疑[16]。1.3.3 特异性试验
按照上述建立的间接ELISA方法,分别对PoRV、TGEV阳性乳汁样品进行检测,每份样品重复3次,确定该方法的特异性。
1.3.4 重复性试验
随机选取10份乳汁样本进行批内和批间间接ELISA检测,每份样品设置3个重复,计算批内和批间的变异系数,分析其重复性。
1.3.5 PEDV SIgA抗体ELISA检测方法的应用
采集52份已知免疫猪流行性腹泻疫苗的临床乳汁样本,采用上述建立的检测方法和免疫荧光方法分别对乳汁中PEDV SIgA和IgA抗体水平进行测定,比较分析IgA与SIgA抗体水平相关性。
2. 结果与分析
2.1 PEDV纯化及蛋白浓度的测定
采用PEG4000沉淀法和蔗糖密度梯度离心的方法对PEDV进行纯化,经RT-PCR结果显示,在40%~60%的蔗糖层有较高浓度的PEDV存在,其大小为327 bp(图1)。经Folin-酚试剂法对纯化样品进行蛋白浓度测定。结果显示,蛋白质量浓度为200 μg·mL−1,杂蛋白的去除率达94%。
![]() 图 1 不同浓度蔗糖层PEDV RT-PCR检测结果M:1000 DNA Marker;1~3:40%~60%层带未稀释、100倍稀释、1000倍稀释;4~6为30%层带未稀释、100倍稀释、1000倍稀释;7~9为20%层带未稀释、100倍稀释、1000倍稀释。Figure 1. RT-PCR detections of PEDV on sucrose layersM:DNA ladder DL1000; 1–3: on not diluted 40%–60% sucrose layer and on those diluted 100× and 1 000×, respectively; 4–6: on not diluted 30% sucrose layer and on those diluted 100× and 1 000×, respectively; 7–9 on not diluted 20% sucrose layer and on those diluted 100× and 1 000×, respectively.
图 1 不同浓度蔗糖层PEDV RT-PCR检测结果M:1000 DNA Marker;1~3:40%~60%层带未稀释、100倍稀释、1000倍稀释;4~6为30%层带未稀释、100倍稀释、1000倍稀释;7~9为20%层带未稀释、100倍稀释、1000倍稀释。Figure 1. RT-PCR detections of PEDV on sucrose layersM:DNA ladder DL1000; 1–3: on not diluted 40%–60% sucrose layer and on those diluted 100× and 1 000×, respectively; 4–6: on not diluted 30% sucrose layer and on those diluted 100× and 1 000×, respectively; 7–9 on not diluted 20% sucrose layer and on those diluted 100× and 1 000×, respectively.2.2 PET32a-SC原核表达蛋白的鉴定及纯化
以His标签抗体为一抗,以羊抗鼠HRP-IgG为二抗进行SDS-PAGE鉴定及Western Blot分析,结果发现在约81 kDa位置处出现目的蛋白(图2、3)。
2.3 抗原最佳包被浓度及最佳样本稀释度的确定
当抗原包被浓度为0.6 μg·孔−1,乳汁稀释比例1∶5时,P/N最大,即抗原最佳包被浓度为0.6 μg·孔−1,乳汁最佳稀释比例为1∶5(表1)。
表 1 抗原最佳包被浓度及乳汁最佳稀释度的确定(OD450 nm)Table 1. Optimal antigen concentration and milk dilution determined according to OD450 nm样本稀释度
Sample dilution抗原稀释度
Antigen dilution/(μg·孔−1)P N P/N 1∶5 1.2 0.821 0.130 6.32 0.6 0.663 0.083 7.99 0.3 0.627 0.096 6.53 0.15 0.584 0.075 7.79 1∶10 1.2 0.725 0.131 5.53 0.6 0.572 0.096 5.96 0.3 0.494 0.093 5.31 0.15 0.455 0.077 5.91 1∶20 1.2 0.69 0.132 5.23 0.6 0.563 0.105 5.36 0.3 0.472 0.115 4.10 0.15 0.436 0.099 4.40 1∶30 1.2 0.519 0.128 4.05 0.6 0.412 0.107 3.85 0.3 0.324 0.117 2.77 0.15 0.271 0.111 2.44 2.4 最佳抗原包被条件的确定
间接ELISA检测结果显示,当抗原37 ℃作用2 h后,P/N最大值达7.65。因此确定抗原最佳包被条件为37 ℃ 2 h(表2)。
表 2 最佳包被条件的确定Table 2. Optimum conditions for coating指标 Index 包被条件 Coating condition 4 ℃包被过夜
4 ℃ wrap overnight37 ℃ 1 h 37 ℃ 2 h P 0.657 0.572 0.620 N 0.130 0.082 0.081 P/N 5.05 6.98 7.65 2.5 最佳封闭条件的确定
间接ELISA结果显示,用2% BSA封闭液、 37 ℃条件下封闭2 h的P/N有最大值。因此确定最佳的封闭条件为:用2% BSA,37 ℃作用2 h(表3)。
表 3 最佳封闭条件的确定Table 3. Optimum conditions for blocking指标 Index 封闭浓度
Closure condition封闭条件(37 ℃)
Closure condition1% 2% 5% 1 h 2 h 3 h P 1.180 1.121 1.034 1.110 1.070 1.077 N 0.241 0.213 0.220 0.282 0.226 0.255 P/N 4.89 5.26 4.68 3.94 4.73 4.22 2.6 最佳乳汁工作条件的确定
采用不同的孵育时间进行ELISA检测,结果显示,将乳汁样本置37 ℃作用60 min时,P/N最大,因此乳汁的最佳工作条件为37 ℃孵育60 min(表4)。
表 4 最佳乳汁样本工作条件的确定Table 4. Optimum working conditions for milk specimens指标
Index孵育时间 Incubation time 37 ℃ 45 min 37 ℃ 60 min 37 ℃ 90 min P 0.638 0.639 0.654 N 0.096 0.085 0.087 P/N 6.65 7.52 7.52 2.7 最佳标记抗体工作浓度的确定
对上述标记的酶标抗体进行不同比例的稀释后,采用上述建立的ELISA进行检测,标记抗体的稀释比例为1∶100、37 ℃作用90 min时,P/N值最大。因此,标记抗体的最佳稀释比例为1∶100倍,37 ℃孵育90 min(表5)。
表 5 最佳标记抗体工作条件的确定Table 5. Optimum working conditions for HRP-labeled secondary antibody指标
Index稀释比例
dilution作用时间
Reaction conditions1∶50 1∶100 1∶200 1∶300 37 ℃ 45 min 37 ℃ 60 min 37 ℃ 90 min P 0.819 0.891 0.709 0.706 0.746 0.796 0.867 N 0.168 0.162 0.172 0.159 0.146 0.150 0.160 P/N 4.88 5.5 4.12 4.44 5.11 5.31 5.42 2.8 底物最佳反应时间的确定
采用不同的TMB作用时间进行ELISA检测,结果发现,TMB反应时间为20 min时,P/N值最大。因此,底物最佳反应时间为20 min(表6)。
表 6 底物最佳反应时间的确定Table 6. Optimum reaction time for TMB指标 Index 孵育时间 Incubation time 15 min 20 min 25 min 30 min P 0.869 0.934 1.019 1.089 N 0.136 0.136 0.215 0.187 P/N 6.39 6.87 4.93 5.82 2.9 临界值判定
采用上述方法对40份经IFA检测的阴性乳汁样本进行检测,结果显示:40份阴性乳汁样本的平均值(
¯X )为0.232,标准差(SD)为0.056;根据统计学原理,确定阴阳性临界值为P=¯X +3SD=0.4,N=¯X +2SD=0.34。当待测样本OD450 nm值≥0.4判定为阳性;当待测样本OD450 nm值≤0.34判定为阴性;介于两者之间判定为可疑。2.10 特异性试验
按照上述建立的间接ELISA方法,分别对PoRV、TGEV阳性乳汁样品进行检测。结果表明,本研究建立的间接ELISA方法与上述乳汁样本均无交叉反应(OD450 nm<0.10),具有良好的特异性。
2.11 重复性试验
采用上述建立的间接ELISA方法对10份乳汁样本进行批内和批间重复性检测,结果显示,批内变异系数在0.3%~1.3%,批间变异系数在1%~6%,表明该方法具有很好的重复性(表7)。
表 7 乳汁样本的重复性检验结果Table 7. Repeatability of whey samples编号
Number组内重复
Intra group repetition组间重复
Intergroup duplication¯X±SD 变异系数CV/% ¯X±SD 变异系数CV/% 1 0.167±0.009 0.3 0.168±0.040 1 2 0.225±0.005 0.2 0.223±0.052 2 3 0.249±0.006 0.2 0.252±0.009 1 4 0.352±0.017 0.6 0.342±0.032 2 5 0.304±0.006 0.2 0.298±0.028 1 6 0.340±0.009 0.3 0.335±0.025 2 7 0.159±0.040 1.3 0.162±0.059 3 8 0.641±0.002 0.1 0.623±0.066 6 9 0.174±0.021 0.8 0.165±0.032 5 10 0.161±0.013 0.5 0.157±0.035 1 2.12 PEDV SIgA抗体检测方法的应用
采用上述建立的ELISA检测方法对临床采集的乳汁样本进行测定,并通过免疫荧光方法对PEDV IgA抗体进行测定。结果显示,52份样本中PEDV IgA抗体阳性率达98.1%,而PEDV SIgA抗体阳性率仅为69.2%。从样品的符合率情况分析发现,PEDV IgA抗体为阳性的样本,其特异性的SIgA抗体阳性率仅为70.6%,提示乳汁中IgA抗体的测定虽然对疫苗的免疫情况存在一定的指导意义,但要真实了解猪群的实际免疫保护情况还需对特异性的SIgA抗体水平进行测定。
3. 讨论与分析
PEDV作为一种肠道性传染病,其特异性SIgA抗体能够抑制PEDV在肠道上皮细胞的附着与增殖,保护仔猪肠道上皮细胞,阻止PEDV侵入机体[17]。目前已经有很多学者针对PEDV特异性抗体的ELISA检测方法进行探讨[18]。但其大多采用中和表位的部分蛋白作为抗原[19],或者采用针对IgA抗体的检测方法[20,21]。虽然也有学者采用PEDV抗原以及SIgA单克隆抗体制备等方法建立了PEDV特异性SIgA抗体检测方法,但因单克隆细胞制备存在筛选难度大、过程繁琐、培养环境条件苛刻等,很难推广应用。
采用本研究建立的方法与免疫荧光方法对PEDV特异性IgA抗体和SIgA特异性抗体检测结果比较分析发现,样品中IgA抗体为阳性时,其特异性的SIgA抗体不一定呈现阳性;样品中IgA抗体阴性的样本,其特异性SIgA抗体基本呈现阴性。这一发现可能是当前猪群免疫疫苗后,乳汁中IgA抗体水平高但仍然出现仔猪拉稀这一现象的原因,也进一步说明了通过乳汁中特异性IgA抗体水平的测定不能全面反映PEDV SIgA抗体的水平情况。由于初乳中不仅存在SIgA,也存在IgA。仔猪吮吸母乳后,其单体IgA通常经过血液循环发挥作用,而SIgA则可以锚定在肠道黏膜表面形成保护层。因此,通过测定乳汁中IgA抗体水平反映的可能是乳汁中的总IgA水平,这也是导致临床样本中PEDV IgA抗体为阳性,其特异性的SIgA抗体为阴性的可能原因。
本研究采用PET32a-SC重组蛋白作为免疫原制备SIgA特异性多克隆抗体,通过对获取的多克隆抗体进行纯化及辣根过氧化物酶标记后,建立了能够特异性识别SIgA抗体的诊断方法。与柏家果等[22]建立的间接ELISA方法相比,本研究通过全病毒作为包被抗原,大大提高了该方法的特异性和灵敏度。以标记的多克隆抗体作为酶标抗体,简化了HRP标记的山羊抗体IgG作为酶标三抗的操作过程,大大提高了工作效率,降低了操作强度。本研究方法的建立为猪群免疫猪流行性腹泻病毒相关疫苗后提供了便捷、有效的检验方法,为PEDV特异性黏膜免疫SIgA抗体水平的监测提供技术手段。因缺乏相关的特异性SIgA抗体检测试剂,PEDV SIgA抗体水平与动物免疫保护之间的关系还有待于结合猪群临床表现及免疫情况进行进一步验证。
-
表 1 营养液配方
Table 1 Formulation of nutrient solution
化合物
Compound化合物含量
Compound content/
(mg·L−1)各元素总含量
Content of element/
(mg·L−1)Ca(NO3)2·4H2O 1000 Ca:169.70 KNO3 500 N:187.80 KH2PO4 250 K:337.00 K2SO4 160 P:56.90 C10H12FeN2NaO8·3H2O 21 Fe:2.80 MnSO4·4H2O 2.02 Mn:0.50 H3BO3 2.86 B:0.50 ZnSO4·7H2O 0.22 Zn:0.05 CuSO4·5H2O 0.08 Cu:0.02 (NH4)6Mo7O24·4H2O 0.02 Mo:0.01 表 2 不同施镁量对西瓜生长发育的影响
Table 2 Effect of different magnesium application on growth and development of C. lanatus
Mg的质量浓度
Mg mass concentration/(mg·L−1)株高
Plant height/cm根长
Root length/cm根系体积
Root volume/cm3地上部干重
Plant dry weight/g根干重
Root dry weight/g生物量
Biological yield/g0 172.07±2.80 Dd 70.47±1.72 Dd 9.67±0.58 Dd 19.33±0.58 De 1.22±0.16 Dd 20.55±0.60 Ee 24 188.87±1.39 CDd 72.97±0.81 Dd 14.33±0.58 BCbc 23.00±1.73 Dd 1.87±0.27 Cc 24.87±1.68 Dd 48 272.30±14.48 Aa 116.13±5.01 Aa 20.67±2.08 Aa 43.93±2.08 Aa 4.73±0.32 Aa 48.66±2.23 Aa 96 244.67±10.52 Bb 92.43±4.19 Bb 15.67±0.58 Bb 36.83±1.61 Bb 2.78±0.19 Bb 39.61±1.43 Bb 192 215.17±15.45 Cc 84.20±1.08 Cc 12.33±1.15 CDc 30.80±0.26 Cc 2.49±0.16 Bb 33.29±1.42 Cc 注:*邓肯氏新复极差测验,大写字母和小写字母不同者分别表示极显著差异(P<0.01)和显著差异(P<0.05)。下同。
Note: In Duncan’s new multiple range test, data with different capital and lowercase letters indicate a highly significant difference (P<0.01) and a significant difference (P<0.05), respectively. Same for the following.表 3 不同施镁量对西瓜果实品质的影响
Table 3 Effect of different magnesium application on fruit quality of C. lanatus
Mg的质量浓度
Mg mass
concentration/(mg·L−1)中心可溶性固形物
Central
soluble solid/%边缘可溶性固形物
Marginal
soluble solid/%可溶性糖
Soluble
sugar/(mg·g−1)可溶性蛋白
Soluble
protein/(mg·g−1)维生素C
Vitamin
C/(mg·g−1)0 9.04±0.37 Cd 6.25±0.24 Cc 42.24±0.19 Ee 13.82±0.17 Ee 21.37±0.21 Ee 24 9.37±0.27 Cd 6.49±0.22 Cc 43.19±0.21 Dd 17.57±0.34 Dd 25.89±0.23 Dd 48 12.65±0.27 Aa 8.92±0.16 Aa 56.68±0.22 Aa 24.36±0.20 Aa 32.56±0.24 Aa 96 11.94±0.21 ABb 8.25±0.20 Bb 50.55±0.35 Bb 21.31±0.21 Bb 31.97±0.07 Bb 192 11.08±0.62 Bc 8.15±0.11 Bb 48.96±0.26 Cc 19.28±0.14 Cc 30.45±0.31 Cc 表 4 不同施镁量对西瓜不同生长期叶片PSⅡ反应中心数量和闭合程度的影响
Table 4 Effects of different magnesium application on PSⅡ RC/CS0 and closed extent of varied genotypes of C. lanatus
Mg的质量浓度
Mg mass concentration/(mg·L−1)伸蔓期 Stretch tendril stage 盛花期 Full-bloom stage 膨瓜期 Growth stage RC/CS0 VJ RC/CS0 VJ RC/CS0 VJ 0 285.92±7.62 Dc 0.54±0.05 Aa 252.40±6.27 Cc 0.68±0.01 Aa 235.68±5.95 Dd 0.72±0.05 Aa 24 302.51±4.04 Cb 0.45±0.02 Ca 289.56±4.12 Bb 0.55±0.04 Bb 269.72±5.81 Cc 0.63±0.03 Aab 48 357.26±8.38 Aa 0.23±0.01 Da 348.41±5.11 Aa 0.25±0.01 Cc 334.29±3.91 Aa 0.32±0.03 Cc 96 314.71±4.54 Bb 0.46±0.05 BCb 289.80±2.43 Bb 0.48±0.05 Bb 285.71±4.10 Bb 0.53±0.05 Bb 192 304.23±3.95 BCb 0.52±0.03 ABa 287.04±5.05 Bb 0.54±0.07 Bb 273.25±6.18 Cbc 0.65±0.08 Aab 表 5 不同施镁量对西瓜不同生育期叶片M0、Sm、Area、Ψ0和φEo的影响
Table 5 Effects of different magnesium application on leaf M0, Sm, Area, Ψ0, and φEo of C. lanatus at different growth stages
时期
TimeMg的质量浓度
Mg mass concentration/(mg·L−1)M0 Sm Area(×100) Ψ0 φEo 伸蔓期
Stretch tendril stage0 0.94±0.06 Aa 17.32±1.11 Dc 226.67±17.93 Bb 0.29±0.05 Cb 0.23±0.02 Cc 24 0.71±0.04 Bb 24.10±2.05 Cb 232.00±11.14 Bb 0.36±0.02 Bb 0.33±0.03 Bb 48 0.52±0.01 Dc 33.12±1.41 Aa 276.00±11.14 Aa 0.66±0.01 Aa 0.53±0.03 Aa 96 0.53±0.05 CDc 31.34±1.40 ABa 261.33±12.22 Aab 0.63±0.03 Aa 0.51±0.03 Aa 192 0.60±0.03 Cc 29.96±1.45 Ba 255.33±21.39 ABab 0.62±0.03 Aa 0.49±0.05 Aa 盛花期
Full-bloom stage0 1.02±0.02 Aa 14.62±1.69 Dd 259.33±31.77 Dc 0.22±0.03 Bb 0.18±0.02 Dd 24 0.80±0.04 Bb 22.47±1.03 Cc 384.67±12.06 Cb 0.28±0.05 Bb 0.27±0.03 Cc 48 0.55±0.02 Dd 32.61±1.19 Aa 502.00±12.00 Aa 0.67±0.03 Aa 0.53±0.01 Aa 96 0.65±0.05Cc 32.77±0.78Aa 482.67±16.17ABa 0.63±0.07Aa 0.51±0.01Bab 192 0.67±0.03 Cc 29.01±1.06 Bb 448.00±33.05 Ba 0.62±0.01 Aa 0.47±0.02 Bb 膨瓜期
Growth stage0 1.40±0.03 Aa 10.62±1.01 Dc 251.33±21.94 Bb 0.19±0.03 Dd 0.14±0.03 Db 24 1.02±0.07 Bb 20.26±0.93 Cb 378.33±23.54 Bb 0.27±0.01 Cc 0.20±0.02 Cb 48 0.53±0.05 Cc 35.45±1.03 Aa 499.33±8.08 Aa 0.58±0.03 Aa 0.52±0.04 Aa 96 1.05±0.04 Bb 34.15±0.98 ABa 494.67±25.79 Aa 0.57±0.02 Bab 0.47±0.01 Ba 192 1.05±0.04 Bb 33.13±0.77 Ba 482.67±21.94 Aa 0.50±0.04 Bb 0.46±0.02 Ba -
[1] 赵跃, 李飒, 黄楠, 等. 减量施肥对京郊地区设施小果型西瓜产量和品质的影响 [J]. 中国瓜菜, 2020, 33(9):47−49. DOI: 10.3969/j.issn.1673-2871.2020.09.009 ZHAO Y, LI S, HUANG N, et al. Effect of reduced fertilization on the yield and quality of protected mini watermelon in Daxing district [J]. China Cucurbits and Vegetables, 2020, 33(9): 47−49.(in Chinese) DOI: 10.3969/j.issn.1673-2871.2020.09.009
[2] 刘文革, 何楠, 赵胜杰, 等. 我国西瓜品种选育研究进展 [J]. 中国瓜菜, 2016, 29(1):1−7. DOI: 10.3969/j.issn.1673-2871.2016.01.001 LIU W G, HE N, ZHAO S J, et al. Advances in watermelon breeding in China [J]. China Cucurbits and Vegetables, 2016, 29(1): 1−7.(in Chinese) DOI: 10.3969/j.issn.1673-2871.2016.01.001
[3] 张文, 潘顺秋, 符传良, 等. 钾镁肥在西瓜上的施用效果研究 [J]. 现代农业科技, 2010(17):108−109. DOI: 10.3969/j.issn.1007-5739.2010.17.058 ZHANG W, PAN S Q, FU C L, et al. Effect of potassium and magnesium fertilizer on Watermelon [J]. Modern Agricultural Sciences and Technology, 2010(17): 108−109.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2010.17.058
[4] 林丽琳, 陈晟, 施木田, 等. Mg对黑美人西瓜叶片C、N代谢的影响 [J]. 亚热带农业研究, 2015, 11(1):25−30. LIN L L, CHEN S, SHI M T, et al. Effect of magnesium on carbon and nitrogen metabolism of Heimeiren watermelon leaves [J]. Subtropical Agriculture Research, 2015, 11(1): 25−30.(in Chinese)
[5] 林丽琳, 陈晟, 施木田, 等. 镁对新天玲西瓜叶片光合色素、可溶性蛋白含量和硝酸还原酶活性的影响 [J]. 热带农业科学, 2015, 35(1):26−30. DOI: 10.3969/j.issn.1009-2196.2015.01.007 LIN L L, CHEN S, SHI M T, et al. Effects of magnesium on leaf photosynthesis pigments, soluble protein content and reducing nitric acid activity of xintianling watermelon [J]. Chinese Journal of Tropical Agriculture, 2015, 35(1): 26−30.(in Chinese) DOI: 10.3969/j.issn.1009-2196.2015.01.007
[6] BEALE S I. Enzymes of chlorophyll biosynthesis [J]. Photosynthesis Research, 1999, 60(1): 43−73. DOI: 10.1023/A:1006297731456
[7] 熊英杰, 陈少风, 李恩香, 等. 植物缺镁研究进展及展望 [J]. 安徽农业科学, 2010, 38(15):7754−7757. DOI: 10.3969/j.issn.0517-6611.2010.15.014 XIONG Y J, CHEN S F, LI E X, et al. Research progress and outlook on magnesium deficiency in plants [J]. Journal of Anhui Agricultural Sciences, 2010, 38(15): 7754−7757.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2010.15.014
[8] MURPHY M P. How mitochondria produce reactive oxygen species [J]. The Biochemical Journal, 2009, 417(1): 1−13. DOI: 10.1042/BJ20081386
[9] HERMANS C, BOURGIS F, FAUCHER M, et al. Magnesium deficiency in sugar beets alters sugar partitioning and phloem loading in young mature leaves [J]. Planta, 2005, 220(4): 541−549. DOI: 10.1007/s00425-004-1376-5
[10] YIN S T, ZE Y G, LIU C, et al. Cerium relieves the inhibition of nitrogen metabolism of spinach caused by magnesium deficiency [J]. Biological Trace Element Research, 2009, 132(1/2/3): 247−258.
[11] 李佳, 曹先梅, 刘立云, 等. 镁对槟榔幼苗光合特性和叶绿体超微结构的影响 [J]. 植物营养与肥料学报, 2019, 25(11):1949−1956. DOI: 10.11674/zwyf.19158 LI J, CAO X M, LIU L Y, et al. Effects of different magnesium nutrition levels on photosynthetic characteristics and chloroplast ultrastructure of Areca palm seedlings [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(11): 1949−1956.(in Chinese) DOI: 10.11674/zwyf.19158
[12] 原佳乐, 马超, 冯雅岚, 等. 不同抗旱性小麦快速叶绿素荧光诱导动力学曲线对干旱及复水的响应 [J]. 植物生理学报, 2018, 54(6):1119−1129. YUAN J L, MA C, FENG Y L, et al. Response of chlorophyll fluorescence transient in leaves of wheats with different drought resistances to drought stresses and rehydration [J]. Plant Physiology Journal, 2018, 54(6): 1119−1129.(in Chinese)
[13] 王芳, 刘鹏, 史锋, 等. 镁对大豆叶片细胞膜透性和保护酶活性的影响 [J]. 植物营养与肥料学报, 2005, 11(5):659−664. DOI: 10.3321/j.issn:1008-505X.2005.05.015 WANG F, LIU P, SHI F, et al. Influences of magnesium on cell membrane permeability and activities of protective enzymes of soybean leaves [J]. Plant Nutrition and Fertilizing Science, 2005, 11(5): 659−664.(in Chinese) DOI: 10.3321/j.issn:1008-505X.2005.05.015
[14] 林仁辉. 小白菜镁素营养生理研究[D]. 福州: 福建农林大学, 2009. LIN R H. Studies on magnesium nutritive physiology of pakchoi[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese)
[15] 孙青慧. 苦瓜镁素营养生理的研究[D]. 福州: 福建农林大学, 2010. SUN Q H. Studies on magnesium nutrition physiology of balsam pear[D]. Fuzhou: Fujian Agriculture and Forestry University, 2010. (in Chinese)
[16] 凌丽俐, 黄翼, 彭良志, 等. 镁缺乏和过量胁迫对纽荷尔脐橙叶绿素荧光特性的影响 [J]. 生态学报, 2014, 34(7):1672−1680. LING L L, HUANG Y, PENG L Z, et al. Influence of magnesium deficiency and excess on chlorophyll fluorescence characteristics of Newhall navel orange leaves [J]. Acta Ecologica Sinica, 2014, 34(7): 1672−1680.(in Chinese)
[17] 申燕, 肖家欣, 杨慧, 等. 镁胁迫对春见橘橙生长和矿质元素分布及叶片超微结构的影响 [J]. 园艺学报, 2011, 38(5):849−858. SHEN Y, XIAO J X, YANG H, et al. Effects of magnesium stress on growth, distribution of several mineral elements and leaf ultrastructure of Harumi Tangor [J]. Acta Horticulturae Sinica, 2011, 38(5): 849−858.(in Chinese)
[18] 田斌, 胡玉洁, 路雪丽, 等. 镁缺乏和过量胁迫对大麦幼苗生长以及生理生化指标的影响 [J]. 杭州师范大学学报(自然科学版), 2018, 17(2):146−152. TIAN B, HU Y J, LU X L, et al. Effects of magnesium deficiency and excessive stress on the growth and physiological and biochemical indexes of barley seedlings [J]. Journal of Hangzhou Normal University (Natural Science Edition), 2018, 17(2): 146−152.(in Chinese)
[19] 林丽琳. 镁对不同基因型西瓜若干生理生化代谢指标的影响[D]. 福州: 福建农林大学, 2015. LIN L L. Effect of magnesium on different genotypes of watermelon in some physiological and biochemical metabolism[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015. (in Chinese)
[20] 李鹏民, 高辉远, Reto J. Strasser. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用 [J]. 植物生理与分子生物学学报, 2005, 31(6):559−566. LI P M, GAO H Y, STRASSER R. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study [J]. Acta Photophysiologica Sinica, 2005, 31(6): 559−566.(in Chinese)
[21] 李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000. [22] SPYCHALLA J P, DESBOROUGH S L. Superoxide dismutase, catalase, and alpha-tocopherol content of stored potato tubers [J]. Plant Physiology, 1990, 94(3): 1214−1218. DOI: 10.1104/pp.94.3.1214
[23] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant and Cell Physiology, 1981, 22(5): 867−880.
[24] HALLIWELL B, FOYER C H. Properties and physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography [J]. Planta, 1978, 139(1): 9−17. DOI: 10.1007/BF00390803
[25] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. [26] 李长志, 李欢, 刘庆, 等. 不同生长时期干旱胁迫甘薯根系生长及荧光生理的特性比较 [J]. 植物营养与肥料学报, 2016, 22(2):511−517. DOI: 10.11674/zwyf.14513 LI C Z, LI H, LIU Q, et al. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages [J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 511−517.(in Chinese) DOI: 10.11674/zwyf.14513
[27] ZHOU X T, ZHAO H L, CAO K, et al. Beneficial roles of melatonin on redox regulation of photosynthetic electron transport and synthesis of D1 protein in tomato seedlings under salt stress [J]. Frontiers in Plant Science, 2016, 7: 1823.
[28] 罗丽娟, 唐莉娜, 陈星峰, 等. 硅对镉胁迫下烟草叶片PSⅡ叶绿素荧光特性的影响 [J]. 烟草科技, 2019, 52(8):1−8. LUO L J, TANG L N, CHEN X F, et al. Effects of silicon on chlorophyll fluorescence characteristics of PSⅡ in tobacco leaves under cadmium stress [J]. Tobacco Science & Technology, 2019, 52(8): 1−8.(in Chinese)
[29] 耿庆伟, 邢浩, 翟衡, 等. 臭氧胁迫下不同光强与温度处理对赤霞珠葡萄叶片PSⅡ光化学活性的影响 [J]. 中国农业科学, 2019, 52(7):1183−1191. DOI: 10.3864/j.issn.0578-1752.2019.07.006 GENG Q W, XING H, ZHAI H, et al. Effects of different light intensity and temperature on PSⅡ photochemical activity in cabernet sauvignon grape leaves under ozone stress [J]. Scientia Agricultura Sinica, 2019, 52(7): 1183−1191.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2019.07.006
[30] STRASSER B J. Donor side capacity of Photosystem II probed by chlorophyll a fluorescence transients [J]. Photosynthesis Research, 1997, 52(2): 147−155. DOI: 10.1023/A:1005896029778
[31] VIERLING E, KIMPEL J A. Plant responses to environmental stress [J]. Current Opinion in Biotechnology, 1992, 3(2): 164−170. DOI: 10.1016/0958-1669(92)90147-B
[32] 沙汉景, 胡文成, 贾琰, 等. 外源水杨酸、脯氨酸和γ-氨基丁酸对盐胁迫下水稻产量的影响 [J]. 作物学报, 2017, 43(11):1677−1688. DOI: 10.3724/SP.J.1006.2017.01677 SHA H J, HU W C, JIA Y, et al. Effect of exogenous salicylic acid, proline, and γ-aminobutyric acid on yield of rice under salt stress [J]. Acta Agronomica Sinica, 2017, 43(11): 1677−1688.(in Chinese) DOI: 10.3724/SP.J.1006.2017.01677
[33] CAKMAK I. Activity of ascorbate-dependent H2O2-scavenging enzymes and leaf chlorosis are enhanced in magnesium- and potassium-deficient leaves, but not in phosphorus-deficient leaves [J]. Journal of Experimental Botany, 1994, 45(9): 1259−1266. DOI: 10.1093/jxb/45.9.1259
[34] 袁琳, 克热木·伊力, 张利权. NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响 [J]. 植物生态学报, 2005, 29(6):985−991. DOI: 10.3321/j.issn:1005-264X.2005.06.015 YUAN L, KEREMU Y L, ZHANG L Q. Effects of nacl stress on active oxygen metabolism and membrane stability in Pistacia vera seedlings [J]. Acta Phytoecologica Sinica, 2005, 29(6): 985−991.(in Chinese) DOI: 10.3321/j.issn:1005-264X.2005.06.015
[35] 何云, 李贤伟, 龚伟. 3种岩石边坡护坡植物叶片质膜透性和可溶性糖含量对低温胁迫的响应 [J]. 四川农业大学学报, 2012, 30(1):42−45. DOI: 10.3969/j.issn.1000-2650.2012.01.008 HE Y, LI X W, GONG W. Response of membrane permeability and soluble carbohydrate of three native Petrophile plants to low temperature stress [J]. Journal of Sichuan Agricultural University, 2012, 30(1): 42−45.(in Chinese) DOI: 10.3969/j.issn.1000-2650.2012.01.008
[36] 王天, 宋佳承, 闫士朋, 等. 低温胁迫下磷肥施用量对油橄榄生长发育的影响 [J]. 植物营养与肥料学报, 2020, 26(5):879−890. DOI: 10.11674/zwyf.19349 WANG T, SONG J C, YAN S P, et al. Growth and development of olive under low temperature stress influenced by phosphate fertilizer application [J]. Journal of Plant Nutrition and Fertilizers, 2020, 26(5): 879−890.(in Chinese) DOI: 10.11674/zwyf.19349
[37] 王利界, 周智彬, 常青, 等. 盐旱交叉胁迫对灰胡杨(Populus pruinosa)幼苗生长和生理生化特性的影响 [J]. 生态学报, 2018, 38(19):7026−7033. WANG L J, ZHOU Z B, CHANG Q, et al. Growth, physiological and biochemical characteristics of Populus pruinosa seedlings under salt-drought stress [J]. Acta Ecologica Sinica, 2018, 38(19): 7026−7033.(in Chinese)
[38] XUE Y F, LIU Z P. Antioxidant enzymes and physiological characteristics in two Jerusalem artichoke cultivars under salt stress [J]. Russian Journal of Plant Physiology, 2008, 55(6): 776−781. DOI: 10.1134/S102144370806006X
[39] PU F, REN X L. Ascorbate levels and activities of enzymes related to the glutathione-ascorbate cycle in fruits of Chinese persimmon cultivars [J]. Horticulture, Environment, and Biotechnology, 2014, 55(4): 315−321. DOI: 10.1007/s13580-014-0177-4
[40] NISHIKAWA F. Ascorbate metabolism in harvested broccoli [J]. Journal of Experimental Botany, 2003, 54(392): 2439−2448. DOI: 10.1093/jxb/erg283
[41] STRASSER B J, STRASSER R J. Measuring fast fluorescence transients to address environmental questions: The JIP-test[M]//Photosynthesis: from Light to Biosphere. Dordrecht: Springer Netherlands, 1995: 4869-4872.
[42] IMAHORI Y, BAI J H, BALDWIN E. Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments [J]. Scientia Horticulturae, 2016, 198: 398−406. DOI: 10.1016/j.scienta.2015.12.006
[43] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J]. Plant Physiology and Biochemistry, 2010, 48(12): 909−930. DOI: 10.1016/j.plaphy.2010.08.016
[44] JOZEFCZAK M, REMANS T, VANGRONSVELD J, et al. Glutathione is a key player in metal-induced oxidative stress defenses [J]. International Journal of Molecular Sciences, 2012, 13(3): 3145−3175. DOI: 10.3390/ijms13033145
[45] MAY M J, VERNOUX T, LEAVER C, et al. Glutathione homeostasis in plants: Implications for environmental sensing and plant development [J]. Journal of Experimental Botany, 1998, 49(321): 649−667.
-
期刊类型引用(0)
其他类型引用(1)








 下载:
下载: