Prokaryotic Expression and Purification of JsMYB305 Transcription Factor in Jasminum sambac
-
摘要:目的 获得茉莉花香气调控转录因子JsMYB305的重组蛋白,为深入研究JsMYB305调控茉莉萜类香气代谢的分子机理及筛选其他互作蛋白提供基础。方法 通过酶切连接的方式,将JsMYB305的编码序列构建到原核表达载体pGEX-4T-1,转化BL21(DE3)表达菌株,通过IPTG诱导蛋白表达、GST亲和树脂分离纯化,最后Western Blot鉴定重组蛋白。结果 重组蛋白的诱导条件为0.2 mmol·L−1 IPTG,最适宜纯化的温度和时间为28 ℃诱导4 h,经20 mmol·L−1 GSH洗脱的蛋白纯度较好,Western Blot结果表明重组蛋白的大小正确。结论 成功获得了JsMYB305重组蛋白,为后期利用GST-pull down技术筛选互作蛋白及EMSA研究JsMYB305对特定启动子位点的结合提供基础。Abstract:Objective The recombinant protein of fragrance-regulating transcription factor JsMYB305 was obtained in preparation for studies on the molecular mechanism of terpenoid-regulation and interacting proteins of the gene in Jasminum sambac.Methods Coding sequence of JsMYB305 was constructed into prokaryotic expression vector pGEX-4T-1 by enzyme digestion and ligation, then, transformed into the BL21 (DE3) expressing strain. The protein expression was induced by IPTG, and the recombinant protein separated and purified using GST affinity resin followed by western blot for positive identification.Result After induction by 0.2 mmol·L−1 IPTG, the recombinant protein was purified at the optimized temperature of 28 ℃ for 4 h and eluted with 20 mmol·L−1 GSH for purification. The western blot confirmed the protein weight to be as expected.Conclusion The recombinant protein of JsMYB305 was successfully obtained to pave the way for further studies on the search for the interacting proteins by GST-pull down technique and the binding of the gene to specific promoter sites by EMSA.
-
0. 引言
【研究意义】牛轮状病毒(Bovine rotavirus,BRV)是引起犊牛腹泻常见的病毒病原体之一,犊牛感染后会出现严重的腹泻、脱水进而引起死亡,已成为影响我国养牛业健康发展的主要疫病之一[1]。据报道,BRV在我国河北、山西、云南、内蒙古、西藏、贵州等地均有感染发生[2]。近年来,福建省草食动物产业发展稳中有涨,其中牛的存栏量已达到35万多头,而福建省关于牛病的研究相对滞后,缺乏一系列病原检测方法。目前,对BRV感染缺乏有效的治疗药物,并且对BRV疫苗的研究较少[3],导致BRV的防控难度加大。此外,犊牛腹泻是临床上常发的疫病,而引起犊牛腹泻的病原较多,如大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、隐孢子虫(Cryptosporidium)、星形病毒(Astrovirus)、冠状病毒(Coronavirus)等[4],仅从临床症状难以辨别,需要通过实验室进行诊断。为此,建立一种BRV RT-PCR检测方法显得尤为重要。【前人研究进展】BRV属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus)[5],因电镜下形似车轮而得名。病毒的基因组是由11段不连续的双链RNA组成[6]。目前对BRV的诊断方法主要有传统方法,如病毒的分离鉴定法、电镜观察诊断法;免疫学检测技术,包括酶联免疫吸附试验、免疫层析试纸条检测技术;分子生物学技术,包括RT-PCR、实时荧光定量RT-PCR、环介导等温扩增技术、原位杂交技术、纳米孔测序技术等[7]。病毒的分离培养主要通过接种MA-104细胞[8],但是分离周期长、费用高,不适合基层的大规模检测。电镜法需要更高端的设备和较高的成本投入,也不适合大规模样品检测及广泛推广[7]。因此,分子生物学技术在BRV病原检测中的应用还有待开发,尤其是PCR技术。PCR检测能够检测出微量病原体,并且操作简单、检测速度快、成本低,与其他的检测方法相比具有一定的优势。目前,已有基于BRV不同基因建立的多种PCR检测体系,如栾倩倩等[9]基于VP7基因建立了BRV半巢式RT-PCR检测方法,拜小强等[10]基于VP4基因建立了RT-qPCR检测方法,Prasad等[11]基于VP4基因建立了RT-PCR检测方法,Basera等[12]基于VP6基因建立了RT-PCR检测方法。轮状病毒的基因组由11个节段的双股RNA组成,其中VP1、VP2、VP3、VP4、VP6和VP7这6段基因分别编码6个结构蛋白[13]。前人所建立的检测方法多是基于VP4、VP6和VP7基因。VP1基因编码位于病毒核心的核糖核酸聚合酶,根据CARPIÓ R V D等[14]的研究,VP1基因具有较高的保守性。【本研究切入点】目前基于VP1基因建立的检测方法较少。【拟解决的关键问题】本研究利用Oligo7.0软件设计并合成1对特异性引物,建立能够检测出BRV的RT-PCR方法,为福建省BRV的防控以及流行病学调查提供技术支持。
1. 材料与方法
1.1 试验材料
1.1.1 样品来源与毒株
禽呼肠孤病毒(Avian reovirus,ARV)、丝状支原体山羊亚种(Mycoplasma mycoides subsp.capri,Mmc)、山羊支原体山羊亚种(Mycoplasma capricolum subsp.capricolum,Mcc)、牛肺炎支原体(Mycoplasma bovis,M.bovis)、绵羊肺炎支原体(Mycoplasma ovipneumoniae,Mo)、山羊化脓隐秘杆菌(Cryptobacterium pyogenes,CP)、鸡细小病毒(Chicken parvovirus,ChPV)、鸡圆圈病毒3型(Gyrovirus 3,GyV3)、鸭圆环病毒1型(Duck circovirus 1,DuCV1)、鸭圆环病毒2型(Duck circovirus 2,DuCV2)、无乳支原体(Mycoplasma agalactiae,MA)、大肠杆菌(Escherichia coli,EC)、沙门氏菌(Salmonella,SE)、羊口疮病毒(Orf virus,ORFV)等DNA或cDNA均由福建省农业科学院畜牧兽医研究所实验室保存。22份临床样品采自福建省牛场,均为临床上疑似BRV的犊牛腹泻粪便样品。
1.1.2 主要试剂
EasyPure® Simple Viral DNA/RNA Kit、TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物技术有限公司;Taq DNA聚合酶、DNA Marker购自宝生物(北京)工程有限公司;凝胶回收试剂盒购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 引物设计与合成
根据GenBank上公布的BRV毒株RVA/Yak-tc/CHN/QH-1/2015/G6P基因组序列(登录号:MK638870.1),利用Oligo7.0软件设计并合成1对特异性检测引物,引物序列如下:上游引物5′-ATGTGCGAGCCATAGTACCA-3′;下游引物5′-TGCGGCATCCAACATTTTCT-3′。扩增片段大小为206 bp。引物由福州尚亚生物技术有限公司合成。
1.2.2 样品处理
牛场采集的腹泻病料,在生物安全柜中用无菌研钵研磨;按1∶4的体积比例加入PBS缓冲液;加入2000 UI·mL−1青霉素和2000 μg·mL−1链霉素;混匀后分装5 mL灭菌离心管;4 ℃作用30 min;6000 r·min−1室温离心10 min,取上清液−70 ℃保存。
1.2.3 核酸提取
按照北京全式金生物技术有限公司EasyPure® Simple Viral DNA/RNA Kit说明书分别提取临床样品以及其他供试样品的DNA和RNA。
1.2.4 反转录
按照反转录试剂盒的操作说明对提取的样本RNA进行反转录,总体系20 μL,在200 μL PCR管中加入RNase-Free Water 5 μL、Random Primer(N9)1 μL和模板2 μL,于PCR仪中65 ℃反应5 min后冰浴2 min,反应结束后继续向离心管中加入2×ES Reaction Mix 10 μL、EasyScript®RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL,反应条件25 ℃,10 min,42 ℃,30 min,85 ℃,5 s,4 ℃保存。
1.2.5 PCR反应体系优化
以反转录得到的cDNA为模板,用设计的特异性引物进行PCR扩增。总体系20 μL,其中2×Pro Taq Master Mix 10 μL、模板3 μL,上下游引物浓度采用矩阵法进行调整,RNase-Free Water补足20 μL,分别取52、54、56、58、60 ℃为退火温度进行PCR反应,以确定最适退火温度。反应结束后,取10 μL PCR扩增产物使用1.5%凝胶进行电泳。电泳结束后在凝胶成像系统扫描仪下观察并将扩增的特异性片段切下,通过胶回收试剂盒纯化后送测序公司进行测序,通过Blast进行对比以确定扩增片段的正确性。
1.2.6 特异性试验
应用建立的方法对禽呼肠孤病毒(ARV)、丝状支原体山羊亚种(Mmc)、山羊支原体山羊亚种(Mcc)、牛肺炎支原体(M. bovis)、绵羊肺炎支原体(Mo)、山羊化脓隐秘杆菌(CP)、鸡细小病毒(ChPV)、鸡圆圈病毒3型(GyV3)、鸭圆环病毒1型(DuCV1)、鸭圆环病毒2型(DuCV2)、无乳支原体(MA)、大肠杆菌(EC)、沙门氏菌(SE)、羊口疮病毒(ORFV)进行PCR扩增,验证该方法的特异性。
1.2.7 敏感性试验
将反转录得到的cDNA进行10倍递增稀释,共稀释9个浓度梯度,分别作为模板进行PCR检测,以确定该方法的敏感性。
1.2.8 重复性试验
应用建立的RT-PCR检测方法分别对3份阳性样本和3份阴性样本平行检测3次,每个样品设3个重复,每次检测间隔3 d,以确定该方法的可重复性。
1.2.9 检测方法的临床应用
利用建立的RT-PCR方法对22份来自福建牛场的犊牛腹泻粪便临床样品进行检测,并将PCR阳性样品的扩增产物进行胶回收测序和同源性比对验证。
2. 结果与分析
2.1 RT-PCR 反应条件的优化及扩增产物的鉴定
通过对酶浓度、引物浓度及退火温度等条件的优化,最终确定RT-PCR最佳反应体系为:2×Pro Taq Master Mix 10 μL、RNase-Free Water 5 μL、模板3 μL、上下游引物浓度10 μmol·L−1各1 μL,最佳反应条件为:95 ℃预变性3 min;95 ℃,15 s,58 ℃,15 s,72 ℃,15 s,进行35个循环;72 ℃延伸7 min。应用优化后的条件对BRV样品进行扩增,并将扩增产物送往福州尚亚生物技术有限公司进行测序。结果(图1)显示,经琼脂糖凝胶电泳扩增出1条约200 bp的目的片段;测序后扩增的基因序列长度为206 bp,经Blast进行对比后与MK638870.1毒株序列同源性为96.69%,与预期结果相符。
2.2 特异性试验
应用建立的方法对禽呼肠孤病毒(ARV)、丝状支原体山羊亚种(Mmc)、山羊支原体山羊亚种(Mcc)、牛肺炎支原体(M.bovis)、绵羊肺炎支原体(Mo)、山羊化脓隐秘杆菌(CP)、鸡细小病毒(ChPV)、鸡圆圈病毒3型(GyV3)、鸭圆环病毒1型(DuCV1)、鸭圆环病毒2型(DuCV2)、无乳支原体(MA)、大肠杆菌(EC)、沙门氏菌(SE)、羊口疮病毒(ORFV)的核酸进行扩增,结果显示除BRV在206 bp处有特异性的扩增条带外,其他病原体核酸样本均未出现扩增条带(图2),表明建立的方法具有良好的特异性。
![]() 图 2 特异性试验结果M:DL2000 Marker;1:BRV阳性对照;2:阴性对照;3~16分别为禽呼肠孤病毒、丝状支原体山羊亚种、山羊支原体山羊亚种、牛肺炎支原体、绵羊肺炎支原体、山羊化脓隐秘杆菌、鸡细小病毒、鸡圆圈病毒3型、鸭圆环病毒1型、鸭圆环病毒2型、无乳支原体、大肠杆菌、沙门氏菌、羊口疮病毒。Figure 2. Specificity of methodologyM: DL2000 Marker; 1: BRV positive control; 2: negative control; 3–16: templates of ARV, Mmc, Mcc, M.bovis, Mo, CP, ChPV, GyV3, DuCV1, DuCV2, MA, EC, SE, and ORFV, respectively.
图 2 特异性试验结果M:DL2000 Marker;1:BRV阳性对照;2:阴性对照;3~16分别为禽呼肠孤病毒、丝状支原体山羊亚种、山羊支原体山羊亚种、牛肺炎支原体、绵羊肺炎支原体、山羊化脓隐秘杆菌、鸡细小病毒、鸡圆圈病毒3型、鸭圆环病毒1型、鸭圆环病毒2型、无乳支原体、大肠杆菌、沙门氏菌、羊口疮病毒。Figure 2. Specificity of methodologyM: DL2000 Marker; 1: BRV positive control; 2: negative control; 3–16: templates of ARV, Mmc, Mcc, M.bovis, Mo, CP, ChPV, GyV3, DuCV1, DuCV2, MA, EC, SE, and ORFV, respectively.2.3 敏感性试验
将BRV的基因组RNA反转录得到的cDNA通过分光光度计测量后得到初始浓度为1389.73 ng·μL−1,稀释到105时仍然可以观察到特异性扩增条带(图3),此时的核酸含量为6.86×105 copies·μL−1,结果表明检测方法具有良好的敏感性。
2.4 重复性试验
利用建立的RT-PCR方法对3份BRV阳性样品,M.bovis、Mo、EC、SE各1份进行批内和批间重复试验。结果显示,批内和批间试验结果均一致(图略),即3份BRV阳性样品有条带扩增,其余样品均无条带扩增,表明该检测方法具有良好的重复性。
2.5 检测方法的临床应用
利用建立的RT-PCR方法对22份临床样品进行检测。结果显示,22份样品中BRV共检测出12份,阳性率为54.55%(图4)。对PCR扩增产物进行胶回收测序,并与GenBank中BRV序列进行同源性比较。所有PCR阳性的产物序列比对后,同源性均高达95%以上,表明该检测方法可用于BRV引起疾病的诊断。
3. 讨论
随着我国养牛产业的不断发展,犊牛腹泻的发生也不断增多。犊牛出现腹泻后会引起脱水、电解质平衡紊乱、生长发育迟缓甚至死亡[6]。由于犊牛的免疫系统发育不成熟,能够引起犊牛腹泻的因素有很多,非感染因素包括:饲养管理不当、环境因素、应激因素等;感染因素包括:细菌感染,例如EC、SE;病毒感染,例如牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、Coronavirus、BRV;寄生虫感染,例如隐孢子虫、球虫、蛔虫、绦虫[4]。但是这些因素所导致的犊牛腹泻在症状上十分相似,很难通过临床症状去判断病因。因此,在临床上对腹泻犊牛做出及时准确的诊断就尤为重要。据报道,近一半的犊牛腹泻与BRV感染有关,是引起犊牛腹泻发病率最高的病原体[15]。研究显示,2005–2006年,在我国的12个畜牧大省及牛群集中的地区,BRV的血清抗体阳性率达90%以上[2],而本研究中检测出高达54.55%的BRV阳性率,这说明我国牛群中BRV感染十分普遍且较为严重,这可能会严重危害养牛产业的发展。目前,BRV感染尚未有有效的治疗方法和药物,主要还是以预防为主,采取综合防治措施来净化牛群是控制本病的根本方法。一方面,发现阳性病例,应立即淘汰病牛,避免更多的健康牛发生感染;另一方面,在引入牛时应该进行严格的检疫和隔离,防止病牛将病毒带入养殖场,这些都离不开快速便捷的检测方法。随着福建省内养牛产业的不断发展,BRV引起的腹泻已引起相关养殖户的重视。本研究建立的BRV RT-PCR方法,不仅能够更好地了解福建省BRV的流行情况,并且为BRV的防控提供有力的技术支撑。
轮状病毒的基因组编码6个结构蛋白和5/6个非结构蛋白(NSP1~6),其中VP1编码位于病毒核心的结构蛋白,是一种核糖核酸聚合酶,在病毒的感染和复制过程中起着至关重要的作用[13]。研究发现VP1基因的保守性较高[14],因此适合作为病原检测的靶基因。本研究所建立的RT-PCR检测方法从样品的处理到检出结果约需4 h,并且与前人所建立RT-PCR检测方法[16]相比有着更高的敏感性,应用该方法对疑似病料进行BRV检测,PCR阳性结果与目的片段测序、同源性比对结果相符,说明该方法可快速、准确地对临床样品进行BRV的检测和监控。
综上所述,本研究成功建立了BRV RT-PCR检测方法,其特异性强、稳定性好,可应用于临床样品的检测,为福建省BRV的防控和流行病学调查提供了有效的技术支撑。
-
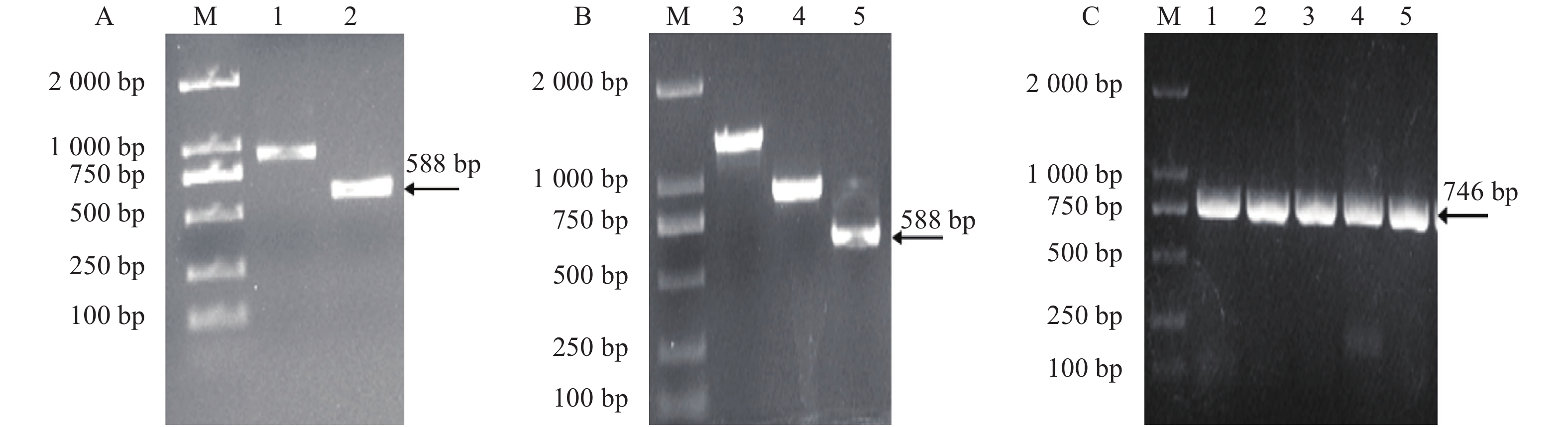
图 1 茉莉JsMYB305基因编码序列的扩增、酶切回收及菌液PCR鉴定
注:M为DL2000 Marker ;A为茉莉JsMYB305基因编码序列的扩增,其中2为JsMYB305基因;B为JsMYB305基因扩增产物酶切回收后的产物,其中5为目的基因,1、3、4为其他基因条带;C为重组载体pGEX-4T-1-JsMYB305的菌液PCR鉴定,1~5为阳性条带。
Figure 1. Amplification of JsMYB305 coding sequence, recovery of PCR product after enzyme digestion, and PCR identification of bacteria
Note: M: DL 2000 marker; A: amplification of JsMYB305 encoding sequence, 2: JsMYB305; B: amplification product of JsMYB305 after enzyme digestion and recovery; 5: JsMYB305; 1, 3, and 4: bands of other genes; C: identification of recombinant vector pGEX-4T-1-JsMYB305; 1-5: positive bands.
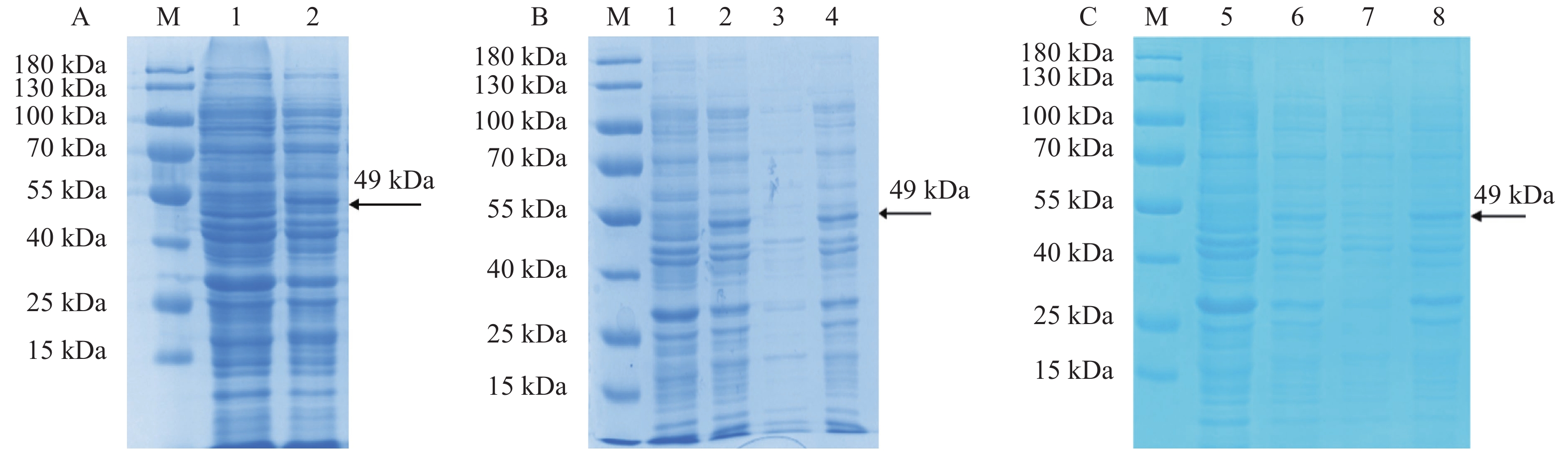
图 2 JsMYB305重组蛋白的诱导表达及可溶性检测
注:M:Protein ladder。A:JsMYB305重组蛋白的诱导表达,1:未诱导的菌体蛋白,2:0.2 mmol·L−1 IPTG诱导后的菌体蛋白。B:37 ℃诱导重组蛋白表达,1:未诱导的菌体蛋白;2、3、4分别为37 ℃ 0.2 mmol·L−1 IPTG诱导的菌体蛋白、上清、沉淀。C:28 ℃诱导重组蛋白表达,5:未诱导的菌体蛋白,6、7、8分别为28 ℃ 0.2 mmol·L−1 IPTG诱导的菌体蛋白、上清、沉淀。
Figure 2. Inducible expression and soluble detection of JsMYB
305 recombinant protein Note: M: protein ladder; A: induced expression of recombinant protein of JsMYB305; 1: uninduced bacterial protein; 2: bacterial protein induced by 0.2 mmol·L−1 IPTG; B: recombinant protein expression induced at 37 ℃; 1: uninduced bacterial protein; 2, 3 and 4: bacterial protein, supernatant, and precipitate, respectively, induced by 0.2 mmol·L−1 IPTG at 37 ℃; C: recombinant protein expression induced at 28 ℃; 5: uninduced bacterial protein; 6, 7, and 8: bacterial protein, supernatant, and precipitate, respectively, induced by 0.2 mmol·L−1 IPTG at 28 ℃.
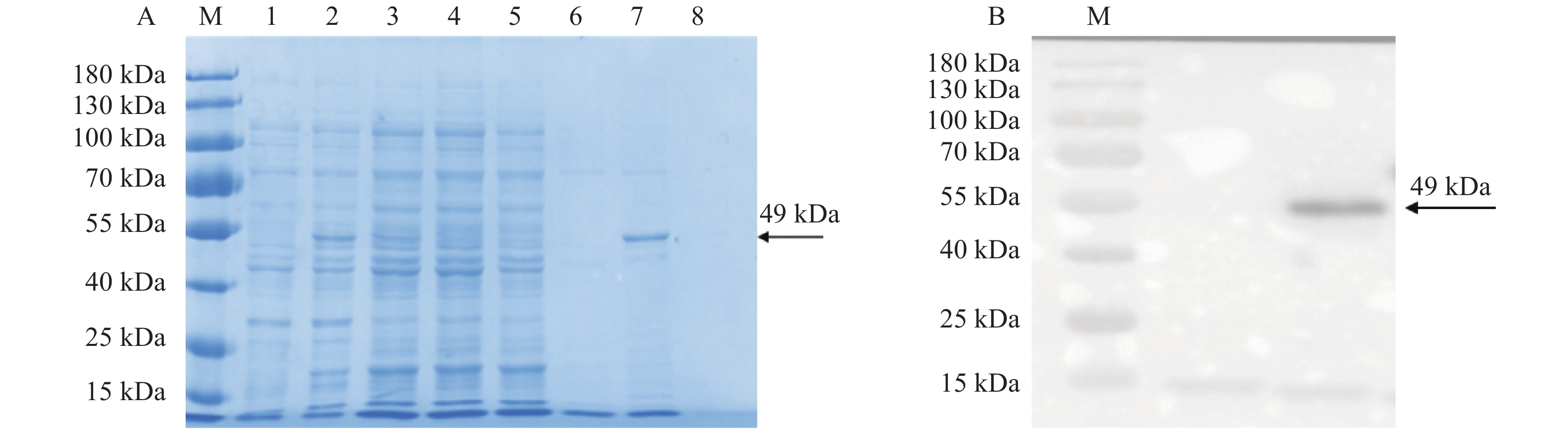
图 3 重组蛋白的纯化及Western Blot 检测
注:M:protein ladder 。A:重组蛋白的纯化 ,1:未诱导的菌体蛋白;2:0.2 mmol·L−1 IPTG诱导后的菌体蛋白;3:超声破碎后的菌体蛋白上清;4:流出液;5:洗涤液;6:10 mmol·L−1 GSH洗脱液;7:20 mmol·L−1 GSH洗脱液;8:30 mmol·L−1 GSH洗脱液;箭头标注的是纯化的重组蛋白。B:纯化蛋白的Western Blot 检测,箭头标注的是JsMYB305重组蛋白与GST单克隆抗体杂交后的条带。
Figure 3. Purification and western blot identification of recombinant protein
Note: M: 15-180 kDa protein ladder; A: purification of recombinant protein; 1: uninduced bacterial protein; 2: bacterial protein induced by 0.2 mmol·L−1 IPTG; 3: supernatant of bacterial protein after ultrasonic crushing; 4: effluent; 5: washing liquid; 6: eluent of 10 mmol·L−1 GSH; 7: eluent of 20 mmol·L−1 GSH; 8: eluent of 30 mmol·L−1 GSH; arrow points at purified recombinant protein; B: detection of purified protein by western blot; arrow points at band after hybridization of JsMYB305 recombinant protein with GST monoclonal antibody.
表 1 构建原核表达载体时扩增JsMYB305编码序列的引物序列
Table 1 Primer sequences for amplifying JsMYB305 coding sequence in prokaryotic expression vector construction
引物名称
Primer name引物序列
Primer sequence(5′-3′ )JsMYB305-F gagagaGGA TCCATGGACAAGAAA ATATGCAAT AGCTCTC JsMYB305-R gagagaGTCGACTTAATCCCCATTAAGTAA CTGGATG 注:上游引物中划线部分为Bam H I酶切位点,下游引物中划线部分为Sal I酶切位点。
Note: The underlined sequence in the forward primer is the Bam H I restriction site, in the reverse primer is the Sal I restriction site. -
[1] 朱建新, 程福建, 杨江帆. 茉莉花茶香气影响因素研究进展 [J]. 中国茶叶, 2021, 43(1):40−43. DOI: 10.3969/j.issn.1000-3150.2021.01.007 ZHU J X, CHENG F J, YANG J F. Research progress on factors influencing aroma of jasmine tea [J]. China Tea, 2021, 43(1): 40−43.(in Chinese) DOI: 10.3969/j.issn.1000-3150.2021.01.007
[2] BERA P, KOTAMREDDY J N R, SAMANTA T, et al. Inter-specific variation in headspace scent volatiles composition of four commercially cultivated jasmine flowers [J]. Natural Product Research, 2015, 29(14): 1328−1335. DOI: 10.1080/14786419.2014.1000319
[3] BERA P, MUKHERJEE C, MITRA A. Enzymatic production and emission of floral scent volatiles in Jasminum sambac [J]. Plant Science, 2017, 256: 25−38. DOI: 10.1016/j.plantsci.2016.11.013
[4] SPITZER-RIMON B, MARHEVKA E, BARKAI O, et al. EOBII, a gene encoding a flower-specific regulator of phenylpropanoid volatiles' biosynthesis in Petunia [J]. The Plant Cell, 2010, 22(6): 1961−1976. DOI: 10.1105/tpc.109.067280
[5] SPITZER-RIMON B, FARHI M, ALBO B, et al. The R2R3-MYB-like regulatory factor EOBI, acting downstream of EOBII, regulates scent production by activating ODO1 and structural scent-related genes in Petunia [J]. The Plant Cell, 2012, 24(12): 5089−5105.
[6] VAN MOERKERCKE A, HARING M A, SCHUURINK R C. The transcription factor emission of benzenoids ii activates the MYB odorant1 promoter at a MYB binding site specific for fragrant petunias [J]. The Plant Journal:for Cell and Molecular Biology, 2011, 67(5): 917−928. DOI: 10.1111/j.1365-313X.2011.04644.x
[7] MEDINA-PUCHE L, MOLINA-HIDALGO F J, BOERSMA M, et al. An R2R3-MYB transcription factor regulates eugenol production in ripe strawberry fruit receptacles [J]. Plant Physiology, 2015, 168(2): 598−614. DOI: 10.1104/pp.114.252908
[8] JIAN W, CAO H H, YUAN S, et al. SlMYB75, an MYB-type transcription factor, promotes anthocyanin accumulation and enhances volatile aroma production in tomato fruits [J]. Horticulture Research, 2019, 6: 22. DOI: 10.1038/s41438-018-0098-y
[9] 孙君, 陈雪津, 陈笛, 等. 茉莉花JsPAL基因及其启动子克隆与表达分析 [J]. 西北植物学报, 2020, 40(6):949−956. SUN J, CHEN X J, CHEN D, et al. Cloning and expression analysis of phenylalanine ammonia-lyase gene from Jasminum sambac and isolation of its promoter [J]. Acta Botanica Boreali-Occidentalia Sinica, 2020, 40(6): 949−956.(in Chinese)
[10] 陈笛, 王鹏杰, 郑玉成, 等. 茉莉花MVD基因及其启动子的克隆与表达 [J]. 福建农林大学学报(自然科学版), 2019, 48(3):309−315. CHEN D, WANG P J, ZHENG Y C, et al. Cloning and expression of MVD gene and its promoter in Jasminum sambac [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2019, 48(3): 309−315.(in Chinese)
[11] 陈笛, 陈雪津, 郭永春, 等. 茉莉花芳樟醇生物合成关键基因的克隆与表达分析[J]. 西北植物学报, 2019, 39(8): 1344−1352. CHEN D, CHEN X J, GUO Y C, et al. Cloning and expression analysis of JsNEL/LINS from Jasminum sambac[J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(8): 1344−1352.(in Chinese)
[12] 崔萌, 刘志钦, 叶乃兴, 等. 茉莉花香气相关基因JsGDS启动子的克隆及功能分析 [J]. 分子植物育种, 2021, 19(2):441−447. CUI M, LIU Z Q, YE N X, et al. Cloning and functional analysis of the aroma-related gene JsGDS promoter from Jasminum sambac [J]. Molecular Plant Breeding, 2021, 19(2): 441−447.(in Chinese)
[13] 陈桂信, 俞滢, 刘雨轩, 等. 茉莉香气释放相关基因分离及JsBEBT的克隆与表达分析 [J]. 分子植物育种, 2021, 19(20):6662−6670. CHEN G X, YU Y, LIU Y X, et al. Isolation of related genes cloning and expression analysis of JsBEBT in jasmine aroma [J]. Molecular Plant Breeding, 2021, 19(20): 6662−6670.(in Chinese)
[14] 陈笛, 郑玉成, 林浥, 等. 茉莉花MK基因及启动子克隆与表达分析 [J]. 分子植物育种, 2020, 18(3):772−779. CHEN D, ZHENG Y C, LIN Y, et al. Cloning and expression analysis of mevalonate kinase gene and its promoter from Jasminum sambac [J]. Molecular Plant Breeding, 2020, 18(3): 772−779.(in Chinese)
[15] 崔萌. 茉莉花香气合成相关基因JsGDS启动子的分离与活性分析[D]. 福州: 福建农林大学, 2020. CUI M. Isolation and activity analysis of promoter of JsGDS gene associated with aroma synthesis from Jasminum sambac[D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. (in Chinese)
[16] 孙君, 陈桂信, 叶乃兴, 等. 茉莉花香气相关基因JsDXS及其启动子的克隆与表达分析 [J]. 园艺学报, 2014, 41(6):1236−1244. SUN J, CHEN G X, YE N X, et al. Cloning and expression analysis of deoxyoxylulose-5-phosphate synthase gene related to aroma from Jasminum sambac and isolation of its promoter [J]. Acta Horticulturae Sinica, 2014, 41(6): 1236−1244.(in Chinese)
[17] 张月, 袁媛, 何弦, 等. 茉莉花JsMYB108和JsMYB305基因的克隆及其对TPS基因的激活作用 [J]. 热带作物学报, 2021, 42(6):1539−1548. DOI: 10.3969/j.issn.1000-2561.2021.06.005 ZHANG Y, YUAN Y, HE X, et al. Cloning of JsMYB108 and JsMYB305 and analysis of their activation on TPS gene in Jasminum sambac [J]. Chinese Journal of Tropical Crops, 2021, 42(6): 1539−1548.(in Chinese) DOI: 10.3969/j.issn.1000-2561.2021.06.005
[18] 张磊, 唐永凯, 李红霞, 等. 促进原核表达蛋白可溶性的研究进展 [J]. 中国生物工程杂志, 2021, 41(S1):138−149. ZHANG L, TANG Y K, LI H X, et al. Advances in promoting solubility of prokaryotic expressed proteins [J]. China Biotechnology, 2021, 41(S1): 138−149.(in Chinese)
[19] 邱淑彬, 荆韧威, 郭正隆, 等. 两种不同的原核表达载体蛋白表达及纯化的比较 [J]. 基因组学与应用生物学, 2020, 39(9):4136−4144. QIU S B, JING R W, GUO Z L, et al. Comparison of two different prokaryotic expression vectors in protein expression and purification [J]. Genomics and Applied Biology, 2020, 39(9): 4136−4144.(in Chinese)
[20] 黄传臻, 刘香利, 曹汝菲, 等. 小麦CWI-B1的原核表达、纯化与多克隆抗体制备 [J]. 农业生物技术学报, 2017, 25(7):1102−1110. HUANG C Z, LIU X L, CAO R F, et al. Prokaryotic expression, purification and preparation of polyclonal antibody for wheat (Triticum aestivum) CWI-B1 [J]. Journal of Agricultural Biotechnology, 2017, 25(7): 1102−1110.(in Chinese)
[21] 陈明, 陈文静. 几种微生物表达系统的比较 [J]. 安徽农学通报(上半月刊), 2011, 17(3):68−71. CHEN M, CHEN W J. Comparisons of some microbial expression systems [J]. Anhui Agricultural Science Bulletin, 2011, 17(3): 68−71.(in Chinese)
[22] 胡京蕊, 沈金宝, 李晶岚, 等. 拟南芥耐盐相关基因AtSTK原核表达载体的构建及表达 [J]. 华北农学报, 2013, 28(2):38−41. DOI: 10.3969/j.issn.1000-7091.2013.02.007 HU J R, SHEN J B, LI J L, et al. Prokaryotic expression vector construction and expression of tolerance related gene AtSTK in Arabidopsis [J]. Acta Agriculturae Boreali-Sinica, 2013, 28(2): 38−41.(in Chinese) DOI: 10.3969/j.issn.1000-7091.2013.02.007
[23] 孙伟, 任家鑫, 腾峰, 等. ZmAGO18b的原核表达载体的构建与表达 [J]. 基因组学与应用生物学, 2020, 39(12):5647−5651. SUN W, REN J X, TENG F, et al. Construction and expression of a prokaryotic expression vector of ZmAGO18b [J]. Genomics and Applied Biology, 2020, 39(12): 5647−5651.(in Chinese)
[24] HARPER S, SPEICHER D W. Purification of proteins fused to glutathione S-transferase [J]. Methods in Molecular Biology (Clifton, N J ), 2011, 681: 259−280.
[25] 朱炳森. 玉米转录因子ZmYY1、ZmYY2与RNA结合蛋白ZmRBM25互作调控ZmABR1表达的研究[D]. 泰安: 山东农业大学, 2020. ZHU B S. Maize transcription factors ZmYY1, ZmYY2 interact with RNA-binding protein ZmRBM25 to regulate ZmABR1 expression[D]. Taian: Shandong Agricultural University, 2020. (in Chinese)
[26] 王意程. 油菜素内酯调控红肉苹果类黄酮合成的机理研究[D]. 泰安: 山东农业大学, 2021. WANG Y C. Mechanism of brassinosteroid on regulation flavonoid biosynthesis in red-fleshed apple[D]. Taian: Shandong Agricultural University, 2021. (in Chinese)
[27] 赵杰, 王兵, 骆梅, 等. GST-pull down技术筛选毛白杨天冬氨酸蛋白酶PtoAED3互作蛋白 [J]. 北京林业大学学报, 2021, 43(5):64−74. DOI: 10.12171/j.1000-1522.20200365 ZHAO J, WANG B, LUO M, et al. Identification of aspartic acid protease PtoAED3-interacting proteins through GST pull-down assays in Populus tomentosa [J]. Journal of Beijing Forestry University, 2021, 43(5): 64−74.(in Chinese) DOI: 10.12171/j.1000-1522.20200365
[28] 窦万福, 祁静静, 胡安华, 等. GST pull-down联合LC-MS/MS筛选柑橘抗溃疡病转录因子CsBZIP40的互作蛋白 [J]. 中国农业科学, 2019, 52(13):2243−2255. DOI: 10.3864/j.issn.0578-1752.2019.13.005 DOU W F, QI J J, HU A H, et al. Screening of interacting proteins of anti-canker transcription factor CsBZIP40 in Citrus by GST pull-down combined with LC-MS/MS [J]. Scientia Agricultura Sinica, 2019, 52(13): 2243−2255.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2019.13.005
-
期刊类型引用(6)
1. 谢世斌,郑辉,沙洲,房琳琳,尼博,张慧,董雅琴,魏荣,崔进. 牛轮状病毒微滴式数字RT-PCR检测方法的建立及初步应用. 中国草食动物科学. 2025(01): 44-49 .  百度学术
百度学术
2. 王秀明,陈君彦,础鲁,刘艳霞. 1种牛轮状病毒Taq-Man荧光定量RT-PCR检测方法的建立. 现代畜牧兽医. 2025(03): 11-15 .  百度学术
百度学术
3. 白和平,张洪伟,刘旭,郭建军,史秋梅,王晓丹. 牛轮状病毒检测方法的研究进展. 中国兽医学报. 2024(04): 847-852 .  百度学术
百度学术
4. 李佳荣,罗宇航,潘艳. 1例牛肠道病毒的诊断与防治报告. 现代畜牧科技. 2024(10): 106-109 .  百度学术
百度学术
5. 孙绍美,李飞,李优英,柴俊,张以芳,郑锦玲. 云南省某牛场牛轮状病毒检测及遗传进化分析. 云南畜牧兽医. 2024(05): 16-20 .  百度学术
百度学术
6. 韩子阳,赵洋,唐欣如,张榕兰,冯静萱,王嘉羽,特木尔巴根,郭宇,武娅楠,张志丹,周伟光. 犊牛轮状病毒RT-LAMP检测方法的建立与应用. 当代畜禽养殖业. 2023(06): 7-12 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载: