Cloning and Expression of PsWRKY33 Promoter in Nane
-
摘要:目的 探讨油柰(Prunus salicina lindley)WRKY33
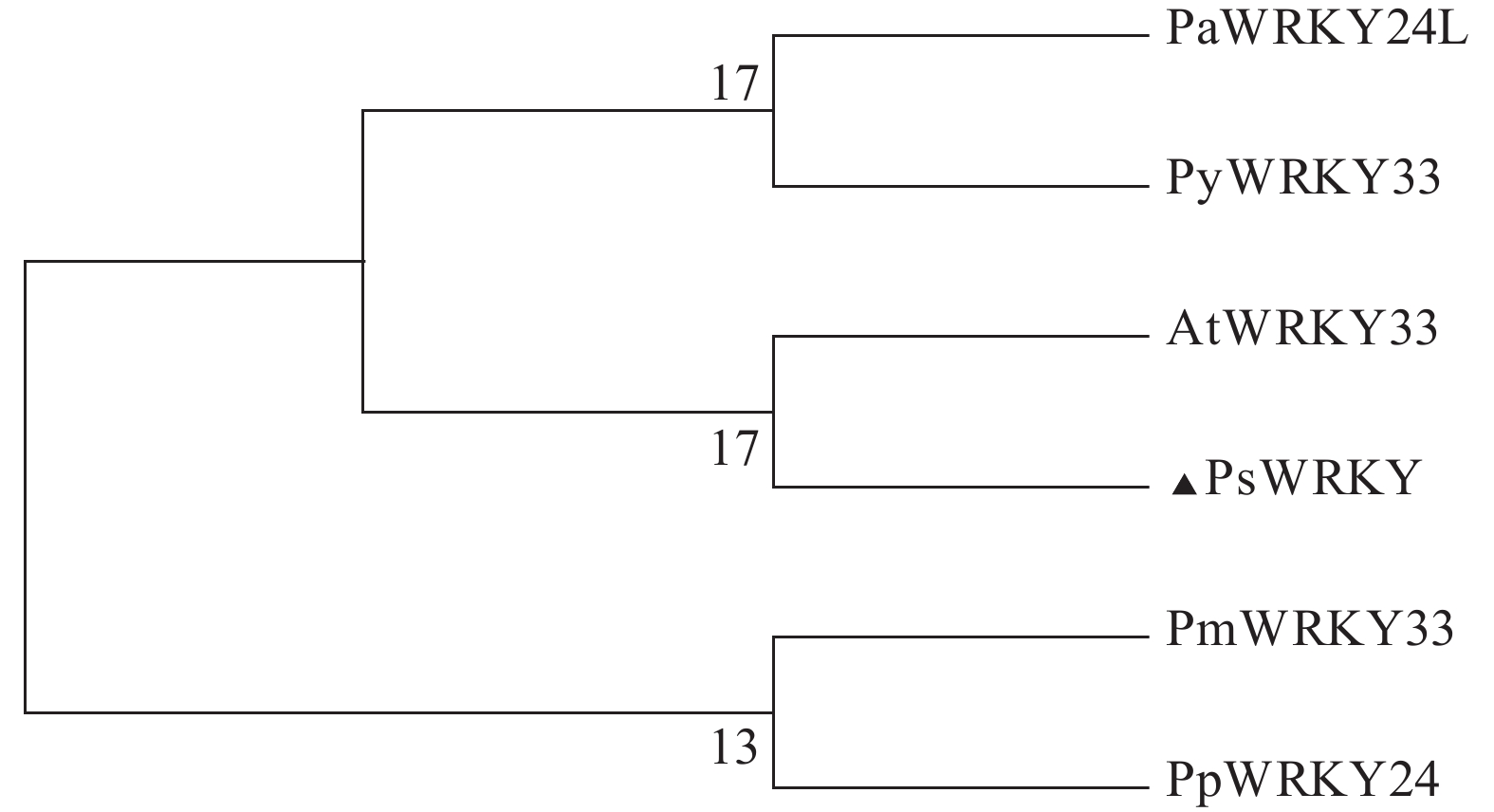
启动子在不同胁迫处理下的表达模式,为进一步深入研究油柰WRKY基因在油柰生长发育或抵御各种逆境胁迫中的作用机制等提供理论依据。 方法 利用MEGA 6.06软件构建PsWRKY33的系统进化树。通过染色体步移技术克隆获得该基因启动子序列,利用PlantCARE数据库分析预测PsWRKY335′端上游启动子区域的顺式作用元件。利用拟南芥浸花法获得转基因植株。通过对不同胁迫处理下的各片段转基因幼苗进行组织化学染色和GUS酶活性测定。 结果 系统进化树分析表明PsWRKY蛋白与拟南芥WRKY33亲缘关系最近,故将该基因命名为PsWRKY33。获得PsWRKY33 基因5′端上游启动子序列长度为1 872 bp,经预测分析发现该启动子区域含有ABRE、ARE、LTR、MYB和W-box等响应不同植物激素等顺式作用元件,基于此构建3个不同长度的缺失片段。对转基因植株不同组织GUS染色发现PsWRKY33 启动子主要表达在叶、花瓣和花序梗上,且随着片段的缺失其表达越低。在不同胁迫处理下,其GUS活性表达程度不同。在低温胁迫条件下,不同长度的PsWRKY33启动子片段均受到不同程度的诱导上调表达;而在SA胁迫下,各片段呈现出不同程度的诱导下调表达。 结论 PsWRKY33基因启动子可能参与调节油柰应答低温胁迫及外源激素SA的响应。 Abstract:Objective Expression of PsWRKY33promoter of Nane (Prunus salicina lindley) under stress was determined for a study on the mechanism of WRKY gene associated with the growth and stress-resistance of the plant. Method Unrooted phylogenetic tree representing relationships among protein sequences of PsWRKY33 was constructed using Nane and other plants through by MEGA 6.06 software. The promoter sequence was cloned by chromosome stepping technique. The cis-acting regulatory elements in the upstream promoter region at the 5′ end of PsWRKY33 were predicted according to the PlantCARE database. Transgenic plants were obtained by using the Arabidopsis immersion method. Histochemical staining and GUS enzyme activity were performed on the transgenic seedlings under different stresses.Result The phylogenetic tree analysis showed that the PsWRKY protein was most closely related to Arabidopsis WRKY33, thus the gene was named PsWRKY33. The 1 872 bp length of 5′ end upstream in PsWRKY33 was obtained, from Nane via genome walking technology. The promoter region contained motifs of hormones (ABRE and ARE) and biotic stresses (LTR, MYB, W-box, and other cis-acting elements). Then, the 3 5′-deletion fragments were constructed. The histochemical staining and GUS activity measurement showed that the full PsWRKY33 promoter fragment mainly expressed in leaves, petals, and peduncles, and its expression decreased with the loss of fragments. Under low temperature, the various fragments of PsWRKY33 promoter were upregulated, but downregulated under SA stress.ConclusionPsWRKY 33 might response to low temperature and exogenous hormone SA stress in Nane.-
Keywords:
- Prunus salicina /
-
PsWRKY33
- promoter /
- histochemical staining /
- stress
-
0. 引言
【研究意义】硅(Silicon,Si)在土壤中的含量高达26.4%[1],但主要以不可溶晶态硅存在,植物并不能吸收,只有少量可溶性单硅酸被植物吸收利用,含量在0.1~0.6 mmol·L−1[2]。硅是大多数植物生长发育的准必需元素,对农作物生长有益 [3]。硅能延缓功能叶早衰[4],提高光合色素含量和光合能力[5],促进干物质累积,提高作物产量和品质[6-8]。硅还能改变碳、氮和磷代谢相关基因[9]及激活防卫相关基因的表达,诱导感病作物产生抗毒物质如酚醛类和黄酮类等[10],以及抑制镉[11]和镍[12]等重金属的吸收累积,提高作物对病虫害和逆境的抵抗能力[13-15]。金线莲 Anoectochilus roxburghii(Wall.)Lindl.为兰科多年生草本珍稀草药,素有“药王”的美称,其主要活性药效成分是黄酮类和多糖类[16],具有清除自由基、抗氧化、消炎、增强免疫力等多种药效[17]。因人为过度采挖,加之生长缓慢,金线莲野生资源已十分匮乏,被列为国家二级保护珍稀植物,现已采用组培扩繁、人工大棚或林地仿野生栽植等方式生产金线莲。因生长慢、产量少,金线莲的市场售价高,然而人工生产的栽培期短和品种差异导致有效活性成分差异大、含量低等问题困扰和阻碍了金线莲产业的发展。因此,如何通过改变栽培措施提高金线莲产量和活性成分含量,一直是金线莲研究的热点[18, 19]。【前人研究进展】现有研究发现,硅对盐胁迫下甘草非药用部位茎和叶中总黄酮的积累有明显的促进作用,这种促进效应因硅浓度、胁迫时间和不同部位而异[20]。于涛等研究发现,水稻增施硅钙肥能显著提高各生育时期叶片总酚和类黄酮含量,能明显降低穗颈瘟的病穗率和病情指数[21]。何永美等发现,用UV-B辐射水稻两个品种后,其叶中硅的含量与总酚和类黄酮含量均呈极显著正相关[22],硅素有助于提高叶中酚类化合物合成关键酶PAL的活性和调控叶中的酚类化合物代谢[23]。杨开兴[24]利用沼液施肥可显著增加金线莲的叶绿素、总黄酮和多糖含量。栽培期长短以及不同栽培基质均会影响金线莲多糖和总氨基酸的累积[25],林下仿生种植的总黄酮含量显著高于大棚种植。【本研究切入点】施用硅是否也能提高金线莲的产量和品质,相关研究目前还未见报道。【拟解决的关键问题】本研究以福建红霞金线莲为材料,利用水培的方式,通过在培养液中施加不同浓度的硅,研究其对与营养生长、代谢生理有关的各项生理生化指标的影响,测定其药效成分总黄酮和多糖含量的变化,为名贵中药材金线莲的提质促产提供理论依据和高效栽培措施。
1. 材料与方法
1.1 材料试剂及主要仪器
福建红霞金线莲为福建闽鑫种业有限公司组培的商品瓶苗,硅素供体试剂为国药集团生产的Na2SiO3·9H2O,霍格兰营养液(青岛海博生物),芦丁对照标准品购于中国食品药品检定研究院(批号:100080−201811),葡萄糖等其他药品均为分析纯(国药集团)。
AUW220D十万分之一电子天平(日本岛津),Dualex4植物氮平衡指数测量仪(法国FORCE-A),Lambda35紫外可见分光光度计(PerkinElmer公司),HH-2(双列)电子数显恒温水浴锅(国华电器有限公司),KQ-2200超声波清洗器(上海锦玟仪器设备有限公司)。
1.2 试验方法
1.2.1 硅对金线莲生长的影响
瓶苗开盖驯化3 d,洗净根部用育苗海绵包裹苗根塞入定植篮中,植于增氧水培种植箱中,用10倍稀释霍格兰营养液作为基本培养液(pH 5.8)预培养2 d。每隔1 h用气泵为处理液定时充气15 min,培养温度(23±2) ℃,光照周期为14 h·d−1,光照强度为54 μmol·m−2·s−1。
1.2.2 硅处理
用Na2SiO3·9H2O和基本培养液配制含不同硅浓度的处理液(pH 5.8),选取生长一致的金线莲进行水培处理。试验共设6个浓度处理(0、0.175、0.350、0.525、0.700、0.875 mmol·L−1),每个处理30株,重复3次。处理液每2 d更换一次,培养条件同上。处理30 d后,测定与营养生长、代谢生理有关的相对生长率(R,Relative growth rate)、叶绿素含量、氮平衡指数(Nitrogen balance index,NBI)和过氧化物酶(Peroxidase,POD)活性,以及与其药效相关的总黄酮和多糖含量等各项生理生化指标。
1.2.3 相对生长率的测定
金线莲生长缓慢,为避免单株测量产生的系统误差,采用测定处理前后总鲜重(30株)变化的方法,计算出相对生长率(R),以此作为对比各处理对金线莲生长影响的指标。称量前用吸水纸吸干金线莲样品表面水分,用分析天平测定每处理(30株)的总鲜重。R计算公式如下:R=(m2−m1)/ m1×100%(m1为处理前总鲜重,m2为处理后总鲜重)。
1.2.4 氮素营养参数测定
每个处理每次随机选6株样株,重复3次,测定其+1叶(顶端第一片完全展开叶为+1叶,叶序依次向下递增)叶脉两侧中部两点氮平衡参数,参数包括叶绿素指数(Chl)、类黄酮指数(Flav)、花青素指数(Anth)和氮平衡指数(NBI)。
1.2.5 叶绿素含量测定
每个处理每次随机选6株样株,重复3次,取+1叶,剪碎后称得混合样0.20 g,采用95%乙醇提取叶绿素[26] ,利用分光光度计测定665 nm、649 nm波长下的吸光度A665和A649,根据下列公式分别计算叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl)的含量。
w(Chl a) = 13.95A665 — 6.88A649
w(Chl b) = 24.96wA649 — 7.32A665
w(Chl) = w(Chl a) + w(Chl b) = 6.63A665 + 18.08A649
1.2.6 过氧化物酶(POD)活性测定
每个处理每次随机选6株样株,重复3次,剪取并归集+1、+2、+3叶,各位叶每次取其鲜叶混合样0.1 g,利用愈创木酚-比色法[27] 测定各位叶的POD活性。
1.2.7 总黄酮和多糖提取测定
每个处理每次随机选6株样株,重复3次,全草105 ℃杀青30 min后,80 ℃干燥至恒重,粉碎后过60目筛备用,总黄酮和多糖含量采用张志信等[28]优化后的方法进行测定。
1.2.8 数据处理与分析
数据用Excel 2013整理和制表绘图,用SPSS 22.0 对数据进行统计分析,采用单因素方差分析和Duncan法进行多重比较分析(α=0.05和α=0.01),数据为平均值±标准偏差。
2. 结果与分析
2.1 硅对金线莲生长的影响
由图1可见,各处理相对生长率均比对照高,相对生长率(R)总体呈先升后降的趋势,各处理均显著高于对照(P<0.01)。0.175和0.700 mmol·L−1的硅处理效果最佳,R值显著高于对照和其他处理(P<0.05),对金线莲的生长促进作用更强;而高浓度0.875 mmol·L−1的硅对金线莲的促生作用最弱,但依然显著好于对照(P<0.01)。
![]() 图 1 不同浓度硅处理对金线莲相对生长率的影响图中不同大、小写字母分别表示处理间的差异达显著水平P<0.01或P<0.05,下图同。Figure 1. Effect of silicon at varied concentrations on relative growth rate of A. roxburghiiData with different capital and lowercase letters mean significant difference at P<0.01 and P<0.05, respectively. Same for following figures.
图 1 不同浓度硅处理对金线莲相对生长率的影响图中不同大、小写字母分别表示处理间的差异达显著水平P<0.01或P<0.05,下图同。Figure 1. Effect of silicon at varied concentrations on relative growth rate of A. roxburghiiData with different capital and lowercase letters mean significant difference at P<0.01 and P<0.05, respectively. Same for following figures.2.2 硅对金线莲叶片叶绿素含量的影响
从图2可以看出,处理对叶绿素a含量的影响大,其含量呈现先升后降趋势;对叶绿素b影响不明显;叶绿素总含量的变化趋势和叶绿素a相似,各处理组均高于对照。叶绿素总含量在0.525 mmol·L−1处理时达最大值,较对照高33.66%(P<0.01);处理浓度增大到0.700 mmol·L−1时含量不增反降,但依然高于对照(P<0.01);处理浓度增大到0.875 mmol·L−1时,总含量依然高于对照值,但差异不显著。由此可见,0.525 mmol·L−1的硅对金线莲的光合生长更有益,0.875 mmol·L−1的硅则无明显益处。
2.3 硅对金线莲氮素营养的影响
NBI反映作物早期氮素营养状况和长势,可快速测定并预测其产量。结果表明,硅处理后金线莲+1叶的NBI和Chl指数值均呈先增后减的趋势(见表1),而Flav值的变化则相反。在0.175 mmol·L−1处理后,Chl值较对照高11.71%(P<0.01),NBI值较对照高18.43%(P<0.05),Flav值较对照低,但差异不显著。当处理浓度为0.525 mmol·L−1时,NBI和Chl值最大,分别较对照高66.87%和24.70%,差异均达极显著水平(P<0.01);Flav值较对照低22.73%(P<0.01)。当浓度≥0.700 mmol·L−1时,NBI和Chl值均显著低于对照值(P<0.05);Flav值则显著高于对照(P<0.05)。硅对Anth值无影响。由此可见,金线莲对低浓度(0.175mmol·L−1)硅处理即可快速响应,当处理浓度为0.525 mmol·L−1时,金线莲的氮素营养状况达到最佳,氮素营养吸收利用好,极大地促进叶绿素的合成;但浓度增大后(≥0.700 mmol·L−1),金线莲的氮素营养状况出现异常变化,可能偏向次生代谢物质的累积,促进了总黄酮等其他成分的合成和累积。
表 1 不同浓度硅处理对金线莲氮平衡指数的影响Table 1. Effect of silicon application at varied concentrations on NBI of A. roxburghii硅Si/(mmol·L−1) 叶绿素指数Chl 类黄酮指数Flav 花青素指数Anth 氮平衡指数NBI 0 29.0±1.2 Cc 0.22±0.04 BCb 0.08±0.01 a 133.4±25.1 CDcd 0.175 32.4±5.3 Bb 0.21±0.03 Cbc 0.08±0.01 a 158.0±49.9 BCbc 0.350 34.6±3.2 ABa 0.20±0.03 Cc 0.08±0.01 a 175.2±26.9 Bb 0.525 36.2±4.4 Aa 0.17±0.02 Dd 0.08±0.00 a 222.5±46.9 Aa 0.700 26.3±2.3 CDd 0.25±0.04 ABa 0.08±0.01 a 107.7±10.6 Ee 0.875 24.7±1.6 Dd 0.26±0.05 Aa 0.08±0.01 a 99.8±20.7 Ee 数据以平均值±标准偏差表示(n=3),同列不同大、小写字母分别表示处理间差异达极显著(P<0.01)或显著水平(P<0.05)。表2同。 Data are presented as mean±SD (n = 3); those with different capital and lowercase letters on same column mean significant difference at P<0.01 and P<0.05, respectively. Same for Table 2. 2.4 硅对金线莲叶片POD酶活性的影响
图3可见,测定金线莲POD酶活的最佳反应时段应控制在120 s内。POD酶在植物体内普遍存在且活性较高的一种抗氧化保护酶类,它可以清除植物体内的过氧化氢,对环境因子变化十分敏感,测定其活性可反映植物体内的代谢变化,是研究植物生理变化非常重要的指标。试验结果发现(见表2),对照组+1叶的POD酶活分别较+2叶和+3叶高68.87%和31.78%,表明新叶的抗氧化生理活性高于老叶。各处理组+1、+2和+3叶POD酶活较对照均有提高,表明硅处理增强了金线莲的抗氧化能力。POD酶活随处理浓度的增大呈现出双峰态势,在处理浓度为0.175 mmol·L−1和0.700 mmol·L−1时,各叶酶活均处于较高峰值,均显著高于对照组(P<0.01),各叶值大小均为+1>+3>+2叶。0.175 mmol·L−1处理组+1叶、+2叶和+3叶中POD酶活分别比对照高179.41%、231.13%和191.97%, 对其各叶抗氧化能力影响的大小为+2>+3>+1叶。0.700 mmol·L−1处理组+1、+2和+3叶中POD酶活性分别比对照高179.80%、210.60%和155.30%,抗氧化能力影响大小是+2叶>+1叶>+3叶。可见,硅处理对+2叶的抗氧化能力影响大。
表 2 不同浓度硅处理对金线莲不同叶位叶片POD酶活的影响Table 2. Effect of silicon application at varied concentrations on peroxidase activity in differently located leaves on an A. roxburghii plant硅Si/(mmol·L−1) +1 叶+1 leaf/(U·g−1) +2叶+2 leaf/(U·g−1) +3叶+3 leaf/(U·g−1) 0 510±66 Bc 302±8 Cd 387±68 Bb 0.175 1425±268 Aa 1000±103 Aa 1157±212 Aa 0.350 688±33 Bbc 528±138 BCc 577±53 Bb 0.525 950±233 Bb 745±120 ABbc 622±63 Bb 0.700 1427±189 Aa 938±164 Aab 988±258 Aa 0.875 923±163 Bb 750±140 ABbc 628±25 Bb 2.5 硅对金线莲多糖的影响
根据葡萄糖标准曲线(见图4)计算各处理样品中的多糖含量(以葡萄糖计)(见图5)。当硅浓度为0.175~0.525 mmol·L−1时,金线莲多糖含量呈下降趋势,显著低于对照值(P<0.05、0.01);当处理浓度增大到0.700 mmol·L−1时,多糖含量达到最高水平,是对照的2倍以上(P<0.05、0.01);继续增大到0.875 mmol·L−1时,多糖含量反而下降,但依然比对照高41.94%,差异显著(P<0.05、0.01)。由此可见,高浓度硅能提高金线莲的多糖含量,0.700 mmol·L−1硅处理对多糖累积效果最佳。
2.6 硅对金线莲总黄酮的影响
根据芦丁标准曲线(见图6)计算各处理样品中的总黄酮含量(以芦丁计)(见图7)。硅处理对金线莲总黄酮含量的影响变化与多糖较为相似。0.175~0.525 mmol·L−1处理时,金线莲的总黄酮含量也呈下降趋势,显著低于对照(P<0.05);浓度增大到0.700 mmol·L−1时,金线莲的总黄酮含量达到最高,比对照高71.45%(P<0.01);继续增大处理浓度到0.875 mmol·L−1时,总黄酮含量反而大幅下降,且低于对照,但差异不显著。由此可见,0.700 mmol·L−1硅处理最益于提高金线莲总黄酮含量,高浓度(≥0.875 mmol·L−1)处理反而会降低。
3. 讨论
单子叶植物大都属高硅累积植物(喜硅植物),其叶片的硅含量显著高于双子叶植物[29],施硅对其生长有利;金线莲也是单子叶植物,试验表明适宜浓度的硅对金线莲的生长也有益,但金线莲是否也属于高硅累积植物,还需通过测定其体内硅的含量来确定。浓度处理对比发现,0.175~0.700 mmol·L−1处理较0.875 mmol·L−1处理对鲜重增长效果更好,总叶绿素含量呈先升后降趋势,以及氮素营养吸收利用(NBI)也表现出低促高抑现象,硅对这三者的影响表现出一致性,表明低浓度硅较高浓度硅对金线莲生长更有益。已有研究认为低浓度硅会提高植物对N、P、K、Ca、Mg、Fe、Mn、Cu、Zn等元素的吸收利用,而高浓度硅会抑制磷、钙、镁等营养离子的吸收和利用[30]。0.525 mmol·L−1浓度硅处理后,总叶绿素含量、Chl值和NBI值均达最高值,表明该处理的金线莲对氮素营养吸收利用最好,能促进叶绿素合成并提高含量。已有研究发现,适量硅可促进植物氮素营养吸收、氨基酸(如L-谷氨酸)合成和原叶绿素酸酯及叶绿素的形成,能显著提高水稻、甘蔗和番茄的叶绿素总含量[31],还能使叶绿体片层结构和基粒增多,提高光合同化能力和增加物质累积[32]。
试验发现,硅对金线莲叶绿素总含量和NBI指数的影响变化趋势是一致的,符合李振海等[33]关于利用氮平衡指数建模估测叶绿素质量分数,具有较好精度的论断,可通过测定NBI指数实现叶绿素含量的快速及无损监测和估算。棉花叶片NBI值和Chl 值的变化与叶片全氮含量呈极显著正相关关系[34],NBI、Chl可作为作物氮素营养状况变化的快速诊断指标。因此,在金线莲栽培生产中,是否也可通过测定NBI和Chl值早期判断其氮素营养和生长状态值得进一步研究和探讨。
试验中发现,金线莲+1叶中的POD酶活性分别均较+2叶和+3叶的高,这可能与+1叶正处于发育成熟初期有关,因为POD也是木质素单体合成的关键酶,其活性在开始成熟或老化组织中活性较高, POD活性的增强亦可作为植物细胞和组织逐步成熟或衰老的一种生理指示。0.175 mmol·L−1的硅处理时,金线莲氮代谢及营养生长旺盛,增强POD酶活性有利于清除体内过多的自由基;另一个峰值出现在0.700 mmol·L−1处理, POD酶活性提高可能与酚类(类黄酮)和多糖等次生代谢物质的合成有关,因为POD不仅是植物酶促防御系统中的关键酶,作为代谢调节因子还参与酚类(类黄酮)物质及植保素的合成。现有研究发现,硅素营养与水稻叶片酚类化合物代谢存在密切联系;水稻在缺硅条件下,叶中的苯丙氨酸解氨酶(Phenylalanine Ammonia-lyase,PAL)活性和酚类化合物含量均极显著下降[35],而PAL正是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢的酶,是酚类化合物代谢的关键酶和限速酶;硅素能在水稻叶上大量沉积,有助于提高叶片酚类化合物合成关键酶PAL的活性,以及调节4一香豆酸辅酶A连接酶(4CL)的活性及其编码基因的表达,促进水稻叶酚类化合物的合成[23]。试验结果也表明,0.700 mmol·L−1浓度处理能显著增加金线莲的总黄酮和多糖含量,且0.700 mmol·L−1的浓度优于0.875 mmol·L−1。
综上所述,施用适量的硅对金线莲水培是有益的。硅浓度为0.525 mmol·L−1时促进金线莲氮素营养吸收利用和光合机能,相对生长率最高,适用于营养生长;0.700 mmol·L−1硅处理使金线莲总黄酮和多糖含量最高,对提高其药用品质有益。今后,可进一步研究在金线莲不同栽培模式下进行硅处理和延长处理时间,对其不同器官中药效成分累积的影响,以及施硅对其抗病抗逆性的影响等方面开展研究,为金线莲的提质促产提供切实有效的栽培技术措施和科学的理论依据。
-
图 2 PsWRKY33
基因启动子序列 注:-60表示ATG上游60个核苷酸。红色粗体字母加框表示预测的顺式作用元件序列。pPsWRKY33、P1、P2、P3加箭头加黑色下划线表示为4个片段(−1 872、−852、−357和−271 bp)的特异性引物,箭头表示它们的方向。
Figure 2. Cis-elements of PsWRKY33 promoter
Note: -60 represented the 60 nucleotides upstream of the ATG. Bold red letters with boxes indicated the predicted sequence of cis-acting elements. pPsWRKY33, P1, P2 and P3 add arrows and black underlines represented the specific primers of four fragments (−1 872, −852, −357 and −271 bp), the arrows indicated their direction.
图 3 PsWRKY33
启动子各片段的GUS载体 注:不同启动子区域的数目表示PsWRKY33翻译起始ATG密码子上游的核苷酸位置。attR1和attR2限制性位点:将pDMC163载体中的CaMV35S启动子替换为PsWRKY33启动子片段。LB和RB:代表T-DNA的左右边缘;Hyg:潮霉素标记基因;GUSA:GUS基因编码区域。黄色的条形图代表PsWRKY33::GUS、PsWRKY33-P1::GUS、PsWRKY33-P2::GUS和PsWRKY33-P3::GUS结构的-1 872 bp、-852 bp、-357 bp和-271 bp PsWRKY33启动子片段。
Figure 3. Schematic diagram of GUS vector of individual PsWRKY33 promoter fragments
Note: The number of different promoter regions represents the nucleotide position upstream of the PsWRKY33 translation initiation ATG codon. The CaMV35S promoter in pDMC163 vector was replaced by PsWRKY33 promoter fragment by attR1 and attR2 restriction sites. LB and RB represent the left and right edges of T-DNA; Hyg, hygromycin B marker gene; GUS is the region that codes for the GUS gene. The yellow bars represent the -1 872 bp, -852 bp, -357 bp and -271 bp PsWRKY33 promoter fragments of PsWRKY33::GUS, PsWRKY33-P1::GUS, PsWRKY33-P2::GUS and PsWRKY33-P3::GUS, respectively.
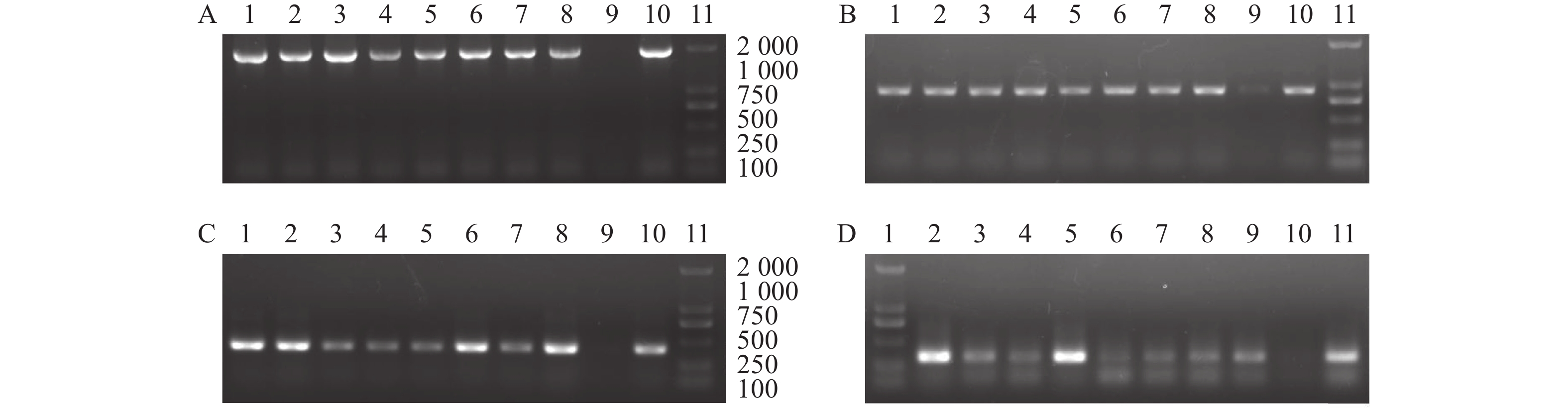
图 4 PCR检测T2代转基因植株
注:A~D分别为pPsWRKY33、pPsWRKY33-P1、pPsWRKY33-P2和pPsWRKY33-P3转基因植株的PCR检测结果。1~8分为pPsWRKY33、pPsWRKY33-P1、pPsWRKY33-P2和pPsWRKY33-P3 8个转基因植株;9为质粒;10为野生型;11为DL 2 000 DNA maker。
Figure 4. Detectioned of transgenic Arabidopsis T2 plants by PCR
Note: A-D: PCR analysis on pPsWRKY33, pPsWRKY33-P1, pPsWRKY33-P2, and pPsWRKY33-P3 transgenic Arabidopsis, respectively; 1-8: 8 strains of pPsWRKY33, pPsWRKY33-P1, pPsWRKY33-P2, and pPsWRKY33-P3 transgenic Arabidopsis, respectively; 9: plasmid; 10: wild type; 11: DNA maker DL 2 000.
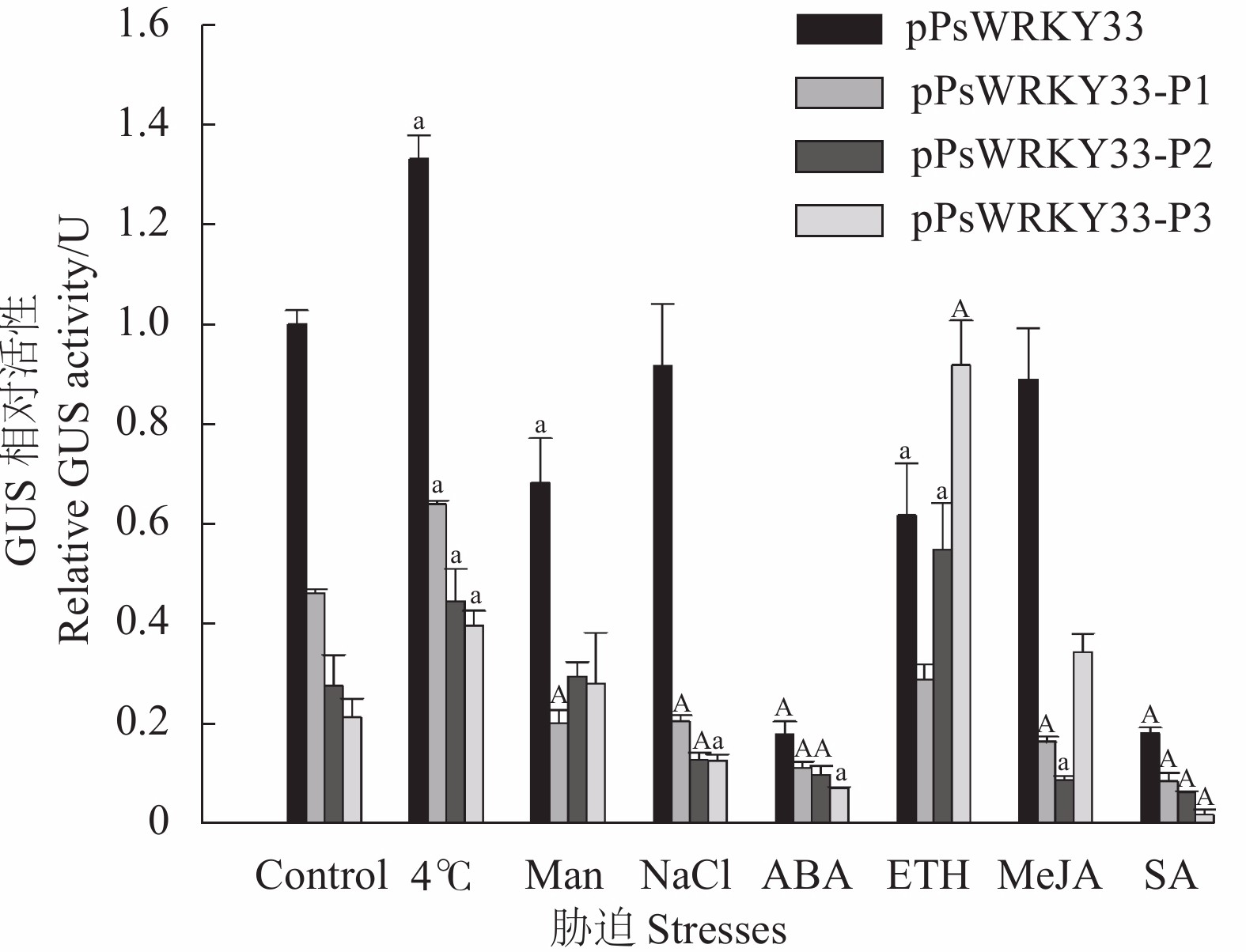
图 7 转基因拟南芥在不同胁迫处理下的GUS相对活性
注:图中不同大、小写字母表示同一处理达极显著(P<0.01)、显著(P<0.05)差异。
Figure 7. GUS relative activity in transgenic Arabidopsis under different stresses
Note: Different uppercase and lowercase letters indicate highly significant (P<0.01) and significant (P<0.05) differences in the same treatment .
表 1 引物序列
Table 1 Sequences of primers
引物名称 Primer name 引物序列(5′-3′) Sequence of primers(5′-3′) PsWRKY33-GSPA GCGAAGTAAGAAGAGGGAGAAACGGAG PsWRKY33-GSPB TGTTGGTGCTGGGGTCTTCATCTG PsWRKY33-GSPC CGAGAAAGTGAAGGTTGGGTGTGAA pPsWRKY33-F GGGGACAAGTTTGTACAAAAAAGCAGGCTTCGAAGTTCTGCCTTGTTTGCT pPsWRKY33-P1-F GGGGACAAGTTTGTACAAAAAAGCAGGCTTCTGATCGAATTTTTTTTTCATA pPsWRKY33-P2-F GGGGACAAGTTTGTACAAAAAAGCAGGCTTCATTATATTGGTTTACATACA pPsWRKY33-P3-F GGGGACAAGTTTGTACAAAAAAGCAGGCTTCAAACCCACGAGCTTTGACCA pPsWRKY33-R GGGGACCACTTTGTACAAGAAAGCTGGGTCAAAGGGGGGGAGAGAGAGAG -
[1] 贾丽. 福建省柰、李、桃种质资源的ISSR分子分析[D]. 福州: 福建农林大学, 2009. JIA L. ISSR analysis of germplasm resources of prunus[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese)
[2] 王连延. 福建省古田县果树的霜冻灾害 [J]. 落叶果树, 2012, 44(3):48−49. DOI: 10.3969/j.issn.1002-2910.2012.03.025 WANG L Y. Frost disaster of fruit trees in Gutian County, Fujian Province [J]. Deciduous Fruits, 2012, 44(3): 48−49.(in Chinese) DOI: 10.3969/j.issn.1002-2910.2012.03.025
[3] ZHU J K. Abiotic stress signaling and responses in plants [J]. Cell, 2016, 167(2): 313−324. DOI: 10.1016/j.cell.2016.08.029
[4] 钟新华. 油柰低产成因及改造技术调查 [J]. 福建果树, 1999(4):24−25. ZHONG X H. Investigation of genesis and transformation technology of lower yield in Oil Nai [J]. Fujian Fruits, 1999(4): 24−25.(in Chinese)
[5] BANERJEE A, ROYCHOUDHURY A. WRKY proteins: Signaling and regulation of expression during abiotic stress responses [J]. The Scientific World Journal, 2015, 2015: 807560.
[6] PHUKAN U J, JEENA G S, SHUKLA R K. WRKY transcription factors: Molecular regulation and stress responses in plants [J]. Frontiers in Plant Science, 2016, 7: 760.
[7] JIANG J J, MA S H, YE N H, et al. WRKY transcription factors in plant responses to stresses [J]. Journal of Integrative Plant Biology, 2017, 59(2): 86−101. DOI: 10.1111/jipb.12513
[8] 相立, 赵蕾, 王玫, 等. 苹果MdWRKY74的克隆和功能分析[J/OL]. 园艺学报, 2021: 1-11 [2021-05-18]. http://kns.cnki.net/kcms/detail/11.1924.s.20210518.1046.002.html. XIANG L, ZHAO L, WANG M, et al. Cloning and functional analysis of MdWRKY74 in apple [J/OL]. Acta Horticulturae Sinica, 2021: 1-11. [2021-05-18]. http://kns.cnki.net/kcms/detail/11.1924.s.20210518.1046.002.html. (in Chinese)
[9] LI S J, FU Q T, CHEN L G, et al. Arabidopsis thaliana WRKY25, WRKY26, and WRKY33 coordinate induction of plant thermotolerance [J]. Planta, 2011, 233(6): 1237−1252. DOI: 10.1007/s00425-011-1375-2
[10] HE G H, XU J Y, WANG Y X, et al. Drought-responsive WRKY transcription factor genes TaWRKY1 and TaWRKY33 from wheat confer drought and/or heat resistance in Arabidopsis [J]. BMC Plant Biology, 2016, 16(1): 116. DOI: 10.1186/s12870-016-0806-4
[11] LI Z, LIANG F P, ZHANG T B, et al. Enhanced tolerance to drought stress resulting from Caragana korshinskii CkWRKY33 in transgenic Arabidopsis thaliana [J]. BMC Genomic Data, 2021, 22(1): 11. DOI: 10.1186/s12863-021-00965-4
[12] 张锦锦. MsWRKY33转录因子调控紫花苜蓿耐盐性的功能研究[D]. 北京: 中国农业科学院, 2021. ZHANG J J. The study on the function of MsWRKY33 transcription factor in regulating salt tolerance of Medicago sativa. L[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. (in Chinese)
[13] SUN X M, ZHANG L L, WONG D C J, et al. The ethylene response factor VaERF092 from Amur grape regulates the transcription factor VaWRKY33, improving cold tolerance [J]. The Plant Journal:for Cell and Molecular Biology, 2019, 99(5): 988−1002.
[14] 陈永萍, 林金辉, 刘志钦, 等. 油柰PsWRKY22基因启动子的克隆与功能鉴定 [J]. 分子植物育种, 2021, 19(9):2837−2845. CHEN Y P, LIN J H, LIU Z Q, et al. Cloning and functional identification of promoter of PsWRKY22 gene in Nai [J]. Molecular Plant Breeding, 2021, 19(9): 2837−2845.(in Chinese)
[15] 蒋琦, 高广春, 吴霁蓂, 等. WRKY转录因子调控植物次生代谢的研究进展[J/OL]. 分子植物育种, 2021: 1-8 [2021-12-03]. http://kns.cnki.net/kcms/detail/46.1068.S.20211201.1439.006.html. JIANG Q, GAO G C, WU J M, et al. Research progress of WRKY transcription factor regulating plant secondary metabolism [J/OL]. Molecular Plant Breeding, 2021: 1-8 [2021-12-03]. http://kns.cnki.net/kcms/detail/46.1068.S.20211201.1439.006.html. (in Chinese)
[16] 张凡, 尹俊龙, 郭瑛琪, 等. WRKY转录因子的研究进展 [J]. 生物技术通报, 2018, 34(1):40−48. ZHANG F, YIN J L, GUO Y Q, et al. Research advances on WRKY transcription factors [J]. Biotechnology Bulletin, 2018, 34(1): 40−48.(in Chinese)
[17] 王雪, 王盛昊, 于冰. 转录因子和启动子互作分析技术及其在植物应答逆境胁迫中的研究进展 [J]. 中国农学通报, 2021, 37(33):112−119. DOI: 10.11924/j.issn.1000-6850.casb2021-0563 WANG X, WANG S H, YU B. Interaction analysis of transcription factors and promoters and its application in response of plants to stress [J]. Chinese Agricultural Science Bulletin, 2021, 37(33): 112−119.(in Chinese) DOI: 10.11924/j.issn.1000-6850.casb2021-0563
[18] 杨晓娜, 赵昶灵, 李云, 等. 启动子序列克隆和功能分析方法的研究进展 [J]. 云南农业大学学报(自然科学版), 2010, 25(2):283−290. YANG X N, ZHAO C L, LI Y, et al. Research advances in the methods of cloning and function-analyzing of promoters [J]. Journal of Yunnan Agricultural University (Natural Science), 2010, 25(2): 283−290.(in Chinese)
[19] 蔡韡韡. 水杨酸诱导下(木奈)抗性相关基因的分离与表达研究[D]. 福州: 福建农林大学, 2016. CAI W W. Isolation and expression of resistance-associated genes under induction of salicylic acid in (Prunus salicina lindli. var cordata J. Y. Zhang et al.)[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016. (in Chinese)
[20] 高永峰, 杨丰铭, 李琴中, 等. 番茄SlWRKY31基因启动子的克隆与逆境应答模式分析 [J]. 西北植物学报, 2018, 38(12):2155−2164. GAO Y F, YANG F M, LI Q Z, et al. Cloning and analysis of stress response pattern of SlWRKY31 gene promoter from tomato [J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(12): 2155−2164.(in Chinese)
[21] 刘志钦, 杨晟, 蔡金森, 等. 辣椒CaWRKY5启动子的分离及其调控元件分析 [J]. 应用与环境生物学报, 2013, 19(3):389−394. DOI: 10.3724/SP.J.1145.2013.00389 LIU Z Q, YANG S, CAI J S, et al. Isolation and Cis-acting analysis of the CaWRKY5 promoter in pepper [J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(3): 389−394.(in Chinese) DOI: 10.3724/SP.J.1145.2013.00389
[22] 杨鹏芳, 段国琴, 胡晓炜, 等. 高等植物启动子研究概述 [J]. 分子植物育种, 2018, 16(5):1482−1493. YANG P F, DUAN G Q, HU X W, et al. Overview of higher plant promoters research [J]. Molecular Plant Breeding, 2018, 16(5): 1482−1493.(in Chinese)
[23] JUNG H W, KIM K D, HWANG B K. Identification of pathogen-responsive regions in the promoter of a pepper lipid transfer protein gene (CALTPI) and the enhanced resistance of the CALTPI transgenic Arabidopsis against pathogen and environmental stresses [J]. Planta, 2005, 221(3): 361−373. DOI: 10.1007/s00425-004-1461-9
[24] RUSHTON P J, REINSTÄDLER A, LIPKA V, et al. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling [J]. The Plant Cell, 2002, 14(4): 749−762. DOI: 10.1105/tpc.010412
-
期刊类型引用(3)
1. 陈玮,甘志凯,谌希. 硒与AM真菌对金线莲微量元素吸收及相关药用品质的影响. 山东农业科学. 2025(01): 87-95 .  百度学术
百度学术
2. 张闻婷,梅瑜,王继华. 珍稀药用植物金线莲研究现状与展望. 中国农学通报. 2024(05): 16-26 .  百度学术
百度学术
3. 危青泉. 林下仿野生栽培密度和采收期对金线莲种植的影响. 绿色科技. 2023(05): 79-82 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载: