Changes in Cell Structure and Gene Expression of Lily Leaves with Necrosis
-
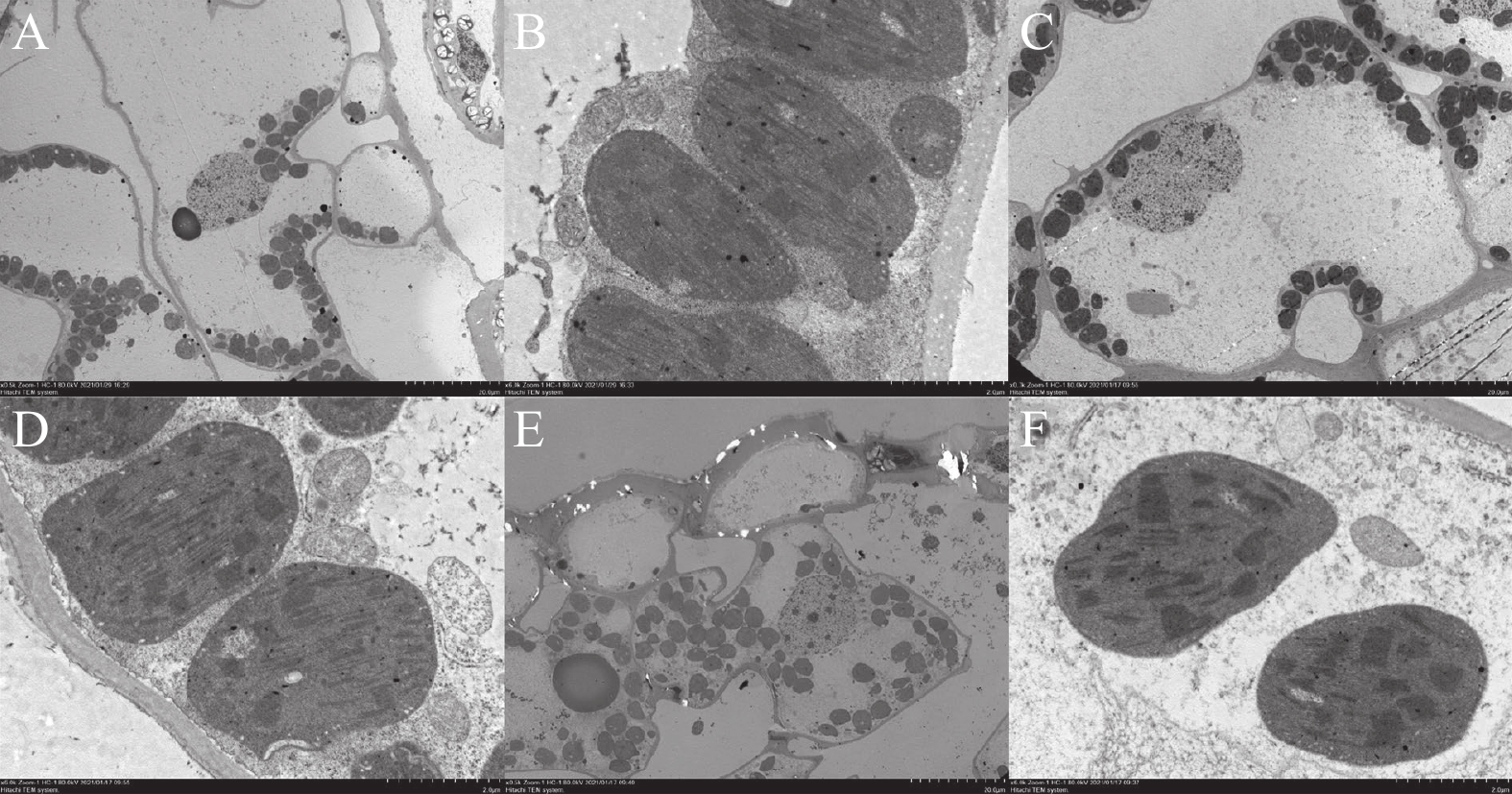
摘要:目的 明确百合叶烧病发病过程中百合叶片细胞结构的变化,探究百合叶烧病发病的分子调控机理。方法 通过扫描电镜和透射电镜观察东方百合Tarrango正常叶片、轻度叶烧叶片和重度叶烧叶片超微结构。并通过比较东方百合Tarrango正常叶片、叶烧叶片、正常叶片喷钙和叶烧叶片喷钙4种处理的转录组测序数据,对差异表达基因进行序列对比和分类分析。结果 百合叶片近轴面表皮细胞大小随叶烧程度的加深而减小,而液泡失水是导致表皮细胞体积缩小的原因。转录组测序共获得349 537条unigenes,平均长度为513.25 bp。124 405条unigenes获得注释,占unigenes总数的35.59%。共发现7 185个差异表达基因,包括5 860个特异差异表达基因和1 325个共同差异表达基因。KEGG富集分析显示,“代谢途径”“丙酮酸代谢”“次生代谢产物的生物合成”和“光合作用生物的碳固定作用”的基因在4组试验处理都有富集。百合叶烧病发病过程中显著下调基因有FOLK、PLD1_2、ATPeF1B 和KCS、CALM、ENO和pel等;而在叶烧叶片喷钙后,表达量上调的基因有CALM、CPK、EIN2、AUX1、PLD1_2和SORD等。结论 缺钙是导致百合叶烧病的重要因素,由缺钙引起的液泡失水和细胞皱缩等病害表征可能受脱落酸、乙烯和生长素等激素调控。Abstract:Objective Changes in the cell structure and gene expression of leaf caused by the pathogenesis of lily upper leaf necrosis (ULN) were studied to understand the molecular mechanism of the disease on Oriental Lily Tarrango (Lilium tarrango) .Methods Ultrastructure of the leaves from normal as well as mildly and severely ULN-infected lily plants was examined under a scanning electron microscope (SEM) and a projection electron microscope (TEM). Transcriptome sequences of the leaf specimens with or without calcium spraying were compared to identify the differentially expressed genes.Result The size of epidermal cells on the adaxial leaf surface shrank as the ULN worsened with vacuolar water loss. A total of 7 185 differentially expressed genes were identified that included 5 860 specific and 1 325 common differentially expressed genes. The KEGG enrichment analysis showed that the genes were enriched in the metabolic pathways, pyruvate metabolism, biosynthesis of secondary metabolites, and carbon fixation of photosynthetic organisms in all 4 groups of specimens with or without calcium spraying. FOLK, PLD1_2, ATPeF1B, KCS, CALM, ENO, and pel were significantly downregulated during the progress of ULN on the leaves. After the calcium spraying, CALM, CPK, EIN2, AUX1, PLD1_2, and SORD were upregulated.Conclusion Calcium deficiency was deemed to be the key factor that led to ULN on the lily plants. The deficiency produced the symptoms, such as vacuolar moisture loss and cellular shrinkage, might be regulated by the hormone metabolisms related to abscisic acid, ethylene, and auxin.
-
0. 引言
【研究意义】近年来,兔肉作为“三高三低”的保健肉,越来越受到人们的青睐,其消费市场逐渐拓展,市场潜力大。福建白兔属小型肉用地方兔,2014年通过了国家畜禽遗传资源专家委员会认定[1],2015年列入福建省畜禽遗传资源保护名录和中国畜禽遗传资源志,其全身披白色毛,具有适应性广、繁殖性能好、肉质优异等优点[2],是中国地方优良兔品种。与大种肉兔相比,其肌肉营养成分高(肌肉粗蛋白含量高),肉质鲜嫩(肌纤维面积小,肌内脂肪含量高)[3-4]。福建白兔耐粗饲、易饲养、价格高,近年来该品种受到农业农村部和福建省农业部门的重视,福建白兔的养殖户和养殖企业逐渐增多,养殖量不断增多,但其饲养方式主要是采取限制饲养。自由采食,幼兔消化道疾病发生率和死亡率高,适宜的家兔饲料添加剂可以让家兔自由采食的同时保证较高的成活率。【前人研究进展】大蒜素(Allicin)是以大蒜鳞茎为原料提取的产品,也可化工合成。动物饲料中使用的大蒜素一般是由合成的大蒜油为原料制成的预混料,具有清除自由基和抗氧化[5]、增强机体免疫力[6]等功能,可改善饲料的适口性、提高采食量、促进动物生长发育、提高生产性能[7]、减少动物患病率[8],倍受养殖行业的青睐。纳豆芽孢杆菌(Bacillus natto,BN),属枯草芽孢杆菌纳豆菌亚种,革兰阳性菌,只具有单层细胞外膜,是一类好氧型、内生抗逆孢子的杆状细菌,具有广谱抗菌活性[9]和极强的抗逆能力[10];可以调节肠道菌群,增强动物细胞免疫反应[11],并能生成多种蛋白酶、糖化酶、脂肪酶等,降解植物性饲料中的碳水化合物,提高饲料的转化率。陈兵等[12]研究发现日粮中添加200 mg·kg−1的纳豆芽孢杆菌可以提高肉鸡的平均日增重、日采食量。在推行无抗饲养的大环境下,纳豆菌作为益生菌既能提高动物免疫力,又不会出现耐药性等不利影响,是环境友好型饲料添加剂。纳豆菌在猪[13]、羊[14]、牛[15]上作为饲料添加剂使用的案例均有研究报道。大蒜素能抑制有害菌,且对益生菌如干酪乳杆菌有促进作用,这是大蒜既能防病治病,又能够促进食欲、帮助消化的重要原因[16]。丁酸梭菌与大蒜素同用,对青脚麻鸡具有显著的生长促进作用[17]。【本研究切入点】大蒜素和纳豆菌作为动物饲料添加剂,两者均可提高采食量、降低发病率、促进生长和改善饲养环境,目前关于二者联合使用在肉兔中的饲养效果未见报道。大蒜素既可提高食欲,又可抑制有害菌、促进有益菌(如纳豆菌)的生长,两者联合使用,可能有协同作用。【拟解决的关键问题】本试验通过研究大蒜素、纳豆菌及其复合物对福建白兔生长性能、抗氧化活性、肠道形态和菌群的影响,旨在为肉兔生产中合理开发利用无抗饲料添加剂,且为开发适用于肉兔自由采食饲喂方式的饲料提供理论参考。
1. 材料与方法
1.1 试验材料
试验动物为健康的福建白兔(40日龄,公母各半),35日龄时购自武平县武东乡袁田村福建白兔生态养殖场,暂养5 d后开始试验。大蒜素购自潍坊加易加生物科技有限公司,大蒜素含量25%;纳豆芽孢杆菌冻干粉购自福建盛德实业有限公司,含量为3.5×108 CFU·g−1。
1.2 试验方法
试验在福建省农业科学院畜牧兽医研究所兔场基地进行。选择平均体重为(657.25±102.21)g的健康福建白兔48只,随机分为4个处理组,对照组饲喂基础饲粮(A组,CK),试验组在基础饲粮上分别添加200 mg·kg−1大蒜素、0.5%纳豆菌、200 mg·kg−1大蒜素+0.5%纳豆菌,设置大蒜素处理组(B组)、纳豆菌处理组(C组)和大蒜素+纳豆菌处理组(D组)。每组12只,饲养于仔兔代谢笼(规格60 cm×40 cm×40 cm),每笼1只。试验期为50 d。全价颗粒料饲喂,每天早晚饲喂2次,乳头式饮水器自由饮水。饲养管理与免疫程序按常规进行。全价饲粮参照NRC(1977) [18]家兔营养标准和De Blas等[19]的生长兔营养需求进行配制,基础饲粮组成及营养水平见表1。
表 1 基础饲粮组成及营养水平(干物质基础)Table 1. Composition and nutrient levels of basic diets (DM basis)项目
Items含量
Content原料 Ingredients 玉米 Corn/% 30.0 豆粕 Soybean meal/% 15.0 麸皮 Wheat bran/% 25.0 花生壳粉 Peanut shell powder/% 5.0 草粉 Grass meal/% 20.0 预混料 Premix1)/% 5.0 合计 Total/% 100.0 营养水平 Nutrient levels2) 粗蛋白质 Crude protein/% 17.0 消化能 Digestible energy/(MJ·kg−1) 10.6 粗纤维 Crude fiber/% 13.0 钙 Ca/% 1.0 磷 P/% 0.5 注:1)预混料为每千克饲粮提供:赖氨酸1 500 mg,蛋氨酸 1 500 mg,CaHPO4 15 000 mg,NaCl 5 000 mg,VA 10 000 IU,VD3 2 000 IU,VE 50 mg,VK3 2.5 mg,硫胺素5 mg,VB12 1 mg,核黄素10 mg,泛酸50 mg,烟酸20 mg,叶酸2.5 mg,氯化胆碱400 mg,Fe 100 mg,Zn 50 mg,Cu 40 mg,Mn 30 mg,I 0.5 mg,Se 0.05 mg,其余为载体补足。2)营养水平为计算值。
Note: 1) Premix provided the following per kg of diets: Lys 1 500 mg, Met 1 500 mg, CaHPO415 000 mg, NaCl 5 000 mg, VA 10 000 IU, VD3 2 000 IU, VE 50 mg, VK3 2.5 mg, thiamine 5 mg, VB12 1 mg, riboflavin 10 mg, pantothenic acid 50 mg, nicotinic acid 20 mg, folic acid 2.5 mg, choline chloride 400 mg, Fe 100 mg, Zn 50 mg, Cu 40 mg, Mn 30 mg, I 0.5 mg, Se 0.05 mg, the rest was meal carrier complement. 2) Nutrient levels were calculated.1.3 指标测定
1.3.1 生长性能测定
试验于40日龄正式开始,于90日龄结束,试验始末对试验兔空腹称重,试验期每日记录每只兔采食情况,包括每日喂料量、剩余料量及浪费料量,并观察试验期间的腹泻和死亡情况。计算仔兔的平均日增重(Average daily gain,ADG)、平均日采食量(Average daily feed intake,ADFI)及料重比(Feed/gain,F/G),计算公式为料重比=消耗饲料总量(kg)/增重总量(kg)。试验结束时,采集每只兔血样后屠宰,进行屠宰测定,测定全净膛重、半净膛重等。无菌采集盲肠内容物进行菌群测定,采集肠道组织样品用于形态学观察。
1.3.2 血清抗氧化酶的测定
丙二醛(Malondialdehyde,MDA)含量、谷胱甘肽过氧化物酶(Glutathion peroxidase,GSH-Px)活性和总抗氧化能力(Total antioxidant capacity, T-AOC),均采用南京建成生物工程研究所提供的试剂盒测定。
1.3.3 肠绒毛高度和隐窝深度
家兔屠宰后迅速剖开腹腔,每只家兔十二指肠、空肠和回肠的相同部位各取下一段肠管1 cm(回肠取最上端),生理盐水冲洗干净,放入10%中性甲醛中固定。石蜡包埋,连续横断切片,厚6 µm,进行常规HE染色。光镜下详细观察和比较各组肠绒毛形态结构的变化情况。每张切片挑选3个100倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件,每张切片选取5根完整的绒毛,分别测量绒毛高度(mm)、隐窝深度(mm);计数每个视野内绒毛和隐窝的数量,计算视野面积(mm2),求出单位面积内绒毛和隐窝的数量。
1.3.4 盲肠微生物多样性
取各组家兔盲肠食糜,迅速放置液氮中,备用。
(1) DNA 抽提和 PCR 扩增。根据 E.Z.N.A.® soil DNA kit(Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总 DNA 抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA 浓度和纯度;使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3~V4 可变区进行 PCR 扩增,扩增程序如下:95 ℃ 预变性 3 min,27 个循环(95 ℃ 变性 30 s,55 ℃ 退火 30 s,72 ℃ 延伸 30 s),然后 72 ℃ 稳定延伸 10 min,最后在4 ℃进行保存(PCR 仪:ABI GeneAmp® 9700型)。PCR反应体系为:5×TransStart FastPfu 缓冲液4 μL,2.5 mmol·L−1 dNTPs 2 μL,上游引物(5 μmol·L−1)0.8 μL,下游引物(5 μmol·L−1)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3个重复。
(2)Illumina Miseq 测序。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen biosciences,union city,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer (Promega,USA)对回收产物进行检测定量。使用NEXTFLEX® Rapid DNA-Seq Kit进行建库:接头链接;使用磁珠筛选去除接头自连片段;利用PCR扩增进行文库模板的富集;磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)[20]。
1.4 数据统计分析
采用Excel 2010 和SPSS 20.0 统计软件对数据进行处理分析,采用单因素方差分析(Oneway ANOVA)检验组间差异显著性,试验结果以平均值±标准差表示。
2. 结果与分析
2.1 不同添加剂对福建白兔生产性能的影响
2.1.1 对腹泻率和死亡率的影响
由表2可知,试验全期,对照A组的腹泻率明显高于试验组, B组与C组腹泻率相当, D组的腹泻率最低;且40~60日龄A组的试验兔腹泻率和死亡率最高, D组死亡率和腹泻率最低。
表 2 不同添加剂对福建白兔腹泻率和死亡率的影响Table 2. Effects of supplements on rates of diarrhea incident and mortality of Fujian white rabbits组别
Groups腹泻率 Number of diarrhea/% 死亡率 Mortality/% 平均
Average40~60 d 60~90 d 平均
Average40~60 d 60~90 d 对照A组 CK 50.00 33.33 25.00 33.33 33.33 0.00 处理B组 Treatment B 25.00 25.00 0.00 33.33 33.33 0.00 处理C组 Treatment C 25.00 25.00 0.00 25.00 16.67 8.33 处理D组 Treatment D 8.33 8.33 0.00 16.67 8.33 8.33 2.1.2 对生长性能的影响
由表3可知,各组的初始体重差异不显著,试验结束的终末体重,处理D组显著高于处理A组(P<0.05),极显著高于处理B组(P<0.01);平均日采食量处理C和D组都极显著高于处理B组(P<0.01);平均日增重处理D组均极显著高于处理A组、处理B组(P<0.01),显著高于处理C组(P<0.05);与其他组比较,料重比D组最低,但各组差异不显著。
表 3 不同添加剂对福建白兔生长性能的影响Table 3. Effect of supplements on growth performance of Fujian white rabbits组别
Groups初始体重
Original weight/g终末体重
Final weight/g平均日采食量
Average feed intake/(g·d−1)平均日增重
Average weight gain/(g·d−1)料重比
F/G处理A组 CK 667.25±78.68 1635.31±131.67 ABb 110.26±8.70 ABab 19.36±2.16 Bb 5.74±0.54 处理B组 Treatment B 659.13±86.17 1622.25±98.21 Bb 105.87±9.75 Bb 19.43±2.07 Bb 5.81±0.86 处理C组 Treatment C 690.33±83.40 1697.61±108.44 ABab 118.20±7.68 Aa 20.27±1.94 ABb 5.92±0.70 处理D组 Treatment D 618.9±112.43 1772.00±90.22 Aa 119.92±8.23 Aa 23.06±3.10 Aa 5.35±0.68 注:同列数据后字母相同或不标者表示差异不显著(P>0. 05);小写字母不同表示差异显著(P<0.05); 大写字母不同表示差异极显著(P<0.01)。表4~8同。
Note: The datas with the same or no letters in a line mean no significance (P>0. 05), the datas with different small letters indicate significance difference (P<0.05), the datas with different capital letters indicate extremely significances difference (P<0.01). Same for Table 4–8.2.1.3 对福建白兔屠宰性能的影响
由表4可知,全净膛重,处理D组均显著高于处理A组(P<0.05)和处理B组(P<0.01);半净膛重处理D组极显著高于处理A和处理B组(P<0.01),处理C组显著高于处理B组(P<0.05)。全净膛率和半净膛率各组之间差异不显著。
表 4 不同添加剂对福建白兔屠宰性能的影响Table 4. Effect of supplements on slaughter performance of Fujian white rabbits组别
Groups全净膛重
Carcass net weight/g半净膛重
Half eviscerated weight/g全净膛率
Whole net carcass rate/%半净膛率
Half-complete ratio/%对照A组 CK 799.06±65.05 ABb 880.31±68.27 Bb 0.49±0.02 0.54±0.02 处理B组Treatment B 790.63±44.17 Bb 870.56±49.53 Bb 0.49±0.02 0.54±0.02 处理C组Treatment C 835.39±47.79 ABab 928.78±52.59 ABa 0.49±0.03 0.55±0.03 处理D组Treatment D 861.65±56.93 Aa 957.8±56.53 Aa 0.49±0.02 0.54±0.02 2.2 对福建白兔血清抗氧化酶的影响
由表5可知,血清中GSH-Px含量,处理B、C、D三组都显著高于处理A组,且 B组和A组之间差异显著(P<0.05),C、D组和A组之间差异均为极显著(P<0.01)。
表 5 不同添加剂对福建白兔血清抗氧化酶的影响Table 5. Effect of supplements on serum antioxidant enzymes of Fujian white rabbits组别
Groups总抗氧化能力
T-AOC/(mmol·L−1)谷胱甘肽过氧化物酶
GSH-Px/(U·mL−1)丙二醛
MDA/(nmol·mL−1)对照A组 CK 0.59±0.08 202.03±37.00 Bb 5.23±1.14 处理B组 Treatment B 0.61±0.08 275.63±53.97 ABa 5.38±1.51 处理C组 Treatment C 0.58±0.12 311.51±49.82 Aa 4.59±2.52 处理D组 Treatment D 0.56±0.06 318.22±69.78 Aa 4.43±1.29 2.3 对福建白兔肠道形态的影响
由表6~7可知,不同组别的肠道绒毛长度和数量差异不显著;回肠隐窝深度处理B组显著高于处理C组(P<0.05);空肠隐窝深度,处理B、C、D组高于处理A组,且B组与A组差异极显著(P<0.01),D组与A组差异显著(P<0.05),B组显著高于C组(P<0.05)。十二指肠隐窝深度不同组别之间差异不显著。回肠隐窝数量A组显著高于组C和D组(P<0.05),其他差异不显著。不同组织切片见图1。
表 6 不同添加剂对福建白兔肠道绒毛长度和隐窝深度的影响Table 6. Effects of supplements on intestinal villus length and crypt depth of Fujian white rabbits(单位:mm) 组别
Groups绒毛长度 Villus length 隐窝深度 Crypt depth 十二指肠
Duodenum回肠
Ileal空肠
Jejunum十二指肠
Duodenum回肠
Ileal空肠
Jejunum对照A组 CK 0.68±0.07 0.54±0.13 0.51±0.08 0.13±0.02 0.10±0.02 Aab 0.10±0.01 Bc 处理B组 Treatment B 0.62±0.13 0.49±0.09 0.49±0.05 0.13±0.05 0.12±0.04 Aa 0.13±0.03 Aa 处理C组 Treatment C 0.65±0.07 0.57±0.07 0.53±0.05 0.10±0.02 0.09±0.01 Ab 0.11±0.02 ABb 处理D组 Treatment D 0.62±0.13 0.52±0.06 0.52±0.07 0.12±0.03 0.10±0.02 Aab 0.12±0.03 ABab 表 7 不同添加剂对福建白兔肠道绒毛数量和隐窝数量的影响Table 7. Effects of supplements on intestinal villi population and crypts of Fujian white rabbits(单位:根·mm−2) 组别
Groups绒毛数量 Villus number 隐窝数量 Crypt number 十二指肠
Duodenum回肠
Ileal空肠
Jejunum十二指肠
Duodenum回肠
Ileal空肠
Jejunum对照A组 CK 4.15±0.88 7.62±1.74 7.44±2.68 13.08±4.03 18.01±7.88Aa 23.5±17.38 处理B组 Treatment B 4.75±1.17 7.70±0.96 6.73±1.02 18.01±6.76 17.34±4.75Aab 28.94±27.38 处理C组 Treatment C 4.58±1.05 7.61±1.05 6.28±0.60 14.68±6.50 12.19±3.48Ab 16.54±6.34 处理D组 Treatment D 4.75±0.95 7.41±1.87 6.16±0.76 14.29±4.78 13.75±2.62Ab 14.32±4.48 2.4 对福建白兔盲肠微生物区系的影响
2.4.1 不同添加剂对福建白兔盲肠菌群 Alpha 多样性分析
肠道微生物测序,对不同组别肠道内容物进行测序,共获得有效序列数为1 702 885 条,每条序列平均长度为408.64 bp,以97%的序列一致性。由表8可知,处理A组的群落多样性Shannon指数显著高于C组(P<0.05),其他差异不显著。
表 8 试验各组测序结果及Alpha多样性分析Table 8. Sequence and alpha diversity of treatment groups项目
Item对照A组
CK处理B组
Treatment B处理C组
Treatment C处理D组
Treatment D分类单元数量 OUT/个 648.00±49.88 571.25±90.6 578.56±144.44 575.20±147.72 覆盖率 Coverage/% 99.58±0.03 99.63±0.05 99.60±0.11 99.62±0.09 Shannon指数 Shannon index 4.82±0.18 Aa 4.59±0.36 Aab 4.53±0.33 Ab 4.54±0.52 Aab Simpson指数 Simpson index 0.02±0.01 0.03±0.02 0.04±0.02 0.03±0.02 ACE指数 ACE index 742.16±54.21 657.55±98.67 673.62±165.4 668.17±150.36 Chaol指数 Chaol index 751.06±49.72 668.86±98.81 689.77±171.52 673.87±169.42 注:同行数据后字母相同或不标者表示差异不显著(P>0. 05);小写字母不同表示差异显著(P<0.05);大写字母不同表示差异极显著(P<0.01)。
Note: The datas with the same or no letters indicate no significance in a row(P>0.05), the datas with different small letters indicate significance difference(P<0.05), the datas with different capital letters indicate extremely significances difference(P<0.01).2.4.2 不同组别福建白兔盲肠菌群结构分析
(1)不同组别福建白兔盲肠菌群门水平的结构分析。不同组别福建白兔盲肠菌群由厚壁菌门(Firmicutes)、拟杆菌门 (Bacteroidetes)、细菌未分类门(Unclassified_k__norank_d__Bacteria)、放线菌门(Actinobacteria);软壁菌门(Tenericutes);变形菌门(Proteobacteria);髌骨细菌门(Patescibacteria)等组成,其中前 3 种菌门是不同组别中菌群的主要组成部分,分别占73.02%、12.03%、2.06%以上(图2)。
(2)不同组别福建白兔盲肠菌群科水平的结构分析。不同组别福建白兔盲肠菌群在科水平以瘤胃菌科Ruminococcaceae、优杆菌科Eubacteriaceae、毛螺菌科Lachnospiraceae、克里斯滕森菌科 Christensenellaceae等为主,分别占27.28%、13.15%、10.53%、6.86%以上(图3)。肠道菌梭菌目-0-未分类(Unclassified_ o_ Clostridiales)在组间差异显著(P<0.05),A组显著高于D 组,其他差异不显著(图4)。
(3)不同组别福建白兔盲肠菌群属水平的结构分析。不同组别福建白兔盲肠菌群在属水平以优杆菌科的norank_f(norank_f__Eubacteriaceae)、瘤胃球菌科的NK4A214菌属(Ruminococcaceae_NK4A214_group)、克里斯滕森菌科的R-7菌属(Christensenellaceae_R-7_group)、绒毛杆菌科的norank_f__菌属 (norank_f__Muribaculaceae)和梭菌目vadinBB60菌科的norank_f__菌属(norank_f__Clostridiales_vadinBB60_group)为主,分别占9.86%、10.05%、6.83%、7.10%、6.69%以上(图5)。Ruminococcaceae_UCG-010在组间差异显著 (P<0.05) ,A组显著高于C 组;unclassified_o__Clostridiales在组间差异显著 (P<0.05) ,A组显著高于D 组(图6)。
3. 讨论
兔是单胃草食动物,断奶仔兔自由采食,容易发生消化道紊乱,造成腹泻甚至死亡[21]。本试验各组的腹泻率和死亡率较高,这是由于采用自由采食的饲喂方式。处理B组与对照A组相比,腹泻率和死亡率明显降低,这与Marchese等[8]研究表明大蒜素可以减少发病率以及降低死亡率的结果一致。何晓政等[17]研究显示大蒜素和丁酸梭菌联用可以促进青脚麻鸡的生长。大蒜素可提高免疫力[6],纳豆芽孢杆菌具有调节肠道和提高机体免疫力[11]的功效。本试验全期,对照组的腹泻率明显高于试验组,大蒜素或纳豆菌处理组腹泻情况相当,大蒜素和纳豆菌复合处理组(D组)的腹泻率最低;且40~60日龄阶段对照A组腹泻和死亡数最高,D组最低,说明大蒜素和纳豆芽孢杆菌有降低死亡和腹泻的作用,而且两者一起使用效果更佳,其原因可能是处理D组肠道有害菌unclassified_ o_ Clostridial显著低于对照A组,这也验证了处理D组试验兔的平均日增重和料重比均高于其他组别。
谷胱甘肽过氧化物酶(GSH-Px)是体内重要的自由基捕获酶之一,不仅具有清除自由基和衍生物的作用,还可减少脂质过氧化物的形成,增强机体抗氧化损伤的能力[22]。肠绒毛长短直接影响着动物的生长发育,绒毛长度增加可以增大小肠吸收营养物质的面积。肠隐窝是绒毛根部上皮陷入固有层形成的管状腺,隐窝深度反映上皮细胞的生产率,上皮细胞从隐窝基部向绒毛端迁移、分化,形成具有吸收功能的绒毛细胞[23]。肠道微生物对宿主的营养代谢、生长、免疫等起着不可忽视的重要作用。而肠道微生物的变化又受到宿主的品种、日粮、所处环境,特别是胃肠道环境的影响,因此宿主与其肠道菌群之间建立了一种共生关系[24]。本试验发现,处理组血清中的GSH-Px含量显著高于对照A组,这与大蒜素具有清除自由基和抗氧化[5]的功效有关。空肠隐窝深度对照A组低于处理组,这可能是由大蒜素可促进食欲且纳豆菌有促进益生菌生长的作用所致。
16S rRNA 的高通量测序,多样性分析得出对照组与试验组肠道菌群菌落丰富度无明显差异。菌群结构分析,以厚壁菌门、拟杆菌门为主,两者占85.05%以上,门水平差异不显著;不同组别福建白兔盲肠菌群在科水平以瘤胃菌科、优杆菌科、毛螺菌科、克里斯滕森菌科等为主,分别占27.28%、13.15%、10.53%、6.86%以上;不同组别福建白兔盲肠菌群在属水平以优杆菌科的norank_f属、瘤胃球菌科的NK4A214菌属、克里斯滕森菌科的R-7菌属、绒毛杆菌科的norank_f菌属为主,分别占9.86%、10.05%、6.83%、7.10%以上,对照组Ruminococcaceae_UCG-010显著高于纳豆菌处理(P<0.05)。有报道显示菌属Ruminococcaceae_UCG-010可能影响血糖的升高[25] ;He等[26]的研究表明番茄籽油可以降低小鼠肠道unclassified_o__Clostridiales菌属,进而改善小鼠的高血脂症。对照组unclassified_o__Clostridiales相对丰度显著高于大蒜素和纳豆菌复合处理组(P<0.05),说明大蒜素和纳豆菌联合使用可调节肠道菌群,改善血脂。
-
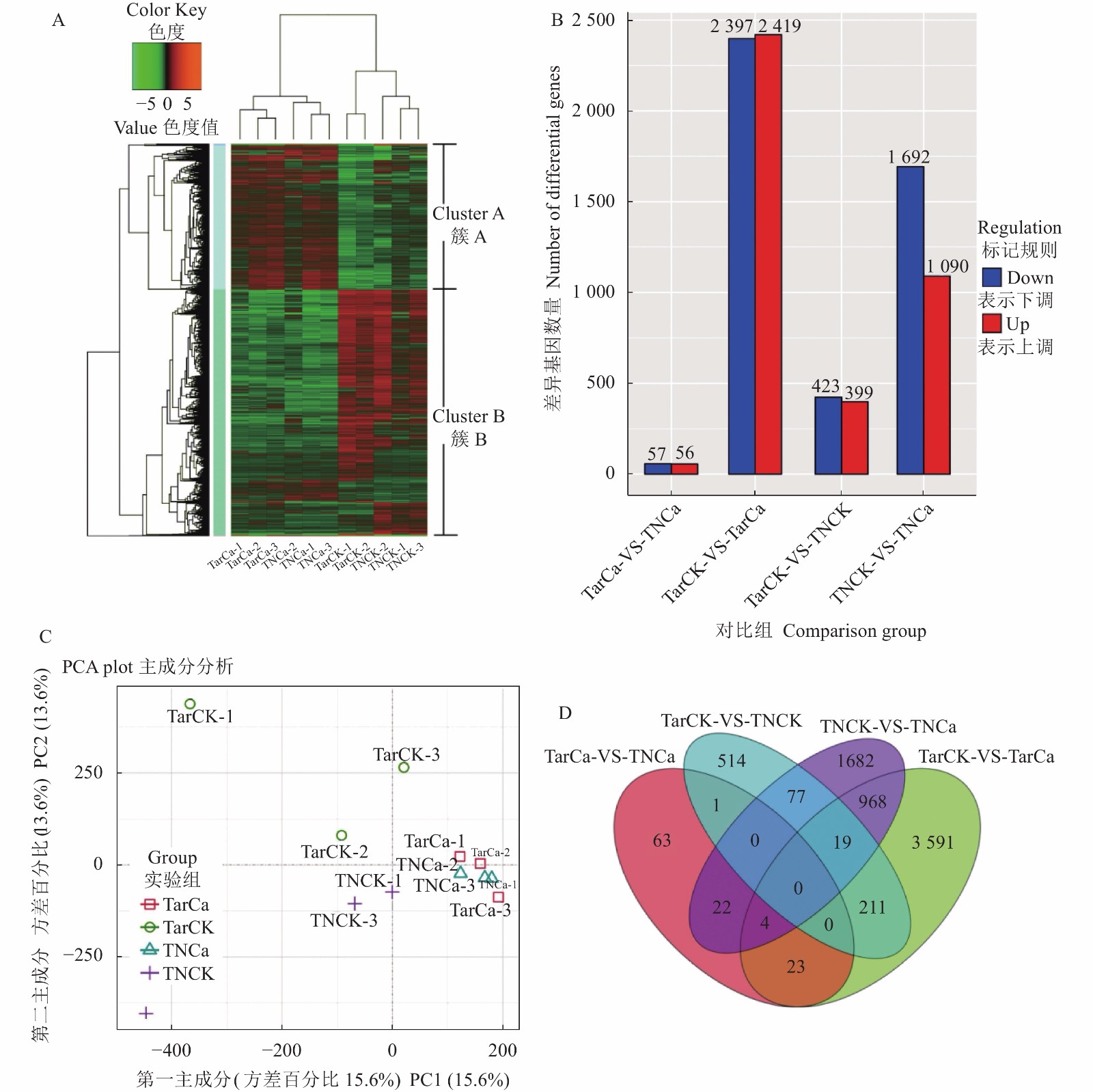
图 5 差异表达基因的表达谱分析
注:A,差异表达基因的聚类分析;B,差异表达基因的数量;C,差异表达基因的主成分分析;D,差异基因维恩图分析。
Figure 5. Expression profiling of differentially expressed genes
Note: A: Cluster analysis on differentially expressed genes; B: Number of differentially expressed genes; C: Principal component analysis on differentially expressed genes; D: Venn diagram of differential genes.
图 6 差异表达基因的GO富集分析
注:1,催化活性;2,结合;3,转运活性;4,结构分子活性;5,电子载体;6,核酸结合转录因子活性;7,酶调节活性;8,抗氧化活性;9,分子传感器活性;10,细胞组分;11,细胞器;12,膜部分;13,细胞器部分;14,细胞膜;15,高分子复合物;16,胞外区;17,类核;18,细胞连接;19,代谢过程;20,细胞过程;21,单一生物过程;22,生物调节;23,应激反应;24,定位;25,发育过程;26,多生物过程;27,免疫系统过程;28,组织细胞组成或生物起源;29,生殖过程;30,多细胞生物过程;31,繁殖;32,细胞外区域部分;33,细胞外基质;34,细胞外基质成分;35,运动;36,生长;37,突触部分。
Figure 6. GO enrichment analysis on differentially expressed genes
Note: 1: catalytic activity; 2: binding; 3: transporter activity; 4: structural molecule activity; 5: electron carrier activity; 6: nucleic acid binding transcription factor activity; 7: enzyme regulator activity; 8: antioxidant activity; 9: molecular transducer activity; 10: cell part; 11: organelle; 12: membrane part;13: organelle part; 14: membrane; 15: macromolecular complex; 16: extracellular region; 17: nucleoid; 18: cell junction; 19: metabolic process; 20: cellular process; 21: single-organism process; 22: biological regulation; 23: response to stimulus; 24: localization; 25: developmental process; 26: multi-organism process; 27: immune system process; 28: cellular component organization or biogenesis; 29: reproductive process; 30: multicellular organismal process; 31: reproduction; 32: extracellular region part; 33: extracellular matrix; 34: extracellular matrix component; 35: locomotion; 36: growth; 37: synapse part.
表 1 12个cDNA文库的过滤数据
Table 1 Clean data of 12 cDNA library
样品
Sample平均长度
Average length/bp总序列数
The total number of sequences总碱基数
Total base number /bpQ20含量
Q20 content /%Q30含量
Q30 content /%GC含量
GC /%TarCK1 148.70 46691744 6943031355 98.11 94.32 50.55 TarCK2 148.77 49717384 7396527911 98.26 94.67 49.80 TarCK3 148.63 40433794 6009572727 98.15 94.35 52.27 TarCa1 148.74 47758784 7103493445 98.15 94.44 51.41 TarCa2 148.87 40229314 5988834979 98.07 94.30 52.04 TarCa3 149.00 46500744 6928790175 98.07 94.28 51.59 TNCK1 148.98 43959714 6549244364 98.15 94.42 50.78 TNCK2 148.79 40479744 6022881697 98.23 94.59 49.17 TNCK3 148.87 45992514 6846847661 98.08 94.21 49.91 TNCa1 149.00 44762836 6669452846 98.10 94.41 52.32 TNCa2 148.96 46342564 6903233715 98.04 94.15 51.03 TNCa3 148.89 48524526 7224858395 98.09 94.31 52.03 合计 Total 541393662 80686769270 表 2 转录组序列组装分析
Table 2 Summary of transcriptome assembly
序列类型
Sequence type重叠群
Contig序列
Unigene最短序列长度 Minimum sequence Length/bp 25 201 最长序列长度 Maximum sequence length/bp 15 734 11 377 序列平均长度 Mean sequence length/bp 53.76 513.25 N50长度 N50 length/bp 48 686 (A+T)/% 51.94 55.72 (C+G)/% 48.06 44.28 序列总数 The total number of sequences 19 585 575 349 537 总碱基数量 Total base number/bp 1 052 959 813 179 400 360 表 3 Unigene 的长度及数量统计
Table 3 Unigene length and quantity statistics
长度
Length/bp数量
Number比例
Percentage/%<200 0 0.00 200~500 265 367 75.92 500~1 000 44113 12.62 1 000~1 500 17 752 5.08 1 500~2 000 10 495 3.00 ≥2 000 11 809 3.38 总数 Total 349 537 100 表 4 显著差异表达基因
Table 4 Significantly differentially expressed genes
对照组
Group基因编号
Gene ID差异倍数
Log2 fold
change基因名称
KO_name基因定义
KO_definitionTarCK/TNCK DN74111_c0_g1_i2 −6.76 FOLK 法呢醇醇激酶 Farnesol kinase TarCK/TNCK DN42826_c0_g2_i2 −6.56 PLD1_2 磷脂酶D1/2 Phospholipase D1/2 TarCK/TNCK DN73032_c0_g2_i1 −3.14 ATPeF1B 膜上ATP合酶 F-type H+-transporting ATPase subunit beta TarCK/TNCK DN59908_c0_g1_i2 −1.88 KCS 3-酮脂酰辅酶A合成酶基因 3-ketoacyl-CoA synthase TarCK/TNCK DN88233_c0_g1_i2 −1.08 ENO 烯醇酶 Enolase TarCK/TNCK DN45172_c0_g1_i1 −1.00 CALM 钙调蛋白 Calmodulin TarCK/TNCK DN75575_c0_g1_i1 6.00 AAO3 脱落醛氧化酶 Abscisic-aldehyde oxidase TNCK/TNCa DN75425_c0_g1_i6 −4.83 ABF ABA响应元件结合因子 ABA responsive element binding factor TNCK/TNCa DN89025_c0_g1_i3 −2.34 MFP2 烯酰辅酶A水合酶/3-羟酰辅酶A脱氢酶 Enoyl-CoA hydratase/3-hydroxyacyl-CoA dehydrogenase TNCK/TNCa DN10149_c0_g1_i1 1.09 AUX1 生长素流入载体蛋白 Auxin influx carrier TNCK/TNCa DN36010_c0_g1_i1 1.20 CALM 钙调蛋白 Calmodulin TNCK/TNCa DN81084_c0_g4_i2 1.29 CPK 钙依赖性蛋白激酶 Calcium-dependent protein kinase TNCK/TNCa DN132576_c0_g1_i1 1.64 CML 钙结合蛋白CML Calcium-binding protein CML TNCK/TNCa DN55671_c1_g1_i8 2.01 PLD1_2 磷脂酶D1/2 Phospholipase D1/2 TNCK/TNCa DN1778_c0_g3_i1 2.45 SORD L-艾杜糖醇-2-脱氢酶 L-iditol 2-dehydrogenase TNCK/TNCa DN48191_c0_g1_i1 2.61 EIN2 乙烯不敏感蛋白2 Ethylene-insensitive protein 2 -
[1] CHANG Y C, ALBANO J P, MILLER W B. William B Miller. Oriental hybrid lily cultivars vary in susceptibility to upper leaf necrosis [J]. Acta Horticulturae, 2008, 766(766): 433−440.
[2] CHANG Y C, MILLER W B. The relationship between leaf enclosure, transpiration, and upper leaf necrosis on Lilium 'Star gazer' [J]. Journal of the American Society for Horticultural Science, 2004, 129(1): 128−133. DOI: 10.21273/JASHS.129.1.0128
[3] CHANG Y C, GRACE-MARTIN K, MILLER W B. Efficacy of exogenous calcium applications for reducing upper leaf necrosis in lilium `Star Gazer' [J]. Hortscience A Publication of the American Society for Horticultural Science, 2004, 39(2): 272−275.
[4] TSAI Y H, SUSILO H, CHANG Y. Effects of temperature and defoliation on upper leaf necrosis in lilium ‘star gazer’ [J]. Acta Horticulturae, 2011, 886(886): 289−297.
[5] 杨爽. 设施百合品种筛选与“叶烧病”发生机理的研究[D]. 北京: 北京林业大学, 2012. YANG S. Studies on screening and mechanism of the upper leaf necroses of facility lily cultivars[D]. Beijing: Beijing Forestry University, 2012. (in Chinese)
[6] MORTAZAVI S N, KARIMI V, AZIMI M H. Pre-harvest foliar application of humic acid, salicylic acid and calcium chloride to increase quantitative and qualitative traits of Lilium longiflorum cut flowers [J]. Journal of Science & Technology of Greenhouse Culture, 2015, 6(3): 37−46.
[7] MIRABBASI N, NIKBAKHT A, ETEMADI N, et al. Effect of different concentrations of potassium silicate, nano-silicon and calcium chloride on concentration of potassium, calcium and magnesium, chlorophyll content and number of florets of Asiatic lily cv. 'Brunello' [J]. Journal of Science & Technology of Greenhouse Culture, 2013, 4(14): 41−50.
[8] FITZPATRICK A H, BHANDARI J, CROWELL D N. Farnesol kinase is involved in farnesol metabolism, ABA signaling and flower development in Arabidopsis [J]. The Plant Journal, 2011, 66(6): 1078−1088. DOI: 10.1111/j.1365-313X.2011.04572.x
[9] LI S, HUANG M, DI Q, et al. The functions of a cucumber phospholipase D alpha gene (CsPLDα) in growth and tolerance to hyperosmotic stress [J]. Plant Physiology and Biochemistry, 2015, 97: 175−186. DOI: 10.1016/j.plaphy.2015.10.006
[10] TODD J, POST-BEITTENMILLER D, JAWORSKI J G. KCS1 encodes a fatty acid elongase 3-ketoacyl-CoA synthase affecting wax biosynthesis in Arabidopsis thaliana [J]. The Plant Journal, 1999, 17(2): 119−130. DOI: 10.1046/j.1365-313X.1999.00352.x
[11] SNEDDEN W A, FROMM H. Calmodulin as a versatile calcium signal transducer in plants [J]. The New Phytologist, 2001, 151(1): 35−66. DOI: 10.1046/j.1469-8137.2001.00154.x
[12] VOLL L M, HAJIREZAEI M R, CZOGALLA-PETER C, et al. Antisense inhibition of enolase strongly limits the metabolism of aromatic amino acids, but has only minor effects on respiration in leaves of transgenic tobacco plants [J]. The New Phytologist, 2009, 184(3): 607−618. DOI: 10.1111/j.1469-8137.2009.02998.x
[13] SUN H, HAO P, GU L, et al. Pectate lyase-like Gene GhPEL76 regulates organ elongation in Arabidopsis and fiber elongation in cotton [J]. Plant Science, 2020, 293: 110395. DOI: 10.1016/j.plantsci.2019.110395
[14] KHAN M, IMRAN Q M, SHAHID M, et al. Nitric oxide- induced AtAO3 differentially regulates plant defense and drought tolerance in Arabidopsis thaliana [J]. BMC Plant Biology, 2019, 19(1): 602. DOI: 10.1186/s12870-019-2210-3
[15] 时欢, 李蓉, 高玉莹, 等. 文心兰乙烯不敏感基因EIN2的克隆及表达分析 [J]. 西北植物学报, 2018, 38(9):1613−1619. SHI H, LI R, GAO Y Y, et al. Cloning and expression of ethylene insensitivity gene EIN2 in oncidesa [J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(9): 1613−1619.(in Chinese)
[16] VANDENBUSSCHE F, PETRÁSEK J, ZÁDNÍKOVÁ P, et al. The auxin influx carriers AUX1 and LAX3 are involved in auxin-ethylene interactions during apical hook development in Arabidopsis thaliana seedlings [J]. Development (Cambridge, England), 2010, 137(4): 597−606. DOI: 10.1242/dev.040790
[17] 王东, 牛蓓, 宋君, 等. 基于银耳转录组测序的多糖代谢途径分析 [J]. 西南农业学报, 2019, 32(6):1347−1352. WANG D, NIU B, SONG J, et al. Study on fructose and mannose metabolism pathway of Tremella fuciformis based on transcriptome [J]. Southwest China Journal of Agricultural Sciences, 2019, 32(6): 1347−1352.(in Chinese)
[18] FINKELSTEIN R, GAMPALA S S L, LYNCH T J, et al. Redundant and distinct functions of the ABA response loci ABA-INSENSITIVE(ABI)5 and ABRE-BINDING FACTOR (ABF)3 [J]. Plant Molecular Biology, 2005, 59(2): 253−267. DOI: 10.1007/s11103-005-8767-2
[19] ARENT S, CHRISTENSEN C E, PYE V E, et al. The multifunctional protein in peroxisomal beta-oxidation: Structure and substrate specificity of the Arabidopsis thaliana protein MFP2 [J]. The Journal of Biological Chemistry, 2010, 285(31): 24066−24077. DOI: 10.1074/jbc.M110.106005
[20] 王五宏, 钟新民, 李必元, 等. 盐钙胁迫下大白菜干烧心病的发生及矿质营养分配 [J]. 核农学报, 2012, 26(8):1204−1208. WANG W H, ZHONG X M, LI B Y, et al. Effects of calcium and salt stress on tipburn and nutrition distribution of Chinese cabbage [J]. Acta Agriculturae Nucleatae Sinica, 2012, 26(8): 1204−1208.(in Chinese)
[21] 程涣, 苏同兵, 于拴仓, 等. 大白菜钙运输基因ECA和钙响应基因CAS在缺钙胁迫下的表达分析 [J]. 植物生理学报, 2015, 51(4):566−572. CHENG H, SU T B, YU S C, et al. Expression analysis of Ca2+ transport and response genes, ECA and CAS, in cabbage under calcium deficiency condition [J]. Plant Physiology Journal, 2015, 51(4): 566−572.(in Chinese)
[22] 王娟, 王倩, 陈清. 结球莴苣“烧边”成因及其调控措施的研究进展 [J]. 中国蔬菜, 2005, 25(B10):32−35. WANG J, WANG Q, CHEN Q. Research progress on causes and control measures of "edge burning" in lettuce [J]. China Vegetables, 2005, 25(B10): 32−35.(in Chinese)
[23] WELTI R, LI W, LI M, et al. Profiling membrane lipids in plant stress responses. Role of phospholipase D alpha in freezing-induced lipid changes in Arabidopsis [J]. The Journal of Biological Chemistry, 2002, 277(35): 31994−32002. DOI: 10.1074/jbc.M205375200
[24] ZHANG Y, ZHU H, ZHANG Q, et al. Phospholipase Dα1 and phosphatidic acid regulate NADPH oxidase activity and production of reactive oxygen species in ABA-mediated stomatal closure in Arabidopsis [J]. The Plant Cell, 2009, 21(8): 2357−2377. DOI: 10.1105/tpc.108.062992
-
期刊类型引用(6)
1. 付红蕾,张朋朋,于新海. 大蒜素对奶牛泌乳性能、乳品质及抗氧化功能的影响. 饲料研究. 2024(03): 14-18 .  百度学术
百度学术
2. 何玉琴,陈冬金,姚浪群,许卫华,曹翀,林标声. 乳化植物甾醇对福建白兔生长性能、肠道形态及盲肠菌群与代谢物的影响. 动物营养学报. 2024(05): 3231-3246 .  百度学术
百度学术
3. 张超帅,李绍钰. 纳豆芽孢杆菌的生物学功能和在畜禽生产中的应用. 饲料研究. 2024(20): 151-155 .  百度学术
百度学术
4. 王丁,徐彬,席燕燕,王改利,付趁,孙全友,李绍钰. 纳豆芽孢杆菌对肉仔鸡生长性能、免疫功能及肠道健康的影响. 饲料研究. 2023(10): 34-39 .  百度学术
百度学术
5. 陈冬金,孙世坤,王锦祥,桑雷,陈岩锋,高承芳,谢喜平. 限饲对福建白兔生长性能、屠宰性能、肉品质、血清免疫和脂类指标、肠道形态及盲肠菌群的影响. 动物营养学报. 2022(09): 6043-6055 .  百度学术
百度学术
6. 韩松林,安才让吉. 大蒜素生物学功能及其在畜禽养殖中的应用研究进展. 饲料研究. 2022(20): 157-159 .  百度学术
百度学术
其他类型引用(6)




 下载:
下载: