Bacterial Community Structure and Diversity in Rhizosphere Soils in Healthy and Black Shank-infected Tobacco Fields
-
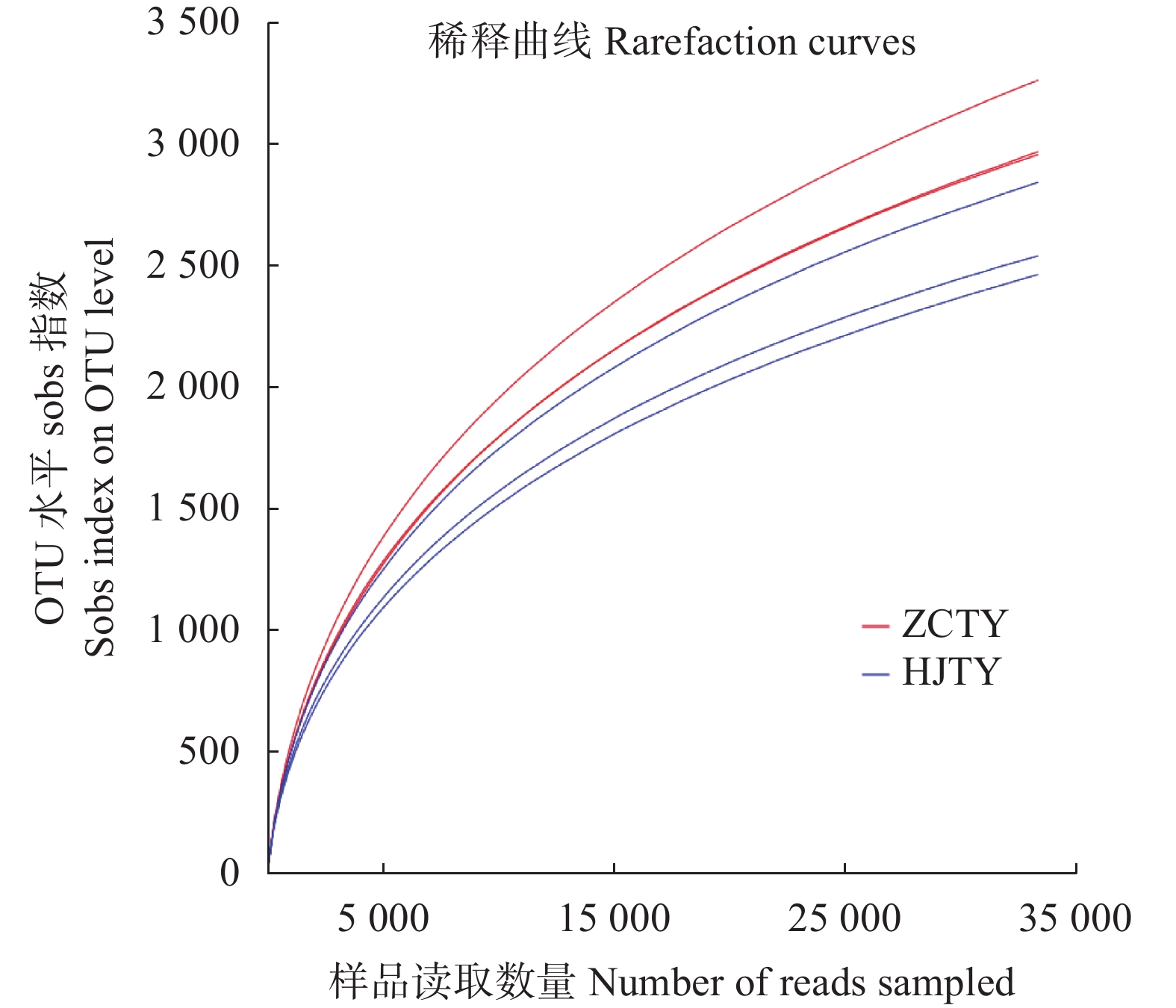
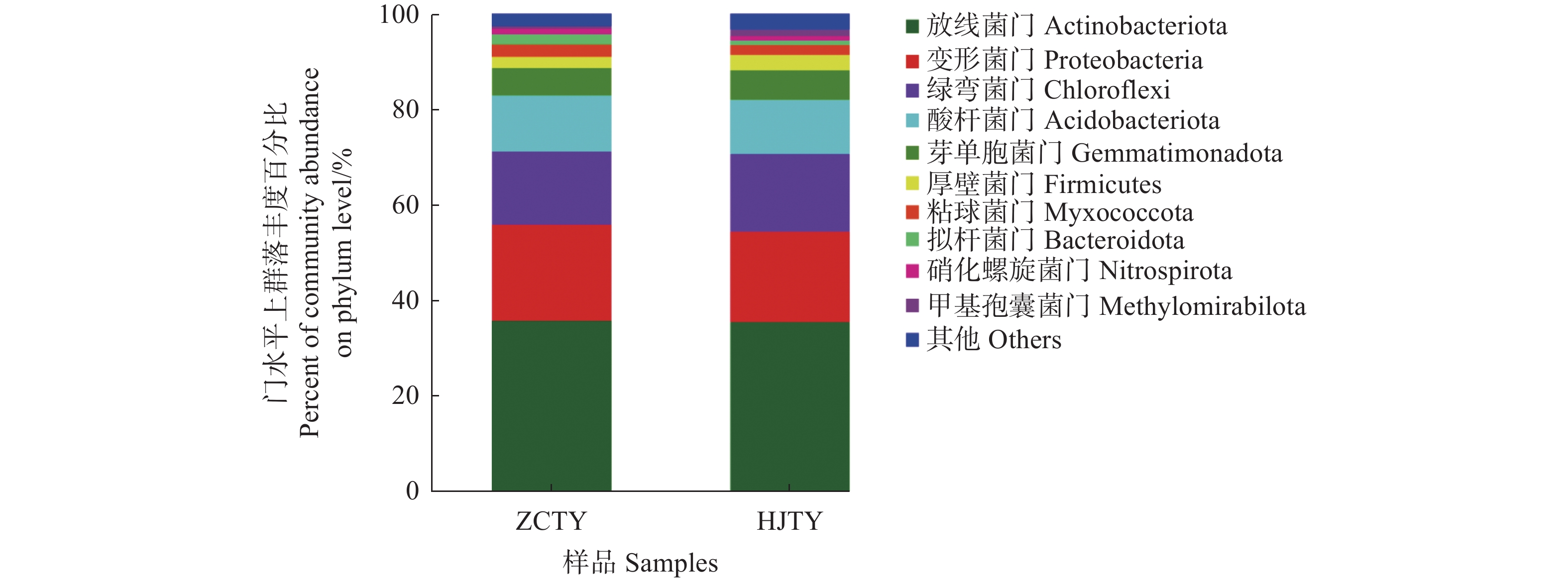
摘要:目的 探究健康与感染黑胫病烟株根际土壤的细菌群落结构差异,为该病害的早期预防或生态调控提供科学依据。方法 利用Illumina MiSeq高通量测序技术分析健康烟株与感染黑胫病烟株根际土壤细菌群落结构差异。结果 健康和患病烟株根际土壤样品中细菌OTU数分别为4 763个和4 653个。感染黑胫病烟株根际土壤OTU总数较健康烟株菌根际土壤减少2.31%,特有OTU数减少3%。与健康烟株根际土样相比感染黑胫病烟株根际土壤细菌群落多样性水平明显下降。患病烟株根际土壤的Shannon、ACE和Chao1指数分别较健康植株降低了3.05%、21.29%、15.23%。同时,感染黑胫病烟株与健康烟株根际土壤细菌菌群落的优势物种显著不同,感染黑胫病烟株根际土壤中拟杆菌门(Bacteroidota)和粘球菌门(Myxococcota)相对丰度减少59.13%、20.38%;厚壁菌门(Firmicutes)、Methylomirabilota相对丰度分别增加了34.17%、117.19%。属水平上,在健康烟株根际土壤样本中为优势菌属的类诺卡氏菌属(Nocardioides, 4.99%)在感染黑胫病烟株土壤样本中未检测到。结论 烟草植株根际土壤中细菌群落结构改变及物种多样性降低是烟草黑胫病发生的重要特征。Abstract:Objective Bacterial community structure and diversity in the rhizosphere soils of healthy and black shank-infected tobacco fields were compared for early disease prevention and ecological regulation of the agriculture.Method Illumina MiSeq high-throughput sequencing was performed on the soil samples to determine the bacterial community composition in the rhizosphere soil.Result There were 4 763 bacterial OTUs in the rhizosphere soil at the lot of healthy tobacco plants and 4 653 in that of the diseased plants. The reductions on total number of OTUs was 2.31% and 3% on the unique OTUs as affected by the infecting disease on the plants. The microbial diversity was significantly reduced, as the Shannon, ACE, and Chao1 indices declined by 3.05%, 21.29%, and 15.23%, respectively. The dominant species in them were significantly different as well, with the relative abundance of Bacteroidota and Myxococcotain decreased by 59.13% and 20.38%, respectively, while those of Firmicutes and Methylomirabilota increased by 34.17% and 117.19%, respectively. At genus level, Nocardioides predominantly presented in the rhizosphere soil of healthy tobacco plants at 4.99%, but not detected at the lot infected by black shank.Conclusion The bacterial community structure was significantly altered and species diversity significantly decreased in the rhizosphere soil as the tobacco plants were infected with the black shank disease.
-
0. 引言
【研究意义】云南山茶是山茶科(Theaceae)山茶属(Camellia)的常绿乔木或灌木,又称滇山茶、云南红花油茶等。云南山茶原产于中国的西南地区,是中国特有种,也是国家二级濒危植物[1−4]。云南山茶因树形高大、花色艳丽且花期长,被誉为云南八大名花之首。其花可入药,种子含油量较高,被誉为“东方橄榄油”,是优质的食用油,且可食药兼用[5]。因此,云南山茶具有广阔的开发利用前景。云南山茶主要分布于西南山区,这些区域土壤瘠薄,干燥少雨,虽然经过多年进化,云南山茶对西南山区环境有了一定适应性。但随着气候环境变化,西南山区近年来旱灾频发,致使云南山茶面临着干旱胁迫的风险[6]。山茶属植物的正常生长发育对水分需求量大,在干旱环境,山茶属植物可通过渗透调节、活性氧清除、植物激素代谢等一系列生理反应来响应干旱胁迫[7],因此研究云南山茶渗透调节物质和植物激素对干旱胁迫的响应,对提高云南山茶抗旱途径,增强其抵御干旱的能力提供理论依据。【前人研究进展】脱落酸(abscisic acid, ABA)是一种重要的植物非生物胁迫应急激素,在植物生长发育和应对各种逆境胁迫中起到重要的调节作用。研究表明,ABA在植物干旱胁迫响应中发挥着重要作用。干旱导致植物中ABA含量大幅提高,从而激活ABA信号转导通路,实现适应干旱环境的生理生化响应[8]。当植物遇到干旱胁迫时,根尖较地上部更为敏感,能合成大量的ABA,经木质部运输和激素信号转导,导致蒸腾速率降低、气孔关闭[9,10]。林先玉等[11,12]发现云南山茶在重度干旱胁迫及复水过程中,云南山茶抗氧化酶系统及叶绿素荧光指标受到影响,喷施外源ABA的云南山茶叶片失水量减少,干旱得到了有效的缓解。郭安红等[13]发现玉米(Zea mays L.)在应对干旱胁迫时,其根、茎、叶中各内源激素积累情况有显著差异。植物内源激素彼此之间是相互作用、相互调节的,而外界环境的影响导致植物内源激素的变化比较复杂,目前,国内外学者对内源激素在干旱胁迫下响应规律尚未统一,即便是同一植物不同时期内源激素的变化也有差别。【本研究切入点】干旱下植物不同组织部位内源激素应对逆境的差异,外源ABA如何影响其他内源激素进而提高植株的耐旱力,还需进一步研究。【拟解决的关键问题】以云南山茶幼苗为材料,研究喷施外源ABA对干旱胁迫下云南山茶幼苗根和叶内源激素代谢的影响,为云南山茶耐旱力研究提供理论依据。
1. 材料与方法
1.1 试验材料
选取6棵生长状况良好、长势一致、无病虫害的两年生(嫁接苗)云南山茶品种苗紫袍为研究材料,平均株高约45 cm,单株定植于塑料花盆(上口径25 cm、下口径20 cm)中,置于西南林业大学后山树木园培养,培养基质为黄壤土、腐质土、珍珠岩、蛭石,质量比为2∶6∶1∶1。
1.2 试验设计
本试验采用 PEG 模拟干旱法进行干旱胁迫。将筛选好的苗从盆中取出,洗净,分为两组,分别标记为D1、D2,培养于装有10 L pH5.5营养液(配方由中国科学院南京土壤研究所提供)的塑料箱中,用带孔硬质泡沫板和海绵固定植株。每天充分供氧,缓苗3 d后,将以上两组苗进行如下处理:①D1(重度干旱)在营养液加入20%(质量分数)PEG_6000,模拟严重干旱胁迫条件作为对照组;②D2(重度干旱+脱落酸)在营养液加入20%(质量分数) PEG_6000,模拟严重干旱胁迫条件,并于干旱胁迫前3 d直至干旱胁迫结束每天早晚8:00叶面喷施质量浓度为100 mg·L−1的脱落酸作为处理组,喷施程度为叶片正反面均匀喷洒至饱和水滴开始滴落。D1组喷施等量蒸馏水,干旱胁迫后将两组苗重新培养于营养液中进行复水处理。在胁迫开始的第0、24、48、72 h以及复水后24、72 h分别对各根和叶进行取样,采样时选取云南山茶自顶芽第3~5片完全舒展开的功能叶及植株须根,每个时间点取3个重复,样品使用液氮速冻后置于−80 ℃冰箱保存备用(表1)。
表 1 试验处理组别代表符号Table 1. Symbols for various treatments处理组
Treatment group组织部位
Tissue site干旱胁迫时长
Drought stress duration复水后24 h(R24 h)
24 h after rehydration复水后72 h(R72 h)
72 h after rehydration0 h 24 h 48 h 72 h D1 根(G1) G0 h G24 h G48 h G72 h GR24 h GR72 h 叶(Y1) Y0 h Y24 h Y48 h Y72 h YR24 h YR72 h D2 根(G2) G0 hA G24 hA G48 hA G72 hA GR24 hA GR72 hA 叶(Y2) Y0 hA Y24 hA Y48 hA Y72 hA YR24 hA YR72 hA 1.3 生理指标测定
渗透调节物质等参考李合生[14]的方法测定:可溶性糖(Soluble sugar,SS)采用蒽酮比色法;可溶性蛋白(Soluble protein,SP)采用考马斯亮蓝显色法;游离脯氨酸(Free proline,Pro)含量采用茚三酮显色法。
1.4 代谢组检测
选取D1、D2组胁迫 0、72 h 以及恢复 72 h 根和叶的样本,每个时间点3 个生物学重复,共36个样本,由武汉迈维生物科技有限公司进行靶向内源激素代谢检测。根和叶的处理方法参照Li[15]、 Floková[16]等的方法。数据采集仪器系统主要包括超高效液相色谱(Ultra Performance Liquid Chromatography, UPLC)(ExionLC™ AD,https://sciex.com.cn/)和串联质谱(Tandem Mass Spectrometry, MS/MS)(QTRAP® 6500+,https://sciex.com.cn/)[17,18]。液相条件为色谱柱:Waters ACQUITY UPLC HSS T3 C18柱(1.8 µm,100 mm×2.1 mm i.d.);流动相:A相,超纯水(加入0.04%的乙酸);B相,乙腈(加入0.04%的乙酸);梯度洗脱程序:0 min A/B为95∶5(V/V),1.0 min A/B为95∶5(V/V),8.0 min为5∶95(V/V),9.0 min为5∶95(V/V),9.1 min为95∶5(V/V),12.0 min为95∶5(V/V);流速0.35 mL·min−1;柱温40 °C;进样量2 μL。质谱条件:电喷雾离子源(Electrospray Ionization, ESI)温度 550 °C,正离子模式下质谱电压
5500 V,负离子模式下质谱电压−4500 V,气帘气(Curtain Gas, CUR)35 psi。在Q_Trap 6500+中,每个离子对是根据优化的去簇电压(declustering potential, DP)和碰撞能(collision energy, CE)进行扫描检测。采用Analyst 1.6.3软件采集质谱数据,基于标准品构建MWDB(Metware Database)数据库,对质谱检测的数据进行定性分析。定量分析是利用三重四级杆质谱的多反应监测模式(Multiple Reaction Monitoring, MRM)分析完成。获得不同样本的质谱分析数据后,采用MultiQuant 3.0.3软件处理质谱数据,对所有目标物的色谱峰进行积分,通过标准曲线进行定量分析[19]。1.5 数据处理
结合单变量统计分析和多变量统计分析的方法,采用差异倍数(Fold change, FC)分析、正交偏最小二乘判别分析(OPLS_DA)模型,对于两组比较:根据 fold change ≥ 2或fold change ≤ 0.5 筛选差异代谢物。采用Origin 2022、TBtools、Excel、SPSS、GraphPad Prism 8、迈维云平台(https://cloud.metware.cn/)、联川生物云平台(https://www.omicstudio.cn/)绘制相关图表进行可视化分析;采用KEGG进行代谢通路富集分析。
2. 结果与分析
2.1 脱落酸对干旱胁迫下云南山茶渗透调节物质的影响
在干旱胁迫及复水处理下云南山茶根系和叶片中可溶性糖、可溶性蛋白、游离脯氨酸含量均发生了显著变化,且叶片中的含量均显著高于根系(图1)。在云南山茶叶片中,可溶性蛋白和可溶性糖含量表现为D2<D1,其中可溶性蛋白含量仅在48 h和72 h 表现为D2>D1,可溶性糖含量仅在72 h表现为D2>D1;游离脯氨酸含量表现为D2>D1且变化显著。在云南山茶根系中,可溶性蛋白和可溶性糖含量表现为D2>D1,可溶性蛋白和可溶性糖在72 h后逐渐表现为D2<D1;游离脯氨酸含量表现为D2<D1且变化显著。
![]() 图 1 云南山茶根和叶渗透调节物质含量不同小写字母表示云南山茶根和叶不同时间处理间的差异显著性(P<0.05)。不同大写字母表示同一时间云南山茶根和叶处理间的差异显著性(P<0.05)。图5同。Figure 1. Contents of osmoregulatory substances in roots and leaves of C. reticulataData with different lowercase letters indicate significant differences at sampling times (P<0.05); those with different capital letters indicate significant differences at same sampling time (P<0.05). Same for Fig. 5.
图 1 云南山茶根和叶渗透调节物质含量不同小写字母表示云南山茶根和叶不同时间处理间的差异显著性(P<0.05)。不同大写字母表示同一时间云南山茶根和叶处理间的差异显著性(P<0.05)。图5同。Figure 1. Contents of osmoregulatory substances in roots and leaves of C. reticulataData with different lowercase letters indicate significant differences at sampling times (P<0.05); those with different capital letters indicate significant differences at same sampling time (P<0.05). Same for Fig. 5.2.2 内源激素代谢组分析
在D1组和D2组中共检测到88种激素化合物,包括2种ABA、26种IAA、36种CKs、10种GA、9种JA、2种SA、1种乙烯类化合物(Ethylene, ETH)、2种独角金内酯(Strigolactones, SL)(图2a)。基于云南山茶幼苗不同处理组根和叶两个部位与内源激素含量进行主成分分析,绘制PCA散点图(图2b)。结果表明,各处理样品组内聚集情况良好,表明样品具有良好的生物学重复。根和叶两个不同组织之间明显分离,表明在样品不同部位中,根和叶两个处理组各时间段内源激素具有明显差异。特别是叶片的几组处理,分离最为显著,这表明喷施了外源脱落酸后,干旱胁迫下的山茶叶片中内源激素的变化最为显著。
2.3 内源激素差异代谢物筛选
本研究可分为胁迫期(0 h_vs_72 h)和复水期(72 h_vs_R72 h)两个时期。在胁迫期D1组和D2组根系中分别筛选到16、22种内源激素差异代谢物,G0 h_vs_G72 h中10种表达上调,6种表达下调;G0 hA_vs_G72 hA中17种表达上调,5种表达下调(图3a),D1组和D2组之间存在10种共有差异代谢物(图3b)。在胁迫期D1组和D2组叶片中分别筛选到24、21种差异代谢物,Y0 h_vs_Y72 h中22种表达上调,2种表达下调;Y0 hA_vs_Y72 hA中18种表达上调,3种表达下调(图3a),D1组和D2组之间存在16种共有差异代谢物(图3b)。在复水期D1组和D2组根系中分别筛选到26、17种内源激素差异代谢物,G72 h_vs_GR72 h中10种表达上调,16种表达下调;G72 hA_vs_GR72 hA中3种表达上调,14种表达下调(图3c),D1组和D2组之间存在11种共有差异代谢物(图3d)。在复水期D1组和D2组叶片中分别筛选到22、25种差异代谢物,Y72 h_vs_YR72 h中19种表达上调,3种表达下调;Y72 hA_vs_YR72 hA中21种表达上调,4种表达下调(图3c),D1组和D2组之间存在17种共有差异代谢物(图3d)。
2.4 内源激素差异代谢物KEGG富集分析
为了探究外源ABA对干旱及复水下云南山茶根和叶两个组织部位内源激素代谢影响的差异,对D2组的差异显著代谢物进行KEGG通路富集分析,发现其富集在玉米素生物合成(Zeatin biosynthesis)、代谢途径(Metabolic pathway)、次生代谢物的生物合成(Biosynthesis of secondary metabolites)、植物激素信号转导(Plant hormone signal transduction)、二萜生物合成(Diterpene biosynthesis)、色氨酸代谢(Tryptophan metabolism)、多种生物碱的生物合成(Biosynthesis of various alkaloids)、氨酰生物合成(Aminoacyl-tRNA biosynthesis)、辅因子生物合成(Biosynthesis of cofactor)、2-氧羧酸代谢(2-oxycarboxylic acid metabolism)等多种代谢通路中。但云南山茶幼苗的根部和叶部的差异显著代谢物显著富集通路不一致(图4)。其中,根部的胁迫期和复水期差异代谢物均显著富集在二萜生物合成通路;叶部胁迫期差异代谢物显著富集在植物激素信号转导途径,复水期显著富集在玉米素生物合成通路。
![]() 图 4 差异代谢物的KEGG富集横坐标表示每个通路对应的富集因子,纵坐标为通路名称,点的颜色为P值,越红表示富集越显著。点的大小代表富集到的差异代谢物的个数多少。a:G0 hA_vs_G72 hA,b:Y0 hA_vs_Y72 hA,c:G72 hA_vs_GR72 hA,d:Y72 hA_vs_YR72 hA。Figure 4. KEGG enrichment map of differential metabolitesHorizontal coordinate: rich factor corresponding to each pathway; vertical coordinate: path name; dot color: P value, the deeper the red color, the more significant the enrichment; dot size: number of differentiated metabolites enriched; a: G0hA_vs_G72hA; b: Y0hA_vs_Y72hA; c: G72hA_vs_GR72hA; d: Y72hA_vs_YR72hA.
图 4 差异代谢物的KEGG富集横坐标表示每个通路对应的富集因子,纵坐标为通路名称,点的颜色为P值,越红表示富集越显著。点的大小代表富集到的差异代谢物的个数多少。a:G0 hA_vs_G72 hA,b:Y0 hA_vs_Y72 hA,c:G72 hA_vs_GR72 hA,d:Y72 hA_vs_YR72 hA。Figure 4. KEGG enrichment map of differential metabolitesHorizontal coordinate: rich factor corresponding to each pathway; vertical coordinate: path name; dot color: P value, the deeper the red color, the more significant the enrichment; dot size: number of differentiated metabolites enriched; a: G0hA_vs_G72hA; b: Y0hA_vs_Y72hA; c: G72hA_vs_GR72hA; d: Y72hA_vs_YR72hA.2.5 主要内源激素差异代谢物变化规律
2.5.1 脱落酸(ABA)和水杨酸(SA)
云南山茶在胁迫期及复水期,根和叶中发生显著差异(|Log2FC|>1)的ABA仅有2种,SA仅有1种,且SA仅在叶片中发生了显著差异(图5)。在胁迫期,D2组的内源ABA显著高于D1组,根中ABA显著高于叶片(图5a),其中ABA-GE仅在D2组的根部积累,叶部无积累(图5b);D2组叶片中SA呈逐渐降低的趋势,D1组趋势与D2组相反(图5c)。在复水期,D2组和D1组叶片中SA均呈逐渐增加的趋势,而ABA与ABA-GE呈现下降或缓慢增长的趋势。
2.5.2 赤霉素(GA)和茉莉酸(JA)
云南山茶根和叶在胁迫期及复水期表现显著差异(|Log2FC|>1)的GA有3种,JA有8种,GA和JA分别在植物的根系和叶片中发生显著变化(图6)。在胁迫期,GA3和GA53在植株根部的积累均显著高于叶部,且GA3和GA53在D2组中的水平著高于D1组,GA1在D2组中的积累显著低于D1组,GA3和GA53随着胁迫时间的推移逐渐升高。JA在D1组和D2组中主要呈增加趋势,D1组和D2组中共有的差异代谢物变化趋势基本一致,且H2JA、JA-ILE在D2组中的积累高于D1组。在复水处理下,植株根和叶两个组织中GA3和GA53均呈下降的趋势,根部GA1水平逐渐降低至0;JA在D1组和D2组中主要呈增加趋势,D1组和D2组中共有的差异代谢物变化趋势基本一致,只有H2JA在D1组呈上调,在D2组中却呈下调,H2JA、OPDA、JA-Val、JA-ILE在D2组中的积累显著低于D1组。
![]() 图 6 胁迫期及复水期3种赤霉素含量变化及茉莉酸热图上下调图中蓝色柱状为D1组,红色柱状为D2组,蓝色方框框选的代谢物为D1组和D2组共有的差异代谢物,未框选的即为特有差异代谢物,下同。a、b、c:3种赤霉素含量变化;d:胁迫期叶片中茉莉酸热图,e:复水期叶片中茉莉酸热图。Figure 6. GA and JA heat map of plant under stress and after rehydrationIn upper and lower diagrams, blue bar: Group D1; red bar: Group D2; metabolites in blue box: differential metabolites shared by D1 and D2; unselected metabolites: unique differential metabolites. Same for below. a, b, c: contents of 3 kinds of GA; d: heat map of JA in leaves under stress; e: heat map of JA in leaves after rehydration.
图 6 胁迫期及复水期3种赤霉素含量变化及茉莉酸热图上下调图中蓝色柱状为D1组,红色柱状为D2组,蓝色方框框选的代谢物为D1组和D2组共有的差异代谢物,未框选的即为特有差异代谢物,下同。a、b、c:3种赤霉素含量变化;d:胁迫期叶片中茉莉酸热图,e:复水期叶片中茉莉酸热图。Figure 6. GA and JA heat map of plant under stress and after rehydrationIn upper and lower diagrams, blue bar: Group D1; red bar: Group D2; metabolites in blue box: differential metabolites shared by D1 and D2; unselected metabolites: unique differential metabolites. Same for below. a, b, c: contents of 3 kinds of GA; d: heat map of JA in leaves under stress; e: heat map of JA in leaves after rehydration.2.5.3 生长素(IAA)和细胞分裂素(CKs)
干旱及复水处理下,有15种IAA和27种CKs在云南山茶中发生了显著(|Log2FC|>1)改变(图7)。在胁迫期根系中,IAA在D1组呈下调趋势,在D2组呈上调趋势;而CKs在D1组和D2组中主要呈上升趋势。其中IAA-Ala、TRA仅在D1组呈显著下调,ILA仅在D2组呈显著上调,且IAA-Ala、IAA-Leu、ILA在D2组中水平显著高于D1组(图7a);2MeScZR、IPR、cZR、BAP、IP、oT、tZ、DHZR、cZ在D2组中的激素水平显著高于D1组(图7b)。在胁迫期叶片中,IAA和CKs在D1组和D2组均呈上调趋势。其中ICA、MEIAA仅在D1组显著上调,且OxIAA、IAN、IAA-Glc、IAA-Asp、ICA、MEIAA在D2组中水平显著低于D1组(图7c);mT9G、IPR、DZ、DHZR等仅在D1组显著上调,且IP、cZR、cZ、pT9G、mT9G、IPR、DZ、DHZR在D2组中的水平显著低于D1组(图7d)。
![]() 图 7 胁迫期及复水期生长素、细胞分裂素热图及上下调图a:胁迫期根系中生长素热图,b:胁迫期根系中细胞分裂素热图,c:胁迫期叶片中生长素热图,d:胁迫期叶片中细胞分裂素热图,e:复水期期根系中生长素热图,f:复水期根系中细胞分裂素热图,g:复水期叶片中生长素热图,h:复水期叶片中细胞分裂素热图。Figure 7. Heat and up-down maps of IAA and cytokinin in plant under stress and after rehydrationa: IAA heat map in roots under stress; b: cytokinin heat map in roots under stress; c: IAA heat map in leaves under stress; d: cytokinin heat map in leaves under stress; e: IAA heat map in roots after rehydration; f: cytokinin heat map in roots after rehydration; g: IAA heat map in leaves after rehydration; h: cytokinin heat map in leaves after rehydration.
图 7 胁迫期及复水期生长素、细胞分裂素热图及上下调图a:胁迫期根系中生长素热图,b:胁迫期根系中细胞分裂素热图,c:胁迫期叶片中生长素热图,d:胁迫期叶片中细胞分裂素热图,e:复水期期根系中生长素热图,f:复水期根系中细胞分裂素热图,g:复水期叶片中生长素热图,h:复水期叶片中细胞分裂素热图。Figure 7. Heat and up-down maps of IAA and cytokinin in plant under stress and after rehydrationa: IAA heat map in roots under stress; b: cytokinin heat map in roots under stress; c: IAA heat map in leaves under stress; d: cytokinin heat map in leaves under stress; e: IAA heat map in roots after rehydration; f: cytokinin heat map in roots after rehydration; g: IAA heat map in leaves after rehydration; h: cytokinin heat map in leaves after rehydration.在复水期根系中,IAA在D1组和D2组主要呈升高趋势,而CKs在D1组和D2组主要呈降低趋势。其中IAA-Glu、ICAlD仅在D1组显著下调,IAA-Asp仅在D2组显著上调,且IAA-Leu、ICAld、IAA-Asp在D2组中的水平高于D1组(图7e);2MeSip、cZ、DHZR、K9G等仅在D1组显著上调,IPR、DHZROG、IP等仅在D2组显著下调,且cZROG、2MeSip、DHZR、K9G、DHZROG在D2组中的水平显著低于D1组(图7f)。在复水期叶片中,IAA和CKs在D1组和D2组主要呈上调趋势。其中OxIAA、IAA-Glc、IAA-Phe仅在D2组显著上调,且ILA、MEIAA、IAA-Asp、OxIAA、IAA-Glc、IAA-Phe在D2组中的积累显著高于D1组(图7g);BAP、iP7G、IPR、tZR等仅在D2组中呈显著上调,且DHZR、cZR、BAP、iP7G、tZR在D2组中的含量显著高于D1组(图7 h)。
2.5.4 生理指标与差异代谢物相关性分析
将检测出的ABA、GA、SA、JA、CKs、IAA中的各自不同种激素含量相加并与渗透调节物质进行相关性分析,结果表明云南山茶幼苗根部(表2)SP、SS与IAA、GA、SA;SS与SP;IAA与GA、SA均呈显著正相关;叶部(表3)SS与IAA、CKs、GA、JA、SA;IAA与CKs、GA、JA;GA与CKs、JA、SA;CKs与SA均呈显著正相关。
表 2 云南山茶幼苗根部生理指标、内源激素的相关系数Table 2. Correlation coefficient of physiological indexes and endogenous hormones of C. reticulata roots生理指标/激素
Physiological indicators/Hormone生理指标/激素
Physiological indicators/Hormone相关性
CorrelationSP IAA 0.948** SP GA 0.831* SP SA 0.976** SP SS 0.954* SS IAA 0.917* SS GA 0.844* SS SA 0.907* IAA GA 0.917* IAA SA 0.875* **表示极显著相关(P<0.01),*表示显著相关(P<0.05)。下同。
**: extremely significant correlation at P<0.01; *: significant correlation at P<0.05. Same for below.表 3 云南山茶幼苗叶部生理指标、内源激素间的相关系数Table 3. Correlation coefficient between physiological indexes and endogenous hormones of C. reticulata leaves生理指标/激素
Physiological indicators/Hormone生理指标/激素
Physiological indicators/Hormone相关性
CorrelationSS IAA 0.902* SS CKs 0.914* SS GA 0.944** SS JA 0.886* SS SA 0.958** IAA CKs 0.841* IAA GA 0.899* IAA JA 0.944** GA CKs 0.936** GA JA 0.915* GA SA 0.896* CKs SA 0.879* 3. 讨论
3.1 云南山茶幼苗根和叶对干旱胁迫及复水处理的差异响应
本试验中云南山茶渗透调节物质在叶片中的含量积累显著高于根系,干旱胁迫下叶片中渗透物质的变化较根系更为显著,这可能由于叶片是渗透调节物质主要产生部位,干旱胁迫下渗透物质的主要调节部位以叶片为主,与季杨等[20]关于在干旱下鸭矛(Dactylis glomerata)叶片渗透物质积累高于根系的结果一致。本研究发现在胁迫期,云南山茶根系通过积累ABA、GA含量,降低IAA含量来响应干旱胁迫,叶片通过提高ABA、JA、SA、IAA含量来应对干旱胁迫。ABA不仅参与植物生长发育调控,还可作为关键调节因子参与非生物胁迫应答,增强植物防御能力和耐旱性[21]。项洪涛等[22]研究表明ABA主要通过调节叶片气孔开闭实现植物对体内水分平衡的控制,提高植物在干旱环境下的耐受力。本研究中,干旱胁迫下云南山茶根系和叶片中ABA含量均发生了明显积累,其中根系中ABA含量积累显著高于叶部,这与任敏等[23]关于根对ABA的反应比地上部敏感,根尖在干旱环境下能合成大量ABA的研究结果一致。路萍[24]研究发现,在干旱胁迫下,植株会抑制IAA从地上部向根系转运,导致IAA在地上部大量积累,使植物叶片IAA含量升高。本研究发现在干旱胁迫下云南山茶根系IAA含量呈下降趋势,而植株叶片IAA含量随着胁迫时间延长呈上升趋势,与上述研究结果一致。胡晓健等[25]研究表明GA能改变植物对水分的利用效率,促使叶片气孔关闭,减少蒸腾作用。本研究发现GA仅在云南山茶根系中发生了显著上升,在叶部呈现小幅度上升,这说明云南山茶在干旱胁迫下根系通过提高GA含量进而响应干旱胁迫。唐子贻等[26]研究发现茶树在干旱下叶片中的GA3呈显著下降趋势,与本研究结果相反。植物抗旱性是一个复杂的综合性状,受多方面因素的影响,这可能是不同物种植物之间存在的差异。SA可以作为信号分子来调控植物的基因表达从而影响其生理特性,在植物的生长发育和抵御逆境胁迫过程中也发挥着重要调控作用[27]。研究证明[28],柑橘(Citrus reticulata Blanco)在受到干旱胁迫后内源JA含量快速增加。本研究同样发现云南山茶叶片中JA和SA含量均随着胁迫时间的推移呈上升趋势而响应干旱胁迫。
王荣荣等[29]研究发现小麦(Triticum aestivum L.)在干旱复水后,植株体内ABA含量逐渐下降到正常水平,IAA含量逐渐上升,发生补偿效应。本研究也发现云南山茶在复水后胁迫症状得到缓解,植株体内水势逐渐恢复,根系和叶片均逐渐降低合成ABA,促进合成IAA,这可能是植株根系和叶片中ABA合成信号转导通路对复水条件做出响应,植株体内水势升高后促进IAA积累发生补偿效应,与上述研究结果一致。牛俊义等[30]研究发现豌豆(Pisum sativum L.)干旱后复水可引起其叶片CKs含量增加,王晓凌等[31]研究表明,玉米在干旱后复水中叶片CKs含量有增长,玉米根系中CKs会向地上部分转移,加速生长导致补偿性生长的发生,弥补干旱胁迫所减少的生长量。本研究同样发现,在复水期云南山茶根系中CKs含量大多都呈下降趋势,叶片中CKs含量呈上升趋势,说明干旱得到缓解后,根系CKs逐渐向地上部分转移,叶片持续积累CKs来响应复水处理,产生补偿效应。
魏晓芸[32]研究发现,干旱胁迫显著影响了红砂(Reaumuria songarica P.)幼苗根部次生代谢物(萜类、酚类、生物碱类、黄酮类等)的合成通路。黎运[33]研究发现油茶(Camellia oleifera A.)在干旱胁迫下,根部差异代谢物显著富集在次生代谢物合成途径上,而叶部差异代谢物显著富集在植物激素信号转导途径上。本研究KEGG富集分析同样发现,云南山茶根部在胁迫期和复水期的差异代谢物均显著富集在二萜生物合成通路;叶部在胁迫期的差异代谢物显著富集在植物激素信号转导途径,在复水期的差异代谢物显著富集在玉米素生物合成通路。
3.2 渗透调节物质与内源激素相互协作响应干旱
在植物经历干旱胁迫时,植物激素作为信号分子可以促进抗氧化酶、渗透调节物质合成,多方协调植物中对非生物胁迫的响应机制[34]。本研究发现干旱胁迫下云南山茶根系中IAA和GA与可溶性蛋白、可溶性糖均呈显著正相关,叶片中IAA、CKs、GA与可溶性糖均呈显著正相关。说明云南山茶在干旱下内源激素促进渗透调节物质合成,与张丽杰[35]和李安[36]等发现干旱下内源激素与渗透调节物质呈正相关的结果一致。
环境信号会诱导植物内源激素合成并通过单一或相互作用调控植物生长发育及新陈代谢[37]。SA不仅可独立地发挥生理作用,也可与其他植物激素(如JA、GA、IAA、CKs等)协同作用,构成植物应答环境胁迫的信号网络,从而提高植物对环境胁迫适应能力[38]。本研究也发现干旱及复水处理下根部的SA与IAA呈显著正相关,叶片中SA与GA、CKs也存在着协同作用。王霞等[39]表明GA对IAA的调节作用为干旱胁迫下GA含量增加,相应地也促进IAA含量增加,本研究干旱及复水处理下植株叶部的GA与IAA也存在着正相关,但干旱胁迫下IAA和GA都增加的机制尚需进一步研究。在干旱下JA含量会快速积累,研究表明JA与IAA、GA均存在着相互协同作用[28],对干旱下欧洲垂枝桦(Betula pendula)叶片内源激素的研究发现,CKs与干旱调节有关,且IAA与CKs的含量随着胁迫时间的推移而增加[35],CKs与IAA之间存在着相互协同的作用。本研究也发现干旱胁迫下叶片CKs与IAA,JA与IAA、GA呈显著正相关。
3.3 施用外源ABA可提高云南山茶耐旱力
植物在受到逆境胁迫时会提高渗透物质的合成能力,降低细胞渗透势,从而缓解胁迫损伤[40]。本试验发现喷施外源ABA能有效提升植株叶部游离脯氨酸的含量,根部可溶性蛋白、可溶性糖的含量,说明外源ABA可降低细胞渗透势,缓解了干旱引起的细胞水分散失,与谢静静等[41]关于外源ABA缓减小麦花后干旱胁迫的效应结果一致。张建生[42]研究发现,施用外源ABA可促进内源ABA合成,而内源ABA可有效缓解干旱,黄小珍[43]研究指出CKs信号可能依赖于ABA信号途径来调控植物对逆境胁迫的响应。本研究发现在干旱胁迫下,D2组中ABA、CKs含量显著高于D1组,说明施用外源ABA可促进植株根系和叶片合成ABA、CKs,提高植株的耐旱力,与上述研究结果一致。在干旱胁迫下D2组根系中GA的含量显著高于D1组,D2组叶片中JA的含量显著高于D1组,说明外源ABA可促进内源GA、JA的合成,这与吴萍民等[44]关于外源ABA可促进GA3含量合成,进而提高植物的耐旱力,马超[45]关于ABA与JA在干旱胁迫下相互协同,相互促进的研究结果一致。本研究表明施用外源ABA在干旱胁迫下可促进云南山茶植株根系ABA、GA、CKs积累和植株叶片ABA、JA积累,进而提高耐旱力。本研究发现在复水处理中,D2组与D1组根系中IAA的含量均呈上升趋势,CKs的含量均呈下降的趋势,且D2组根系中IAA含量高于D1组,D2组根系中CKs含量低于D1组。表明复水后,植株体内水势逐渐升高,根系中IAA含量逐渐升高发生补偿效应,CKs逐渐从根系向地上部转运。施用外源ABA可促进植株根系IAA合成,促进CKs从根系向地上部转移,进而促进植株在复水后恢复。本研究发现,在复水期D1组叶片中JA含量持续上升,D2组中JA含量显著低于D1组。表明施用外源ABA在复水期可抑制植株叶片中JA积累,减缓植株衰老,与前人研究结果一致[46]。上述结果表明施用外源ABA在复水期可促进云南山茶根系IAA的积累,降低根系中CKs含量,降低植株叶片中JA含量而调控自身机制,促进植株的恢复。
4. 结论
本研究以云南山茶幼苗作为材料,测定渗透调节物质及内源激素代谢组,通过比较分析发现云南山茶幼苗根和叶生理指标及内源激素对干旱及复水的响应不一致。干旱及复水处理下渗透调节的关键部位是在叶部。干旱胁迫下云南山茶幼苗的根部促进积累ABA、GA、CKs含量,降低IAA含量,而叶部则是促进积累ABA、JA、SA、IAA、CKs的含量。复水处理下云南山茶幼苗根部ABA、GA、CKs各激素水平逐渐下降,IAA含量逐渐上升,而叶部通过积累JA、SA、IAA、CKs含量调控自身机制。差异显著代谢物KEGG富集分析表明,根部显著富集在二萜生物合成通路中,叶部显著富集在植物激素信号转导途径和玉米素生物合成通路中。渗透调节物质与内源激素的相关性分析表明两者之间存在显著正相关。施用外源ABA在干旱胁迫下可分别提升云南山茶根部可溶性蛋白、可溶性糖、ABA、GA、CKs和叶部游离脯氨酸、ABA、JA的含量,进而提高耐旱力;在复水期可分别降低根部CKs和叶部JA的含量,促进根部和叶部IAA的合成,进而促进植株的恢复。本试验为有关逆境中植物体内各种激素之间的关系和变化规律及KEGG富集通路的分析提供理论依据。
-
表 1 健康与感染黑胫病烟株根际土壤微细菌多样性指数
Table 1 Microbial diversity indices of rhizosphere soils at tobacco lots infected with black shank disease
处理
Treatment丰富度指数
Richness index多样性指数
Diversity index覆盖率
Coverage/%ACE Chao1 Shannon Simpson HJTY 3741.63 3792.47 6.36 0.0048 97.14 ZCTY 4753.59 4473.79 6.56 0.0044 96.53 -
[1] 王志愿, 姜清治, 霍沁建. 烟草黑胫病的研究进展 [J]. 中国农学通报, 2010, 26(21):250−255. WANG Z Y, JIANG Q Z, HUO Q J. Progress of research on tobacco black shank [J]. Chinese Agricultural Science Bulletin, 2010, 26(21): 250−255.(in Chinese)
[2] YUAN X L, ZHANG C S, KONG F Y, et al. Genome analysis of Phytophthora nicotianae JM01 provides insights into its pathogenicity mechanisms. [J]. Plants (Basel, Switzerland), 2021, 10(8): 1620.
[3] 王佩, 张强, 孙渭, 等. 烟草黑胫病抗性基因分子检测及其抗性特性分析 [J]. 分子植物育种, 2019, 17(20):6743−6750. WANG P, ZHANG Q, SUN W, et al. Molecular detection and resistance characteristics of tobacco black shank resistance gene [J]. Molecular Plant Breeding, 2019, 17(20): 6743−6750.(in Chinese)
[4] ANTONOPOULOS D F, MELTON T, MILA A L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco [J]. Plant Disease, 2010, 94(5): 613−620. DOI: 10.1094/PDIS-94-5-0613
[5] 赵辉, 王喜英, 刘国权, 等. 烟草黑胫病发生因素及综合防治研究进展 [J]. 湖南农业科学, 2020(11):99−103. ZHAO H, WANG X Y, LIU G Q, et al. Research progress on occurrence of tobacco black shank (Phytophthora parasitica var. nicotianae) and its integrated control [J]. Hunan Agricultural Sciences, 2020(11): 99−103.(in Chinese)
[6] 贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考 [J]. 生物多样性, 2013, 21(4):411−420. HE J Z, LI J, ZHENG Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems [J]. Biodiversity Science, 2013, 21(4): 411−420.(in Chinese)
[7] 李忠奎, 凌爱芬, 李红丽, 等. 基于多样性测序对健康与易感病烟田根际 土壤微生物群落分析 [J]. 河南农业大学学报, 2019, 53(6):918−925. LI Z K, LING A F, LI H L, et al. Analysis of rhizosphere soil microbial communities in healthy and susceptible tobacco fields based on diversity sequencing [J]. Journal of Henan Agricultural University, 2019, 53(6): 918−925.(in Chinese)
[8] 史普酉, 杨成翠, 贾孟, 等. 不同黑胫病发病程度下植烟根际土壤酶活性及细菌群落结构差异比较 [J]. 中国土壤与肥料, 2020(1):179−187. SHI P Y, YANG C C, JIA M, et al. Comparison of soil enzyme activity and bacterial community structure in tobacco-growing rhizosphere under different incidence of black Tibia disease [J]. Soils and Fertilizers Sciences in China, 2020(1): 179−187.(in Chinese)
[9] 何川, 刘国顺, 李祖良, 等. 连作对植烟土壤有机碳和酶活性的影响及其与土传病害的关系 [J]. 河南农业大学学报, 2011, 45(6):701−705. HE C, LIU G S, LI Z L, et al. Effect of continuous cropping on tobacco soil organic carbon, enzyme activities, and its relationship with soil-borne diseases [J]. Journal of Henan Agricultural University, 2011, 45(6): 701−705.(in Chinese)
[10] 葛艺, 徐绍辉, 徐艳. 根际微生物组构建的影响因素研究进展 [J]. 浙江农业学报, 2019, 31(12):2120−2130. GE Y, XU S H, XU Y. Review on influencing factors of rhizosphere microbiome assemblage [J]. Acta Agriculturae Zhejiangensis, 2019, 31(12): 2120−2130.(in Chinese)
[11] 周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展 [J]. 吉林农业大学学报, 2016, 38(3):253−260. ZHOU W J, LU D G, QIN S J. Research Progress in Interaction between Plant and Rhizosphere Microorganism [J]. Journal of Jilin Agricultural University, 2016, 38(3): 253−260.(in Chinese)
[12] 刘利佳, 李芳芳, 何雷, 等. 烟草镰刀菌根腐病病原菌的鉴定及其对5种杀菌剂的敏感性分析 [J]. 河南农业科学, 2021, 50(7):101−109. LIU J L, LI F F, HE L, et al. Pathogen identification of tobbaco fusarium root rot and its sensitivity to five fungicides [J]. Journal of Henan Agricultural Sciences, 2021, 50(7): 101−109.(in Chinese)
[13] 程洋洋, 杨其亚, 郑香峰, 等. 拮抗菌控制小麦赤霉病及其机制的研究进展 [J]. 粮食与油脂, 2018, 31(6):11−13. CHENG Y Y, YANG Q Y, ZHENG X F, et al. Research progress on control of antagonistic strains against Fusarium head blight and possible mechanism [J]. Cereals & Oils, 2018, 31(6): 11−13.(in Chinese)
[14] 李金融, 侯湖平, 王琛, 等. 基于高通量测序的复垦土壤细菌多样性研究 [J]. 环境科学与技术, 2018, 41(12):148−157. LI J R, HOU H P, WANG C, et al. Soil bacteria diversity of reclaimed soil based on high throughput sequencing [J]. Environmental Science & Technology, 2018, 41(12): 148−157.(in Chinese)
[15] 安丽芸, 李君剑, 严俊霞, 等. 微生物多样性对土壤碳代谢特征的影响 [J]. 环境科学, 2017, 38(10):4420−4426. AN L Y, LI J J, YAN J X, et al. Effects of microbial diversity on soil carbon mineralization [J]. Environmental Science, 2017, 38(10): 4420−4426.(in Chinese)
[16] 向立刚, 汪汉成, 郭华, 等. 健康与感染黑胫病烟株根际土壤与茎秆细菌群落结构与多样性 [J]. 中国烟草学报, 2020, 26(1):100−108. XIANG L G, WANG H C, GUO H, et al. Bacterial community structure and diversity in rhizospheric soil and in stalk of healthy and black shank disease-infected tobacco plants [J]. Acta Tabacaria Sinica, 2020, 26(1): 100−108.(in Chinese)
[17] WAGN Q J, MA Y, WANG J F, et al. Integration of biofumigation with antagonistic microorganism can control Phytophthora blight of pepper plants by regulating soil bacterial community structure [J]. European Journal of Soil Biology, 2014, 61: 58−67. DOI: 10.1016/j.ejsobi.2013.12.004
[18] 杨云礼, 徐明, 邹晓, 等. 不同植被类型对黔中山地丘陵区土壤细菌群落特征的影响研究 [J]. 生态与农村环境学报, 2021, 37(4):518−525. YANG Y L, XU M, ZOU X, et al. Effects of different vegetation types on the characteristics of soil bacterial communities in the hilly area of central Guizhou [J]. Journal of Ecology and Rural Environment, 2021, 37(4): 518−525.(in Chinese)
[19] 徐扬, 张冠初, 丁红, 等. 土壤类型对花生根际土壤细菌群落多样性和产量的影响[J/OL]. 生物技术通报: 1-14[2021-12-28]. XU Y, ZHANG G C, DING H, et al. Effects of soil type on bacterial community diversity and yield in rhizosphere soils of peanuts[J/OL]. Biotechnology Bulletin: 1-14[2021-12-28] (in Chinese).
[20] SHI Y, DELGADO-BAQUERIZO M, LI Y, et al. Abundance of kinless hubs within soil microbial networks are associated with high functional potential in agricultural ecosystems [J]. Environment International, 2020, 142: 105869. DOI: 10.1016/j.envint.2020.105869
[21] 杨安娜, 陆云峰, 张俊红, 等. 杉木人工林土壤养分及酸杆菌群落结构变化 [J]. 林业科学, 2019, 55(1):119−127. YANG A N, LU Y F, ZHANG J H, et al. Changes in soil nutrients and acidobacteria community structure in Cunninghamia lanceolata plantations [J]. Scientia Silvae Sinicae, 2019, 55(1): 119−127.(in Chinese)
[22] 刘东海, 乔艳, 李双来, 等. 不同种植模式对佛手山药土壤养分和微生物群落的影响 [J]. 湖北农业科学, 2021, 60(23):79−84. LIU D H, QIAO Y, LI S L, et al. Effects of different planting patterns on soil nutrients and microbial community of Foshou yam [J]. Hubei Agricultural Sciences, 2021, 60(23): 79−84.(in Chinese)
[23] LEE J M, JIN C Z, PARK S H, et al. Nocardioides antri sp. nov., isolated from soil in a rock cave [J]. Current Microbiology, 2021, 78(5): 2130−2135. DOI: 10.1007/s00284-021-02370-7
-
期刊类型引用(1)
1. 徐芬芬,周油涌,徐兵. 萘乙酸(NAA)对模拟干旱胁迫下上饶白玉豆种子萌发及其幼苗根系生长的影响. 上饶师范学院学报. 2024(06): 50-56 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: