Morphological and Molecular Identification of Potato Cyst Nematode from Sichuan
-
摘要:目的 四川省越西县马铃薯发现疑似线虫侵染症状,为查清病原,对分离获得的线虫进行形态学和分子生物学鉴定。方法 采集马铃薯根系和根围土壤,对根系内部线虫进行染色观察,用简易漂浮法分离孢囊,并对发现的二龄幼虫、雌虫和孢囊进行显微摄影和形态学测计。提取孢囊和二龄幼虫的DNA,用种特异PCR方法进行鉴定,同时PCR扩增后获得核糖体rDNA部分18S基因、28S基因D2~D3区和ITS区DNA序列,在GenBank中下载已登录的各近似种(球孢囊线虫属)的部分序列,进行序列比对,并使用MrBayes 3.2.3软件进行贝叶斯法系统进化树的构建。结果 该种线虫能入侵寄主根系内部,二龄幼虫口针基部球近圆形,向后倾斜;口针平均长<23 μm;孢囊Granek比值≥3,与马铃薯金线虫高度一致。特异PCR扩增3个孢囊和4条二龄幼虫均得到了430 bp左右的明亮条带,进一步测序后得到的序列长度均为434 bp,与马铃薯金线虫一致。核糖体rDNA 18S和28S进化分析表明,该四川越西马铃薯上发现的孢囊线虫属于球孢囊属线虫,核糖体ITS基因序列进一步分析证实该群体确为马铃薯金线虫。结论 四川省越西县马铃薯根系分离获得的线虫为马铃薯金线虫,该线虫为我国内检和外检均十分关注的检疫性线虫,一旦传入和定殖扩散,根除十分困难。建议尽快建立马铃薯金线虫疫情监测体系,加强马铃薯种薯的检疫监督管理,增加马铃薯金线虫防控技术的研发投入、研发检测和防控技术,为我国马铃薯主粮化产业健康可持续发展保驾护航。Abstract:Objective To isolate and identify the pathogen causing cyst nematode infection in Yuexi, Sichuan.Method Roots of the diseased potato plants as well as soil around them were collected to find nematodes by staining and examining under a microscope, while cysts separated by means of simple floatation. The second stage juveniles (J2s), female adults, and cysts found were photographed, and their morphological measurements recorded. DNA of the cysts and the J2s were extracted and identified by species-specific PCR. DNA sequences of 18S gene and 28s D2~D3 region, as well as the ITS location in ribosomal DNA, were obtained. Sequences of some cyst nematode species were downloaded from GenBank for alignment. MrBayes 3.2.3 software was used to construct the Bayesian phylogenetic tree.Result The isolated nematode could infect the host root system. The J2 stylet knobs rounded to flattened anteriorly; the mean stylet length was less than 23 μm; and the cyst Granek’s ratio was higher or equal to 3, which is similar to that for Globodera rostochiensis. The DNA templates of 3 cysts and 4 J2s were amplified by species-specific PCR to obtain a band of approximately 430 bp. Further sequencing determined the length to be precisely 434 bp, same as G. rostochiensis. The cyst nematode was shown to be a species of Globodera by an evolutionary analysis on the rDNA 18S and 28S and confirmed to be G. rostochiensis by another evolutionary analysis on ITS gene.Conclusion The isolated nematodes from Yuexi, Sichuan was identified as G. rostochiensis, which is of great concern for the domestic disease control and import quarantine, as it can be highly difficult to eradicate once being introduced and colonized in the country. Consequently, a stringent monitoring system must be implemented as soon as possible. Reinforced quarantine, supervision, and management to curtail the possible invasion are urgently needed. Increased efforts on the basic studies as well as developments of detection methodology and prevention and control technology on G. rostochiensis are recommended.
-
Keywords:
- Potato cyst nematode /
- morphology /
- molecular identification /
- quarantine /
- identification /
- monitoring
-
0. 引言
【研究意义】马铃薯是世界上第三大、我国第四大粮食作物,是集粮食、蔬菜、饲料和工业原料于一身的优势作物。中国是世界马铃薯生产种植大国,四川种植面积则居我国首位,约73万hm2。2012年至今,四川省马铃薯种植面积和总产连续全国第一,马铃薯产业已经逐渐成为四川省农业增产、农民增收的一大支柱产业。近年来,四川省将马铃薯产业列为四川省特色优势农业产业,大力推进马铃薯主粮化开发战略,依靠得天独厚的地理优势和健全的良种繁育体系,极大地推动了马铃薯产业的快速发展。但在加强育种和外来品种引进力度的同时,马铃薯孢囊线虫的传入扩散风险也在加大。马铃薯孢囊线虫的监测研究对马铃薯产业的可持续发展具有重大意义。【前人研究进展】马铃薯孢囊线虫主要包括马铃薯金线虫(Globodera rostochiensis Skarbilovich,1959)[1]和马铃薯白线虫(Globodera pallida Behrans, 1975)[2],是严重威胁马铃薯产业的重要病原线虫,危害非常严重,是国际公认的最重要检疫性有害生物,也是我国重要的进境植物检疫性有害生物,2020年被列入农业农村部《全国农业植物检疫性有害生物名录》。据国外报道,马铃薯金线虫一般会造成马铃薯减产20%,在热带地区,危害严重时造成产量损失80%~90%,甚至绝收[3]。为防止其传入,长期以来我国一直禁止马铃薯种薯的商业引进,目前尚未批准任何食用马铃薯的输入。【本研究切入点】2021年6月,笔者在四川省越西县发现马铃薯田块部分植株较矮,叶片黄化,长势较差,挖取植株根部,发现根系上有淡黄色至金黄色的球形孢囊,疑似马铃薯孢囊线虫侵染。目前我国尚未发现马铃薯孢囊线虫,因此亟需对该病原进行鉴定。【拟解决的关键问题】对马铃薯孢囊线虫进行分离和形态学、分子生物学鉴定,以期明确病原线虫种类,为进一步开展马铃薯孢囊线虫的监测、鉴定和防控提供参考。
1. 材料与方法
1.1 样品采集
样品采自越西县竹阿觉镇古二乡马铃薯种植田块(102°41′37.3″E;28°25′46.8″N;海拔2315.1 m),种植的马铃薯为青薯9号种,采集时间为马铃薯花期。针对马铃薯生长不良、矮化的田块,多点采集根围土壤混合样品各约500 g,同时将马铃薯苗连根拔起,观察并采集少许根系。
1.2 线虫分离
土壤中的二龄幼虫采用改良漏斗法(宁波市镇海百川生物科技有限公司)进行线虫分离。称取土壤100 g,用双层纱布包裹,置于加有适量水的漏斗中(水量以刚盖没土壤为宜),25 ℃恒温培养24 h后,用表面皿接取5~10 mL 线虫分离液,在Zeiss Stemi 305解剖镜下观察是否有线虫。
土壤中的孢囊采用简易漂浮法分离。称取风干土壤100 g,置于2000 mL的三角瓶中,加水至水深5 cm左右后充分摇晃,随后边加水边搅动,直至水面至瓶口处,静置片刻。将瓶口的漂浮物通过20 目和100 目滤,将100 目筛上的收集物轻轻倒入有滤纸的漏斗中过滤。过滤完毕后取滤纸在解剖镜下观察孢囊并计数。
用解剖刀切破较新鲜的孢囊,可见其中有大量虫卵。用移液器将适量虫卵转移到载玻片上,盖上盖玻片,轻轻用手指按压,部分虫卵破碎,游离出来的线虫即为孢囊线虫二龄幼虫(J2)。
1.3 形态学鉴定
1.3.1 孢囊阴门锥制作
将孢囊转移到塑料培养皿上的水滴中,于解剖镜下用解剖刀切下孢囊的后端(即颈部的对面一侧)部分,用竹针或0号狼毛笔轻轻剔除阴门锥内的黏附物和卵,用解剖刀适当修整阴门锥的边缘。然后取一片干净的载玻片,在中间加一小滴甘油,在解剖镜下用挑针将上述修整好的阴门锥移至甘油滴的中央,用挑针往下压,使其外表面向上。在甘油滴两边对称放置两块小蜡块,加盖玻片,于64 ℃的加热板上加热,待蜡块融化后自然冷却,用中性树胶封片。
1.3.2 显微镜观察摄影及测量
用Zeiss Imager Z1 显微镜和Axioscop MRm 数码相机对J2、孢囊、阴门锥的整体形态和内部特征进行观察、摄影和测量。
1.4 根系内部线虫染色
马铃薯花期采集植株根系,采用幼苗根系次氯酸钠——酸性品红整体染色[4-5]。观察根系内部孢囊线虫的侵染情况。
1.5 分子生物学鉴定
1.5.1 孢囊和幼虫DNA的提取
取分离得到的3个孢囊和6条二龄幼虫,参照王江岭等[6]的方法分别提取DNA,于−20 ℃保存待用。
1.5.2 种特异性PCR鉴定
使用ITS5和PITSr3引物[7]对获取的DNA样品进行PCR扩增,反应同时设置一组阴性对照及一组空白对照,阴性对照的DNA模板为大豆孢囊线虫。反应体系(25 μL):10×PCR Buffer(Mg2+ free) 2.5 μL,25 mmol·L−1 MgCl2 2 μL,2.5 mmol·L−1 dNTP Mix 2 μL,10 μmol·L−1引物各0.5 μL, 5 U·μL−1 Taq DNA 聚合酶0.4 μL,模板DNA 2 μL,ddH2O补足。反应程序:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,35 个循环;72 ℃ 5 min。进行PCR扩增后将产物在添加Gelred染料的1×TAE溶液制成1%的琼脂糖凝胶电泳,以DL100 bp(TaKaRa)为Marker,用紫外凝胶成像仪观察并照相,以确认扩增是否有效。扩增产物片段大小与Marker进行比较。剩余扩增产物送杭州擎科生物技术有限公司双向测序。
1.5.3 线虫核糖体基因扩增和测序分析
分别取单个孢囊和2条二龄幼虫的DNA模板,采用核糖体rDNA部分18S基因扩增引物:988(5′-CTCAAAGATTAAGCCATGC-3′)和 1912 (5′-TTTACGGTCAGAACTAGGG-3′); 1813 (5′-CTGCGTGAGAGGTGAAAT-3′)和2646(5′-GCTACCTTGTTACGACTTTT-3′)[8],核糖体rDNA 28S基因D2~D3区扩增引物391A(5′- AGCGGAGGAAAAGAAACTAA -3′) 和501 (5′-TCGGAAGGAACCAGCTACTA-3′)[9],核糖体rDNA ITS区扩增引物TW81 (5′- GTTTCCGTAGGTGAACCTGC-3′)和AB28 (5′-ATATGCTTAAGTTCAGCGGGT-3′)[10],进行上述基因PCR扩增。上述引物由上海英骏生物技术有限公司合成,PCR扩增程序参照各引物所在文献[8-10]。进行PCR扩增后将产物在添加Gelred染料的1×TAE溶液制成1%的琼脂糖凝胶电泳,以DL100 bp(TaKaRa)为Marker,用紫外凝胶成像仪观察并照相,以确认扩增是否有效。18S基因和28S基因D2~D3区扩增产物由杭州擎科生物科技有限公司进行双向测序,ITS序列直接测序不能获得有效序列,由上述公司进行克隆测序。
使用ChormasPro软件对测序得到的双向峰图文件进行拼接,剔除测序结果两端多余碱基后,得到用于后续比对和系统进化分析的序列。登陆NCBI网站中的BLAST(Basic local alignment search tool)页面(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对。在GenBank中下载已登录的各近似种(球孢囊线虫属)的部分序列,在Clustal[11]的默认设置下进行序列比对,并在MEGA软件下使用p-distance设置对所得序列及其近似类群进行两两序列相似度计算(Pairwise Distance)。
通过jModeltest软件[12],以甜菜孢囊线虫(Heterodera schachtii MW834323)和大豆孢囊线虫(Heterodera glycines EF611124)为外群,对得到的序列比对文件在赤池信息量准则(Akaike information criterion,AIC)标准下进行核苷酸替换模型的评估,得到相应的支持模型。使用MrBayes 3.2.3软件[13]对得到的序列比对文件进行贝叶斯法系统进化树的构建,根据所获得的核苷酸替换模型,参照Ronquist 等[13]的说明对程序做出设定。在4 条马尔科夫链(Markov Chain)下独立进行3条热链和1条冷链的5× 107 次运行,每1000 次运行进行一次抽样,剔除前25%可能未处于稳态时的系统进化树。采用多数一致(50%)原则,用MCMC(Markov Chain Monte Carlo)方法评估所获得贝叶斯系统进化树的后验概率值[14],在TreeGraph 2软件中对系统进化树进行查看和编辑[15]。
2. 结果与分析
2.1 田间症状
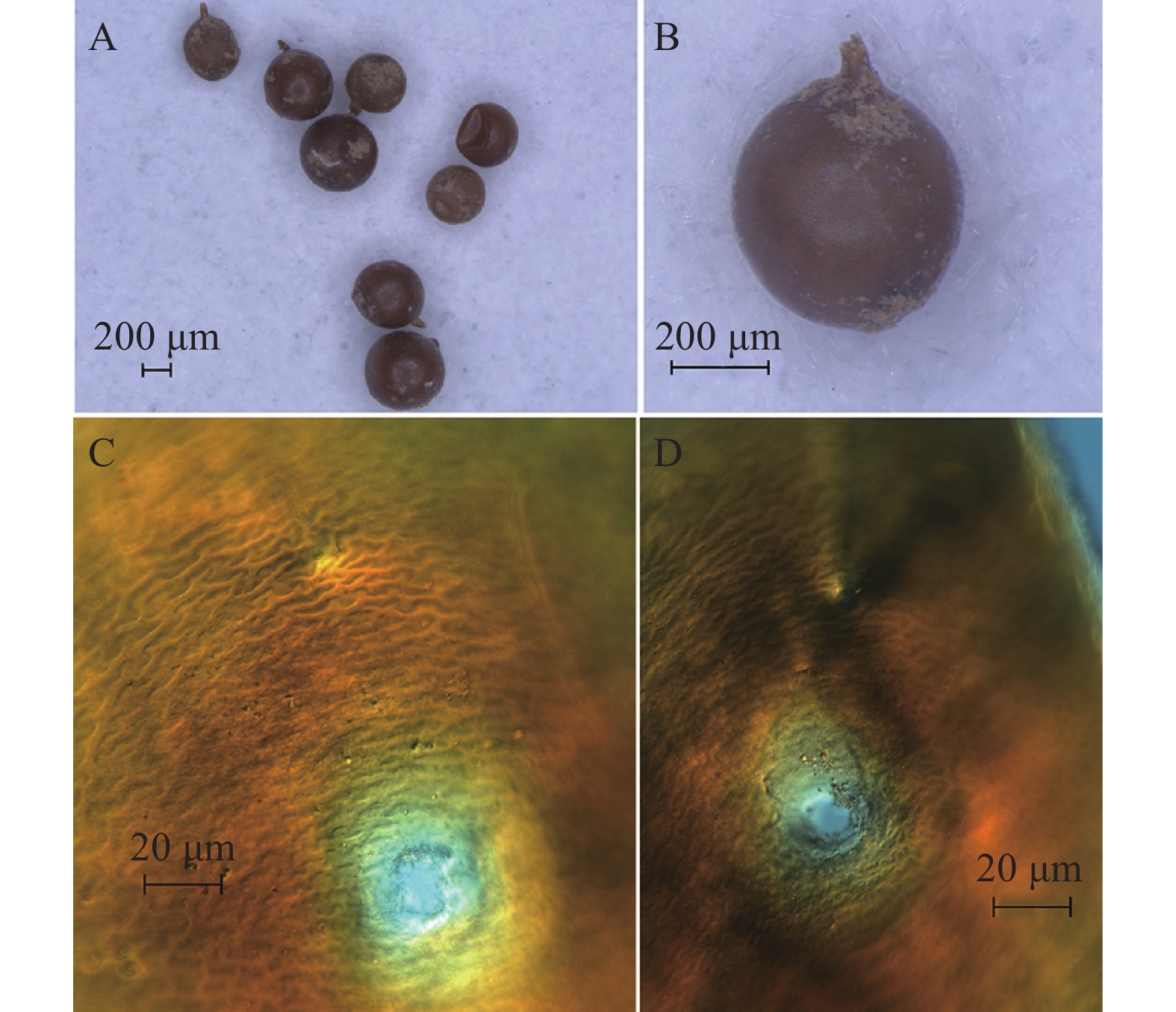
采样田块马铃薯植株较矮,叶片黄化,长势较差。拔起植株可看到部分根系上有淡黄色至金黄色的球形颗粒,为球孢囊属线虫的雌虫或孢囊(图1)。其数量较大,肉眼可见,多的有数百粒以上。
2.2 形态特征描述
100 g风干土壤用漂浮法分离获得孢囊100多个,用改良漏斗法分离获得大量孢囊线虫二龄幼虫,但未发现雄虫。
雌虫:虫体近球形,具突出的颈部。白色至淡黄色。头部具有融合的唇和1或2个明显的唇片。颈部环纹不规则,大多数体壁变成网纹型脊,头骨架发育弱。口针锥部约占口针长的50%,与杆部区别明显,口针基部球向后倾斜,口针从头架延伸到口针长约75%处。中食道球大,几乎球形,瓣门呈新月形。排泄孔明显,位于颈基部。双卵巢充满整个体腔。阴门横裂,周围角质层轻微环形凹陷,形成阴门膜孔。阴门位于两个细的唇突状新月形区域之间。肛门与阴门膜孔间角质层约有12个平行的脊,少数交叉相连。
孢囊(图2):孢囊球形或近球形,颈部突出,尾部圆滑,无任何突起的圆锥体状结构。其色泽金黄或黑褐色。表皮层具有“Z”字形的脊状纹。阴门锥为单环膜孔型,无阴门桥、下桥和其他内腺突,无泡状突。卵存在于孢囊中,不形成卵囊。新鲜孢囊的阴门区完整,但较老的孢囊标本部分或全部阴门膜孔丢失。肛门明显,不形成膜孔,有时可见“V”形结构。
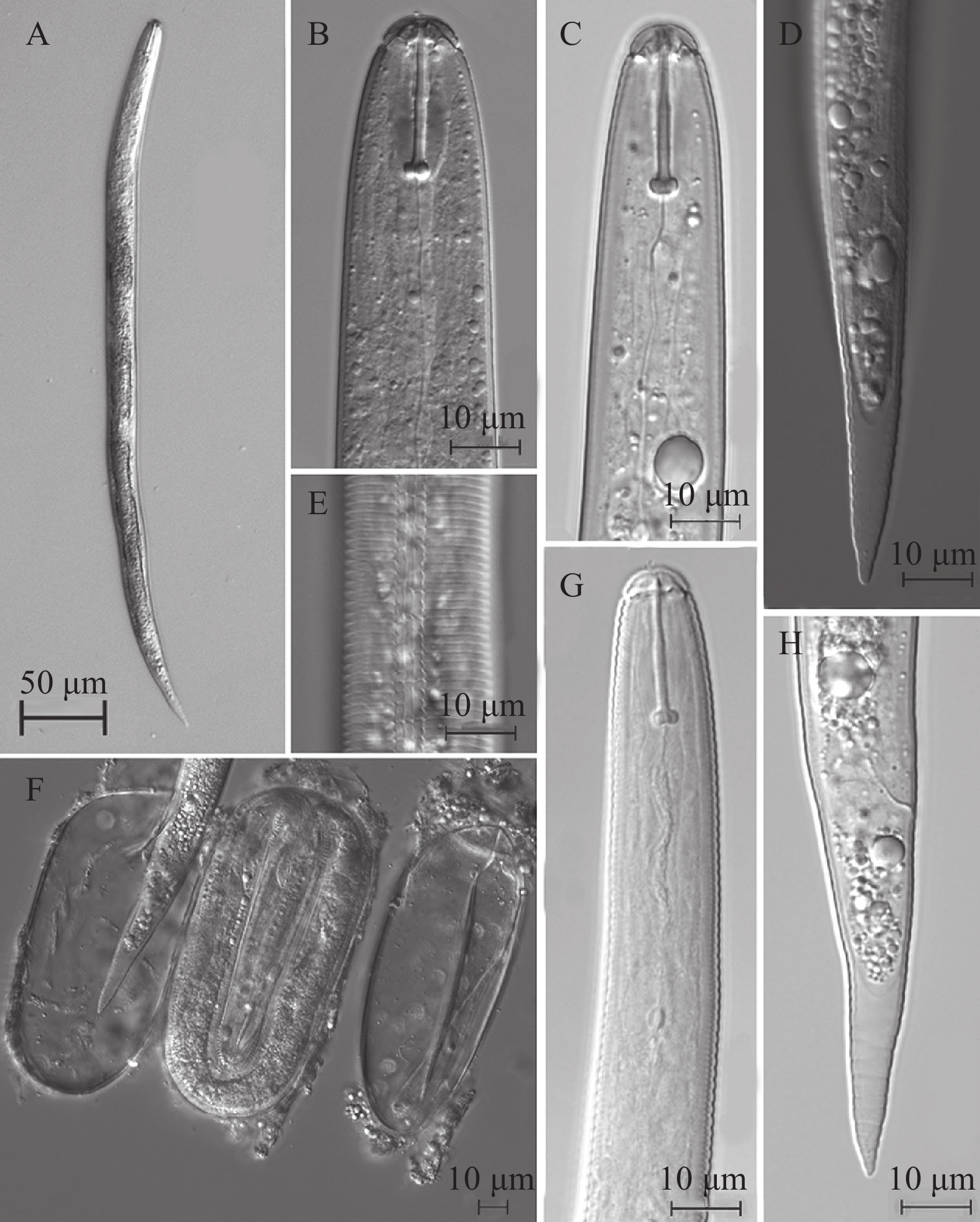
二龄幼虫(图3):分离得到各种线虫的混合物。根据口针强壮、长约20 μm、基部球显著膨大且为幼虫的特点,容易将孢囊属线虫与其他各种线虫区分。共计分离到孢囊属线虫二龄幼虫约500条,蠕虫形,角质层环纹规则,侧区4条侧线。热杀死后虫体通常略腹弯,体长405~444 μm。头部圆形,轻微缢缩,4~6个环纹。口针强壮,长19.4~21.9 μm,口针基部球近圆形,略向后倾斜,前面较平,口针锥部约占口针长的50%。食道腺向后延伸至约35%体长处。排泄孔位于近尾部约20%体长处。半月体明显,2 个体环长,位于排泄孔前1 个体环处。尾部渐变细,末端细圆,透明尾约占尾长的1/2。
2.3 二龄幼虫(J2)和孢囊形态测量值
对四川越西群体20 条J2和15个孢囊进行测计,并与国外马铃薯金线虫参考文献的资料进行比较,结果见表1。
表 1 四川越西群体孢囊线虫样品与国外马铃薯金线虫测计值比较Table 1. Morphometrics of cyst and J2 of Yuexi and foreign G. rostochiensis项目 Items 四川越西样品
Sample from Yuexi SichuanGermany, Golden & Ellington[16] Russia, Kazachenko[17] Slovenis, Libelice,
Sirca & Urek[18]孢囊
Cyst (n)15 50 25 10 长(不包括颈)
Length (exclude neck)/μm484±79.9(362–599) 680(450–990) 589(467–725) — 宽
Width /μm424±83.4(327–550) 540(250–810) 559(430–713) — 长/宽
Length/width1.2±0.1(1.0–1.3) 1.27(1.0–1.8) 1.04(0.9–1.3) — 膜孔直径
Fenestra width /μm16.7±2.9(13.0–23.0) 15.0(8–20) 14.1(10.4–19.5) 17.9±1.7(14.6–19.4) 脊数
Numer of ridges18.3±2.4(15.0–24.0) — — 18.3±1.6(16–22) 肛门至膜孔距离
Anus-fenestra distance/μm61.4±9.6(43–76) 68(29–116) 50.7(33.8–78) 64.8±4.7(58.1–73.3) Granek值
Granek’s ratio3.7±0.6(2.7–4.7) 4.5(2.0–7.0) 3.7(2.1–5.4) 3.6±0.4(3.0–4.3) J2(n) 20 50 25 30 体长
Length/μm422.5±11.8(405–444) 430(370–470) 392(366–406) 434.4±16.7(402.7–468.0) a 22.9±0.8(21.9–25.3) 19(16–23) 21.3(18.6–25.4) 21.4±1.1(18.9–23.0) b 2.5±0.1(2.3–2.6) 2.3(2.2–2.5) 3(2.7–3.4) — c 9.1±0.5(8.2–10.3) 8(7–9) 9(8.1–11) 9.0±0.6(7.8–11.0) 口针长 Stylet /μm 20.2±0.5(19.4–21.9) 22(21–23) 19.9(19.5–20.8) 20.7±0.6(18.9–22.4) 唇高
Labial region height/μm3.8±0.3(3.3–4.7) — — — 唇宽
Labial region diameter/μm9.4±0.4(8.3–10.1) — — — 口针基部球至背食道腺的距离
DGO/μm4.3±0.6(3.0–5.2) 5.5(5.0–6.7) 5.0(3.9–5.2) 3.8±0.8(2.4–5.0) 头顶至排泄孔
Anterior end to excretory pore /μm96.1±2.8(88.0–100.0) — 84.7(75.6–91) — 头顶至中食道球瓣门
Anterior end to median bulb valve /μm61.9±3.0(52.0–65.6) 68(64–76) 61(54.6–66.3) 65.0±6.9(55.3–77.6) 最大体宽
Max Body diameter /μm18.4±0.3(17.5–19.0) 23(19–26) — 20.1±0.6(18.9–22.4) 肛门处体宽
Body diameter at anus level /μm11.9±0.6(11.0–13.0) — 10.9(10.4–11.7) 12.7±0.7(11.3–14.4) 尾透明区长
Hyaline region /μm21.4±1.8(17.7–25.0) 24(18–30) 19.9(19.5–20.8) 25.1±1.6(22.5–29.9) 尾长
Tail /μm46.8±2.9(40.0–51.0) 51(44–57) 43.5(36.4–46.8) 48.5±2.7(42.6–53.8) 注:a, 体长/最大体宽;b,体长/体前端至食道与肠连接处的距离;c,体长/尾长。
Note: a, body length/maximum body width; b, body length/distance from the front of body to the junction of esophagus and intestine; c, body length/tail length.四川越西群体的孢囊呈球形、金黄色,阴门膜孔之间角质层脊数15~24 个,Granek比值为2.7~4.7,二龄幼虫口针长度19.4~21.9 μm,口针基部球近圆形、略向后倾斜、前面较平,DGO距离3.0~5.2 μm,透明尾长17.7~25.0 μm。上述特征或测计值均与马铃薯金线虫相符。
2.4 根系内部线虫染色结果
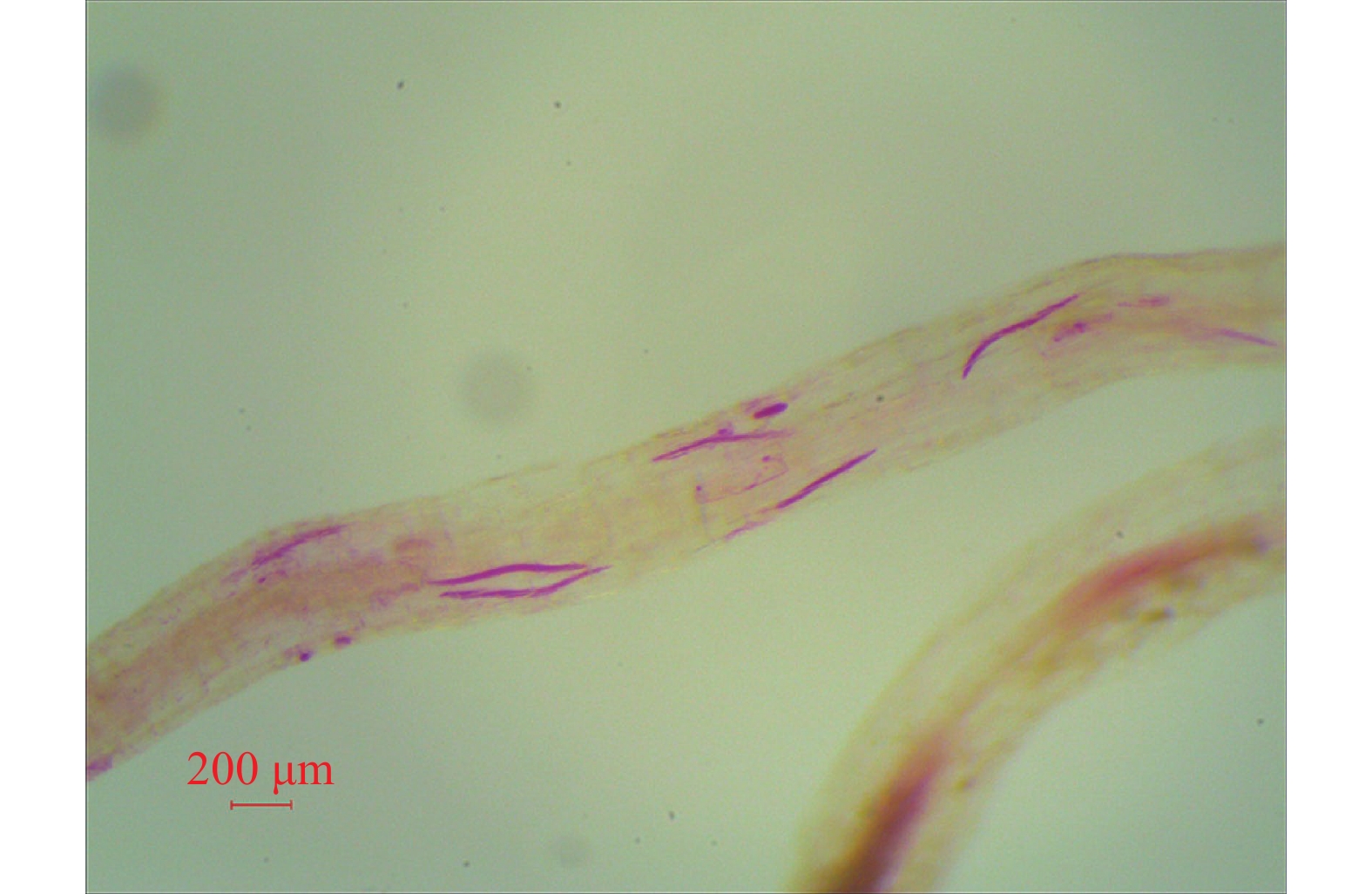
经根系透明染色后,可观察到根内有大量线虫寄生,呈粉红色(图4),其体长约400 μm, 体宽略短于20 μm,和表2中的测计值相符。进一步形态特征观察表明其与上述孢囊线虫二龄幼虫一致,因此该种线虫能入侵马铃薯根系内部。
2.5 线虫的分子生物学鉴定
2.5.1 特异性引物扩增
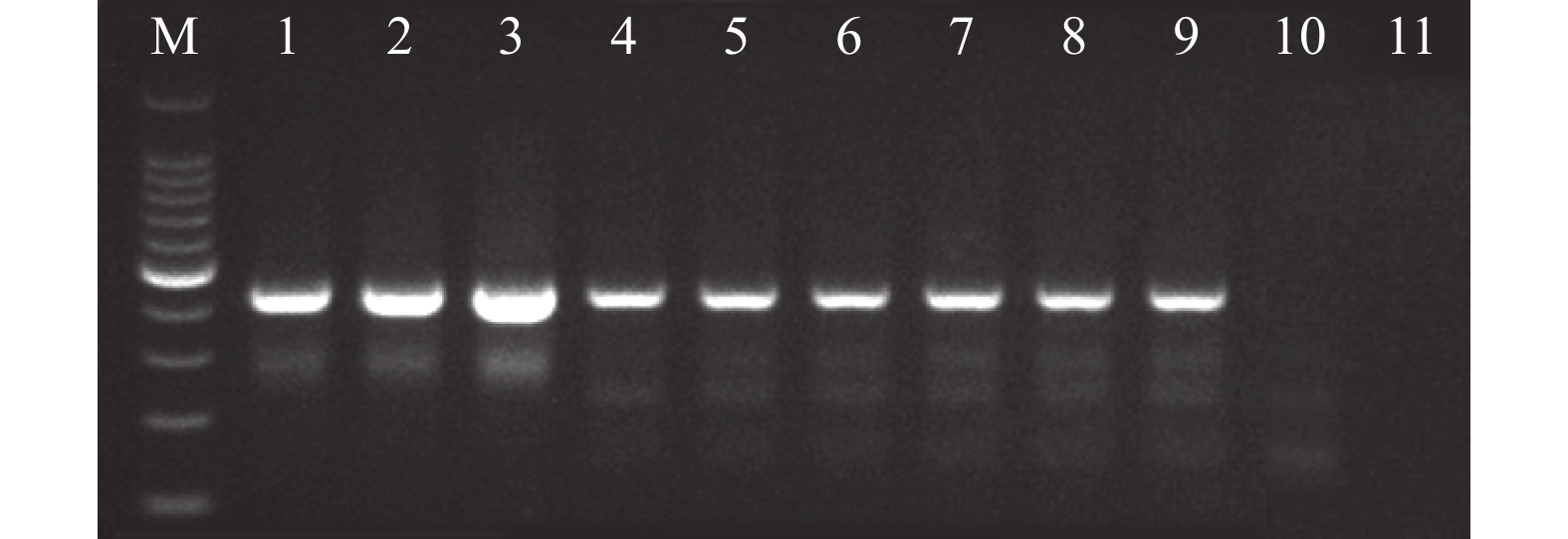
特异性引物扩增后,所测试的3个孢囊和4条二龄幼虫均得到了430 bp左右的明亮条带(图5),和预期的434 bp马铃薯金线虫种特异条带大小相一致。进一步测序后得到的序列长度均为434 bp,blast比对分析发现,和Genbank数据库中的马铃薯金线虫序列相似度为100%。
2.5.2 核糖体基因DNA序列分析
对该四川越西分离得到的线虫群体进行核糖体rDNA 18S 区基因扩增测序,3个模板获得的片段大小均为1 740 bp,GenBank登录号为MZ613180。该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体18S基因序列相似度为 99.41%(AY593877 1 696/1 701 bp)~ 99.94% (KJ636271 1 700/1 701 bp),和其他马铃薯白线虫的序列相似度为99.53%(Globodera pallida strain GlobPal10 KJ636269)~99.77%(Globodera pallida isolate GlobPal3 AY284620),和其他球孢囊属线虫的序列相似度为99.12%(Globodera achilleae strain GlobAch2 KJ636274)~100%(Globodera tabacum isolate 1094 FJ040401 1 701/1 701 bp)。因此,核糖体rDNA 18S 区基因无法准确区分球孢囊属具体种类,但能明确该群体属于球孢囊属。
该群体的核糖体28S 区基因扩增测序所得片段大小均为953 bp,GenBank登录号为MZ613167。该类群和其他国家和地区所报道的马铃薯金线虫群体28S基因序列相似度为 99.06%(AY592987 947/956 bp)~ 100%(MK311333 953/953 bp),和马铃薯白线虫(G. pallida)的28S序列相似度为97.59%(EU855119 932/955 bp)至 98.89% (LT159821 711/719 bp);和艾草球孢囊线虫(G. artemisiae)的28S序列相似度为98.01% (EU855121 937/956 bp)~ 98.19%(MT233316 702/720 bp);和烟草球孢囊线虫(G. tabacum)的28S序列相似度为99.40%(GQ294492)。同样,核糖体rDNA 28S 区基因无法准确区分球孢囊属一些种类,但能明确该四川越西群体属于球孢囊属。
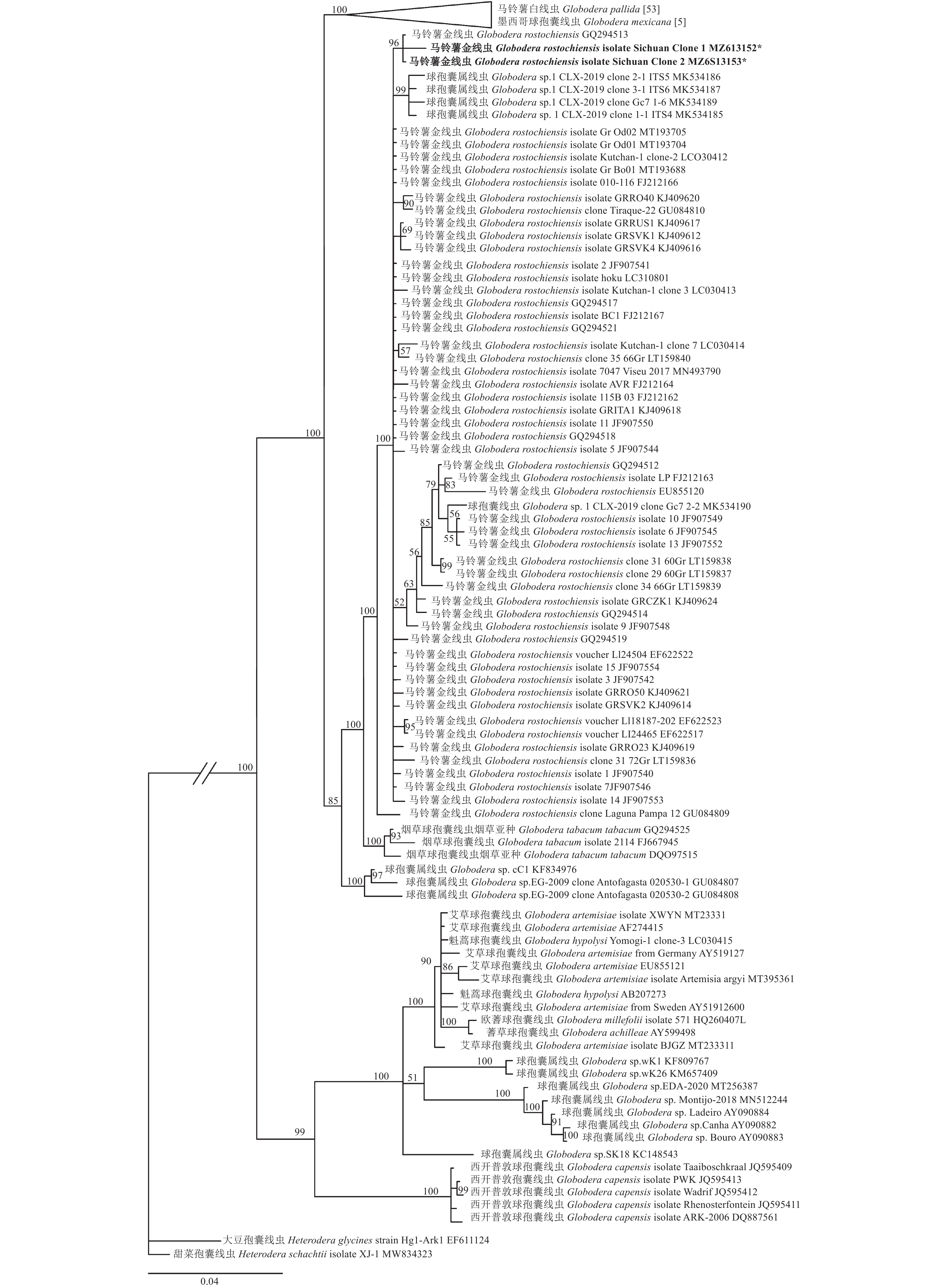
该群体的核糖体ITS 区基因扩增产物直接测序失败,经克隆测序后,得到2条序列,长度分别为1 040 bp和1 041 bp,GenBank登录号为MZ613152和MZ613153,两序列相似度为99.33%(1035/1041 bp)。该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体ITS基因序列相似度最高,为 97.90%(JF907553 981/1002 bp)~ 99.90%(GQ294513 1040/1041 bp),同时和其系统发育关系中的烟草球孢囊线虫的序列相似度为 97.26% (FJ667945 924/950 bp)~ 97.90 %(GQ294525 1024/1045 bp),和马铃薯白线虫的序列相似度最高为 96.5% (LT159833)。从系统发育树(图6)上可以看出,该四川越西群体和其他国家和地区所报道的马铃薯金线虫群体(源于NCBI网站)聚类在了具高置信度(后验证概率=100)同一分支,表明该四川越西群体确为马铃薯金线虫。
2.6 鉴定结论
孢囊属线虫属于孢囊线虫亚科,该科常见的有球孢囊线虫属线虫Globodera、刻点孢囊线虫属线虫Punctodera、仙人掌孢囊线虫属线虫Cactodera、孢囊线虫属线虫Heterodera[19]。刻点孢囊线虫属孢囊呈卵形、肛门区域形成膜孔;仙人掌孢囊线虫属孢囊呈柠檬形、有简化的阴门锥;孢囊属线虫呈柠檬形、有突出的阴门锥;而球孢囊属线虫孢囊呈球形、无阴门锥、肛门区不形成膜孔,可与近似属明显区分。该四川越西线虫群体孢囊呈球形、无阴门锥、肛门区不形成膜孔,明显为球孢囊属线虫。
据Subbotin等[19]报道,球孢囊属线虫包括10种线虫。此后,2012年美国Idaho州发现艾灵顿氏球孢囊线虫G. ellingtonae[20],2013年,南非杂草上发现西开普敦球孢囊线虫G. capensi[21], 2017年南非发现厄加勒斯球孢囊线虫G. agulhasensis[22],在南非杂草上又发现桑德维尔德球孢囊线虫G. sandveldensis[23]。因此,目前已经报道的球孢囊属线虫共计14种[23,24]。据Subbotin等[19]的检索表,G. mali孢囊角质层薄、透明;G. zelandica 二龄幼虫口针平均长度≥27 μm;G. leptonepia 二龄幼虫口针平均长度<19 μm;G. bravoae二龄幼虫透明尾长>31 μm 。G. capensis、G. millefolii、G. artemisiae、G. agulhasensis、G. sandveldensis等5种线虫大多寄生于菊科植物,Granek比值平均值≤2。因此待测样品很容易与上述9种线虫区分。四川越西群体与烟草孢囊线虫G. tabacum的区别是肛门和阴门膜孔之间角质层脊数[18(15~24)个vs 7(5~15)个];和G. ellingtonae的区别是肛门和阴门膜孔之间角质层脊数[18(15~24)个 vs 13(10~18)个];与墨西哥孢囊线虫G. mexicana的区别是Granek比值:平均3.7 vs 2.8。
根据寄主和形态特征,四川越西孢囊线虫群体容易与其他线虫进行区分,最相似的为马铃薯白线虫。与马铃薯白线虫的区别是雌虫和孢囊颜色(雌虫白色逐渐变黄,变成金黄或褐色的孢囊vs雌虫白色,变成褐色的孢囊),J2体长略短(405.0~443.5 μm vs 440~525 μm),J2口针长略短[20.2 (19.4~21.9) μm vs 23.6(21~26) μm],J2尾长略短[46.8 (40.0~51.0) μm vs 51.9(46~52) μm],J2口针基部球形态(近圆形、略向后倾斜、前面较平vs前表面向前突起),肛门和阴门膜孔之间角质层脊数[18(15~24) 个vs 12.2(8~20) 个],肛门至膜孔距离(43~76 μm vs 88~102 μm),Granek比值[3.7 (2.7~4.7) vs 2.2(1.2~3.6)][3,25]。
该四川越西线虫群体与马铃薯金线虫形态学基本一致。特异PCR方法、核糖体DNA序列分析,尤其是其ITS基因序列与已经登录的马铃薯金线虫十分近似,相似度高达99.9%,且与马铃薯白线虫的相似度最高只有96.5%。因此,形态学和分子生物学方法均支持该线虫为马铃薯金线虫。
3. 讨论与结论
马铃薯金线虫为害隐蔽,潜伏期长,侵染早期植株没有明显的症状,仅通过田间观察很难确认是否有该线虫为害。严重危害时,能导致寄主黄化、坏死、萎蔫、矮化甚至死亡,但上述症状与缺水缺肥等症状很难区分,常常需要采集土壤和根系样品,在实验室进行孢囊或幼虫的分离鉴定。镜检观察孢囊呈球形、无阴门锥、肛门区不形成膜孔,可判断该线虫属于球孢囊属;再根据二龄幼虫口针基部球近圆形,向后倾斜;口针平均长<23 μm;Granek比值≥3,可判断为马铃薯金线虫。
线虫体型微小,鉴定特征十分细微,形态学鉴定需要丰富的经验。因此,分子生物学方法是线虫鉴定的重要辅助手段。根据EPPO[25]的方法,本研究采用Bulman & Marshall [7]报道的马铃薯金线虫特异性引物ITS5和PITSr3对线虫孢囊或二龄幼虫进行PCR扩增,电泳和测序结果表明,扩增产物为434 bp,与报道的马铃薯金线虫特征片段完全一致。同时,本研究对四川越西群体核糖体rDNA 18S、rDNA 28S和ITS基因进行克隆、测序和分析发现,该群体18S和28S序列与马铃薯金线虫和马铃薯白线虫的序列相似度均较高,但难以区分具体种类,仅可以确定该线虫属于球孢囊属线虫。核糖体ITS基因序列分析表明,该种线虫和国外报道的马铃薯金线虫群体ITS基因序列相似度最高,系统发育树结果也表明该群体和其他国家和地区所报道的马铃薯金线虫群体聚类在了具高置信度(后验证概率=100)同一分支,证实四川越西群体确为马铃薯金线虫。因此,ITS基因作为分子靶标在球孢囊线虫的种类鉴定中较为有效,推荐用特异性PCR方法或ITS基因对马铃薯金线虫进行分子鉴定。
随着经济全球化和国际贸易的日趋频繁,马铃薯金线虫已经随马铃薯种质资源等的私人携带、交换或其他根系材料的引种而传入我国。李建中等[26]用生态位模型GARP和MaxEnt对马铃薯金线虫和白线虫在我国的适生区进行了分析,结果表明,云南东北部、贵州、重庆、四川东部、湖南、湖北南部、山东南部、河南、安徽和江苏等省市为马铃薯金线虫中高风险区。由于该线虫在我国具有适生区域广、防控难度大、潜在危害损失高和社会影响巨大等特点,一旦传入和定殖扩散,根除十分困难。在没有寄主作物的情况下,其孢囊能在土壤中存活20年以上[27]。因此建议在疫情发生区域采取严格的应急控制措施,力争消灭,同时在疫情周围及高风险区域设立监测点,严控疫情点的马铃薯和其他根茎类材料的跨区域调运,严防疫情扩散。鉴于马铃薯金线虫的为害经济重要性,需尽快完善马铃薯孢囊线虫疫情监测及防控技术体系,加强马铃薯种薯的检疫监督管理,开展马铃薯金线虫全国普查,增加马铃薯金线虫防控技术的研发投入,为我国马铃薯主粮化产业健康可持续发展保驾护航。
-
表 1 四川越西群体孢囊线虫样品与国外马铃薯金线虫测计值比较
Table 1 Morphometrics of cyst and J2 of Yuexi and foreign G. rostochiensis
项目 Items 四川越西样品
Sample from Yuexi SichuanGermany, Golden & Ellington[16] Russia, Kazachenko[17] Slovenis, Libelice,
Sirca & Urek[18]孢囊
Cyst (n)15 50 25 10 长(不包括颈)
Length (exclude neck)/μm484±79.9(362–599) 680(450–990) 589(467–725) — 宽
Width /μm424±83.4(327–550) 540(250–810) 559(430–713) — 长/宽
Length/width1.2±0.1(1.0–1.3) 1.27(1.0–1.8) 1.04(0.9–1.3) — 膜孔直径
Fenestra width /μm16.7±2.9(13.0–23.0) 15.0(8–20) 14.1(10.4–19.5) 17.9±1.7(14.6–19.4) 脊数
Numer of ridges18.3±2.4(15.0–24.0) — — 18.3±1.6(16–22) 肛门至膜孔距离
Anus-fenestra distance/μm61.4±9.6(43–76) 68(29–116) 50.7(33.8–78) 64.8±4.7(58.1–73.3) Granek值
Granek’s ratio3.7±0.6(2.7–4.7) 4.5(2.0–7.0) 3.7(2.1–5.4) 3.6±0.4(3.0–4.3) J2(n) 20 50 25 30 体长
Length/μm422.5±11.8(405–444) 430(370–470) 392(366–406) 434.4±16.7(402.7–468.0) a 22.9±0.8(21.9–25.3) 19(16–23) 21.3(18.6–25.4) 21.4±1.1(18.9–23.0) b 2.5±0.1(2.3–2.6) 2.3(2.2–2.5) 3(2.7–3.4) — c 9.1±0.5(8.2–10.3) 8(7–9) 9(8.1–11) 9.0±0.6(7.8–11.0) 口针长 Stylet /μm 20.2±0.5(19.4–21.9) 22(21–23) 19.9(19.5–20.8) 20.7±0.6(18.9–22.4) 唇高
Labial region height/μm3.8±0.3(3.3–4.7) — — — 唇宽
Labial region diameter/μm9.4±0.4(8.3–10.1) — — — 口针基部球至背食道腺的距离
DGO/μm4.3±0.6(3.0–5.2) 5.5(5.0–6.7) 5.0(3.9–5.2) 3.8±0.8(2.4–5.0) 头顶至排泄孔
Anterior end to excretory pore /μm96.1±2.8(88.0–100.0) — 84.7(75.6–91) — 头顶至中食道球瓣门
Anterior end to median bulb valve /μm61.9±3.0(52.0–65.6) 68(64–76) 61(54.6–66.3) 65.0±6.9(55.3–77.6) 最大体宽
Max Body diameter /μm18.4±0.3(17.5–19.0) 23(19–26) — 20.1±0.6(18.9–22.4) 肛门处体宽
Body diameter at anus level /μm11.9±0.6(11.0–13.0) — 10.9(10.4–11.7) 12.7±0.7(11.3–14.4) 尾透明区长
Hyaline region /μm21.4±1.8(17.7–25.0) 24(18–30) 19.9(19.5–20.8) 25.1±1.6(22.5–29.9) 尾长
Tail /μm46.8±2.9(40.0–51.0) 51(44–57) 43.5(36.4–46.8) 48.5±2.7(42.6–53.8) 注:a, 体长/最大体宽;b,体长/体前端至食道与肠连接处的距离;c,体长/尾长。
Note: a, body length/maximum body width; b, body length/distance from the front of body to the junction of esophagus and intestine; c, body length/tail length. -
[1] WOLLENWEBER H. Krankheiten und Beschädingung der Kartoffel [J]. Arbeiten Forschungs Institut für Kartoffel, 1923, 7: 1−56.
[2] STONE A R. Heterodera pallida n. sp. (Nematoda: Heteroderidae), a second species of potato cyst nematode [J]. Nematologica, 1973, 18(1972): 591−606.
[3] 彭焕, 刘慧, 江如, 等. 警惕检疫性有害生物马铃薯孢囊线虫(Globodera rostochiensis和G. pallida)入侵我国 [J]. 植物保护, 2020, 46(6):1−9. PENG H, LIU H, JIANG R, et al. Potential invasion of the potato cyst nematode Globodera rostochiensis and G. pallida into China [J]. Plant Protection, 2020, 46(6): 1−9.(in Chinese)
[4] BYBD D W, KIRKPATRICK T, BARKER K R. An improved technique for clearing and staining plant tissues for detection of Nematodes [J]. Journal of Nematology, 1983, 15(1): 142−143.
[5] FAN J W, HU C L, ZHANG L N, et al. Jasmonic acid mediates tomato's response to root knot Nematodes [J]. Journal of Plant Growth Regulation, 2015, 34(1): 196−205. DOI: 10.1007/s00344-014-9457-6
[6] 王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法 [J]. 植物检疫, 2011, 25(2):32−35. WANG J L, ZHANG J C, GU J F. Method of extract DNA from a single nematode [J]. Plant Quarantine, 2011, 25(2): 32−35.(in Chinese)
[7] BULMAN S R, MARSHALL J W. Differentiation of Australasian potato cyst nematode (PCN) populations using the polymerase chain reaction (PCR) [J]. New Zealand Journal of Crop and Horticultural Science, 1997, 25(2): 123−129. DOI: 10.1080/01140671.1997.9513998
[8] HOLTERMAN M, VAN DER WURFF A, VAN DEN ELSEN S, et al. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among Nematodes and accelerated evolution toward crown clades [J]. Molecular Biology and Evolution, 2006, 23(9): 1792−1800. DOI: 10.1093/molbev/msl044
[9] NADLER S A, CARRENO R A, MEJÍA-MADRID H, et al. Molecular phylogeny of clade III Nematodes reveals multiple origins of tissue parasitism [J]. Parasitology, 2007, 134(Pt 10): 1421−1442.
[10] CURRAN J, DRIVER F, BALLARD J W O, et al. Phylogeny of metarhizium-analysisi of ribosoma DNA-sequence data [J]. Mycological Research, 1994, 98: 547−552. DOI: 10.1016/S0953-7562(09)80478-4
[11] THOMPSON J D, HIGGINS D G, GIBSON T J. CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice [J]. Nucleic Acids Research, 1994, 22(22): 4673−4680. DOI: 10.1093/nar/22.22.4673
[12] DARRIBA D, TABOADA G L, DOALLO R, et al. jModelTest 2: More models, new heuristics and parallel computing [J]. Nature Methods, 2012, 9(8): 772.
[13] RONQUIST F, HUELSENBECK J P. MrBayes 3: Bayesian phylogenetic inference under mixed models [J]. Bioinformatics, 2003, 19(12): 1572−1574. DOI: 10.1093/bioinformatics/btg180
[14] LARGET B, SIMON D. Markov chasin Monte Carlo algorithms for the Bayesian analysis of phylogenetic trees [J]. Molecular Biology and Evolution, 1999, 16(6): 750. DOI: 10.1093/oxfordjournals.molbev.a026160
[15] STÖVER B C, MÜLLER K F. TreeGraph 2: Combining and visualizing evidence from different phylogenetic analyses [J]. BMC Bioinformatics, 2010, 11: 7. DOI: 10.1186/1471-2105-11-7
[16] GOLDEN A M, ELLINGTON D M S. Redescription of Heterodera rostochiensis (Nematoda: Heteroderidae) with a key and notes on closely related species [J]. Proceedings of the Helminthological Society of Washington, 1972, 39: 64−77.
[17] KAZACHENKO I P. Cyst-forming nematodes of the Russian Far East and measures of their control [J]. Vladivostok, USSR, Dalnauka, 1993: 77.
[18] SIRCA S, UREK G. Morphometrical and ribosomal DNA sequence analysis of Globodera rostochiensis and Globodera achilleae from Slovenia [J]. Russian Journal of Nematology, 2004(12): 161−168.
[19] SUBBOTIN S A, HALFORD P D, WARRY A, et al. Variations in ribosomal DNA sequences and phylogeny of Globodera parasitising Solanaceae [J]. Nematology, 2000(2): 591−604.
[20] HANDOO Z A, CARTA L K, SKANTAR A M, et al. Description of Globodera ellingtonae n. sp. (Nematoda: Heteroderidae) from Oregon [J]. Journal of Nematology, 2012, 44(1): 40−57.
[21] KNOETZE R, SWART A, TIEDT L R. Description of Globodera capensis n. sp. (Nematoda: Heteroderidae) from South Africa [J]. Nematology, 2013, 15(2): 233−250. DOI: 10.1163/15685411-00002673
[22] KNOETZE R A B, SWART A C, WENTZEL R A, et al. Description of Globodera agulhasensis n. Sp. (Nematoda: Heteroderidae) from South Africa [J]. Nematology, 2017(3): 305−322.
[23] KNOETZE R, SWART A, WENTZEL R, et al. Description of Globodera sandveldensis n. sp (Nematoda: Heteroderidae) from South Africa [J]. Nematology, 2017(7): 805−816.
[24] 中华人民共和国农业农村部, 海关总署. 中华人民共和国进境植物检疫性有害生物名录[OL]. [2021-10-22]. http://www.customs.gov.cn/dzs/2746776/3699554/index.html. [25] EPPO. PM 7/40 (4) Globodera rostochiensis and Globodera pallida [J]. EPPO Bulletin, 2017, 47(2): 174−197. DOI: 10.1111/epp.12391
[26] 李建中, 彭德良. 马铃薯孢囊线虫在我国的适生性风险分析与控制预案[C]. 中国植物病理学会学术年会, 2009: 401. [27] WINSLOW R D, WILLIS R J. Nematode diseases of potatoes. II. Potato cyst nematode, Heterodera rostochiensis. In Economic Nematology; Webster, J. , Ed[M]. Academic Press: New York, NY, USA, 1972: 18–34.
-
期刊类型引用(3)
1. 尹艳蝶,杨艳梅,付启春,王琴,李永青,段锦凤,刘玉竹,王桥美,胡先奇. 马铃薯根系分泌物对马铃薯金线虫孵化和趋化的影响及外源酸类物质的验证. 中国农业科学. 2024(11): 2161-2175 .  百度学术
百度学术
2. 段锦凤,杨艳梅,刘玉竹,李乾坤,胡先奇. 云南常见马铃薯品种对马铃薯金线虫的抗性及其与抗性基因H1的相关性. 植物保护. 2024(06): 126-132 .  百度学术
百度学术
3. 宋家雄,许翀,陈敏,李永青,张汉学,普松权,梅焱,杨毅娟,彭德良. 马铃薯金线虫发生特点及综合防控方法. 植物检疫. 2023(01): 68-72 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载: