Estimation of Aboveground Rice Biomass by Unmanned Aerial Vehicle Imaging
-
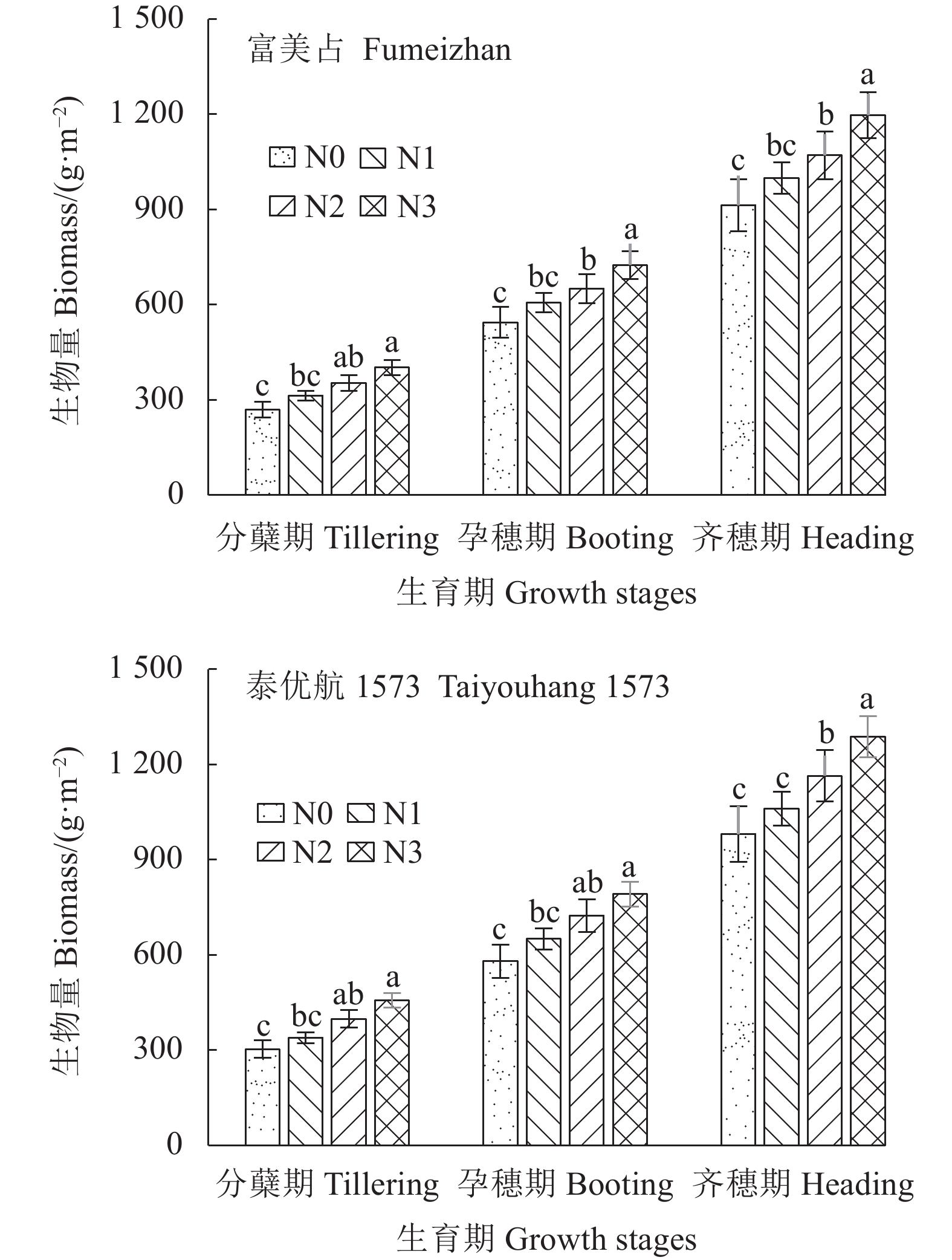
摘要:目的 为探究无人机图像估算水稻地上部生物量(Aboveground biomass,AGB)的可行性,明确各图像特征与水稻AGB的定量关系,构建基于图像特征的水稻AGB估算模型。方法 通过实施2个品种和4个施氮水平的小区试验,于分蘖期、孕穗期和齐穗期测定水稻AGB,同步采用无人机搭载数码相机获取水稻图像并提取颜色指数和纹理特征,分析其在不同生育期与水稻AGB之间的相关性,构建定量估算模型,并对模型进行检验。结果 颜色指数中红蓝差值(r-b)与水稻AGB之间的相关性最好,纹理特征参数(G-mean)与水稻AGB之间的相关性最高;基于红蓝差值(r-b)和G-mean构建的水稻AGB双指数模型优于单一指数模型,全生育期估算模型y=2544.507+5054.243x1−145.543x2−556.553x1x2+27379.41x12+3.927x22,建模决定系数(R2)为0.9202,模型检验的决定系数(R2)为0.9112。结论 基于颜色指数(r-b)和纹理特征参数(G-mean)融合构建的AGB估算模型可准确的估算水稻AGB,在水稻长势快速无损监测和精确管理中具有应用价值。Abstract:Objective Feasibility of using images generated by unmanned aerial vehicle (UAV) to estimate the aboveground biomass (AGB) on a rice field was evaluated for crop production prediction.Methods On fields of two different varieties of rice fertilized with 4 varied nitrogen applications, AGB of rice plants at tillering, booting, and full heading stages were recorded by using the UAV imaging technology. Data on color and texture measurements were extracted from the images to correlate with corresponding AGB. A mathematic model was constructed, tested, and validated for prediction accuracy.Result On color, the red and blue differentiation (r-b) of the images highly correlated with the AGB; on texture, it was the G-mean. A prediction model was thus obtained for the entire growth period as y=2 544.507+5 054.243x1−145.543x2−556.553x1x2+27 379.41x12+3.927x22 , which had a correlation coefficient (R2) of 0.920 2 and a test determination coefficient of 0.911 2.Conclusion The prediction model based on r-b and G-mean derived from the UAV images performed satisfactorily in monitoring the AGB for the entire growth period of rice in the field. It was conceivably applicable for the farming operation and crop management.
-
Keywords:
- Rice /
- aboveground biomass /
- UAV image /
- estimation model
-
0. 引言
【研究意义】自2020年以来,我国江苏、山东、福建等鹅养殖地区出现了以雏鹅肝脾白色针尖状坏死点为主要病变特征的新疫病[1],病原被鉴定为鹅源番鸭呼肠孤病毒(goose-origin muscovy reovirus, Go-MDRV)或新型鹅呼肠孤病毒(novel goose reovirus, NGRV)[2]。该病发病率和死亡率高,对我国鹅产业的健康发展造成了严重影响。因此,开展鹅源呼肠孤病毒毒株的分离鉴定,有助于更好了解该病的危害及毒株病原情况,为该病预防和控制提供理论基础。【前人研究进展】番鸭呼肠孤病毒(muscovy duck reovirus, MDRV)属于呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus),主要易感宿主为雏番鸭[3]。1997年以来,我国番鸭养殖场相继暴发了番鸭呼肠孤病毒病,临床上以肝脾表面和切面大量白色针尖状坏死点为主要病变特征,俗称“番鸭花肝病”或“番鸭肝白点病”[4]。此病主要在7~45日龄的雏番鸭群中流行,发病率在30%~90%,病死率可高达60%~80%[5]。有学者从肝脏和脾脏出血的典型病变雏鹅中分离到一株鹅源鸭呼肠孤病毒,σC基因测定表明是一株鹅源番鸭呼肠孤病毒(Go-MDRV),通过雏番鸭和雏鹅的致病性试验发现Go-MDRV对雏鹅和雏番鸭均有一定的致病性[6]。根据临床症状和病理变化,可将我国目前流行的水禽呼肠孤病毒分为两种:引起番鸭“肝白点”病的番鸭呼肠孤病毒和引起鸭出血性坏死性肝炎的新型呼肠孤病毒[3,7]。这两种水禽呼肠孤病毒均能感染鹅,前者感染导致鹅肝脾白点,后者感染肝脾出血坏死样病变。水禽呼肠孤病毒的σB蛋白和σC 蛋白是病毒外衣壳蛋白的成分,σB蛋白含有群特异性中和抗原表位,能特异性地结合宿主细胞,促进病毒复制位于病毒粒子外衣壳的表面,在病毒的吸附中发挥着重要作用[8]。σC蛋白是病毒外衣壳中最小的一种蛋白,作为吸附蛋白与宿主细胞受体特异性结合,识别并启动宿主病毒感染,是影响病毒宿主范围和致病性的关键蛋白[9,10]。水禽呼肠孤病毒作为分节段病毒,病毒复制所需RNA聚合酶矫正功能不强,导致该病毒在复制过程中容易发生基因重组[11],出现致病性、传染性、致死性和宿主范围有差异的变异株。【本研究切入点】近年来,雏鹅出现软脚,肝、脾白色坏死点样病变的病例逐渐增多[6,12−15],病原为鹅源番鸭呼肠孤病毒,但是鹅源番鸭呼肠孤病毒与经典的番鸭呼肠孤病毒相比,其全基因与致病性的差异还不明晰,开展鹅源番鸭呼肠孤病毒毒株的分离鉴定,有助于解析番鸭呼肠孤病毒在番鸭和鹅中的进化规律,为致病机制及防控技术研究提供依据。【拟解决的关键问题】为探究江苏省徐州市某鹅养殖场病雏鹅在临床症状上出现肝脏和脾脏白色坏死点、肝脏和肾脏肿大的死亡原因,从病雏鹅肝脏和脾脏中分离得到1株病毒,通过分离鉴定、测序分析和动物回归试验,确定其病原体为鹅源番鸭呼肠孤病毒,为我国番鸭呼肠孤病毒的防控提供分子流行病学研究数据。
1. 材料与方法
1.1 病料来源
江苏省徐州市某养殖场,鹅表现出软脚、不愿走动、精神不振等临床症状。发病死亡鹅剖检见肝脏和脾脏有白色坏死点,肝脏和肾脏肿大。
1.2 主要试剂
DL2000 DNA Marker购自宝生物工程(大连)有限公司;琼脂糖凝胶DNA快速回收试剂盒、质粒小提试剂盒购自北京擎科生物科技有限公司;胰蛋白胨、酵母提取物、琼脂糖均购自Sigma公司;病毒DNA/RNA提取试剂盒、2×Taq Plus Master Mix、5 min TA/Blunt-Zero Cloning Kit、Phanta Max Super-Fidelity DNA Polymerase、反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit和RNase-free ddH2O均购自南京诺唯赞生物科技有限公司;核酸染料GelStain(
10000 ×)和大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;氨苄青霉素购自生工生物工程(上海)股份有限公司;切片石蜡和HE染色试剂盒购自上海吉至生化科技有限公司。1.3 主要仪器
普通梯度PCR仪(CF-F9677)购自卡尤迪生物科技(北京)有限公司;电泳电源(power600)购自北京百晶生物技术有限公司;凝胶成像分析系统(Tanon-
3500 )购自上海天能科技有限公司;石蜡切片机(M2235)购自德国徕卡微系统有限公司;超纯水机(UPH-1-10TN)购自四川优普超纯科技有限公司;离心机(TS1520)购自山海天(苏州)科技有限公司;制冰机(IMS-40)购自雪科电器有限公司;高压灭菌锅(MLS-830L)购自普和希健康医疗器械(上海)有限公司。1.4 试验动物、鸭胚和细胞
番鸭胚和3日龄健康雏鹅购自漳州某养殖场;取孵化15 d的番鸭胚制备番鸭胚成纤维细胞(MDEF)。
1.5 反转录聚合酶链反应RT-PCR检测
将病料组织剪成适当体积,放入研钵,加入3倍组织体积的Hank’s液混合研磨成匀浆。随后将病毒组织液于−80 ℃中反复冻融3次,
8000 r·min-1离心10 min,离心后上清液使用0.22 μm滤器过滤,病毒液于−80 ℃冰箱保存备用。取200 μL病料匀浆上清,按照FastPure Viral DNA/RNA Mini Kit提取试剂盒说明书提取病毒核酸,将提取的RNA按照反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit说明书将RNA反转录为cDNA,并置于−80 ℃中保存备用。利用Oligo 6引物设计软件,参照 GenBank 中已发表的MDRV S4序列设计特异性检测引物。同时通过参考相关文献,对鹅细小病毒(goose parvovirus, GPV)[16]、番鸭细小病毒(muscovy duck parvovirus, MDPV)[16]、鸭腺病毒B血清2型(duck adenovirus B2, DAdV B2)[17]、鸭甲型肝炎病毒1型(duck hepatitis A viral, DHAV-1)[18]、鸭病毒性肠炎病毒(duck virus enteritis, DEV)[19]、NDRV [20]、禽流感病毒H9亚型(avian influenza virus H9 subtype, AIV H9)[21]和禽坦布苏病毒(avian tembusu virus, ATMUV)[22]等常见鸭源病毒合成检测引物(表1),由北京擎科生物科技有限公司合成。PCR检测反应体系为2×Taq Plus Master Mix 10 μL,上游引物和下游引物各1 μL,模板2 μL,ddH2O 6 μL。反应程序为预变性95 ℃ 3 min;变性95 ℃ 15 s,退火60 ℃ 15 s,延伸72 ℃ 45 s,共35个循环;彻底延伸5 min后4 ℃保存。最后取10 μL PCR产物进行琼脂糖凝胶电泳检测(1.5%琼脂糖),使用紫外凝胶成像仪查看结果。
表 1 用于病原检测的引物Table 1. Primers used for pathogen identification引物名称
Prime name引物序列
Primers sequence (5'–3')产物大小
Product
size/bp番鸭呼肠弧病毒
MDRVF:TTCCTGGCTCGCTAAGATAGA 327 R:ATCCATGCAATCCTGAAGGC 鹅细小病毒
GPVF:GAGGTAGACAGCAACAGAAA 343 R:GCTCGTCCGTGACCATA 番鸭细小病毒
MDPVF:TAATGGTGGCAGGAATGCACAGTTC 311 R:TGTTACCATGATGTCTGAAAT 鸭腺病毒B血清2型
DAdV B2F: TATCCCTACTGGTGGCCCTC 581 R:TCAGTGGCTGCGTACACTTT 鸭甲型肝炎病毒1型
DHAV-1F:CAACTCGACCAATHCCTGG 462 R:CCTGRTGRACCATTGTRACTG 鸭病毒性肠炎病毒
DEVF:TGGGAAGGCTTTCGGTCGC 232 R:CATTCGCGCCTTTGCTAAATTCTCT 新型鸭呼肠孤病毒
NDRVF:TCGTCACTACTGTCAAGCTC 594 R:TATGTATGAGAGGAGCCACA 禽流感病毒H9亚型
AIV H9F:ACAGAGCATAATGGGATGCT 367 R:GGGCGTCTTGGATAGGGTAAT 禽坦布苏病毒
ATMUVF:ATGACGGACACCACTCCTTT 200 R:GGGCTGCGTTACTATTCACC 1.6 病毒分离培养
将PCR鉴定为阳性的研磨液过滤后接种到11日龄的番鸭胚的尿囊腔中,每枚胚接种0.2 mL,接种完后用石蜡封孔,并做好标记。在37 ℃温箱中培养7 d。每天早晚观察有无死胚,丢弃24 h内死亡胚,在无菌超净台内收集2 d后死亡胚尿囊液,若番鸭胚至第7天还未死亡,则放入4 ℃冰箱处死后再无菌收集尿囊液,于–80 ℃保存,之后进行连续传代。将收集到的尿囊液参照上述方法进行核酸提取、反转录,并进行PCR鉴定。
将稳定传代的尿囊液用0.22 μm滤器过滤,取800 μL接种到生长状况良好的MDEF上,置于37 ℃、5% CO2的细胞培养箱中,吸附1 h后取出,吸出病毒液,加入2%的维持液,观察细胞状态。当病变达到80%时收集病毒液。经反复冻融后按照同样的方法盲传3代。
1.7 病毒σB和σC基因序列测定及分析
参照GenBank中MDRV σB和σC基因的保守序列设计2对引物(表2),由北京擎科生物有限公司合成。经过RT-PCR扩增基因序列,用1.5%琼脂糖凝胶电泳检测RT-PCR产物。将RT-PCR产物经胶回收试剂盒回收纯化后,按照5 min TA/Blunt-Zero Cloning Kit试剂盒说明书,与载体连接,转化至DH5α感受态细胞,涂布至含氨苄抗性的LB琼脂平板,37 ℃恒温培养箱过夜培养。无菌挑取白色单个菌落,接种至带有氨苄抗性LB液体培养基中,37 ℃摇床220 r·min-1振荡培养8 h,待菌液浑浊后提取质粒。使用Trelief® Plasmid Mini Kit Plus高纯度质粒小提试剂盒,对提取的质粒进行PCR扩增,将检测结果为阳性的质粒送往北京擎科生物科技有限公司进行测序,测序结果在NCBI BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行比对验证。通过DNAStar 5.0程序包中的MegAlign软件Clustal W方法进行JS2022株σB和σC基因核苷酸和氨基酸同源性比对,用MEGA 11软件制作进化树。
表 2 扩增番鸭呼肠孤病毒σB和σC基因的引物Table 2. Primer used for MDRV σB and σC引物名称
Prime name引物序列
Primers sequence (5'–3')产物大小
Product size/bpσB-F GCTTTTTGAGCCCTTAGCGTGC 1201 σB-R GATGAATACTGAGCCCCGCTGA σC-F ATGTCCGAAACTCCCGCTCC 810 σC-R TCAAATGGTCGCAATGGAGA 1.8 动物回归试验
将16只11日龄健康雏鹅随机分成两组,攻毒组8羽,每只在腿肌部位注射1.2 mL病毒尿囊液;健康对照组8羽,同样在腿肌部位注射同等剂量的Hank’s液。将两组雏鹅分别养在两个动物房内,饲养14 d,每天观察记录雏鹅的发病与死亡情况。采集病死鹅的肝脏和脾脏用10%甲醛固定液固定组织用于病理组织切片的制备。
2. 结果与分析
2.1 病料的病原检测
如图1所示,将病料用上述设计的番鸭呼肠孤病毒检测引物以及其他病原检测引物进行PCR扩增,仅有番鸭呼肠孤病毒特异性引物有扩增条带,大小为327 bp,与预期大小相符,其他病原检测引物均无条带,初步判断此份临床样品为番鸭呼肠孤病毒感染。
![]() 图 1 病料中的病原PCR检测结果M:DNA分子质量标准;-:阴性对照;1~9检测引物分别为:番鸭呼肠弧病毒、鹅细小病毒、番鸭细小病毒、鸭腺病毒B血清2型、鸭甲型肝炎病毒1型、鸭病毒性肠炎病毒、新型鸭呼肠孤病毒、禽流感病毒H9亚型、鸭坦布苏病毒;+:番鸭呼肠弧病毒阳性对照。Figure 1. PCR detection on pathogens in tissue specimensM: DL2000 DNA marker; -: negative control; 1–9: detection primers for MDRV, GPV, MDPV, DAdV B2, DHAV-1, DEV, NDRV, AIV H9 and ATMUV, respectively; +: positive control of MDRV.
图 1 病料中的病原PCR检测结果M:DNA分子质量标准;-:阴性对照;1~9检测引物分别为:番鸭呼肠弧病毒、鹅细小病毒、番鸭细小病毒、鸭腺病毒B血清2型、鸭甲型肝炎病毒1型、鸭病毒性肠炎病毒、新型鸭呼肠孤病毒、禽流感病毒H9亚型、鸭坦布苏病毒;+:番鸭呼肠弧病毒阳性对照。Figure 1. PCR detection on pathogens in tissue specimensM: DL2000 DNA marker; -: negative control; 1–9: detection primers for MDRV, GPV, MDPV, DAdV B2, DHAV-1, DEV, NDRV, AIV H9 and ATMUV, respectively; +: positive control of MDRV.2.2 病毒的鸭胚分离
将病料研磨液经过滤后接种到11日龄番鸭胚,番鸭胚在传至第2代时开始死亡,死亡时间在接种后第3天;传至第6代时番鸭胚死亡时间趋于稳定,基本稳定在第3~5天。死亡番鸭胚尿囊液清澈,尿囊膜出现增厚、水肿的现象;胚体皮肤和皮下出现出血点,呈鲜红色(图2)。
2.3 病毒的细胞分离培养
将稳定传代的尿囊液过滤后接种到生长状况良好的MDEF细胞上,连续传代,传至第3代时细胞在第4 天开始圆缩、崩解(图3),传至第6代时趋于稳定。正常对照细胞生长良好,未出现病变。结果表明成功分离到一株鹅源番鸭呼肠孤病毒,将该毒株命名为JS2022株。
2.4 σB和σC基因序列测定及分析
利用DNAStar分析软件进行序列拼接,并上传至GenBank公共数据库,登录号为OP598195~OP598204。JS2022株σB基因片段长度为
1104 bp,编码367个氨基酸;σC基因片段长度为810 bp,编码269个氨基酸。通过DNAStar 5.0程序包中的MegAlign软件Clustal W方法进行JS2022株σB和σC基因核苷酸同源性比对(图4和图5)及氨基酸同源性比对(图6和图7),结果显示JS2022株σB和σC基因序列与鹅源番鸭呼肠孤核苷酸序列的同源性分别为99.1%~99.5%和99.3%~99.9%,氨基酸序列同源性分别为92.9%~99.7%和92.9%~99.7%;与禽呼肠孤病毒的同源性最低,核苷酸同源性分别为59.7%~61.5%和31.4%~33.7%,氨基酸序列同源性分别为60.5%~61.3%和20.8%~21.4%;与番鸭呼肠孤病毒的同源性也相对较高,核苷酸同源性分别为91.0%~96.8%和91.8%~99.1%,氨基酸序列同源性分别为91.8%~97.5%和93.6%~99.7%;与新型鸭呼肠孤病毒的核苷酸同源性分别为66.9%~67.5%和30.4%~30.6%,氨基酸序列同源性分别为68.9%~70.6%和34.1%~34.7%。σB和σC基因核苷酸序列同源性结果表明,JS2022分离株与禽呼肠孤病毒和新型鸭呼肠孤病毒同源性差异较大,与近年来鹅源番鸭呼肠孤病毒的同源性高,且σC基因与鹅源禽呼肠孤病毒HEB株和AHFY株同源性高达99.9%,核苷酸仅有一个差异位点(A78T),导致对应的氨基酸位点也发生了变化(E26D),与鹅源禽呼肠孤病毒 GD2020株、GD-88/2021株核苷酸有6个差异位点(C17T、A78T、T246C、T405C、T594G、T630C),对应氨基酸位点有2处差异(A6V、E26D);σB基因与GD2020株、GD-88/2021株核苷酸有6个差异位点(T33C、C435T、C486A、C819T、A978C、C1098T),而对应氨基酸位点仅有1处差异(Q326H)。
为了进一步分析JS2022株σB和σC基因序列与其他水禽呼肠孤病毒的进化关系,根据测序结果用MEGA 11软件绘制了σB和σC基因的系统发育进化树(图8和图9)。从进化树可看出,分离株JS2022株σB基因与2020年以来分离到的鹅源禽呼肠孤病毒GD2020株、GD-88/2021株处于同一分支,与进化树中的所有番鸭呼肠孤病毒毒株处在同一大分支中,σC基因也同样与鹅源禽呼肠孤病毒GD2020株、GD-88/2021株、HEB株、AHFY株处于番鸭呼肠孤病毒毒株大分支。表明JS2022株与鹅源番鸭呼肠孤病毒的亲缘关系更近,与禽呼肠孤病毒和新型鸭呼肠孤病毒的亲缘关系较远。
2.5 动物回归试验
在整个试验期间,对照组雏鹅均未出现任何异常症状。攻毒组在攻毒后第2天部分雏鹅开始发病,感染鹅出现精神沉郁、不愿走动、软脚、拉稀等症状;攻毒后5~7 d死亡2羽,及时剖检感染鹅发现肝脏和脾脏均出现密密麻麻的针尖状白点(图10A、B),肾脏肿大且有白点(图10C),胸腺和法氏囊萎缩,胰腺有散在出血点(图10D)。攻毒10 d后雏鹅状态开始恢复后续无死亡现象,但是耐过鹅生长发育受阻,个别鹅成为侏儒鹅。
![]() 图 10 分离毒株的动物回归试验A:肝脏出现大量针尖状白色坏死点;B:脾脏肿大,有大针尖状的白色坏死点;C:肾脏肿大,散在的白色坏死灶;D:胰腺有少量出血点。Figure 10. Regression test on gooselings inoculated with isolated strain of virusA: numerous white pinhead necrotic foci appeared on goose liver; B: splenomegaly with enlarged necrotic foci; C: enlarged kidneys with scattered necrotic foci; D: a small number of hemorrhages on goose pancreas.
图 10 分离毒株的动物回归试验A:肝脏出现大量针尖状白色坏死点;B:脾脏肿大,有大针尖状的白色坏死点;C:肾脏肿大,散在的白色坏死灶;D:胰腺有少量出血点。Figure 10. Regression test on gooselings inoculated with isolated strain of virusA: numerous white pinhead necrotic foci appeared on goose liver; B: splenomegaly with enlarged necrotic foci; C: enlarged kidneys with scattered necrotic foci; D: a small number of hemorrhages on goose pancreas.2.6 病理组织学观察
整个动物试验过程中对照组鹅均无任何异常。病毒感染雏鹅死后及时取其肝脏、脾脏和肾脏进行病理切片制作,光学显微镜下(200×)观察可见肝脏发生局灶性坏死,肝小叶内可见大量的坏死肝细胞残体,局部可见淋巴细胞浸润及少量的红细胞(图11A红色箭头),坏死灶周围的肝细胞呈不同程度的细胞肿胀和脂肪变性(图11A黑色箭头),肝窦内有红细胞淤积;脾脏红髓和白髓界限不清,淋巴滤泡内部分淋巴细胞坏死呈红色均质(图11B绿色箭头),巨噬细胞数量增多(图11B蓝色箭头),红髓内血窦扩张(图11B红色箭头);肾组织中肾小球(图11C蓝色箭头)未见明显异常,肾小管可见细胞管型,肾小管上皮细胞发生广泛的变性、坏死和脱落(图11C绿色箭头),间质可见少量炎细胞浸润(图11C红色箭头)。
3. 讨论
番鸭呼肠孤病毒是导致番鸭“肝白点病”和“花肝病”的病原,感染后宿主发病率高、传染性强,发病番鸭临床上表现为软脚、精神状态差、拉稀等,病理剖检典型病变为肝脏和脾脏肿大且表面和实质均有大量针尖状白点[23]。近年来部分地区鹅养殖场出现了类似疾病,以肝、脾有白色坏死点为主要病变特征,给养鹅业造成了重大的经济影响。
本试验从江苏省某鸭场收集了疑似番鸭呼肠孤病毒感染鹅的病料,通过接种番鸭胚和MDEF细胞,成功分离到一株鹅源番鸭呼肠孤病毒,并将其命名为JS2022株。JS2022株与胡奇林等[3]采用番鸭胚分离的番鸭呼肠孤病毒病变一致,均为死亡胚尿囊膜混浊增厚,尿囊液清澈;死亡胚周身出血,呈紫红色,本试验接毒胚传至第6代时番鸭胚死亡时间趋于稳定,基本稳定在第3~5天。通过对σB和σC全基因序列的核苷酸和氨基酸进行同源性分析,结果显示,分离株JS2022株σB和σC基因核苷酸序列都是与鹅源番鸭呼肠孤病毒毒株的同源性最高,与禽呼肠孤病毒的同源性最低。从进化树可看出,进化树被分为了番鸭呼肠孤病毒、新型鸭呼肠孤病毒、禽呼肠孤病毒3个不同的进化群,本分离株存在于番鸭呼肠孤病毒进化群中,但是其遗传进化关系与鹅源番鸭呼肠孤病毒GD2020株更近,该结果与郑炜鸿等[6]分离出的846-Goose-CHN-2020株(广东)σC基因序列遗传关系分析一致,均是与广东鹅源番鸭呼肠孤病毒分离株相似性最高,但本分离株来自江苏,可以推测该分离株可能是当前广东、江苏等地区鹅群中的主要流行毒株之一。动物回归试验结果表明,在人工感染后第2天雏鹅就出现精神沉郁、食欲不佳、拉稀等症状,病死鹅临床症状、剖检病变及组织病理学变化与自然发病鹅相似。
基因序列分析、动物回归试验指出本分离株JS2022归属于番鸭呼肠孤病毒大类,并且与鹅源番鸭呼肠孤病毒σB和σC基因的同源性高于鸭源番鸭呼肠孤病毒σB和σC基因的同源性,这也可能是番鸭呼肠孤病毒通过番鸭传染给鹅,随着宿主的改变,病毒发生一定程度的突变,增加了水禽易感宿主的种类,因此需要更加注意水禽呼肠孤病毒的流行监测及不同基因型毒株之间的重组情况。
-
表 1 地上部生物量与颜色指数之间的相关性
Table 1 Correlation between AGB and color indices
序号
Number颜色指数
Color index相关系数r
Correlation coefficient分蘖期
Tillering孕穗期
Booting齐穗期
Heading全生育期
Whole growth period1 r-b −0.899** −0.914** −0.887** −0.890** 2 VARI 0.809** 0.844** 0.833** 0.841** 3 G −0.818** −0.834** −0.843** −0.841** 4 NRI −0.821** −0.833** −0.822** −0.823** 5 r/b −0.817** −0.825** −0.821** −0.822** 6 R −0.802** −0.821** −0.812** −0.811** 7 WI 0.792** 0.803** 0.793** 0.795** 8 NBI 0.764* 0.798** 0.792** 0.793** 9 MGRVI 0.748* 0.778* 0.772* 0.769* 10 GRVI 0.750* 0.757* 0.764* 0.766* 11 ExR −0.738* −0.745* −0.741* −0.746* 12 g/b −0.63* −0.73* −0.731* −0.728* 13 ExGR 0.532 0.614* 0.609* 0.611* 14 B −0.569 −0.583 −0.578 −0.572 15 g-b −0.478 −0.532 −0.523 −0.516 16 ExG 0.245 0.321 0.328 0.331 17 NGI 0.245 0.312 0.321 0.315 18 r+b −0.245 −0.311 −0.301 −0.312 19 RGBVI 0.042 0.052 0.049 0.051 *代表P=0.05显著水平,**代表P=0.01极显著水平。表5同。
Significance level: * represents P=0.05. Extremely significant level:** represents P=0.01.The same as Table 5.表 2 基于红蓝差值(r-b)的AGB估算模型构建和验证
Table 2 Construction and validation of AGB estimation model based on (r-b)
生育期
Growth stage建模
Calibration检验
Validation类型 Type 估算模型 Estimation model 决定系数R 2
Coefficient of determination R2RMSE/
(g·m−2)RRMSE/
%R2 分蘖期
Tillering二次多项式 Quadratic y = 2690.9x2 − 2806.5x + 942.59 0.8778 22.07 6.09 0.8682 指数 Exponential y = 972.12e−3.47x 0.8774 24.15 6.64 0.8639 对数 Logarithmic y = −355.2ln(x) − 83.638 0.8772 22.94 6.28 0.8568 乘幂 Power y = 100.57x−1.011 0.8748 24.83 6.78 0.8487 线性 Linear y = −1213.7x + 711.68 0.8719 24.25 6.65 0.8543 孕穗期
Booting二次多项式 Quadratic y = −1491.4x2 − 836.69x + 892.93 0.8820 20.22 5.58 0.8713 线性 Linear y = −1431.4x + 948.53 0.8801 20.54 5.66 0.8654 指数 Exponential y = 1017.8e−2.182x 0.8741 21.95 6.09 0.8501 对数 Logarithmic y = −268.9ln(x) + 220.54 0.8574 27.76 7.58 0.8435 乘幂 Power y = 336.6x−0.408 0.8409 29.73 8.09 0.8212 齐穗期
Heading二次多项式 Quadratic y = 3480.4x2 − 2549.8x + 1311.2 0.8728 23.99 6.62 0.8643 指数 Exponential y = 1292.7e−1.637x 0.8694 25.67 7.08 0.8566 线性 Linear y = −1778.5x + 1281.7 0.8630 26.46 7.25 0.8521 对数 Logarithmic y = −135ln(x) + 754.89 0.8159 27.9 7.68 0.8072 乘幂 Power y = 799.19x−0.123 0.7956 33.17 9.04 0.7013 全生育期
Whole growth period二次多项式 Quadratic y = 705.61x2 − 3450.2x + 1364.8 0.8693 24.65 6.74 0.8614 指数 Exponential y = 1688.3e−4.88x 0.8237 29.91 8.15 0.8122 线性 Linear y = −3177.4x + 1344.4 0.8689 26.59 7.30 0.8461 对数 Logarithmic y = −381.9ln(x) + 25.399 0.7251 35.06 9.62 0.6531 乘幂 Power y = 238.62x−0.547 0.5263 51.25 14.09 0.4101 表 3 地上部生物量与纹理特征参数之间的相关性
Table 3 Correlations between AGB and texture features
序号
Number纹理特征参数
Texture feature相关系数 r
correlation coefficient r分蘖期
Tillering孕穗期
Booting齐穗期
Heading全生育期
Whole growth period1 G-均值 −0.907** −0.932** −0.917** −0.901** G-mean 2 R-均值 −0.887** −0.891** −0.890** −0.889** R-mean 3 R-二阶矩 0.583* 0.782* 0.727* 0.801** R-second moment 4 B-均值 −0.768* −0.749* −0.762* −0.787* B-mean 5 R-方差 0.652* 0.742* 0.772* 0.713* R-variance 6 B-二阶矩 0.543 0.652* 0.544 0.522 B-second moment 7 G-方差 0.568 0.563 0.612* 0.555 G-variance 8 B-方差 0.464 0.494 0.432 0.564 B-variance 9 G-对比度 0.333 0.452 0.411 0.562 G-contrast 10 R-相异性 0.488 0.521 0.517 0.553 R-dissimilarity 11 B-信息熵 −0.327 −0.431 −0.417 −0.476 B-entropy 12 G-协同性 −0.415 −0.463 −0.434 −0.408 G-homogeneity 13 R-信息熵 −0.457 −0.325 −0.402 −0.376 R-entropy 14 G-相异性 0.404 0.441 0.454 0.412 G-dissimilarity 15 B-协同性 0.212 0.221 0.322 0.435 B-homogeneity 16 B-对比度 0.126 0.321 0.311 0.411 B-contrast 17 G-信息熵 −0.371 −0.362 −0.322 −0.377 G-entropy 18 R-协同性 0.195 0.211 0.322 0.164 R-homogeneity 19 B-相关性 −0.204 −0.264 −0.228 −0.224 B-correlation 20 G-二阶矩 0.04 0.211 0.142 0.226 G-second moment 21 R-相关性 −0.107 −0.124 −0.214 −0.135 R-correlation 22 R-对比度 0.118 0.123 0.135 0.074 R-contrast 23 B-相异性 0.093 0.132 0.127 0.211 B-dissimilarity 24 G-相关性 −0.006 −0.013 −0.021 −0.089 G-correlation 表 4 基于纹理特征参数(G-mean)的水稻各生育期AGB模型的构建和检验
Table 4 Construction and validation of AGB estimation model for each growth stage of rice plants based on texture G-mean
生育期
Growth stage建模 Calibration 检验 Validation 类型
Type估算模型
Estimation model决定系数R 2
Coefficient of
determination R2均方根误差
RMSE/
(g·m−2)相对均方根误差
RRMSE/
%决定系数
R2分蘖期
Tillering二次多项式 Quadratic y = 0.0736x2 − 14.46x + 780.83 0.8875 22.06 6.08 0.8797 对数 Logarithmic y = −327ln(x) + 1525.7 0.8873 21.67 6.01 0.8635 指数 Exponential y = 902.39e−0.026x 0.8871 23.89 6.56 0.8717 线性 Linear y = −9.0632x + 684.31 0.8859 23.65 6.48 0.8790 乘幂 Power y = 9934.4x−0.934 0.8742 24.45 6.70 0.8311 孕穗期
Booting二次多项式 Quadratic y = 0.1879x2 − 25.845x + 1201.6 0.9128 17.14 4.75 0.9034 指数 Exponential y = 1237.7e−0.024x 0.9126 16.63 4.63 0.9017 对数 Logarithmic y = −411.4ln(x) + 1994.6 0.9118 15.70 4.38 0.9004 线性 Linear y = −15.965x + 1075.6 0.9106 17.97 4.98 0.9094 乘幂 Power y = 5007.2x−0.627 0.9071 19.69 5.42 0.8903 齐穗期
Heading二次多项式 Quadratic y = 2.2052x2 − 114.72x + 2398.5 0.9014 17.26 4.81 0.8945 乘幂 Power y = 5702.9x−0.584 0.9001 17.52 4.95 0.8809 对数 Logarithmic y = −634.1ln(x) + 2892.2 0.8948 17.66 4.91 0.8843 指数 Exponential y = 1930.3e−0.033x 0.8888 20.01 5.57 0.8671 线性 Linear y = −35.866x + 1714.6 0.8778 22.64 6.22 0.8121 全生育期
Whole growth period二次多项式 Quadratic y = 0.9499x2 − 86.442x + 2254 0.9005 11.10 3.11 0.8993 乘幂 Power y = 45897x−1.33 0.8925 16.09 4.53 0.8713 对数 Logarithmic y = −865.4ln(x) + 3492.7 0.8913 13.95 3.89 0.8671 指数 Exponential y = 2447.4e−0.051x 0.8883 11.69 3.29 0.9098 线性 Linear y = −32.075x + 1557.3 0.8692 26.59 7.31 0.8463 表 5 基于r-b和G-mean的AGB双指数线性回归模型的构建和检验
Table 5 Construction and validation of AGB estimation model based on r-b and G-mean
生育期
Growth stage建模 Calibration 检验 Validation 估算模型
Model决定系数R 2
Coefficient of
determination R2均方根误差
RMSE/
(g·m−2)相对均方根误差
RRMSE/
%决定
系数
R2分蘖期 Tillering y=879.0997−3088.61x1+5.9053x2+364.8907x1x2−18580.4 x12−1.607 x22 0.9099 16.46 4.68 0.8903 孕穗期 Booting y=1218.506−1364.43x1−16.1009x2+380.0562x1x2−21120.2947x12−1.4778 x22 0.9155 22.01 3.32 0.9006 齐穗期 Heading y=2422.079+3430.592x1−143.099 x2−381.908x1x2+13707.691x12+4.369x22 0.9043 36.46 3.37 0.8901 全生育期
Whole growth periody=2544.507+5054.243x1−145.543x2−556.553x1x2+27379.41x12+3.927x22 0.9202 76.20 10.91 0.9112 -
[1] ZHU W, SUN Z, PENG J, et al. Estimating maize above-ground biomass using 3d point clouds of multi-source unmanned aerial vehicle data at multi-spatial scales [J]. Remote Sens, 2019, 11: 2678. DOI: 10.3390/rs11222678
[2] 田婷, 张青, 张海东, 等. 基于无人机遥感的水稻产量估测 [J]. 中国稻米, 2022, 28(1):67−71, 77. TIAN T, ZHANG Q, ZHANG H D. Estimating yield of rice based on remote sensing by unmanned aerial vehicle [J]. China Rice, 2022, 28(1): 67−71, 77.(in Chinese)
[3] 周蓉, 赵天忠, 吴发云. 基于Landsat 8遥感影像的地上生物量模型反演研究 [J]. 西北林学院学报, 2022, 37(2):186−192. DOI: 10.3969/j.issn.1001-7461.2022.02.26 ZHOU R, ZHAO T Z, WU F Y. Aboveground biomass model based on Landsat 8 remote sensing images [J]. Journal of Northwest Forestry University, 2022, 37(2): 186−192.(in Chinese) DOI: 10.3969/j.issn.1001-7461.2022.02.26
[4] 姜妍, 王琳, 杨月, 等. 无人机高光谱成像技术在作物生长信息监测中的应用 [J]. 东北农业大学学报, 2022, 53(3):88−96. JIANG Y, WANG L, YANG Y, et al. Application of UAV hyperspectral imaging technology in crop growth information monitoring [J]. Journal of Northeast Agricultural University, 2022, 53(3): 88−96.(in Chinese)
[5] 杨福芹, 李天驰, 冯海宽, 等. 基于无人机数码影像的冬小麦氮素营养诊断研究 [J]. 福建农业学报, 2021, 36(3):369−378. YANG F Q, LI T C, FENG H K, et al. UAV digital image-assisted monitoring on nitrogen nutrition of winter wheat in the field [J]. Fujian Journalof Agricultural Sciences, 2021, 36(3): 369−378.(in Chinese)
[6] 梁胤豪, 陈全, 董彩霞, 等. 基于深度学习和无人机遥感技术的玉米雄穗检测研究 [J]. 福建农业学报, 2020, 35(4):456−464. LIANG Y H, CHEN Q, DONG C X, et al. Application of deep-learning and UAV for field surveying corn tassel [J]. Fujian Journal of Agricultural Sciences, 2020, 35(4): 456−464.(in Chinese)
[7] YANG G J, LIU J G, ZHAO C J, et al. Unmanned aerial vehicle remote sensing for field-based crop phenotyping: Current status and perspectives [J]. Frontiers in Plant Science, 2017, 8: 1111. DOI: 10.3389/fpls.2017.01111
[8] CASANOVA D, EPEMA G F, GOUDRIAAN J. Monitoring rice reflectance at field level for estimating biomass and LAI [J]. Field Crops Research, 1998, 55(1/2): 83−92.
[9] TAKAHASHI W, NGUYEN-CONG V, KAWAGUCHI S, et al. Statistical models for prediction of dry weight and nitrogen accumulation based on visible and near-infrared hyper-spectral reflectance of rice canopies [J]. Plant Production Science, 2000, 3(4): 377−386. DOI: 10.1626/pps.3.377
[10] GNYP M L, MIAO Y X, YUAN F, et al. Hyperspectral canopy sensing of paddy rice aboveground biomass at different growth stages [J]. Field Crops Research, 2014, 155: 42−55. DOI: 10.1016/j.fcr.2013.09.023
[11] 王秀珍, 黄敬峰, 李云梅, 等. 水稻地上鲜生物量的高光谱遥感估算模型研究 [J]. 作物学报, 2003, 29(6):815−821. DOI: 10.3321/j.issn:0496-3490.2003.06.004 WANG X Z, HUANG J F, LI Y M, et al. Study on hyperspectral remote sensing estimation models for the ground fresh biomass of rice [J]. Acta Agronomica Sinica, 2003, 29(6): 815−821.(in Chinese) DOI: 10.3321/j.issn:0496-3490.2003.06.004
[12] DAI M, YANG T L, YAO Z S, et al. Wheat biomass estimation in different growth stages based on color and texture features of UAV images [J/OL]. Smart Agriculture, Published online: 2022-02-22 14: 21: 52. URL: https://kns.cnki.net/kcms/detail/10.1681.S.20220221.1425.002.html.
[13] 杨俊, 丁峰, 陈晨, 等. 小麦生物量及产量与无人机图像特征参数的相关性 [J]. 农业工程学报, 2019, 35(23):104−110. DOI: 10.11975/j.issn.1002-6819.2019.23.013 YANG J, DING F, CHEN C, et al. Correlation of wheat biomass and yield with UAV image characteristic parameters [J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(23): 104−110.(in Chinese) DOI: 10.11975/j.issn.1002-6819.2019.23.013
[14] 刘畅, 杨贵军, 李振海, 等. 融合无人机光谱信息与纹理信息的冬小麦生物量估测 [J]. 中国农业科学, 2018, 51(16):3060−3073. DOI: 10.3864/j.issn.0578-1752.2018.16.003 LIU C, YANG G J, LI Z H, et al. Biomass estimation in winter wheat by UAV spectral information and texture information fusion [J]. Scientia Agricultura Sinica, 2018, 51(16): 3060−3073.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2018.16.003
[15] 陈晨. 基于无人机图像的小麦生物量与产量的估测研究[D]. 扬州: 扬州大学, 2019 CHEN C. Estimation of wheat biomass and yield based on UAV images[D]. Yangzhou: Yangzhou University, 2019. (in Chinese)
[16] 张建, 谢田晋, 尉晓楠, 等. 无人机多角度成像方式的饲料油菜生物量估算研究 [J]. 作物学报, 2021, 47(9):1816−1823. ZHANG J, XIE T J, WEI X N, et al. Estimation of feed rapeseed biomass based on multi-angle oblique imaging technique of unmanned aerial vehicle [J]. Acta Agronomica Sinica, 2021, 47(9): 1816−1823.(in Chinese)
[17] 刘杨, 冯海宽, 孙乾, 等. 不同分辨率无人机数码影像的马铃薯地上生物量估算研究 [J]. 光谱学与光谱分析, 2021, 41(5):1470−1476. LIU Y, FENG H K, SUN Q, et al. Estimation study of above ground biomass in potato based on UAV digital images with different resolutions [J]. Spectroscopy And Spectral Analysis, 2021, 41(5): 1470−1476.(in Chinese)
[18] 陶惠林, 徐良骥, 冯海宽, 等. 基于无人机数码影像的冬小麦株高和生物量估算 [J]. 农业工程学报, 2019, 35(19):107−116. DOI: 10.11975/j.issn.1002-6819.2019.19.013 TAO H L, XU L J, FENG H K, et al. Estimation of plant height and biomass of winter wheat based on UAV digital image [J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(19): 107−116.(in Chinese) DOI: 10.11975/j.issn.1002-6819.2019.19.013
[19] 李艳大, 叶春, 曹中盛, 等. 基于作物生长监测诊断仪的双季稻叶片氮含量和氮积累量监测 [J]. 应用生态学报, 2020, 31(9):3040−3050. DOI: 10.13287/j.1001-9332.202009.012 LI Y D, YE C, CAO Z S, et al. Monitoring leaf nitrogen concentration and nitrogen accumulation of double cropping rice based on crop growth monitoring and diagnosis apparatus [J]. Chinese Journal of Applied Ecology, 2020, 31(9): 3040−3050.(in Chinese) DOI: 10.13287/j.1001-9332.202009.012
[20] 叶春, 刘莹, 李艳大, 等. 基于RGB颜色空间的早稻氮素营养监测研究 [J]. 中国农业大学学报, 2020, 25(8):25−34. DOI: 10.11841/j.issn.1007-4333.2020.08.03 YE C, LIU Y, LI Y D, et al. Monitoring the nitrogen nutrition of early rice based on RGB color space [J]. Journal of China Agricultural University, 2020, 25(8): 25−34.(in Chinese) DOI: 10.11841/j.issn.1007-4333.2020.08.03
[21] 石媛媛. 基于数字图像的水稻氮磷钾营养诊断与建模研究[D]. 杭州: 浙江大学, 2011 SHI Y Y. Rice nutrition diagnosis and modeling based on digital image[D]. Hangzhou: Zhejiang University, 2011. (in Chinese)
[22] 吴华兵, 朱艳, 田永超, 等. 棉花冠层高光谱参数与叶片氮含量的定量关系 [J]. 植物生态学报, 2007, 31(5):903−909. DOI: 10.17521/cjpe.2007.0114 WU H B, ZHU Y, TIAN Y C, et al. Relationship between canopy hyperspectra parameter and leaf nitrogen concentration in cotton [J]. Journal of Plant Ecology, 2007, 31(5): 903−909.(in Chinese) DOI: 10.17521/cjpe.2007.0114
[23] LEE K J, LEE B W. Estimation of rice growth and nitrogen nutrition status using color digital camera image analysis [J]. European Journal of Agronomy, 2013, 48: 57−65. DOI: 10.1016/j.eja.2013.02.011
[24] 班松涛. 水稻长势无人机遥感监测研究[D]. 杨凌: 西北农林科技大学, 2020 BAN S T. Monitoring rice growth conditions using UAV remote sensing system[D]. Yangling: Northwest A&F University, 2020. (in Chinese)




 下载:
下载: