Temperature-induced Feminization of Channel Catfish
-
摘要:目的 在性别分化前利用高温诱导斑点叉尾鮰性别逆转,探究雄性斑点叉尾鮰雌性化的合适水体温度。方法 设置(30±0.5) ℃ (T-30,CK)、(33±0.5) ℃ (T-33)和(36±0.5) ℃ (T-36) 3个温度组对1dah试验鱼进行为期30 d的温度诱导。对卵巢已分化成型的60日龄试验鱼测量并统计生长数据、存活率、卵巢形成比例,同时结合遗传性别鉴定结果计算各组的性逆转率。分别在解剖学和组织学水平观察各组试验鱼的性腺结构和卵母细胞发育水平。进一步采用qRT-PCR方法分别检测雄性性别标志基因dmrt1和雌性性别标志基因foxl2在150日龄XX雌鱼、XY伪雌鱼卵巢中的表达水平。结果 T-30组、T-33组和T-36组试验鱼的存活率分别为95.33%、91.33%、82.67%;随着温度的升高,各组试验鱼的体长、体重先增加后减小,T-30组、T-33组和T-36组试验鱼的体长分别为9.13 cm、10.14 cm、8.80 cm;T-30组、T-33组和T-36组试验鱼的体重分别为6.31 g、9.76 g、6.11 g;T-30组、T-33组和T-36组试验鱼的卵巢形成比例分别为51.00%、66.67%、77.67%。性逆转效果评估结果显示:T-30组XX雌鱼和T-33组、T-36组伪XY雌鱼卵母细胞以Ⅱ期卵母细胞为主,T-30组中XX雌鱼和T-36组XY伪雌鱼出现Ⅲ期卵母细胞;T-33组中XY伪雌鱼出现卵巢发育缓慢、轮廓不清、与体腔黏膜相连的现象。对斑点叉尾鮰性别相关基因检测显示:foxl2基因在XY雌鱼中被激活,dmrt1基因在XY雌鱼中的表达被抑制。结论 对性别分化前的斑点叉尾鮰持续进行高温诱导,可以使斑点叉尾鮰的生理性别向雌性化方向分化。Abstract:Objective Water temperature required to induce feminization on male channel catfish fries before sex differentiation was determined.Method One-dah channel catfish fries were treated for 30 d in water at the temperature of (30±0.5) ℃ (T-30, CK), (33±0.5) ℃ (T-33) or (36±0.5) ℃ (T-36). Growth and rates of survival, ovarian formation, and sex reversal of individual fish that had ovaries differentiated and formed in 60 d with positive genetic sex identification were measured, calculated, and recorded. In each group, the ovarian development of XX and XY females as determined by the anatomy and H&E staining sections was compared and analyzed. Subsequently, qRT-PCR was used to detect the expressions of foxl2 and dmrt1 in XX and XY female ovaries as well as XY male testis at 150 dahs.Result The survival rates of the fries under T-30, T-33, and T-36 were 95.33%, 91.33%, and 82.67%, respectively. The body length of the fish under T-30 measured at 9.13 cm, under T-33 at 10.14 cm, and under T-36 at 8.80 cm, while the body weighed at 6.31 g for CK, 9.76 g for those under T-33, and at 6.11 g for those under T-36. The ovarian formation percentages were 51.00% under CK, 66.67% under T-33, and 77.67% under T-36. On sex reversal, the majority of oocytes in the XX females were at stage Ⅱ under T-30, but under T-33 and T-36 in the XY females. The stage Ⅲ oocytes were found in the XX females under T-30 as well as in the XY females under T-36. Under T-33, the XY female channel catfish showed slow oval development with unclear outline and coelomic mucosa. The expression of foxl2 was upregulated and that of dmrt1 downregulated in the XY females.Conclusion The physiological sex before sexual differentiation of channel catfish could be converted to female by continuous high-temperature induction.
-
Keywords:
- Channel catfish /
- sexual reversal /
- temperature /
- feminization
-
0. 引言
【研究意义】流感病毒是单股负链RNA病毒,根据核蛋白及基质蛋白抗原性的不同分为甲、乙、丙、丁四型[1]。其中甲型流感病毒(Influenza A virus, IAV)传播范围广,变异速度快,致病力强,可在不同宿主间传播,严重危害人类及动物的健康[2]。天然免疫应答是宿主应对病原入侵的第一层屏障,干扰素通路的激活和调控在其中发挥核心作用[3]。研究宿主抗病毒天然免疫调控有助于深入理解流感病毒与宿主间的互作机制,为流感病毒的预防和治疗提供新的思路。【前人研究进展】流感病毒入侵细胞后,暴露在细胞质中的病毒RNA被RIG-I样受体(RIG-I-like receptor, RLR)和Toll样受体(Toll-like receptor, TLR)等识别[4]。这些模式识别受体发挥类似传感器的作用,被病毒RNA激活后将病毒入侵的信号传导至下游的干扰素调控因子(Interferon regulatory factor, IRF)[5]。IRF进一步转移至核内,启动干扰素的表达[6]。干扰素产生后被分泌至胞外,与细胞膜上的干扰素受体结合后使STAT1等转录因子被激活,STAT1激活后能促进上百种干扰素刺激基因(IFN stimulated genes, ISGs)的转录,如干扰素诱导跨膜蛋白(Interferon induced transmembrane proteins, IFITMs)和2′-5′寡聚腺苷酸合成酶样蛋白(2′-5′-oligoadenylate synthetase like protein, OASL)等,这些蛋白具有抗病毒活性,能够抑制病毒在宿主体内的复制[7]。细胞因子信号转导抑制因子(Suppressor of cytokine signaling, SOCS)蛋白家族是一类细胞信号转导抑制因子,在病毒感染、炎症性疾病、肿瘤发生发展等过程中发挥重要的调控作用[8]。SOCS3是SOCS蛋白家族的成员之一,其蛋白结构中除Src同源结构域(SH2)及SOCS box结构域外还含有激酶抑制区域,可以特异性结合JAK激酶(Janus kinase, JAK)的激酶活性区域,抑制其发挥作用[9]。SOCS3在流感病毒感染后可被诱导表达升高。相关研究表明炎症因子白细胞介素6(Interleukin-6, IL-6)下游信号通路受流感病毒诱导的SOCS3抑制后,宿主代偿性激活核因子κB(Nuclear factor kappa-B, NF-κB)从而引发了IL-6的过量表达,导致恶性的病理反应[10]。【本研究切入点】SOCS3在调控宿主炎症因子的表达中发挥了关键作用,但流感病毒感染过程中SOCS3对干扰素的表达以及干扰素信号传递的影响尚不清楚。【拟解决的关键问题】本研究旨在探究流感病毒感染中SOCS3对干扰素信号通路的调控作用,为揭示宿主抗病毒天然免疫调控网络提供新的数据与视角。
1. 材料与方法
1.1 试验试剂
DMEM、胎牛血清、限制性内切酶及T4连接酶购自赛默飞世尔科技。Lipo 8000转染试剂购自上海碧云天生物技术有限公司。siRNA转染试剂购自常州百代生物科技股份有限公司。β-Actin抗体、SOCS3抗体、STAT1和p-STAT1抗体、Flag标签抗体、偶联HRP的山羊抗鼠IgG及山羊抗家兔 IgG 购自CST(Cell Signaling Technology),流感病毒NP抗体由福建省畜禽病原感染与免疫学重点实验室(本实验室)制备。高保真酶、RT-PCR mix及反转录试剂购自南京诺维赞生物科技股份有限公司。Trizol购自天根生化科技(北京)有限公司。
1.2 细胞系、流感病毒、质粒及siRNA
试验中所用人肺腺癌细胞(A549)及人肾上皮细胞(HEK293T)由本实验室保存。A/PR/8/34(PR8)、A/California/04/2009(CA04)、A/WSN/33(WSN)及A/Chicken/Fujian/MQ01/2015(H9N2)4株流感病毒毒株保存于本实验室−80 ℃冰箱中。慢病毒载体pnl-EGFP-CMV-WPREDU3及其包装质粒为本实验室保存。pnl-SOCS3过表达质粒由笔者构建。干扰SOCS3的siRNA由生工生物工程(上海)股份有限公司合成。
1.3 过表达SOCS3细胞系构建
过表达SOCS3引物序列(pnl-SOCS3-F:GCTAGCATGGTCACCCACAGCAAGTTTCCCG,pnl-SOCS3-R:CTCGAGTTACTTGTCATCGTCGTCCTTGTAATCAAGCGGGGCATCGTACTGGT-CC)。以A549细胞cDNA为模板扩增SOCS3片段,连接至pnl-EGFP-CMV-WPREDU3慢病毒载体中。使用HEK293T进行慢病毒包装,将pnl-SOCS3质粒与包装质粒package、pVSVG各8 μg转染至HEK293T细胞中,培养48 h后,收取含慢病毒的上清。A549细胞消化后取适量加入上清重悬并加入聚凝胺,将细胞铺至6孔板中感染36 h后再进行传代。
1.4 siRNA转染
干扰SOCS3 siRNA序列由笔者设计,序列为正向:GAAGAGCCUAUUACAUCUATT,反向:UAGAUGUAAUAGGCUCUUCTT。第1天将A549细胞铺至六孔板中,第2天生长至密度为30%~50%时进行转染。将120 pmol的siRNA与10 μL的转染试剂分别加入至250 μL的DMEM中,室温静置5 min,然后将两者混合后静置20 min,完成后加入六孔板中。转染48 h后进行后续试验。
1.5 病毒感染
流感病毒扩增后使用空斑试验测定病毒滴度。A549细胞在10 cm培养皿中生长至密度约为100%时,对细胞进行消化并铺入六孔板中。待第2天密度为80%~90%时,进行病毒感染,病毒感染复数(Multiplicity of infection, MOI)为1。将旧培养基弃掉,每孔加入1 mL PBS清洗,重复3遍,然后加入1 mL病毒维持液,然后在每孔中加入所需量的病毒。将六孔板放入二氧化碳培养箱中,每15 min取出六孔板轻轻摇晃使病毒均匀吸附。1 h后将维持液弃掉,使用1 mL PBS清洗细胞3遍后加入2 mL新的病毒维持液。放入细胞培养箱中继续培养。
1.6 RNA提取
将六孔板中的培养液弃去,用PBS清洗3遍,每孔加入1 mL Trizol,用枪尖反复吹打使细胞充分裂解,收集至EP管中。每1 mL Trizol 加入200 μL氯仿,充分震荡混匀,于室温静置3 min,12000 r·min−1 离心15 min,将上清转移至新的EP管中,加入等量异丙醇,混匀静置10 min,12000 r·min−1 离心10 min,弃去上清,用1 mL 75%乙醇清洗沉淀2次,将乙醇弃去,短暂离心收集管壁残余的液体并用枪尖吸去,开盖静置片刻后加入适量DEPC水溶解RNA。
1.7 蛋白样品制备
弃去六孔板中的培养液,用PBS清洗细胞3次,每孔加入1 mL PBS,用枪尖将细胞轻轻刮下收集至EP管中,4500 r·min−1离心3 min。每管加入60 μL细胞裂解液,用枪尖吹打混匀,于冰上静置30 min,每10 min轻弹管壁混匀1次。静置结束后,12000 r·min−1离心10 min,吸出上清加入新的EP管中,加入等量上样缓冲液(2×),混匀后将EP管置于沸水中,5 min后取出,于−20 ℃冰箱中保存。
1.8 RT-PCR扩增
RNA提取完成后进行浓度测定,依照反转录试剂盒所提供的方法进行反转录。以反转录后的cDNA为模板进行PCR,PCR所用的反应总体系为15 μL,首先将2×PCR mix与等体积的ddH2O混合,每个PCR管中加入13 μL稀释后的PCR mix,然后加入1 μL上下游引物,最后加入1 μL对应的cDNA。体系配置完成后,将PCR样品放入PCR仪中进行扩增。待PCR程序结束后,取出PCR样品,从每管中取10 μL进行琼脂糖凝胶电泳,电泳时间为30 min,电压120 V,结束后使用凝胶图像分析系统(上海天能生命科学有限公司)进行成像。文中所用RT-PCR引物序列见表1。
表 1 RT-PCR引物序列Table 1. Sequences of primers for RT-PCR引物
Primer上游引物 5′-3′
Forward primer 5′-3′下游引物 5′-3′
Reverse primer 5′-3′GAPDH TGGGTGTGAACCATGAGAAGT AAGGCCATGCCAGTGAGCTT NP (流感病毒) TCAAACGTGGGATCAATG GTGCAGACCGTGCTAAAA SOCS3 CAGTACGATGCCCCGCTTTA GAAGCTGGAGACTCAGGTGG IFN-β GCACTGGCTGGAATGAGACTA ACTCTGACTATGGTCCAGGCA IL-28 CCTGGTGGACGTCTTGGAC GCGGAAGAGGTTGAAGGTGA IL-29 TGGTGACTTTGGTGCTAGGC GGCCTTCTTGAAGCTCGCTA RIG-I GAAGATCCAGAATGCCAGAATC CTGGGATCTGATTCGCAAAA MDA5 CTGCTGCAGAAAACAATGGA TGGCTGAACTGTGGTTGAAA TLR3 AGTGCCGTCTATTTGCCACA GCATCCCAAAGGGCAAAAGG IRF3 GGGGAGTGATGAGCTACGTG CTACAATGAAGGGCCCCAGG IRF7 GAGCTGTGCTGGCGAGAAG CTCTCCAGGAGCCTTGGTTG 1.9 Western blot检测
使用Western blot检测蛋白样品时,首先进行SDS-PAGE凝胶电泳,凝胶浓度为10%,电泳时间及电压设置为浓缩胶80 V、30 min,分离胶120 V、120 min。电泳结束后进行转膜,转印夹结构从负极至正极依次为海绵、3层滤纸、凝胶、NC膜、3层滤纸、海绵,转膜条件设置为250 mA、120 min。转膜完成后将NC膜放入含5%奶粉的1×TBS中封闭2 h。依据蛋白Marker确定目的蛋白条带在NC膜上的大致位置,将条带裁下进行一抗孵育,时间最少2 h。一抗孵育结束后将条带放入1×TBST中,并置于摇床上清洗30 min,每10 min换液1次。然后孵育二抗,时间约1 h,孵育结束后1×TBST清洗30 min,每10 min换液一次。最后使用化学发光图像分析系统(上海天能生命科学有限公司)进行成像。
2. 结果与分析
2.1 SOCS3抑制流感病毒感染后的I型和III型干扰素的表达
为了探究SOCS3在流感病毒感染中是否调控干扰素的表达,首先利用慢病毒载体构建了稳定过表达SOCS3的A549细胞系,以及使用siRNA敲低细胞中SOCS3的表达,然后采用RT-PCR检测SOCS3的过表达和敲低表达效果。图1-A、B显示SOCS3的过表达和敲低效果良好。使用PR8流感病毒感染SOCS3过表达和敲低细胞以及对照细胞,0、12、24 h后收取RNA样品,使用RT-PCR检测IFN-β及IL-28、IL-29的表达情况,结果发现过表达SOCS3后IFN-β及IL-28、IL-29表达降低,尤其在病毒感染12 h时抑制效果最明显(图1-C),而转染靶向SOCS3的siRNA的细胞中表达量升高(图1-D),表明SOCS3在流感病毒感染中可以负调控干扰素的产生。此外还检测了不同流感病毒毒株感染SOCS3过表达细胞系后干扰素的表达变化,结果表明在WSN、CA04及H9N2流感病毒感染时SOCS3过表达均能下调干扰素产生(图1-E、F、G)。同时还使用poly I:C处理过表达SOCS3的细胞系,模拟病毒感染,结果显示SOCS3同样能够抑制poly I:C刺激下干扰素的产生(图1-H)。
2.2 SOCS3抑制流感病毒相关模式识别受体的表达
上述结果表明SOCS3在流感病毒感染后负调控干扰素的表达。为了进一步探究SOCS3如何调控干扰素的表达,在过表达SOCS3细胞系感染PR8病毒后收取0、12、24 h的样品,通过RT-PCR检测了流感病毒相关模式识别受体RIG-I、MDA5及TLR3的表达变化,结果显示三者在SOCS3过表达细胞系中表达水平均明显降低(图2-A)。另外使用WSN、CA04及H9N2流感病毒感染SOCS3过表达细胞系和对照细胞系, RT-PCR检测发现SOCS3过表达细胞系中RIG-I、MDA5及TLR3的表达均明显下调(图2-B、C、D)。
2.3 SOCS3抑制干扰素转录因子IRF7的表达
随后,在SOCS3过表达细胞系感染PR8病毒后检测了干扰素调节因子IRF3及IRF7的表达变化。RT-PCR结果显示,过表达SOCS3能够在转录水平抑制IRF7的表达,但对IRF3的表达无影响(图3-A)。此外,过表达SOCS3也能抑制poly I:C诱导的IRF7的表达,同样对IRF3的表达没有影响(图3-B)。
2.4 SOCS3负调控STAT1的磷酸化
在SOCS3过表达细胞系感染流感病毒后,于0、12、24 h收取蛋白样品检测磷酸化STAT1的表达水平,结果显示过表达SOCS3的细胞在感染流感病毒后STAT1的磷酸化水平降低(图4-A)。将靶向SOCS3的siRNA转染至细胞中,感染病毒后检测STAT1的磷酸化水平,发现STAT1的磷酸化在12 h明显升高(图4-B)。以上结果表明SOCS3对流感病毒诱导的STAT1磷酸化起负调控作用。
3. 讨论与结论
流感病毒感染后,宿主的天然免疫系统通过诱导产生多种细胞因子和炎症因子来抵御病毒入侵,其中干扰素是最重要的抗病毒免疫因子之一,由干扰素诱导产生的抗病毒ISGs,能破坏病毒生命周期,抑制病毒复制。然而细胞因子和趋化因子等的过量表达会造成机体免疫调控失衡,甚至导致“细胞因子风暴”而损伤宿主机体[11]。因此宿主机体也存在诸多调控机制来平衡各类免疫因子的表达[12]。SOCS3作为细胞因子信号传导抑制因子之一,在先天免疫信号通路的调控中发挥着关键作用[13]。
在流感病毒感染过程中,SOCS3通过抑制STAT3的磷酸化阻断炎症相关信号通路的传导[14]。而SOCS3对干扰素通路的影响及作用机制,目前尚不明确。本研究首先检测了不同流感病毒毒株感染后,过表达及敲低SOCS3对干扰素的影响,结果表明SOCS3能负调控流感病毒感染下干扰素的产生。随后为了探究SOCS3如何负调控干扰素的产生,在流感病毒感染后检测SOCS3过表达细胞系中相关模式识别受体的表达,结果表明SOCS3过表达后RIG-I、MDA5和TLR3转录水平的表达受到抑制。RIG-I、MDA5和TLR3在流感病毒感染后首先识别病毒相关分子模式,并将信号传导至下游的转录因子从而启动干扰素的转录。IRF3和IRF7是干扰素的转录调节因子,在干扰素的转录中起重要作用,二者被激活后转移至细胞核内,与干扰素基因的启动子结合,促进干扰素的转录。本研究发现在流感病毒感染后SOCS3能够在转录水平下调IRF7的表达,但对IRF3的表达没有影响。原因可能是由于IRF3与IRF7两者调控通路不一致,而SOCS3特异性影响了IRF7的调节通路。
干扰素产生后通过JAK/STAT1通路进行信号转导, STAT1是干扰素信号转导中的重要因子。干扰素分泌后与细胞膜上的干扰素受体结合,使得干扰素受体构象改变从而激活JAK1,磷酸化后的JAK1进一步激活STAT1和STAT2[15]。磷酸化的STAT1形成同源二聚体或与磷酸化的STAT2形成异源二聚体,随后与干扰素调节因子9(Interferon regulatory factor 9, IRF9)形成复合物,并被转运至细胞核中,促进抗病毒ISGs的转录[16]。本研究证明SOCS3在JAK/STAT1通路的信号转导中也发挥了负调控作用,过表达SOCS3抑制STAT1的磷酸化,而敲低SOCS3表达上调STAT1的磷酸化。上述结果发现流感病毒诱导的SOCS3蛋白可以调控RIG-I、MDA5、TLR3、IRF7表达以及STAT1的磷酸化,表明SOCS3蛋白在干扰素产生和下游通路中均发挥重要作用,从多个方面影响了干扰素信号通路的活性。SOCS3在其他病毒感染时也能抑制宿主干扰素介导的天然免疫反应,如Zhang等[17]研究发现肠病毒D68 (EV-D68)通过诱导SOCS3的上调抑制STAT3磷酸化,并拮抗IFNβ和下游ISGs的抗病毒作用;Wang等[18]发现新城疫病毒(Newcastle disease virus, NDV)感染通过MEK/ERK信号通路上调SOCS3的表达,进而抑制STAT1的磷酸化和下游干扰素诱导GTP结合蛋白1(MX dynamin like GTPase 1, MX1)、OASL的表达;Xie等[19]证明1型鸭肝炎病毒(Duck hepatitis A virus type 1, DHAV-1)感染诱导SOCS3的表达,高表达的SOCS3通过抑制IFNα、STAT1、STAT3以及下游MX1、OASL的表达促进DHAV-1的复制。
综上所述,SOCS3在拮抗宿主干扰素的抗病毒免疫反应中发挥重要作用。本研究从模式识别受体及干扰素调节因子的角度探明了流感病毒诱导的SOCS3对干扰素表达的调控机制,并揭示了SOCS3通过抑制JAK/STAT1通路影响干扰素抗病毒信号的传递。这些结果丰富了人们对SOCS3调控天然免疫信号通路的理解,为阐明流感病毒与宿主之间复杂的互作机制提供了理论基础。然而,文中仅在转录水平探讨了SOCS3对 RIG-I、MDA5、TLR3、IRF7的表达调控作用,是否在蛋白水平及通过何种方式影响这些分子的表达仍需要进一步研究。另外,SOCS3对干扰素信号通路的负调控作用是机体防止细胞因子过度表达的结果,还是流感病毒通过“劫持”SOCS3抑制干扰素信号通路从而有利于自身复制,这些问题目前尚无定论,有待进一步研究。
-
图 1 60日龄斑点叉尾鮰卵巢组织
图A、C、G是T-30、T-33、T-36组中XX雌鱼的卵巢组织切片图,图E、I是T-33、T-36组中XY伪雌鱼的卵巢组织切片图;图B、D、H是T-30、T-33、T-36组中XX雌鱼的卵巢组织解剖图,图F、J是T-33、T-36组XY伪雌鱼的卵巢组织解剖图。
Figure 1. Histological sections and anatomy of ovaries of 60 dah channel catfish
A, C, and G: histological ovarian sections of channel catfish (XX) under T-30, T-33, and T-36, respectively; E and I: histological ovarian sections of sexual reversal channel catfish (XY) under T-33 and T-36, respectively; B, D, and H: ovarian anatomy of channel catfish (XX) under T-30, T-33, and T-36, respectively; F and J: ovarian anatomy of sex-reversed channel catfish (XY) under T-33 and T-36, respectively.
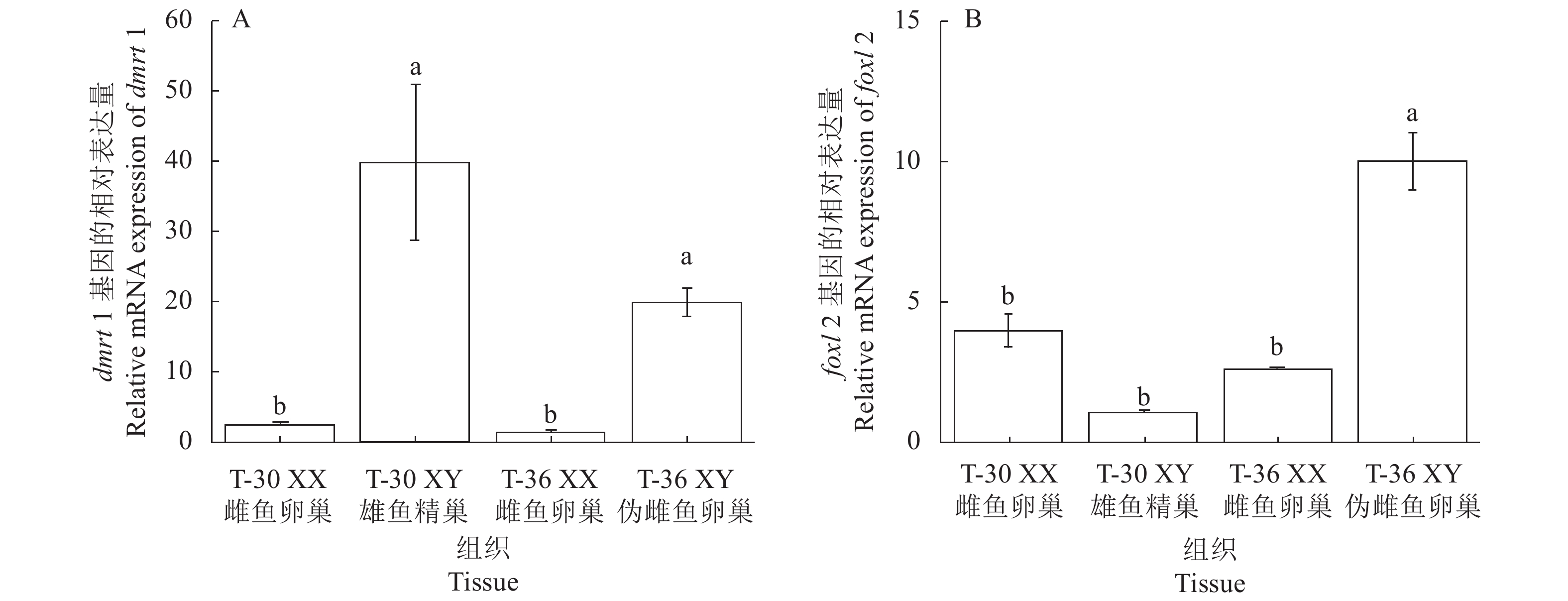
图 2 斑点叉尾鮰性别分化基因表达
A为斑点叉尾鮰雄性性别分化基因dmrt1表达图,B为斑点叉尾鮰雌性性别决定基因foxl2表达图。图中小写字母表示显著性差异( P <0.05)。
Figure 2. mRNA expressions of sex differentiation genes in channel catfish
A: mRNA expression of dmrt1; B: mRNA expression of foxl2. Means with different lowercase letters indicate significant difference at P<0.05.
表 1 开口饵料及微粒饲料调整方案
Table 1 Particulate feed adjustment for channel catfish
饲料
Feed试验鱼体长
Body length/mm投喂天数
Feeding days/d卤虫 1~6 3 微粒饲料S1 6~10 6 微粒饲料S2 9~14 6 微粒饲料S3 13~18 6 微粒饲料S4 18~28 6 表 2 qRT-PCR反应引物表
Table 2 Primers for q-PCR
基因
Gene引物
Primers序列 (5′-3′)
Sequence (5′-3′)长度
Length/bp退火温度
Tm/℃dmrt1 dmrt1-F
dmrt1-RGTGATTACGGCTTTGCGGTG
TAGCGGGAAGGCTGACAAAA20
2057
56foxl2 foxl2-F
foxl2-RTGATGCACTGCCCTTACTGG
CACAAGTCTCGGGTAGTGGG20
2057
58α-tubulin α-tubulinF
α-tubulinRAGCCATACAATTCCATCCTGACC
GCGGCAGATGTCGTAGATGG23
2056
58表 3 试验鱼生长特性和雌鱼比例
Table 3 Growth and survival of channel catfish and proportion of females in each experimental group
组别
Group存活率
Survival rate/%体长
Body length/cm体重
Body weight/g卵巢形成比例
Ovarian ratio/%性逆转率
Sex reversal rate/%T-30 95.33±0.94 a 9.13±0.75 6.310±1.58 51.00±1.03 a 0 a T-33 91.33±1.25 a 10.14±1.39 9.761±2.80 66.67±1.22 b 31.98±1.34 b T-36 82.67±1.25 b 8.80±0.81 6.113±1.62 77.67±1.35 c 54.43±1.96 c 同列数据后不同小写字母表示差异显著 (P<0.05)。
Means with different lowercase letters on the same column indicate significant difference (P<0.05). -
[1] 张振东, 肖友红. 美斑点叉尾鮰法案系统性回顾 [J]. 海洋与渔业, 2017(1):65−66. ZHANG Z D, XIAO Y H. Systematic review of channel catfish act in the United States [J]. Ocean & Fishery, 2017(1): 65−66.(in Chinese)
[2] 钟立强, 王明华, 陈校辉, 等. 江苏斑点叉尾鮰产业现状及发展战略思考 [J]. 中国农学通报, 2021, 37(17):137−143. ZHONG L Q, WANG M H, CHEN X H, et al. Current status and development strategy of the channel catfish industry in Jiangsu [J]. Chinese Agricultural Science Bulletin, 2021, 37(17): 137−143.(in Chinese)
[3] DESPREZ D, MÉLARD C. Effect of ambient water temperature on sex determinism in the blue tilapia Oreochromis aureus [J]. Aquaculture, 1998, 162(1/2): 79−84.
[4] 陈玉红, 林丹军, 尤永隆. 泥鳅的性腺分化及温度对性腺分化的影响 [J]. 中国水产科学, 2007, 14(1):74−82. CHEN Y H, LIN D J, YOU Y L. Gonad differentiation in loach(Misgurnus anguillicaudatus) and the temperature effects [J]. Journal of Fishery Sciences of China, 2007, 14(1): 74−82.(in Chinese)
[5] ABOZAID H, WESSELS S, HÖRSTGEN-SCHWARK G. Effect of rearing temperatures during embryonic development on the phenotypic sex in zebrafish (Danio rerio) [J]. Sexual Development, 2011, 5(5): 259−265. DOI: 10.1159/000330120
[6] 王浚宇. 高温和甲基睾酮联合处理对尼罗罗非鱼性别分化的影响研究[D]. 泰安: 山东农业大学, 2020. WANG J Y. Effects of co-treatment with high temperature and methyltestosterone on sex differentiation of Nile tilapia[D]. Taian: Shandong Agricultural University, 2020. (in Chinese)
[7] KITANO T, TAKAMUNE K, KOBAYASHI T, et al. Suppression of P450 aromatase gene expression in sex-reversed males produced by rearing genetically female larvae at a high water temperature during a period of sex differentiation in the Japanese flounder (Paralichthys olivaceus) [J]. Journal of Molecular Endocrinology, 1999, 23(2): 167−176. DOI: 10.1677/jme.0.0230167
[8] 齐飘飘, 陈敏, 于跃, 等. 高温和皮质醇对黄颡鱼性别分化的影响 [J]. 水生生物学报, 2021, 45(1):106−117. QI P P, CHEN M, YU Y, et al. Effects of high temperature and cortisol on sex differentiation of yellow catfish(Tachysurus fulvidraco) [J]. Acta Hydrobiologica Sinica, 2021, 45(1): 106−117.(in Chinese)
[9] CONOVER D O, KYNARD B E. Environmental sex determination: Interaction of temperature and genotype in a fish [J]. Science, 1981, 213(4507): 577−579. DOI: 10.1126/science.213.4507.577
[10] 孙毅. 温度对小黄鱼早期生长发育和性别分化的影响[D]. 舟山: 浙江海洋大学, 2018. SUN Y. Effects of temperature on early growth and sex differentiation in little yellow croaker[D]. Zhoushan: Zhejiang Ocean University, 2018. (in Chinese)
[11] 岳敏娟. 温度对鲫鱼性别决定的影响及分子机制探讨[D]. 福州: 福建师范大学, 2009. YUE M J. The study of the influence of the temperature on sex differentiation of Carassius auratus and the molecular mechnism[D]. Fuzhou: Fujian Normal University, 2009. (in Chinese)
[12] 张思敏, 王孝杰, 李吉方, 等. 温度对许氏平鲉性腺分化的影响及其机制 [J]. 水产学报, 2019, 43(7):1569−1580. ZHANG S M, WANG X J, LI J F, et al. Effects of temperature on gonadal differentiation of black rockfish (Sebastes schlegelii) and its mechanism [J]. Journal of Fisheries of China, 2019, 43(7): 1569−1580.(in Chinese)
[13] 程晓春. 温度对江黄颡鱼(Pseudobagrus vachelli)性分化的研究[D]. 福州: 福建师范大学, 2007. CHENG X C. The study of the influence of temperature on sex differentiation of teleost, Pseudobagrus vachelli[D]. Fuzhou: Fujian Normal University, 2007. (in Chinese)
[14] PATIÑO R, DAVIS K B, SCHOORE J E, et al. Sex differentiation of channel catfish gonads: normal development and effects of temperature [J]. The Journal of Experimental Zoology, 1996, 276(3): 209−218.
[15] ZHANG S Y, ZHANG X H, CHEN X H, et al. Construction of a high-density linkage map and QTL fine mapping for growth- and sex-related traits in channel catfish (Ictalurus punctatus) [J]. Frontiers in Genetics, 2019, 10: 251. DOI: 10.3389/fgene.2019.00251
[16] 牛莹月, 区又君, 蓝军南, 等. 人工培育四指马鲅鳃组织结构及其早期发育 [J]. 南方水产科学, 2020, 16(5):108−114. NIU Y Y, OU Y J, LAN J N, et al. Structure and early development of gill tissue in artificially cultured Eleutheronema tetradactylum [J]. South China Fisheries Science, 2020, 16(5): 108−114.(in Chinese)
[17] ZHANG S Y, LI Y, SHAO J J, et al. Functional identification and characterization of IpMSTNa, a novel orthologous myostatin (MSTN) gene in channel catfish Ictalurus punctatus [J]. International Journal of Biological Macromolecules, 2020, 152: 1−10. DOI: 10.1016/j.ijbiomac.2020.02.060
[18] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method [J]. Methods, 2001, 25(4): 402−408. DOI: 10.1006/meth.2001.1262
[19] HAYASHI Y, KOBIRA H, YAMAGUCHI T, et al. High temperature causes masculinization of genetically female medaka by elevation of cortisol [J]. Molecular Reproduction and Development, 2010, 77(8): 679−686. DOI: 10.1002/mrd.21203
[20] 邹芝英, 杨弘, 李大宇. 罗非鱼性别决定和分化机制的研究进展 [J]. 中国水产科学, 2009, 16(1):139−145. DOI: 10.3321/j.issn:1005-8737.2009.01.020 ZOU Z Y, YANG H, LI D Y. Research advances on sex determination and differentiation mechanism in tilapia [J]. Journal of Fishery Sciences of China, 2009, 16(1): 139−145.(in Chinese) DOI: 10.3321/j.issn:1005-8737.2009.01.020
[21] HAYASAKA O, TAKEUCHI Y, SHIOZAKI K, et al. Green light irradiation during sex differentiation induces female-to-male sex reversal in the medaka Oryzias latipes [J]. Scientific Reports, 2019, 9: 2383. DOI: 10.1038/s41598-019-38908-w
[22] WU R S S, ZHOU B S, RANDALL D J, et al. Aquatic hypoxia is an endocrine disruptor and impairs fish reproduction [J]. Environmental Science & Technology, 2003, 37(6): 1137−1141.
[23] FRANCIS R C, BARLOW G W. Social control of primary sex differentiation in the Midas cichlid [J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(22): 10673−10675. DOI: 10.1073/pnas.90.22.10673
[24] 王成龙, 关文志, 李永强, 等. 17β-雌二醇诱导黄颡鱼雌性化的研究 [J]. 南方水产科学, 2020, 16(3):25−30. DOI: 10.12131/20200001 WANG C L, GUAN W Z, LI Y Q, et al. Study on 17β-estradiol induced feminization of Pelteobagrus fulvidraco [J]. South China Fisheries Science, 2020, 16(3): 25−30.(in Chinese) DOI: 10.12131/20200001
[25] 王海贞, 王辉, 强俊, 等. 温度、盐度和pH对尼罗罗非鱼性别分化的影响 [J]. 应用生态学报, 2012, 23(10):2893−2899. WANG H Z, WANG H, QIANG J, et al. Effects of water temperature, salinity and pH on sex differentiation of Oreochromis niloticus [J]. Chinese Journal of Applied Ecology, 2012, 23(10): 2893−2899.(in Chinese)
[26] CARTER A W, SADD B M, TUBERVILLE T D, et al. Short heatwaves during fluctuating incubation regimes produce females under temperature-dependent sex determination with implications for sex ratios in nature [J]. Scientific Reports, 2018, 8: 3. DOI: 10.1038/s41598-017-17708-0
[27] BOWDEN R M, PAITZ R T. Temperature fluctuations and maternal estrogens as critical factors for understanding temperature-dependent sex determination in nature [J]. Journal of Experimental Zoology Part A:Ecological and Integrative Physiology, 2018, 329(4/5): 177−184.
[28] 陈兴汉, 刘晓春, 蒙子宁, 等. 温度调控诱导尼罗罗非鱼仔鱼雄性化的研究 [J]. 中山大学学报(自然科学版), 2013, 52(1):94−99. CHEN X H, LIU X C, MENG Z N, et al. Masculinization by temperature control in larvae Nile Tilapia, Oreochromis niloticus L [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2013, 52(1): 94−99.(in Chinese)
[29] KILLEN S S. Growth trajectory influences temperature preference in fish through an effect on metabolic rate [J]. Journal of Animal Ecology, 2014, 83(6): 1513−1522. DOI: 10.1111/1365-2656.12244
[30] 刘鉴毅, 宋志明, 王妤, 等. 温度对点篮子鱼幼鱼生长、摄食和消化酶活性的影响 [J]. 海洋渔业, 2015, 37(5):442−448. LIU J Y, SONG Z M, WANG Y, et al. Effects of water temperature on growth, feeding and activities of digestive enzymes of juvenile Siganus guttatas [J]. Marine Fisheries, 2015, 37(5): 442−448.(in Chinese)
[31] HUANG S S, YE L P, CHEN H L. Sex determination and maintenance: The role of DMRT1 and FOXL2 [J]. Asian Journal of Andrology, 2017, 19(6): 619−624. DOI: 10.4103/1008-682X.194420
[32] BAROILLER J F, GUIGUEN Y, FOSTIER A. Endocrine and environmental aspects of sex differentiation in fish [J]. Cellular and Molecular Life Sciences, 1999, 55(6/7): 910−931.
[33] GUIGUEN Y, BAROILLER J F, RICORDEL M J, et al. Involvement of estrogens in the process of sex differentiation in two fish species: The rainbow trout (Oncorhynchus mykiss) and a tilapia (Oreochromis niloticus) [J]. Molecular Reproduction and Development, 1999, 54(2): 154−162. DOI: 10.1002/(SICI)1098-2795(199910)54:2<154::AID-MRD7>3.0.CO;2-5
[34] WEBSTER K A, SCHACH U, ORDAZ A, et al. Dmrt1 is necessary for male sexual development in zebrafish [J]. Developmental Biology, 2017, 422(1): 33−46. DOI: 10.1016/j.ydbio.2016.12.008
[35] GAN R H, WANG Y, LI Z, et al. Functional divergence of multiple duplicated Foxl2 homeologs and alleles in a recurrent polyploid fish [J]. Molecular Biology and Evolution, 2021, 38(5): 1995−2013. DOI: 10.1093/molbev/msab002
[36] BANH Q Q T, GUPPY J L, DOMINGOS J A, et al. Induction of precocious females in the protandrous barramundi (Lates calcarifer) through implants containing 17β-estradiol - effects on gonadal morphology, gene expression and DNA methylation of key sex genes [J]. Aquaculture, 2021, 539: 736601. DOI: 10.1016/j.aquaculture.2021.736601




 下载:
下载: