Morphological and SRAP Markers-based Genetic Diversity Determination on Phaseolus lunatus L. Germplasms
-
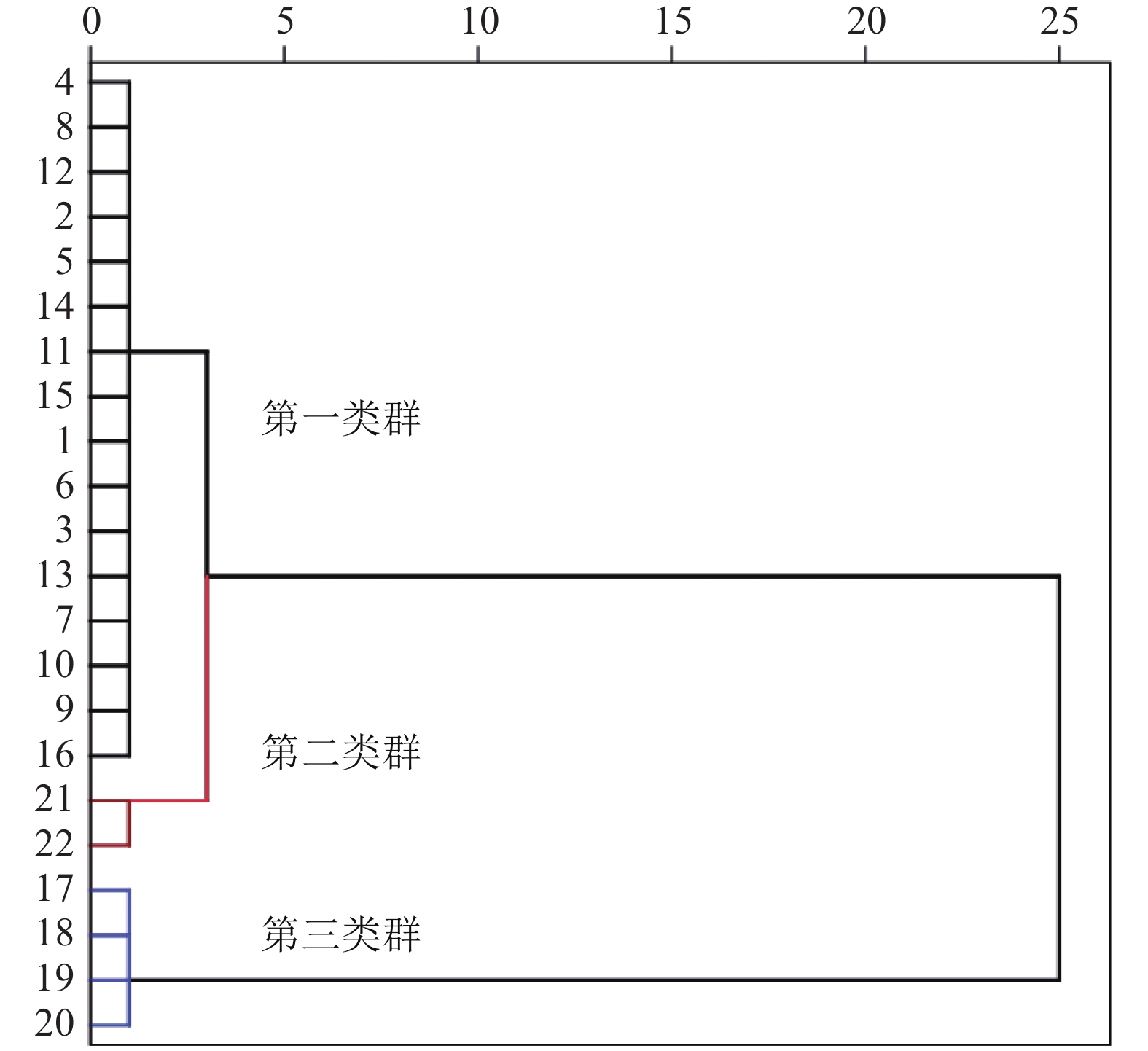
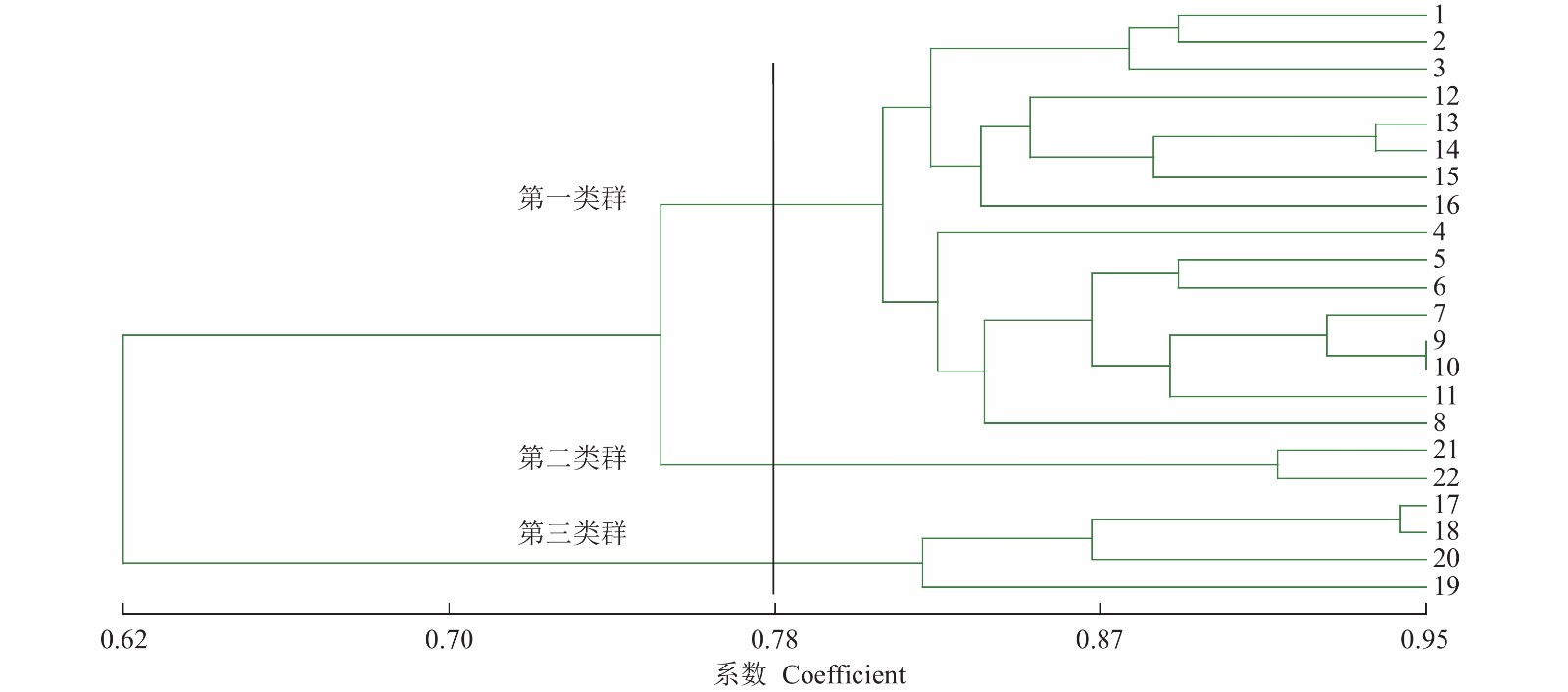
摘要:目的 探明莱豆种质资源遗传多样性和亲缘关系,为莱豆种质资源优良基因深度发掘和新品种选育提供科学依据。方法 利用形态标记和SRAP分子标记两种方法对22份莱豆资源的26个数量性状和 18个质量性状进行测定、分析。结果 筛选出的28对SRAP引物扩增多态性条带158条,平均多态性比率为77.75%。两种标记方法聚类结果显示,根据莱豆荚果大小可以将22份莱豆资源分为三大类群体。其中,“上横山10-2-6”和“下横山10-3-3”亲缘关系较近,推测可能存在频繁的基因交流。结论 22份莱豆资源遗传多样性丰富,形态标记和SRAP分子标记两种聚类方法基本支持根据荚果大小划分莱豆资源,为莱豆种质资源的创新利用奠定基础。Abstract:Objective Genetic diversity and relationship of Phaseolus lunatus L. germplasms were determined using the morphological and SRAP markers.Method Twenty-six quantitative and 18 quality traits of 22 lima bean germplasms were analyzed based on the morphological as well as the SRAP molecular markers.Result Twenty-eight pairs of SRAP primers were selected to obtain 158 amplified polymorphic bands with an average polymorphism ratio of 77.75%. The two methods applying different markers clustered the 22 varieties into 3 categories. Genetically, Shanghengshan10-2-6 and Xiahengshan 10-3-3 were relatively close. They might have gone through numerous gene exchanges in the past.Conclusion The 22 lima bean germplasms were rich in genetic diversity. The morphological and SRAP molecular markers-based clustering essentially agreed with the classification by the pod size.
-
0. 引言
【研究意义】近年来,随着畜禽养殖业的不断发展,畜禽废弃物的产量越来越大,沼气工程为处理畜禽养殖场废弃物提供了有效手段[1]。沼液是厌氧发酵后的副产物,含有丰富的营养元素,多以速效性及水溶性状态存在,易被作物吸收利用,是一种优质的有机肥料[2]。沼液施肥后可以增强土壤肥力,在提高作物产量、改善品质和防病抗逆等方面发挥重要作用[3]。通过沼液还田利用可以有效解决沼液的消纳问题,已成为当前畜禽养殖废弃物资源化利用的重要途径[4]。农业农村部在2018年重点推广的十大类型生态农业模式中,就有4类模式涉及沼液还田利用。沼液进入农田后会引起土壤环境发生系列改变,包括土壤的营养结构、土壤中重金属的形态和含量、土壤酸碱环境等,而土壤微生物能够敏感地反映出土壤环境的变化,是评价土壤质量的主要指标之一[5]。因此,研究沼液施肥对农田土壤微生物群落及微生态环境的影响,对于评价土壤质量演变、制定科学沼液还田方案具有重要的指导意义。【前人研究进展】目前关于沼液还田影响土壤微生物的研究主要集中在土壤微生物群落代谢功能多样性、土壤微生物数量、土壤细菌群落特征等方面。郑学博等[6]对旱地红壤的研究表明,沼液还田显著影响旱地红壤微生物群落的代谢活性和多样性。冯丹妮等[7]对水旱轮作耕层土壤的研究表明,长期沼液还田有利于土壤微生物数量和酶活性的提高,但对土壤微生态平衡及土壤质量存在潜在威胁。朱金山等[8]对稻田土壤的研究表明,不同沼液还田年限下稻田耕层土壤细菌群落组成及多样性均发生了明显变化。【本研究切入点】在众多研究中,有关沼液还田对土壤真菌群落特征影响的研究却较少报道。土壤真菌作为土壤微生物中主要的类群之一,是土壤中有机物的重要分解者,在陆地生态系统养分循环中发挥着重要作用,真菌多样性及其群落结构的变化是评价其所在生态系统健康稳定的关键性指标之一[9-10]。【拟解决的关键问题】为此,本文基于高通量测序技术,对采自连续施用沼液6年和未施用沼液的槟榔芋种植地块土壤真菌多样性及群落结构进行研究,探讨沼液施用对土壤真菌群落特征的影响,以及土壤真菌对由沼液施用引起的土壤理化性质变化的响应,为促进沼液资源化利用,维持畜禽养殖业的可持续发展提供理论依据。
1. 材料与方法
1.1 采样点基本情况
采样点位于建瓯市某养猪场粪污处理沼气工程周边的农田(27°13.30′N;118°12.80′E),该区域属于中亚热带海洋性季风气候,四季分明,雨量充足,春夏多雨,秋冬干燥,常年平均气温约18.80 ℃,降雨量约1 700 mm左右,无霜期约286 d。施肥用沼液来自该养猪场基地沼气工程充分发酵后经氧化塘处理的液体(沼液与氧化塘的水配比为1∶2),布管道至田里,按需实施漫灌施肥。供试沼液基本理化性质为:pH 7.99,化学需氧量(COD)285 mg·L−1,五日生化需氧量(BOD5)263 mg·L−1,氨氮475 mg·L−1,总氮978 mg·L−1,总磷22.50 mg·L−1。采样点土壤质地为砂壤土,主要种植作物为槟榔芋,每年只种1季,3月中下旬种植,11月初收获,冬季闲田。沼液灌溉的田块按照基肥和追肥方式灌入,在槟榔芋种植前,每667 m2灌入沼液量约15 t与田土混匀作基肥,随后每隔15 d进行1次追肥,每次追肥灌入沼液量约6 t,大概8月下旬进行最后1次追肥,整个生长期都不施用其他肥料,其他农艺管理措施均按照当地常规习惯统一实施。
1.2 样品的采集与制备
沼液施肥试验开始于2013年3月,于2018年10月(沼液施肥第6年),在槟榔芋种植地块上进行根际土壤样品的采集。采样时除去表层枯枝落叶等杂物,用取土器沿着植株的根部采集0~20 cm土层的土壤样品,标记为BS,同时采集周边一处地势较高未施用沼液的槟榔芋土壤作为对照样品,标记为CK,这2块槟榔芋田同属于一个农户,种植方式和田间管理方式相同。每块样地设置3份重复,每份重复样品均由5点取样法获得5个小样组成,现场混合均匀后装入无菌塑封袋中,放入带有冰块的保温箱中运回实验室。将取回的土样分成2份,1份用于土壤基本理化性质的测定,另一份存放于–80 ℃冰箱内用于DNA提取。
1.3 土壤理化性质测定
土壤pH值采用酸度计法(土∶水=1∶2.5)测定;有机质含量采用重铬酸钾氧化法测定;碱解氮采用扩散法测定;速效磷采用钼锑抗比色法测定;速效钾采用火焰光度计法测定。每个指标都进行全程同步试剂空白控制,每个样均设平行双样。
1.4 土壤基因组DNA提取
采用PowerSoil DNA Isolation Kit(MoBio Laboratories, Carlsbad,CA,USA)试剂盒,参照说明书,对土壤微生物总DNA进行提取。将提取的DNA用1%琼脂糖凝胶进行电泳,使用Nanodrop 2000检验其质量和浓度。
1.5 PCR扩增与高通量测序
选用引物ITS1-F(CTTGGTCATTTAGAGGAAGTAA)和ITS2-R(TGCGTTCTTCATCGATGC),对真菌ITS基因的ITS1可变区进行扩增,扩增程序为:95 ℃预变性5 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系总体积为20 μL,各反应组分为:4 μL 5×FastPfu Buffer缓冲液,1 μL引物(5 μM),2 μL dNTPs(2.5 mM),2 μL模板DNA,不足部分由无菌超纯水补足。反应结束后,扩增产物通过2%的琼脂糖凝胶电泳进行检测,采用QIAquick Gel Extraction Kit(QIAGEN, Germany)凝胶回收试剂盒进行纯化。将纯化后的扩增片段进行文库构建,构建好的文库经检测合格后,使用Illumina公司的Miseq PE250平台进行测序(由北京奥维森基因科技有限公司协助完成)。
1.6 数据分析
利用QIIME 1.8软件对测序原始数据进行质量筛查,去除barcode和primer并拼接后得到原始序列,经进一步去除嵌合体及短序列后得到高质量序列。使用UPARSE 10.0.240软件,对有效数据按97%的序列相似度进行归并和OTU(operational taxonomic unit)划分,统计样品中每个OTU的丰度信息。基于OTU的结果,计算Chao1指数、Observed species指数、PD whole tree指数和Shannon指数来进行生物多样性分析。采用RDP Classifier(http://sourceforge.net/projects/rdp-classifier/)方法对照Silva 128(http://www.arb-silva.de)数据库对OTU代表性序列进行物种分类注释,比对阈值设置为70%,并在不同分类水平上统计样本的群落组成。
样品在不同分类水平上的群落组成比较柱形图是通过OrginPro 2015软件得到的。利用R语言的Venn Diagram程序包和gplot程序包分别绘制韦恩图和热图,采用Canoco for Windows 4.5软件对真菌群落和理化因子进行典范对应分析。
2. 结果与分析
2.1 长期施用沼液对土壤理化性质的影响
对槟榔芋种植地块土壤pH分析结果表明:连续施用沼液6年后,土壤中pH有降低的趋势,但整体变化不显著(P>0.05),所测土样均呈微酸性。进一步对槟榔芋地块土壤样本的主要化学参数分析表明:连续施用沼液6年后,土壤有机质、碱解氮和速效钾含量均有一定程度提高,增幅分别为4.18%、10.92%和48.95%(表1),与未施用沼液土壤相比差异均达到显著性水平(P<0.05)。
表 1 不同施肥方式土壤理化性质Table 1. Physicochemical characteristics of soil under varied fertilizations样品编号
Samples IDpH 有机质
Organic matter/(g·kg−1)碱解氮
Alkali-hydrolysis N/(mg·kg−1)速效磷
Available P/(mg·kg−1)速效钾
Available K/(mg·kg−1)CK 5.29±0.01a 38.02±0.06b 229±0.28b 31.59±0.25a 190±0.76b BS 5.27±0.0a 39.61±0.01a 254±2.47 a 30.17±0.10a 283±2.09a 注:CK,未施用沼液土壤;BS,沼液施肥6年土壤;同列数据后不同小写字母表示处理间在0.05水平差异显著,表2同。
Note: CK, Soil with no biogas fertilization; BS, Soil with 6-year biogas slurry fertilization; Data with different lowercase letters on same column indicate significant difference among treatments at 0.05 level. Same for Table 2.2.2 长期施用沼液对土壤真菌多样性的影响
2.2.1 土壤真菌OTU水平分析
从未施用沼液(CK)和施用沼液(BS)两组土壤中,分别获得真菌总有效序列108 605条和82 479条,测序覆盖率在99%以上,说明测序数据量合理,能够比较真实的反映所测土壤样品中真菌群落组成情况。在97%相似性水平下,对样品的有效数据进行聚类,共划分出2 202个真菌OTUs。未施用沼液土壤(CK)样品中含有真菌种类1 839个,施用沼液土壤(BS)样品中含有1 844个,其中CK和BS有相同种类1 481个,特有种类分别为358个和363个(图1),表明不同施肥方式下土壤真菌OTUs组成有一定的差异。
2.2.2 土壤真菌多样性分析
基于OTU的结果,通过Chao1、Observed species、PD whole tree和Shannon等4种不同的计算指标来进行样品多样性分析,结果如表2所示。Chao1指数表征微生物物种的丰富度,用以估计群落中的OTU数目;Observed species指数用以估计样品中实际观测到的OTU数目;PD whole tree指数表征系统发育的多样性指数;Shannon指数表征样品中微生物群落的多样性程度。由表2可知,与未施用沼液土壤比较,长期施用沼液土壤Chao1和Observed species指数显著上升(P<0.05),增幅分别为30.38%和26.36%,即真菌群落的物种丰富度增加;PD whole tree和Shannon指数也呈现上升的趋势,其中PD whole tree指数与未施用沼液土壤相比差异达显著性水平(P<0.05),即长期施用沼液后,土壤真菌群落的多样性增加。
表 2 不同施肥方式土壤真菌多样性分析Table 2. Fungal diversity in soil under varied fertilizations样品编号 Samples ID Chao1 Observed species PD whole tree Shannon CK 1 623±14.72b 1 252±18.88b 248±2.14b 6.72±0.26a BS 2 116±57.86a 1 582±66.11a 305±6.34a 6.87±0.23a 2.2.3 土壤真菌群落组成分析
将2组土壤样品中得到的OTU,分别在门、纲、目、科、属5个水平上进行物种注释,统计不同组土壤样品中的真菌群落组成情况,图2-图4分别展示了门、纲、属3个不同水平的群落结构比较结果。
从门的分类水平上看(图2),2组土壤真菌主要由子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、未被分类的真菌门(Fungi_unidentified)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)等组成,其中优势菌门为子囊菌门、担子菌门、被孢霉门和未被分类的真菌门,它们占整体真菌群落总丰度的92%以上。对不同施肥方式土壤中真菌类群比较发现,长期施用沼液土壤中被孢霉门的相对丰度明显高于未施用沼液土壤,增幅为88.98%;而担子菌门和未被分类的真菌门的相对丰度却低于未施用沼液土壤,分别减少了13.35%和27.14%,可见施用沼液改变了土壤真菌优势菌门的相对丰度。此外,长期施用沼液后,土壤中的一些非优势菌门的相对丰度也发生了明显变化,如球囊菌门和罗兹菌门所占比例呈减少趋势,较未施用沼液土壤分别减少了88.70%和46.62%。
从纲的分类水平上看(图3),2组土壤真菌主要由粪壳菌纲(Sordariomycetes)、未被分类的真菌纲(Fungi unidentified)、被孢霉纲(Mortierellomycetes)、伞菌纲(Agaricomycetes)、座囊菌纲(Dothidemycetes)等组成,其中优势菌纲为粪壳菌纲、未被分类的真菌纲、被孢霉纲和伞菌纲,这些类群占整体真菌群落总丰度的67%以上。与未施用沼液土壤比较,长期施用沼液土壤中丰度显著增加的类群为被孢霉纲,增幅为90.12%,而一些非优势菌群如散囊菌纲(Eurotiomycetes)、球囊菌纲(Glomeromycetes)、古根菌纲(Archaeorhizomycetes)和微球黑粉菌纲(Microbotryomycetes)所占比例显著减少,较未施用沼液土壤分别减少了47.84%、90.14%、99.29%和97.68%。
为了更形象直观的呈现长期施用沼液后土壤真菌群落结构的变化,进一步选取相对丰度较高(>1%)的真菌属进行聚类分析(图4)。
从图4中可以看出,2组土壤真菌群落组成既有一定相似性,又表现出了一定差异性。未被分类的真菌属Fungi unidentified和隶属子囊菌门的Pseudeurotium属聚为一类,在2组土壤样品中的相对丰度无明显变化。隶属子囊菌门的Penicillium属、Acremonium属和Sordaria属、隶属担子菌门的Psilocybe属、隶属球囊菌门的Pacispora属聚为一类,这些类群在两组土壤中的相对丰度大小为未施用沼液>施用沼液,为未施用沼液土壤的优势菌属;而隶属子囊菌门的Rhodoveronaea属、Trichoderma属、Westerdykella属和Chaetomium属等、隶属担子菌门的Saitozyma属和Ramaria属、隶属被孢霉门的Mortierella属聚为一类,这些类群在长期施用沼液后比例明显增加,成为施用沼液土壤中的优势菌属。
2.3 土壤真菌群落与土壤理化性质的相关性
为了分析土壤理化因子对真菌群落的影响,在门水平上选取相对丰度大于0.1%的真菌类群与土壤的pH、有机质(OM)、碱解氮(AN)、速效磷(AP)和速效钾(AK)等5个理化因子进行典范对应分析。首先对土壤真菌群落做降趋势对应分析(Detrended correspondence analysis, DCA)。结果显示,4个排序轴中梯度最大长度为0.457,小于3,因此本研究选择基于线性模型的冗余分析(Reundancy analysis, RDA)进行排序(图5)。
从图5可以看出,未施用沼液和施用沼液土壤为2个相对独立的群落,表明它们之间的真菌群落差异较大,说明了施用沼液对土壤真菌群落的影响比较明显。RDA前2个排序轴共解释了98.0%的真菌群落变化,其中第1排序轴解释了84.5%的变异。经forward分析,对真菌群落影响程度排前3位的土壤因子依次为碱解氮、速效钾和有机质,蒙特卡罗检验显示这3个因子对土壤真菌群落影响显著(P<0.05)。碱解氮、速效钾和有机质存在明显的协同作用,其含量与Mortierellomycota、Entorrhizomycota和Cercozoa等菌群丰度呈极显著或显著正相关,而与Glomeromycota丰度呈极显著负相关。
3. 讨论
施用沼液能够提高土壤养分含量,增加土壤中微生物的数量及多样性指数[11]。本研究中,多样性分析结果表明,长期沼液施肥明显增加了土壤真菌的物种丰富度和群落多样性。这主要是由于沼液的长期施用改善了土壤理化性质,为土壤真菌提供了良好的生长环境及充足的能源,从而刺激了真菌微生物的活性,增加其群落的丰富度和多样性。与本研究相似,郑学博等[6]的研究也表明沼液还田会提高土壤微生物群落功能的多样性。左狄等[12]关于不同深度稻田土壤的研究表明,沼液还田显著增加了各深度土壤中微生物的数量。而朱金山等[8]的研究发现,随着沼液施肥年限的增加,稻田土壤微生物的物种丰富度和群落多样性逐渐降低。冯丹妮等[13]关于水稻油菜轮作土壤的研究也发现,沼液连年施用不利于丰富耕层土壤细菌的群落多样性。这可能与土壤质量状况、不同的沼液成分或不同的浇灌措施等都有密切关系,如Jose等[14]研究发现,土壤在受到高浓度重金属污染后,细菌群落多样性会显著降低。
从群落组成上来看,本研究在2组土壤样品中,真菌鉴定出子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)等主要菌门,其中子囊菌门为两组土壤中丰富度最高的真菌类群。与众多研究结果一致[15-17],子囊菌门在土壤生态系统中广泛存在,这可能是因为子囊菌可以产生大量的无性孢子,从而快速生长[18]。另外,本研究所测土壤均呈微酸性,这也就证实了子囊菌门为酸性土壤中的主要优势菌群[19]。同样,2组土壤鉴定出的优势菌纲有粪壳菌纲(Sordariomycetes)、被孢霉纲(Mortierellomycetes)和伞菌纲(Agaricomycetes),其中丰富度最高的优势菌为粪壳菌纲,这与徐雪雪等[20]、季凌飞等[21]的研究结果相类似,即该优势菌普遍存在于土壤中且丰富度最高。
本研究揭示,长期施用沼液改变了土壤真菌群落的相对丰度,提高了被孢霉门的相对丰度,降低了担子菌门、球囊菌门、罗兹菌门等的相对丰度。同样,长期施用沼液提高了被孢霉纲的相对丰度,降低了球囊菌纲的相对丰度。大量研究表明,不同施肥模式引起土壤环境条件的改变,会间接影响土壤微生物群落结构[22-24]。在本研究中,沼液施肥后槟榔芋根际土壤的理化性质也发生了不同程度的变化。RDA分析结果显示,土壤碱解氮、速效钾和有机质含量对土壤真菌群落影响显著,之前研究也报道了这些理化因子对土壤真菌群落结构的影响。如冯翠娥等[25]的研究表明碱解氮含量是影响土壤真菌群落组成最主要的因子之一;武俊男等[26]的研究表明速效钾含量是决定土壤真菌群落组成的关键因素之一;Liu等[27]、Luo等[28]认为有机碳含量是影响土壤真菌多样性的重要因素。本文中,长期施用沼液明显提高了土壤中碱解氮、速效钾和有机质含量,这些土壤因子与被孢霉门丰度呈极显著或显著正相关,与球囊菌门丰度却呈极显著负相关,这也就导致了长期施用沼液后被孢霉门丰度增加,而球囊菌门丰度减少。另外,有研究表明,球囊菌门中分布着大量的丛枝菌根真菌,连续施用沼液可能会降低土壤中丛枝菌根真菌含量,进而降低了球囊菌门的相对丰度[29-30]。
本研究发现,与未施用沼液土壤相比,长期施用沼液后土壤真菌属水平类群的相对丰度也发生明显变化。其中隶属子囊菌门的Rhodoveronaea属、Trichoderma属、Westerdykella属和Chaetomium属等、隶属担子菌门的Saitozyma属和Ramaria属、隶属被孢霉门的Mortierella属丰度明显增加。这主要是因为长期的沼液施用为这些菌群的生长提供了丰富的碳源和氮源,进而促进了其生长繁殖。然而,隶属子囊菌门的Penicillium属、Acremonium属和Sordaria属、隶属担子菌门的Psilocybe属、隶属球囊菌门的Pacispora属,这些类群在长期施用沼液后丰度明显降低,说明这些类群对沼液施肥引发的环境变化较为敏感。另外,有研究表明,Trichoderma、Chaetomium、Penicillium、Acremonium等菌属是目前报道的纤维素降解菌,对纤维素分解具有较强的作用[31]。本文施用沼液有效增加了Trichoderma和Chaetomium菌属的相对丰度,说明土壤施用沼液可能有利于某些纤维素降解菌的生长,这为后续从施用沼液土壤中筛选分离能高效分解纤维素的真菌提供了基础。然而,有关沼液施肥土壤中哪些菌为有益菌,哪些菌为有害菌,这些菌与槟榔芋生长发育之间的关系还需后期菌群功能分类分析进一步验证。
4. 结论
本文采用Illumina平台的MiSeq高通量测序技术,从真菌群落多样性、丰度及组成等方面研究了沼液施肥对槟榔芋种植地块土壤真菌的影响。结果表明,施用沼液明显提高了土壤有机质、碱解氮和速效钾含量,土壤理化性质的改变影响着土壤真菌多样性和群落结构特征。与未施用沼液土壤比较,长期施用沼液后土壤真菌物种OTUs数量、丰富度和群落多样性有明显增加,不同分类水平上各真菌类群所占比例也发生了改变。真菌门水平鉴定出子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)等类群,其中子囊菌门为土壤中丰富度最高的真菌类群。与未施用沼液土壤比较,在长期施用沼液的土壤中,被孢霉门中被孢霉纲相对丰度明显增加,而球囊菌门中球囊菌纲丰度明显减少;长期施用沼液后土壤真菌属水平优势类群也发生明显改变。RDA分析结果表明,施用沼液组土壤真菌群落结构与未施用沼液组差异较大,土壤碱解氮、速效钾和有机质含量是引起土壤真菌群落变化的重要环境因素。
-
表 1 供试莱豆种质资源
Table 1 P. lunatus germplasms studied
编号 Code 材料名称 Name 原产地 Orign 编号 Code 材料名称 Name 原产地 Orign 1 铁灶本 莆田市城厢区霞林办铁灶村 12 DJ-11-3-1-1 莆田市仙游县大济镇 2 莆1046 莆田市荔城区新度镇渠桥村 13 FT-08-2-5-3 莆田市仙游县枫亭镇 3 JD-1603 莆田市荔城区黄石镇清前村 14 DW17-1-5 莆田市仙游县度尾镇 4 莆莱1号 莆田市农科所选育 15 14LD-5-2-7 莆田市仙游县赖店镇 5 龙莱1号 龙岩市龙津作物所选育 16 DW15-6-1 莆田市仙游县度尾镇 6 QC12-1-17-3 莆田市荔城区新度镇青垞村 17 小莱豆16-5-6 莆田市城厢区常太镇 7 QC12-2-6-5 莆田市荔城区新度镇青垞村 18 小莱豆16-21-11 莆田市城厢区常太镇 8 横山10-1—1 莆田市荔城区新度镇横山村 19 中莱16-12-5 莆田市新度镇渠桥村 9 上横山10-2-6 莆田市荔城区新度镇横山村 20 武平黑花籽扁豆 龙岩市武平县 10 下横山10-3-3 莆田市荔城区新度镇横山村 21 PLQQ-08-2-6 莆田市荔城区新度镇渠桥村 11 新周13-6-2-7 莆田市仙游县园庄镇新周村 22 PLQQ-08-5-3 莆田市荔城区新度镇渠桥村 表 2 SRAP分析所用的引物序列
Table 2 Primer sequences used in SRAP analysis
编号Code 上游引物序列(5′-3′)Upstream primer sequences 下游引物序列(5′-3′)Downstream primer sequences me1em20 TGAGTCCAAACCGGATA GACTGCGTACGAATTCAG me2em13 TGAGTCCAAACCGGAGC GACTGCGTACGAATTGGT me2em20 TGAGTCCAAACCGGAGC GACTGCGTACGAATTCAG me4em2 TGAGTCCAAACCGGACC GACTGCGTACGAATTTGC me4em4 TGAGTCCAAACCGGACC GACTGCGTACGAATTTGA me4em11 TGAGTCCAAACCGGACC GACTGCGTACGAATTTCG me5em2 TGAGTCCAAACCGGAAG GACTGCGTACGAATTTGC me5em8 TGAGTCCAAACCGGAAG GACTGCGTACGAATTCTG me5em13 TGAGTCCAAACCGGAAG GACTGCGTACGAATTGGT me6em2 TGAGTCCAAACCGGTAA GACTGCGTACGAATTTGC me6em3 TGAGTCCAAACCGGTAA GACTGCGTACGAATTGAC me7em12 TGAGTCCAAACCGGTCC GACTGCGTACGAATTGTC me8em2 TGAGTCCAAACCGGTGC GACTGCGTACGAATTTGC me8em4 TGAGTCCAAACCGGTGC GACTGCGTACGAATTTGC me8em11 TGAGTCCAAACCGGTGC GACTGCGTACGAATTTCG me10em2 TGGGGACAACCCGGCTT GACTGCGTACGAATTTGC me10em3 TGGGGACAACCCGGCTT TGAGTCCAAACCGGAAT me10em4 TGGGGACAACCCGGCTT TGAGTCCAAACCGGACC me11em4 TGGGGACAACCCGGTTC TGAGTCCAAACCGGACC me11em7 TGGGGACAACCCGGTTC GACTGCGTACGAATTATG me12em4 TGGGGACAACCCGGTAG GACTGCGTACGAATTTGA me13em1 TGGGGACAACCCGGTCA GACTGCGTACGAATTAAT me13em3 TGGGGACAACCCGGTCA TGAGTCCAAACCGGAAT me13em9 TGGGGACAACCCGGTCA GACTGCGTACGAATTACG me13em14 TGGGGACAACCCGGTCA GACTGCGTACGAATTCAG me13em15 TGGGGACAACCCGGTCA GACTGCGTACGAATTCTG me14em1 TGGGGACAACCCGGTGT GACTGCGTACGAATTAAT me14em3 TGGGGACAACCCGGTGT GACTGCGTACGAATTGAC 表 3 莱豆种质资源数量性状
Table 3 Quantifiable traits of P. lunatus
品种编号Variety code 第一对真叶First pair of true leaves 顶端小叶Top lobule 主蔓粗Main stem diamete/cm 鲜荚fresh pods 鲜豆百粒重hundred-grain weight of frsh bean/g 干荚Dry pods 干豆百粒重hundred-grain weight of dry bean/g 真叶长True leaf length/cm 真叶宽True leaf width/cm 叶长Leaf length/cm 叶宽Leaf width/cm 叶柄长Petiole length/cm 叶柄粗Petiole thickness/mm 荚长Pod length/cm 荚宽Pod width/cm 荚重Pod weight/g 荚粒数pod seednumber 荚长Pod length/cm 荚宽Pod length/cm 荚重Pod weight/g 荚粒数pod seed number 1 9.39 9.10 11.18 7.70 9.10 2.33 1.23 10.74 2.79 12.66 2.61 312.21 10.78 2.50 4.92 2.40 155.08 2 7.75 6.43 10.82 7.02 9.47 2.22 1.39 10.14 2.75 13.45 2.62 349.17 11.15 2.32 5.55 2.60 163.73 3 8.48 8.08 10.72 6.22 10.32 2.00 1.30 10.69 2.56 12.81 2.53 313.80 15.69 2.24 5.08 2.50 155.24 4 8.79 7.31 12.11 6.87 11.27 2.04 1.47 11.44 2.92 19.17 3.00 374.30 11.33 2.41 7.56 2.50 175.80 5 8.74 8.18 10.37 6.58 9.98 2.00 1.63 10.14 2.63 14.42 2.50 356.62 9.78 2.49 5.86 2.60 167.58 6 8.57 8.83 10.38 6.12 8.95 1.84 1.26 10.77 2.72 11.49 2.35 311.38 11.68 2.37 5.62 2.90 150.83 7 8.78 9.19 10.02 5.67 8.92 1.83 1.33 10.44 2.69 10.69 2.45 330.77 11.61 2.51 5.62 3.00 136.77 8 7.21 8.07 12.27 6.92 11.21 1.97 1.51 11.88 2.66 15.06 2.88 373.22 11.63 2.38 6.80 3.00 179.93 9 10.48 9.54 10.44 6.32 9.59 2.51 1.34 11.50 2.55 12.50 2.80 320.50 10.29 2.07 4.43 2.50 136.68 10 10.17 9.20 11.61 7.28 9.93 1.99 1.35 10.42 2.94 11.19 2.40 333.05 10.10 2.38 4.05 2.40 129.67 11 9.41 8.53 12.15 6.67 10.11 1.99 1.69 10.57 2.70 11.38 2.55 333.33 11.19 2.39 5.56 2.80 160.96 12 8.77 9.03 11.62 6.47 11.36 1.97 1.89 11.18 2.76 12.24 2.63 364.39 11.33 2.60 6.36 3.00 170.63 13 8.01 7.30 10.68 6.36 10.20 1.94 1.31 11.06 2.58 13.11 2.80 307.26 10.50 2.26 5.24 2.50 165.52 14 8.40 7.77 11.75 6.78 10.32 1.88 1.66 11.34 3.00 14.17 2.42 363.45 11.12 2.42 5.19 2.50 157.92 15 9.43 8.01 12.45 7.09 11.12 1.93 1.37 12.56 2.82 17.17 2.90 335.03 11.63 2.28 5.37 2.45 161.52 16 5.28 8.26 11.31 6.25 9.23 1.90 1.63 11.20 2.66 14.09 2.60 351.20 10.07 2.24 7.29 2.40 136.75 17 10.23 7.04 6.50 5.67 6.25 1.48 0.92 7.25 1.47 4.71 2.85 104.61 7.53 1.47 2.61 2.85 55.19 18 9.79 7.58 6.94 6.08 9.37 1.69 1.03 7.23 1.44 4.67 3.05 99.61 7.39 1.45 2.66 2.80 57.20 19 9.04 7.16 6.78 5.54 6.33 1.40 1.01 7.09 1.66 4.32 2.70 93.97 7.30 1.65 2.29 2.75 54.67 20 9.47 7.99 9.24 6.79 8.89 1.71 1.02 7.56 1.93 6.47 3.30 128.35 6.81 1.55 2.26 2.70 57.59 21 8.93 8.62 10.88 6.35 12.61 2.28 1.77 12.06 2.74 17.62 2.80 417.11 11.73 2.49 5.93 2.60 167.46 22 8.98 8.38 11.19 7.10 12.54 2.15 1.85 13.10 2.77 19.62 3.09 411.34 12.02 2.33 6.72 3.00 169.70 表 4 28对引物的扩增结果
Table 4 Amplicon of 28 primer pairs
引物组合Primer combination 总带数Total bands 差异带Difference band 基本带Basic bands 多态性Polymorphism/ % ME2EM13 9 9 0 100.0 ME4EM4 4 2 2 50.0 ME5EM8 8 8 0 100.0 ME5EM13 9 8 1 88.89 ME6EM2 7 5 2 71.43 ME6EM3 10 10 0 100.0 ME7EM12 5 4 1 80.0 ME8EM2 6 3 3 50.0 ME10EM2 5 5 0 100.0 ME10EM3 3 2 1 66.67 ME10EM4 3 3 0 100.0 ME11EM4 6 5 1 83.33 ME11EM7 6 6 0 100.0 ME8EM11 5 4 1 80.0 ME12EM4 6 4 2 66.67 ME13EM1 8 5 3 62.5 ME13EM3 5 4 1 80.0 ME13EM9 4 4 0 100.0 ME13EM14 4 4 0 100.0 ME13EM15 4 1 3 25.0 ME14EM1 4 2 2 50.0 ME14EM3 6 4 2 66.67 ME4EM2 5 4 1 80.0 ME4EM11 5 3 2 60.0 ME5EM2 5 4 1 80.0 ME8EM4 7 6 1 85.71 ME2EM20 5 5 0 100.0 ME13EM5 4 2 2 50.0 合计Total 158 126 32 平均 Mean 5.64 4.5 1.14 77.75 -
[1] BAUDOIN J P , ROCHA O , DEGREE J, et al. Ecogeography, demography, diversity and conservation of Phaseolus lunatus L. in the Central Valley of Costa Rica[M]. systematic&ecogeographicstudies on crop genepools, 2004: 1-94.
[2] 彭葵, 李锦鸿, 李育军, 等. 华南地区利马豆绿色高产栽培技术 [J]. 长江蔬菜, 2020(22):40−42. PENG K, LI J H, LI Y J, et al. Green and high-yield cultivation techniques for Lima bean in South China [J]. Journal of Changjiang Vegetables, 2020(22): 40−42.(in Chinese)
[3] 张德纯. 莱豆史话 [J]. 中国蔬菜, 2009(11):15. ZHANG D C. H. Vegetable history of Lima bean [J]. China Vegetables, 2009(11): 15.(in Chinese)
[4] 郭媛贞, 黄强, 陈芝, 等. 优质莱豆新品种“莆莱1号”的选育 [J]. 福建农业学报, 2014, 29(3):247−249. DOI: 10.3969/j.issn.1008-0384.2014.03.010 GUO Y Z, HUANG Q, CHEN Z, et al. Breeding of qew Lima bean cultivar pulai No. 1 [J]. Fujian Journal of Agricultural Sciences, 2014, 29(3): 247−249.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2014.03.010
[5] 李广昌. 龙岩莱豆生态特性及高产栽培措施 [J]. 吉林蔬菜, 2008(5):8−9. DOI: 10.3969/j.issn.1672-0180.2008.05.005 LI G C. Ecological characteristics and high-yield cultivation measures of Leymus chinensis in Longyan [J]. Jilin Vegetable, 2008(5): 8−9.(in Chinese) DOI: 10.3969/j.issn.1672-0180.2008.05.005
[6] 姜永平, 宋益民, 章洪娟. 南通市地方特色蔬菜洋扁豆设施高效无公害栽培技术 [J]. 现代农业科技, 2013(15):101−102. DOI: 10.3969/j.issn.1007-5739.2013.15.064 JIANG Y P, SONG Y M, ZHANG H J. Efficient and pollution-free cultivation techniques of local vegetable lentils in Nantong city [J]. Xiandai Nongye Keji, 2013(15): 101−102.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2013.15.064
[7] 翁文燊. “香菇豆”的营养成分 [J]. 福建农业科技, 1990(3):43. DOI: 10.13651/j.cnki.fjnykj.1990.03.031 CHEN W S. Nutritional ingredients of Lima bean [J]. Fujian Agricultural Science and Technology, 1990(3): 43.(in Chinese) DOI: 10.13651/j.cnki.fjnykj.1990.03.031
[8] 陈小红, 吴德武, 黎英. 超声波法提取莱豆总黄酮研究 [J]. 长江大学学报(自然科学版), 2014(12):74−76,8. CHEN X H, WU D W, LI Y. Study on extraction of total flavonoids from Phaseolus lunatus L. by ultrasonic wave [J]. Journal of Yangtze University (Natural Science Edition), 2014(12): 74−76,8.(in Chinese)
[9] 雷蕾. 普通菜豆核心种质遗传结构及多样性研究[D]. 北京: 中国农业科学院, 2018. LEI L. Study on genetic structure and diversity of common bean core collection[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[10] KRUPA U. Main nutritional and antinutritional compounds of bean seeds - a review [J]. Polish Journal of Food and Nutrition Sciences, 2008, 58(2): 149−155.
[11] ALMEIDA C, PEDROSA-HARAND A. High macro-collinearity between lima bean(Phaseolus lunatus L. ) and the common bean (P. vulgaris L. ) as revealed by comparative cytogenetic mapping [J]. TheorAppl Genet, 2013, 126(7): 1909−1916. DOI: 10.1007/s00122-013-2106-9
[12] WINTER P, KAHL G. Molecular marker technologies for plant improvement [J]. World Journal of Microbiology and Biotechnology, 1995, 11(4): 438−448. DOI: 10.1007/BF00364619
[13] LI G, QUIROS C F. Sequence- related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theoretical and Applied Genetics, 2001, 103(2): 455−461.
[14] 陈方永, 谢丽雪, 倪海枝, 等. 卵圆型软条白沙枇杷变异种质鉴定研究 [J]. 植物遗传资源学报, 2014, 15(5):986−991. DOI: 10.13430/j.cnki.jpgr.2014.05.010 CHEN F Y, XIE L X, NI H Z, et al. Identification of egg-shaped Ruantiao Baisha loquat mutant germplasm [J]. Journal of Plant Genetic Resources, 2014, 15(5): 986−991.(in Chinese) DOI: 10.13430/j.cnki.jpgr.2014.05.010
[15] 张坤, 周源洁, 李尧, 等. 基于SRAP和SCoT标记的猕猴桃种质遗传多样性分析及变异材料鉴定 [J]. 果树学报, 2021, 38(12):2059−2071. DOI: 10.13925/j.cnki.gsxb.20210264 ZHANG K, ZHOU Y J, LI Y, et al. Genetic diversity analysis of kiwifruit germplasm and identification of variant based on SRAP and SCoT markers [J]. Journal of Fruit Science, 2021, 38(12): 2059−2071.(in Chinese) DOI: 10.13925/j.cnki.gsxb.20210264
[16] 李佳奇, 于卓, 杨东升, 等. 基于SRAP分子标记的冰草遗传连锁图谱构建 [J]. 西北植物学报, 2019, 39(1):76−83. DOI: 10.7606/j.issn.1000-4025.2019.01.0076 LI J Q, YU Z, YANG D S, et al. Construction of genetic linkage map for crested wheatgrass(Agropyron) based on SRAP molecular markers [J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(1): 76−83.(in Chinese) DOI: 10.7606/j.issn.1000-4025.2019.01.0076
[17] 张明飞, 于卓, 于肖夏, 等. 四倍体马铃薯SRAP分子遗传连锁图谱的构建 [J]. 草业学报, 2019, 28(8):190−199. DOI: 10.11686/cyxb2019230 ZHANG M F, YU Z, YU X X, et al. Construction of a genetic linkage map for tetraploid potato based on SRAP markers [J]. Acta Prataculturae Sinica, 2019, 28(8): 190−199.(in Chinese) DOI: 10.11686/cyxb2019230
[18] 张冬菊, 李世超, 吴鹏夫, 等. 基于表型和SRAP标记的切花菊品种遗传多样性分析 [J]. 园艺学报, 2014, 41(1):118−130. DOI: 10.3969/j.issn.0513-353X.2014.01.014 ZHANG D J, LI S C, WU P F, et al. Genetic diversity analysis in cut Chrysanthemum cultivars based on morphology and SRAP markers [J]. Acta Horticulturae Sinica, 2014, 41(1): 118−130.(in Chinese) DOI: 10.3969/j.issn.0513-353X.2014.01.014
[19] 李晋华, 王少铭, 罗莉斯, 等. 基于SRAP标记的生姜种质资源遗传多样性分析 [J]. 分子植物育种, 2021:1−29. LI J H, WANG S M, LUO L S, et al. Genetic Diversity of Ginger Germplasm Resources Based on SRAP [J]. Molecular Plant Breeding, 2021: 1−29.(in Chinese)
[20] 陶爱芬, 魏嘉俊, 刘星, 等. 应用SRAP标记绘制88份南瓜属种质资源DNA指纹图谱 [J]. 植物遗传资源学报, 2017, 18(2):225−232. DOI: 10.13430/j.cnki.jpgr.2017.02.008 TAO A F, WEI J J, LIU X, et al. Construction of molecular fingerprinting map for 88 accessions of Cucurbita by SRAP markers [J]. Journal of Plant Genetic Resources, 2017, 18(2): 225−232.(in Chinese) DOI: 10.13430/j.cnki.jpgr.2017.02.008
[21] 李慧峰, 冉昆, 王涛. 利用SRAP标记构建山东省苹果资源指纹图谱 [J]. 沈阳农业大学学报, 2020, 51(4):470−475. LI H F, RAN K, WANG T. Molecular fingerprinting construction of Shandong Malus germplasms based on SRAP markers [J]. Journal of Shenyang Agricultural University, 2020, 51(4): 470−475.(in Chinese)
[22] 王述民, 张亚芝, 魏淑红. 普通菜豆种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2006. [23] 刘凯, 陈汉才, 李桂花, 等. 豇豆种质资源遗传多样性和亲缘关系的SRAP和SSR分析 [J]. 中国农学通报, 2014, 30(31):156−163. DOI: 10.11924/j.issn.1000-6850.2014-1615 LIU K, CHEN H C, LI G H, et al. Genetic diversity and phylogenetic relationships analysis of cowpea germplasm resources by SRAP and SSR [J]. Chinese Agricultural Science Bulletin, 2014, 30(31): 156−163.(in Chinese) DOI: 10.11924/j.issn.1000-6850.2014-1615
[24] 张春宝, 邱红梅, 赵洪锟, 等. 东北地区大豆种质遗传多样性的SRAP标记分析 [J]. 大豆科学, 2014, 33(1):17−22. DOI: 10.11861/j.issn.1000-9841.2014.01.0017 ZHANG C B, QIU H M, ZHAO H K, et al. Genetic diversity analysis of soybean germplasm in northeast region of China by SRAP markers [J]. Soybean Science, 2014, 33(1): 17−22.(in Chinese) DOI: 10.11861/j.issn.1000-9841.2014.01.0017
[25] 侯万伟, 张小娟. 蚕豆SRAP标记的建立及遗传多样性分析 [J]. 分子植物育种, 2021, 19(10):3339−3343. DOI: 10.13271/j.mpb.019.003339 HOU W W, ZHANG X J. Establishment and genetic diversity analysis of SRAP markers in Vicia faba [J]. Molecular Plant Breeding, 2021, 19(10): 3339−3343.(in Chinese) DOI: 10.13271/j.mpb.019.003339
[26] 刘明骞, 陈丽君, 丁美美, 等. 基于SRAP分子标记的剑豆遗传多样性分析 [J]. 中国农业大学学报, 2015, 20(2):58−66. DOI: 10.11841/j.issn.1007-4333.2015.02.008 LIU M Q, CHEN L J, DING M M, et al. Genetic diversity of Canavalia ensiformis(L.)DC. accessions revealed by SRAP markers [J]. Journal of China Agricultural University, 2015, 20(2): 58−66.(in Chinese) DOI: 10.11841/j.issn.1007-4333.2015.02.008
[27] MARTINS M, TENREIRO R, OLIVEIRA M M. Genetic relatedness of Portuguese almond cultivars assessed by RAPD and ISSR markers [J]. Plant Cell Reports, 2003, 22(1): 71−78. DOI: 10.1007/s00299-003-0659-9
-
期刊类型引用(2)
1. 曾志浩,袁宗胜,陈雪莹,林鸿艳,黄晓南,刘芳. 3种红树植物根际与非根际土壤细菌群落结构及多样性特征. 福建农业学报. 2022(06): 809-816 .  本站查看
本站查看
2. 雷菲,张冬明,吴宇佳,谭皓,吉清妹,潘孝忠. 化肥减量配施有机肥对樱桃番茄产量、品质和微生物群落结构的影响. 江西农业大学学报. 2021(06): 1269-1277 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: