The Community Structure and Diversity Characteristics of Rhizosphere Bacteria and Endophytic Bacteria in Phyllostachys edulis under Annual Growth Characteristics (On and Off Years)
-
摘要:目的 研究大小年毛竹林毛竹根际细菌和内生细菌群落多样性及其结构差异。方法 采集I度、II度和IV度的大年和小年毛竹林中毛竹的竹鞭、鞭根、根际土壤和林间土壤,提取样本基因组DNA,利用Illumina高通量测序技术分析毛竹根际细菌和内生细菌群落结构多样性。结果 各组样本总共鉴定出31个门、49个纲、108个目、212个科、472个属细菌。从优势菌群及丰度来看,大年竹鞭和鞭根的优势菌纲为α-变形菌纲,优势菌目为根瘤菌目;小年竹鞭和鞭根的优势菌纲为γ-变形菌纲,优势菌目为芽孢杆菌目。在门水平上,大年竹鞭样本放线菌门的丰度高于小年竹鞭样本,大年毛竹鞭根酸杆菌门和变形菌门的丰度大于小年毛竹鞭根样本,厚壁菌门和拟杆菌门的丰富度小于小年毛竹鞭根样本。在纲和目水平上,大年竹鞭和鞭根样本与小年样本相比较,主要优势菌群为弗兰克氏菌目和α-变形菌纲下属的根瘤菌目。在科水平上,大年毛竹鞭根样本在黄杆菌科的丰度都大于小年样本。在属水平上,大年毛竹鞭根样本在慢生根瘤菌属的丰度大于小年毛竹鞭根样本,而大年毛竹竹鞭和鞭根样本细菌在伯克氏菌科的丰度都低于小年毛竹竹鞭和鞭根样本。从多样性来看,大小年毛竹根际土壤在各水平的细菌群落组成上差异不大,但根际细菌的多样性和丰度高于林间土壤。结论 毛竹的竹龄及大小年更替对根际细菌群落多样性的影响不大,根际细菌群落具有更高的多样性。大小年毛竹竹鞭和鞭根内生细菌在主要类群上有明显的不同。Abstract:Objective To study the diversity and structural differences of rhizosphere bacteria and endophytic bacterial communities in Phyllostachys edulis forests during on and off years.Methods Samples of rhizomes and rhizomes roots as well as rhizosphere soils of degree I, degree II and degree IV P. edulis and non-rhizosphere soils were collected in the on and off years. Genomic DNA was extracted from samples, and Illumina high-throughput sequencing technology was used to analyze the diversity of rhizosphere bacteria and endophytic bacterial communities in P. edulis.Results A total of 31 phyla, 49 classes, 108 orders, 212 families, and 472 genera were identified. The dominant phyla in the on-year P. edulis rhizomes and rhizomes roots were α-Amastigotes, and the dominant order Rhizobia. In the off-year specimens, the dominant phylum was γ-Amastigotes, and the dominant order Bacillariophyceae. At phylum level, the abundance of Actinobacteria was higher in the on-year than in off-year rhizomes; and those of Acidobacteria and Methylobacteria were greater in the on-year than in the off-year rhizomes roots; and those of Firmicutes and Bacteroidetes were less in the on-year than in the off-year rhizomes roots. At class and order levels, the dominants included Frankiaceae and Rhizobia of α-Amastigotes in the on-year rhizomes and rhizomes roots as compared with the off-year samples. At the family level, the abundance of Flavobacteriaceae in the rhizomes root of the on-year was greater than that in the off-year samples. At the genus level, the abundance of Bradyrhizobium in the rhizomes root of on-year was greater than that in off-year. However, the abundance of Burkholderiaceae was lower of on-year than off-year. The rhizosphere soil at the forest in either on or off years did not differ significantly on bacterial diversity, but it was higher on the diversity and richness than the non-rhizosphere soil.Conclusion The rhizosphere bacterial community at a P. edulis forest appeared to be more diverse than the non-rhizosphere, although the diversity was not significantly altered between the years of on and off on the P. edulis growth. The dominant bacteria in the rhizomes and rhizomes roots of the plants differed significantly during the on and off years.
-
Keywords:
- Phyllostachys edulis forest /
- on and off year /
- bacterial community /
- diversity
-
0. 引言
【研究意义】毛竹(Phyllostachys edulis)是我国南方重要的森林资源,又名楠竹,是竹类中分布最广、面积最大、价值最高的优良竹种[1]。自然生长的毛竹林头年大量发笋长竹,第二年生鞭换叶,交替进行,每两年为一周期,如此周而复始,形成了毛竹林生长的大小年周期循环[2]。大小年毛竹林,往往只靠大年出笋成竹,小年不出笋或者很少出笋,两者隔年交替,严重影响毛竹单产的进一步提高[3]。植物是一个超级有机体,在植物表面和内部富集了数量庞大且种类繁多的微生物,植物与微生物共同进化、相互作用[4]。在长期的进化过程中,植物对微生物群落进行选择形成了植物特定的微生物群落,即微生物组[5]。微生物组在植物的生长发育、抗病、抗逆中扮演着重要的角色,而研究毛竹林大小年和微生物组的关联性对了解毛竹周年生长特性具有重要意义。【前人研究进展】植物不同生长发育阶段,微生物群落结构会发生变化,不同的微环境条件塑造了不同的微生物群落[6]。对马铃薯、甜菜和萝卜等作物研究表明,根际微生物可以通过改变土壤结构、pH以及营养物质的转化等,在植物生长、营养吸收、产量和抗病性中发挥关键作用[7-8]。【本研究切入点】国内外针对毛竹林大小年的研究多集中在大小年毛竹林本体上,认为毛竹林大小年属于生理现象,由毛竹自身营养物质积累消耗的节律变化及其内源激素在立竹个体生长中的节律变化[9],并同时受外部环境的影响而形成的,缺少毛竹林、土壤和微生物三者之间关系的研究,有关大小年毛竹林周期循环与微生物组之间变化规律的研究鲜见报道。毛竹林大小年的形成机制是否与毛竹微生物组有关联;大小年毛竹林生长与根际细菌和内生细菌群落结构变化之间是否存在驱动机制等值得探讨。【拟解决的关键问题】本文以大小年毛竹林中I、II、IV度毛竹的竹鞭、鞭根、根际土壤和林间土壤为研究对象,通过Illumina高通量测序技术研究大、小年毛竹根际细菌和内生细菌群落的结构和多样性特征,为进一步研究毛竹林大小年和微生物组的关联性提供理论基础。
1. 材料与方法
1.1 样本采集
采样地点设在福建省三明市永安市西洋镇三畲村毛竹林基地(东经117°46′,北纬25°89′),土壤类型为黄壤。在典型的大小年毛竹林地,于2020年5月(小年)、2021年5月(大年)分别采集I度(1年生)、II度(2~3年生)、IV度(6~7年生)各5株毛竹的竹鞭、鞭根、根际土壤及林间土壤共20个样本,样本编码规则见表1。选取根际土壤时,沿毛竹竹鞭挖开,顺竹鞭选取附着在鞭根上粒径小于1cm土壤作为根际土壤,并采集毛竹林间土壤作为对照。同一种样本采集后立即混合作为混合样放入无菌袋中,24 h 内放入−20 ℃保存。
表 1 样本编码规则Table 1. Sample codes毛竹类型P. edulis type 样本编码 Sample encoding 竹鞭Rhizome 鞭根Rhizome root 根际土壤Rhizosphere soil 林间土壤Forest soil 大年毛竹IOn-year P. edulis I ON.1.A5 ON.1.B5 ON.1.C5 ON.CK.C5 大年毛竹IIOn-year P. edulis II ON.2.A5 ON.2.B5 ON.2.C5 大年毛竹IVOn-year P. edulis IV ON.4.A5 ON.4.B5 ON.4.C5 小年毛竹IOff-year P. edulis I OF.1.A5 OF.1.B5 OF.1.C5 OF.CK.C5 小年毛竹IIOff-year P. edulis II OF.2.A5 OF.2.B5 OF.2.C5 小年毛竹IVOff-year P. edulis IV OF.4.A5 OF.4.B5 OF.4.C5 1.2 基因组DNA提取和16S rRNA高通量测序
用每份样本袋内的混合样提取DNA进行测序(其中组织样本经表面消毒并验证无菌),采用天根DNA提取试剂盒提取样本的基因组DNA,采用上游引物799F(5′-AACMGGATTAGATACCCKG-3′)和1193R (5′-ACGTCATCCCCACCTTCC-3′)对各样本16S rRNA基因 V5~V7可变区进行扩增。PCR体系:5 μL 10×Buffer;5 μL dNTPs(2 mmol·L−1); 1 μL DNA聚合酶;引物各1.5 μL;50 ngDNA模板;双蒸水补足50 μL。反应条件:94 ℃ 10 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min稳定延伸。质检合格的文库利用Illumina NovaSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序(北京诺禾致源科技股份有限公司)。
1.3 数据分析
测序得到的原始数据处理后得到有效数据,在97%相似水平下进行 OTUs聚类和物种信息分析[10]。利用R语言工具制作样本稀释曲线[11];利用R语言工具统计后作出Venn图;采用mothur[12]软件计算Alpha多样性指数,并采用Wilxocon秩和检验进行Alpha多样性的组间差异分析,利用R语言进行NMDS统计分析和作图;利用R语言PCoA统计分析和作图;利用Qiime计算Beta多样性距离矩阵,然后用R语言作图画样本层次聚类树;基于数据库中OTU的tree和OTU上的基因信息进行PICRUSt分析,预测菌群代谢功能[13]。
2. 结果与分析
2.1 测序结果分析
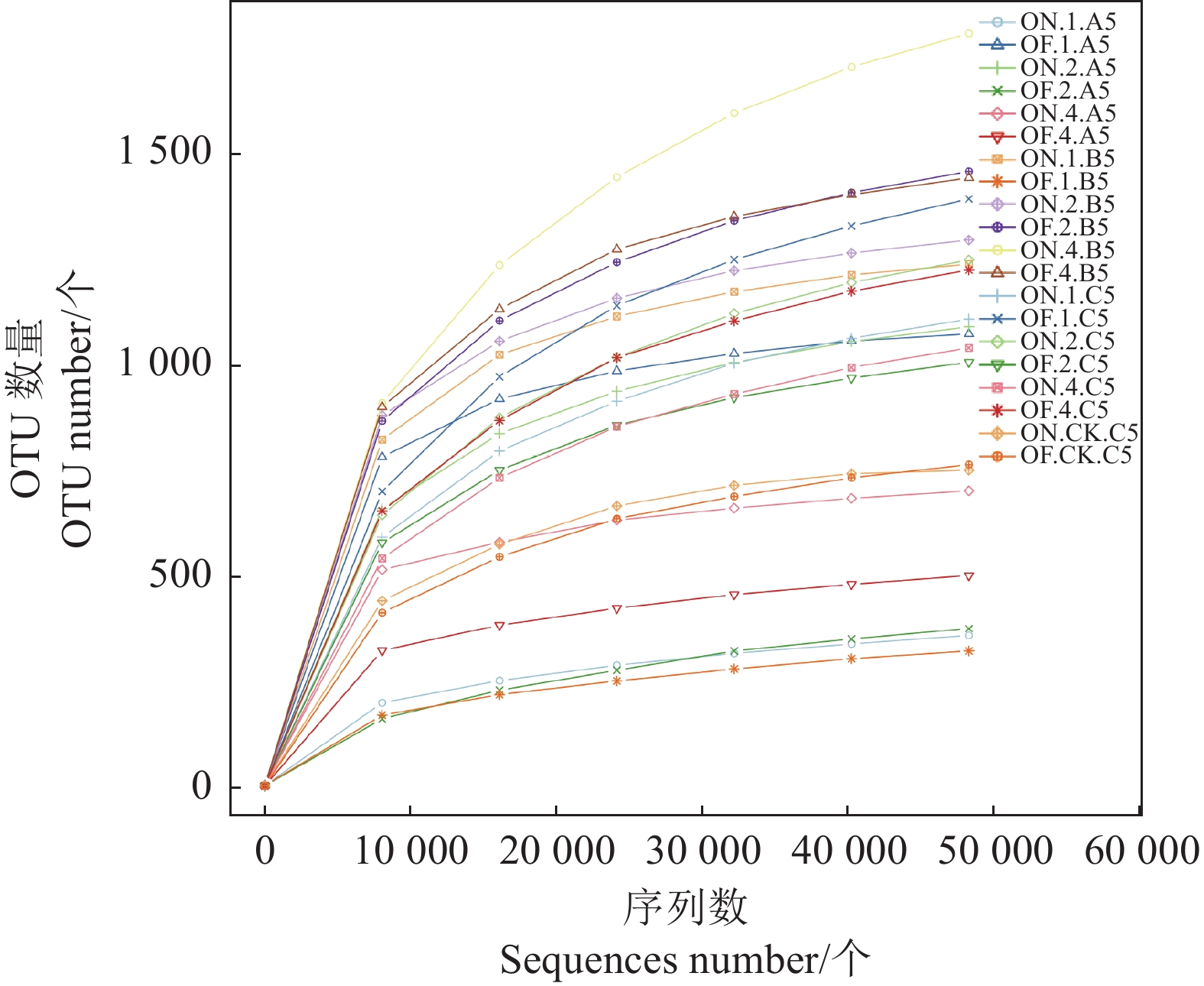
各组样本细菌16S rRNA基因高通量测序后共得到5037118条有效序列,样本测序深度为99.42%~99.92%。质控后的序列依据97%的序列相似性聚类获得细菌OTU数5802个。图1显示各组稀释曲线随着测序量的增大逐渐平缓,观测物种数趋于稳定,表明测序深度足以可靠描述毛竹和土壤样本相关的细菌微生物组。通过构建稀释曲线,表明竹鞭样本OTUs在400~1 000个饱和,鞭根样本 OTUs在1 200~1 400个饱和,根际土壤样本OTUs在1 000~1 400个 达到饱和,林间土壤样本 OTUs在750个左右达到饱和。
大小年毛竹各样本共鉴定出细菌31门、49纲、108目、212科、472属。从图2-a可以看出,I、II、IV度大、小年竹鞭样本ON.1.A5、OF.1.A5、ON.2.A5、OF.2.A5、ON.4.A5、OF.4.A5共有OTU有108个,特有OTU分别为61、424、440、42、215、67个。从图2-b可以看出,I、II、IV度大、小年鞭根样本ON.1.B5、OF.1.B5、ON.2.B5、OF.2.B5、ON.4.B5、OF.4.B5共有OTU170个,特有OTU分别为212、9、272、396、652、536个。从图2-c可以看出,I、II、IV度大、小年根际土壤样本及林间土壤样本ON.1.C5、OF.1.C5、ON.2.C5、OF.2.C5、ON.4.C5、OF.4.C5、ON.CK.C5、OF.CK.C5有269共有OTU为269个,特有OTU分别为176、382、287、133、162、312、192、104个。从各样本OTU数目可以看出,毛竹鞭根特有OTU数目随着毛竹生长而增加;毛竹小年根际土壤特有OTU数目均多于小年林间土壤样本。
2.2 细菌群落组成分析
为进一步研究大、小年毛竹根际细菌和内生细菌群落中特定分类群的变化,笔者比较了不同水平上根际细菌和内生细菌的相对丰度。
在门水平上,从图3可以看出,竹鞭和鞭根样本中优势菌门为变形菌门,而土壤样本的优势菌门为酸杆菌门。I度、II度样本在门水平的细菌群落组成上,大年和小年毛竹竹鞭样本间差异较小,而IV度毛竹的大年和小年竹鞭样本之间表现出一定差异。I度大年竹鞭在放线菌门的丰度为38.04%,大于I度小年竹鞭的22.25%;II度大年竹鞭在放线菌门和拟杆菌门的丰度为20.33%和6.46%,大于II度小年竹鞭的12.42%和1.07%;IV度大年竹鞭在放线菌门和酸杆菌门的丰度为21.54%和17.44%,大于IV度小年竹鞭的12.86%和2.57%,而IV度小年竹鞭在蓝藻菌门有较高占比为15.26%,远大于IV度大年竹鞭的0.09%。在酸杆菌门和变形菌门的丰度上,大年鞭根样本大于小年样本;而在厚壁菌门和拟杆菌门的丰度上,大年鞭根样本小于小年样本。II度毛竹大小年鞭根样本则在酸杆菌门的占比上表现出较明显的差异;林间土壤和各组根际土壤比较也有一定差异,林间土壤样本的绿弯菌门的丰度较根际土样本高。
在纲水平上,从图4可以看出,I、II、IV度的大、小年毛竹竹鞭样本之间,大年毛竹竹鞭样本在γ-变形菌纲的丰度低于小年毛竹竹鞭样本,在α-变形菌纲的丰度高于小年毛竹竹鞭样本;而IV度的大年毛竹竹鞭样本在酸杆菌纲表现出了较其他组样本更高的丰度。大小年毛竹鞭根样本之间比较,I、II、IV度的大年毛竹鞭根样本在α-变形菌纲的丰度都高于小年毛竹鞭根样本;I度、IV度大年和小年样本在纲水平的细菌群落组成的差异相似,大年样本在酸杆菌纲的丰度大于小年样本,在γ-变形菌纲和拟杆菌纲的丰度小于小年样本;而II度毛竹鞭根样本大年和小年的差异表现在酸杆菌纲。I、II、IV度的大年和小年毛竹鞭根土壤样本之间比较,在纲水平的细菌群落组成上差异不大;而林间土壤样本在α-变形菌纲的丰度略低于各组根际土壤样本。
在目水平上,从图5可以看出,I、II、IV度的大、小年毛竹竹鞭样本在目水平的细菌群落组成上,呈现的规律性较弱,可以看出大年毛竹竹鞭样本在根瘤菌目的占比都高于小年的毛竹竹鞭样本,在弗兰克氏菌目的丰富度普遍高于小年的毛竹竹鞭样本。在I、II、IV度的大小年毛竹鞭根样本中呈现的规律与毛竹竹鞭样本相同,大年的毛竹鞭根样本在根瘤菌目的丰度都高于小年的毛竹鞭根样本,在弗兰克氏菌目的丰度普遍高于小年的毛竹鞭根样本。I、II、IV度的大小年毛竹鞭根土壤样本在目水平的细菌群落组成上差异不大,而林间土壤样本和各组根际土壤样本相比,在根瘤菌目的占比较小。
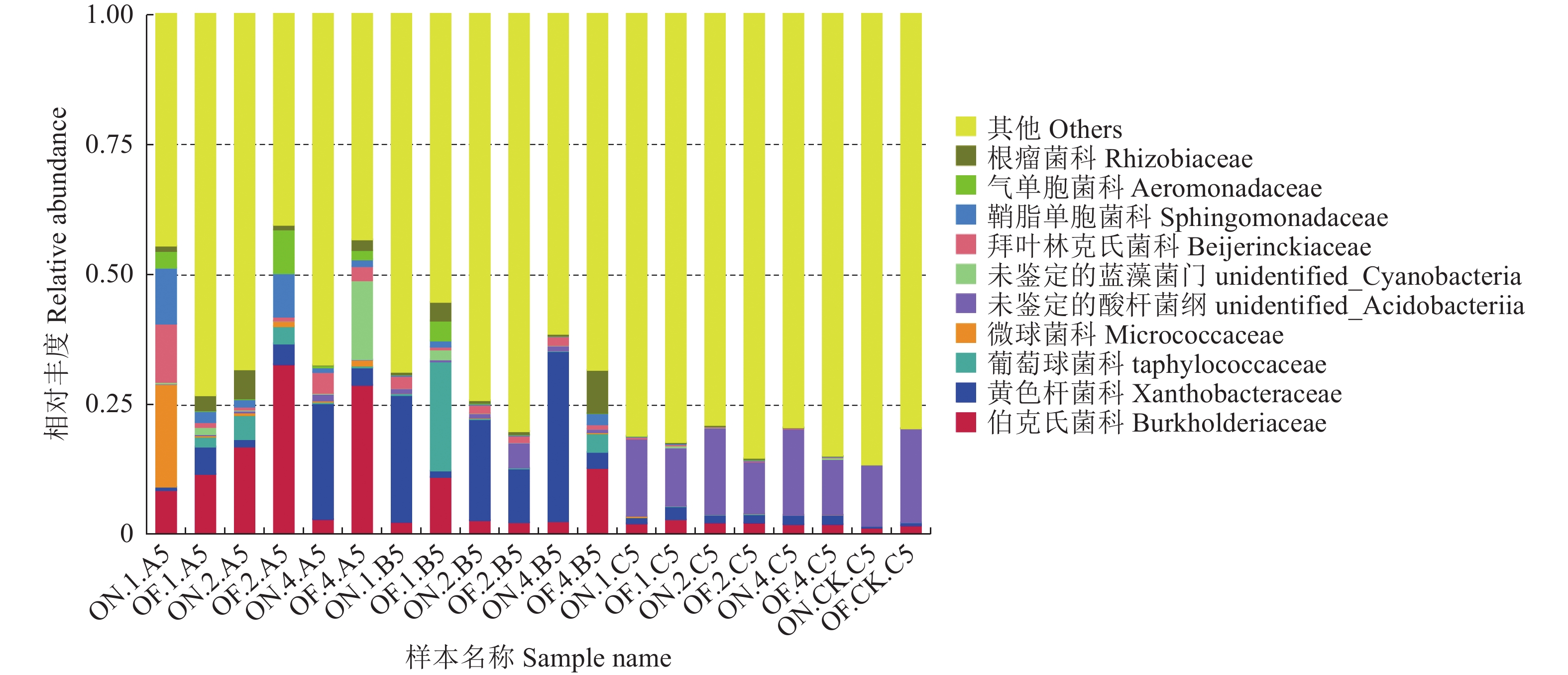
在科水平上,从图6可以看出,I、II、IV度大、小年毛竹竹鞭样本在科水平的细菌群落组成上表现出一定差异,大年的毛竹竹鞭样本在伯克氏菌科的丰富度都小于小年的毛竹竹鞭样本;I度大年毛竹竹鞭样本与其他组样本有一定差异,在微球菌科、拜叶林克氏菌科和鞘脂单胞菌科上占比较大。在毛竹鞭根样本科水平的细菌群落组成上,大年样本在黄色杆菌科的丰度都大于小年样本,I度、IV度大年毛竹鞭根样本在伯克氏菌科和葡萄球菌科的丰度小于小年样本。各组大小年毛竹鞭根土壤样本之间比较,在科水平的细菌群落组成上差异不大。
在属水平上,大小年毛竹竹鞭、鞭根和根际土壤样本细菌主要包括葡萄球菌属Staphylococcus、考克氏菌属Kocuria、慢生根瘤菌属Bradyrhizobium、甲基杆菌属Methylobacterium、鞘氨醇单胞菌属Sphingomonas、罗尔斯通菌属Ralstonia、气单胞菌属Aeromonas。从图7可以看出,大年毛竹鞭根样本在慢生根瘤菌属的丰度大于小年毛竹鞭根样本。各组大小年毛竹根际土壤样本之间比较,在属水平的细菌群落组成上差异不大。
2.3 细菌群落Alpha多样性分析
大小年毛竹的竹鞭、鞭根和土壤样本基于OTU数的Alpha多样性指数如表2所示,II度和IV度的毛竹竹鞭大年样本的细菌多样性大于小年样本,而I度毛竹竹鞭的大年样本的细菌多样性小于小年样本。毛竹鞭根样本的细菌多样性没有呈现明显规律,但总体上是大年的I度和IV度毛竹鞭根样本的细菌多样性大于小年的样本,而大年II度鞭根样本的细菌多样性小于小年样本。I度和IV度的根际土大年样本的细菌多样性小于小年样本,而II度的根际土大年样本的细菌多样性大于小年样本。毛竹根际细菌的多样性和丰度均要高于林间土壤样本。
表 2 各组样本的Alpha 多样性指数Table 2. Alpha diversity index of samples样本Sample 观测物种数/个Observed Species/piece 丰度指数ACE 香农指数Shannon 谱系多样性指数PD whole Tree 文库覆盖率Coverage/ % ON.1.A5 364 487.039 5.814 72.574 99.8 OF.1.A5 1078 1121.452 7.854 395.731 99.8 ON.2.A5 1095 1222.288 7.202 176.932 99.6 OF.2.A5 381 533.381 5.436 76.422 99.7 ON.4.A5 707 792.52 7.308 112.857 99.8 OF.4.A5 507 606.924 6.04 66.159 99.8 ON.1.B5 1243 1312.372 7.763 99.038 99.7 OF.1.B5 327 443.358 5.564 38.95 99.8 ON.2.B5 1300 1399.941 7.863 113.514 99.7 OF.2.B5 1462 1635.752 7.565 145.073 99.5 ON.4.B5 1790 2110.068 7.489 158.795 99.1 OF.4.B5 1447 1561.34 7.769 334.921 99.6 ON.1.C5 1113 1277.2 5.884 94.135 99.5 OF.1.C5 1397 1626.968 5.974 155.08 99.3 ON.2.C5 1253 1460.243 5.924 194.704 99.4 OF.2.C5 1011 1129.53 5.889 115.281 99.6 ON.4.C5 1045 1227.566 5.473 95.286 99.5 OF.4.C5 1229 1409.537 5.54 109.603 99.5 ON.CK.C5 756 756 5.776 95.302 100 OF.CK.C5 769 877.076 5.082 67.327 99.7 2.4 细菌群落Beta多样性分析
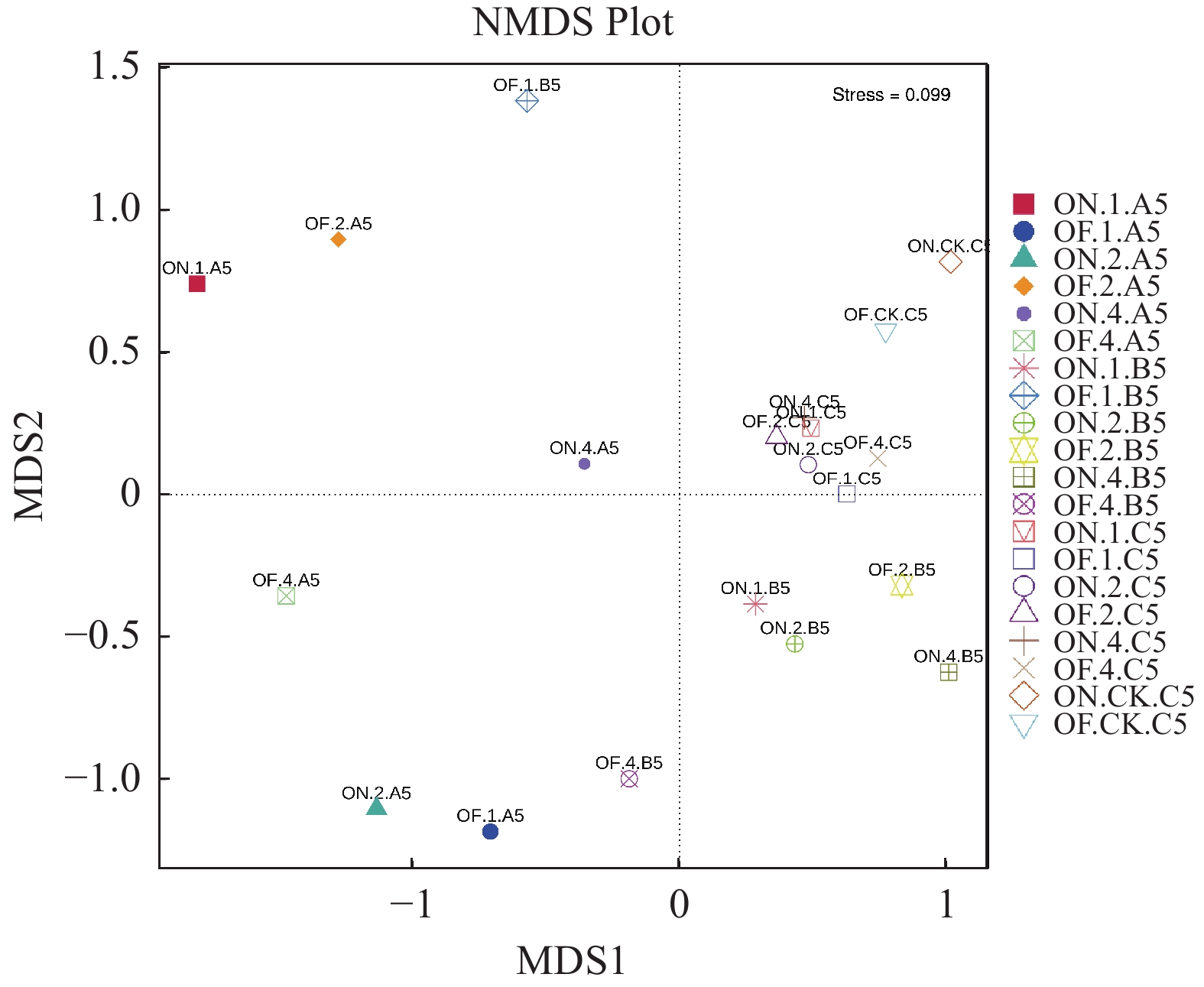
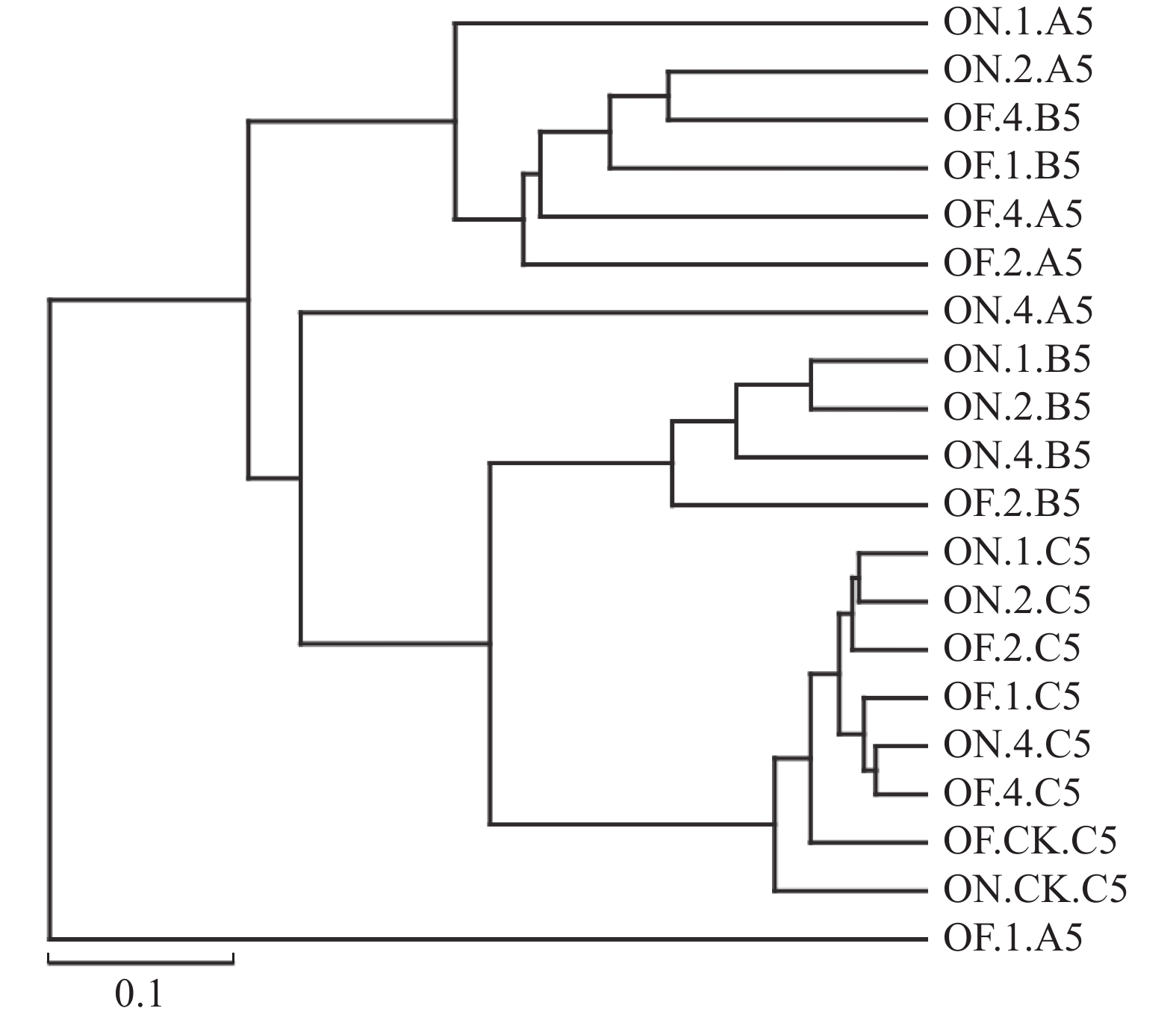
对各组样本进行NMDS分析(图8)并同时构建样本聚类树(图9)。可以看出,大小年毛竹的竹鞭样本之间距离较远,说明存在差异,即不同竹龄的大、小年毛竹竹鞭的细菌群落组成结构存在差异。大小年毛竹的鞭根样本间趋向于聚集但并不紧密,说明样本间有一定差距但差距较小。大小年毛竹的根际土壤样本紧密聚集,说明各样本群落组成较为相似,而与林间土壤样本存在一定距离,说明毛竹根部对土壤的细菌群落组成有一定选择作用。从图9可以看出,样本聚类树显示大年毛竹竹鞭和鞭根样本与小年毛竹竹鞭和鞭根样本之间呈现不同程度的区分。大小年毛竹的根际土壤样本之间区分不明显,而根际土壤样本与林间土壤样本有一定区分。
3. 讨论与结论
3.1 毛竹竹鞭、鞭根和根际土壤中细菌群落的差异
OTU数量与分布显示,毛竹鞭根内生细菌的特有OTU数目随着毛竹生长而增加,鞭根内生细菌共有的OTU数目明显多于竹鞭共有的OTU数目,毛竹根际土壤特有OTU数目要普遍多于林间土壤,小年I度根鞭土壤的特有OTU 最多,小年林间土壤的特有OTU数目最少,说明不同竹龄的毛竹对细菌的影响不同,鞭根的生长产生一定的有机质,为细菌创造了有利的生存环境,使细菌富集[14-16]。
Alpha多样性指数显示,毛竹根际细菌的多样性与丰富度都要高于林间土壤,说明毛竹鞭根根际为土壤细菌创造了有利的生存环境。Beta多样性分析显示,根际土壤样本与林间土壤样本有一定区分,这与禾本科的根际微生物研究结果一致[17-19]。大小年毛竹的根际土壤样本聚集紧密,而与林间土壤样本存在一定距离,表明随着毛竹的生长,毛竹根部分泌物逐步沉积造成根际土壤有机质成分与林间土的不同改变了某些细菌的生境,从而改变细菌的定殖能力,使根际土壤逐渐产生了高丰度的,以及特有化的微生物种群[8,20]。但大小年毛竹的根际土壤样本之间的多样性区分不明显,在细菌群落组成上差异也不大,说明根际土的细菌群落组成对毛竹大小年的形成无影响。
3.2 大小年毛竹竹鞭和鞭根内生细菌群落的优势菌群及作用
在门水平上,大年竹鞭样本在放线菌门的丰富度都要高于小年竹鞭样本,Henning等[21]研究表明,放线菌门在碳循环中起重要作用,其与有机质降解和利用相关,从而推测大年毛竹竹鞭在碳元素相关营养物质的消耗上可能要多于小年毛竹竹鞭。在纲和目水平上,大年竹鞭和鞭根样本与小年样本比较,主要优势菌群为弗兰克氏菌目和α-变形菌纲下属的根瘤菌目;多项研究证明,根瘤菌目具有固氮功能,参与生态系统中氮的修复[22-23], 变形菌的丰度也与植株的营养条件成正比,它能在细菌群落的建立中起关键作用[24-25]。同时弗兰克氏菌是一类能够与木本植物共生结瘤固氮的放线菌[26],其可修复植株在逆境下对氮元素的吸收[27]。这两类菌群可能有利于大年毛竹根际土中氮元素的循环。而在科水平上,小年毛竹竹鞭和鞭根样本细菌在伯克氏菌科的丰富度都要高于大年毛竹竹鞭和鞭根样本。伯克氏菌被认为是一种植物促生菌,其在生物固氮和促进植物生长方面发挥重要作用[28-29]。所以本研究推测大年毛竹和小年毛竹的竹鞭和鞭根在养分吸收方面相关联的主要菌群不同。
3.3 大小年毛竹竹鞭和鞭根内生细菌群落组成的差异
从本研究的数据分析可以看出,大年和小年毛竹的竹鞭和鞭根样本细菌群落组成存在差异,且I度、II度和IV度毛竹在差异上也有所不同。细菌定殖虽是一个动态过程,但健康的毛竹能在不同时期能选择合适的细菌占据毛竹组织的定殖生态位[30-31],因此造成不同时期细菌群落组成差异。但本研究具有一定的局限性,有关大年和小年毛竹的竹鞭和鞭根样本细菌群落差异与大小年之间是否存在耦合机理,是否受竹龄影响等的具体规律还有待进一步研究。
综上,本研究对I度、II度、IV度大小年毛竹的竹鞭、鞭根和根际细菌群落组成进行了分析,比较了不同水平上细菌群落的相对丰度,找到一定差异规律,分析了差异菌群的相关作用,并推测大、小年毛竹的竹鞭和鞭根在养分吸收方面的主要菌群不同。本研究有助于研究毛竹林大年和小年的竹鞭和鞭根细菌群落及根际细菌的差异特征,为进一步研究毛竹林大小年和细菌群落的关联性提供理论基础。但毛竹相关细菌群落和养分吸收之间的具体关系,以及与毛竹竹龄相互影响的规律尚不明晰,有待进一步研究。
-
表 1 样本编码规则
Table 1 Sample codes
毛竹类型P. edulis type 样本编码 Sample encoding 竹鞭Rhizome 鞭根Rhizome root 根际土壤Rhizosphere soil 林间土壤Forest soil 大年毛竹IOn-year P. edulis I ON.1.A5 ON.1.B5 ON.1.C5 ON.CK.C5 大年毛竹IIOn-year P. edulis II ON.2.A5 ON.2.B5 ON.2.C5 大年毛竹IVOn-year P. edulis IV ON.4.A5 ON.4.B5 ON.4.C5 小年毛竹IOff-year P. edulis I OF.1.A5 OF.1.B5 OF.1.C5 OF.CK.C5 小年毛竹IIOff-year P. edulis II OF.2.A5 OF.2.B5 OF.2.C5 小年毛竹IVOff-year P. edulis IV OF.4.A5 OF.4.B5 OF.4.C5 表 2 各组样本的Alpha 多样性指数
Table 2 Alpha diversity index of samples
样本Sample 观测物种数/个Observed Species/piece 丰度指数ACE 香农指数Shannon 谱系多样性指数PD whole Tree 文库覆盖率Coverage/ % ON.1.A5 364 487.039 5.814 72.574 99.8 OF.1.A5 1078 1121.452 7.854 395.731 99.8 ON.2.A5 1095 1222.288 7.202 176.932 99.6 OF.2.A5 381 533.381 5.436 76.422 99.7 ON.4.A5 707 792.52 7.308 112.857 99.8 OF.4.A5 507 606.924 6.04 66.159 99.8 ON.1.B5 1243 1312.372 7.763 99.038 99.7 OF.1.B5 327 443.358 5.564 38.95 99.8 ON.2.B5 1300 1399.941 7.863 113.514 99.7 OF.2.B5 1462 1635.752 7.565 145.073 99.5 ON.4.B5 1790 2110.068 7.489 158.795 99.1 OF.4.B5 1447 1561.34 7.769 334.921 99.6 ON.1.C5 1113 1277.2 5.884 94.135 99.5 OF.1.C5 1397 1626.968 5.974 155.08 99.3 ON.2.C5 1253 1460.243 5.924 194.704 99.4 OF.2.C5 1011 1129.53 5.889 115.281 99.6 ON.4.C5 1045 1227.566 5.473 95.286 99.5 OF.4.C5 1229 1409.537 5.54 109.603 99.5 ON.CK.C5 756 756 5.776 95.302 100 OF.CK.C5 769 877.076 5.082 67.327 99.7 -
[1] PENG Z H, LU Y, LI L B, et al. The draft genome of the fast-growing non-timber forest species moso bamboo (Phyllostachys heterocycla) [J]. Nature Genetics, 2013, 45(4): 456−461. DOI: 10.1038/ng.2569
[2] LONGWEI, LI N, LU D S, et al. Mapping Moso bamboo forest and its on-year and off-year distribution in a subtropical region using time-series Sentinel-2 and Landsat 8 data [J]. Remote Sensing of Environment, 2019, 231: 111265. DOI: 10.1016/j.rse.2019.111265
[3] ZHOU Y F, ZHOU G M, DU H Q, et al. Biotic and abiotic influences on monthly variation in carbon fluxes in on-year and off-year Moso bamboo forest [J]. Trees, 2019, 33(1): 153−169. DOI: 10.1007/s00468-018-1765-1
[4] SHELAKE R M, PRAMANIK D, KIM J Y. Exploration of plant-microbe interactions for sustainable agriculture in CRISPR era [J]. Microorganisms, 2019, 7(8): 269. DOI: 10.3390/microorganisms7080269
[5] MÜLLER D B, VOGEL C, BAI Y, et al. The plant microbiota: Systems-level insights and perspectives [J]. Annual Review of Genetics, 2016, 50: 211−234. DOI: 10.1146/annurev-genet-120215-034952
[6] MA B, WANG H Z, DSOUZA M, et al. Geographic patterns of co-occurrence network topological features for soil microbiota at continental scale in Eastern China [J]. The ISME Journal, 2016, 10(8): 1891−1901. DOI: 10.1038/ismej.2015.261
[7] KLOEPPER J W, LEONG J, TEINTZE M, et al . Enhanced plant growth by siderophores produced by plant growth -promothing rhizobacteria [J]. Nature, 1980, 286 (5776): 885−886 . DOI: 10.1038/286885a0
[8] BULGARELLI D, SCHLAEPPI K, SPAEPEN S, et al . Sturcture and functions of the bacterial microbiota of plant [J]. Annual Review of Plant Biology, 2013, 64 : 807−838. DOI: 10.1146/annurev-arplant-050312-120106
[9] 吴良如,萧江华. 大小年毛竹林中内源激素节律变化特征的研究 [J]. 竹子研究汇刊,1998, 1998, 17(1):24−30. LIANGU W, JIANGHUA XIAO. Study on Dynamic Characteristics of Eudogenous Phytohormone in On-and-Off Year Bamboo (Phyllost achys Heterocycles Var. Pubescens) Grove [J]. Journal of Bamboo Research, 1998, 17(1): 24−30.(in Chinese)
[10] EDGAR R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10): 996−998. DOI: 10.1038/nmeth.2604
[11] LIN X C, CHOW T Y, CHEN H H, et al. Understanding bamboo flowering based on large-scale analysis of expressed sequence tags [J]. Genetics and Molecular Research:GMR, 2010, 9(2): 1085−1093. DOI: 10.4238/vol9-2gmr804
[12] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009, 75(23): 7537−7541. DOI: 10.1128/AEM.01541-09
[13] ISAGI Y, SHIMADA K, KUSHIMA H, et al. Clonal structure and flowering traits of a bamboo[Phyllostachys pubescens (Mazel) Ohwi]stand grown from a simultaneous flowering as revealed by AFLP analysis [J]. Molecular Ecology, 2004, 13(7): 2017−2021. DOI: 10.1111/j.1365-294X.2004.02197.x
[14] BAIS H P, WEIR T L, PERRY L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms [J]. Annual Review of Plant Biology, 2006, 57: 233−266. DOI: 10.1146/annurev.arplant.57.032905.105159
[15] REINHOLD-HUREK B, BÜNGER W, BURBANO C S, et al. Roots shaping their microbiome: Global hotspots for microbial activity [J]. Annual Review of Phytopathology, 2015, 53: 403−424. DOI: 10.1146/annurev-phyto-082712-102342
[16] COLEMAN-DERR D, DESGARENNES D, FONSECA-GARCIA C, et al. Plant compartment and biogeography affect microbiome composition in cultivated and native Agave species [J]. The New Phytologist, 2016, 209(2): 798−811. DOI: 10.1111/nph.13697
[17] XUAN D T, GUONG V T, ROSLING A, et al. Different crop rotation systems as drivers of change in soil bacterial community structure and yield of rice, Oryza sativa [J]. Biology and Fertility of Soils, 2012, 48(2): 217−225. DOI: 10.1007/s00374-011-0618-5
[18] XIANGZHEN, LI,. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar [J]. Soil Biology and Biochemistry, 2014, 68: 392−401. DOI: 10.1016/j.soilbio.2013.10.017
[19] SHI Y H, PAN Y S, XIANG L, et al. Assembly of rhizosphere microbial communities in Artemisia annua: Recruitment of plant growth-promoting microorganisms and inter-Kingdom interactions between bacteria and fungi [J]. Plant and Soil, 2022, 470(1): 127−139.
[20] BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health [J]. Trends in Plant Science, 2012, 17(8): 478−486. DOI: 10.1016/j.tplants.2012.04.001
[21] HENNING S M, YANG J P, SHAO P, et al. Health benefit of vegetable/fruit juice-based diet: Role of microbiome [J]. Scientific Reports, 2017, 7: 2167. DOI: 10.1038/s41598-017-02200-6
[22] PENG G X, ZHANG W, LUO H F, et al. Enterobacter oryzae sp. nov. , a nitrogen-fixing bacterium isolated from the wild rice species Oryza latifolia[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(Pt 7): 1650-1655.
[23] BOTHE H. Biology of the Nitrogen Cycle[M]. Amsterdam: Elsevier Science Ltd, 2007: 147-163.
[24] OROZCO-MOSQUEDA M D C, ROCHA-GRANADOS M D C, GLICK B R, et al. Microbiome engineering to improve biocontrol and plant growth-promoting mechanisms [J]. Microbiological Research, 2018, 208: 25−31. DOI: 10.1016/j.micres.2018.01.005
[25] STÉPHANE, COMPANT C, SESSITSCH A. Plant growth-promoting bacteria in the rhizo- and endosphere of plants: Their role, colonization, mechanisms involved and prospects for utilization [J]. Soil Biology and Biochemistry, 2010, 42(5): 669−678. DOI: 10.1016/j.soilbio.2009.11.024
[26] 张爱梅, 殷一然, 孙坤. 沙棘属植物弗兰克氏菌研究进展 [J]. 微生物学通报, 2020, 47(11):3933−3944. DOI: 10.13344/j.microbiol.china.200427 ZHANG A M, YIN Y R, SUN K. Research progress in Frankia spp. associated with Hippophae L [J]. Microbiology China, 2020, 47(11): 3933−3944.(in Chinese) DOI: 10.13344/j.microbiol.china.200427
[27] DIAGNE N, ARUMUGAM K, NGOM M, et al. Use of Frankia and actinorhizal plants for degraded lands reclamation [J]. BioMed Research International, 2013, 2013: 948258.
[28] 黄瑞林, 张娜, 孙波, 等. 典型农田根际土壤伯克霍尔德氏菌群落结构及其多样性 [J]. 土壤学报, 2020, 57(4):975−985. DOI: 10.11766/trxb201901040008 HUANG R L, ZHANG N, SUN B, et al. Community structure of burkholderiales and its diversity in typical maize rhizosphere soil [J]. Acta Pedologica Sinica, 2020, 57(4): 975−985.(in Chinese) DOI: 10.11766/trxb201901040008
[29] SIJAM K, DIKIN A. Biochemical and physiological characterization of Burkholderia cepacia as biological control agent [J]. International Journal of Agriculture & Biology, 2005, 7(3): 385−388.
[30] HARDOIM P R, VAN OVERBEEK L S, ELSAS J D. Properties of bacterial endophytes and their proposed role in plant growth [J]. Trends in Microbiology, 2008, 16(10): 463−471. DOI: 10.1016/j.tim.2008.07.008
[31] LEBEIS S L. The potential for give and take in plant-microbiome relationships [J]. Frontiers in Plant Science, 2014, 5: 287.
-
期刊类型引用(2)
1. 张清,项春铸,田佳怡,江明君,房翠莲,李全,曹婷婷,宋新章. 毛竹篼根和鞭根解磷细菌对磷添加的响应. 应用生态学报. 2025(01): 284-292 .  百度学术
百度学术
2. 刘志中. 促生菌作用下的毛竹根系分泌物对土壤微生物的影响研究. 佳木斯大学学报(自然科学版). 2024(10): 172-175 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: