Effect of Composting Chamaecrista rotundifolia on Microbial Community in Soil
-
摘要:目的 探明豆科绿肥圆叶决明翻压对果园红壤细菌群落的影响规律。方法 以空白对照(CK)和添加狼尾草(P处理)为对照,采用模拟培养试验,研究添加圆叶决明(J处理)后培养10~180 d果园红壤细菌群落数量、组成、多样性及结构的动态变化。结果 25 ℃恒温恒湿培养,门、纲、目、科和属水平细菌种群数量的变化主要发生在培养10~60 d,80~140 d处理间相对丰度具有显著差异的细菌数量减少,至培养180 d,3种处理所有细菌的相对丰度无显著差异。变形菌、酸杆菌和放线菌为3种处理相对丰度占比位于前3的优势细菌。与CK相比,P处理和J处理变形菌相对丰度随培养时间延长逐渐降低,而酸杆菌门相对丰度则先升后降,J处理放线菌门相对丰度随着培养时间延长而升高,P处理和J处理的变形菌、放线菌、绿弯菌、厚壁菌、拟杆菌和疣微菌随时间的变化均可用三次或二次函数拟合。P处理和J处理提高了红壤细菌ACE、Chao1和Shannon指数,降低了Simpson指数。结论 添加圆叶决明改变果园红壤细菌群落组成和结构,提高了果园红壤细菌群落的丰度和多样性,但添加圆叶决明和添加杂交狼尾草之间细菌群落结构差异不大。Abstract:Objective Effect of applying Chamaecrista rotundifolia plant materials to decompose as green manure on the microbial communities in red orchard soil was studied.Method In a simulated experiment, red soil collected from an orchard was used as blank control (CK) or as treatments with added P. americanum×P. purpureum (P) or C. rotundifolia (J). After 10-180d of incubation at 25 ℃ and constant humidity, the soils were sampled 9 times for Illumina high-throughput sequencing.Results Significant alterations were observed in the microbial populations at phylum, class, order, family, and genus levels from 10d to 60d. The relative abundance decreased in 80-140d and became similar for all samples by 180d with Proteobacteria, Acidobacteria, and Actinomycetes being the dominant microbes. Proteobacteria populations in P and J became lower than in CK, while Acidobacteria rose at first and then declined as the incubation prolonged. Actinobacteria in J increased during incubation, whereas Proteobacteria, Actinomyces, Chloroflexi, Firmicutes, Bacteroides, and Verrucobacterium in P and J followed a pattern of either 3 or 2 regression function. Both P and J raised the ACE, Chao1, and Shannon indices, but lowered the Simpson index.Conclusion Composting round-leaf, short-lived perennial cassia C. rotundifolia changed the composition and structure and increased the abundance and diversity of the bacterial community in the red orchard soil. However, no significantly different effects induced by the applications of C. rotundifolia and P. americanum×P. purpureum were found.
-
Keywords:
- Chamaecrista rotundifolia /
- soil microorganisms /
- bacterial diversity /
- bacterial community /
- orchard /
- red soil
-
0. 引言
【研究意义】细菌是土壤微生物的重要组成部分,占比70%~90%,参与了土壤氮、碳循环过程,维系着土壤生态系统物质转化和能量流动[1,2],土壤细菌群落组成、多样性、结构和功能等反映了土壤的质量和肥力[3,4]。豆科绿肥能通过根系共生的根瘤菌将空气中游离态氮转化为可被作物吸收利用的氮素形态,再通过植株翻压向土壤释放氮,提高土壤氮含量和供氮能力,同时增加土壤有机质含量[5,6]。豆科绿肥对土壤肥力的改变主要通过土壤微生物完成,因此研究绿肥作用下土壤细菌群落组成、结构和多样性等的变化对评价土壤健康状况和土壤功能发挥等具有重要的意义。【前人研究进展】翻压豆科绿肥是当前农业生产中常用的一种技术措施,绿肥作为传统农业的精髓,其还田腐解有利于改良土壤,提高土壤肥力[6-8]。绿肥还田对土壤肥力的提升作用主要通过微生物实现,当绿肥植株进入土壤,改变了土壤细菌的营养源,因而可能导致土壤细菌数量、组成和结构等发生改变[9-11],而细菌种群数的变化又可能影响土壤功能的发挥。刘国顺等[12]、张黎明等[13]、佀国涵等[14]、陈晓波等[15]、白小军等[16]和郑佳舜[17]研究表明,绿肥施用可增加植烟土、水稻土和设施土壤细菌、真菌和放线菌数量或微生物量碳氮等。蒋宇航等[18]研究表明豆科绿肥拉热多大豆翻压能显著增加茶园细菌含量。现有的相关研究主要集中于水稻土和植烟土壤,较少涉及绿肥翻压对山地果园土壤细菌群落的影响。豆科绿肥圆叶决明(Chamaecrista rotundifolia)原产于北美洲、中美洲和南美洲北部,二十世纪八十年代被引进中国后,在我国南方丘陵山地具有很强的适应性,并被广泛推广种植[19]。圆叶决明主要被用作果茶园的套种绿肥,其套种后能明显提高土壤肥力、改善土壤理化性状、防治水土流失[20,21],提高富营养细菌的含量,改变红壤丘陵区土壤细菌群落结构和组成[21]。圆叶决明降解过程还能提高了红壤供氮水平和红壤氮转化能力[22]。【本研究切入点】南方水热资源丰富,果茶园是南方重要的土地类型,由于不同绿肥养分含量及C/N存在较大差异,加上土壤类型的不同,绿肥施用后对土壤细菌群落的影响也不尽相同。【拟解决的关键问题】本研究拟开展豆科绿肥圆叶决明施用对土壤细菌的影响研究,评估添加圆叶决明对果园红壤细菌群落组成与结构特征的影响,旨在为圆叶决明在山地果园的推广提供科学依据。
1. 材料与方法
1.1 供试材料
2018年6月,从福建省尤溪县玉池村后山果园采集土壤作为供试土壤,土壤类型为红壤。采用多点采样法从供试果园采集5~20 cm土壤样品,风干后过 1 cm 筛备用。供试果园土壤质地为黏土,全氮(N)含量为0.50 g∙kg−1,全磷(P2O5)含量为0.48 g∙kg−1,全钾(K2O)含量为21.69 g∙kg−1,有机质(OM)含量为8.14 g∙kg−1,pH值为 5.59,C/N比为9.44。
供试绿肥为圆叶决明(Chamaecrista rotundifolia),以杂交狼尾草(P.americanum×P.purpureum)和空白为对照,这2种草均由福建省农业科学院农业生态研究所提供。取生长120 d的圆叶决明和杂交狼尾草植株(包括茎、叶),烘干后磨成长度<0.5 cm的粗草粉备用。圆叶决明的全氮、有机碳和粗纤维含量分别为23.49 、448.03 和306.25 g∙kg−1,C/N为19.07;杂交狼尾草的全氮、有机碳和粗纤维含量分别为15.20 、522.40 和318.50 g∙kg−1,C/N为34.37。
1.2 试验设计
采用室内好气恒温恒湿培养法进行模拟培养试验,设3个处理,即未添加草粉对照处理(CK)、添加狼尾草草粉处理(P处理)和添加圆叶决明草粉处理(J处理),每处理设3次重复。草粉的添加量根据生产实际中的圆叶决明常规施用量确定,即草土质量比为1∶100,培养温度为常温25 ℃。分别称取150 g过筛后的供试果园土壤装入81个200 mL的玻璃培养瓶中。向其中两组分别添加1.5 g·瓶-1的狼尾草和圆叶决明草粉并混合均匀,然后向所有培养瓶添加适量蒸馏水调节含水量至20%,称重,记下重量,放入25 ℃恒温恒湿培养箱中培养,每隔2 d取出培养瓶称重,损失的重量用充蒸馏水补充至与初始培养的重量一致。先培养2周以激活土壤中的微生物,然后开始计时,共培养180 d。本研究取样9次,取样时间分别为培养10、20、30、40、60、80、100、140、180 d时。每次取出的土样均放入−80 ℃冰箱备用,集齐所有样品后送至北京百迈客进行土壤细菌16S高通量测序。
1.3 测试和分析方法
1.3.1 土壤DNA的提取和高通量测序
土壤细菌测序步骤参照Caporaso等的方法[23]。称取0.25~0.50 g的混合土壤,使用mobio土壤微生物DNA强力提取试剂盒(PowerSoil® DNA Isolation Kit)提取土壤微生物总DNA,进行PCR扩增。PCR引物为细菌16S rRNA的V3和V4区域的保守序列引物[23],上下游引物分别为338F (5′- ACT CCT ACG GGA GGC AGC A-3′) 和 806R (5′-GGA CTA CHV GGG TWT CTAA T-3′)。PCR 反应体系为:10 µL buffer、10 μL high GC Enhancer、0.2 μL Q5 High-Fidelity DNA 聚合酶、1 μL dNTP、1.5 μL 10 μmol∙L−1的前引物、1.5 μL 10 μmol∙L−1后引物、40~60 ng DNA 模板,补ddH2O 于PCR 反应体系使其总体积为50 μL。PCR 反应程序为:95 ℃预变性5 min、95 ℃变性1 min、50 ℃退火1 min、72 ℃延伸1 min、72 ℃终延伸7 min、4 ℃保存和15个循环。
将PCR扩增产物与磁珠按照1∶1.5的比例混均匀后进行磁珠筛选片段。取35 μL洗脱液置于新的PCR管中进行Solexa PCR,反应体系为:10 μL目标区域PCR纯化产物、1 μL 10 μmol∙L−1的MPPI-a、1 μL 10 μmol∙L−1的MPPI-b、201 μL 的2×Phμsion HF MM、8 μL的ddH2O、反应总体积为40 μL。PCR反应程序为:98 ℃预变性30 s、98 ℃变性10 s、65 ℃退火30 s、72 ℃延伸30 s、72 ℃终延伸5 min、10 ℃保存、10个循环。将PCR产物进行电泳检测,纯化,切目的片段回收,用Hiseq 2500 PE250进行测序。土壤高通量测序在北京百迈客生物有限公司完成。
1.3.2 细菌多样性分析
将高通量测序得到的原始图像数据文件经碱基识别分析转化为原始测序序列,再经过一些列技术手段对原始序列进行拼接、质控过滤等,获得高质量序列,确保所得数据符合后续分析要求。利用QIIME软件[24]对高质量有效序列进行OTU划分,再与细菌的16S rRNA基因Silva数据库比对[25],确定细菌的分类、数量和组成。
本研究采用Mothur[26]version v.1.30软件分析Alpha 指数。Alpha 多样性指数包括Chao1指数(Chao1 richness estimator)、ACE指数(Ace richness estimator)、香农-威纳多样性指数(Shannon-wiener diversity index)和辛普森多样性指数(Simpson diversity index)。
1.4 数据处理
用Excel 2016软件进行数据整理,采用SPSS 19.0软件对门水平细菌的相对丰度(>1%)、Alpha 多样性指数等数据进行方差分析(Analysis of Variance,ANOVA)和回归分析(Regression Analysis),差异显著性水平P< 0.05。PCA(Principal component analysis)分析和绘图采用Canoco 5软件。
2. 结果与分析
2.1 不同处理果园红壤细菌种群数量
将3处理细菌的相对丰度进行对比,然后对相对丰度具有显著差异的细菌数量进行累计,其在不同分类水平上的结果如表1所示。3种处理不同分类水平相对丰度存在显著性差异的细菌种群数量主要集中在10~60 d,培养80 d,纲、目、科和属水平还存在一定数量相对丰度具有显著差异的细菌种群数量,100 d后相对丰度具有显著差异的细菌种群数量明显减少,至180 d,3种处理之间细菌相对丰度无显著差异。不同组之间,Ⅰ和Ⅱ组存在显著性差异的细菌种群数明显多于Ⅲ组,Ⅰ和Ⅱ组之间差别不大。
表 1 不同处理间相对丰度具有统计学差异的果园红壤细菌种群数量Table 1. Bacterial population with statistically different relative abundance in red orchard soil by treatments分类水平Classification level 编号No. 比对组Comparison group 不同处理时间细菌种群数Bacterial population at different treatment times/种 10 d 20 d 30 d 40 d 60 d 80 d 100 d 140 d 180 d 平均Average 门 Phylum Ⅰ CK VS J 11 13 12 5 14 0 1 0 0 6.22 Ⅱ CK VS P 14 11 8 7 14 0 0 1 0 6.11 Ⅲ P VS J 4 2 4 2 6 0 1 1 0 2.22 纲 Class Ⅰ CK VS J 39 32 26 20 42 7 1 3 0 18.89 Ⅱ CK VS P 37 33 27 22 48 9 0 5 0 20.11 Ⅲ P VS J 11 4 7 2 14 4 1 3 0 5.11 目 Order Ⅰ CK VS J 54 40 37 21 47 9 2 5 0 23.89 Ⅱ CK VS P 49 42 40 24 46 10 1 8 0 24.44 Ⅲ P VS J 19 9 10 2 14 6 1 5 0 7.33 科 Family Ⅰ CK VS J 94 74 68 48 72 23 2 6 0 43.00 Ⅱ CK VS P 81 69 66 54 74 27 1 7 0 42.11 Ⅲ P VS J 31 17 20 10 23 12 1 7 0 13.44 属 Genus Ⅰ CK VS J 92 67 63 35 72 12 2 6 0 38.78 Ⅱ CK VS P 79 59 64 38 72 13 2 7 0 37.11 Ⅲ P VS J 36 16 19 8 21 8 0 7 0 12.78 CK为对照;P为添加杂交狼尾草处理;J为添加圆叶决明处理。10、20、30、40、60、80 、100、140和180 d为土壤培养天数。CK: blank control; P: treatment with P. americanum×P. purpureum; J: treatment with C. rotundifolia. 10, 20, 30, 40, 60, 80, 100, 140, and 180d: number of incubation days. 2.2 果园红壤细菌组成及动态回归方程
3处理门水平上相对丰度前10的土壤细菌有:变形菌门、酸杆菌门、放线菌门、绿弯菌门、芽单胞菌门、厚壁菌门、拟杆菌、疣微菌门、浮霉菌门和硝化螺旋菌门(图1)。变形菌门为所有处理的第1优势种群,CK处理果园红壤变形菌门相对丰度为33.85%~38.61%,且随培养时间变化不大。P处理的相对丰度为34.38%~47.36%,J处理的相对丰度为32.98%~52.57%,二者均随着培养时间延长而降低。酸杆菌门为第2优势种群,其中CK处理果园红壤酸杆菌门相对丰度为10.11%~22.54%,且随着培养时间延长而降低。P处理相对丰度为11.20%~19.75%,J处理相对丰度为11.51%~18.57%,两者均随着培养时间延长先升后降。放线菌门为第3优势种群,CK处理果园红壤放线菌门相对丰度为8.45%~18.01%, P处理相对丰度为5.93%~19.76%,CK和P处理放线菌随时间变化变化无明显规律性;J处理的相对丰度为5.55%~19.84%,随着培养时间延长而升高,且在100~180 d的增加值最大。绿弯菌门为第4优势种群,CK处理果园红壤绿弯菌门相对丰度为6.13%~14.60%,P处理相对丰度为5.79%~12.14%,J处理相对丰度为4.09%~14.93%,3个处理均随着培养时间的延长相对丰度增加。厚壁菌、疣微菌、拟杆菌为果园红壤的第5、6、7优势菌群,且在不同处理、不同时间其分布有明显差异。
![]() 图 1 不同处理门水平细菌的相对丰度由于培养100 d具有显著性差异的细菌数量减少,到180 d不存在具有显著性差异的细菌,因此数据只取至培养140 d,即取8次取样的数据,下同。Figure 1. Bacterial relative abundance at phylum level by treatmentsSince bacteria count after 100 d of incubation showed significant decreases and not on 180 d, only data up to 140 d are presented,that is, data from eight samples are listed。 Same for below.
图 1 不同处理门水平细菌的相对丰度由于培养100 d具有显著性差异的细菌数量减少,到180 d不存在具有显著性差异的细菌,因此数据只取至培养140 d,即取8次取样的数据,下同。Figure 1. Bacterial relative abundance at phylum level by treatmentsSince bacteria count after 100 d of incubation showed significant decreases and not on 180 d, only data up to 140 d are presented,that is, data from eight samples are listed。 Same for below.门水平不同处理细菌相对丰度随时间变化的回归方程如表2所示。CK处理仅疣微菌和浮霉菌随时间的变化可用线性函数和三次函数拟合(P<0.05),表明这两种菌受培养时间的影响较大。而P和J处理的变形菌、放线菌、绿弯菌、厚壁菌、拟杆菌和疣微菌随时间的变化均可用三次或二次函数拟合(P<0.05),此外J处理的浮霉菌随时间的变化可用二次函数拟合(P<0.05),而P处理的芽单胞菌可用三次函数拟合(P<0.05)。表明红壤中加入圆叶决明和狼尾草草粉改变了土壤细菌群落随时间的变化规律。
表 2 门水平不同处理细菌相对丰度随时间变化的回归方程Table 2. Regression equations on bacterial relative abundance at phylum level by treatments处理Treatment 细菌门Bacterial phylum R2 F P 方程式Equation CK 疣微菌 Verrucomicrobia 0.702 11.98 0.013 y=−0.599x+6.678 浮霉菌 Planctomycetes 0.853 15.88 0.007 y=0.010x3−0.061x2−0.176x+2.125 J 变形菌 Proteobacteria 0.973 19.74 0.007 y=−0.327x3+3.954x2−14.467x+63.172 放线菌 Actinobacteria 0.857 14.31 0.009 y=0.474x2−2.669x+8.984 绿弯菌 Chloroflexi 0.908 11.75 0.013 y=0.104x3−1.196x2+4.331x+0.846 厚壁菌 Firmicutes 0.979 53.14 0.000 y=0.096x3−0.925x2+2.585x−1.025 拟杆菌 Bacteroidetes 0.849 14.96 0.008 y=−1.093x+9.938 疣微菌 Verrucomicrobia 0.914 56.66 0.000 y=−0.069x2+0.129x+4.559 浮霉菌 Planctomycetes 0.761 9.68 0.021 y=0.030x2−0.378x+ 2.758 P 变形菌 Proteobacteria 0.910 13.46 0.015 y=−3×10−5x3+0.0073x2−0.456x+53.82 放线菌 Actinobacteria 0.803 7.68 0.030 y=0.617x2−5.00x+15.64 绿弯菌 Chloroflexi 0.875 11.056 0.021 y=0.090x3−1.138x2+4.319x+2.161 芽单胞菌Gemmatimonadetes 0.835 6.77 0.048 y=0.059x3−0.695x2+2.116x+2.527 厚壁菌 Firmicutes 0.843 10.89 0.015 y=0.170x2−1.169x+2.832 拟杆菌 Bacteroidetes 0.884 16.53 0.006 y=−0.174x2+0.561x+6.842 疣微菌 Verrucomicrobia 0.856 11.25 0.020 y=0.035x3−0.571x2+2.365x+1.678 2.3 果园红壤细菌多样性
Chao1指数和ACE指数表示菌群丰度,其值越大表示群落丰度越高。香农-威纳多样性指数和辛普森多样性指数度量菌群多样性,Simpson 指数值越大,说明群落多样性越低;Shannon 指数越大,说明群落多样性越高。果园红壤细菌多样性指数如表3所示。培养10~80 d,P和J处理的ACE和Chao1指数均显著高于CK,而Simpson指数则显著低于CK,培养20、30 、60 d,P和J处理的Shannon指数显著高于CK。其他时间和处理之间差异不显著。不同处理细菌多样性随时间变化的回归方程如表4所示。CK处理Alpha多样性指数的回归方程P>0.05,没有统计学意义,因此未在表中列出。P和J处理的ACE和Chao1指数随时间的变化能用三次函数拟合(P<0.05),香农-威纳多样性指数和辛普森多样性指数随时间的变化可用二次函数拟合(P<0.05)。
表 3 不同处理土壤细菌多样性指数Table 3. Soil bacterial diversity index under treatments指标Index 处理Treatment 培养时间 Incubation time/d 10 20 30 40 60 80 100 140 ACE CK 1 689.00±13.50 b 1 480±3.61 b 1 629.00±16.50 b 1 615.33±45.83 b 1 266.33±40.99 b 1 870.33±270.09 b 1 762.00±308.58 a 1 728.33±48.42 a P 1 800.67±6.89 a 1 624.67±5.70 a 1 821.33±7.26 a 1 800.67±5.49 a 1 762.00±11.02 a 2 584.00±23.12 a 1 944.33±36.35 a 1 886.67±44.18 a J 1 776.33±11.92 a 1 626.67±6.12 a 1 818.00±3.06 a 1 785.33±5.84 a 1 748.33±11.62 a 2 504.33±57.17 a 1 865.67±86.34 a 1 854.67±69.53 a Chao1 CK 1 714.67±16.37 b 1 511.33±8.09 b 1 650.00±10.26 b 1 650.33±39.18 b 1 295.00±58.00 b 1 903.67±273.09 b 1 764.33±316.83 a 1 743.00±52.08 a P 1 806.00±7.00 a 1 638.67±6.84 a 1 833.67±10.40 a 1 824.33±1.86 a 1 787.67±16.02 a 2 579.00±33.23 a 1 944.33±48.21 a 1 929.33±66.20 a J 1 793.00±18.77 a 1 639.00±13.50 a 1 829.67±6.89 a 1 799.33±8.82 a 1 775.67±14.33 a 2 511.67±71.66 a 1 879.00±85.51 a 1 858.33±67.17 a Simpson CK 0.010±0.001 a 0.015±0.002 a 0.014±0.002 a 0.013±0.003 a 0.018±0.004 a 0.013±0.002 a 0.025±0.006 a 0.015±0.001 a P 0.006±0.000 b 0.007±0.001 b 0.006±0.000 b 0.005±0.000 b 0.005±0.000 b 0.007±0.000 b 0.020±0.003 a 0.014±0.001 a J 0.007±0.000 b 0.006±0.000 b 0.007±0.000 b 0.008±0.001 b 0.007±0.000 b 0.011±0.001 ab 0.016±0.001 a 0.015±0.003 a Shannon CK 6.14±0.03 a 5.90±0.07 b 5.92±0.10 b 5.82±0.19 a 5.19±0.17 b 5.69±0.30 a 5.25±0.39 a 5.30±0.06 a P 6.15±0.02 a 6.12±0.04 a 6.25±0.02 a 6.22±0.03 a 6.25±0.00 a 6.11±0.01 a 5.32±0.08 a 5.42±0.01 a J 6.04±0.05 a 6.14±0.03 a 6.16±0.03 a 6.10±0.10 a 6.18±0.02 a 5.98±0.03 a 5.35±0.04 a 5.33±0.014 a 表 4 不同处理细菌多样性随时间变化的回归方程Table 4. Regression equations on bacterial diversity of treatments处理Treatment 指标Index R2 F P 方程式Equation J ACE 0.399 4.420 0.015 y=2184.10−557.18x3+171.77x2−13.49x Chao1 0.409 4.610 0.013 y=2206.64−566.82x3+174.80x2−13.75x Simpson 0.679 22.200 0.00 y=0.007−0.001x2+0.0001x Shannon 0.819 47.540 0.00 y=5.81+0.249x2−0.04x P ACE 0.468 5.880 0.005 y=2294.81−667.47x3+202.20x2−15.71x Chao1 0.461 5.700 0.005 y=2253.50−612.06x3+187.45x2−14.58x Simpson 0.556 13.170 0.000 y=0.009−0.002x2+0.0001x Shannon 0.798 41.580 0.000 y=5.89+0.234x2−0.041x x为培养时间,y为细菌群落Alpha多样性指数。P为显著性,<0.05表示差异显著。x: incubation time; y: alpha diversity index of bacterial community. P: difference at 5% level. 2.4 果园红壤细菌群落结构主成分分析
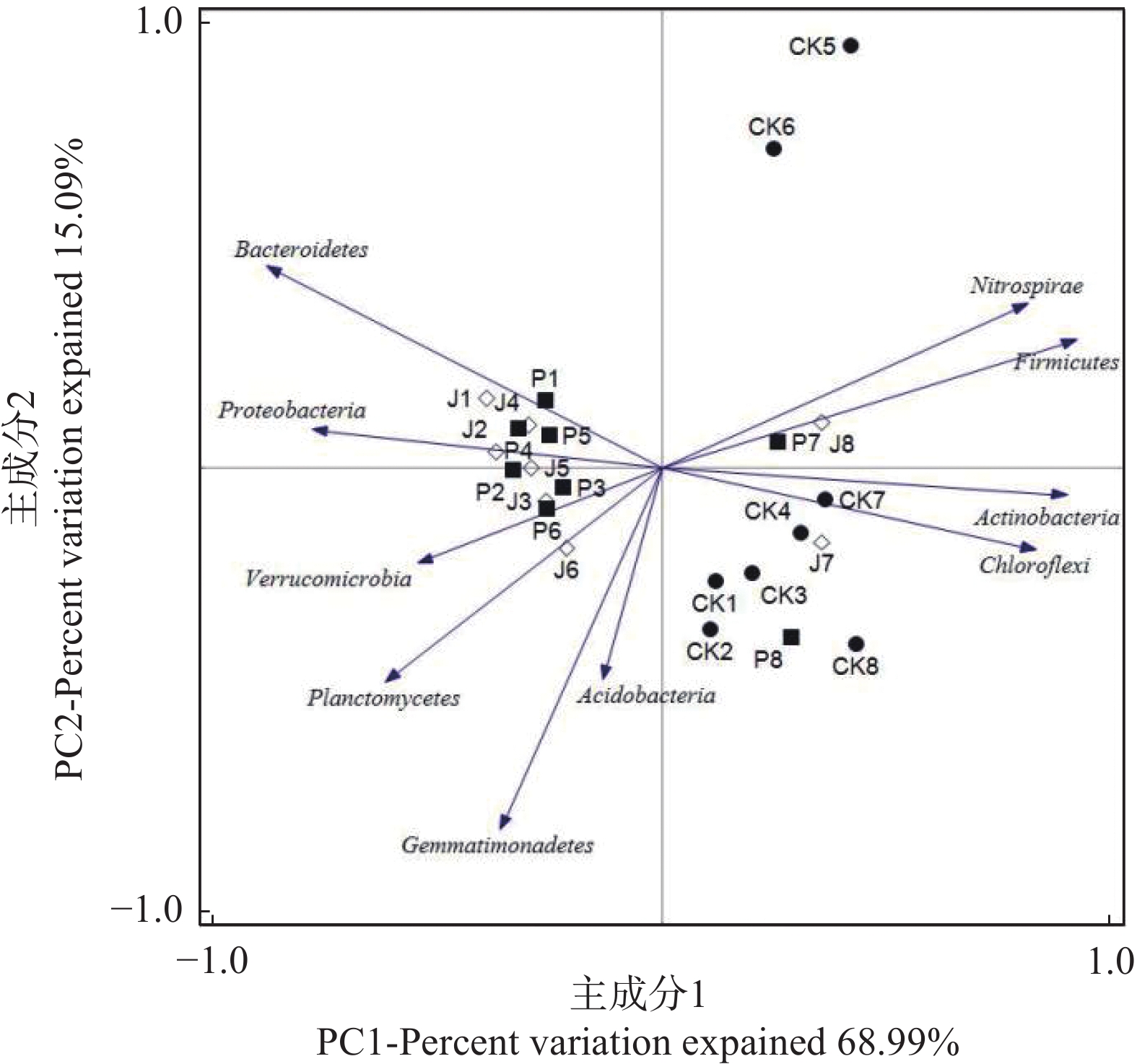
果园红壤细菌群落的PCA分析(图2)可知,不同处理之间第一主成分PC1贡献率为68.99%,第二主成分PC2的贡献率为15.09%,PC1和PC2对土壤细菌群落的总贡献率为84.08%,能反应基于土壤细菌群落差异的样本之间的主要差异。CK处理8次取样的样品位于PC1的正值区,而J和P处理除P7、P8、J7和J8外,P1~P6、J1~J6的样品均位于PC1的负值区,表明在第一主成分PC1已将CK与J、P处理的样品区分开。表明添加圆叶决明会改变土壤细菌结构,但添加圆叶决明和添加杂交狼尾草之间土壤细菌群落结构差异不大。
3. 讨论
土壤微生物对外界生物和非生物因素很敏感[27],当外源有机物加入土壤,改变了土壤微生物的营养源,因此会改变土壤细菌群落的繁殖和生长,导致细菌种群数发生改变[9,10]。万水霞等[28]研究表明,绿肥施用会增加土壤微生物数量。绿肥翻压提高茶园土壤、植烟土壤、设施土壤和水稻田土壤可培养细菌、真菌和放线菌数量[10,13,15,29,30]。本研究发现,添加圆叶决明至果园红壤,显著改变了细菌种群的数量,说明添加圆叶决明到果园红壤中,改变了土壤细菌营养源,改变细菌的生长和繁殖。由于绿肥C/N比不同,可能造成影响不尽相同[30]。本研究添加圆叶决明(C/N=19.07)红壤与添加杂交狼尾草(C/N=34.37)红壤相比,在门、纲、科、目、属水平上也存在一定数目相对丰度具有显著差异的细菌,但这种差异小于添加圆叶决明的红壤和空白对照。
Tao等[31]研究表明,绿肥对土壤细菌群落结构产生显著的影响,不加绿肥的土壤以变形菌相对丰度最高,而绿肥处理的土壤酸杆菌相对丰度最高。本研究发现,所有处理的土壤样品,位于前3的细菌优势种群均为变形菌门、酸杆菌门和放线菌门,但在不同时间段细菌的相对丰度及随时间的变化规律上均有明显差异,且添加圆叶决明处理果园红壤变形菌、放线菌、绿弯菌、厚壁菌、拟杆菌和疣微菌等细菌的相对丰度随时间发生了明显变化,这种变化规律可用二次或三次函数拟合,表明圆叶决明降解过程不同时间段土壤细菌群落组成发生了改变。
多样性是概括生态系统群落特征的指标之一,其中,Chao1指数表示菌群丰度,其值越大表示群落丰度越高,且对稀有物种的变化非常敏感[32],Chao1指数增加意味着非优势种群的数量增加[33]。本研究发现添加圆叶决明至果园红壤显著增加了Chao1指数,表明随着圆叶决明添加进土壤,降解有机质的细菌大量繁殖,可能提高了非优势种群的数量。本研究发现添加圆叶决明至果园红壤显著增加了Shannon指数,显著降低Simpson指数,表明圆叶决明降解过程增加了果园红壤的细菌多样性。Sul等[34]研究表明,添加绿肥和秸秆能增加土壤细菌群落的多样性,这与本研究的结果一致。Caban等[35]研究发现,绿肥毛叶苕子能增加被抗生素污染土壤的微生物活性、微生物多样性指数(ACE、Chao 1、Shannon和Np-Shannon)。造成这种现象的原因可能与绿肥翻压后通过植物残体给土壤补充有机质有关,绿肥为土壤微生物的生长提供了大量的营养元素,增加了部分微生物的活跃程度,从而增加了细菌多样性。林叶春等[36]研究发现,黑麦草、光叶紫花苕、燕麦和紫云英压青均显著降低了土壤细菌Shannon指数。研究结果的差异可能与取样时间、土壤性质等有关,本研究绿肥对红壤细菌多样性的影响也只存在于培养10~80 d,后期3处理之间无明显差异。与添加杂交狼尾草相比,添加圆叶决明对果园红壤的多样性产生一定的影响,但差异较空白对照小。说明有机质的C/N对细菌群落组成的改变有一定的影响,而发生改变的细菌可能是物料C/N变化的主导响应因子,因此应进一步深入研究因物料C/N不同而产生差异的土壤细菌种群类别。
4. 结论
经25 ℃恒温恒湿培养,门、纲、目、科和属5水平的细菌变化主要发生在10~60 d,培养180 d时3种处理细菌相对丰度无显著差异。J处理和CK、P处理和CK之间具有显著差异的细菌数量多,而J和P处理之间具有显著差异的细菌数量少。变形菌、酸杆菌和放线菌为3种处理相对丰度占比位于前3的优势细菌。与CK相比,添加圆叶决明改变了不同培养时间土壤细菌群落的组成。其中变形菌、放线菌、绿弯菌、厚壁菌、拟杆菌、疣微菌和浮霉菌随时间的变化均可用三次或二次函数拟合(P<0.05)。添加圆叶决明提高了果园红壤细菌群落的丰度和多样性,改变果园红壤细菌群落结构,但添加圆叶决明和添加杂交狼尾草之间细菌群落结构差异不大。
-
图 1 不同处理门水平细菌的相对丰度
由于培养100 d具有显著性差异的细菌数量减少,到180 d不存在具有显著性差异的细菌,因此数据只取至培养140 d,即取8次取样的数据,下同。
Figure 1. Bacterial relative abundance at phylum level by treatments
Since bacteria count after 100 d of incubation showed significant decreases and not on 180 d, only data up to 140 d are presented,that is, data from eight samples are listed。 Same for below.
表 1 不同处理间相对丰度具有统计学差异的果园红壤细菌种群数量
Table 1 Bacterial population with statistically different relative abundance in red orchard soil by treatments
分类水平Classification level 编号No. 比对组Comparison group 不同处理时间细菌种群数Bacterial population at different treatment times/种 10 d 20 d 30 d 40 d 60 d 80 d 100 d 140 d 180 d 平均Average 门 Phylum Ⅰ CK VS J 11 13 12 5 14 0 1 0 0 6.22 Ⅱ CK VS P 14 11 8 7 14 0 0 1 0 6.11 Ⅲ P VS J 4 2 4 2 6 0 1 1 0 2.22 纲 Class Ⅰ CK VS J 39 32 26 20 42 7 1 3 0 18.89 Ⅱ CK VS P 37 33 27 22 48 9 0 5 0 20.11 Ⅲ P VS J 11 4 7 2 14 4 1 3 0 5.11 目 Order Ⅰ CK VS J 54 40 37 21 47 9 2 5 0 23.89 Ⅱ CK VS P 49 42 40 24 46 10 1 8 0 24.44 Ⅲ P VS J 19 9 10 2 14 6 1 5 0 7.33 科 Family Ⅰ CK VS J 94 74 68 48 72 23 2 6 0 43.00 Ⅱ CK VS P 81 69 66 54 74 27 1 7 0 42.11 Ⅲ P VS J 31 17 20 10 23 12 1 7 0 13.44 属 Genus Ⅰ CK VS J 92 67 63 35 72 12 2 6 0 38.78 Ⅱ CK VS P 79 59 64 38 72 13 2 7 0 37.11 Ⅲ P VS J 36 16 19 8 21 8 0 7 0 12.78 CK为对照;P为添加杂交狼尾草处理;J为添加圆叶决明处理。10、20、30、40、60、80 、100、140和180 d为土壤培养天数。CK: blank control; P: treatment with P. americanum×P. purpureum; J: treatment with C. rotundifolia. 10, 20, 30, 40, 60, 80, 100, 140, and 180d: number of incubation days. 表 2 门水平不同处理细菌相对丰度随时间变化的回归方程
Table 2 Regression equations on bacterial relative abundance at phylum level by treatments
处理Treatment 细菌门Bacterial phylum R2 F P 方程式Equation CK 疣微菌 Verrucomicrobia 0.702 11.98 0.013 y=−0.599x+6.678 浮霉菌 Planctomycetes 0.853 15.88 0.007 y=0.010x3−0.061x2−0.176x+2.125 J 变形菌 Proteobacteria 0.973 19.74 0.007 y=−0.327x3+3.954x2−14.467x+63.172 放线菌 Actinobacteria 0.857 14.31 0.009 y=0.474x2−2.669x+8.984 绿弯菌 Chloroflexi 0.908 11.75 0.013 y=0.104x3−1.196x2+4.331x+0.846 厚壁菌 Firmicutes 0.979 53.14 0.000 y=0.096x3−0.925x2+2.585x−1.025 拟杆菌 Bacteroidetes 0.849 14.96 0.008 y=−1.093x+9.938 疣微菌 Verrucomicrobia 0.914 56.66 0.000 y=−0.069x2+0.129x+4.559 浮霉菌 Planctomycetes 0.761 9.68 0.021 y=0.030x2−0.378x+ 2.758 P 变形菌 Proteobacteria 0.910 13.46 0.015 y=−3×10−5x3+0.0073x2−0.456x+53.82 放线菌 Actinobacteria 0.803 7.68 0.030 y=0.617x2−5.00x+15.64 绿弯菌 Chloroflexi 0.875 11.056 0.021 y=0.090x3−1.138x2+4.319x+2.161 芽单胞菌Gemmatimonadetes 0.835 6.77 0.048 y=0.059x3−0.695x2+2.116x+2.527 厚壁菌 Firmicutes 0.843 10.89 0.015 y=0.170x2−1.169x+2.832 拟杆菌 Bacteroidetes 0.884 16.53 0.006 y=−0.174x2+0.561x+6.842 疣微菌 Verrucomicrobia 0.856 11.25 0.020 y=0.035x3−0.571x2+2.365x+1.678 表 3 不同处理土壤细菌多样性指数
Table 3 Soil bacterial diversity index under treatments
指标Index 处理Treatment 培养时间 Incubation time/d 10 20 30 40 60 80 100 140 ACE CK 1 689.00±13.50 b 1 480±3.61 b 1 629.00±16.50 b 1 615.33±45.83 b 1 266.33±40.99 b 1 870.33±270.09 b 1 762.00±308.58 a 1 728.33±48.42 a P 1 800.67±6.89 a 1 624.67±5.70 a 1 821.33±7.26 a 1 800.67±5.49 a 1 762.00±11.02 a 2 584.00±23.12 a 1 944.33±36.35 a 1 886.67±44.18 a J 1 776.33±11.92 a 1 626.67±6.12 a 1 818.00±3.06 a 1 785.33±5.84 a 1 748.33±11.62 a 2 504.33±57.17 a 1 865.67±86.34 a 1 854.67±69.53 a Chao1 CK 1 714.67±16.37 b 1 511.33±8.09 b 1 650.00±10.26 b 1 650.33±39.18 b 1 295.00±58.00 b 1 903.67±273.09 b 1 764.33±316.83 a 1 743.00±52.08 a P 1 806.00±7.00 a 1 638.67±6.84 a 1 833.67±10.40 a 1 824.33±1.86 a 1 787.67±16.02 a 2 579.00±33.23 a 1 944.33±48.21 a 1 929.33±66.20 a J 1 793.00±18.77 a 1 639.00±13.50 a 1 829.67±6.89 a 1 799.33±8.82 a 1 775.67±14.33 a 2 511.67±71.66 a 1 879.00±85.51 a 1 858.33±67.17 a Simpson CK 0.010±0.001 a 0.015±0.002 a 0.014±0.002 a 0.013±0.003 a 0.018±0.004 a 0.013±0.002 a 0.025±0.006 a 0.015±0.001 a P 0.006±0.000 b 0.007±0.001 b 0.006±0.000 b 0.005±0.000 b 0.005±0.000 b 0.007±0.000 b 0.020±0.003 a 0.014±0.001 a J 0.007±0.000 b 0.006±0.000 b 0.007±0.000 b 0.008±0.001 b 0.007±0.000 b 0.011±0.001 ab 0.016±0.001 a 0.015±0.003 a Shannon CK 6.14±0.03 a 5.90±0.07 b 5.92±0.10 b 5.82±0.19 a 5.19±0.17 b 5.69±0.30 a 5.25±0.39 a 5.30±0.06 a P 6.15±0.02 a 6.12±0.04 a 6.25±0.02 a 6.22±0.03 a 6.25±0.00 a 6.11±0.01 a 5.32±0.08 a 5.42±0.01 a J 6.04±0.05 a 6.14±0.03 a 6.16±0.03 a 6.10±0.10 a 6.18±0.02 a 5.98±0.03 a 5.35±0.04 a 5.33±0.014 a 表 4 不同处理细菌多样性随时间变化的回归方程
Table 4 Regression equations on bacterial diversity of treatments
处理Treatment 指标Index R2 F P 方程式Equation J ACE 0.399 4.420 0.015 y=2184.10−557.18x3+171.77x2−13.49x Chao1 0.409 4.610 0.013 y=2206.64−566.82x3+174.80x2−13.75x Simpson 0.679 22.200 0.00 y=0.007−0.001x2+0.0001x Shannon 0.819 47.540 0.00 y=5.81+0.249x2−0.04x P ACE 0.468 5.880 0.005 y=2294.81−667.47x3+202.20x2−15.71x Chao1 0.461 5.700 0.005 y=2253.50−612.06x3+187.45x2−14.58x Simpson 0.556 13.170 0.000 y=0.009−0.002x2+0.0001x Shannon 0.798 41.580 0.000 y=5.89+0.234x2−0.041x x为培养时间,y为细菌群落Alpha多样性指数。P为显著性,<0.05表示差异显著。x: incubation time; y: alpha diversity index of bacterial community. P: difference at 5% level. -
[1] 林先贵, 陈瑞蕊, 胡君利. 土壤微生物资源管理、应用技术与学科展望 [J]. 生态学报, 2010, 30(24):7029−7037. LIN X G, CHEN R R, HU J L. The management and application of soil microbial resources and the perspectives of soil microbiology [J]. Acta Ecologica Sinica, 2010, 30(24): 7029−7037.(in Chinese)
[2] 唐婧, 徐小蓉, 商传禹, 等. 南明河城区河段细菌多样性与环境因子的关系 [J]. 微生物学报, 2015, 55(8):1050−1059. DOI: 10.13343/j.cnki.wsxb.20140568 TANG J, XU X R, SHANG C Y, et al. Association of bacterial diversity in city area of Nanming River with environmental factors [J]. Acta Microbiologica Sinica, 2015, 55(8): 1050−1059.(in Chinese) DOI: 10.13343/j.cnki.wsxb.20140568
[3] FINN D, KOPITTKE P M, DENNIS P G, et al. Microbial energy and matter transformation in agricultural soils [J]. Soil Biology and Biochemistry, 2017, 111: 176−192. DOI: 10.1016/j.soilbio.2017.04.010
[4] LUXHØI J, BRUUN S, STENBERG B, et al. Prediction of gross and net nitrogen mineralization-immobilization-turnover from respiration [J]. Soil Science Society of America Journal, 2006, 70(4): 1121−1128. DOI: 10.2136/sssaj2005.0133
[5] TORABIAN S, FARHANGI-ABRIZ S, DENTON M D. Do tillage systems influence nitrogen fixation in legumes? A review [J]. Soil and Tillage Research, 2019, 185: 113−121. DOI: 10.1016/j.still.2018.09.006
[6] 曹卫东, 包兴国, 徐昌旭, 等. 中国绿肥科研60年回顾与未来展望 [J]. 植物营养与肥料学报, 2017, 23(6):1450−1461. DOI: 10.11674/zwyf.17291 CAO W D, BAO X G, XU C X, et al. Reviews and prospects on science and technology of green manure in China [J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(6): 1450−1461.(in Chinese) DOI: 10.11674/zwyf.17291
[7] GEISSELER D, HORWATH W R, DOANE T A. DANIEL G, WILLIAM R H, TIMOTHY A D. Significance of organic nitrogen uptake from plant residues by soil microorganisms as affected by carbon and nitrogen availability [J]. Soil Biology and Biochemistry, 2009, 41(6): 1281−1288. DOI: 10.1016/j.soilbio.2009.03.014
[8] DUCHENE O, VIAN J F, CELETTE F. Intercropping with legume for agroecological cropping systems: Complementarity and facilitation processes and the importance of soil microorganisms. A review [J]. Agriculture, Ecosystems & Environment, 2017, 240: 148−161.
[9] DIACONOM, PERSIANI AL, CANALI S, et al. Agronomic performance and sustainability indicators in organic tomato combining different agro-ecological practices [J]. Nutrient Cycling in Agroecosystems, 2018, 112(1): 101−117. DOI: 10.1007/s10705-018-9933-7
[10] ELFSTRAND S, HEDLUND K, MåRTENSSON A. Soil enzyme activities, microbial community composition and function after 47 years of continuous green manuring [J]. Applied Soil Ecology, 2007, 35(3): 610−621. DOI: 10.1016/j.apsoil.2006.09.011
[11] PAUL E A. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization [J]. Soil Biology and Biochemistry, 2016, 98: 109−126. DOI: 10.1016/j.soilbio.2016.04.001
[12] 刘国顺, 李正, 敬海霞, 等. 连年翻压绿肥对植烟土壤微生物量及酶活性的影响 [J]. 植物营养与肥料学报, 2010, 16(6):1472−1478. DOI: 10.11674/zwyf.2010.0624 LIU G S, LI Z, JING H X, et al. Effects of consecutive turnover of green manures on soil microbial biomass and enzyme activity [J]. Plant Nutrition and Fertilizer Science, 2010, 16(6): 1472−1478.(in Chinese) DOI: 10.11674/zwyf.2010.0624
[13] 张黎明, 邓小华, 周米良, 等. 不同种类绿肥翻压还田对植烟土壤微生物量及酶活性的影响 [J]. 中国烟草科学, 2016, 37(4):13−18. ZHANG L M, DENG X H, ZHOU M L, et al. Effects of different green manures on microbial biomass and enzyme activities of tobacco-planting soil [J]. Chinese Tobacco Science, 2016, 37(4): 13−18.(in Chinese)
[14] 佀国涵, 赵书军, 王瑞, 等. 连年翻压绿肥对植烟土壤物理及生物性状的影响 [J]. 植物营养与肥料学报, 2014, 20(4):905−912. SI G H, ZHAO S J, WANG R, et al. Effects of consecutive overturning of green manure on soil physical and biological characteristics in tobacco-planting fields [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 905−912.(in Chinese)
[15] 陈晓波, 官会林, 郭云周, 等. 绿肥翻压对烟地红壤微生物及土壤养分的影响 [J]. 中国土壤与肥料, 2011(4):74−78. DOI: 10.3969/j.issn.1673-6257.2011.04.017 CHEN X B, GUAN H L, GUO Y Z, et al. The effect of plowing under green manure on the soil microorganism and fertility in tobacco cultivation red soil [J]. Soil and Fertilizer Sciences in China, 2011(4): 74−78.(in Chinese) DOI: 10.3969/j.issn.1673-6257.2011.04.017
[16] 白小军, 冯海萍, 张丽娟, 等. 种植及翻压绿肥对设施土壤养分及微生物区系的影响 [J]. 北方园艺, 2014(23):144−147. BAI X J, FENG H P, ZHANG L J, et al. Effect of the planting and green manure application on soil nutrients and microbial flora in greenhouse [J]. Northern Horticulture, 2014(23): 144−147.(in Chinese)
[17] ZHENG J S, HU J M, WEI X H, et al. Effects of green manure returning on soil microbial biomass carbon and mineralization of organic carbon in smash ridging paddy field [J]. Chinese Journal of Eco-Agriculture, 2021, 29(4): 691−703.
[18] 蒋宇航, 林生, 林伟伟, 等. 不同肥料对退化茶园根际土壤微生物代谢活性和群落结构的影响 [J]. 生态学杂志, 2017, 36(10):2894−2902. DOI: 10.13292/j.1000-4890.201710.034 JIANG Y H, LIN S, LIN W W, et al. Effects of different fertilizer applications on microbial metabolic activity and community structure in tea rhizosphere soil [J]. Chinese Journal of Ecology, 2017, 36(10): 2894−2902.(in Chinese) DOI: 10.13292/j.1000-4890.201710.034
[19] 应朝阳, 罗旭辉, 黄毅斌, 等. 闽引圆叶决明适应性研究 [J]. 草地学报, 2010, 18(1):137−140. YING Z Y, LUO X H, HUANG Y B, et al. Study on adaptability of Chamaecrista rotundifolia Greene. cv. Minyin [J]. Acta Agrestia Sinica, 2010, 18(1): 137−140.(in Chinese)
[20] 罗旭辉, 詹杰, 王义祥, 等. 侵蚀果园长期植草的生态效益分析 [J]. 草地学报, 2011, 19(5):729−734. LUO X H, ZHAN J, WANG Y X, et al. Soil & water conservation function and comprehensive benefits of intercropping forage in eroded fruit garden [J]. Acta Agrestia Sinica, 2011, 19(5): 729−734.(in Chinese)
[21] ZHONG Z M, HUANG X S, FENG D Q, et al. Long-term effects of legume mulching on soil chemical properties and bacterial community composition and structure [J]. Agriculture, Ecosystems & Environment, 2018, 268: 24−33.
[22] 钟珍梅, 杨庆, 游小凤, 等. 圆叶决明添加量对红壤可溶性氮及酶活性的影响 [J]. 草地学报, 2022, 30(3):622−630. ZHONG Z M, YANG Q, YOU X F, et al. Effects of Additions of Chamaecrista rotundifolia on the Soluble Nitrogen and Enzyme Activity of red soil [J]. Acta Agrestia Sinica, 2022, 30(3): 622−630.(in Chinese)
[23] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010, 7(5): 335−336. DOI: 10.1038/nmeth.f.303
[24] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection [J]. Bioinformatics, 2011, 27(16): 2194−2200. DOI: 10.1093/bioinformatics/btr381
[25] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools [J]. Nucleic Acids Research, 2013, 41(D1): D590−D596.
[26] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009, 75(23): 7537−7541. DOI: 10.1128/AEM.01541-09
[27] FIERER N. Embracing the unknown: Disentangling the complexities of the soil microbiome [J]. Nature Reviews Microbiology, 2017, 15(10): 579−590. DOI: 10.1038/nrmicro.2017.87
[28] 万水霞, 唐杉, 蒋光月, 等. 紫云英与化肥配施对土壤微生物特征和作物产量的影响 [J]. 草业学报, 2016, 25(6):109−117. DOI: 10.11686/cyxb2016030 WAN S X, TANG S, JIANG G Y, et al. Effects of Chinese milk vetch manure and fertilizer on soil microbial characteristics and yield of rice [J]. Acta Prataculturae Sinica, 2016, 25(6): 109−117.(in Chinese) DOI: 10.11686/cyxb2016030
[29] 林新坚, 林斯, 邱珊莲, 等. 不同培肥模式对茶园土壤微生物活性和群落结构的影响 [J]. 植物营养与肥料学报, 2013, 19(1):93−101. LIN X J, LIN S, QIU S L, et al. Effect of different fertilization strategies on structure and activity of microbial community in tea orchard soils [J]. Plant Nutrition and Fertilizer Science, 2013, 19(1): 93−101.(in Chinese)
[30] SIX J, CARPENTIER A, VAN KESSEL C, et al. Impact of elevated CO2 on soil organic matter dynamics as related to changes in aggregate turnover and residue quality [J]. Plant and Soil, 2001, 234(1): 27−36. DOI: 10.1023/A:1010504611456
[31] TAO J M, LIU X D, LIANG Y L, et al. Maize growth responses to soil microbes and soil properties after fertilization with different green manures [J]. Applied Microbiology and Biotechnology, 2017, 101(3): 1289−1299. DOI: 10.1007/s00253-016-7938-1
[32] NANNIPIERI P, ASCHER J, CECCHERINI M T, et al. Microbial diversity and soil functions [J]. European Journal of Soil Science, 2003, 54(4): 655−670. DOI: 10.1046/j.1351-0754.2003.0556.x
[33] CUI H, ZHOU Y, GU Z, et al. The combined effects of cover crops and symbiotic microbes on phosphatase gene and organic phosphorus hydrolysis in subtropical orchard soils [J]. Soil Biology and Biochemistry, 2015, 82: 119−126. DOI: 10.1016/j.soilbio.2015.01.003
[34] SUL W, ASUMING-BREMPONG S, WANG Q, et al. Tropical agricultural land management influences on soil microbial communities through its effect on soil organic carbon [J]. Soil Biology and Biochemistry, 2013, 65: 33−38. DOI: 10.1016/j.soilbio.2013.05.007
[35] CABAN J R, KUPPUSAMY S, KIM J H, et al. Green manure amendment enhances microbial activity and diversity in antibiotic-contaminated soil [J]. Applied Soil Ecology, 2018, 129: 72−76. DOI: 10.1016/j.apsoil.2018.04.013
[36] 林叶春, 李雨, 陈伟, 等. 绿肥压青对喀斯特地区植烟土壤细菌群落特征的影响 [J]. 中国土壤与肥料, 2018(3):161−167. DOI: 10.11838/sfsc.20180325 LIN Y C, LI Y, CHEN W, et al. Effects of green manures on the bacterial community characteristics of the rhizosphere soil in flue-cured tobacco [J]. Soil and Fertilizer Sciences in China, 2018(3): 161−167.(in Chinese) DOI: 10.11838/sfsc.20180325




 下载:
下载: