Response Surface Optimization of Medium Formulation for Culture of Lyophyllum decastes
-
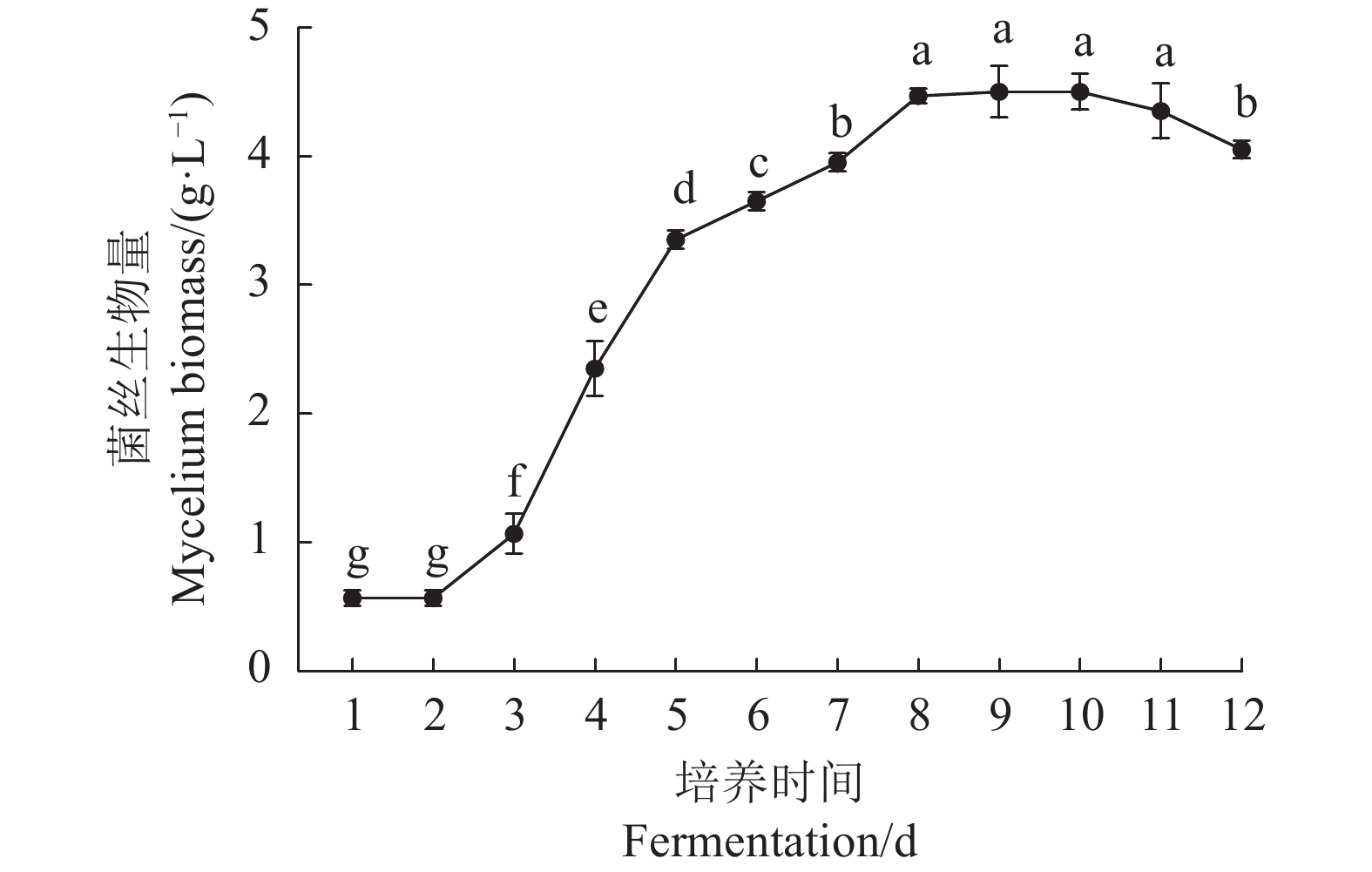
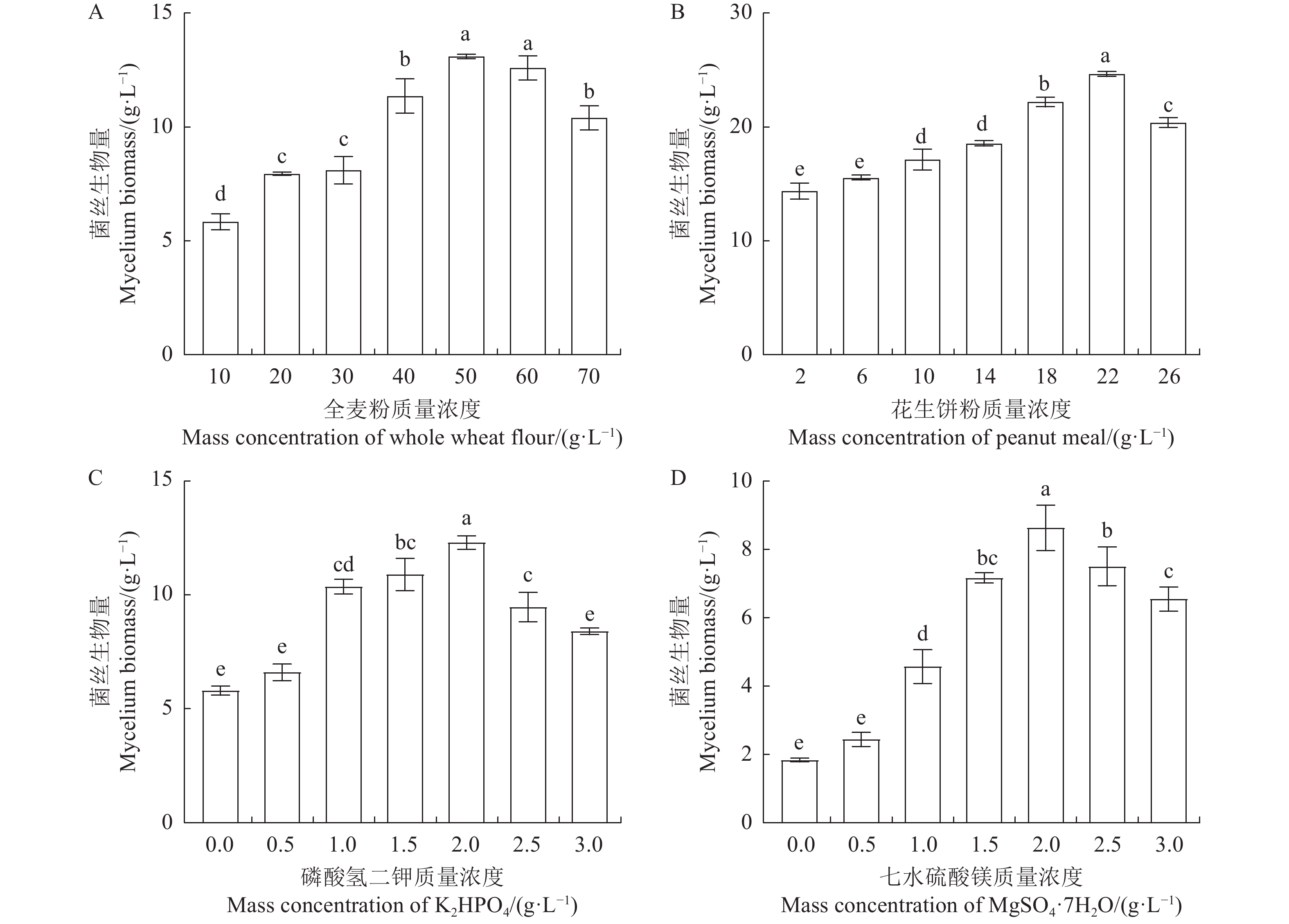
摘要:目的 以提高鹿茸菇液体菌种菌丝生物量为目的,通过优化液体菌种发酵配方,制备优良液体菌种,推动鹿茸菇工厂化生产快速发展。方法 以鹿茸菇为研究材料,采用摇瓶培养方式,通过单因素设计分析6种碳源、8种氮源、10种金属离子对鹿茸菇菌丝生长的影响。采用Box-Behnken响应面法进一步优化单因素筛选出的碳源、氮源与金属离子,比较分析液体菌种与固体菌种应用于鹿茸菇生产的优劣性。结果 适合鹿茸菇生长的营养要素分别为全麦粉、花生饼粉、KH2PO4与MgSO4·7H2O,营养要素间的最优配方为全麦粉47 g·L−1、花生饼粉22 g·L−1、KH2PO4 2.00 g·L−1、MgSO4·7H2O 2.00 g·L−1,当发酵培养至第8 d时,菌丝生物量达到最大值(32.81±1.10 g·L−1),以优化配方制备的鹿茸菇液体菌种菌丝生物量较初始配方提高了7.34倍。在生产试验中液体菌种较固体菌种,制种时间缩短48 d,菌丝萌发时间缩短2 d,单袋产量提高15.47%。结论 本研究研发的液体菌种发酵配方可获得高质量的生产用种,以液体发酵方式制备鹿茸菇生产用种适合鹿茸菇工厂化生产。Abstract:Objective To improve the mycelium biomass of Lyophyllum decast liquid seeds, high-quality liquid seeds are prepared by optimizing the liquid fermentation formula, to promote the rapid development of industrial production of L. decastes mushrooms.Methods Taking L. decastes as the research material, the effects of 6 kinds of carbon sources, 8 kinds of nitrogen sources, and 10 kinds of metal ions on the mycelium growth were analyzed by single-factor design. The carbon source, nitrogen source, and metal ions screened out by single-factor design were further optimized by the Box-Behnken response surface method, and the advantages and disadvantages of liquid seeds and solid seeds in the production of L. decastes mushrooms were compared.Results The nutritional elements suitable for the growth of L. decastes were whole wheat flour, peanut meal, K2HPO4, and MgSO4·7H2O, and the optimal formula was whole wheat flour 47 g·L−1, peanut meal 22 g·L−1, K2HPO4 2.00 g·L−1, MgSO4·7H2O 2.00 g·L−1. When the fermentation culture reached the 8th day, the dry cell mass (DCM) was 32.81±1.10 g·L−1. Compared with the DCM by the initial formula, the DCM prepared with the optimized formula was increased by 7.34 times. Compared with solid seeds, the production time of liquid seeds was shortened by 48 days, the time of mycelium germination was shortened by 2 days, and the yield per bag increased by 15.47%, in industrial production.Conclusion The liquid fermentation formula developed in this study can obtain high-quality production seeds, and the liquid fermentation strategy for the preparation of seeds is suitable for the industrial production of L. decastes mushrooms.
-
Keywords:
- Lyophyllum decastes /
- Liquid seeds /
- Liquid fermentation formula /
- Mycelium biomass
-
0. 引言
【研究意义】植物土传病害由生活在土壤中或随植物病株残体残留在土壤中的病原物侵染植物根部或茎部引起,具有危害面积大、病原种类多和病害治理困难的特点[1-3]。随着集约化农业的发展和高附加值作物的连年栽培,土传病害逐年加重,连年栽种3~5年后可造成减产20%~40%,严重的减产60%以上,作物品质也受到严重影响,土传病害已成为我国农业生产可持续发展的主要制约因素[4-5]。化学药剂防治具有成本低、见效快等优点,在植物土传病害防控中发挥着重要作用[3]。但是,化学药剂的长期大量使用容易引起药物残留、环境污染和抗药性增强等问题。生物防治以利用拮抗微生物防治为主要手段,通常具有抗病和促生的双重效果,对人体无毒无害、不污染环境及不容易使病原菌产生抗性,符合我国当前农业生物药物与生态农业作为优先发展的主题,是实现植物土传病害绿色防控的有效技术手段[1, 5-7]。目前应用于植物土传病害生物防治的微生物菌剂中,除了木霉(Trichoderma sp.)和假单胞杆菌(Pseudomonas sp.),其余的多为芽胞杆菌属(Bacillus spp.),如枯草芽胞杆菌(B. subtilis)、解淀粉芽胞杆菌(B. amyloliquefacien)和贝莱斯芽胞杆菌(B. velezensis)等[1, 8-10]。当前可供选择的拮抗菌株资源仍然很少,可用于作物生产的制剂或产品的种类和数量均有限,现有的菌株难以同时防治种类繁多的病原物引致的病害[5-6],因此,筛选获得对多种植物土传病害病原菌具有拮抗作用的生防菌株并研究其拮抗机制具有重要意义。【前人研究进展】贝莱斯芽胞杆菌可以产生抗生素、酶、植物激素和抗肿瘤剂,在农业、工业和医学上均有广泛用途[11-14]。大量的研究表明,贝莱斯芽胞杆菌抑菌谱广,对多种植物病原真菌和细菌均具有良好和抑制效果和防治潜力[11, 15]。贝莱斯芽胞杆菌 E69菌株和E33菌株是来自水稻叶片的内生菌,对立枯丝核菌(Rhizoctonia solani)、灰葡萄孢菌(Botrytis cinerea)、尖孢镰刀菌(Fusarium oxysporum)、烟草疫霉(Phytophthora nicotianae)和链格孢菌(Alternaria alternate)等病原菌均具有显著的拮抗作用[16];赵昱榕等[17]从黄瓜植株体内分离筛选获得的贝莱斯芽胞杆菌ZF2,对多主棒孢病菌(Corynespora cassiicola)在内的6 种病原真菌和 7 种病原细菌具有显著拮抗效果。以土传病原菌为目标的拮抗贝莱斯芽胞杆菌筛选已有一些报道。崔文会等[18]土壤中分离筛选获得贝莱斯芽胞杆菌CX-2菌株,该菌株对水稻、小麦和大豆等作物的6种土传病原真菌均有明显的抑菌活性。罗汉果白绢病与根腐病的病原菌分别为腐皮镰孢菌(F. solani)和齐整小核菌,王瑞昊等[19]从罗汉果根际土壤中筛选分离对这2种病原菌有拮抗作用的贝莱斯芽胞杆菌TYX-2菌株。许帅等[20]从马铃薯根际土壤分离筛选获得对马铃薯枯萎病菌(F. oxysporum)有拮抗作用的贝莱斯芽胞杆菌菌株ZF128,盆栽试验防效为 82.46%。贝莱斯芽胞杆菌2A-2B菌株是从杂草Sporobolus airoides 根围土壤分离获得,可显著抑制尖孢镰刀菌、立枯丝核菌、辣椒疫霉(Phytophtora capsici)和腐皮镰刀菌等土传病原菌菌丝的生长[13, 21]。【本研究切入点】本课题组在前期研究中以桑树细菌性枯萎病菌(Enterobacter spp.)和桑枝菌核病菌(Sclerotinia sclerotiorum)作为目标测试菌,获得一批具有明显拮抗活性的芽胞杆菌菌株,其中NN01、NN02、NN04、NN05、NN88和NN95等6个拮抗菌株被鉴定为贝莱斯芽胞杆菌[22-23],这些拮抗菌株对尖孢镰刀菌等主要土传病害病原菌是否具有拮抗活性及其抑菌机理均有待明确。【拟解决的关键问题】测定NN01、NN02、NN04、NN05、NN88和NN95等6株贝莱斯芽胞杆菌对核盘菌、灰葡萄孢、立枯丝核菌、尖孢镰刀菌、齐整小核菌、烟草疫霉和终极腐霉(Pythium ultimum)的抑菌活性,以期明确其产生的胞外酶及携带的抗生素相关基因种类,为植物常见土传病害的生物防治提供菌种资源,为进一步开发利用这些拮抗菌株提供理论依据。
1. 材料与方法
1.1 供试材料
1.1.1 菌株及植物材料
6株贝莱斯芽胞杆菌菌株由本实验室前期研究获得,其中NN01、NN02、NN04分离自桑树品种桂优12的枝条,NN05、NN88、NN95分离自桑树品种桂优62的根部[22-23]。植物土传病原菌为核盘菌、灰葡萄孢菌、立枯丝核菌、尖孢镰刀菌古巴专化型(F. oxysporum f. sp. cubense)、齐整小核菌、烟草疫霉和终极腐霉,其中齐整小核菌从桑白绢病病桑树上分离获得并保存,其他供试病原菌由广西大学农学院植物病理学研究室提供。用于离体接种的桑树品种为桂桑优62,由广西蚕业站惠赠;生菜叶片购于广西大学菜市场,品种未知。对照枯草芽胞杆菌可湿性粉剂为河北中保绿农作物科技有限公司产品(有效成分含量:1×1011 CFU·g−1)。
1.1.2 培养基
LB培养基 (luria-bertani, LB):酵母提取物5.0 g,胰蛋白胨10.0 g,NaCl 10.0 g,去离子水定容到1 000 mL,pH7.0~7.2。枯草芽胞杆菌常用培养基:葡萄糖20.0 g,蛋白胨15.0 g,NaCl 5.0 g,牛肉膏0.5 g,去离子水定容到1 000 mL,pH7.0~7.2。马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA):PDA粉购自BD公司,按照说明书配制。 V8培养基:V8 果汁 200 mL,CaCO3 3.0 g,琼脂粉15.0 g,去离子水定容到1 000 mL,pH 7.0~7.2。蛋白酶检测培养基:脱脂奶粉12.0 g,琼脂20.0 g,去离子水定容至1 000 mL。纤维素酶检测培养基:羧甲基纤维素钠10.0 g,蛋白胨10.0 g,琼脂20.0 g,酵母粉5.0 g,KH2PO4 1.0 g,NaCl 5.0 g,去离子水定容到1000 mL,pH7.0。β-1,3-葡聚糖酶检测培养基:酵母粉5.0 g,蛋白胨10.0 g,刚果红0.4 g,NaCl 5.0 g,琼脂20.0 g,去离子水定容至1 000 mL,pH值5.5~6.0。
1.1.3 主要仪器设备
实验室pH计(梅特勒-托利多仪器有限公司)、台式离心机(艾本德中国有限公司)、恒温培养振荡器(上海福玛实验设备有限公司)、电热恒温培养箱(上海福玛实验设备有限公司)、微型分光光度计(Biochrom有限公司)、PCR仪(赛默飞世尔科技中国有限公司)。
1.2 试验方法
1.2.1 拮抗贝莱斯芽胞杆菌抑菌活性的测定
采用平板对峙法测定6株贝莱斯芽胞杆菌对7种供试植物土传病害病原菌的抑制作用:待测拮抗菌用LB培养基,在28 ℃条件下振荡培养至OD600值为1.0;各种病原菌在PDA培养平板或V8培养基平板上(烟草疫霉)培养,菌落直径约为8.00 cm时,用打孔器在菌落边缘取直径0.6 cm的菌饼,倒置接种于PDA平板中央,在其周围距离2.0 cm对称的4个点上接种1.0 µL拮抗菌菌液,以LB培养基作为对照,每株拮抗菌3次重复。对照(CK)平板上病原菌菌落直径约为8.00 cm时,测量各个处理与对照的菌落直径,按如下公式计算菌丝生长抑制率:菌丝生长抑制率/%=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.2.2 拮抗贝莱斯芽胞杆菌对病原菌菌丝形态的影响
取上述对峙培养中抑菌带边沿的菌丝进行形态观察,以不接种拮抗菌只接种病原菌的培养平板为对照。
1.2.3 拮抗贝莱斯芽胞杆菌无菌发酵液对病原菌抑制活性的测定
各供试拮抗菌株接种于枯草芽胞杆菌常用培养基(液体培养基),28 ℃、200 r·min−1培养48 h,得到拮抗菌发酵液;将发酵液在10000 r·min−1条件下离心10 min,吸取上清,用0.22 µm的细菌过滤器过滤获得无菌发酵上清液;制作双层PDA平板(琼脂粉含量,上层为16 g·L−1,下层为20 g·L−1),取直径为0.6 cm的病原菌菌饼置于双层PDA平板中央;在距离中央2 cm处对称的4个位置将上层的培养基打孔,取出上层琼脂圆片,将40 µL无菌发酵上清液加入到打好的孔内,28 ℃下进行培养。以加入无菌LB培养基为对照,每个处理3个重复。其余步骤同“1.2.1”。
1.2.4 叶片离体接种测定拮抗贝莱斯芽胞杆菌的防治效果
选取齐整小核菌和核盘菌为目标菌进行离体防治效果测定。齐整小核菌接种于健康桑叶,在桑叶沿中线对称的2个位置制造伤口,在培养至3 d的齐整小核菌菌落边缘打孔,菌饼接种于右边伤口处,无菌PDA培养基接种于左边伤口处作为对照,将叶片置于湿润的滤纸上,分别无菌水(CK1)、新鲜拮抗菌菌液(1×108 CFU·mL−1)和枯草芽胞杆菌可湿性粉剂(稀释1 000倍液)(CK2)喷雾,至叶片湿润不滴水为止,每个处理3次重复,24 h后重复喷雾1次。接种叶片于28 ℃培养箱中放置72 h,以十字交叉法测量病斑的直径,计算防治效果。核盘菌则接种生菜叶片,培养温度为25 ℃,接种48 h后测量病斑的大小,其他操作步骤与桑叶片接种方法相同。防治效果/%=(对照叶片病斑直径-处理叶片病斑直径)/对照叶片病斑直径×100。
1.2.5 拮抗贝莱斯芽胞杆菌细菌胞外酶活性的测定
蛋白酶活性的检测:将6株待测拮抗菌接种于 LB培养基中,28 ℃、200 r·min−1下培养,至菌液OD600值为0.6,分别吸取1.0 µL拮抗菌菌液,均匀点在距离蛋白酶检测培养基平板中心约2.0 cm处。设置3个重复,以无菌LB液体培养基作为对照,培养2 d后,观察在菌落边缘是否形成透明圈。若形成透明圈,根据透明圈的大小判断菌株产生蛋白酶活性的大小。纤维素酶活性的检测:按上述方法将待测拮抗菌接种于纤维素酶活性检测培养基平板上,经28 ℃培养3 d后,用质量浓度为1.0 mg·mL−1的刚果红溶液5.0 mL染色15 min,倒掉刚果红溶液加入5.0 mL l.0 mol·L−1的NaCl溶液,静置15 min,倒掉NaCl溶液,观察是否形成透明圈。β-1,3-葡聚糖酶活性的检测:在β-1,3-葡聚糖酶活性检测培养基上进行,操作步骤同蛋白酶活性的检测。
1.2.6 拮抗贝莱斯芽胞杆菌抗生素相关基因的检测
依据文献合成用于检测mycB [24]、fenB[25]、ituA [25]、sfp [25]、bamC[26]、erisA[26]、bacA [27]、spaS [27]、yndj [28]和qk [29]共 10 个目标基因的引物(表1)。分别以6株拮抗菌的基因组DNA作为模板对目标基因进行PCR 检测。PCR反应体系:总反应体积50 μL,其中Taq Mix 25 μL,上下游引物(10 mmol·L−1)各 2 μL, DNA模板(50 ng·μL−1) 2 μL,ddH2O 19 μL。反应条件:95 ℃预变性5 min,94 ℃ 变性30 s,退火30 s,72 ℃ 延伸 2 min,运行30个循环,最后72 ℃ 延伸 5 min,其中erisA的退火温度为54 ℃,bamC、bacA 和spaS的退火温度为58 ℃,其余基因的退火温度为55 ℃。PCR产物经1.0% 琼脂糖凝胶电泳检测,将条带大小正确的片段进行回收纯化后测序。
表 1 用于检测拮抗贝莱斯芽胞杆菌抗生素相关基因的引物Table 1. Primers used to detect antibiotic-related genes in Bv strains基因
Genes引物名称及其序列(5′→3′)
Primers and the sequences片段大小
Product size/bp抑菌物质
Antifungal substancesmycB MycB-F:ATGTCGGTGTTTAAAAATCAAGTAACG
MycB-R:TTAGGACGCCAGCAGTTCTTCTATTGA2 024 抗霉枯草菌素
MycosubtilinfenB FenB-F:CTATAGTTTGTTGACGGCTC
FenB-R:CAGCACTGGTTCTTGTCGCA1 600 丰原素
FengycinituA ItuA-F:ATGTATACCAGTCAATTCC
ItuA-R:GATCCGAAGCTGACAATAG1 047 伊枯草菌素
Iturinsfp Sfp-F:ATGAAGATTTACGGAATTTA
Sfp-R:TTATAAAAGCTCTTCGTACG675 表面活性素
SurfactinbamC Bamc-F:AGTAAATGAACGCGCCAATC
Bamc-R:CCCTCTCCTGCCACATAGAG957 杆菌霉素
BacillomycinerisA Erisa-f:TTCGATGARTTCGATTTGGA
Erisa-r:GCAGCCCTTTTTCTTTTATTTC357 Ericin spaS Spas-f:GGTTTGTTGGATGGAGCTGT
Spas-r:GCAAGGAGTCAGAGCAAGGT375 枯草菌素
SubtilinbacA Baca-f:CAGCTCATGGGAATGCTTTT
Baca-r:CTCGGTCCTGAAGGGACAAG498 溶杆菌素
Bacylisinyndj 147-F:CAGAGCGACAGCAATCACAT
148-147-R:TGAATTTCGGTCCGCTTATC212 假定蛋白
Yndjqk Qk1-F:CTTAAACGTCAGAGGCGGAG
Qk1-R:ATTGTGCAGCTGCTTGTACG704 枯草杆菌蛋白酶
Subtilisin1.2.7 数据统计与分析
用Excel计算平均数及标准差,利用IBM SPSS Statistics V21.0软件进行统计学分析,利用新复极差测验法(SSR法)进行平均数之间的多重比较,判断不同处理间的差异显著性。
2. 结果与分析
2.1 6株贝莱斯芽胞杆菌对土传病害病原菌的抑菌活性
采用对峙培养法测定6株贝莱斯芽胞杆菌对7种土传病害病原菌抑菌活性,结果显示,6株拮抗菌株对核盘菌、灰葡萄孢、立枯丝核菌、尖孢镰刀菌、齐整小核菌和烟草疫霉等6种病原菌菌丝生长均有较强的抑制作用,对终极腐霉抑制效果不明显(图1-A)。不同拮抗菌株对不同病原菌的抑菌活性有明显差异,菌株NN01对核盘菌、灰葡萄孢、尖孢镰刀菌和齐整小核菌的抑制效果较好,抑菌率均达34.07%及以上;NN02对齐整小核菌的抑制活性最高,达76.11%,对核盘菌和尖孢镰刀菌的抑菌率分别为52.22%和46.67%;NN04对齐整小核菌和尖孢镰刀菌的抑菌活性较高,分别为74.81%和56.30%;NN88对齐整小核菌和尖孢镰刀菌的抑菌活性也较高,分别为62.41%和40.56%(表2)。就病原菌而言,所有拮抗菌株对齐整小核菌具有较强的抑制作用,菌丝抑制率在28.70% ~ 76.11%;有4个拮抗菌株(NN01、NN02、NN04、NN88)有对尖孢镰刀菌具有较强的抑制作用,抑制率在40.56%~56.30%;所有拮抗菌株对立枯丝核菌和烟草疫霉抑制作用较弱,菌丝抑制率均未达到19.26%。采用枯草芽胞杆菌培养基培养所有拮抗菌株,过滤获得无菌发酵液,以核盘菌、灰葡萄孢菌和立枯丝核菌作为指示菌进行对峙培养,结果显示所有菌株的无菌发酵液对病原菌也均具有明显的抑制作用(图1-B)。
![]() 图 1 贝莱斯芽胞杆菌(A)及其无菌发酵液(B)对 7 种土传病害病原菌菌丝生长的抑制效果注:CK,LB 培养基;1,核盘菌;2,灰葡萄孢;3,立枯丝核菌;4,尖孢镰刀菌古巴专化;5,齐整小核菌;6,烟草疫霉;7,终极腐霉。Figure 1. Inhibitory effects of Bv culture liquid (A) and cell-free fermentation broth (B) against 7 soil-borne pathogensNote: CK, LB medium;1, S. sclerotiorum; 2, B. cinerea; 3, R. solani;4, F. oxysporum f. sp. cubense; 5, S. rolfsii; 6, P.a nicotianae; 7, P. ultimum.表 2 拮抗贝莱斯芽胞杆菌对土传病原菌菌丝生长的影响Table 2. Effect of Bv strains on in vitro growth of soil-borne pathogens
图 1 贝莱斯芽胞杆菌(A)及其无菌发酵液(B)对 7 种土传病害病原菌菌丝生长的抑制效果注:CK,LB 培养基;1,核盘菌;2,灰葡萄孢;3,立枯丝核菌;4,尖孢镰刀菌古巴专化;5,齐整小核菌;6,烟草疫霉;7,终极腐霉。Figure 1. Inhibitory effects of Bv culture liquid (A) and cell-free fermentation broth (B) against 7 soil-borne pathogensNote: CK, LB medium;1, S. sclerotiorum; 2, B. cinerea; 3, R. solani;4, F. oxysporum f. sp. cubense; 5, S. rolfsii; 6, P.a nicotianae; 7, P. ultimum.表 2 拮抗贝莱斯芽胞杆菌对土传病原菌菌丝生长的影响Table 2. Effect of Bv strains on in vitro growth of soil-borne pathogens病原菌
Pathogens菌株及抑制率
B. velezensi strains and Inhibition rate /%NN01 NN02 NN04 NN05 NN88 NN95 齐整小核菌(S. rolfsii ) 67.59±4.12 a 76.11±0.61 a 74.81±6.11 a 46.67±6.70 a 62.41±2.57 a 28.70±3.88 a 核盘菌(S. sclerotiorum) 34.07±16.19d 52.22±3.14 b 19.44±8.85 c 14.81±2.18 b 13.50±2.58 d 10.93±3.47 b 灰葡萄孢菌(B. cinerea) 56.39±1.67 b 11.11±4.16 c 13.056±2.46 c 13.89±5.20 b 12.78±3.20 d 22.78±4.11 ab 尖孢镰刀菌古巴专化型(F. oxysporum f. sp. cubense) 47.78±1.41 c 46.67±0.99 b 56.30±3.63 b 11.67±1.53 b 40.56±9.65 b 11.67±1.17 b 烟草疫霉(P. nicotianae) 10.00±4.97 e 12.96±1.67 c 13.70±1.67 c 15.74±1.30 b 19.26±2.69 c 15.37±3.02 b 注:表中数据为3次重复的平均值±标准差,同列的相同小写字母表示在 0.05 水平上无显著差异。 Note: Data presented as mean±standard deviations were calculated from three independent experiments.Values followed by the same letter within a row were not significantly different at 0.05 level. 2.2 拮抗贝莱斯芽胞杆菌对核盘菌和灰葡萄孢菌菌丝形态的影响
在PDA上对峙培养48 ~96 h后,用显微镜观察抑菌带中核盘菌和灰葡萄孢菌菌丝形态,结果显示,NN02、NN88和NN95菌株处理的核盘菌菌丝原生质浓缩,颜色加深,局部菌丝破裂,原生质分布不均匀;NN02、NN04、NN05、NN88、NN95处理的灰葡萄孢菌菌丝也有相似的表现。NN01、NN04处理的核盘菌菌丝及NN01处理下的灰葡萄孢菌菌丝颜色加深,其形态无明显变化(图2)。
2.3 拮抗贝莱斯芽胞杆菌在离体叶片上的防治效果
分别在桑叶片接种齐整小核菌,生菜叶片在接种核盘菌后,用6株贝莱斯芽胞杆菌液喷雾处理,48~72 h后观察发病情况。结果显示,所有拮抗菌株对桑叶片或生菜叶片的病斑扩展均有不同程度的抑制作用(图3),对桑白绢病的防治效果都在53.40%以上,其中NN01防治效果为71.32%,NN01、NN02、NN05菌株防治效果分别为65.65%、65.05%和61.46%高于对照枯草芽胞杆菌菌剂(CK2),其余菌株的抑制效果与枯草芽胞杆菌菌剂的相当;所有拮抗菌株对生菜菌核病的抑制效果均优于对照枯草芽胞杆菌菌剂(CK2),其中NN01防治效果最好,为65.68%(表3)。
表 3 离体条件下6株贝莱斯芽胞杆菌桑白绢病和生菜菌核病的防治效果Table 3. In vitro control efficacy of Bv strains against S. rolfsii and S. sclerotiorum桑叶 mulberry 生菜叶 lettuce 菌株
Strain病斑直径
Lesion diameter/cm防治效果
Control efficacy/%菌株
Strain病斑直径
Lesion diameter/cm防治效果
Control efficacy/%NN01 1.61±0.12 71.32±2.26 a NN01 1.97±0.45 65.68±0.08 a NN05 1.91±0.28 65.65±3.70 b NN02 2.42±0.75 57.82±0.13 b NN02 1.95±0.20 65.05±5.12 b NN05 2.52±0.82 56.08±0.14 b NN95 2.15±0.10 61.46±1.87 c NN88 2.77±1.35 51.72±0.23 c CK2 2.25±0.39 59.67±7.00 c NN04 2.93±1.02 48.81±0.18 c NN04 2.33±0.23 58.18±4.19 c NN95 3.23±0.25 43.57±0.04 d NN88 2.60±0.26 53.40±4.67 c CK2 4.05±1.15 29.32±0.20 e CK1 5.58±0.12 — CK1 5.73±0.91 — 注:① 表中数据为3次重复的平均值±标准差,同列的相同小写字母表示在 0.05 水平上无显著差异。② CK1:无菌水;CK2:枯草芽胞杆菌。
Note: ① Data presented as mean±standard deviations were calculated from three independent experiments. Values followed by the same letter within a row were not significantly different at 0.05 level. ② CK1:sterilized water;CK2:B. subtilis.2.4 拮抗贝莱斯芽胞杆菌胞外酶活性
胞外酶活性进行检测结果显示,所有菌株在纤维素酶和酶蛋白酶检测培养基上均可产生明显透明圈,表明这些菌株可以产生纤维素酶和蛋白酶,其中NN01、NN02、NN04和NN88产纤维素酶的能力较强,NN05、NN95产纤维素酶的能力较弱;NN04产蛋白酶的能力最强,其次为NN01和NN02菌株。在β-1,3-葡聚糖酶检测平板上,NN02、NN04、NN05、NN88能够形成透明圈,但是透明圈界限不够明显,说明这些菌株可以产生葡聚糖酶,但是酶活性较弱或者产量较低,而菌株NN01和NN95在β-1,3-葡聚糖酶检测平板上不产生可见透明圈,表明在此条件下,这2个菌株不产生葡聚糖酶(图4) 。
![]() 图 4 拮抗贝莱斯芽胞杆菌的纤维素酶、蛋白酶和β-1,3-葡聚糖酶活性检测注:①1:NN01;2:NN02;3:NN04;4:NN05;5:NN88;6:NN95。②A:纤维素酶;B:蛋白酶;C:β-1,3-葡聚糖酶。Figure 4. Determination of cellulase, protease, and amylase activities in Bv strainsNote: ①1: NN01; 2: NN02; 3: NN04; 4: NN05; 5: NN88; 6: NN95. ② A: Cellulase; B: Protease; C: β-1,3-glucanase.
图 4 拮抗贝莱斯芽胞杆菌的纤维素酶、蛋白酶和β-1,3-葡聚糖酶活性检测注:①1:NN01;2:NN02;3:NN04;4:NN05;5:NN88;6:NN95。②A:纤维素酶;B:蛋白酶;C:β-1,3-葡聚糖酶。Figure 4. Determination of cellulase, protease, and amylase activities in Bv strainsNote: ①1: NN01; 2: NN02; 3: NN04; 4: NN05; 5: NN88; 6: NN95. ② A: Cellulase; B: Protease; C: β-1,3-glucanase.2.5 拮抗贝莱斯芽胞杆菌抗生素合成相关基因的检测
分别以拮抗菌株的总DNA作为模板,使用10对引物(表1)对抗生素合成相关基因进行PCR扩增。电泳检测显示,除了菌株NN95基因组没有扩增出fenB基因的特异条带,其余菌株用5对基因(mycB、fenB、ituA、bacA、yndj)的引物均可扩增出特异性单一的条带,条带大小正确(图5),经测序验证均为对应的目标基因片段,表明这些菌株都具有产生抗霉枯草菌素、丰原素、伊枯草菌素、溶杆菌素和假定蛋白Yndj的潜力,而NN95菌株没有产生丰原素的潜力。另外5对基因(sfp、bamc、erisa、spaS、qk)的引物则没有扩增出明显的条带(图中未显示),表明所有拮抗菌株中均没有携带产生表面活性素、杆菌霉素、Ericin、枯草菌素和枯草杆菌蛋白酶等抗生素的相关基因。
![]() 图 5 贝莱斯芽胞杆菌菌株中抗生素合成基因电泳检测结果注:①M:1 kb DNA marker;1:NN01;2:NN02;3:NN04;4:NN05;5:NN88;6:NN95。② A:mycB (2 024 bp);B:fenB (1 400 bp);C:ituA (1 150 bp);C:mycB (2 024 bp);D:bacA (498 bp);E:yndj (212 bp)。Figure 5. Detection of antibiotic-related genes in Bv strains by PCR amplificationNote: ①M: 1 kb DNA marker; 1: NN01; 2: NN02; 3: NN04; 4: NN05; 5: NN88; 6: NN95. ② A: mycB (2 024 bp); B: fenB (1 400 bp); C: ituA (1 150 bp); C: mycB (2 024 bp); D: bacA (498 bp); E: yndj (212 bp).
图 5 贝莱斯芽胞杆菌菌株中抗生素合成基因电泳检测结果注:①M:1 kb DNA marker;1:NN01;2:NN02;3:NN04;4:NN05;5:NN88;6:NN95。② A:mycB (2 024 bp);B:fenB (1 400 bp);C:ituA (1 150 bp);C:mycB (2 024 bp);D:bacA (498 bp);E:yndj (212 bp)。Figure 5. Detection of antibiotic-related genes in Bv strains by PCR amplificationNote: ①M: 1 kb DNA marker; 1: NN01; 2: NN02; 3: NN04; 4: NN05; 5: NN88; 6: NN95. ② A: mycB (2 024 bp); B: fenB (1 400 bp); C: ituA (1 150 bp); C: mycB (2 024 bp); D: bacA (498 bp); E: yndj (212 bp).3. 讨论与结论
贝莱斯芽胞杆菌来源广泛,抑菌谱广且可促进植物生长,作为植物生防制剂具有良好的应用前景,开展贝莱斯芽胞杆菌菌种资源的收集、筛选对推进植物病害的生物防治具有重要意义[13-14, 30]。本研究表明6株贝莱斯芽胞杆菌对核盘菌、灰葡萄孢菌、立枯丝核菌、尖孢镰刀菌、齐整小核菌和烟草疫霉等病原菌菌丝生长均具有明显抑菌活性,为常见植物土传病害的生物防治提供了菌种资源。作用机理不同的多个菌株混合使用可以提高拮抗菌的防治效果,可以防治同一作物上不同病害,甚至防治不同作物上不同病害[5, 10],在今后的盆栽试验及大田试验中,将使用不同菌株混合后进行防治,评估其用于制备混合菌剂的潜力。
芽胞杆菌可分泌产生多种胞外酶和抗生素等抗菌物质,参与抑菌过程[9]。芽胞杆菌分泌的常见胞外酶包括几丁质酶、蛋白酶、纤维素酶和β-1,3-葡聚糖酶等,胞外酶的种类及其活性可作为筛选拮抗菌的主要标记,通常产生胞外酶种类多的拮抗菌株,均具有较好的生防效果[12, 31]。脂肽类抗生素(lipopeptin)是芽胞杆菌分泌的主要抗菌物质,以伊枯草菌素家族、表面活性素和丰原素为主,其中伊枯草菌素家族包括伊枯草菌素、杆菌抗霉素和抗霉枯草菌素等,可破坏真菌细胞壁、细胞膜,强烈抑制真菌菌丝生长;丰原素作用机理与伊枯草菌素家族的相似,对丝状真菌抑制效果好[9, 32];溶杆菌素可导致微生物细胞壁的结构受损,细胞溶解死亡,对真菌和细菌都具有广谱的抗菌活性[33- 34]。本研究中的6个拮抗贝莱斯芽胞杆菌菌株均能分泌蛋白酶和纤维素酶,4个菌株可以产生少量的β-1,3-葡聚糖酶;除了NN95菌株不携带fenB,所有拮抗菌株都携带mycB、fenB、ituA、bacA和yndj等抗生素相关基因,表明这些菌株都具有产生抗霉枯草菌素、丰原素、伊枯草菌素、溶杆菌素和假定蛋白Yndj的潜力。拮抗菌株的无菌发酵液对病原菌具有明显的抑菌作用,抑菌带边缘的菌丝出现原生质浓缩或外泄、菌丝破裂、颜色变深等,推测6株拮抗菌产生的胞外酶和抗生素参与了它们的抑菌过程。与其他5个菌株相比,NN95菌株在平板上的抑菌效果相对较差,可能与该菌株缺少fenB基因有关。
在本研究中拮抗菌株在平板对峙培养显示的抑菌活性与叶片离体防治效果不存在一一对应关系,NN02和NN04对白绢病菌平板测试的抑菌活性分别为76.11%和74.81%,均比NN01菌株的(67.59%)高,但是其离体防治效果比NN01菌株的低;NN95菌株对齐整小核菌平板抑制为28.70%,离体防治效果61.46%,均优于NN04和NN88菌株,推测不同菌株的作用机制存在一定的差异。在平板对峙培养中,菌株产生拮抗物质的活性和生物量直接影响其抑菌效果,而离体叶片或田间防治效果则是拮抗菌-病原菌-寄主植物三者的相互作用的结果,与菌株产生的拮抗物质、定殖能力、能否诱导产生诱导抗性及寄主的抗病性等均有密切关系[9, 35]。今后可以利用基因组学、蛋白组学和代谢组学等多种组学方法联合分析,明确抗生素相关基因及胞外酶在拮抗菌-病原菌-寄主植物三者之间发挥作用的机制。
本研究中的拮抗菌株对立枯丝核菌、烟草疫霉和终极腐霉抑菌活性较低或没有活性。不同的病原菌对不同拮抗物质的反应有所不同,而培养条件会影响拮抗菌产生拮抗物质的种类及浓度[34, 36]。如枯草芽胞杆菌野生型菌株(ATCC 6633)对病原菌并没有明显的抑制活性,其过量表达抗霉枯草菌素基因的工程菌株BBG100则对灰葡萄孢菌、尖孢镰刀菌和瓜果腐霉(Pythium aphanidermatum)有明显的拮抗活性[37]。后续研究将通过改变培养基配方及培养条件或者构建主要抗生素相关基因的过量表达菌株,重新评估这些菌株产生拮抗物质的活性及其抑菌范围。此外,本研究中6株拮抗贝莱斯芽胞杆菌均携带bacA基因,具有产生溶杆菌素的潜力。溶杆菌素对细菌有强的抑制作用[9, 34],一些贝莱斯芽孢杆菌菌株对植物病原细菌也具有较强的抑制活性[9, 34, 38]。本研究中的拮抗菌株对茄科青枯菌(Ralstonia solanacearum)等土传细菌性病原是否有抑制作用,值得进一步研究。
6株拮抗贝莱斯芽胞杆菌抑菌谱广,对核盘菌、灰葡萄孢、立枯丝核菌、尖孢镰刀菌、齐整小核菌和烟草疫霉等6种土传病原菌菌丝生长具有抑制作用;所有拮抗菌株均能较好抑制桑白绢病和生菜菌核病病斑的发展,产生纤维素酶和蛋白酶;除了NN95菌株不携带fenB,所有拮抗菌株都携带mycB、fenB、ituA、bacA和yndj等抗生素相关基因,具有产生抗霉枯草菌素、丰原素、伊枯草菌素、溶杆菌素和假定蛋白Yndj的潜力,是植物土传病害潜在的生防菌。
-
表 1 Box-Behnken设计因素水平及编码
Table 1 Codes and levels of factors in Box-Behnken experiment
水平
Level因素 Factors/(g·L−1) A 全麦粉
Whole wheat flourB 花生饼粉
Peanut mealC 磷酸氢二钾
K2HPO4/D七水硫酸镁
MgSO4·7H2O/+1 55 24 2.25 2.25 0 50 22 2.00 2.00 −1 45 20 1.75 1.75 表 2 Box-Behnken试验设计及试验结果
Table 2 Design and results of Box-Behnken experiment
试验号
NumberA全麦粉
Whole wheat
flourB花生饼粉
Peanut
mealC磷酸氢
二钾
K2HPO4D七水
硫酸镁
MgSO4·7H2O菌丝生物量
Mycelium
biomass/
(g·L−1)1 −1 −1 0 0 29.61±1.18 2 +1 −1 0 0 29.90±1.45 3 −1 +1 0 0 32.27±1.11 4 +1 +1 0 0 28.77±2.01 5 0 0 −1 −1 30.79±1.28 6 0 0 +1 −1 29.41±1.88 7 0 0 −1 +1 28.00±0.30 8 0 0 +1 +1 30.21±1.09 9 −1 0 0 −1 31.72±2.12 10 +1 0 0 −1 29.37±1.63 11 −1 0 0 +1 30.20±2.00 12 +1 0 0 +1 29.11±2.51 13 0 −1 −1 0 29.29±4.29 14 0 +1 −1 0 30.00±0.68 15 0 −1 +1 0 30.20±1.45 16 0 +1 +1 0 30.11±4.80 17 −1 0 −1 0 30.00±2.97 18 +1 0 −1 0 30.17±4.12 19 −1 0 +1 0 32.48±0.21 20 +1 0 +1 0 28.73±4.01 21 0 −1 0 −1 30.09±4.38 表 3 二次回归方程方差分析
Table 3 ANOVA on quadratic regression equation
来源
Source平方和
SS自由度
DS均方
MSF P 显著性
Significance模型
Model0.7362 14 0.0526 98.95 <0.0001 ** A 0.0878 1 0.0878 165.28 <0.0001 ** B 0.0127 1 0.0127 23.85 0.0002 ** C 0.0074 1 0.0074 13.96 0.0022 ** D 0.0248 1 0.0248 0.31 <0.0001 ** AB 0.0358 1 0.0358 0.02 <0.0001 ** AC 0.0371 01 0.0371 6.12 <0.0001 * AD 0.0044 1 0.0044 0.32 0.0118 * BC 0.0015 1 0.0015 0.08 0.1114 BD 0.0011 1 0.0011 0.02 0.1702 CD 0.0327 1 0.0327 0.03 <0.0001 ** A2 0.1299 1 0.1299 169.26 <0.0001 ** B2 0.1974 1 0.1974 9.19 <0.0001 ** C2 0.2045 1 0.2045 127.92 <0.0001 ** D2 0.2302 1 0.2302 37.54 <0.0001 ** 残差
Residual0.0074 14 0.0005 失拟项
Lack of fit0.0047 10 0.0005 0.69 0.7126 纯误差
Pure error0.0027 4 0.0007 总和
Cor total0.7436 28 R2=0.9900 R2adj=0.9800 *表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
* indicates significant difference at P<0.05; ** extremely significant at P<0.01.表 4 液体菌种和固体菌种栽培过程及出菇比较
Table 4 Comparison of fermentation processes andmushroom fruiting using liquid and solid media
指标
Index液体菌种
Liquid strain固体菌种
Solid strain原种培养时间 Original culture time/d 8 24 栽培种培养时间 Culture spawn incubation time/d 8 40 制种周期 Seed production cycle/d 16 64 菌丝萌发时间 Time of mycelium germination/d 2 4 满袋时间 Bags full time/d 42 45 污染率 Pollution rate/% 8.33 29.17 现蕾时间 Budding time/d 7 9 采收时间 Harvest time/d 25 27 单包产量 Single package output/g 500.89±20.12 432.00±25.36 子实体整齐度 Fruiting body uniformity +++ ++ 菇长 Length/cm 12.82±1.19 11.76±0.83 菇径 Size/mm 12.37±1.66 17.36±1.71 盖高 Height/mm 6.86±1.35 10.72±1.85 盖径 Diameter/mm 20.06±3.77 26.10±3.94 +++表示子实体整齐度较一致; ++表示子实体整齐度一致。
+++shows uniform fruiting body formation; ++acceptable fruiting body uniformity. -
[1] 戴玉成, 周丽伟, 杨祝良, 等. 中国食用菌名录 [J]. 菌物学报, 2010, 29(1):1−21. DAI Y C, ZHOU L W, YANG Z L, et al. A revised checklist of edible fungi in China [J]. Mycosystema, 2010, 29(1): 1−21.(in Chinese)
[2] 程继红. 鹿茸菇的栽培现状与营养保健价值 [J]. 食药用菌, 2021, 29(1):12−15. CHENG J H. Cultivation status and its nutrition and health care value of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2021, 29(1): 12−15.(in Chinese)
[3] 程继红, 郑慧芬, 贲伟东, 等. 荷叶离褶伞工厂化栽培 [J]. 食用菌学报, 2008, 15(2):20−22. CHENG J H, ZHENG H F, BEN W D, et al. Industrial cultivation of Lyophyllum decastes [J]. Acta Edulis Fungi, 2008, 15(2): 20−22.(in Chinese)
[4] 木村荣一, 王建兵. 鹿茸菇的工厂化栽培 [J]. 食药用菌, 2019, 27(4):237−240. Eiichi K, WANG J B. Industrial cultivation of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2019, 27(4): 237−240.(in Chinese)
[5] 管婉, 陈业桥, 唐利华, 等. 食用菌液体菌种的制备及应用研究概况 [J]. 食用菌, 2021, 43(5):5−7. GUAN W, CHEN Y Q, TANG L H, et al. General situation of preparation and application of liquid strains of edible fungi [J]. Edible Fungi, 2021, 43(5): 5−7.(in Chinese)
[6] 徐来清, 张书祥. 假蜜环菌发酵工艺的优化研究 [J]. 生物学杂志, 2014, 31(3):91−94. XU L Q, ZHANG S X. The optimization of the fermentation technology of Armillariella tabescens [J]. Journal of Biology, 2014, 31(3): 91−94.(in Chinese)
[7] 刘敏, 卢红, 黄媛媛, 等. 茶树菇液体发酵条件研究 [J]. 北方园艺, 2016(11):142−144. LIU M, LU H, HUANG Y Y, et al. Study on the liquid fermentation condition of agrocybeaegerita(brig. ) sing [J]. Northern Horticulture, 2016(11): 142−144.(in Chinese)
[8] FENG Y L, LI W Q, WU X Q, et al. Statistical optimization of media for mycelial growth and exo-polysaccharide production by Lentinus edodes and a kinetic model study of two growth morphologies [J]. Biochemical Engineering Journal, 2010, 49(1): 104−112. DOI: 10.1016/j.bej.2009.12.002
[9] 杨丽维, 王玉, 班立桐, 等. 杏鲍菇液体菌种培养基的筛选和优化 [J]. 北方园艺, 2014(6):150−152. YANG L W, WANG Y, BAN L T, et al. Study on the screening and optimizing of liquid spawn medium of Pleurotus eryngii [J]. Northern Horticulture, 2014(6): 150−152.(in Chinese)
[10] BOX G E P. Statistics for Experiments: An Introduction to Design, Data Analysis and Model Building [M]. New York: Wiley, 1990.
[11] HUMFELD H. The production of mushroom Mycelium (Agaricus campestris) in submerged culture [J]. Science, 1948, 107(2780): 373. DOI: 10.1126/science.107.2780.373
[12] 刘启燕, 戚俊, 周洪英, 等. 食用菌液体菌种工厂化生产应用现状及发展浅析 [J]. 食用菌, 2018, 40(6):8−10, 22. DOI: 10.3969/j.issn.1000-8357.2018.06.003 LIU Q Y, QI J, ZHOU H Y, et al. Present situation and development tendency of using liquid spawn of edible mushrooms in industrialized production [J]. Edible Fungi, 2018, 40(6): 8−10, 22.(in Chinese) DOI: 10.3969/j.issn.1000-8357.2018.06.003
[13] 李立功. 荷叶离褶伞研究进展 [J]. 中国林副特产, 2019(1):79−81, 90. LI L G. Research progress of Lyophyllum decastes [J]. Forest by-Product and Speciality in China, 2019(1): 79−81, 90.(in Chinese)
[14] 魏生龙, 王治江, 于海萍, 等. 荷叶离褶伞生物学特性研究 [J]. 菌物学报, 2006, 25(1):101−108. WEI S L, WANG Z J, YU H P, et al. Biological characteristics of Lyophyllum decastes (Fr. : Fr. ) singer [J]. Mycosystema, 2006, 25(1): 101−108.(in Chinese)
[15] 魏生龙, 连海丽, 于海萍, 等. 矿质营养与其他生长物质对荷叶离褶伞菌丝生长的影响 [J]. 菌物学报, 2008, 27(2):201−208. WEI S L, LIAN H L, YU H P, et al. The influence of mineral nutritions and other growth substances on the growth of mycelia of Lyophyllum decastes [J]. Mycosystema, 2008, 27(2): 201−208.(in Chinese)
[16] 张凌姗. 鹿茸菇生态学特性与液体菌种配方的优化研究 [J]. 食药用菌, 2020, 28(6):425−427,439. ZHANG L S. Study on ecological characteristics and optimization of liquid spawn formula of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2020, 28(6): 425−427,439.(in Chinese)
[17] 张汉燚, 王治江, 席亚丽, 等. 荷叶离褶伞中试发酵条件与培养基优化研究 [J]. 中国酿造, 2012, 31(1):96−99. ZHANG H Y, WANG Z J, XI Y L, et al. Optimization of fermentation conditions and medium components for pilot production of Lyophyllum decastes [J]. China Brewing, 2012, 31(1): 96−99.(in Chinese)
[18] 席亚丽, 王治江, 魏生龙, 等. 荷叶离褶伞摇瓶发酵条件研究 [J]. 河西学院学报, 2011, 27(2):68−74,57. XI Y L, WANG Z J, WEI S L, et al. Study on fermentation conditions of Lyophyllum decastes in shake flask [J]. Journal of Hexi University, 2011, 27(2): 68−74,57.(in Chinese)
[19] 徐长毫, 董冰雪, 李长杰, 等. 响应面法优化灵芝AM21菌株液体深层发酵培养基配方 [J]. 食用菌学报, 2011, 18(4):31−36. XU C H, DONG B X, LI C J, et al. Optimization of fermentation medium for triterpenoid production by Ganoderma lucidum AM21 using response surface methodology [J]. Acta Edulis Fungi, 2011, 18(4): 31−36.(in Chinese)
[20] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用 [J]. 实验室研究与探索, 2015, 34(8):41−45. LI L, ZHANG S, HE Q, et al. Application of response surface methodology in experiment design and optimization [J]. Research and Exploration in Laboratory, 2015, 34(8): 41−45.(in Chinese)
[21] 程继红. 名贵食药用菌鹿茸菇商业化生产现状与发展前景 [J]. 食药用菌, 2014, 22(4):194−197. CHENG J H. The commercial production situation and prospects of the new valuable edible and medicinal mushroom, Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2014, 22(4): 194−197.(in Chinese)
-
期刊类型引用(8)
1. 朱瑜,周信雁,魏宇飞,谢源源,韦勋,杨尚东,庞师婵. 嫁接对番茄植株根际微生物群落组成的影响. 西南农业学报. 2024(01): 199-209 .  百度学术
百度学术
2. 张铭鑫,彭娜,王尧尧,王仪,李宝通,刘慧芹,高微微. 西洋参根腐病拮抗菌XT-25的生防作用研究. 核农学报. 2024(07): 1249-1257 .  百度学术
百度学术
3. 韦锡昌,林蓝慧,蒙姣荣,李界秋,王忠文. 一株香蕉枯萎病菌拮抗菌的筛选鉴定及盆栽防治效果. 西南农业学报. 2024(07): 1522-1530 .  百度学术
百度学术
4. 蒋攀婷,伍玉玲,何昊哲,蒙姣荣,罗慧,方中斌,李界秋. 芒果炭疽病拮抗菌L18-7菌株的筛选、鉴定及拮抗机制研究. 西南农业学报. 2023(04): 742-749 .  百度学术
百度学术
5. 李雨浓. 向日葵菌核病防治措施研究进展. 农业科技通讯. 2023(05): 169-173 .  百度学术
百度学术
6. 李小杰,邱睿,刘畅,姚晨虓,白静科,陈玉国,李淑君. 基于全基因组测序的贝莱斯芽胞杆菌Ba-0321抑菌机制分析及相关功能验证. 中国生物防治学报. 2023(04): 885-894 .  百度学术
百度学术
7. 施春兰,汤永玉,叶坤浩,曾舒泉,张永科,何霞红,魏朝霞,曾华兰,叶鹏盛,吴国星. 附子白绢病拮抗细菌的分离鉴定及发酵条件优化. 南方农业学报. 2023(06): 1720-1731 .  百度学术
百度学术
8. 白敬,吉馨予,赵国群. 稻瘟病菌拮抗菌HKD-6的筛选、鉴定及其抑菌物质分析. 江西农业学报. 2022(12): 111-119+135 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: