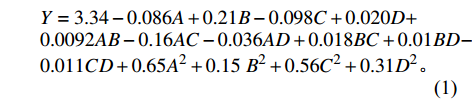Response Surface Optimization of Medium Formulation for Culture of Lyophyllum decastes
-
摘要:目的 以提高鹿茸菇液体菌种菌丝生物量为目的,通过优化液体菌种发酵配方,制备优良液体菌种,推动鹿茸菇工厂化生产快速发展。方法 以鹿茸菇为研究材料,采用摇瓶培养方式,通过单因素设计分析6种碳源、8种氮源、10种金属离子对鹿茸菇菌丝生长的影响。采用Box-Behnken响应面法进一步优化单因素筛选出的碳源、氮源与金属离子,比较分析液体菌种与固体菌种应用于鹿茸菇生产的优劣性。结果 适合鹿茸菇生长的营养要素分别为全麦粉、花生饼粉、KH2PO4与MgSO4·7H2O,营养要素间的最优配方为全麦粉47 g·L−1、花生饼粉22 g·L−1、KH2PO4 2.00 g·L−1、MgSO4·7H2O 2.00 g·L−1,当发酵培养至第8 d时,菌丝生物量达到最大值(32.81±1.10 g·L−1),以优化配方制备的鹿茸菇液体菌种菌丝生物量较初始配方提高了7.34倍。在生产试验中液体菌种较固体菌种,制种时间缩短48 d,菌丝萌发时间缩短2 d,单袋产量提高15.47%。结论 本研究研发的液体菌种发酵配方可获得高质量的生产用种,以液体发酵方式制备鹿茸菇生产用种适合鹿茸菇工厂化生产。Abstract:Objective To improve the mycelium biomass of Lyophyllum decast liquid seeds, high-quality liquid seeds are prepared by optimizing the liquid fermentation formula, to promote the rapid development of industrial production of L. decastes mushrooms.Methods Taking L. decastes as the research material, the effects of 6 kinds of carbon sources, 8 kinds of nitrogen sources, and 10 kinds of metal ions on the mycelium growth were analyzed by single-factor design. The carbon source, nitrogen source, and metal ions screened out by single-factor design were further optimized by the Box-Behnken response surface method, and the advantages and disadvantages of liquid seeds and solid seeds in the production of L. decastes mushrooms were compared.Results The nutritional elements suitable for the growth of L. decastes were whole wheat flour, peanut meal, K2HPO4, and MgSO4·7H2O, and the optimal formula was whole wheat flour 47 g·L−1, peanut meal 22 g·L−1, K2HPO4 2.00 g·L−1, MgSO4·7H2O 2.00 g·L−1. When the fermentation culture reached the 8th day, the dry cell mass (DCM) was 32.81±1.10 g·L−1. Compared with the DCM by the initial formula, the DCM prepared with the optimized formula was increased by 7.34 times. Compared with solid seeds, the production time of liquid seeds was shortened by 48 days, the time of mycelium germination was shortened by 2 days, and the yield per bag increased by 15.47%, in industrial production.Conclusion The liquid fermentation formula developed in this study can obtain high-quality production seeds, and the liquid fermentation strategy for the preparation of seeds is suitable for the industrial production of L. decastes mushrooms.
-
Keywords:
- Lyophyllum decastes /
- Liquid seeds /
- Liquid fermentation formula /
- Mycelium biomass
-
0. 引言
【研究意义】鹿茸菇,学名荷叶离褶伞[Lyophyllum decastes (Fr.) Singer][1],是一种珍稀的药食两用型高等真菌。鹿茸菇口感爽脆、味道清淡,备受老百姓的喜爱,成为“网红菇”[2]。国内市场对于鹿茸菇的巨大需求,推动了鹿茸菇产业的快速发展,使其成为继金针菇、杏鲍菇、真姬菇、双孢蘑菇之后的新型食用菌工厂化栽培品种,生产基地主要聚集于上海、江苏、浙江、福建等地相关食用菌企业。菌丝培养阶段在整个食用菌栽培过程中十分重要。鹿茸菇菌丝在栽培基质中萌发时间长,抗杂菌能力弱[3],易发生有害菌侵害,污染率高,后期出菇产量低甚至不出菇[4]。目前鹿茸菇工厂化栽培多以固体菌种为主,传统固体菌种存在萌发时间长、制种周期长、菌龄不一致[5]、污染率高等弊端,而液体菌种培养工序简单[6],扩繁迅速,短时间内可达到一定的生物量[7-9],菌球更易分散,菌丝萌发快[10]。液体菌种较固体菌种更适用于鹿茸菇工厂化生产,因此急需开展鹿茸菇液体菌种配方优化研究。【前人研究进展】第二次世界大战期间,为了满足对抗生素的大量需求,发酵罐制造业开始兴起,同时解决了液体深层发酵的供氧问题,奠定了现代发酵工业的基础。Humfeld [11]首次使用液体深层发酵技术成功制备Agaricu campestris菌丝体。随着发酵工程理论知识与实践经验的不断积累,液体深层发酵技术现已广泛应用于大多数食用菌品种[5](除混合种出菇类型,如银耳)生产用种的制备。与固体菌种相比,液体菌种优势更明显,应用前景更广阔[12],制备工艺具备完全替代固体菌种的潜能。关于鹿茸菇方面的研究主要聚焦于鹿茸菇菌丝在平板培养基上的生物学特性,包括不同碳源、氮源、金属离子、生长素对鹿茸菇平板菌丝生长的影响[13-14],摇瓶试验分析不同培养基成分对鹿茸菇液体菌丝生长的影响[15],通气搅拌式发酵罐中优化鹿茸菇液体菌丝发酵条件,液体菌种配方优化等[16]。张汉燚等[17]对鹿茸菇中试发酵培养基进行优化,最佳培养基配方为玉米面5%、大豆0.5%、ZnSO4 0.025%、MgSO4 0.05%、KH2PO4 0.05%。发酵至第8 天时,菌丝体生物量达到最大值(10.578 g·L−1)。席亚丽等[18]对鹿茸菇摇瓶发酵条件进行探索,获得最佳培养基配方为玉米面200 g·L−1、蔗糖 15 g·L−1、麸皮35 g·L−1、酵母膏1.5 g·L−1;温度26℃,接种量10%,培养时间为6~8 d。【本研究切入点】鹿茸菇液体菌种培养优化的研究多采用单因素和正交试验结合的方式,试验设计考虑多种因素的影响,但无法明确因素之间交互作用对响应值的影响,缺少各因素与响应值之间的函数关系,无法确定最大响应值所对应的因素组合方式。目前,单因素试验和Box-Behnken响应面法结合优化鹿茸菇液体菌种发酵配方的研究较少,鹿茸菇液体发酵培养工厂化生产效率有待提高。【拟解决的关键问题】本研究以鹿茸菇为研究材料,采用摇瓶培养方式,以提高菌丝生物量为目的,采用单因素试验和Box-Behnken响应面法结合的方式,对培养基碳源、氮源和无机盐的添加量进行优化,以期获得适合鹿茸菇菌丝生长的液体发酵培养基配方,为推动鹿茸菇液体菌种生产提供理论依据。
1. 材料与方法
1.1 试验材料
1.1.1 供试菌株
鹿茸菇菌种(编号:LDS-1-YJY-2018)保存于福建农林大学(古田)菌业研究院,为福建珍菌子生物科技有限公司生产菌种。
1.1.2 试剂
酵母粉、蛋白胨均购于Oxoid;琼脂粉购于Chembase;葡萄糖、蔗糖、鱼粉、维生素B1、K2HPO4、MgSO4·7H2O、ZnSO4、CaSO4等无机盐均购于国药集团化学试剂有限公司;供试碳源玉米粉、小麦粉、全麦粉均购于陇龙之家,玉米芯购于联丰农产品深加工;供试氮源豆粕粉、牛肉膏、黄豆饼粉、花生饼粉、棉籽饼粉、玉米浆均购于鸿润宝顺培养基原料厂家。
1.1.3 培养基配方
PDA加富液体培养基(1 L):土豆200 g,葡萄糖20 g,蛋白胨2 g,酵母粉2 g,K2HPO4 2.5 g,MgSO4·7H2O 1 g,Vitamin B1 0.1 g,pH自然。PDA加富固体培养基在液体培养基的基础之上加入琼脂20 g。
摇瓶一级种子液培养基(1 L):葡萄糖20 g,蛋白胨2 g,酵母粉2 g,K2HPO4 2.5 g,MgSO4·7H2O 1 g,pH自然。
摇瓶基础发酵培养基(1 L):葡萄糖20 g,蛋白胨2 g,K2HPO4 2.5 g,MgSO4·7H2O 1 g,pH自然。
固体菌种培养基:木屑78%,麸皮20%,葡萄糖1%,石灰1%,含水率65%左右。
1.2 试验方法
1.2.1 摇瓶一级种子液的制备
将保藏菌种接种于PDA加富固体培养基平板,25℃,培养20 d左右直至菌丝长满平板。应用打孔器(0.5 mm直径)在平板上面打30孔,应用接种器将菌块挑入摇瓶一级种子液培养基(含磁力搅拌子),25℃,150 r·min−1培养4 d,第4 天取出摇瓶置于磁力搅拌器上以800 r·min−1、30 min打散菌球,继续培养4 d,即制成一级种子液。
1.2.2 液体菌种生长动力学曲线的测定
按10%接种量将一级种子液接种于100 mL基础发酵培养基,25℃、150 r·min−1振荡培养。每隔1 d分别取出发酵液,100目纱布过滤收集菌球,RO水清洗3遍,60℃烘干至恒重。每个处理设置3个重复。
1.2.3 最适液体发酵培养基成分筛选
基础发酵培养基121℃,灭菌20 min。其中玉米芯、玉米粉、小麦粉、全麦粉、豆粕粉、黄豆饼粉、花生饼粉、棉籽饼粉、鱼粉需115℃灭菌40 min,冷却后均要求过100目筛网,滤液加入基础发酵培养基。按10%接种量接入相应培养基,25℃,150 r·min−1,培养8 d,100目纱布过滤收集菌球,RO水清洗3遍,60℃烘干至恒重。每个处理设置3个重复。该操作方法适用于1.2.3、1.2.4与1.2.5。
以摇瓶基础发酵培养基为基础,分别用不同种类的碳源、氮源、无机盐替代摇瓶基础发酵培养基相对应的培养基成分,以筛选最适合鹿茸菇液体菌球生长的碳源、氮源与无机盐。供试碳源(20 g·L−1):葡萄糖、蔗糖、玉米芯、玉米粉、小麦粉、全麦粉,CK为不加碳源;供试氮源(2 g·L−1):蛋白胨、豆粕粉、牛肉膏、黄豆饼粉、花生饼粉、棉籽饼粉、鱼粉、玉米浆,CK为不加氮源;供试无机盐(1 g·L−1):CoCl2、CuSO4、ZnSO4、CaSO4、MnSO4、FeSO4、NaCl、KCl、MgSO4·7H2O、K2HPO4,CK为不加无机盐。
1.2.4 单因素设计
以摇瓶基础发酵培养基为基础,分别替换其中碳源、氮源、无机盐成分进行单因素试验。各因素质量浓度梯度如下:全麦粉为10、20、30、40、50、60、70 g·L−1;花生饼粉为2、6、10、14、18、22、26 g·L−1;K2HPO4为 0.5、1.0、1.5、2.0、2.5、3.0 g·L−1;MgSO4·7H2O为0.5、1.0、1.5、2.0、2.5、3.0 g·L−1。
1.2.5 响应面设计试验
基于单因素设计结果,以菌丝生物量为响应值评价指标,采用Box-Behnken响应面法对全麦粉(A)、花生饼粉(B)、磷酸氢二钾(K2HPO4,C)、七水硫酸镁(MgSO4·7H2O,D)进行4因素3水平优化设计试验(表1)。
表 1 Box-Behnken设计因素水平及编码Table 1. Codes and levels of factors in Box-Behnken experiment水平
Level因素 Factors/(g·L−1) A 全麦粉
Whole wheat flourB 花生饼粉
Peanut mealC 磷酸氢二钾
K2HPO4/D七水硫酸镁
MgSO4·7H2O/+1 55 24 2.25 2.25 0 50 22 2.00 2.00 −1 45 20 1.75 1.75 1.2.6 液体菌种和固体菌种出菇试验
按照最适发酵培养基配方制备液体菌种,以10%的接种量接种于250 mL摇瓶内,24℃ 130 r·min−1培养8 d,获得液体菌种。采用袋口接种的方式将液体栽培种接种至菌袋内,每袋接种25~30 mL,接种固体菌种作为对照组。养菌与出菇管理工艺均由福建珍菌子生物科技有限公司完成。
1.3 统计分析
培养基成分筛选试验和单因素试验使用Graphpad Prism 9软件作图。响应面试验使用Design Expert 8.0.6软件进行。试验数据均使用SPSS Statistics 26软件进行显著性差异分析。
2. 结果与分析
2.1 鹿茸菇液体菌种生长动力学曲线
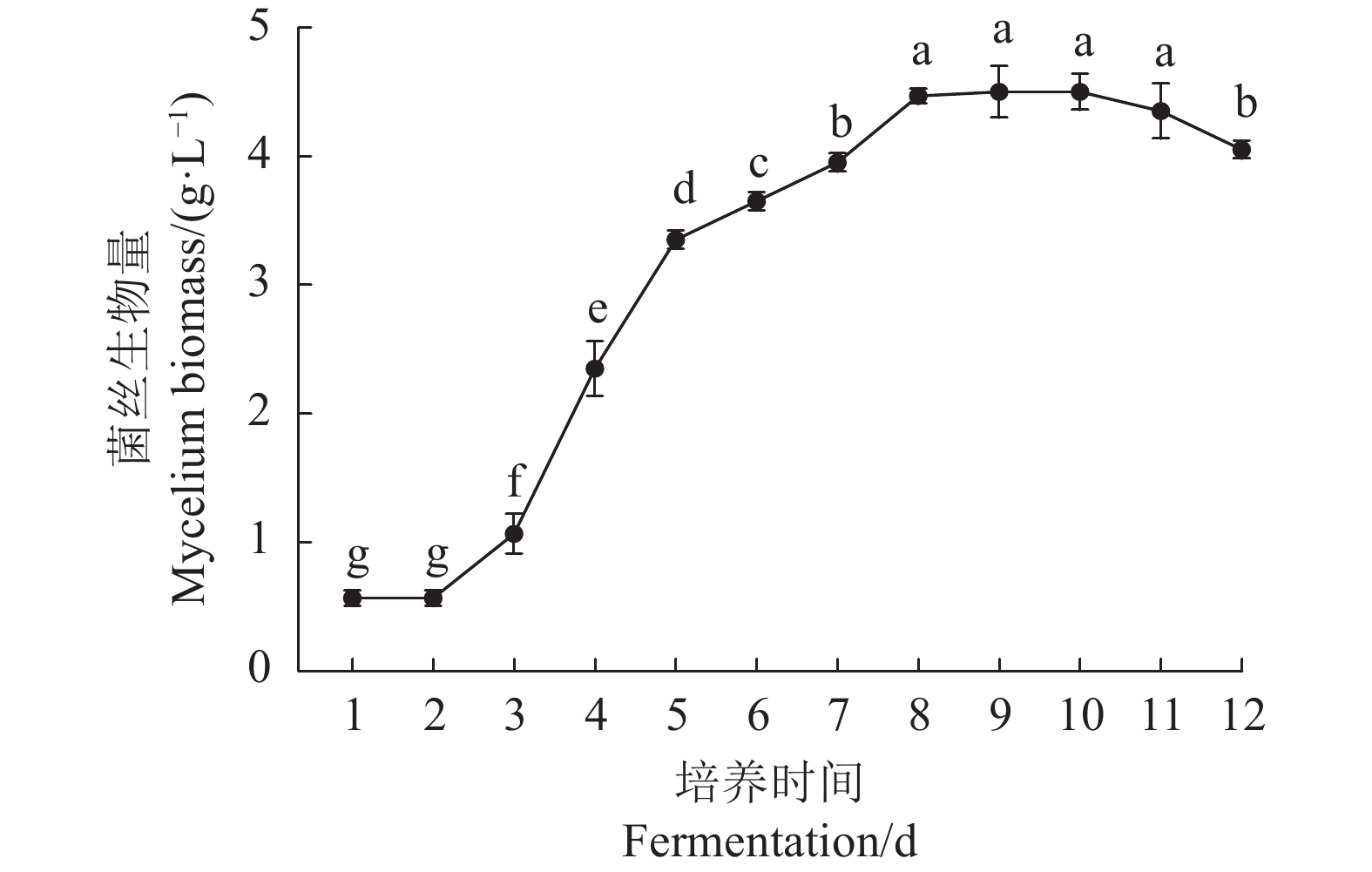
由图1可知,鹿茸菇菌丝生物量随培养时间的延长呈先上升后下降的趋势。在发酵过程中,0~2 d为延滞期,2~8 d为快速生长期,8~10 d为稳定期,10 d后进入衰亡期。当鹿茸菇菌丝培养至第8 天时,菌丝生物量达到最大值(4.47 g·L−1),因此确定鹿茸菇液体菌种培养时间为8 d。
2.2 培养基成分的筛选
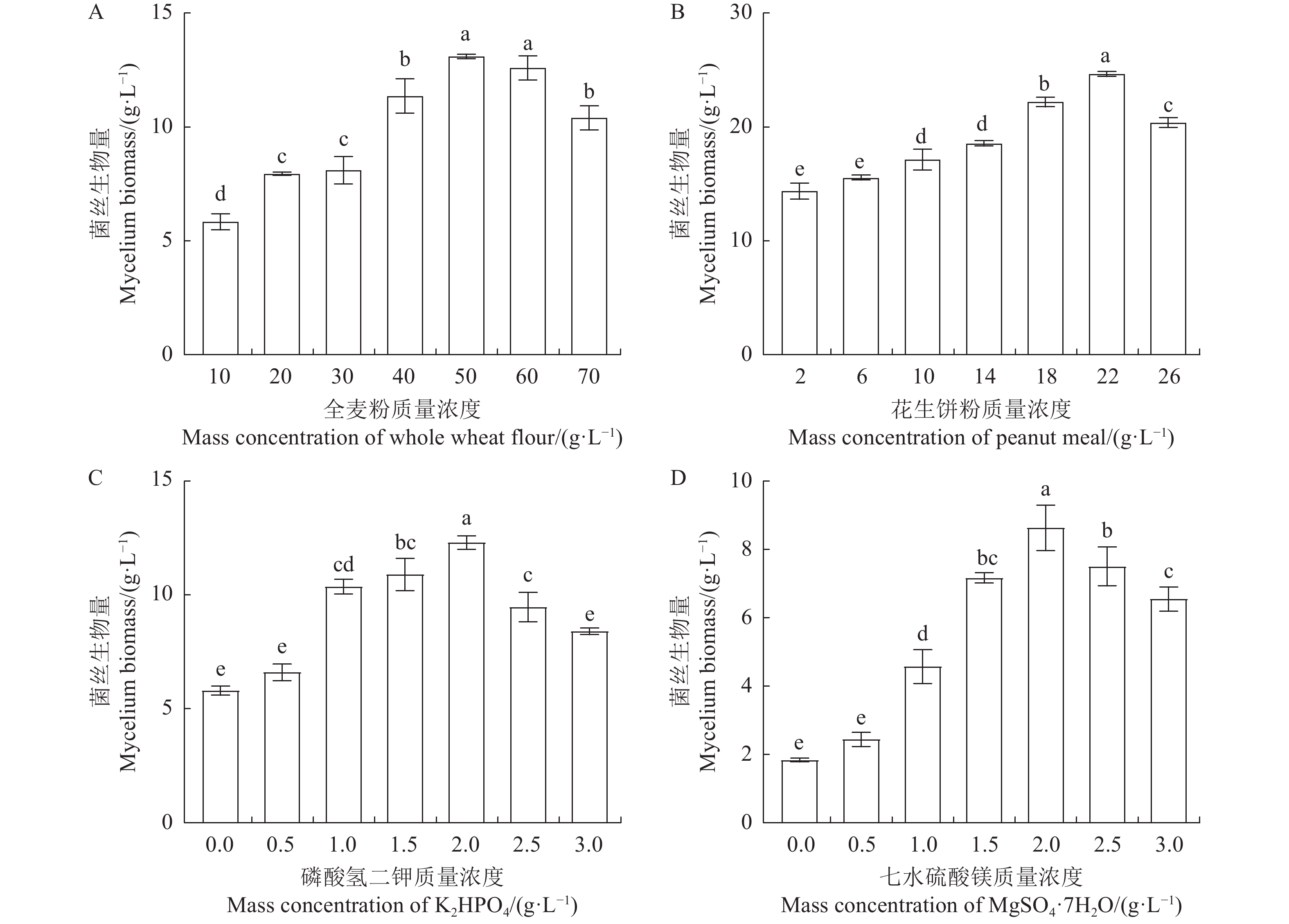
由图2-A可知,鹿茸菇菌丝在6种供试碳源中均可生长,且菌丝生物量均高于不加碳源的对照组。不同碳源对菌丝生物量的影响具有显著差异性,从高到低的顺序为:全麦粉>葡萄糖>蔗糖>小麦粉>玉米粉>玉米芯,以全麦粉作为碳源时,菌丝生物量达到最大值(8.50 g·L−1),显著高于其他碳源。由图2-B可知,鹿茸菇菌丝在8种供试氮源中均可生长,其中花生饼粉是供试氮源中最适宜鹿茸菇生长的复合氮源,以花生饼粉作为氮源时,菌丝生物量可达11.12 g·L−1。由图2-C可知,当Co2+与Cu2+质量浓度为1 g·L−1时,菌丝生物量均低于不加无机盐的对照组,抑制鹿茸菇菌丝的正常生长,而其余离子均不同程度地促进菌丝的生长发育,其中尤以K+与Mg2+最为显著。以上数据表明,较适合于鹿茸菇菌丝发酵的碳源、氮源、无机盐分别为全麦粉、花生饼粉、K2HPO4与MgSO4·7H2O。
2.3 单因素试验
为了探究培养基单一成分如何影响鹿茸菇液体菌丝的生长,分别开展了全麦粉、花生饼粉、K2HPO4与MgSO4·7H2O单因素质量浓度梯度试验。以全麦粉作为培养基的碳源,质量浓度为40~60 g·L−1时,菌丝生物量达到最大值(13.10 g·L−1)(图3-A)。以花生饼粉作为培养基的氮源时,质量浓度为18~26 g·L−1时,菌丝生物量达到最大值(24.65 g·L−1)(图3-B)。以K2HPO4与MgSO4作为培养基的无机盐时,K2HPO4与MgSO4·7H2O的质量浓度均为1.5~2.5 g·L−1,菌丝生物量分别达到其最大值(图3-C、D)。在不考虑培养基成分之间是否存在交互作用的影响下,单因素设计已成功筛选到各培养基成分较适合鹿茸菇菌丝生长的质量浓度范围。
2.4 响应面优化试验
在单因素试验结果的基础上,采用Box-Behnken设计对碳源(全麦粉)、氮源(花生饼粉)、无机盐(K2HPO4与MgSO4·7H2O)进行4因素3水平响应面优化试验,结果见表2。以因素为自变量,菌丝生物量为响应值,使用Design Expert 8.0.6软件进行多元线性回归和二次项拟合,可得到二次多项回归方程式(1),方差分析见表3。
表 2 Box-Behnken试验设计及试验结果Table 2. Design and results of Box-Behnken experiment试验号
NumberA全麦粉
Whole wheat
flourB花生饼粉
Peanut
mealC磷酸氢
二钾
K2HPO4D七水
硫酸镁
MgSO4·7H2O菌丝生物量
Mycelium
biomass/
(g·L−1)1 −1 −1 0 0 29.61±1.18 2 +1 −1 0 0 29.90±1.45 3 −1 +1 0 0 32.27±1.11 4 +1 +1 0 0 28.77±2.01 5 0 0 −1 −1 30.79±1.28 6 0 0 +1 −1 29.41±1.88 7 0 0 −1 +1 28.00±0.30 8 0 0 +1 +1 30.21±1.09 9 −1 0 0 −1 31.72±2.12 10 +1 0 0 −1 29.37±1.63 11 −1 0 0 +1 30.20±2.00 12 +1 0 0 +1 29.11±2.51 13 0 −1 −1 0 29.29±4.29 14 0 +1 −1 0 30.00±0.68 15 0 −1 +1 0 30.20±1.45 16 0 +1 +1 0 30.11±4.80 17 −1 0 −1 0 30.00±2.97 18 +1 0 −1 0 30.17±4.12 19 −1 0 +1 0 32.48±0.21 20 +1 0 +1 0 28.73±4.01 21 0 −1 0 −1 30.09±4.38 表 3 二次回归方程方差分析Table 3. ANOVA on quadratic regression equation来源
Source平方和
SS自由度
DS均方
MSF P 显著性
Significance模型
Model0.7362 14 0.0526 98.95 <0.0001 ** A 0.0878 1 0.0878 165.28 <0.0001 ** B 0.0127 1 0.0127 23.85 0.0002 ** C 0.0074 1 0.0074 13.96 0.0022 ** D 0.0248 1 0.0248 0.31 <0.0001 ** AB 0.0358 1 0.0358 0.02 <0.0001 ** AC 0.0371 01 0.0371 6.12 <0.0001 * AD 0.0044 1 0.0044 0.32 0.0118 * BC 0.0015 1 0.0015 0.08 0.1114 BD 0.0011 1 0.0011 0.02 0.1702 CD 0.0327 1 0.0327 0.03 <0.0001 ** A2 0.1299 1 0.1299 169.26 <0.0001 ** B2 0.1974 1 0.1974 9.19 <0.0001 ** C2 0.2045 1 0.2045 127.92 <0.0001 ** D2 0.2302 1 0.2302 37.54 <0.0001 ** 残差
Residual0.0074 14 0.0005 失拟项
Lack of fit0.0047 10 0.0005 0.69 0.7126 纯误差
Pure error0.0027 4 0.0007 总和
Cor total0.7436 28 R2=0.9900 R2adj=0.9800 *表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
* indicates significant difference at P<0.05; ** extremely significant at P<0.01.Y=3.34−0.086A+0.21B−0.098C+0.020D+0.0092AB−0.16AC−0.036AD+0.018BC+0.01BD−0.011CD+0.65A2+0.15 B2+0.56C2+0.31D2。 通过表3方差分析表可知,模型P<0.01,说明回归方程在0.01水平极显著,表明试验设计可靠;失拟项P>0.05,说明所得方程与实际拟合非正常误差所占比例较小,可用该模型和回归方程来预测试验数据。R2=0.9900,R2adj=0.9800,进一步说明该模型拟合度较好,可信度高,约98.00%的鹿茸菇液体菌种生物量可用该模型进行预测[19]。A、B、C、D的P值小于0.01,说明其对菌丝生物量有极显著影响。AB、CD之间交互作用对菌丝生物量有极显著影响,AC、AD有显著影响,BD、BC无显著影响。比较F值大小可知,影响菌丝生物量的因素主次顺序为A全麦粉>B花生饼粉>C磷酸氢二钾>D硫酸镁,交互项影响顺序为AC>AD>BC>CD>AB=BD。
响应曲面图可更加直观地反映两两因素之间交互作用情况,等高线的形状为椭圆形表示交互作用明显,圆形则表示交互作用不明显[20]。在全麦粉质量浓度为45~52 g·L−1与花生饼粉质量浓度为21.2~23.5 g·L−1、全麦粉质量浓度为45.0~51.5 g·L−1与K2HPO4 质量浓度为1.9~2.2 g·L−1、全麦粉质量浓度为45.2~51.5 g·L−1与MgSO4·7H2O 质量浓度为1.8~2.1 g·L−1,菌丝生物量均出现极大值(图4-A~C);全麦粉与花生饼粉、碳酸氢二钾均存在显著的交互作用(表3)。其余因素之间几乎不存在交互作用,主要由单因素自身决定菌丝生物量(表3、图4)。
2.5 响应面验证试验
鹿茸菇液体菌种发酵培养基响应面优化试验中,最佳组合为全麦粉47.84 g·L−1、花生饼粉22.39 g·L−1、K2HPO4 2.04 g·L−1、MgSO4·7H2O 1.97 g·L−1,预测菌丝生物量为33.60 g·L−1。考虑实际情况,将各组用量简化为全麦粉47 g·L−1、花生饼粉22 g·L−1、K2HPO4 2.00 g·L−1、MgSO4·7H2O 2.00 g·L−1,此条件下的菌丝生物量为(32.81±1.10) g·L−1。实际值与预测值相差较小,说明本研究建立的模型可对菌丝生物量进行预测,试验设计有效可靠。
2.6 液体菌种与固体菌种出菇试验
如表4所示,液体菌种制种周期仅需16 d,较固体菌种缩短了48 d。液体菌种接种后存在多个萌发位点,2 d后观察到菌丝萌发;固体菌种是从接种块向四周生长,萌发点较少,需4 d才能萌发。鹿茸菇菌丝在栽培基质中萌发时间长,发菌较慢,较其他食用菌更易被杂菌污染,抗杂菌能力更弱,污染率高,后期出菇产量低甚至不出菇。固体菌种萌发时间长、菌丝生长速率低,污染率达29.17%,远高于液体菌种。液体菌种在菌种制备和栽培周期方面均具有优势。
表 4 液体菌种和固体菌种栽培过程及出菇比较Table 4. Comparison of fermentation processes andmushroom fruiting using liquid and solid media指标
Index液体菌种
Liquid strain固体菌种
Solid strain原种培养时间 Original culture time/d 8 24 栽培种培养时间 Culture spawn incubation time/d 8 40 制种周期 Seed production cycle/d 16 64 菌丝萌发时间 Time of mycelium germination/d 2 4 满袋时间 Bags full time/d 42 45 污染率 Pollution rate/% 8.33 29.17 现蕾时间 Budding time/d 7 9 采收时间 Harvest time/d 25 27 单包产量 Single package output/g 500.89±20.12 432.00±25.36 子实体整齐度 Fruiting body uniformity +++ ++ 菇长 Length/cm 12.82±1.19 11.76±0.83 菇径 Size/mm 12.37±1.66 17.36±1.71 盖高 Height/mm 6.86±1.35 10.72±1.85 盖径 Diameter/mm 20.06±3.77 26.10±3.94 +++表示子实体整齐度较一致; ++表示子实体整齐度一致。
+++shows uniform fruiting body formation; ++acceptable fruiting body uniformity.如表4与图5所示,接种液体菌种的子实体整齐度较一致,单包产量和成品菇数量更高,产量较固体菌种提高15.74%。子实体农艺性状方面,接种液体菌种的子实体菇长略高于固体,而固体菌种的菇径、盖高和盖径均高于液体菌种,菌柄粗、菌盖大会影响荷叶离褶伞的口感,降低商品价值。
综合分析液体菌种和固体菌种的培养周期、出菇产量、子实体农艺性状等方面,液体菌种表现优异。因此采用本研究的培养基配方所制备的液体菌种可用于鹿茸菇工厂化栽培。
3. 讨论与结论
本研究经过分析4种廉价的复合碳源与2种昂贵的单一碳源、7种廉价的复合氮源与1种昂贵的复合氮源,发现廉价型的全麦粉与花生饼粉具有作为鹿茸菇液体菌种发酵主料的潜质。此外,本项研究发现鹿茸菇菌丝可利用的碳源、氮源种类极广,但更倾向于利用复合型碳氮源,与魏生龙等[14]研究结果较一致 。在本研究中,玉米粉与小麦粉作为碳源时,鹿茸菇菌丝生物量无显著性差异,该项结果与席亚丽等[18]的研究结果较一致 ,但本研究结果表明全麦粉作为碳源培养鹿茸菇液体菌丝的效果是小麦粉的2.2倍,说明麦壳和麸皮也具有促进液体菌丝生长发育的功能[17]。分析无机盐对鹿茸菇菌丝生长的影响,发现除Co2+与Cu2+显著抑制菌球生长之外,其他供试离子均具有正效应。该研究结果与魏生龙等[14]的研究结果存在一定差异,原因可能在于鹿茸菇平板菌丝与液体菌丝生长发育对离子的吸收利用情况不同[13]。在栽培过程中,鹿茸菇菌丝在栽培料中的快速定植是极为重要的一个环节,菌丝定植时间过长,容易出现高污染,这与程继红[21]所描述的情况极为相似。本研究利用单因素-响应面优化的培养基配方,在摇瓶培养时收获菌丝生物量可达32.81±1.10 g·L−1,该值是张凌珊[16]研究结果的40余倍,应用该配方制备的液体菌种与传统固体菌种相比,制种周期、污染率均大幅下降,单包产量提高15.74%,具有较大的生产应用潜能。
本研究结果最优配方为全麦粉47 g·L−1、花生饼粉22 g·L−1、KH2PO4 2.00 g·L−1、MgSO4·7H2O 2.00 g·L−1,当发酵培养至第8 d时,菌丝生物量达到最大值(32.81±1.10g·L−1),该配方可获得高质量的生产用种。尽管如此,该液体菌种配方优化尚处于发酵优化的小试阶段,后续关于接种量、发酵罐培养方式等技术参数有待进一步优化。此外,本研究结果表明以液体发酵方式制备鹿茸菇生产用种适合鹿茸菇工厂化生产。
-
表 1 Box-Behnken设计因素水平及编码
Table 1 Codes and levels of factors in Box-Behnken experiment
水平
Level因素 Factors/(g·L−1) A 全麦粉
Whole wheat flourB 花生饼粉
Peanut mealC 磷酸氢二钾
K2HPO4/D七水硫酸镁
MgSO4·7H2O/+1 55 24 2.25 2.25 0 50 22 2.00 2.00 −1 45 20 1.75 1.75 表 2 Box-Behnken试验设计及试验结果
Table 2 Design and results of Box-Behnken experiment
试验号
NumberA全麦粉
Whole wheat
flourB花生饼粉
Peanut
mealC磷酸氢
二钾
K2HPO4D七水
硫酸镁
MgSO4·7H2O菌丝生物量
Mycelium
biomass/
(g·L−1)1 −1 −1 0 0 29.61±1.18 2 +1 −1 0 0 29.90±1.45 3 −1 +1 0 0 32.27±1.11 4 +1 +1 0 0 28.77±2.01 5 0 0 −1 −1 30.79±1.28 6 0 0 +1 −1 29.41±1.88 7 0 0 −1 +1 28.00±0.30 8 0 0 +1 +1 30.21±1.09 9 −1 0 0 −1 31.72±2.12 10 +1 0 0 −1 29.37±1.63 11 −1 0 0 +1 30.20±2.00 12 +1 0 0 +1 29.11±2.51 13 0 −1 −1 0 29.29±4.29 14 0 +1 −1 0 30.00±0.68 15 0 −1 +1 0 30.20±1.45 16 0 +1 +1 0 30.11±4.80 17 −1 0 −1 0 30.00±2.97 18 +1 0 −1 0 30.17±4.12 19 −1 0 +1 0 32.48±0.21 20 +1 0 +1 0 28.73±4.01 21 0 −1 0 −1 30.09±4.38 表 3 二次回归方程方差分析
Table 3 ANOVA on quadratic regression equation
来源
Source平方和
SS自由度
DS均方
MSF P 显著性
Significance模型
Model0.7362 14 0.0526 98.95 <0.0001 ** A 0.0878 1 0.0878 165.28 <0.0001 ** B 0.0127 1 0.0127 23.85 0.0002 ** C 0.0074 1 0.0074 13.96 0.0022 ** D 0.0248 1 0.0248 0.31 <0.0001 ** AB 0.0358 1 0.0358 0.02 <0.0001 ** AC 0.0371 01 0.0371 6.12 <0.0001 * AD 0.0044 1 0.0044 0.32 0.0118 * BC 0.0015 1 0.0015 0.08 0.1114 BD 0.0011 1 0.0011 0.02 0.1702 CD 0.0327 1 0.0327 0.03 <0.0001 ** A2 0.1299 1 0.1299 169.26 <0.0001 ** B2 0.1974 1 0.1974 9.19 <0.0001 ** C2 0.2045 1 0.2045 127.92 <0.0001 ** D2 0.2302 1 0.2302 37.54 <0.0001 ** 残差
Residual0.0074 14 0.0005 失拟项
Lack of fit0.0047 10 0.0005 0.69 0.7126 纯误差
Pure error0.0027 4 0.0007 总和
Cor total0.7436 28 R2=0.9900 R2adj=0.9800 *表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
* indicates significant difference at P<0.05; ** extremely significant at P<0.01.表 4 液体菌种和固体菌种栽培过程及出菇比较
Table 4 Comparison of fermentation processes andmushroom fruiting using liquid and solid media
指标
Index液体菌种
Liquid strain固体菌种
Solid strain原种培养时间 Original culture time/d 8 24 栽培种培养时间 Culture spawn incubation time/d 8 40 制种周期 Seed production cycle/d 16 64 菌丝萌发时间 Time of mycelium germination/d 2 4 满袋时间 Bags full time/d 42 45 污染率 Pollution rate/% 8.33 29.17 现蕾时间 Budding time/d 7 9 采收时间 Harvest time/d 25 27 单包产量 Single package output/g 500.89±20.12 432.00±25.36 子实体整齐度 Fruiting body uniformity +++ ++ 菇长 Length/cm 12.82±1.19 11.76±0.83 菇径 Size/mm 12.37±1.66 17.36±1.71 盖高 Height/mm 6.86±1.35 10.72±1.85 盖径 Diameter/mm 20.06±3.77 26.10±3.94 +++表示子实体整齐度较一致; ++表示子实体整齐度一致。
+++shows uniform fruiting body formation; ++acceptable fruiting body uniformity. -
[1] 戴玉成, 周丽伟, 杨祝良, 等. 中国食用菌名录 [J]. 菌物学报, 2010, 29(1):1−21. DAI Y C, ZHOU L W, YANG Z L, et al. A revised checklist of edible fungi in China [J]. Mycosystema, 2010, 29(1): 1−21.(in Chinese)
[2] 程继红. 鹿茸菇的栽培现状与营养保健价值 [J]. 食药用菌, 2021, 29(1):12−15. CHENG J H. Cultivation status and its nutrition and health care value of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2021, 29(1): 12−15.(in Chinese)
[3] 程继红, 郑慧芬, 贲伟东, 等. 荷叶离褶伞工厂化栽培 [J]. 食用菌学报, 2008, 15(2):20−22. CHENG J H, ZHENG H F, BEN W D, et al. Industrial cultivation of Lyophyllum decastes [J]. Acta Edulis Fungi, 2008, 15(2): 20−22.(in Chinese)
[4] 木村荣一, 王建兵. 鹿茸菇的工厂化栽培 [J]. 食药用菌, 2019, 27(4):237−240. Eiichi K, WANG J B. Industrial cultivation of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2019, 27(4): 237−240.(in Chinese)
[5] 管婉, 陈业桥, 唐利华, 等. 食用菌液体菌种的制备及应用研究概况 [J]. 食用菌, 2021, 43(5):5−7. GUAN W, CHEN Y Q, TANG L H, et al. General situation of preparation and application of liquid strains of edible fungi [J]. Edible Fungi, 2021, 43(5): 5−7.(in Chinese)
[6] 徐来清, 张书祥. 假蜜环菌发酵工艺的优化研究 [J]. 生物学杂志, 2014, 31(3):91−94. XU L Q, ZHANG S X. The optimization of the fermentation technology of Armillariella tabescens [J]. Journal of Biology, 2014, 31(3): 91−94.(in Chinese)
[7] 刘敏, 卢红, 黄媛媛, 等. 茶树菇液体发酵条件研究 [J]. 北方园艺, 2016(11):142−144. LIU M, LU H, HUANG Y Y, et al. Study on the liquid fermentation condition of agrocybeaegerita(brig. ) sing [J]. Northern Horticulture, 2016(11): 142−144.(in Chinese)
[8] FENG Y L, LI W Q, WU X Q, et al. Statistical optimization of media for mycelial growth and exo-polysaccharide production by Lentinus edodes and a kinetic model study of two growth morphologies [J]. Biochemical Engineering Journal, 2010, 49(1): 104−112. DOI: 10.1016/j.bej.2009.12.002
[9] 杨丽维, 王玉, 班立桐, 等. 杏鲍菇液体菌种培养基的筛选和优化 [J]. 北方园艺, 2014(6):150−152. YANG L W, WANG Y, BAN L T, et al. Study on the screening and optimizing of liquid spawn medium of Pleurotus eryngii [J]. Northern Horticulture, 2014(6): 150−152.(in Chinese)
[10] BOX G E P. Statistics for Experiments: An Introduction to Design, Data Analysis and Model Building [M]. New York: Wiley, 1990.
[11] HUMFELD H. The production of mushroom Mycelium (Agaricus campestris) in submerged culture [J]. Science, 1948, 107(2780): 373. DOI: 10.1126/science.107.2780.373
[12] 刘启燕, 戚俊, 周洪英, 等. 食用菌液体菌种工厂化生产应用现状及发展浅析 [J]. 食用菌, 2018, 40(6):8−10, 22. DOI: 10.3969/j.issn.1000-8357.2018.06.003 LIU Q Y, QI J, ZHOU H Y, et al. Present situation and development tendency of using liquid spawn of edible mushrooms in industrialized production [J]. Edible Fungi, 2018, 40(6): 8−10, 22.(in Chinese) DOI: 10.3969/j.issn.1000-8357.2018.06.003
[13] 李立功. 荷叶离褶伞研究进展 [J]. 中国林副特产, 2019(1):79−81, 90. LI L G. Research progress of Lyophyllum decastes [J]. Forest by-Product and Speciality in China, 2019(1): 79−81, 90.(in Chinese)
[14] 魏生龙, 王治江, 于海萍, 等. 荷叶离褶伞生物学特性研究 [J]. 菌物学报, 2006, 25(1):101−108. WEI S L, WANG Z J, YU H P, et al. Biological characteristics of Lyophyllum decastes (Fr. : Fr. ) singer [J]. Mycosystema, 2006, 25(1): 101−108.(in Chinese)
[15] 魏生龙, 连海丽, 于海萍, 等. 矿质营养与其他生长物质对荷叶离褶伞菌丝生长的影响 [J]. 菌物学报, 2008, 27(2):201−208. WEI S L, LIAN H L, YU H P, et al. The influence of mineral nutritions and other growth substances on the growth of mycelia of Lyophyllum decastes [J]. Mycosystema, 2008, 27(2): 201−208.(in Chinese)
[16] 张凌姗. 鹿茸菇生态学特性与液体菌种配方的优化研究 [J]. 食药用菌, 2020, 28(6):425−427,439. ZHANG L S. Study on ecological characteristics and optimization of liquid spawn formula of Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2020, 28(6): 425−427,439.(in Chinese)
[17] 张汉燚, 王治江, 席亚丽, 等. 荷叶离褶伞中试发酵条件与培养基优化研究 [J]. 中国酿造, 2012, 31(1):96−99. ZHANG H Y, WANG Z J, XI Y L, et al. Optimization of fermentation conditions and medium components for pilot production of Lyophyllum decastes [J]. China Brewing, 2012, 31(1): 96−99.(in Chinese)
[18] 席亚丽, 王治江, 魏生龙, 等. 荷叶离褶伞摇瓶发酵条件研究 [J]. 河西学院学报, 2011, 27(2):68−74,57. XI Y L, WANG Z J, WEI S L, et al. Study on fermentation conditions of Lyophyllum decastes in shake flask [J]. Journal of Hexi University, 2011, 27(2): 68−74,57.(in Chinese)
[19] 徐长毫, 董冰雪, 李长杰, 等. 响应面法优化灵芝AM21菌株液体深层发酵培养基配方 [J]. 食用菌学报, 2011, 18(4):31−36. XU C H, DONG B X, LI C J, et al. Optimization of fermentation medium for triterpenoid production by Ganoderma lucidum AM21 using response surface methodology [J]. Acta Edulis Fungi, 2011, 18(4): 31−36.(in Chinese)
[20] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用 [J]. 实验室研究与探索, 2015, 34(8):41−45. LI L, ZHANG S, HE Q, et al. Application of response surface methodology in experiment design and optimization [J]. Research and Exploration in Laboratory, 2015, 34(8): 41−45.(in Chinese)
[21] 程继红. 名贵食药用菌鹿茸菇商业化生产现状与发展前景 [J]. 食药用菌, 2014, 22(4):194−197. CHENG J H. The commercial production situation and prospects of the new valuable edible and medicinal mushroom, Lyophyllum decastes [J]. Edible and Medicinal Mushrooms, 2014, 22(4): 194−197.(in Chinese)
-
期刊类型引用(5)
1. 周静,张馨,赵兴秀,何义国,陈雨,张靖. 长裙竹荪液体培养基优化. 食用菌. 2024(03): 9-13+16 .  百度学术
百度学术
2. 金文松,李建华,单灿灿,吴涛锐,程泳春,程利纹,李佳欢,孙淑静,胡开辉. 鹿茸菇菌包后熟指标与出菇产量间的相关性. 福建农林大学学报(自然科学版). 2024(04): 563-569 .  百度学术
百度学术
3. 彭汇涵,于海玲,王明元,杨苗,万雨欣. 鹿茸菇液体菌种培养过程中生理指标的变化规律. 华侨大学学报(自然科学版). 2024(05): 667-672 .  百度学术
百度学术
4. 龚娜,刘国丽,陈珣,马晓颖,肇莹,肖军. 一株野生肺形侧耳的鉴定及其液体发酵培养基的优化. 浙江农业学报. 2024(11): 2535-2545 .  百度学术
百度学术
5. 陈珣,肇莹,龚娜,刘国丽,马晓颖,张敏,肖军. 基于响应面法优化滑菇液体菌种发酵培养基配方. 南方农业学报. 2024(12): 3625-3635 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: