Growth and Saline-tolerance of Quinoa Seeds and Seedlings under Salt Stress
-
摘要:目的 探究盐胁迫对藜麦生长发育及生理特性的影响,并研究3种抗逆基因在藜麦中的响应模式。方法 以藜麦品种Temuco为材料,用不同浓度NaCl溶液(0、200、 450 mmol·L−1)处理藜麦种子和盆栽幼苗,通过测定种子萌发和幼苗生理指标、成熟植株农艺性状、种子营养成分含量,以及SOD、 POD、BADH基因的时空表达,明确不同浓度NaCl胁迫对藜麦种子萌发、幼苗生长和种子品质的影响,以及3种抗逆基因对不同盐胁迫的响应。结果 (1)在高浓度NaCl(450 mmol·L−1)胁迫下藜麦种子发芽和植株生长均受到明显抑制,影响种子N元素的吸收,Na+/K+比率显著上升,超氧化物歧化酶(SOD)和过氧化物酶(POD)的酶活性显著下降,而丙二醛(MDA)含量明显高于对照。低浓度NaCl(200 mmol·L−1)胁迫有助于藜麦生长发育,除发芽指数下降外,种子活力指数和鲜重显著增加,各营养元素含量不受影响且略有上升,诱导SOD和POD酶活性显著增加,MDA含量与对照相比无明显差别。(2)可溶性糖和脯氨酸含量在200 mmol·L−1和450 mmol·L−1两个盐浓度下,与对照相比较均有显著增加,可溶性糖的增幅分别为68.06%和41.67%,脯氨酸含量的增幅分别为237.38%和189.97%。两者均随着盐浓度的增加呈现先上升后下降的趋势。(3)SOD、POD和BADH三个抗逆基因在高浓度盐胁迫下表达量响应模式存在组织特异性和耐盐敏感性差异。BADH和SOD基因在根部组织中的表达量高于茎部和叶片,而POD基因则在叶片组织中的表达量最高,根部最低。结论 高盐胁迫会影响藜麦Temuco种子的营养成分,使其萌发和生长受到抑制;基因的时间动态表达水平表明,在200 mmol·L−1和450 mmol·L−1两个盐浓度下,BADH均较POD和SOD对盐胁迫的响应更为迅速和敏感,因此BADH基因的表达量水平和响应速度可作为藜麦耐盐种质筛选的标记之一。本研究对藜麦的耐盐机制的深入和耐盐种质的选育提供了理论依据。Abstract:Objective Germination, growth, and physiology of quinoa seeds and seedlings under salt stress were analyzed.Method Temuco Quinoa seeds and potted seedlings were treated with NaCl solutions of different concentrations (i.e., 0, 200, and 450 mmol·L−1). Physiological indexes on seed germination and seedling growth, agronomic traits of mature plants, contents of nutrients in the seeds or seedlings, and spatial-temporal expression of SOD, POD, and BADH in the seedlings, were monitored to determine the effects of the imposed salt stress.Result (1) Quinoa seed germination and seedling growth were significantly inhibited by the high NaCl concentration at 450 mmol·L−1. The N-uptake was ill-affected, the Na+/K+ ratio significantly increased, the activities of superoxide dismutase (SOD) and peroxidase (POD) significantly decreased, while malondialdehyde (MDA) content significantly higher than that of control. However, under 200 mmol NaCl·L−1, the quinoa plants grew and developed well. Aside from a declined germination index, the seed vigor index and fresh seedling weight were significantly increased, the content of all nutrients slightly raised, and the SOD and POD activities significantly elevated without a significant difference in MDA over control. (2) Under the salt stress of 200 mmol·L−1 and 450 mmol·L−1, the soluble sugar content increased by 68.06% and 41.67%, and the proline by 237.38% and 189.97%, respectively. As the salt concentration increased, they share a similar trend of firstly increasing then a decline. (3) In response to salt stress, BADH and SOD were more highly expressed in the root tissues than in the stems and leaves, while POD was highest in the leaves and lowest in the roots.Conclusion High salt concentration at 450 mmol·L−1 ill-affected the nutrient content in Temuco quinoa seeds, inhibited the germination, and hindered the seedling development. The temporal expression of BADH was more rapid and sensitive to salt stress than those of POD and SOD at either 200 mmol·L−1 or 450 mmol·L−1. Consequently, it could be served as an indicator in screening salt-tolerant quinoa germplasms.
-
Keywords:
- Quinoa /
- physiology /
- resilience genes /
- salt tolerance mechanism
-
0. 引言
【研究意义】土壤盐渍化已成为影响全球环境问题并严重影响作物生产安全[1]。过量的盐分迫使植物根系吸收大量的钠(Na+)和氯(Cl−),从而干扰钾(K+)稳态,影响细胞活性、代谢和光合作用,导致活性氧(ROS)的积累,并产生渗透胁迫和离子毒性,从而导致植株无法正常生长[2]。培育耐盐作物是有效利用盐碱地和解决农作物盐胁迫问题的可行途径[3]。藜麦(Chenopodium quinoa Willd.),又称南美藜、藜谷、奎奴亚藜等,属于藜科藜属的双子叶植物,距今已有七千余年的种植历史[4]。藜麦的营养价值极高,含有丰富的蛋白质、维生素、矿物质,以及一些人体所必需的氨基酸与多酚,藜麦的氨基酸组成与人体的氨基酸需求相似且优于很多谷物[5]。除此之外,藜麦的抗盐碱、抗干旱和抗病虫害等能力强,植株在高海拔、寒冷、土壤贫瘠情况下仍能生长良好,被认为未来最具有潜力的作物之一[6]。因此,精心选育具有高强抗性的藜麦新品种,进一步促进盐碱地生物改良,保障粮食安全,具有重大的现实意义。【前人研究进展】藜麦作为一种兼性盐生植物,具有天然的耐盐碱能力,其耐盐机制受多方面的控制[7-8]。有研究表明藜麦耐盐通过Na+/H+逆向转运蛋白(NHX) 将Na+在液泡中区隔化、有效的液泡和木质部K+浓度的保持、较高的活性氧(ROS)耐受性以及对气孔发育的有效控制等,从而能在盐碱地较正常生存[9]。许多研究表明,超氧化物歧化酶(SOD)、过氧化物酶(POD)、甜菜碱醛脱氢酶(BADH)、脯氨酸、可溶性糖等在植物对抗逆境胁迫过程中起到了非常重要的作用[10]。【本研究切入点】对藜麦在盐逆境胁迫下的研究,国内外多集中在不同品种藜麦的耐盐性鉴定以及不同盐浓度对藜麦种子的活力和相关生理生化特性的影响,但对盐胁迫处理后相关耐盐基因的表达量变化情况却鲜有报道。【拟解决的关键问题】通过探讨不同浓度盐胁迫对藜麦种子发芽率和幼苗生理特性的影响,以及盐胁迫下SOD、POD的酶活性及其BADH基因时空表达模式和不同盐胁迫下藜麦农艺性状的影响,以期为藜麦的推广应用、盐碱地改良及植物耐盐机理研究提供理论基础。
1. 材料与方法
1.1 种子萌发及植株培养条件
选田间农艺形状优良的藜麦品种Temuco种子,75%酒精消毒后用蒸馏水洗净。用0、200、450 mmol·L−1 NaCl溶液处理24h,将处理后的种子置于发芽盒中,每盒100粒种子,每个盐浓度重复3次。每盒分别加入50 mL上述各溶液后,将所有发芽盒置于光照培养箱(宁波莱福科技有限公司)中,培养条件设置如下。阶段1:光照100%,温度25 ℃,16 h;阶段2:光照0,温度20 ℃,8 h。以24 h为一个循环,每天统计发芽数,计算发芽势和发芽率。第15天每个重复取5株幼苗测定鲜重和株高并测定叶片的生理生化指标,同时取根、茎、叶组织测定不同部位下SOD、POD和BADH基因的表达量差异。
幼苗期瞬时盐处理:挑取蒸馏水条件下发芽第15天长势一致的幼苗,分别用0、200、450 mmol·L−1NaCl溶液处理,由于幼苗的瞬时处理在根部受到的影响最为直接,选择在0、2、6、12、24 h取根部的组织样品,分别测定SOD、 POD和BADH基因的表达量。
成熟植株培养和处理:另取Temuco饱满种子100颗种于盆钵,每钵1颗,置于塑料大棚内。幼苗长至8片真叶时,将相同量的0、200、450 mmol·L−1 3个浓度NaCl溶液倒入试验所选长势一致的幼苗土壤中,所有盆底部装上底托,有水溢出则再次倒入土壤中。每个浓度处理8株幼苗,每个处理重复3次。
1.2 生理生化指标及元素测定方法
分别选取发芽盒中第15天各处理的幼苗子叶,称重后用锡箔纸包好放入液氮中,转至超低温冰箱(−80 ℃)中保存,用于SOD、POD、MDA、脯氨酸和可溶性糖等指标的测定。SOD活性的测定采用氮蓝四唑(NBT)法[11],POD活性测定采用愈创木酚法[11],可溶性糖含量采用苯酚-硫酸法[11],脯氨酸含量测定采用茚三酮法[11],MDA含量的测定采用硫代巴比妥酸法[11]。
盆钵藜麦植株在成熟初期时测定农艺性状。叶面积采用任永峰等[12]的方法测定,叶片相对含水量测定用加热烘干法;待植株完全成熟后收获种子,去杂质和脱粒处理后置于干燥环境中5 d,挑选饱满种子。千粒重依据国家标准GB/T 5519-2008进行测定[12]。
种子的各元素含量采用原子吸收分光光度计法[13],硫含量测定采用硫酸钡比浊法[14],碳含量测定采用干烧法[15],氮含量测定采用凯氏定氮法[16]。钠钾比测定采用Hans等[17]的方法。
1.3 荧光定量PCR(qPCR)检测基因相对表达量
Trizol试剂快速提取法提取RNA,DNase I消化去除DNA污染后,取3 µg RNA作为模板,以Oligo d(T)18为引物,使用M-MLV反转录酶(TaKaRa公司,日本)合成cDNA。通过比对GenBank核酸序列数据库中已公布物种(菠菜、拟南芥和甜菜)的cDNA序列和基因组DNA序列,于基因的保守区域设计引物。PCR扩增产物经DNA凝胶回收试剂盒纯化(Axygen公司,美国)回收并连接至pMD18-T载体(Takara公司,日本)后送华大基因测序部测序。根据测序获得的藜麦的cDNA序列信息,设计特异性的基因表达引物(表1)。BioRad CFX connect™ real-time PCR System (BioRad, USA)用于进行荧光定量PCR,酶试剂为SuperReal Premix Plus with SYBR Green I(天根公司,中国)。
表 1 藜麦3种基因扩增引物Table 1. Amplification primers of 3 quinoa genes引物名称
Name正向引物
Forward primer反向引物
Reverse primer用途
UseBADH-1 CTGAAGAAATCATCGGTGATATTC TCAAGGAGACTTGTACCATC BADH cDNA片段扩增 BADH-2 GCATTTGAAGAAAGGGTA CACTACGCTTGACTCCTCCC BADH基因定量PCR POD-1 GGATGTGATGCATCAGTACTAGTAG GACAACAGCATCTCTAGCAGC POD cDNA片段扩增 POD-2 GATTCAACTCCAGGAAACACA CAGCATCTCTAGCAGCATAGG POD基因定量PCR SOD-1 AACCACTCAATTTTCTGGAAGA AGTATGCATGCTCCCAAACATC SOD cDNA片段扩增 SOD-2 TGATTTGGAGTGGTTTCAAC CAATTAGTCAAGGAGGTGGT SOD基因定量PCR 相对表达量以GAPDH基因为内参进行靶基因的标准化,用2−ΔΔ Ct法来分析试验数据。
Δ Ct=Ct(靶基因)−Ct(GADPH)
ΔΔ Ct=Δ Ct(试验组)−Δ Ct(对照组)
1.4 数据处理
所有数据均取3个重复的平均值,SPSS(19.0)软件进行单因素方差(ANOVA)统计分析,差异显著性定义为P<0.05,Excel(2019)软件制作相应图表。已知物种的基因序列使用NCBI在线软件BLASTN检索(http://ncbi.nlm.nih.gov)下载,序列比对使用软件MEGA 5.0,引物设计使用软件Primer 5.0。
2. 结果与分析
2.1 不同NaCl浓度对藜麦种子萌发的影响
从表2可知,在200 mmol·L−1 NaCl浓度处理下,相比对照而言,种子的发芽率、发芽势和株高均无显著差异;在450 mmol·L−1 NaCl浓度下,发芽率和发芽势相比对照分别显著下降50.50%和73.86%,苗期株高相比对照显著下降40.31%。发芽指数随浓度上升显著下降。活力指数和鲜重均在200 mmol·L−1 NaCl浓度时最高,较对照增幅分别为47.87%和90.91%;在450 mmol·L−1 NaCl浓度下,活力指数相比对照下降80.18%,鲜重则和对照之间差异不显著。该试验结果表明高盐浓度会抑制藜麦的发芽以及幼苗活力,低盐环境有利于提高藜麦的活力指数。
表 2 不同NaCl浓度对藜麦种子Temuco萌发的影响Table 2. Quinoa seed germination affected by NaCl stressNaCl浓度
NaCl concentration/( mmol·L−1)发芽率
Germination rate/%发芽势
Germination potential/%发芽指数
Germination index活力指数
Vitality Index株高
Plant height/cm鲜重
Fresh weight/g0 85.40 a 78.72 a 16.53 a 3.28 b 3.87 a 0.22 b 200 80.34 a 72.52 a 11.93 b 4.85 a 4.21 a 0.42 a 450 42.27 b 20.58 b 3.82 c 0.65 c 2.31 b 0.19 b 同列数据后不同小写字母表示同一指标在不同浓度下差异显著(P<0.05),下同。
Data with different lowercase letters on same column indicate significant differences on same indicator at different concentrations (P<0.05). Same for below.2.2 不同NaCl浓度对成熟植株农艺性状的影响
考察成熟的藜麦植株的农艺性状,有助于鉴定植株适应性、抗逆性和丰产性。由表3可知,450 mmol·L−1 NaCl浓度下,株高、叶面积和叶片相对含水量与对照相比,分别显著下降了16.09%、15.88%和12.35%,说明高盐浓度下藜麦植株的生长发育受到明显抑制。而200 mmol·L−1 NaCl浓度盐处理下株高、叶面积、千粒重和叶片相对含水量与对照处理间均无显著差异。
表 3 Temuco成熟期不同浓度盐胁迫下农艺性状Table 3. Agronomic characteristics of Temuco quinoa under salt stress at mature stageNaCl浓度
NaCl concentration/(mmol·L−1)株高
Plant height/cm叶面积
leaf area/cm2叶片相对含水量
Relative water content of leaves/%千粒重
thousand kernel weight/g0 157.2 a 952.3 a 91.5 a 4.11 a 200 155.6 a 947.8 a 87.7 a 4.02 a 450 131.9 b 801.1 b 80.2 b 4.08 a 2.3 不同NaCl浓度胁迫下种子元素含量变化
由表4可知,在450 mmol·L−1 NaCl浓度下,藜麦种子的N元素含量与对照相比显著降低16.21%,N元素是种子内部各种有机物的重要组成成分,该结果表明高盐胁迫会显著影响种子内部有机物的合成运输等过程,此外其他元素的含量无明显变化;在200 mmol·L−1 NaCl浓度下,各个元素含量与对照相比均无显著差异。
表 4 Temuco种子各元素成分含量Table 4. Contents of elements in Temuco seedsNaCl浓度
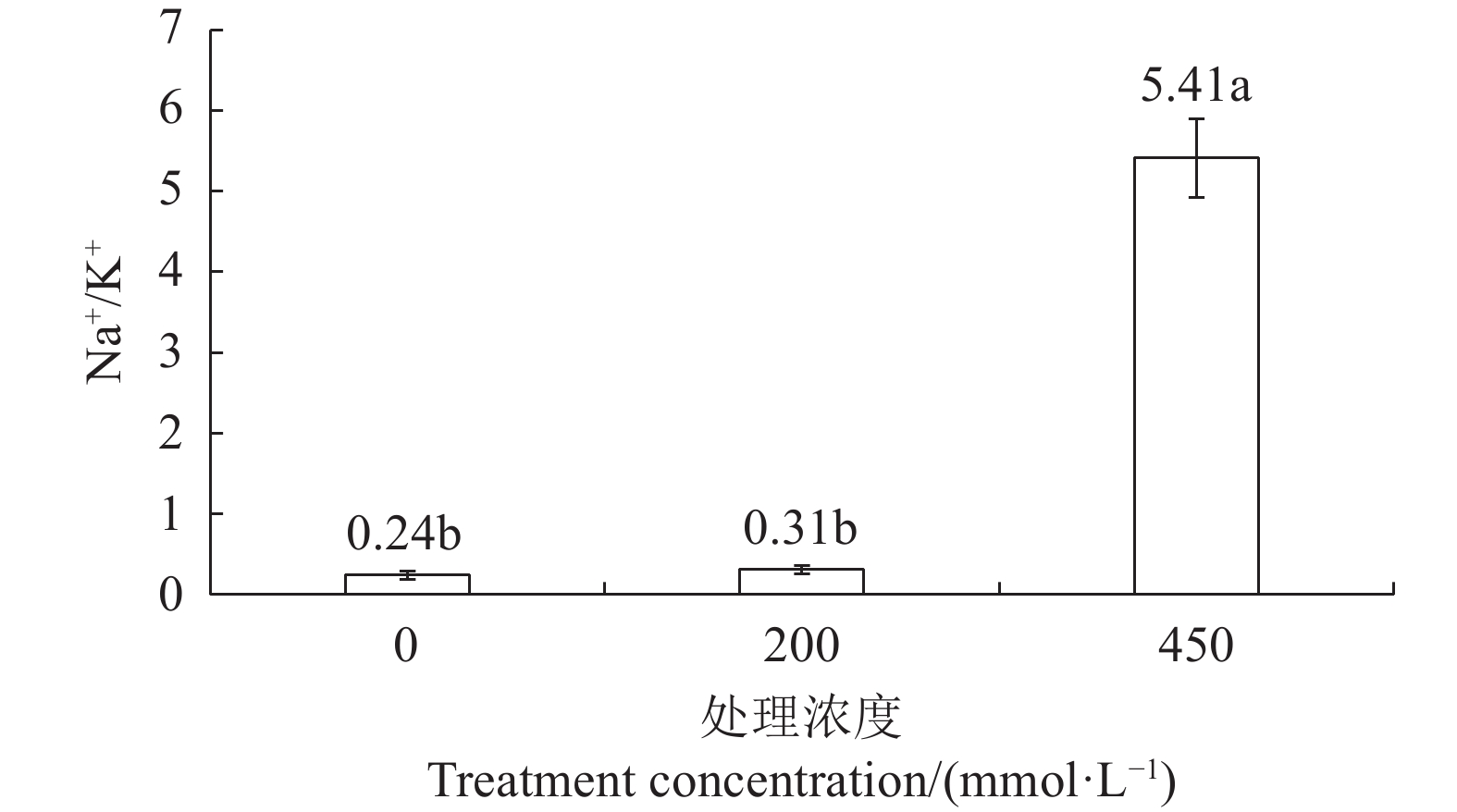
NaCl concentration/(mmol·L−1)N/% C/% S/% Fe/(mg·g−1) Cu/(mg·g−1) Ca/(mg·g−1) Mg/(mg·g−1) 0 3.27 a 44.82 a 0.20 a 0.058 a 0.005 a 8.592 a 1.784 a 200 3.41 a 45.03 a 0.23 a 0.060 a 0.006 a 8.439 a 1.692 a 450 2.74 b 44.91 a 0.21 a 0.057 a 0.006 a 8.682 a 1.729 a 图1中横坐标为NaCl浓度,纵坐标为Na+/K+比。结果表明低浓度盐胁迫下Na+/K+比率与对照相比没有发生显著变化,在高浓度盐胁迫处理下Na+/K+比率显著上升。Na+/K+比率可以作为检测种子活力的敏感指标,该结果表明高浓度盐胁迫会显著降低藜麦的种子活力,而低盐胁迫对藜麦种子活力并无明显影响。低浓度下Na+/K+比率没有显著变化,在高浓度时Na+/K+比率显著上升,这说明450 mmol·L−1高浓度NaCl可迫使Na+离子大量进入藜麦种子细胞,而藜麦种子对于低浓度NaCl不敏感。
2.4 不同NaCl浓度下幼苗叶片生理生化指标的变化
随着盐浓度的增加,幼苗SOD、POD活性呈现出先上升后下降的单峰变化趋势(表5)。在200 mmol·L−1 NaCl浓度下,SOD和POD的酶活性分别达到最高值138.75 U·g−1·min−1和96.37 U·g−1·min−1 ,与对照相比分别显著提高了20.48%和27.95%;在450 mmol·L−1 NaCl浓度时,SOD和POD的活性与对照相比分别显著下降了20.04%和29.26%(表5)。可溶性糖和脯氨酸含量在200 mmol·L−1和450 mmol·L−1两个盐浓度下,与对照相比较均有显著增长,可溶性糖的增幅分别为68.06%和41.67%,脯氨酸含量的增幅分别为237.38%和189.97%。但在高盐浓度下,可溶性糖的含量相较于低盐浓度显著降低,脯氨酸含量无显著变化,两者均呈现出先增长后逐渐下降的趋势,同时可看出脯氨酸对NaCl浓度的耐受性要强于可溶性糖(表5)。
表 5 不同NaCl浓度处理后幼苗叶片生理生化指标Table 5. Physiochemical indexes of seedling leaves treated with NaCl solutions of varied concentrationsNaCl浓度
NaCl concentration/
( mmol·L−1)SOD活性
SOD Activity/
(U·g−1·min−1)POD活性
POD Activity/
(U·g−1·min−1)可溶性糖含量
Soluble suger content/
(mg·g−1)脯氨酸含量
Proline content/
(μg·g−1)MDA含量
MDA content/
(μmol·g−1)0 115.16 b 75.32 b 7.20 c 25.12 b 3.42 b 200 138.75 a 96.37 a 12.10 a 84.75 a 3.54 b 450 92.08 c 53.28 c 10.20 b 72.84 a 5.57 a MDA含量可以反映细胞膜脂质过氧化作用水平。由表5可知,当NaCl浓度达200 mmol·L−1时,MDA含量略有上升但未达显著,当NaCl浓度达到450 mmol·L−1时,MDA含量较对照显著提高62.87%。说明高盐浓度会使藜麦细胞内活性氧不断升高,细胞膜逐渐受到破坏。
2.5 BADH、SOD和POD基因在不同盐浓度下的表达情况
在不同的盐浓度和不同的组织部位,藜麦的BADH、SOD和POD 3个基因存在不同的表达形式(图2)。从图2可知,BADH基因表达主要集中在根部,在200 mmol·L−1和450 mmol·L−1的NaCl浓度下均表现出显著的上升;SOD基因表达响应也主要在根部,其表达量在200 mmol·L−1盐浓度显著升高,后在450 mmol·L−1盐浓度时呈现显著下降;POD基因的表达的主要部位为茎叶,其表达量随盐浓度增加先上升后下降。
取根部的组织进行动态基因表达水平测定,结果表明(图3A),在200 mmol·L−1盐浓度胁迫下,BADH和POD的表达量于盐处理2 h时后有所增加,整体呈现上升倾向,至24 h时仍处于上升趋势,SOD在该浓度下随时间变化不大;在450 mmol·L−1盐浓度条件下,BADH表达量在处理后的2 ~12 h显著增加,但在24 h时出现急剧下降;SOD和POD在该浓度下无显著变化。这说明这三者基因对盐浓度的敏感性和反应速度均存在差异。
3. 讨论与结论
藜麦是一种兼性盐生植物,现有2500多份种质资源,不同资源之间的耐盐能力有差异,有些品种能耐受高达海水的盐浓度(约500 mmol·L−1 NaCl)[18-19]。藜麦种质Temuco原产地南美,植株茎叶绿色,种子土黄色,田间农艺性状表现优良。本研究结果发现在低盐(200 mmol·L−1 NaCl)环境下有助于藜麦Temuco生长,而在450 mmol·L−1盐浓度下,Temuco种子的发芽率、发芽势、发芽指数、活力指数和株高均呈现显著下降,成株的株高、叶面积和叶片相对含水量也显著降低,显然细胞的生长受到了阻挠和迫害;同时,MDA含量急剧上升,说明细胞活性氧增加,氧化反应加剧,细胞膜受到破坏[20];抗氧化酶SOD和POD活性在该浓度下也显著下降,表明高盐环境下细胞活力下降,酶活性受到影响;此外高盐明显降低了植株对N元素的吸收,Na+/K+比率显著上升,从而降低蛋白质合成和酶促反应的活性。但是在200 mmol·L−1低盐浓度下,除发芽指数有所下降外,Temuco的种子活力指数和鲜重出现显著增加,且各个营养元素还略有上升趋势,这说明低盐含量有利于藜麦的生长发育;在该浓度下SOD、POD、可溶性糖和脯氨酸等均增加,表明低盐浓度胁迫下藜麦植株通过抗氧化酶活性增强用已清除植株体内产生的自由基,以及积累渗透调节物质以抵抗盐胁迫的伤害。
藜麦的SOD、POD、可溶性糖和脯氨酸均参与对抗盐胁迫,但对盐耐受程度不同。随着盐浓度的增加,这四种成分都随之增加,说明它们对盐胁迫均有响应;但是SOD和POD对盐耐受浓度小于450 mmol·L−1,而可溶性糖和脯氨酸对盐耐受浓度大于450 mmol·L−1。这说明,在Temuco细胞的耐盐机制中,渗透保护剂的耐受能力要大于抗氧化酶体系。
藜麦抗逆基因的表达存在组织特异性。BADH和SOD基因在藜麦的根部位置表达较多。根部是植株盐分吸收的直接接触部位,也是盐胁迫以及其导致的活性氧产生的最强位置,这说明BADH和SOD具有局部靶标效应;而POD基因的主要表达位置在叶片和茎秆,这可能跟其功能是清除过氧化物有关[21],因此其作用发挥较BADH和SOD的物理位置上要延后。
BADH基因对NaCl胁迫更为敏感,反应更为迅速。从时间动态表达上可以看到,在低盐浓度下,BADH和POD反应敏感;在450 mmol·L−1高盐环境下,BADH依然反应迅速,但是POD和SOD基本无响应。BADH是渗透压调节的关键中间酶,当细胞内外压强出现顺逆差时,BADH基因会迅速反应以调整细胞渗透调节物质GB的含量,Jacobsen等[7]和Ruffino等[22]也报道过藜麦通过增加细胞内甜菜碱、脯氨酸等渗透调节物质来维持细胞膨压。同时,过高的盐浓度会抑制酶活性,15 d的幼苗在450 mmol·L−1盐浓度瞬时处理下,POD和SOD基本无反应,这说明POD和SOD合成通路上的上游酶可能已经提前失活。因此可以将BADH基因的表达量水平和响应速度作为藜麦耐盐种质筛选的标记之一。
相同盐浓度下不同的胁迫方式对藜麦生长发育的影响不同。本试验使用3种不同的盐胁迫方式,观察发现:a)在450 mmol·L−1盐浓度下,瞬时盐处理第15天的幼苗,12 h后幼苗开始萎蔫并在24 h后基本处于失水状态;b)从种子萌发开始就一直处于高盐胁迫环境下的藜麦,尽管生长受到抑制,但依然可以存活,说明藜麦在从种子萌发到组织分化的整个生长过程中有充分的自我调整时间以适应高盐环境;c)等待成株后再进行盐处理则植株对高盐的耐受性较强,其生长发育也受抑制,但仍可以完成生命历程。因此,在藜麦的引种或是耐盐品种的培育过程中,要注意移栽的时间以及处理方式的合理选择。
藜麦是未来最具潜力的农作物之一,而芽期和苗期是盐胁迫对于藜麦的影响的两个关键时期[17]。本研究对藜麦种质Temuco在不同NaCl浓度下的生理生化特性及抗逆基因的不同响应模式进行了探讨,为进一步深入研究藜麦的耐盐机制和耐盐种质的选育提供理论基础。
-
表 1 藜麦3种基因扩增引物
Table 1 Amplification primers of 3 quinoa genes
引物名称
Name正向引物
Forward primer反向引物
Reverse primer用途
UseBADH-1 CTGAAGAAATCATCGGTGATATTC TCAAGGAGACTTGTACCATC BADH cDNA片段扩增 BADH-2 GCATTTGAAGAAAGGGTA CACTACGCTTGACTCCTCCC BADH基因定量PCR POD-1 GGATGTGATGCATCAGTACTAGTAG GACAACAGCATCTCTAGCAGC POD cDNA片段扩增 POD-2 GATTCAACTCCAGGAAACACA CAGCATCTCTAGCAGCATAGG POD基因定量PCR SOD-1 AACCACTCAATTTTCTGGAAGA AGTATGCATGCTCCCAAACATC SOD cDNA片段扩增 SOD-2 TGATTTGGAGTGGTTTCAAC CAATTAGTCAAGGAGGTGGT SOD基因定量PCR 表 2 不同NaCl浓度对藜麦种子Temuco萌发的影响
Table 2 Quinoa seed germination affected by NaCl stress
NaCl浓度
NaCl concentration/( mmol·L−1)发芽率
Germination rate/%发芽势
Germination potential/%发芽指数
Germination index活力指数
Vitality Index株高
Plant height/cm鲜重
Fresh weight/g0 85.40 a 78.72 a 16.53 a 3.28 b 3.87 a 0.22 b 200 80.34 a 72.52 a 11.93 b 4.85 a 4.21 a 0.42 a 450 42.27 b 20.58 b 3.82 c 0.65 c 2.31 b 0.19 b 同列数据后不同小写字母表示同一指标在不同浓度下差异显著(P<0.05),下同。
Data with different lowercase letters on same column indicate significant differences on same indicator at different concentrations (P<0.05). Same for below.表 3 Temuco成熟期不同浓度盐胁迫下农艺性状
Table 3 Agronomic characteristics of Temuco quinoa under salt stress at mature stage
NaCl浓度
NaCl concentration/(mmol·L−1)株高
Plant height/cm叶面积
leaf area/cm2叶片相对含水量
Relative water content of leaves/%千粒重
thousand kernel weight/g0 157.2 a 952.3 a 91.5 a 4.11 a 200 155.6 a 947.8 a 87.7 a 4.02 a 450 131.9 b 801.1 b 80.2 b 4.08 a 表 4 Temuco种子各元素成分含量
Table 4 Contents of elements in Temuco seeds
NaCl浓度
NaCl concentration/(mmol·L−1)N/% C/% S/% Fe/(mg·g−1) Cu/(mg·g−1) Ca/(mg·g−1) Mg/(mg·g−1) 0 3.27 a 44.82 a 0.20 a 0.058 a 0.005 a 8.592 a 1.784 a 200 3.41 a 45.03 a 0.23 a 0.060 a 0.006 a 8.439 a 1.692 a 450 2.74 b 44.91 a 0.21 a 0.057 a 0.006 a 8.682 a 1.729 a 表 5 不同NaCl浓度处理后幼苗叶片生理生化指标
Table 5 Physiochemical indexes of seedling leaves treated with NaCl solutions of varied concentrations
NaCl浓度
NaCl concentration/
( mmol·L−1)SOD活性
SOD Activity/
(U·g−1·min−1)POD活性
POD Activity/
(U·g−1·min−1)可溶性糖含量
Soluble suger content/
(mg·g−1)脯氨酸含量
Proline content/
(μg·g−1)MDA含量
MDA content/
(μmol·g−1)0 115.16 b 75.32 b 7.20 c 25.12 b 3.42 b 200 138.75 a 96.37 a 12.10 a 84.75 a 3.54 b 450 92.08 c 53.28 c 10.20 b 72.84 a 5.57 a -
[1] VAN ZELM E, ZHANG Y X, TESTERINK C. Salt tolerance mechanisms of plants [J]. Annual Review of Plant Biology, 2020, 71: 403−433. DOI: 10.1146/annurev-arplant-050718-100005
[2] WAQAS M, CHEN Y N, IQBAL H, et al. Synergistic consequences of salinity and potassium deficiency in quinoa: Linking with stomatal patterning, ionic relations and oxidative metabolism [J]. Plant Physiology and Biochemistry, 2021, 159: 17−27. DOI: 10.1016/j.plaphy.2020.11.043
[3] 徐成龙, 董奕岑, 卢家磊, 等. 我国滨海盐碱地土壤改良及资源化利用研究进展 [J]. 世界林业研究, 2020, 33(6):68−73. XU C L, DONG Y C, LU J L, et al. Research progress of soil improvement and soil resources utilization of coastal saline-alkaline land in China [J]. World Forestry Research, 2020, 33(6): 68−73.(in Chinese)
[4] LIN M Y, HAN P P, LI Y Y, et al. Quinoa secondary metabolites and their biological activities or functions [J]. Molecules, 2019, 24(13): 2512. DOI: 10.3390/molecules24132512
[5] HUSSAIN M I, FAROOQ M, SYED Q A, et al. Botany, nutritional value, phytochemical composition and biological activities of quinoa [J]. Plants, 2021, 10(11): 2258. DOI: 10.3390/plants10112258
[6] 任贵兴, 杨修仕, 么杨. 中国藜麦产业现状 [J]. 作物杂志, 2015(5):1−5. REN G X, YANG X S, YAO Y. Current situation of quinoa industry in China [J]. Crops, 2015(5): 1−5.(in Chinese)
[7] JACOBSEN S E, MUJICA A, JENSEN C R. The resistance of quinoa (Chenopodium quinoaWilld. ) to adverse abiotic factors [J]. Food Reviews International, 2003, 19(1/2): 99−109.
[8] LÓPEZ-MARQUÉS R L, NØRREVANG A F, ACHE P, et al. Prospects for the accelerated improvement of the resilient crop quinoa [J]. Journal of Experimental Botany, 2020, 71(18): 5333−5347. DOI: 10.1093/jxb/eraa285
[9] MA Q, SU C X, DONG C H. Genome-wide transcriptomic and proteomic exploration of molecular regulations in quinoa responses to ethylene and salt stress [J]. Plants, 2021, 10(11): 2281. DOI: 10.3390/plants10112281
[10] 王志恒, 徐中伟, 周吴艳, 等. 藜麦种子萌发阶段响应干旱和盐胁迫变化的综合评价 [J]. 中国生态农业学报(中英文), 2020, 28(7):1033−1042. WANG Z H, XU Z W, ZHOU W Y, et al. Comprehensive evaluation of quinoa seed responses to drought and salt stress during germination [J]. Chinese Journal of Eco-Agriculture, 2020, 28(7): 1033−1042.(in Chinese)
[11] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [12] 任永峰, 黄琴, 王志敏, 等. 不同化控剂对藜麦农艺性状及产量的影响 [J]. 中国农业大学学报, 2018, 23(8):8−16. REN Y F, HUANG Q, WANG Z M, et al. Effects of chemical control on agronomic traits and yield of quinoa [J]. Journal of China Agricultural University, 2018, 23(8): 8−16.(in Chinese)
[13] 解卫海, 刘丹, 孙金利, 等. 脱水和高氧压过程中单叶蔓荆叶片细胞膜透性分析 [J]. 林业科学, 2015, 51(6):44−49. XIE W H, LIU D, SUN J L, et al. Permeability of cells in leaves of Vitex trifolia var. simplicifolia under stresses of dehydration and high oxygen pressure [J]. Scientia Silvae Sinicae, 2015, 51(6): 44−49.(in Chinese)
[14] 杨璐, 依丽米努尔, 朱苗苗, 等. 植物叶片中硫含量测定方法研究 [J]. 应用化工, 2015, 44(3):575−579. YANG L, YILIMINUER, ZHU M M, et al. Study on the determination of sulfur content in plant leaves [J]. Applied Chemical Industry, 2015, 44(3): 575−579.(in Chinese)
[15] 付尧, 孙玉军. 植物有机碳测定研究进展 [J]. 世界林业研究, 2013, 26(1):24−30. FU Y, SUN Y J. A study of the determination of organic carbon of vegetation [J]. World Forestry Research, 2013, 26(1): 24−30.(in Chinese)
[16] 常硕, 张延国, 刘广洋, 等. 杜马斯燃烧定氮法和凯氏定氮法在蔬菜粗蛋白质含量检测中的比较 [J]. 中国蔬菜, 2021(6):68−73. CHANG S, ZHANG Y G, LIU G Y, et al. Comparative studies on determination of crude protein in common vegetables by Dumas combustion method and Kjeldahl method [J]. China Vegetables, 2021(6): 68−73.(in Chinese)
[17] KOYRO H W, EISA S S. Effect of salinity on composition, viability and germination of seeds of Chenopodium quinoa Willd [J]. Plant and Soil, 2008, 302(1/2): 79−90.
[18] 李丽丽, 姜奇彦, 牛风娟, 等. 藜麦耐盐机制研究进展 [J]. 中国农业科技导报, 2016, 18(2):31−40. LI L L, JIANG Q Y, NIU F J, et al. Research progress on salt tolerance mechanisms in quinoa [J]. Journal of Agricultural Science and Technology, 2016, 18(2): 31−40.(in Chinese)
[19] 陆敏佳, 蒋玉蓉, 陆国权, 等. 利用SSR标记分析藜麦品种的遗传多样性 [J]. 核农学报, 2015, 29(2):260−269. DOI: 10.11869/j.issn.100-8551.2015.02.0260 LU M J, JIANG Y R, LU G Q, et al. Genetic diversity of quinoa germplasm assessed by SSR markers [J]. Journal of Nuclear Agricultural Sciences, 2015, 29(2): 260−269.(in Chinese) DOI: 10.11869/j.issn.100-8551.2015.02.0260
[20] 刘文瑜, 杨发荣, 黄杰, 等. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响 [J]. 西北植物学报, 2017, 37(9):1797−1804. DOI: 10.7606/j.issn.1000-4025.2017.09.1797 LIU W Y, YANG F R, HUANG J, et al. Response of seedling growth and the activities of antioxidant enzymes of Chenopodium quinoato salt stress [J]. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(9): 1797−1804.(in Chinese) DOI: 10.7606/j.issn.1000-4025.2017.09.1797
[21] ADOLF V I, JACOBSEN S E, SHABALA S. Salt tolerance mechanisms in quinoa (Chenopodium quinoa Willd.) [J]. Environmental and Experimental Botany, 2013, 92: 43−54. DOI: 10.1016/j.envexpbot.2012.07.004
[22] RUFFINO A M C, ROSA M, HILAL M, et al. The role of cotyledon metabolism in the establishment of quinoa (Chenopodium quinoa) seedlings growing under salinity [J]. Plant and Soil, 2010, 326(1/2): 213−224.
-
期刊类型引用(4)
1. 杨宏伟,彭正凯,李娟宁,马剑,乔岩,李学海,虎婷,刘瑞琦. 藜麦幼苗对混合盐碱胁迫的生理响应及耐盐碱性评价. 饲料研究. 2024(11): 82-88 .  百度学术
百度学术
2. 陈小慧,雷阳,韩雪,刘海,马洪娜. 天门冬种子萌发响应干旱胁迫的生理机制研究. 耕作与栽培. 2024(03): 34-38+43 .  百度学术
百度学术
3. 苏小茜,许宇捷,魏健,王光野. 盐胁迫对种子萌发的影响及作用机制研究进展. 现代农业科技. 2024(22): 57-61 .  百度学术
百度学术
4. 春宇,李向颖,元元,萨日娜. 盐碱胁迫对藜麦生理生化及代谢水平的影响综述. 农业科学研究. 2024(04): 67-77 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: