Effects of High Temperature on Lifespan, Fecundity, and Protective Enzymes of Ectropis grisescens
-
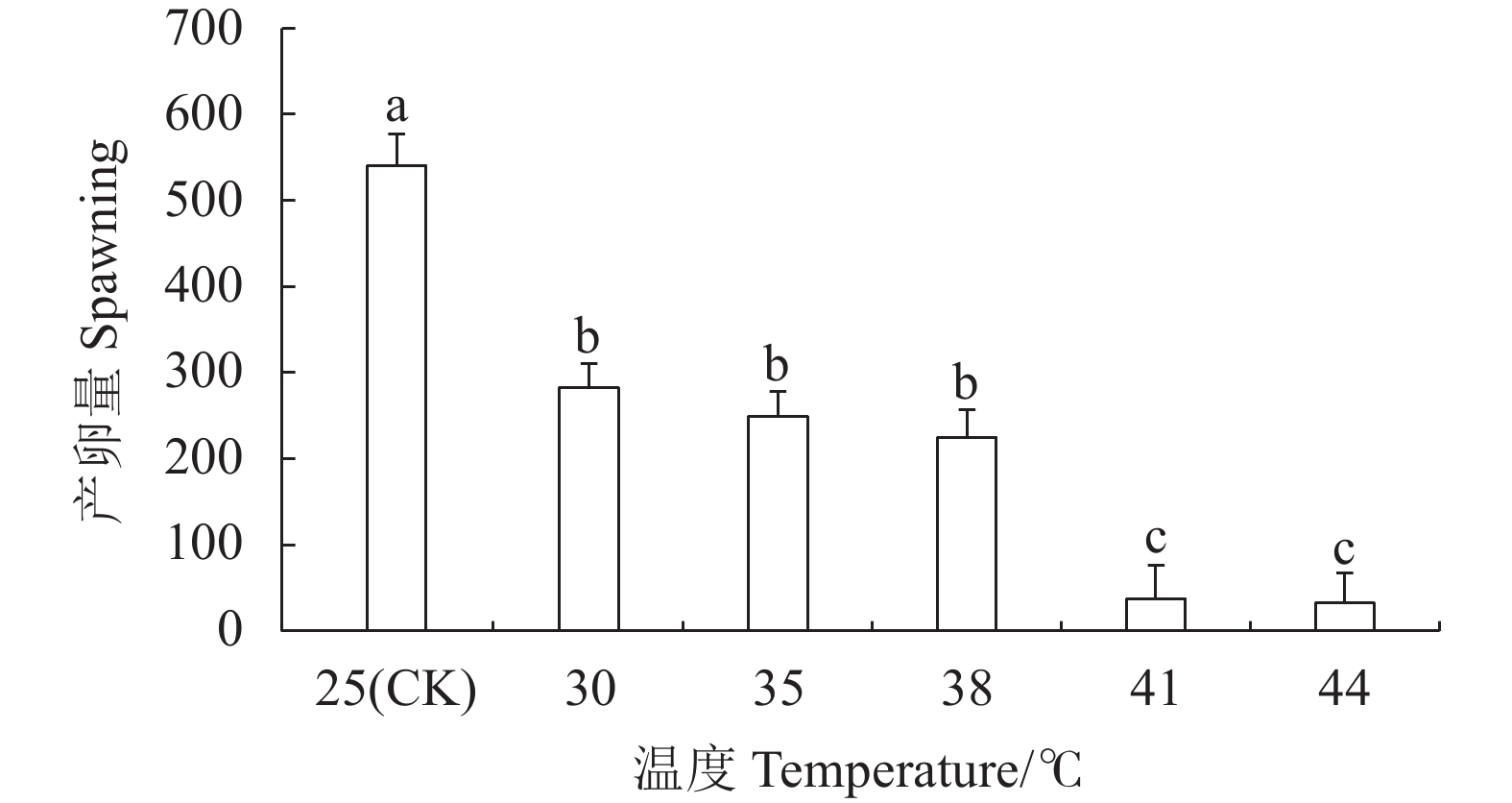
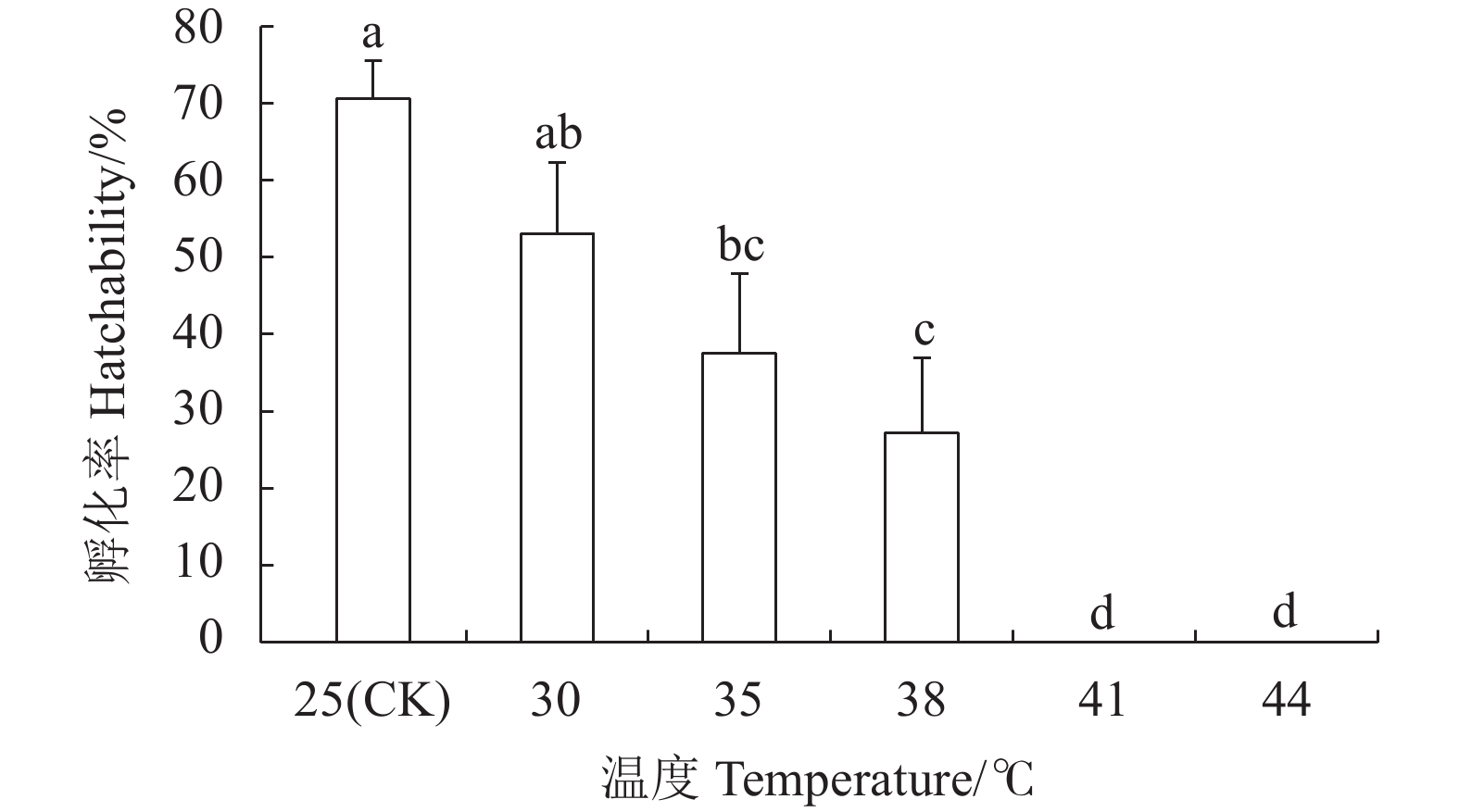
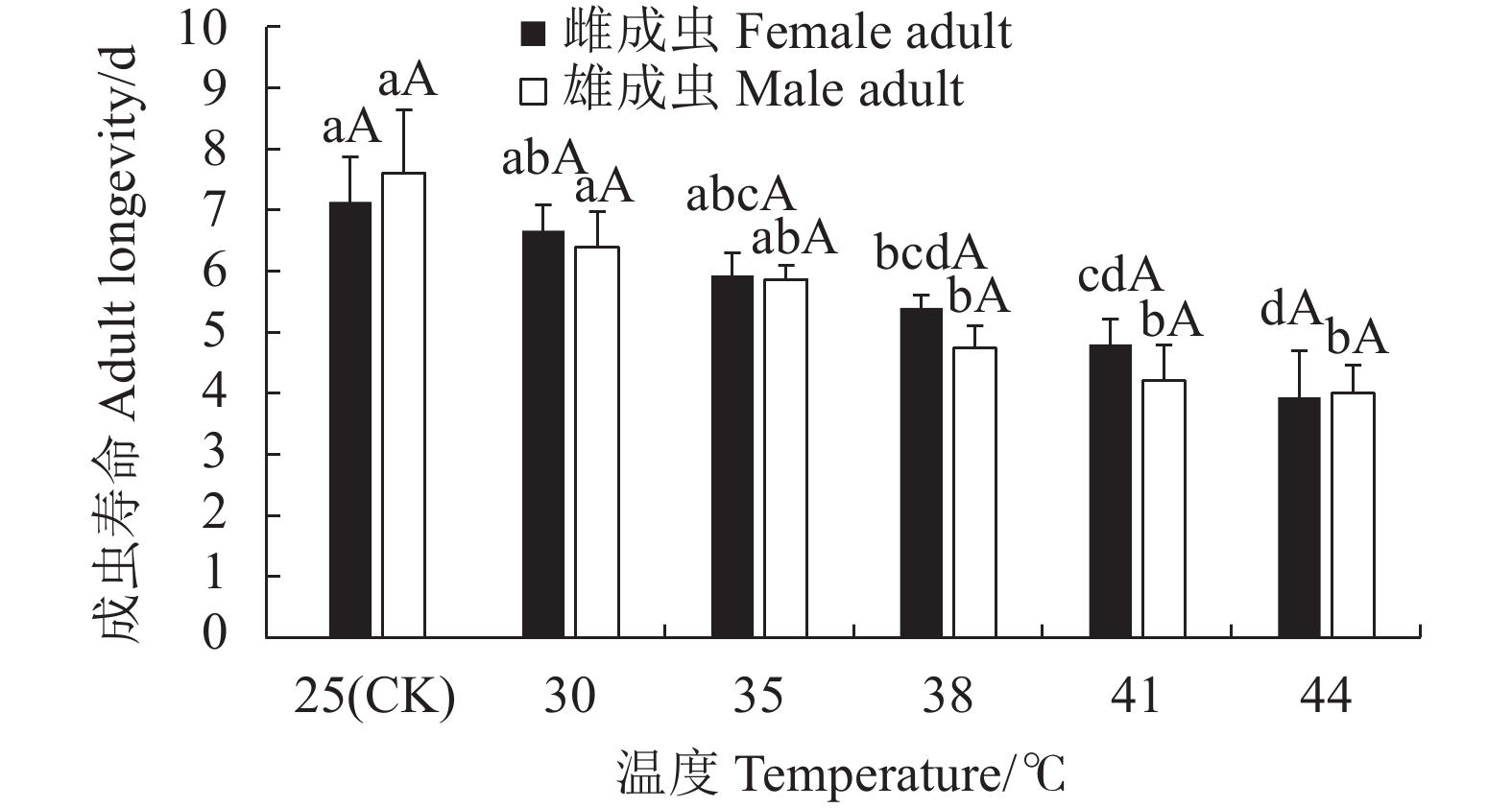
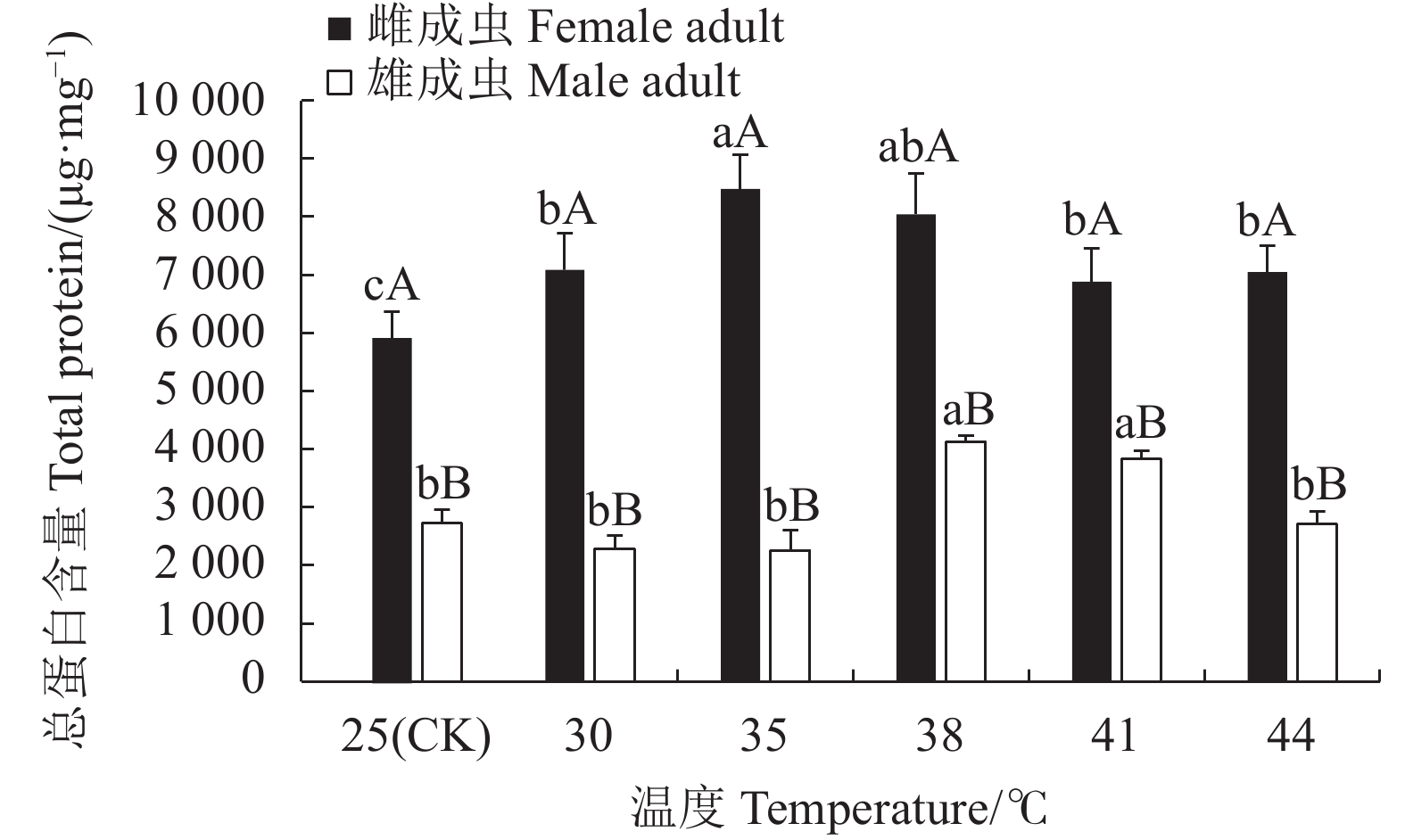
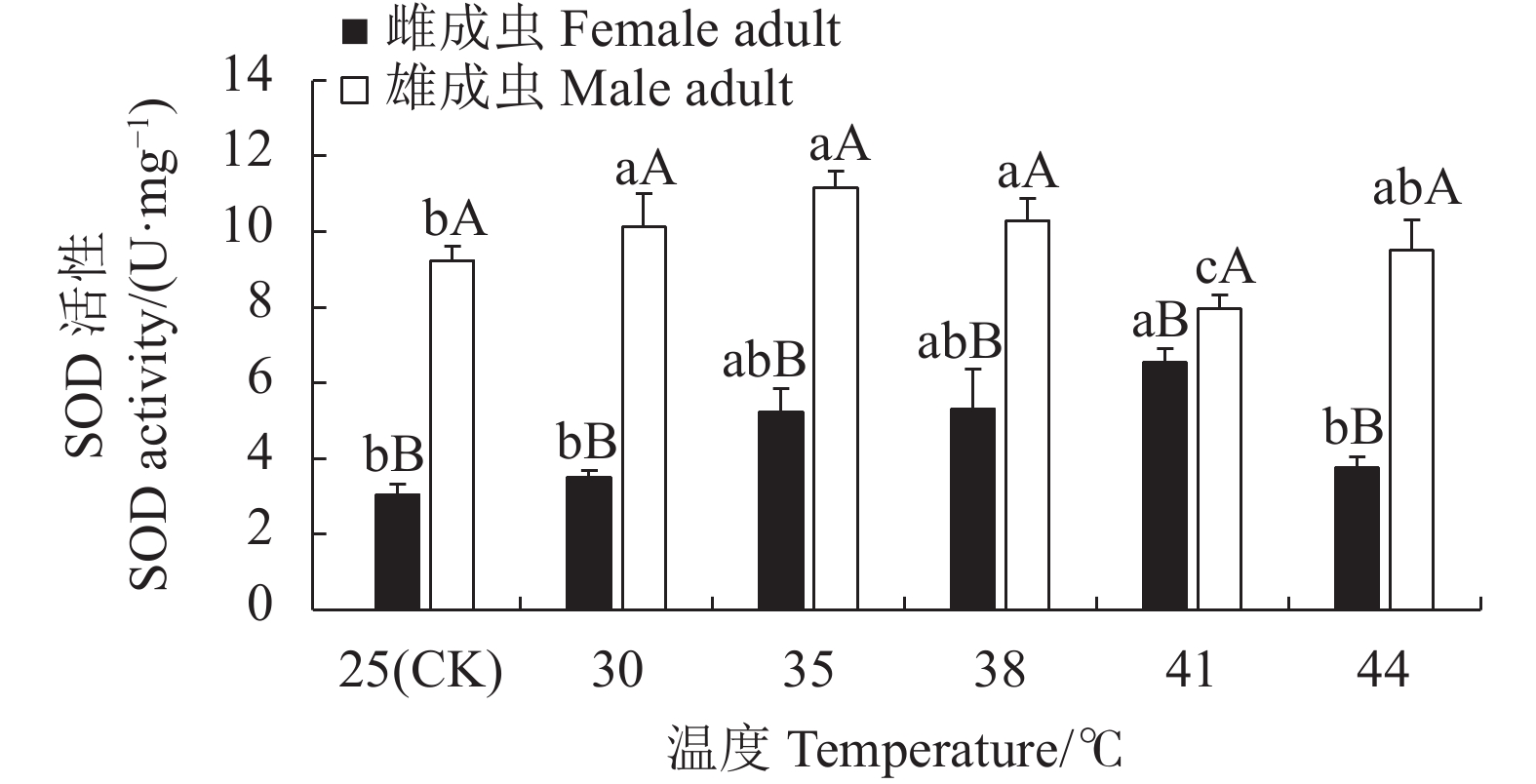
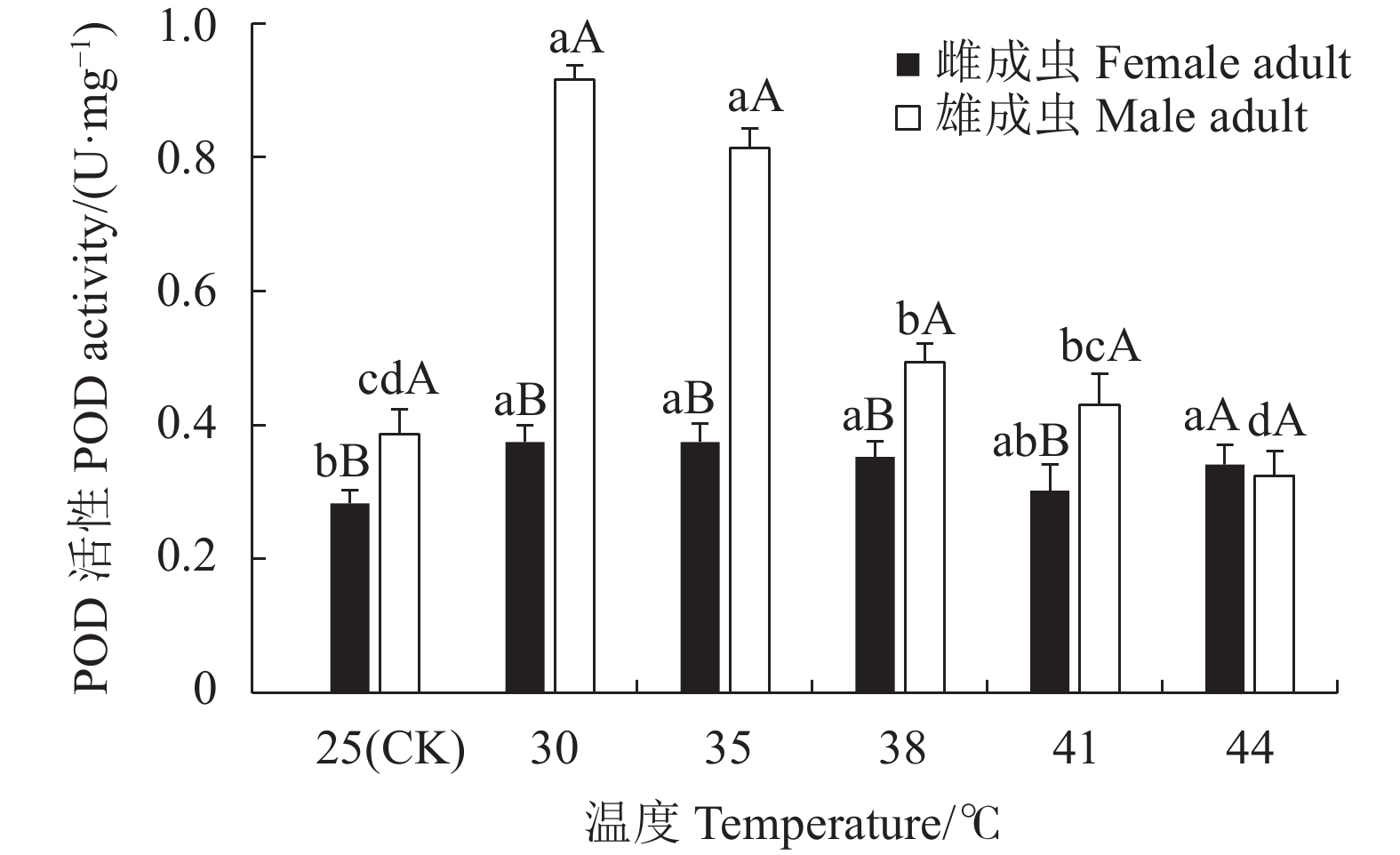
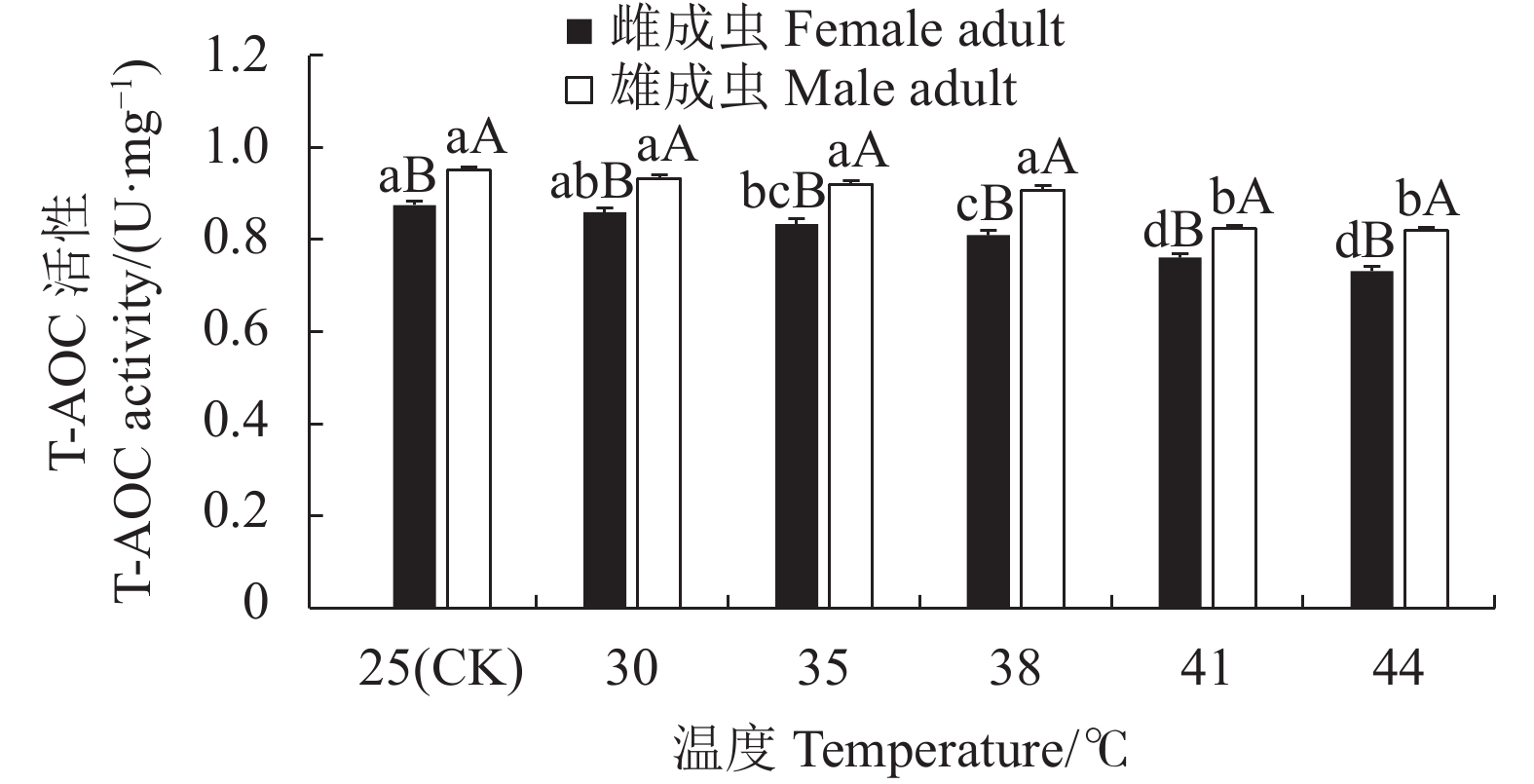
摘要:目的 明确灰茶尺蠖(Ectropis grisescens Warren)对高温的耐受性及其体内抗氧化系统对高温胁迫的响应机制。方法 以25 ℃为对照,灰茶尺蠖雌、雄成虫经高温 30、35、38 ℃和41 ℃处理1 h,44 ℃处理3 min后,测定其寿命、产卵量、卵孵化率及其体内总蛋白含量、超氧化物歧化酶(Superoxide dismutas,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)的活性和总抗氧化(Total antioxidant capacity,T-AOC)能力的变化。结果 随着胁迫温度的增加,灰茶尺蠖雌、雄成虫的寿命缩短,雌成虫的产卵量逐渐下降,卵孵化率降低。41 ℃和44 ℃时,卵孵化率为0。灰茶尺蠖雌、雄成虫总蛋白含量分别在35 ℃和38 ℃时达最高值,均显著高于其他处理,且雌、雄间差异显著。雌成虫SOD活性呈“低-高-低”的趋势,雄成虫SOD活性41 ℃处理较低。雌成虫在44 ℃时CAT活性最高,T-AOC含量随温度的增加逐渐降低,雌成虫的POD活性随温度升高逐渐增加,雄成虫呈“低-高-低”的趋势。结论 灰茶尺蠖体内保护酶活性在适应高温胁迫过程中发挥了重要作用。Abstract:Objective Resistance and response to high temperatures of the antioxidants in Ectropis grisescens were studied.Method Lifespan and fecundity of adult E. grisescens Warren after being exposed to 30 ℃, 35 ℃, 38 ℃ or 41 ℃ for 1 h or 44 ℃ for 3 min were observed according to measurements on the egg hatchability and total protein content and activities of superoxide dismutase (SOD), catalase (CAT), and peroxidase (POD) as well as total antioxidant capacity (T-AOC) in the insects.Result The increased temperature significantly shortened the lifespan, decreased the female oviposition, and lowered the egg hatchability of E. grisescens. At 41 ℃ and 44 ℃, the egg ceased to hatch. The maximum total protein contents in the female and male adults differed significantly under different temperatures—it was under 35 ℃ for the females and 38 ℃ for the males. The SOD activity in the female adults changed in an upside-down V pattern as the temperature rose, while that in the male adults was low at 41 ℃. In the female adults the highest CAT activity occurred at 44 ℃, the T-AOC decreased with increasing temperature, and the POD rose with rising temperature, whereas those in the male adults exhibited a low-high-low trend in the temperature range.Conclusion The protective enzymes in E. grisescens Warren played a key role in how the insect adapted to high temperature stress.
-
Keywords:
- Ectropis grisescens Warren /
- protective enzymes /
- oviposition /
- hatchability /
- high temperature
-
0. 引言
【研究意义】自2020年以来,我国江苏、山东、福建等鹅养殖地区出现了以雏鹅肝脾白色针尖状坏死点为主要病变特征的新疫病[1],病原被鉴定为鹅源番鸭呼肠孤病毒(goose-origin muscovy reovirus, Go-MDRV)或新型鹅呼肠孤病毒(novel goose reovirus, NGRV)[2]。该病发病率和死亡率高,对我国鹅产业的健康发展造成了严重影响。因此,开展鹅源呼肠孤病毒毒株的分离鉴定,有助于更好了解该病的危害及毒株病原情况,为该病预防和控制提供理论基础。【前人研究进展】番鸭呼肠孤病毒(muscovy duck reovirus, MDRV)属于呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus),主要易感宿主为雏番鸭[3]。1997年以来,我国番鸭养殖场相继暴发了番鸭呼肠孤病毒病,临床上以肝脾表面和切面大量白色针尖状坏死点为主要病变特征,俗称“番鸭花肝病”或“番鸭肝白点病”[4]。此病主要在7~45日龄的雏番鸭群中流行,发病率在30%~90%,病死率可高达60%~80%[5]。有学者从肝脏和脾脏出血的典型病变雏鹅中分离到一株鹅源鸭呼肠孤病毒,σC基因测定表明是一株鹅源番鸭呼肠孤病毒(Go-MDRV),通过雏番鸭和雏鹅的致病性试验发现Go-MDRV对雏鹅和雏番鸭均有一定的致病性[6]。根据临床症状和病理变化,可将我国目前流行的水禽呼肠孤病毒分为两种:引起番鸭“肝白点”病的番鸭呼肠孤病毒和引起鸭出血性坏死性肝炎的新型呼肠孤病毒[3,7]。这两种水禽呼肠孤病毒均能感染鹅,前者感染导致鹅肝脾白点,后者感染肝脾出血坏死样病变。水禽呼肠孤病毒的σB蛋白和σC 蛋白是病毒外衣壳蛋白的成分,σB蛋白含有群特异性中和抗原表位,能特异性地结合宿主细胞,促进病毒复制位于病毒粒子外衣壳的表面,在病毒的吸附中发挥着重要作用[8]。σC蛋白是病毒外衣壳中最小的一种蛋白,作为吸附蛋白与宿主细胞受体特异性结合,识别并启动宿主病毒感染,是影响病毒宿主范围和致病性的关键蛋白[9,10]。水禽呼肠孤病毒作为分节段病毒,病毒复制所需RNA聚合酶矫正功能不强,导致该病毒在复制过程中容易发生基因重组[11],出现致病性、传染性、致死性和宿主范围有差异的变异株。【本研究切入点】近年来,雏鹅出现软脚,肝、脾白色坏死点样病变的病例逐渐增多[6,12−15],病原为鹅源番鸭呼肠孤病毒,但是鹅源番鸭呼肠孤病毒与经典的番鸭呼肠孤病毒相比,其全基因与致病性的差异还不明晰,开展鹅源番鸭呼肠孤病毒毒株的分离鉴定,有助于解析番鸭呼肠孤病毒在番鸭和鹅中的进化规律,为致病机制及防控技术研究提供依据。【拟解决的关键问题】为探究江苏省徐州市某鹅养殖场病雏鹅在临床症状上出现肝脏和脾脏白色坏死点、肝脏和肾脏肿大的死亡原因,从病雏鹅肝脏和脾脏中分离得到1株病毒,通过分离鉴定、测序分析和动物回归试验,确定其病原体为鹅源番鸭呼肠孤病毒,为我国番鸭呼肠孤病毒的防控提供分子流行病学研究数据。
1. 材料与方法
1.1 病料来源
江苏省徐州市某养殖场,鹅表现出软脚、不愿走动、精神不振等临床症状。发病死亡鹅剖检见肝脏和脾脏有白色坏死点,肝脏和肾脏肿大。
1.2 主要试剂
DL2000 DNA Marker购自宝生物工程(大连)有限公司;琼脂糖凝胶DNA快速回收试剂盒、质粒小提试剂盒购自北京擎科生物科技有限公司;胰蛋白胨、酵母提取物、琼脂糖均购自Sigma公司;病毒DNA/RNA提取试剂盒、2×Taq Plus Master Mix、5 min TA/Blunt-Zero Cloning Kit、Phanta Max Super-Fidelity DNA Polymerase、反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit和RNase-free ddH2O均购自南京诺唯赞生物科技有限公司;核酸染料GelStain(
10000 ×)和大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;氨苄青霉素购自生工生物工程(上海)股份有限公司;切片石蜡和HE染色试剂盒购自上海吉至生化科技有限公司。1.3 主要仪器
普通梯度PCR仪(CF-F9677)购自卡尤迪生物科技(北京)有限公司;电泳电源(power600)购自北京百晶生物技术有限公司;凝胶成像分析系统(Tanon-
3500 )购自上海天能科技有限公司;石蜡切片机(M2235)购自德国徕卡微系统有限公司;超纯水机(UPH-1-10TN)购自四川优普超纯科技有限公司;离心机(TS1520)购自山海天(苏州)科技有限公司;制冰机(IMS-40)购自雪科电器有限公司;高压灭菌锅(MLS-830L)购自普和希健康医疗器械(上海)有限公司。1.4 试验动物、鸭胚和细胞
番鸭胚和3日龄健康雏鹅购自漳州某养殖场;取孵化15 d的番鸭胚制备番鸭胚成纤维细胞(MDEF)。
1.5 反转录聚合酶链反应RT-PCR检测
将病料组织剪成适当体积,放入研钵,加入3倍组织体积的Hank’s液混合研磨成匀浆。随后将病毒组织液于−80 ℃中反复冻融3次,
8000 r·min-1离心10 min,离心后上清液使用0.22 μm滤器过滤,病毒液于−80 ℃冰箱保存备用。取200 μL病料匀浆上清,按照FastPure Viral DNA/RNA Mini Kit提取试剂盒说明书提取病毒核酸,将提取的RNA按照反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit说明书将RNA反转录为cDNA,并置于−80 ℃中保存备用。利用Oligo 6引物设计软件,参照 GenBank 中已发表的MDRV S4序列设计特异性检测引物。同时通过参考相关文献,对鹅细小病毒(goose parvovirus, GPV)[16]、番鸭细小病毒(muscovy duck parvovirus, MDPV)[16]、鸭腺病毒B血清2型(duck adenovirus B2, DAdV B2)[17]、鸭甲型肝炎病毒1型(duck hepatitis A viral, DHAV-1)[18]、鸭病毒性肠炎病毒(duck virus enteritis, DEV)[19]、NDRV [20]、禽流感病毒H9亚型(avian influenza virus H9 subtype, AIV H9)[21]和禽坦布苏病毒(avian tembusu virus, ATMUV)[22]等常见鸭源病毒合成检测引物(表1),由北京擎科生物科技有限公司合成。PCR检测反应体系为2×Taq Plus Master Mix 10 μL,上游引物和下游引物各1 μL,模板2 μL,ddH2O 6 μL。反应程序为预变性95 ℃ 3 min;变性95 ℃ 15 s,退火60 ℃ 15 s,延伸72 ℃ 45 s,共35个循环;彻底延伸5 min后4 ℃保存。最后取10 μL PCR产物进行琼脂糖凝胶电泳检测(1.5%琼脂糖),使用紫外凝胶成像仪查看结果。
表 1 用于病原检测的引物Table 1. Primers used for pathogen identification引物名称
Prime name引物序列
Primers sequence (5'–3')产物大小
Product
size/bp番鸭呼肠弧病毒
MDRVF:TTCCTGGCTCGCTAAGATAGA 327 R:ATCCATGCAATCCTGAAGGC 鹅细小病毒
GPVF:GAGGTAGACAGCAACAGAAA 343 R:GCTCGTCCGTGACCATA 番鸭细小病毒
MDPVF:TAATGGTGGCAGGAATGCACAGTTC 311 R:TGTTACCATGATGTCTGAAAT 鸭腺病毒B血清2型
DAdV B2F: TATCCCTACTGGTGGCCCTC 581 R:TCAGTGGCTGCGTACACTTT 鸭甲型肝炎病毒1型
DHAV-1F:CAACTCGACCAATHCCTGG 462 R:CCTGRTGRACCATTGTRACTG 鸭病毒性肠炎病毒
DEVF:TGGGAAGGCTTTCGGTCGC 232 R:CATTCGCGCCTTTGCTAAATTCTCT 新型鸭呼肠孤病毒
NDRVF:TCGTCACTACTGTCAAGCTC 594 R:TATGTATGAGAGGAGCCACA 禽流感病毒H9亚型
AIV H9F:ACAGAGCATAATGGGATGCT 367 R:GGGCGTCTTGGATAGGGTAAT 禽坦布苏病毒
ATMUVF:ATGACGGACACCACTCCTTT 200 R:GGGCTGCGTTACTATTCACC 1.6 病毒分离培养
将PCR鉴定为阳性的研磨液过滤后接种到11日龄的番鸭胚的尿囊腔中,每枚胚接种0.2 mL,接种完后用石蜡封孔,并做好标记。在37 ℃温箱中培养7 d。每天早晚观察有无死胚,丢弃24 h内死亡胚,在无菌超净台内收集2 d后死亡胚尿囊液,若番鸭胚至第7天还未死亡,则放入4 ℃冰箱处死后再无菌收集尿囊液,于–80 ℃保存,之后进行连续传代。将收集到的尿囊液参照上述方法进行核酸提取、反转录,并进行PCR鉴定。
将稳定传代的尿囊液用0.22 μm滤器过滤,取800 μL接种到生长状况良好的MDEF上,置于37 ℃、5% CO2的细胞培养箱中,吸附1 h后取出,吸出病毒液,加入2%的维持液,观察细胞状态。当病变达到80%时收集病毒液。经反复冻融后按照同样的方法盲传3代。
1.7 病毒σB和σC基因序列测定及分析
参照GenBank中MDRV σB和σC基因的保守序列设计2对引物(表2),由北京擎科生物有限公司合成。经过RT-PCR扩增基因序列,用1.5%琼脂糖凝胶电泳检测RT-PCR产物。将RT-PCR产物经胶回收试剂盒回收纯化后,按照5 min TA/Blunt-Zero Cloning Kit试剂盒说明书,与载体连接,转化至DH5α感受态细胞,涂布至含氨苄抗性的LB琼脂平板,37 ℃恒温培养箱过夜培养。无菌挑取白色单个菌落,接种至带有氨苄抗性LB液体培养基中,37 ℃摇床220 r·min-1振荡培养8 h,待菌液浑浊后提取质粒。使用Trelief® Plasmid Mini Kit Plus高纯度质粒小提试剂盒,对提取的质粒进行PCR扩增,将检测结果为阳性的质粒送往北京擎科生物科技有限公司进行测序,测序结果在NCBI BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行比对验证。通过DNAStar 5.0程序包中的MegAlign软件Clustal W方法进行JS2022株σB和σC基因核苷酸和氨基酸同源性比对,用MEGA 11软件制作进化树。
表 2 扩增番鸭呼肠孤病毒σB和σC基因的引物Table 2. Primer used for MDRV σB and σC引物名称
Prime name引物序列
Primers sequence (5'–3')产物大小
Product size/bpσB-F GCTTTTTGAGCCCTTAGCGTGC 1201 σB-R GATGAATACTGAGCCCCGCTGA σC-F ATGTCCGAAACTCCCGCTCC 810 σC-R TCAAATGGTCGCAATGGAGA 1.8 动物回归试验
将16只11日龄健康雏鹅随机分成两组,攻毒组8羽,每只在腿肌部位注射1.2 mL病毒尿囊液;健康对照组8羽,同样在腿肌部位注射同等剂量的Hank’s液。将两组雏鹅分别养在两个动物房内,饲养14 d,每天观察记录雏鹅的发病与死亡情况。采集病死鹅的肝脏和脾脏用10%甲醛固定液固定组织用于病理组织切片的制备。
2. 结果与分析
2.1 病料的病原检测
如图1所示,将病料用上述设计的番鸭呼肠孤病毒检测引物以及其他病原检测引物进行PCR扩增,仅有番鸭呼肠孤病毒特异性引物有扩增条带,大小为327 bp,与预期大小相符,其他病原检测引物均无条带,初步判断此份临床样品为番鸭呼肠孤病毒感染。
![]() 图 1 病料中的病原PCR检测结果M:DNA分子质量标准;-:阴性对照;1~9检测引物分别为:番鸭呼肠弧病毒、鹅细小病毒、番鸭细小病毒、鸭腺病毒B血清2型、鸭甲型肝炎病毒1型、鸭病毒性肠炎病毒、新型鸭呼肠孤病毒、禽流感病毒H9亚型、鸭坦布苏病毒;+:番鸭呼肠弧病毒阳性对照。Figure 1. PCR detection on pathogens in tissue specimensM: DL2000 DNA marker; -: negative control; 1–9: detection primers for MDRV, GPV, MDPV, DAdV B2, DHAV-1, DEV, NDRV, AIV H9 and ATMUV, respectively; +: positive control of MDRV.
图 1 病料中的病原PCR检测结果M:DNA分子质量标准;-:阴性对照;1~9检测引物分别为:番鸭呼肠弧病毒、鹅细小病毒、番鸭细小病毒、鸭腺病毒B血清2型、鸭甲型肝炎病毒1型、鸭病毒性肠炎病毒、新型鸭呼肠孤病毒、禽流感病毒H9亚型、鸭坦布苏病毒;+:番鸭呼肠弧病毒阳性对照。Figure 1. PCR detection on pathogens in tissue specimensM: DL2000 DNA marker; -: negative control; 1–9: detection primers for MDRV, GPV, MDPV, DAdV B2, DHAV-1, DEV, NDRV, AIV H9 and ATMUV, respectively; +: positive control of MDRV.2.2 病毒的鸭胚分离
将病料研磨液经过滤后接种到11日龄番鸭胚,番鸭胚在传至第2代时开始死亡,死亡时间在接种后第3天;传至第6代时番鸭胚死亡时间趋于稳定,基本稳定在第3~5天。死亡番鸭胚尿囊液清澈,尿囊膜出现增厚、水肿的现象;胚体皮肤和皮下出现出血点,呈鲜红色(图2)。
2.3 病毒的细胞分离培养
将稳定传代的尿囊液过滤后接种到生长状况良好的MDEF细胞上,连续传代,传至第3代时细胞在第4 天开始圆缩、崩解(图3),传至第6代时趋于稳定。正常对照细胞生长良好,未出现病变。结果表明成功分离到一株鹅源番鸭呼肠孤病毒,将该毒株命名为JS2022株。
2.4 σB和σC基因序列测定及分析
利用DNAStar分析软件进行序列拼接,并上传至GenBank公共数据库,登录号为OP598195~OP598204。JS2022株σB基因片段长度为
1104 bp,编码367个氨基酸;σC基因片段长度为810 bp,编码269个氨基酸。通过DNAStar 5.0程序包中的MegAlign软件Clustal W方法进行JS2022株σB和σC基因核苷酸同源性比对(图4和图5)及氨基酸同源性比对(图6和图7),结果显示JS2022株σB和σC基因序列与鹅源番鸭呼肠孤核苷酸序列的同源性分别为99.1%~99.5%和99.3%~99.9%,氨基酸序列同源性分别为92.9%~99.7%和92.9%~99.7%;与禽呼肠孤病毒的同源性最低,核苷酸同源性分别为59.7%~61.5%和31.4%~33.7%,氨基酸序列同源性分别为60.5%~61.3%和20.8%~21.4%;与番鸭呼肠孤病毒的同源性也相对较高,核苷酸同源性分别为91.0%~96.8%和91.8%~99.1%,氨基酸序列同源性分别为91.8%~97.5%和93.6%~99.7%;与新型鸭呼肠孤病毒的核苷酸同源性分别为66.9%~67.5%和30.4%~30.6%,氨基酸序列同源性分别为68.9%~70.6%和34.1%~34.7%。σB和σC基因核苷酸序列同源性结果表明,JS2022分离株与禽呼肠孤病毒和新型鸭呼肠孤病毒同源性差异较大,与近年来鹅源番鸭呼肠孤病毒的同源性高,且σC基因与鹅源禽呼肠孤病毒HEB株和AHFY株同源性高达99.9%,核苷酸仅有一个差异位点(A78T),导致对应的氨基酸位点也发生了变化(E26D),与鹅源禽呼肠孤病毒 GD2020株、GD-88/2021株核苷酸有6个差异位点(C17T、A78T、T246C、T405C、T594G、T630C),对应氨基酸位点有2处差异(A6V、E26D);σB基因与GD2020株、GD-88/2021株核苷酸有6个差异位点(T33C、C435T、C486A、C819T、A978C、C1098T),而对应氨基酸位点仅有1处差异(Q326H)。
为了进一步分析JS2022株σB和σC基因序列与其他水禽呼肠孤病毒的进化关系,根据测序结果用MEGA 11软件绘制了σB和σC基因的系统发育进化树(图8和图9)。从进化树可看出,分离株JS2022株σB基因与2020年以来分离到的鹅源禽呼肠孤病毒GD2020株、GD-88/2021株处于同一分支,与进化树中的所有番鸭呼肠孤病毒毒株处在同一大分支中,σC基因也同样与鹅源禽呼肠孤病毒GD2020株、GD-88/2021株、HEB株、AHFY株处于番鸭呼肠孤病毒毒株大分支。表明JS2022株与鹅源番鸭呼肠孤病毒的亲缘关系更近,与禽呼肠孤病毒和新型鸭呼肠孤病毒的亲缘关系较远。
2.5 动物回归试验
在整个试验期间,对照组雏鹅均未出现任何异常症状。攻毒组在攻毒后第2天部分雏鹅开始发病,感染鹅出现精神沉郁、不愿走动、软脚、拉稀等症状;攻毒后5~7 d死亡2羽,及时剖检感染鹅发现肝脏和脾脏均出现密密麻麻的针尖状白点(图10A、B),肾脏肿大且有白点(图10C),胸腺和法氏囊萎缩,胰腺有散在出血点(图10D)。攻毒10 d后雏鹅状态开始恢复后续无死亡现象,但是耐过鹅生长发育受阻,个别鹅成为侏儒鹅。
![]() 图 10 分离毒株的动物回归试验A:肝脏出现大量针尖状白色坏死点;B:脾脏肿大,有大针尖状的白色坏死点;C:肾脏肿大,散在的白色坏死灶;D:胰腺有少量出血点。Figure 10. Regression test on gooselings inoculated with isolated strain of virusA: numerous white pinhead necrotic foci appeared on goose liver; B: splenomegaly with enlarged necrotic foci; C: enlarged kidneys with scattered necrotic foci; D: a small number of hemorrhages on goose pancreas.
图 10 分离毒株的动物回归试验A:肝脏出现大量针尖状白色坏死点;B:脾脏肿大,有大针尖状的白色坏死点;C:肾脏肿大,散在的白色坏死灶;D:胰腺有少量出血点。Figure 10. Regression test on gooselings inoculated with isolated strain of virusA: numerous white pinhead necrotic foci appeared on goose liver; B: splenomegaly with enlarged necrotic foci; C: enlarged kidneys with scattered necrotic foci; D: a small number of hemorrhages on goose pancreas.2.6 病理组织学观察
整个动物试验过程中对照组鹅均无任何异常。病毒感染雏鹅死后及时取其肝脏、脾脏和肾脏进行病理切片制作,光学显微镜下(200×)观察可见肝脏发生局灶性坏死,肝小叶内可见大量的坏死肝细胞残体,局部可见淋巴细胞浸润及少量的红细胞(图11A红色箭头),坏死灶周围的肝细胞呈不同程度的细胞肿胀和脂肪变性(图11A黑色箭头),肝窦内有红细胞淤积;脾脏红髓和白髓界限不清,淋巴滤泡内部分淋巴细胞坏死呈红色均质(图11B绿色箭头),巨噬细胞数量增多(图11B蓝色箭头),红髓内血窦扩张(图11B红色箭头);肾组织中肾小球(图11C蓝色箭头)未见明显异常,肾小管可见细胞管型,肾小管上皮细胞发生广泛的变性、坏死和脱落(图11C绿色箭头),间质可见少量炎细胞浸润(图11C红色箭头)。
3. 讨论
番鸭呼肠孤病毒是导致番鸭“肝白点病”和“花肝病”的病原,感染后宿主发病率高、传染性强,发病番鸭临床上表现为软脚、精神状态差、拉稀等,病理剖检典型病变为肝脏和脾脏肿大且表面和实质均有大量针尖状白点[23]。近年来部分地区鹅养殖场出现了类似疾病,以肝、脾有白色坏死点为主要病变特征,给养鹅业造成了重大的经济影响。
本试验从江苏省某鸭场收集了疑似番鸭呼肠孤病毒感染鹅的病料,通过接种番鸭胚和MDEF细胞,成功分离到一株鹅源番鸭呼肠孤病毒,并将其命名为JS2022株。JS2022株与胡奇林等[3]采用番鸭胚分离的番鸭呼肠孤病毒病变一致,均为死亡胚尿囊膜混浊增厚,尿囊液清澈;死亡胚周身出血,呈紫红色,本试验接毒胚传至第6代时番鸭胚死亡时间趋于稳定,基本稳定在第3~5天。通过对σB和σC全基因序列的核苷酸和氨基酸进行同源性分析,结果显示,分离株JS2022株σB和σC基因核苷酸序列都是与鹅源番鸭呼肠孤病毒毒株的同源性最高,与禽呼肠孤病毒的同源性最低。从进化树可看出,进化树被分为了番鸭呼肠孤病毒、新型鸭呼肠孤病毒、禽呼肠孤病毒3个不同的进化群,本分离株存在于番鸭呼肠孤病毒进化群中,但是其遗传进化关系与鹅源番鸭呼肠孤病毒GD2020株更近,该结果与郑炜鸿等[6]分离出的846-Goose-CHN-2020株(广东)σC基因序列遗传关系分析一致,均是与广东鹅源番鸭呼肠孤病毒分离株相似性最高,但本分离株来自江苏,可以推测该分离株可能是当前广东、江苏等地区鹅群中的主要流行毒株之一。动物回归试验结果表明,在人工感染后第2天雏鹅就出现精神沉郁、食欲不佳、拉稀等症状,病死鹅临床症状、剖检病变及组织病理学变化与自然发病鹅相似。
基因序列分析、动物回归试验指出本分离株JS2022归属于番鸭呼肠孤病毒大类,并且与鹅源番鸭呼肠孤病毒σB和σC基因的同源性高于鸭源番鸭呼肠孤病毒σB和σC基因的同源性,这也可能是番鸭呼肠孤病毒通过番鸭传染给鹅,随着宿主的改变,病毒发生一定程度的突变,增加了水禽易感宿主的种类,因此需要更加注意水禽呼肠孤病毒的流行监测及不同基因型毒株之间的重组情况。
-
图 3 温度胁迫对灰茶尺蠖寿命的影响
不同小写字母表示雌或雄成虫不同温度处理间的差异显著性(P<0.05)。不同大写字母表示同一温度雌、雄成虫处理间的差异显著性(P<0.05)。下图同。
Figure 3. Effect of high temperature on lifespan of E. grisescens
Those with different lowercase letters indicate significant differences between male and female adults at differert temperature (P<0.05); those with different capital letters indicate significant difference between male and female adults at the same temperature (P<0.05). Same for below.
-
[1] 陈宗懋, 蔡晓明, 周利, 等. 中国茶园有害生物防控40年 [J]. 中国茶叶, 2020, 42(1):1−8. CHEN Z M, CAI X M, ZHOU L, et al. Developments on tea plant pest control in past 40 years in China [J]. China Tea, 2020, 42(1): 1−8.(in Chinese)
[2] 王定锋, 李良德, 李慧玲, 等. 基于转录组数据高通量发掘灰茶尺蠖微卫星标记 [J]. 茶叶学报, 2021, 62(4):191−197. WANG D F, LI L D, LI H L, et al. High-throughput unveiling of microsatellite markers using Ectropis grisescens transcriptome [J]. Acta Tea Sinica, 2021, 62(4): 191−197.(in Chinese)
[3] LI Z Q, CAI X M, LUO Z X, et al. Geographical distribution of Ectropis grisescens (Lepidoptera: Geometridae) and Ectropis obliqua in China and description of an efficient identification method [J]. Journal of Economic Entomology, 2019, 112(1): 277−283. DOI: 10.1093/jee/toy358
[4] 罗宗秀, 苏亮, 李兆群, 等. 灰茶尺蠖性信息素田间应用技术研究 [J]. 茶叶科学, 2018, 38(2):140−145. LUO Z X, SU L, LI Z Q, et al. Field application technology of sex pheromone on Ectropis grisescens [J]. Journal of Tea Science, 2018, 38(2): 140−145.(in Chinese)
[5] MARNETT L J, RIGGINS J N, WEST J D. Endogenous generation of reactive oxidants and electrophiles and their reactions with DNA and protein [J]. The Journal of Clinical Investigation, 2003, 111(5): 583−593. DOI: 10.1172/JCI200318022
[6] 李慧, 郝德君, 徐天, 等. 高温胁迫对植食性昆虫影响研究进展 [J]. 南京林业大学学报(自然科学版), 2022, 46(6):215−224. LI H, HAO D J, XU T, et al. The effects of heat stress on herbivorous insects: An overview and future directions [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2022, 46(6): 215−224.(in Chinese)
[7] DUBOVSKIĬ I M, GRIZANOVA E V, CHERTKOVA E A, et al. Generation of reactive oxygen species and activity of antioxidants in larva hemolymph of Galleria mellonella (L. ) (lepidoptera: Piralidae) at development of process of encapsulation [J]. Zhurnal Evoliutsionnoi Biokhimii i Fiziologii, 2010, 46(1): 30−36.
[8] 曹美琳, 陶晡, 刘顺, 等. 温度对二点委夜蛾实验种群的影响 [J]. 植物保护学报, 2012, 39(6):531−535. CAO M L, TAO B, LIU S, et al. Influence of temperature on experimental population of Athetis lepigone(Möschler) [J]. Journal of Plant Protection, 2012, 39(6): 531−535.(in Chinese)
[9] MCDONALD J R, HEAD J, BALE J S, et al. Cold tolerance, overwintering and establishment potential of Thrips palmi [J]. Physiological Entomology, 2000, 25(2): 159−166. DOI: 10.1046/j.1365-3032.2000.00179.x
[10] GONZÁLEZ-TOKMAN D, CÓRDOBA-AGUILAR A, DÁTTILO W, et al. Insect responses to heat: Physiological mechanisms, evolution and ecological implications in a warming world [J]. Biological Reviews of the Cambridge Philosophical Society, 2020, 95(3): 802−821. DOI: 10.1111/brv.12588
[11] FILAZZOLA A, MATTER S F, MACIVOR J S. The direct and indirect effects of extreme climate events on insects [J]. The Science of the Total Environment, 2021, 769: 145161. DOI: 10.1016/j.scitotenv.2021.145161
[12] VIDAL M C, ANNEBERG T J, CURÉ A E, et al. The variable effects of global change on insect mutualisms [J]. Current Opinion in Insect Science, 2021, 47: 46−52. DOI: 10.1016/j.cois.2021.03.002
[13] BLOIS J L, ZARNETSKE P L, FITZPATRICK M C, et al. Climate change and the past, present, and future of biotic interactions [J]. Science, 2013, 341(6145): 499−504. DOI: 10.1126/science.1237184
[14] BALE J S. Insects and low temperatures: From molecular biology to distributions and abundance [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2002, 357(1423): 849−62. DOI: 10.1098/rstb.2002.1074
[15] SINCLAIR B J, VERNON P, JACO KLOK C, et al. Insects at low temperatures: An ecological perspective [J]. Trends in Ecology & Evolution, 2003, 18(5): 257−262.
[16] 蒋素容, 李冠烁, 李庆, 等. 温度对麻疯树柄细蛾生长发育和繁殖的影响 [J]. 中国森林病虫, 2012, 31(4):8−10,17. JIANG S R, LI G S, LI Q, et al. Effects of temperature on development and reproduction of Stomphastis thraustica Meyrick [J]. Forest Pest and Disease, 2012, 31(4): 8−10,17.(in Chinese)
[17] 杜娟, 郭建挺, 张亚素, 等. 温度对梨小食心虫Grapholitha molesta Busck生长发育及繁殖的影响 [J]. 西北农业学报, 2009, 18(6):314−318. DU J, GUO J T, ZHANG Y S, et al. Effect of temperature on development and reproduction of Grapholitha molesta (Busck) (Lepidoptera: Tortricidae) [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2009, 18(6): 314−318.(in Chinese)
[18] 邢俊, 李佳睿, 王洪平. 不同温度对桃小食心虫保护酶系活性的影响 [J]. 贵州农业科学, 2012, 40(6):107−109. XING J, LI J R, WANG H P. Effect of different temperature on the activity of protective enzymes of Carposina niponensis [J]. Guizhou Agricultural Sciences, 2012, 40(6): 107−109.(in Chinese)
[19] 张芸, 钱秀娟, 姬国红, 等. 夜蛾斯氏线虫对黄粉虫三种保护酶活力的影响 [J]. 甘肃农业大学学报, 2010, 45(5):88−91,95. ZHANG Y, QIAN X J, JI G H, et al. Changes of the activities of protective enzymes in Tenebrio molitor infected by Steinernema feltiae [J]. Journal of Gansu Agricultural University, 2010, 45(5): 88−91,95.(in Chinese)
[20] 周冬, 杜一民, 杨杰, 等. 连续多代UV-B照射对麦长管蚜保护酶活性的影响 [J]. 昆虫学报, 2014, 57(7):762−768. ZHOU D, DU Y M, YANG J, et al. Effects of UV-B radiation in successive generations on the activities of protective enzymes in the grain aphid, Sitobion avenae(Hemiptera: Aphididae) [J]. Acta Entomologica Sinica, 2014, 57(7): 762−768.(in Chinese)
[21] 方程. 光照对梨小食心虫Grapholita molesta(Busck)主要生物学参数及保护酶活性的影响[D]. 杨凌: 西北农林科技大学, 2015. FANG C. Effects of different lights on main biological parameters and protective enzymes of Grapholita molesta(Lepidoptera: Tortricidae)[D]. Yangling: Northwest A & F University, 2015. (in Chinese)
[22] 李品武, 付雪莲, 陈世春, 等. 温度胁迫对茶淡黄刺蛾四种保护酶活力和总抗氧化力的影响 [J]. 应用昆虫学报, 2016, 53(4):809−816. DOI: 10.7679/j.issn.2095-1353.2016.04.015 LI P W, FU X L, CHEN S C, et al. Effect of temperature stress on four protective enzymes and overall antioxidant capacity in Darna trima(Moore) [J]. Chinese Journal of Applied Entomology, 2016, 53(4): 809−816.(in Chinese) DOI: 10.7679/j.issn.2095-1353.2016.04.015
[23] 卢亚菲, 张祥, 王广, 等. 紫外辐射对三叶草彩斑蚜3种保护酶活性的影响 [J]. 草业科学, 2019, 36(5):1428−1434. LU Y F, ZHANG X, WANG G, et al. Effects of ultraviolet radiation on three types of protective enzymes in Therioaphis trifolii [J]. Pratacultural Science, 2019, 36(5): 1428−1434.(in Chinese)
[24] 郭俊杰, 王勇, 季清娥, 等. 高温对阿里山潜蝇茧蜂体内保护酶系活性的影响 [J]. 热带作物学报, 2013, 34(6):1166−1169. GUO J J, WANG Y, JI Q E, et al. The influence of the activity of Fopius arisanus (sonan) protective enzyme system at high temperature [J]. Chinese Journal of Tropical Crops, 2013, 34(6): 1166−1169.(in Chinese)
[25] 谢勤丹, 刘天宇, 王强, 等. 高温对感染Wolbachia米蛾体内保护酶和生殖的影响 [J]. 黑龙江农业科学, 2021(1):59−63. XIE Q D, LIU T Y, WANG Q, et al. Effects of high temperature on protective enzymes and reproduction in infected with Wolbachia [J]. Heilongjiang Agricultural Sciences, 2021(1): 59−63.(in Chinese)
[26] 乔利, 秦道正, 卢兆成, 等. 温度对茶小绿叶蝉成虫存活率及保护酶系的影响 [J]. 植物保护学报, 2015, 42(2):223−228. QIAO L, QIN D Z, LU Z C, et al. Effects of temperature on survival rate and protection enzymes of Empoasca onukii Matsuda [J]. Journal of Plant Protection, 2015, 42(2): 223−228.(in Chinese)
[27] 葛超美, 殷坤山, 唐美君, 等. 灰茶尺蠖发育起点温度和有效积温的研究 [J]. 植物保护, 2016, 42(6):110−112. GE C M, YIN K S, TANG M J, et al. Developmental threshold temperature and effective accumulated temperature of Ectropis grisescens [J]. Plant Protection, 2016, 42(6): 110−112.(in Chinese)
[28] JAFARI S, FATHIPOUR Y, FARAJI F. Temperature-dependent development of Neoseiulus barkeri (Acari: Phytoseiidae) on Tetranychus urticae (Acari: Tetranychidae) at seven constant temperatures [J]. Insect Science, 2012, 19(2): 220−228. DOI: 10.1111/j.1744-7917.2011.01444.x
[29] 张天浩, 惠琴, 赵义涛, 等. 短时高温对绿豆象各虫态生长发育的影响 [J]. 应用昆虫学报, 2020, 57(2):363−370. ZHANG T H, HUI Q, ZHAO Y T, et al. Effects of short-term heat stress on different developmental stages of Callosobruchus chinensis(L. )(Coleoptera: Bruchidae) [J]. Chinese Journal of Applied Entomology, 2020, 57(2): 363−370.(in Chinese)
[30] 崔娟, 乔方, 胡英露, 等. 高温胁迫对筛豆龟蝽成虫抗氧化能力的影响 [J]. 环境昆虫学报, 2021, 43(5):1244−1249. CUI J, QIAO F, HU Y L, et al. Antioxidant responses of Megacopta cribraria (Hemiptera: Plataspidae) adults exposed to high temperature stress [J]. Journal of Environmental Entomology, 2021, 43(5): 1244−1249.(in Chinese)
[31] 向敏, 樊泰山, 扈鸿霞, 等. 短时高温对意大利蝗存活和生殖的影响 [J]. 应用昆虫学报, 2017, 54(3):426−433. XIANG M, FAN T S, HU H X, et al. Effects of short-term exposure to high temperature on the survival and fecundity of Calliptamus italicus(Orthopera: Acrididae) [J]. Chinese Journal of Applied Entomology, 2017, 54(3): 426−433.(in Chinese)
[32] 蒋明星, 张孝羲, 李永飞. 日短期高温对棉铃虫实验种群的影响 [J]. 昆虫知识, 1998, 35(3):139−141. JIANG M X, ZHANG X X, LI Y F. Effects of short-term high temperature on experimental population of cotton bollworm [J]. Entomological Knowledge, 1998, 35(3): 139−141.(in Chinese)
[33] 崔旭红, 徐建信, 李晓宇, 等. 短时高温暴露对Q型烟粉虱成虫存活和生殖适应性的影响 [J]. 中国农学通报, 2011, 27(5):377−379. CUI X H, XU J X, LI X Y, et al. Effects of brief exposure to high temperature on survival and fecundity of Bemisia tabaci Q-biotype (Homoptera: Aleyrodidae) [J]. Chinese Agricultural Science Bulletin, 2011, 27(5): 377−379.(in Chinese)
[34] 蒋丰泽, 郑灵燕, 郭技星, 等. 温度对昆虫繁殖力的影响及其生理生化机制 [J]. 环境昆虫学报, 2015, 37(3):653−663. JIANG F Z, ZHENG L Y, GUO J X, et al. Effects of temperature stress on insect fertility and its physiological and biochemical mechanisms [J]. Journal of Environmental Entomology, 2015, 37(3): 653−663.(in Chinese)
[35] 韩永旭. 高温对亚洲玉米螟生长发育和繁殖的影响[D]. 沈阳: 沈阳农业大学, 2017. HAN Y X. Effects of high temperature on development and fecundity of Ostrinia furnacalis(Guenée)[D]. Shenyang: Shenyang Agricultural University, 2017. (in Chinese)
[36] 杨步莲. 高温对抗性和敏感小菜蛾体内保护酶系的影响[D]. 福州: 福建农林大学, 2012. YANG B L. Effects of high temperature on protective enzyme in resistant and susceptible Plutella xylostella[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese)
[37] 李爽. 雌雄意大利蝗耐高温差异及其生理生化响应对策研究[D]. 乌鲁木齐: 新疆师范大学, 2016. LI S. Differences in heat tolerance and physio-biochemical mechanisms between female and male Calliptamus italicus adults (Orthopera: Acrididae)[D]. Urumqi: Xinjiang Normal University, 2016. (in Chinese)
[38] FRIDOVICH I. Free radical in biology[M]. New York: Academic press, 1976.
[39] PACKER L, OTTING F. Oxygen radicals in biological systems [J]. Academic Press, 1984, 105(1): 273−280.
[40] FRIDOVICH I. Oxygen is toxic! [J]. BioScience, 1977, 27(7): 462−466. DOI: 10.2307/1297527




 下载:
下载: