Physiology and Expression of PIP of Hippophae rhamnoides under Salt Stress
-
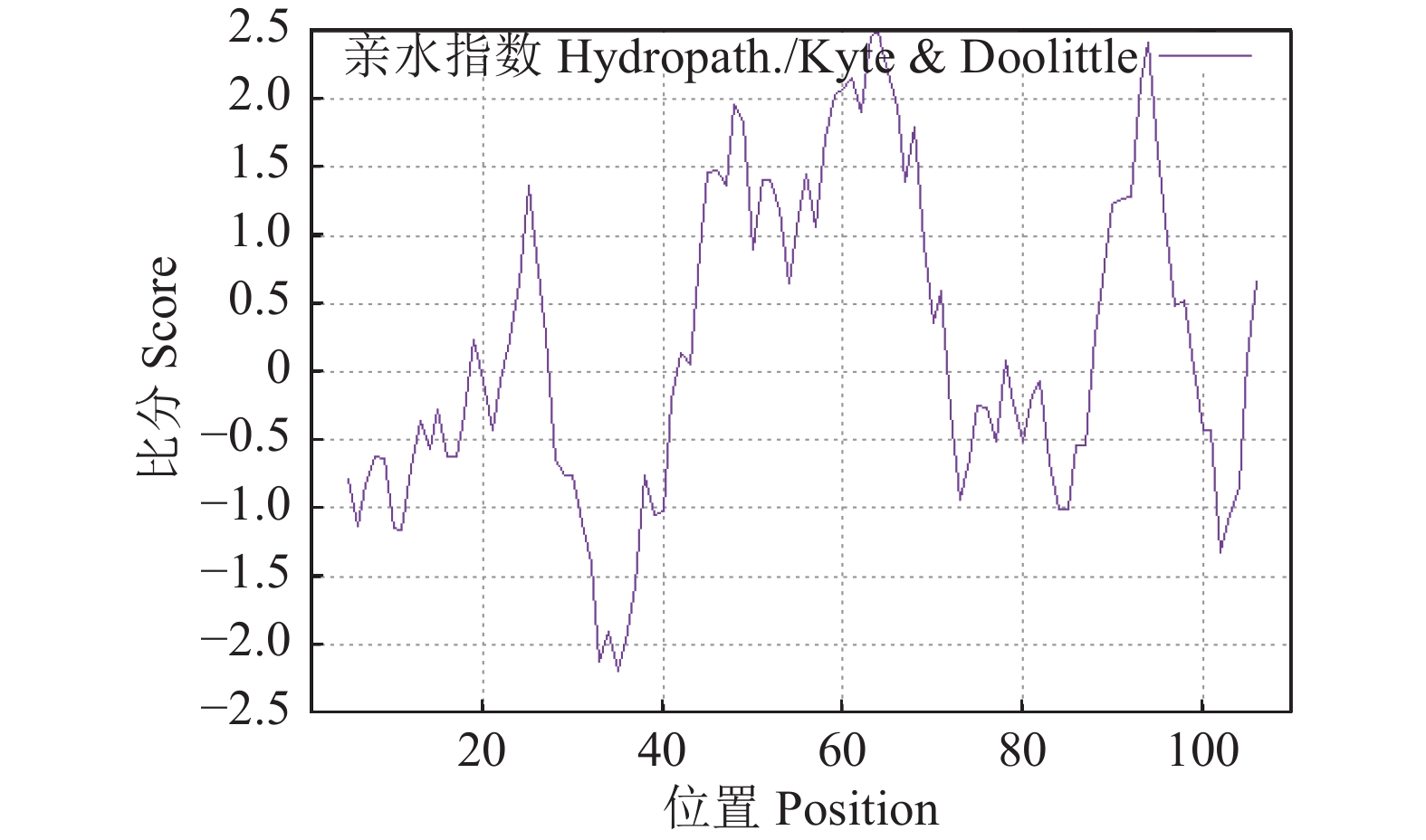
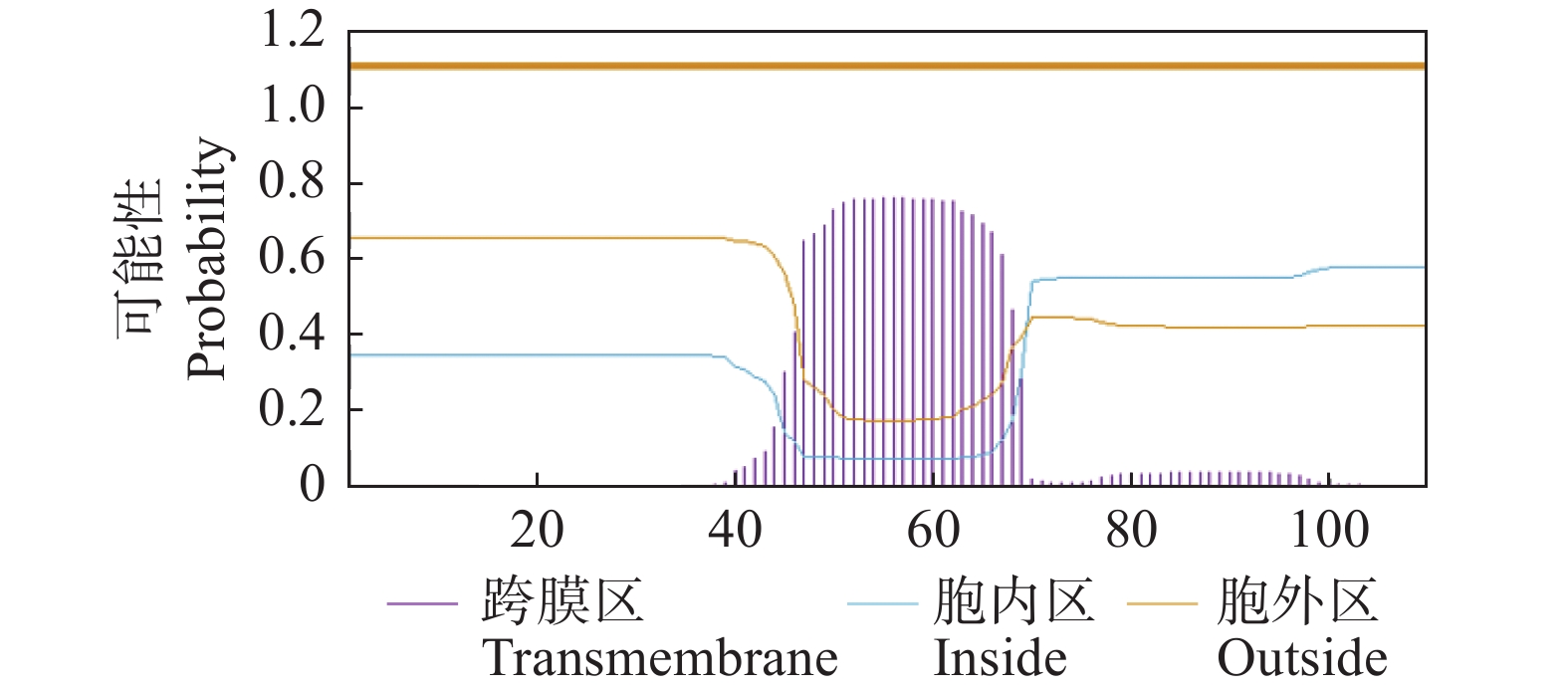
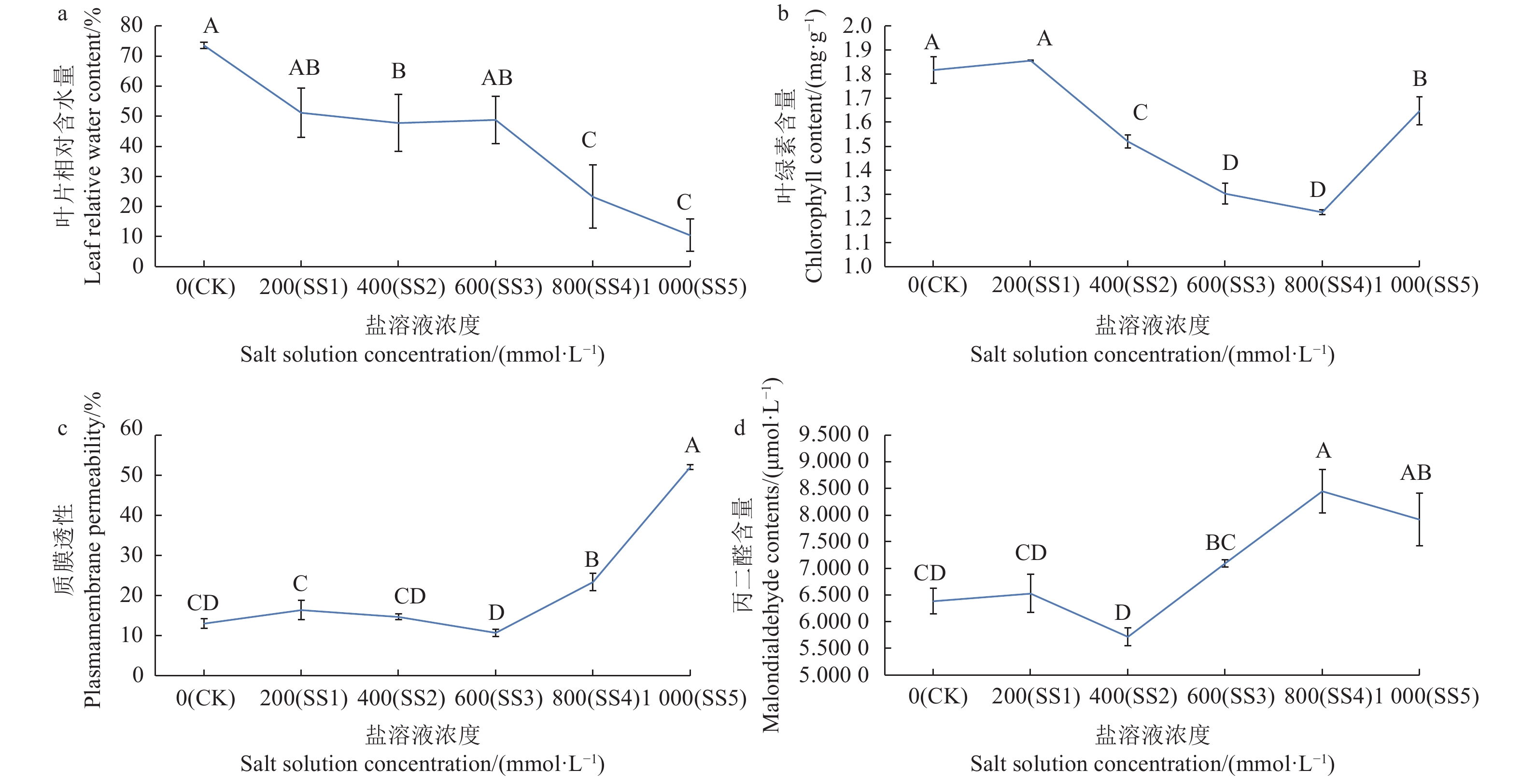
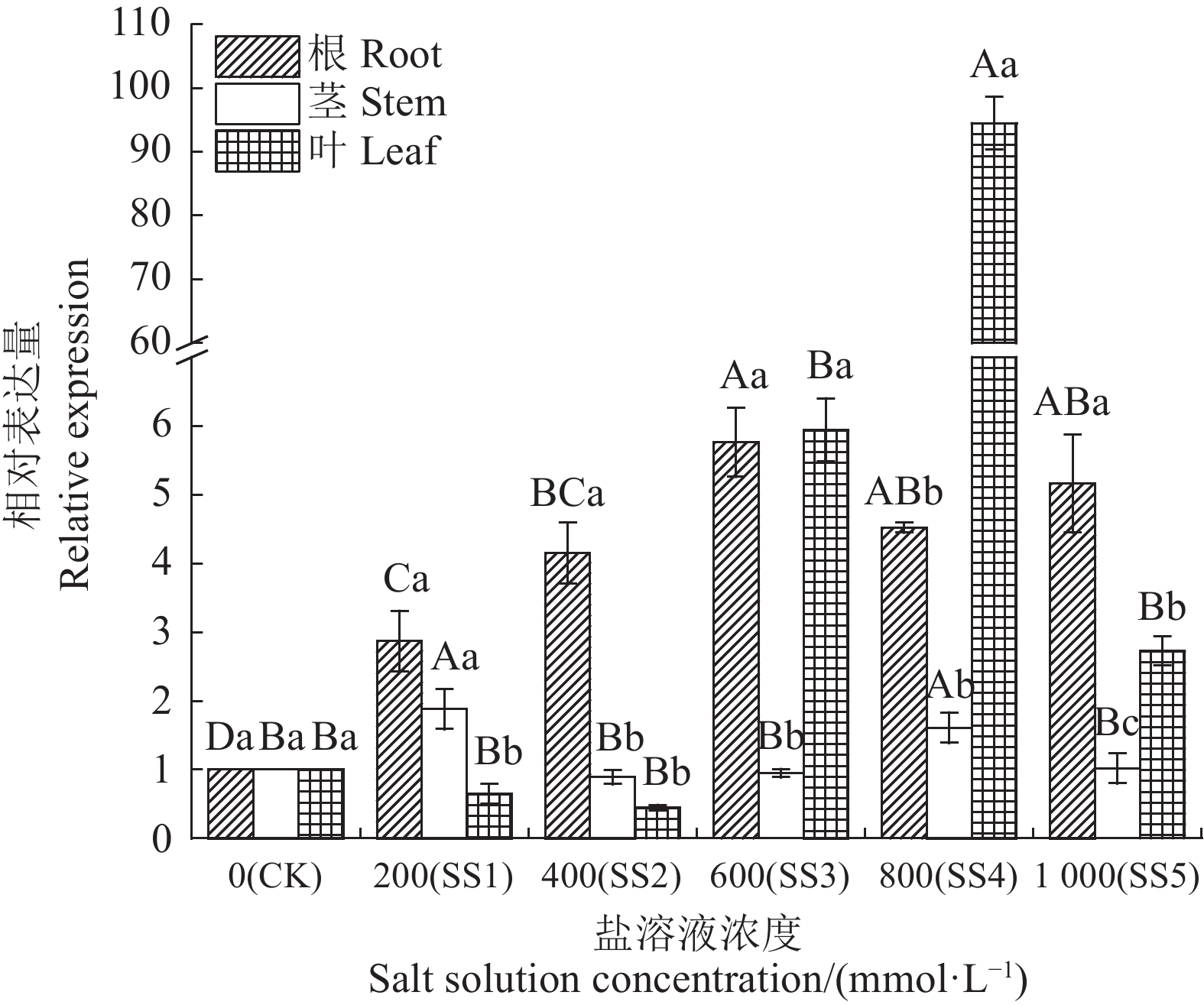
摘要:目的 探讨水通道蛋白(Plasma membrane intrinsic proteins,PIPs)在中国沙棘盐胁迫响应中的作用,为中国沙棘应对盐胁迫机理研究提供参考。方法 以中国沙棘(Hippophae rhamnoides subsp. sinensis)为试验材料,对中国沙棘质膜内在蛋白基因(HrPIP)序列进行生物信息学分析,并研究不同程度盐胁迫(200、400、600、800、1000 mmol·L−1)对中国沙棘生理指标及HrPIP基因表达模式的影响。结果 中国沙棘HrPIP基因编码110个氨基酸,其编码蛋白质位于细胞膜上,无信号肽,无跨膜螺旋区,为疏水性蛋白。中国沙棘相对含水量随着盐胁迫的加深逐渐下降;叶绿素含量总体呈先下降后升高的趋势;质膜透性和丙二醛含量在低浓度盐胁迫下变化不大,在高盐浓度下急剧上升,在1000 mmol·L−1时丙二醛含量有所降低而膜透性继续升高。HrPIP基因的表达随着盐胁迫程度的加剧而变化,其在根中的表达量呈先上升后下降再上升的趋势,在叶中呈先下调后急剧上升而后又下降的趋势,在茎中则呈“M”型表达模式。结论 中国沙棘在盐胁迫下具有一定的抗盐性,胁迫下HrPIP基因的表达量变化促进根的吸水、茎的运输、叶的保水等,从而提高水分吸收,调节自身的耐盐性,说明该基因在中国沙棘应对盐胁迫的过程中起着重要作用。Abstract:Objective Mechanism of aquaporins relating to the plasma membrane intrinsic proteins (PIPs) of Hippophae rhamnoides subsp. sinensis in response to salt stress was studied.Methods Bioinformatics of HrPIP was analyzed. Physiological indexes and expressions of the gene in tissues of H. rhamnoides under normal and imposed salt stresses of 200, 400, 600, 800, or 1,000 mmol ·L−1 NaCl were determined.Results Located in the cell membrane, HrPIP encoded 110 amino acids. The hydrophobic protein had no signal peptide or transmembrane helix region. As salt stress intensified, the RWC decreased gradually, and the chlorophyll content declined initially followed by an incline. The permeability of the plasma membrane and the content of MDA changed slightly when the salt concentration was low but increased significantly when the concentration was high. The 1000 mmol·L−1 salt stress induced declined MDA but continuously rising membrane permeability. The expressions of HrPIP in different organs varied by the increasing salt stress. In roots, it rose at lower salt concentrations then declined but rose again at high salt levels. In the leaves, the opposite trend was observed, whereas it was in an “M” pattern in the stems.Conclusion H.rhamnoides subsp. sinensis was salt resistant to a certain degree. Under the stress, by altering the HrPIP expression to increase water absorption in roots, transport in stems, and retention in leaves the plant manipulated the cellular salt concentration to achieve an improved stress tolerance.
-
Keywords:
- Hippophae rhamnoides subsp. sinensis /
- HrPIP /
- salt stress /
- expression pattern
-
文心兰Oncidium又名舞女兰、瘤瓣兰等,主要分布于中南美洲的热带和亚热带地区。文心兰花色艳丽、花型奇特、观赏期长,是世界重要的盆花和切花种类之一。我国从20世纪90年代开始引种文心兰[1],主要以切花栽培为主。切花文心兰为具假鳞茎薄叶种,15~30℃范围内均能正常生长,15~20℃适宜营养生长,20~25℃适宜开花[2-3]。福建属亚热带湿润气候,其特点是温暖湿润,年平均气温15~22℃,非常适宜文心兰切花栽培,但福州等地夏季持续的高温严重影响了文心兰植株的生长,导致假鳞茎易皱缩,从而影响秋冬季开花产量和品质。
目前国内学者对春兰[4]、杂交兰[5]、金线兰[6]、蝴蝶兰[7]等兰科植物进行了高温胁迫研究,有关文心兰高温胁迫的研究尚未见报道。因此本研究根据福州夏季气温自然变化规律,在光照培养箱中模拟高温胁迫,测定文心兰新芽顶叶中叶绿素、可溶性糖、还原糖、脯氨酸(Pro)等含量及相对电导率、过氧化物酶(POD)活性等多项生理指标,以探讨高温胁迫下文心兰生理变化规律和耐热机制,为筛选出文心兰耐热性鉴定生理指标及建立适宜夏季高温气候特点的栽培管理技术提供理论依据。
1. 材料与方法
1.1 试验材料
以自育切花文心兰新品种‘金辉’为试验试材,选择1个饱满假鳞茎带1个新芽(新芽高度一致,新芽假鳞茎未膨大)的幼苗共192株为供试材料。
1.2 高温处理及取样方法
根据福州夏季日夜气温的自然变化规律,用光照培养箱(光照培养箱为“一恒MGC-450HP-2”,光照时强度为12 000 lx,空气相对湿度75%~80%)模拟高温胁迫。以夏季最高温时温室能调控的温度(黑暗28℃ 10 h→光照30℃ 5 h→光照32℃ 4 h→光照30℃ 5 h,以此循环)为对照(CK),高温处理(T)温度变化为黑暗28℃ 10 h→光照32℃ 2 h→光照36℃ 3 h→光照40℃ 4 h→光照36℃ 3 h→光照32℃ 2 h,以此循环。高温胁迫前在CK条件下预处理7 d,CK与高温胁迫各96株,处理过程中均保持栽培介质湿润。高温胁迫处理共42 d,CK与高温处理均每隔7 d随机选取12株新芽的2片顶叶共24片叶进行生理指标的测定。
1.3 测定内容
各生理指标测定方法参考《植物生理生化实验原理和技术》[8]、《植物生理学实验指导》[9-10]中提供的方法并适当改进。叶绿素含量的测定采用丙酮浸提法,相对电导率的测定采用电导仪法(电导仪为“HANNA HI8733”),可溶性糖的测定采用蒽酮比色法,还原糖的测定采用3,5-二硝基水杨酸法,Pro含量的测定采用茚三酮法,POD活性的测定采用愈创木酚法。紫外可见分光光度计型号为“岛津UV-1780”。各项生理指标的测定均重复3次。叶绿素、可溶性糖、还原糖、Pro的含量均为鲜重的含量,相对电导率及POD活性为鲜样的测定值。用Excel和SPSS软件进行数据统计分析。
2. 结果与分析
2.1 高温胁迫对文心兰形态和叶绿素含量的影响
对照处理42 d后假鳞茎饱满,叶色浓绿无坏死,且新芽基部基本已膨大形成假鳞茎;而高温胁迫处理42 d后植株虽无死亡,但假鳞茎明显失水皱缩,顶叶叶尖出现焦枯,顶叶叶色由浓绿变为黄绿,部分苞叶变黄甚至坏死,新芽基部极少能膨大形成假鳞茎。高温处理后的植株转入温室中均能恢复生长。从图 1可知,受高温胁迫后文心兰顶叶叶绿素(a+b)含量总体上呈现不断下降的变化趋势,而对照则呈平缓上升的变化趋势。高温胁迫7 d时,高温处理叶绿素含量略高于对照,至14~21 d时则低于对照,但差异不显著;当高温胁迫至28 d时叶绿素含量(0.698 mg·g-1)则显著低于对照(0.781 mg·g-1);当高温胁迫至42 d时,叶绿素含量(0.676 mg·g-1)进一步显著降低,比对照下降19.12%。
2.2 高温胁迫对可溶性糖含量的影响
从图 2可知,对照中可溶性糖含量呈不断上升的变化趋势,由7 d的0.189%上升到42 d的0.351%。高温胁迫7~21 d时可溶性糖含量分别为0.222%、0.247%和0.317%,分别比对照提高17.16%、19.32%和10.07%,差异均显著;28~35 d时可溶性糖含量与对照差异不显著,且增幅均减小;至42 d时高温胁迫下可溶性糖含量为0.321%,比对照降低8.55%,差异显著。
2.3 高温胁迫对还原糖含量的影响
从图 3可知,对照与高温胁迫处理还原糖含量的变化趋势基本一致,总体上均持续增加,但在不同时期的增幅和含量有显著差异。高温胁迫7 d时还原糖含量为2.512%,比对照高18.83%,差异显著;随后高温胁迫下还原糖含量增幅减小,至28 d时与对照差异不显著,至35、42 d时高温胁迫下还原糖含量分别为2.750%、2.958%,与对照相比显著降低了11.66%和11.36%。
2.4 高温胁迫对相对电导率的影响
从图 4可知,对照相对电导率呈现先升后降,然后再升再降的变化趋势,而高温胁迫下相对电导率先升高后趋于稳定的变化趋势,高温胁迫下相对电导率显著高于对照,提高幅度为8.49~20.66%。高温胁迫7~35 d时相对电导率持续上升,由21.48%上升到24.80%;35~42 d时下降,但差异不显著。
2.5 高温胁迫对Pro含量的影响
从图 5可知,对照与高温胁迫处理下文心兰顶叶Pro含量的变化趋势基本一致,均呈升、降、升的变化趋势,但高温胁迫下Pro含量均显著高于对照。7~14 d时Pro含量均持续上升,至14 d时高温胁迫下Pro含量为25.69 μg·g-1,比对照高51.30%;14~28 d时Pro含量均缓慢下降;高温胁迫28~42 d时Pro含量急剧上升,至42 d时Pro含量高达28.38 μg·g-1,比对照高56.11%。
2.6 高温胁迫对POD活性的影响
从图 6可知,随高温胁迫时间的增加,文心兰顶叶中POD活性呈不断上升的变化趋势。处理7~21 d时POD活性上升较缓,且低于对照,但差异不显著;高温胁迫28 d以后POD活性具有较大幅度的增强,且高于对照;至35、42 d时POD活性显著提高,分别为0.0464U·g-1·min-1和0.0496 U·g-1·min-1,分别比对照提高8.47%和11.58%。
3. 讨论与结论
叶绿素是光合作用不可缺少的物质,叶绿素含量多少与光合机能大小密切相关。本研究中受持续高温胁迫后文心兰顶叶叶绿素含量不断下降,这与春兰[4]、蝴蝶兰[7, 11]的研究结果一致。本研究中高温胁迫7 d时叶绿素含量略高于对照,这与短暂的高温提高了叶绿素合成相关酶的活性,从而加快了叶绿素的合成有关[12],银杏中也有类似的报道[13];随高温胁迫时间的延长,持续高温降低了叶绿素的合成,同时高温胁迫下活性氧氧化加速了叶绿素的降解[14],因此叶绿素含量显著降低。
脯氨酸、可溶性糖是重要的渗透调节物质。当植物处于逆境胁迫下,脯氨酸合成酶类对脯氨酸的反馈抑制的敏感性降低,导致体内游离脯氨酸含量增加[15],且增长的百分率大小与耐热性有关[16],但胁迫温度过高时又会导致脯氨酸含量降低[17]。本研究中受高温胁迫文心兰顶叶中脯氨酸含量显著提高,且与对照保持一致的动态变化趋势,说明文心兰具有较好的耐热性。可溶性糖是重要的光合产物,本研究发现高温胁迫初期能显著提高可溶性糖的积累,但随高温胁迫时间的进一步延长,可溶性糖的积累显著下降,可能是高温胁迫后期叶绿素降解导致光合效率降低引起的,这与金线莲的研究结果一致[6]。本研究中高温胁迫初期还原糖含量显著提高,这可能与高温胁迫下植株体内碳水化合物转换以提高抗性有关[18],随高温胁迫时间的延长,还原糖含量显著低于对照,这可能与光合作用减弱而呼吸作用加强有关,这与在黄瓜中的研究结果一致[19]。
高温胁迫下膜蛋白受伤害导致细胞膜透性增加,胞液外渗而使相对电导率增大[20],因此叶片相对电导率是耐热性鉴定的重要生理指标。本研究中高温胁迫下顶叶相对电导率显著高于对照,高温胁迫前期相对电导率增幅较大,后期趋于稳定,表明高温胁迫初期一定程度上破坏了细胞膜,后期电导率的下降说明植株抗逆性增强,提高了对高温环境的适应能力。本研究中相对电导率的变化与甜椒[21]、辣椒[22]的研究结果一致。
POD是氧化酶系统中的保护酶,是细胞内防御酶系统中重要的清除酶之一。高温胁迫下POD活性变化主要与品种耐热性、处理温度及处理时间有关[23],POD含量越高,其耐热性越好,适应性越强[24]。本研究中高温胁迫初期POD活性低于对照,但后期活性急剧增加且显著高于对照,这种变化规律与小苍兰类似[25],这可能与叶绿素降解和膜脂过氧化有关。不断升高的POD活性能分解膜脂过氧化产生的H2O2,从而防止细胞膜的伤害,表明文心兰具有很好的耐热性。
综上所述,高温胁迫下文心兰顶叶的相对电导率及脯氨酸含量均显著高于对照,而叶绿素含量则不断降低,说明以上指标可作为鉴定文心兰耐热性的关键指标;可溶性糖含量、还原糖含量、POD活性的变化趋势则与高温胁迫的时间有关,可作为辅助指标。
-
图 6 HrPIP基因在中国沙棘根茎叶中的表达模式
不同大写字母表示不同胁迫处理下差异极显著(P<0.01),不同小写字母表示不同组织之间差异显著(P<0.05)。
Figure 6. Expressions of HrPIP in roots and leaves of H. rhamnoides
Data with different capital letters indicate extremely significant difference under treatments (P<0.01); those with different lowercase letters, significant difference between tissues (P<0.05).
-
[1] 曲悦, 王姝瑶, 郝鑫, 等. 盐胁迫诱导植物交叉适应及其信号转导 [J]. 植物生理学报, 2022, 58(6):1045−1054. DOI: 10.13592/j.cnki.ppj.300027 QU Y, WANG S Y, HAO X, et al. Plant cross-adaptation and signal transduction induced by salt stress [J]. Plant Physiology Journal, 2022, 58(6): 1045−1054.(in Chinese) DOI: 10.13592/j.cnki.ppj.300027
[2] 刘云芬, 彭华, 王薇薇, 等. 植物耐盐性生理与分子机制研究进展 [J]. 江苏农业科学, 2019, 47(12):30−36. LIU Y F, PENG H, WANG W W, et al. Research progress on physiological and molecular mechanisms of salt tolerance for plants [J]. Jiangsu Agricultural Sciences, 2019, 47(12): 30−36.(in Chinese)
[3] 赵亚楠, 王建鑫, 陈蜜蜜, 等. 盐胁迫下对植物生长影响的研究进展[C]//华北五省市(区)环境科学学会第二十二届学术年会论文集. 2021: 18–24. [4] 包珠拉太, 高丽, 王锁民. 植物水通道蛋白及其生理功能 [J]. 植物生理学报, 2017, 53(7):1171−1178. BAO Z, GAO L, WANG S M. Physiological functions of plant aquaporin [J]. Plant Physiology Journal, 2017, 53(7): 1171−1178.(in Chinese)
[5] MAUREL C, VERDOUCQ L, RODRIGUES O. Aquaporins and plant transpiration [J]. Plant, Cell & Environment, 2016, 39(11): 2580−2587.
[6] PAWŁOWICZ I, MASAJADA K. Aquaporins as a link between water relations and photosynthetic pathway in abiotic stress tolerance in plants [J]. Gene, 2019, 687: 166−172. DOI: 10.1016/j.gene.2018.11.031
[7] ZWIAZEK J J, XU H, TAN X F, et al. Significance of oxygen transport through aquaporins [J]. Scientific Reports, 2017, 7: 40411. DOI: 10.1038/srep40411
[8] 阮成江, 谢庆良. 盐胁迫下沙棘的渗透调节效应 [J]. 植物资源与环境学报, 2002, 11(2):45−47. RUAN C J, XIE Q L. Osmotic adjustment effect of Hippophae rhamnoides L. under salt stress [J]. Journal of Plant Resources and Environment, 2002, 11(2): 45−47.(in Chinese)
[9] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [10] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR [J]. Nucleic Acids Research, 2001, 29(9): e45. DOI: 10.1093/nar/29.9.e45
[11] 谭照国, 苑少华, 李艳梅, 等. 小麦TaPIP1基因克隆及其在花药开裂中潜在功能分析 [J]. 作物学报, 2022, 48(9):2242−2254. TAN Z G, YUAN S H, LI Y M, et al. Cloning of TaPIP1 gene and its potential function in anther dehiscence in wheat [J]. Acta Agronomica Sinica, 2022, 48(9): 2242−2254.(in Chinese)
[12] LI R, WANG J F, LI S T, et al. Plasma membrane intrinsic proteins SlPIP2;1, SlPIP2;7 and SlPIP2;5 conferring enhanced drought stress tolerance in tomato [J]. Scientific Reports, 2016, 6: 31814. DOI: 10.1038/srep31814
[13] 张冰冰, 孙天旭, 赵月明, 等. 羊草LcPIP基因遗传转化露地菊及其抗盐性鉴定 [J]. 植物生理学报, 2018, 54(3):491−499. ZHANG B B, SUN T X, ZHAO Y M, et al. Genetic transformation of LcPIP gene in Chrysanthemum morifolium and identification of its salt resistance [J]. Plant Physiology Journal, 2018, 54(3): 491−499.(in Chinese)
[14] 余桂红, 孙晓波, 张旭, 等. 转SbPIP1基因小麦植株的获得及发芽期耐盐性鉴定 [J]. 分子植物育种, 2012, 10(4):398−403. YU G H, SUN X B, ZHANG X, et al. Obtaining of transgenic wheat plants with SbPIP1 gene and preliminary assay of salt tolerance [J]. Molecular Plant Breeding, 2012, 10(4): 398−403.(in Chinese)
[15] HUANG L Y, LI Z Z, PAN S B, et al. Ameliorating effects of exogenous calcium on the photosynthetic physiology of honeysuckle (Lonicera japonica) under salt stress [J]. Functional Plant Biology, 2019, 46(12): 1103−1113. DOI: 10.1071/FP19116
[16] 刘晶, 才华, 刘莹, 等. 两种紫花苜蓿苗期耐盐生理特性的初步研究及其耐盐性比较 [J]. 草业学报, 2013, 22(2):250−256. LIU J, CAI H, LIU Y, et al. A study on physiological characteristics and comparison of salt tolerance of two Medicago sativa at the seedling stage [J]. Acta Prataculturae Sinica, 2013, 22(2): 250−256.(in Chinese)
[17] 冉昆, 孙晓莉, 张勇, 等. 杜梨质膜水孔蛋白基因PbPIP1的克隆与表达分析 [J]. 植物生理学报, 2016, 52(6):868−876. RAN K, SUN X L, ZHANG Y, et al. Cloning and expression analysis of a plasma membrane aquaporion gene PbPIP1 in Pyrus betulifoli a [J]. Plant Physiology Journal, 2016, 52(6): 868−876.(in Chinese)
[18] 周洪华, 李卫红. 胡杨木质部水分传导对盐胁迫的响应与适应 [J]. 植物生态学报, 2015, 39(1):81−91. DOI: 10.17521/cjpe.2015.0009 ZHOU H H, LI W H. Responses and adaptation of xylem hydraulic conductivity to salt stress in Populus euphratic a [J]. Chinese Journal of Plant Ecology, 2015, 39(1): 81−91.(in Chinese) DOI: 10.17521/cjpe.2015.0009
[19] 岳川, 曹红利, 王赞, 等. 茶树水通道蛋白基因的克隆与表达分析 [J]. 西北植物学报, 2018, 38(8):1419−1427. DOI: 10.7606/j.issn.1000-4025.2018.08.1419 YUE C, CAO H L, WANG Z, et al. Cloning and expression analysis of aquaporin protein genes in tea plant(Camellia sinensis) [J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(8): 1419−1427.(in Chinese) DOI: 10.7606/j.issn.1000-4025.2018.08.1419
[20] 颜培玲, 潘学军, 张文娥. 野生毛葡萄水通道蛋白基因VhPIP1的克隆及其在干旱胁迫下的表达分析 [J]. 园艺学报, 2015, 42(2):221−232. DOI: 10.16420/j.issn.0513-353x.2014-0875 YAN P L, PAN X J, ZHANG W E. Cloning of aquaporion gene VhPIP1 in Vitis heyneana and its expression under drought stress [J]. Acta Horticulturae Sinica, 2015, 42(2): 221−232.(in Chinese) DOI: 10.16420/j.issn.0513-353x.2014-0875
[21] LI W, FU L F, GENG Z W, et al. Physiological characteristic changes and full-length transcriptome of rose (Rosa chinensis) roots and leaves in response to drought stress [J]. Plant and Cell Physiology, 2021, 61(12): 2153−2166. DOI: 10.1093/pcp/pcaa137
[22] KIM Y, CHUNG Y S, LEE E, et al. Root response to drought stress in rice (Oryza sativa L. ) [J]. International Journal of Molecular Sciences, 2020, 21(4): 1513. DOI: 10.3390/ijms21041513
[23] GUPTA A, RICO-MEDINA A, CAÑO-DELGADO A I. The physiology of plant responses to drought [J]. Science, 2020, 368(6488): 266−269. DOI: 10.1126/science.aaz7614
[24] 李淑钰, 李传友. 植物根系可塑性发育的研究进展与展望 [J]. 中国基础科学, 2016, 18(2):14−21. DOI: 10.3969/j.issn.1009-2412.2016.02.002 LI S Y, LI C Y. Developmental plasticity of plant roots [J]. China Basic Science, 2016, 18(2): 14−21.(in Chinese) DOI: 10.3969/j.issn.1009-2412.2016.02.002
-
期刊类型引用(9)
1. 常翠芳,郭丽娟,于宏,韩亚梅,朱景乐,武荣花. 四个长阶花品种叶片对高温胁迫形态及生理响应. 北方园艺. 2024(11): 56-63 .  百度学术
百度学术
2. 罗小燕,罗远华,易双双,李崇晖,廖易,张志群,郑碧兰,陆顺教. 不同文心兰品种耐热性指标筛选与评价体系构建. 热带作物学报. 2024(07): 1348-1358 .  百度学术
百度学术
3. 罗小燕,易双双,李崇晖,廖易,张志群,陆顺教. 兰花热胁迫响应机制及耐热性研究进展. 分子植物育种. 2023(19): 6406-6412 .  百度学术
百度学术
4. 郑素兰,林莹,黄宇,刘磊. 高温胁迫对2个矾根盆栽品种生理特性的影响. 闽南师范大学学报(自然科学版). 2021(01): 114-118 .  百度学术
百度学术
5. 冯保云,李蓉,赖钟雄,林玉玲. 文心兰HSP70基因的克隆及表达分析. 热带作物学报. 2020(04): 745-754 .  百度学术
百度学术
6. 罗远华,方能炎,林榕燕,钟淮钦,黄敏玲. 遮光处理对文心兰生长发育和生理指标的影响. 北方园艺. 2019(01): 91-97 .  百度学术
百度学术
7. 颜彩燕,边子星,杨福孙,姚肖健. 金针菇菌渣肥料的制备及其对文心兰生长发育的影响. 中国食用菌. 2019(12): 20-23 .  百度学术
百度学术
8. 罗远华,方能炎,林榕燕,钟淮钦,黄敏玲. 温度对文心兰生长特性和生理指标的影响. 福建农业学报. 2018(07): 702-707 .  本站查看
本站查看
9. 肖文芳,李佐,陈和明,吕复兵. 不同蝴蝶兰品种耐热性比较测定及综合评价. 热带农业科学. 2018(12): 43-48 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载: