Germination of Acacia cincinnata Seeds Promoted by Applied Electric Field
-
摘要:目的 分析不同电场、时间及两者交互处理对卷荚相思种子萌发特性的影响,为卷荚相思种子萌发及可持续经营提供理论参考。方法 以卷荚相思种子为研究对象,采用室内模拟试验,以不同电场强度和处理时间为控制因素,电压强度为0.0、0.2、0.4、0.6、0.8、1.0 kV·cm−1,时间处理为0、15、30、45、60 min,研究不同电场强度和时间交互处理对其种子萌发特性的影响。结果 随着电场强度增强,处理时间的延长,卷荚相思种子的发芽率、发芽势和发芽指数均呈现不同程度的变化趋势。其中,在处理时间15、30、60 min下发芽率随着电场强度的增强呈现先降后升再降的趋势,但在处理时间45 min下发芽率随着电场强度的增强呈现先升后降的趋势;而发芽势和发芽指数均在电场强度0.6~0.8 kV·cm−1和处理时间45 min下处于最优状态,且与CK相比具有显著差异(P<0.05)。经过多元非线性回归分析得出,不同电场强度与时间交互处理下的最优回归方程为:Y=7.73+135.23X1+1.24X2-86.16X12−0.00911X22−0.75X1X2(R2=0.81,P<0.05)。聚类分析结果电场和时间交互环境处理对发芽指数有非常显著的影响。结论 电场和时间两者交互处理对卷荚相思种子萌发特性具有一定的影响,发芽率在0.6 kV·cm−1处理45 min最高,说明适宜电场强度和处理时间可以提高卷荚相思种子发芽率。Abstract:Objective Effect of electric field and treatment time applied to Acacia cincinnata seeds on germination was investigated.Method A. cincinnata seeds were treated by electric voltages ranging from 0 (CK) to 1.0 kV·cm−1 for 15, 30, 45, or 60m prior to germination under normal conditions. Indicators of germination displayed by the seeds were analyzed.Result The seeds exposed to an increasing electric field for up to 60 m germinated at a rate that showed a down-up-down pattern with a peak at 45m. The germination potential and index were at the highest under 0.6−0.8 kV·cm−1 for 45 m and significantly different from CK (P<0.05). A best fit regression function between the applied electric field and time was found to be Y = 7.73 + 135.23 X1 + 1.24 X2−86.16 X12−0.00911 X22 - 0.75 X1 X2 at R2 = 0.81 (P<0.05). A cluster analysis indicated an extremely significant effect of the electric field/time interaction exerted on the seed germination index.Conclusion The of an electric field and treatment time applied on A. cincinnata seeds significantly affected the germination with a rate peaked under 0.6 kV·cm−1 for 45 m.
-
0. 引 言
【研究意义】卷荚相思(Acacia cincinnata)属豆科金(Leguminosae)合欢(Vachellia farnesiana)属植物,在我国南方地区广泛种植。卷荚相思是沿海沙地重要的树种资源之一,具有适生性强、产量高、生长快、性状优良等特性,是优质的家具用材和造纸树种[1]。但在林业生产中,经常会出现种子空壳、质量不高、籽粒不饱满等现象,最终导致卷荚相思种子萌发率不高,因此选择合适的方法提高卷荚相思种子的萌发率非常必要。物理农林业是物理技术和农林业生产有机结合的一种生产方式,将电、磁、光、热等物理学科知识与农林业生产相关领域的前沿技术结合起来,使用特殊技术方法处理植物,在无污染的条件下,达到增产、优质、抗病和高效的目的,并且在工艺上和成本上都易于实现,在农林业中的应用和研究是十分广泛的。目前,电场种子处理技术应用于种植业和养殖业,在农林业生产和环境保护中已发挥巨大的作用[2]。为此探讨电场处理对卷荚相思种子萌发的影响效应,为研究种子萌发提供理论基础。【前人研究进展】相关研究表明,电场与时间两者交互处理不仅可以刺激植物种子萌发、生长、愈伤组织形成以及细胞融合,而且可以提高细胞膜内的电位差,膜内外电位差的改变,影响物质交换的速度[3];电场处理技术在食品加工和贮存[4]、畜牧业[5]、水产养殖业[6]和病虫害防治[7]等方面都获得了重要的成果,取得了显著的经济效益[8]。种子顺利萌发、成苗是植物完成生活史的前提,除受种子自身大小、质量、环境和储存方式等因素影响外,还受制于前期对种子的处理等重要因素[9]。利用适宜的电场处理植物种子可以明显提高种子活力,并且提高种子的发芽率、发芽势和发芽指数,使其出苗整齐和迅速,促进了作物对生长发育所需要养分的吸收,加速植物的生长发育,促进其光合作用,提高植物的产量及质量[10−15]。【本研究切入点】目前电场处理对卷荚相思种子萌发影响和生长的影响研究鲜见报道,电场强度和处理时间对植物种子萌发的影响阈值尚未确定。【拟解决的关键问题】开展不同电场强度和处理时间交互下对卷荚相思种子萌发的影响试验,研究萌发阈值及其对生长指标影响等问题,为卷荚相思种子萌发及可持续经营提供理论参考。
1. 材料与方法
1.1 试验区概况
试验地位于福建农林大学(119°13′51.73″E、26°04′55.5″N),属于亚热带季风性气候,全年冬暖夏凉,年平均日照1755.4 h,无霜期达360 d以上。年均温为19.9 ℃,极端最高温42 ℃,最低温度为0 ℃,年空气相对湿度79 %。
1.2 供试材料
试验所用卷荚相思种子于2022年3月采集于福建省漳浦中西国有林场,选取大小一致、颗粒饱满的种子用于萌发试验。
1.3 试验设计
本试验电场由波尔高压电源73030P型电场发生器产生,使用2块平行金属板进行连接且金属板之间保持0.5 cm距离并形成一个连续可调的电场,种子均匀分布在底层金属板上。利用二次通用旋转组合设计[16]进行预试验,设置电场强度分别为0.2、0.4、0.6、0.8、1.0 kV·cm−1和处理时间分别为15、30、45、60 min的电场处理,未经处理为对照(CK),以电压强度和时间为控制因素,共计20个处理,1个对照,每个处理3个重复,每个重复50粒种子。
1.4 试验方法
电场处理种子后第2天进行置床,采用纸上培养法[17]进行种子萌发试验,将处理后的种子用15% 福尔马林消毒30 min并用蒸馏水冲洗数遍。将各培养皿内滤纸润湿后每个培养皿50粒种子,并重复3次。将培养皿放入恒温培养箱中进行发芽试验,设定萌发条件为温度25 ℃,湿度70%,12 h光照和12 h黑暗交替。在每个培养皿中加入2 mL蒸馏水,每天17:00记录种子萌发情况。当种子胚根突破种皮2 mm时,视为种子萌发。
1.5 萌发指标计算
卷荚相思种子在第3天开始萌发并于12 d后结束发芽,发芽结束后分别计算发芽率、发芽势和发芽指数。公式如下[18]:
发芽率(GE)/% = (发芽种子数/供试种子数) ×100;
发芽势(GR)/% = (初期发芽种子数/供试种子数) ×100;
发芽指数 (GI) = ∑(第t天种子发芽数/相应发芽天数)。
1.6 数据分析
采用SPSS 25.0对种子萌发指标进行统计分析,运用Duncan’s法进行多重比较(P<0.05)不同电场和时间交互处理种子萌发特性;种子萌发指标采用平均值±标准误表示。为了验证数据是否满足条件,对其进行KS检验,如若原始数据不满足正态分布,对原始数据进行10作底数的lg(x+1)对数转换,保证数据呈正态分布。采用Origin 2022进行非线性回归分析和聚类分析。
2. 结果与分析
2.1 电压和时间交互处理对种子萌发特性的影响
2.1.1 不同电场强度和时间交互处理对种子发芽率的影响
在电场强度和时间交互处理下,卷荚相思的种子发芽率在一定程度上存在差异(表1)。从电场强度看,在15~60 min时发芽率随着电场的增高与CK相比呈现先降后升再降的趋势,且在电场强度0.6 kV·cm−1,处理时长为45、60 min时和电场强度0.8 kV·cm−1,处理时长为30 min时卷荚相思种子的发芽率均达较高水平,分别为75.00%、74.67%和74.33%,比CK分别提高13.64%、13.14%和12.62%,且存在显著差异。从处理时间来看,在电场强度为0.6 、0.8 kV·cm−1时,随着处理时间的延长,卷荚相思种子发芽率逐渐提高,呈现先升后降的趋势,且均高于CK,0.6 kV·cm−1时与CK相比分别提高2.5%、8.1%、13.63%和13.14%;0.8 kV·cm−1时与CK相比分别提高1.0%、12.62%、8.1%和6.1%。说明在电场强度0.8 kV·cm−1、处理时间45 min的双因素交互处理下,可以有效提高种子的发芽率。
表 1 不同电场强度与时间交互处理对卷荚相思种子发芽率的影响Table 1. Effect of applied electric field and treatment time on germination rate of A. cincinnata seeds(单位:%) 电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 66.00±4.00 aA 66.00±4.00 aA 66.00±4.00 aB 66.00±4.00 aC 66.00±4.00 aAB 0.2 66.00±4.00 aA 48.67±2.52 cC 55.00±2.00 bcD 66.00±3.00 aC 60.67±5.77 abB 0.4 66.00±4.00 aA 56.00±2.00 bB 67.33±1.15 aB 70.33±1.53 aAB 70.00±3.46 aA 0.6 66.00±4.00 bA 67.67±2.52 abA 71.33±3.06 abAB 75.00±3.00 aA 74.67±7.57 aA 0.8 66.00±4.00 cA 66.67±2.08 bcA 74.33±3.51 aA 71.33±2.52 abAB 70.00±2.00 abcA 1.0 66.00±4.00 aA 65.33±2.52 aA 60.33±3.51 abC 59.33±2.52 bD 50.00±2.00 cC 同行中不同小写字母代表不同处理时间存在显著差异(P<0.05),同列中不同大写字母代表不同电场强度存在显著差异(P<0.05)。下同。
Data with different lowercase letters on same row represent significant differences under different treatment times (P<0.05); and those with different uppercase letters on same column represent significant differences under different electric field (P<0.05). Same for below.2.1.2 不同电场强度和时间交互处理对种子发芽势的影响
不同电场强度和时间交互处理对卷荚相思种子发芽势有不同程度的影响且存在一定差异(表2)。不同强度的电场可产生不同的生物学效应,发芽势有时升高,有时降低,但整体呈现出促进作用。0.2 kV·cm−1处理下随着时间的延长呈现先下降后上升再下降的趋势,且在15 min时与CK有显著差异(P<0.05);0.4 kV·cm−1处理下随着时间的延长呈现先降后升的趋势,在60 min时发芽势达最高,但是与CK无显著差异(P>0.05);0.6~1.0 kV·cm−1 处理下随着时间的延长呈现先升后降的趋势,且电场强度在0.8 kV·cm−1、处理时间45 min时发芽势达到最高并且与CK相比有显著差异(P<0.05),表2可以看出电场强度在0.6 、0.8 kV·cm−1,处理时间在30~45 min时,对卷荚相思种子的发芽势有一定的促进作用,并且与CK相比显著提高(P<0.05)。说明电场处理对卷荚相思种子具有一定的改善作用,在电场强度0.8 kV·cm−1、处理时间45 min可以促进发芽势的提高。
表 2 不同电场强度与时间交互处理对卷荚相思种子发芽势的影响Table 2. Effect of applied electric field and treatment time on germination potential of A. cincinnata seeds(单位:%) 电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 39.67±2.08 aA 39.67±2.08 aCD 39.67±2.08 aB 39.67±2.08 aB 39.67±2.08 aB 0.2 39.67±2.08 abA 30.51±1.47 cE 36.24±3.31 abB 40.38±3.19 aB 35.33±1.15 bBC 0.4 39.67±2.08 abA 37.99±1.98 cD 38.38±4.65 cB 42.43±5.00 abB 46.67±4.16 aA 0.6 39.67±2.08 bA 48.02±1.60 aA 49.99±4.52 aA 50.58±1.87 aA 49.00±3.00 aA 0.8 39.67±2.08 cA 47.33±3.88 bAB 50.37±1.46 abA 52.73±1.79 aA 47.33±3.05 bA 1.0 39.67±2.08 abA 42.98±3.61 aBC 41.26±3.85 aB 41.23±5.27 aB 33.19±2.71 bC 2.1.3 不同电场强度和时间交互处理对种子发芽指数的影响
不同电场强度和时间交互处理对卷荚相思种子发芽指数有不同程度的影响并且存在一定的差异(表3)。从不同的电场强度看,0.2 kV·cm−1处理下的发芽指数在45 min时处于最高值,与CK相比提高了13.91%,但并无显著差异(P>0.05);0.4 kV·cm−1处理下的发芽指数呈现先降后升的趋势;0.6~1.0 kV·cm−1处理下的发芽指数均呈现先升后降的趋势,且在电场强度0.8 kV·cm−1、处理时间45 min时处于最高值,与CK相比提高了24.63%,具有显著差异(P<0.05);0.6 kV·cm−1处理下在处理时间15~60 min时与CK均有显著差异(P<0.05),1.0 kV·cm−1处理下在45 、60 min与CK相比降低了11.95%和12.68%,具有显著差异(P<0.05)。在相同处理时间下,随着电场强度的增强对发芽指数均产生不同程度的影响,可以看出0.4~0.6 kV·cm−1电场强度在30~60 min处理时间下对卷荚相思种子发芽指数刺激的作用优于0.2 、1.0 kV·cm−1的电场强度。从表中可以看出在电场和时间两者交互处理下能够促进卷荚相思种子的萌发,在电场强度0.8 kV·cm−1、处理时间45 min可以促进发芽指数的提高,具有优化促进作用。
表 3 不同电场强度与时间交互处理对卷荚相思种子发芽指数的影响Table 3. Effect of applied electric field and treatment time on germination index of A. cincinnata seeds电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 8.12±0.40 aA 8.12±0.40 aB 8.12±0.40 aBC 8.12±0.40 aCD 8.12±0.40 aBCD 0.2 8.12±0.40 abA 6.21±0.41 cD 7.38±0.63 bC 9.25±1.01 aABC 7.79±0.51 bCD 0.4 8.12±0.40 abA 7.12±0.47 bC 8.74±0.77 aAB 8.63±0.79 aBC 9.15±0.36 aAB 0.6 8.12±0.40 bA 9.24±0.66 abA 9.83±0.71 aA 9.57±0.55 abAB 9.35±1.18 abA 0.8 8.12±0.40 cA 8.91±0.22 bcAB 9.67±0.55 abA 10.12±0.52 aA 8.85±0.47 bcABC 1.0 8.12±0.40 aA 8.16±0.37 aB 7.64±0.70 abBC 7.15±0.23 bD 7.09±0.33 bD 2.1.4 电场和时间双因素交互处理对种子形态指标的影响
电场和时间交互处理对卷荚相思种子形态指标的双因素方差分析结果(表4)表明,电场、时间及两者交互处理对卷荚相思种子的发芽率、发芽势和发芽指数均具有显著影响(P<0.05)。
表 4 电场和时间交互处理对卷荚相思种子形态指标影响的双因素方差分析Table 4. Two-way ANOVA on effects of applied electric field and treatment time on morphological indexes of A. cincinnata seeds参数
Parameter电场强度
Electric field strength处理时间
Handling time电场强度×处理时间
electric field strength×
Handling timeF值
F valueP值
P valueF值
F valueP值
P valueF值
F valueP值
P value发芽率 GE 51.004 0.000 13.908 0.000 8.292 0.000 发芽势 GR 42.144 0.000 4.332 0.010 3.139 0.003 发芽指数 GI 27.919 0.000 7.365 0.000 4.294 0.000 2.2 卷荚相思种子萌发特性模型及分类分析
2.2.1 卷荚相思种子发芽率非线性回归方程的建立
对不同电场强度与处理时间进行非线性回归分析(表5)。发芽率(Y)作为因变量,自变量为电场(X1)和时间(X2),将这2个变量引入方程。通过非线性回归分析,不同电场强度与时间交互处理下的最优回归方程为:Y=7.73+135.23X1+1.24X2−86.16X12−0.00911X22−0.75X1X2,非线性回归方程达到显著水平(P<0.05),对回归方程进行显著性F检验,其F值为45.01806,大于F0.05(5,50)=2.40,表明非线性回归方程与实际情况拟合度高,能反映2项因素与发芽率的综合关系,说明上述模型具有统计学意义。
表 5 不同电场强度与时间交互处理对发芽率非线性回归模型Table 5. Nonlinear regression model between seed germination rate and applied electric field/time方程拟合度
R2调整后R2
Adjusted R2平方和 Square sum df 均方 Mean square F值 F value 回归
regression残差
residual error回归
regression残差
residual error回归
regression残差
residual error0.81 0.79 3251.04548 779.93786 5 54 650.2091 14.44329 45.01806 2.2.2 不同电场强度和时间交互处理下种子萌发特性热图及其聚类分析
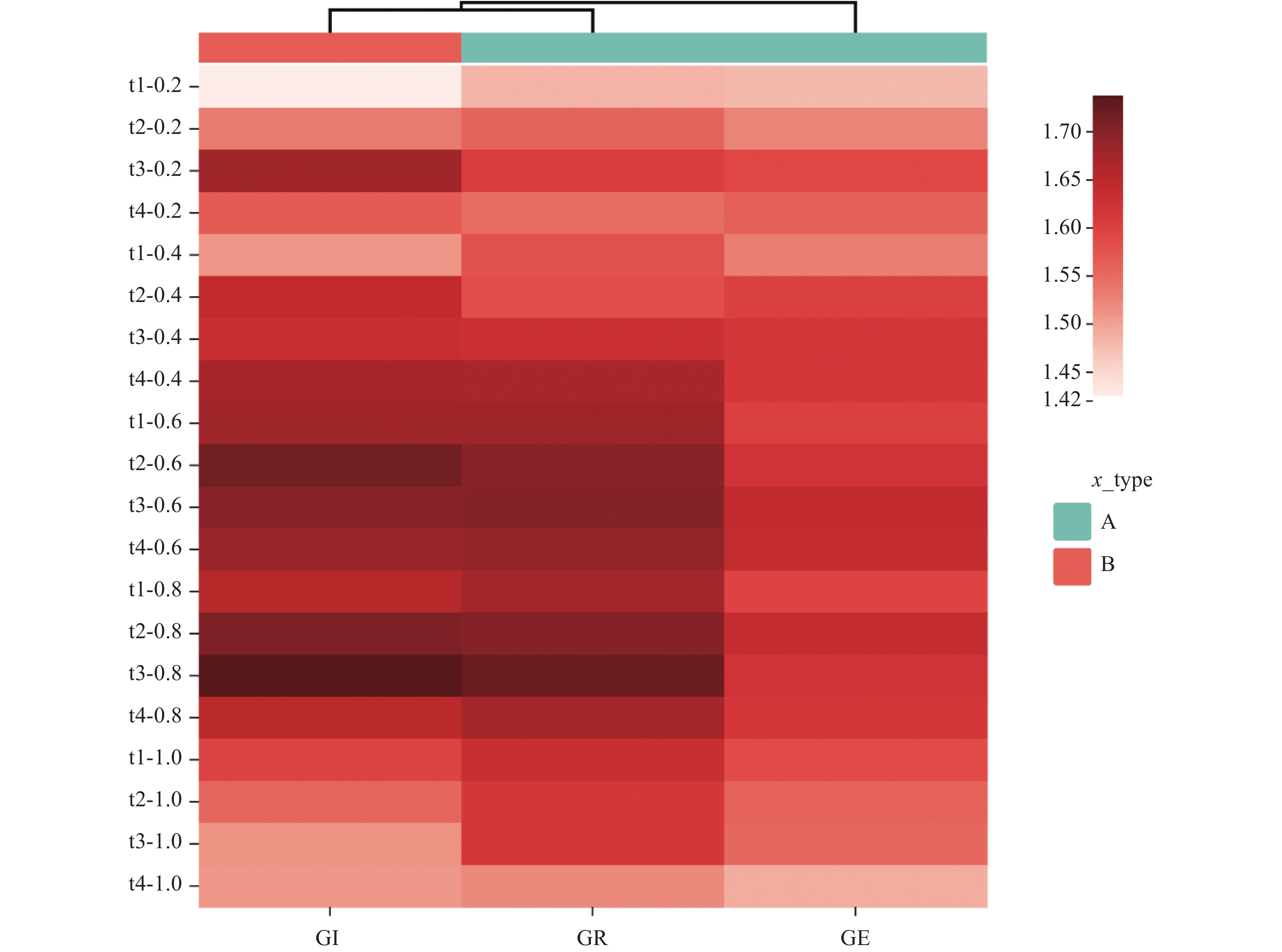
为了直观分析5种电场强度在经过不同处理时间的交互作用,卷荚相思萌发期3个指标在相同环境下的变化情况,利用热图对卷荚相思种子萌发期性状的变化量进行可视化处理,通过纵向聚类反映3个指标在同一环境下的相互关系。5种电场强度处理下萌发期3个指标相对值的变化热图及聚类分析结果见图1。
![]() 图 1 不同电场强度与时间交互处理下的聚类分析①热图中红色表示电场对指标有促进作用,且颜色越深,作用越强;② t1-0.2、t2-0.2、t3-0.2、t4-0.2代表0.2 kV·cm−1,t1~t4分别代表处理时间为15、30、45和60 min,以此类推;③GE:发芽率,GR:发芽势,GI:发芽指数。Figure 1. Clustering of applied electric field and treatment time.①Red indicates how electric field promotes indicators--the darker the color, the stronger the effect; ② t1−0.2, t2−0.2, t3−0.2, and t4−0.2 represent treatments under 0.2kV·cm−1; t1-t4 represent treatments of 15, 30, 45, and 60m, respectively. Same for the others; ③GE stands for germination rate; GR stands for germination potential; GI stands for germination index.
图 1 不同电场强度与时间交互处理下的聚类分析①热图中红色表示电场对指标有促进作用,且颜色越深,作用越强;② t1-0.2、t2-0.2、t3-0.2、t4-0.2代表0.2 kV·cm−1,t1~t4分别代表处理时间为15、30、45和60 min,以此类推;③GE:发芽率,GR:发芽势,GI:发芽指数。Figure 1. Clustering of applied electric field and treatment time.①Red indicates how electric field promotes indicators--the darker the color, the stronger the effect; ② t1−0.2, t2−0.2, t3−0.2, and t4−0.2 represent treatments under 0.2kV·cm−1; t1-t4 represent treatments of 15, 30, 45, and 60m, respectively. Same for the others; ③GE stands for germination rate; GR stands for germination potential; GI stands for germination index.由图1可以看出,在不同电场强度和时间交互处理下的4个不同处理时间对发芽率影响不显著;发芽指数显示区域在t2-0.6和t3-0.8时呈现深红色,说明在此时间段下可以显著提高发芽指数;且在t1-0.2时显示区域呈现米白色,说明对发芽指数影响不大。发芽势在t3-0.8处理下显示区域呈现深红色,说明在此时间段下可以提高发芽势。综上,说明不同的电场强度和时间交互处理下对这3个指标的作用效果有所区别。电场处理下,根据卷荚相思种子各指标变化情况可将3个指标分为2类,指标发芽率单独聚为一类,发芽势和发芽指数聚为一类。
3. 讨论与结论
种子萌发期是植物生长发育初期阶段最为敏感的环节,关系到植物种子能否健康生长[19, 20]。发芽率、发芽势和发芽指数由种子最终发芽个数和萌发时间决定,可以反映种子萌发的生活力程度、发芽速率和整齐度[21]。本研究电场处理对卷荚相思种子萌发特性的影响与前人的研究结果基本一致,如武翠卿等[22]研究发现经高压静电场预处理后,谷子(Setaria italica)、荞麦(Fagopyrum esculentum Moench)及高粱(Sorghum bicolor)的千粒质量及产量都有增加,适宜的电场强度可促进谷子株高的增加,场强过低或者过高反而抑制株高的增加。李美清等[23]研究表明高压静电场处理改变了番茄(Solanum lycopersicum)的生长特性,适宜的电场对茎粗、鲜质量、叶绿素含量、根系形态具有促进作用,并提高产量。本研究发现不同电场强度和时间交互处理对卷荚相思种子的发芽率、发芽势和发芽指数具有不同程度的影响。发芽率在电场强度0.6 kV·cm−1、处理时间45 min时处于最佳状态,发芽势在电场强度0.8 kV·cm−1、处理时间45 min时均处于最高值,并且与CK有显著差异,发芽指数在电场强度0.6~0.8 kV·cm−1、处理时间30~45 min时均处于最优状态。说明卷荚相思种子在适宜的电场和时间交互处理对种子萌发有一定的作用,但是达到一定的电场阈值之后明显抑制种子的萌发。低压电场对种子萌发特性并没有促进作用,反而抑制了种子的萌发,这可能是卷荚相思种子表面附着一层保护膜,电场处理没有穿过种子表面的保护层,引起植物种子细胞内外物质的扩散[24]以及种子萌发反应所需要的养分条件。但高压电场对种子萌发特性具有抑制作用,这可能是电场回路里产生的电压太强直接击穿卷荚相思种子保护膜,对种子内部造成了一定的损伤,影响了植物种子体内电子传递和质子流的传递,并影响种子的萌发特性[25]。
植物种子的发芽率受本身特性和外界环境的双重影响,它们共同决定了植物的生长发育[26]。合理的电场强度和处理时间等对植物种子发芽率的提高具有重要作用[27]。前人研究表明,电场和时间两者交互处理下可以调控植物种子的发芽率[28]。在电场处理种子前,需要考虑电场强度的大小对植物种子的生物效应(在一定的场强范围内,才能引起生物效应),但是电场处理的作用时间对生物效应的影响也很重要,在选择最佳电场强度时也要考虑作用时间的长短,当电场强度和时间适宜时可以提升发芽速度并且提高发芽率[29]。本研究通过对不同电场强度和时间交互处理下对卷荚相思种子发芽率进行多元非线性回归分析,构建显著的多元非线性回归方程,得到不同电场强度和时间交互处理下最优非线性回归方程:Y=7.73+135.23X1+1.24X2−86.16X12−0.00911X22−0.75X1X2(R2=0.81,P<0.05)。非线性回归分析表明,卷荚相思种子发芽率与电场强度和处理时间之间存在显著(P<0.05)的相关性,且电场和时间两者交互处理能够影响卷荚相思种子发芽率。
通过聚类分析将发芽率、发芽势和发芽指数3个指标划分为2类,第1类为发芽率,第2类为发芽势和发芽指数组成。从分类结果上看,卷荚相思种子萌发期的发芽指数表现趋势较为显著。发芽指数放大种子活力特征,使活力不同的种子差异更加明显[30]。刘继宏[31]研究发现静电处理种子可以加速种子的新陈代谢,促进种子的萌发,并有效提高种子活力,增强酶活性。有研究发现电场的回路会产生电晕放电,可击穿空气中的NO和O3,与空气中的水发生反应,并使种子内部的生理条件发生变化,有利于种子的萌发[32, 33]。这可能是电场和时间交互处理下激发种子体内的潜力,改变种子膜内外电位差以及物质交换的速度,从而影响种子体内各种酶的活性,最终影响种子的萌发特性。
综上所述,卷荚相思种子发芽率在电场强度0.6 kV·cm−1、处理时间45 min时处于最高状态;发芽势和发芽指数均在电场强度0.8 kV·cm−1、处理时间45 min时处于最高状态。试验表明不同电场强度和时间两者交互处理对卷荚相思种子的萌发起到了促进作用但也产生了阻碍作用,造成不同的作用效果取决于电场强度和处理时间。结果表明适宜的电场强度和时间交互处理能够刺激卷荚相思种子的内部各种贬藏物质由休眠状态转变为活跃状态从而促进种子萌发,改善种子的活力。
-
图 1 不同电场强度与时间交互处理下的聚类分析
①热图中红色表示电场对指标有促进作用,且颜色越深,作用越强;② t1-0.2、t2-0.2、t3-0.2、t4-0.2代表0.2 kV·cm−1,t1~t4分别代表处理时间为15、30、45和60 min,以此类推;③GE:发芽率,GR:发芽势,GI:发芽指数。
Figure 1. Clustering of applied electric field and treatment time.
①Red indicates how electric field promotes indicators--the darker the color, the stronger the effect; ② t1−0.2, t2−0.2, t3−0.2, and t4−0.2 represent treatments under 0.2kV·cm−1; t1-t4 represent treatments of 15, 30, 45, and 60m, respectively. Same for the others; ③GE stands for germination rate; GR stands for germination potential; GI stands for germination index.
表 1 不同电场强度与时间交互处理对卷荚相思种子发芽率的影响
Table 1 Effect of applied electric field and treatment time on germination rate of A. cincinnata seeds
(单位:%) 电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 66.00±4.00 aA 66.00±4.00 aA 66.00±4.00 aB 66.00±4.00 aC 66.00±4.00 aAB 0.2 66.00±4.00 aA 48.67±2.52 cC 55.00±2.00 bcD 66.00±3.00 aC 60.67±5.77 abB 0.4 66.00±4.00 aA 56.00±2.00 bB 67.33±1.15 aB 70.33±1.53 aAB 70.00±3.46 aA 0.6 66.00±4.00 bA 67.67±2.52 abA 71.33±3.06 abAB 75.00±3.00 aA 74.67±7.57 aA 0.8 66.00±4.00 cA 66.67±2.08 bcA 74.33±3.51 aA 71.33±2.52 abAB 70.00±2.00 abcA 1.0 66.00±4.00 aA 65.33±2.52 aA 60.33±3.51 abC 59.33±2.52 bD 50.00±2.00 cC 同行中不同小写字母代表不同处理时间存在显著差异(P<0.05),同列中不同大写字母代表不同电场强度存在显著差异(P<0.05)。下同。
Data with different lowercase letters on same row represent significant differences under different treatment times (P<0.05); and those with different uppercase letters on same column represent significant differences under different electric field (P<0.05). Same for below.表 2 不同电场强度与时间交互处理对卷荚相思种子发芽势的影响
Table 2 Effect of applied electric field and treatment time on germination potential of A. cincinnata seeds
(单位:%) 电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 39.67±2.08 aA 39.67±2.08 aCD 39.67±2.08 aB 39.67±2.08 aB 39.67±2.08 aB 0.2 39.67±2.08 abA 30.51±1.47 cE 36.24±3.31 abB 40.38±3.19 aB 35.33±1.15 bBC 0.4 39.67±2.08 abA 37.99±1.98 cD 38.38±4.65 cB 42.43±5.00 abB 46.67±4.16 aA 0.6 39.67±2.08 bA 48.02±1.60 aA 49.99±4.52 aA 50.58±1.87 aA 49.00±3.00 aA 0.8 39.67±2.08 cA 47.33±3.88 bAB 50.37±1.46 abA 52.73±1.79 aA 47.33±3.05 bA 1.0 39.67±2.08 abA 42.98±3.61 aBC 41.26±3.85 aB 41.23±5.27 aB 33.19±2.71 bC 表 3 不同电场强度与时间交互处理对卷荚相思种子发芽指数的影响
Table 3 Effect of applied electric field and treatment time on germination index of A. cincinnata seeds
电场强度
Electric field strength/(kV·cm−1)处理时间 Handling time 0 min 15 min 30 min 45 min 60 min 0.0 8.12±0.40 aA 8.12±0.40 aB 8.12±0.40 aBC 8.12±0.40 aCD 8.12±0.40 aBCD 0.2 8.12±0.40 abA 6.21±0.41 cD 7.38±0.63 bC 9.25±1.01 aABC 7.79±0.51 bCD 0.4 8.12±0.40 abA 7.12±0.47 bC 8.74±0.77 aAB 8.63±0.79 aBC 9.15±0.36 aAB 0.6 8.12±0.40 bA 9.24±0.66 abA 9.83±0.71 aA 9.57±0.55 abAB 9.35±1.18 abA 0.8 8.12±0.40 cA 8.91±0.22 bcAB 9.67±0.55 abA 10.12±0.52 aA 8.85±0.47 bcABC 1.0 8.12±0.40 aA 8.16±0.37 aB 7.64±0.70 abBC 7.15±0.23 bD 7.09±0.33 bD 表 4 电场和时间交互处理对卷荚相思种子形态指标影响的双因素方差分析
Table 4 Two-way ANOVA on effects of applied electric field and treatment time on morphological indexes of A. cincinnata seeds
参数
Parameter电场强度
Electric field strength处理时间
Handling time电场强度×处理时间
electric field strength×
Handling timeF值
F valueP值
P valueF值
F valueP值
P valueF值
F valueP值
P value发芽率 GE 51.004 0.000 13.908 0.000 8.292 0.000 发芽势 GR 42.144 0.000 4.332 0.010 3.139 0.003 发芽指数 GI 27.919 0.000 7.365 0.000 4.294 0.000 表 5 不同电场强度与时间交互处理对发芽率非线性回归模型
Table 5 Nonlinear regression model between seed germination rate and applied electric field/time
方程拟合度
R2调整后R2
Adjusted R2平方和 Square sum df 均方 Mean square F值 F value 回归
regression残差
residual error回归
regression残差
residual error回归
regression残差
residual error0.81 0.79 3251.04548 779.93786 5 54 650.2091 14.44329 45.01806 -
[1] 陈胜, 韩金发, 沈海春, 等. 卷荚相思嫩枝扦插技术研究 [J]. 西南林学院学报, 2007, 27(6):30−34. CHEN S, HAN J F, SHEN H C, et al. Cuttage experiment with tender cuttings of Acacia continma [J]. Journal of Southwest Forestry College, 2007, 27(6): 30−34. (in Chinese)
[2] 唐静. 物理农业技术在农业生产中的应用研究 [J]. 农村经济与科技, 2018, 29(16):23. DOI: 10.3969/j.issn.1007-7103.2018.16.020 TANG J. Study on the application of physical agricultural technology in agricultural production [J]. Rural Economy and Science-Technology, 2018, 29(16): 23. (in Chinese) DOI: 10.3969/j.issn.1007-7103.2018.16.020
[3] 陈建中. 高压电场处理对谷子幼苗生理效应研究[D]. 太谷: 山西农业大学, 2016 CHEN J Z. Physiological effects of high voltage electric field on millet seedling[D]. Taigu: Shanxi Agricultural University, 2016. (in Chinese)
[4] 汪禄祥, 刘家富, 张小林, 等. 果蔬贮藏、保鲜中所采用的物理技术方法 [J]. 食品工业科技, 1996, 17(4):77−79. WANG L X, LIU J F, ZHANG X L, et al. Physical techniques and methods used in storage and preservation of fruits and vegetables [J]. Science and Technology of Food Industry, 1996, 17(4): 77−79. (in Chinese)
[5] 关玉贵, 刘云, 王云鹤, 等. He-Ne激光提高蛋鸡产蛋率影响的研究 [J]. 激光杂志, 1996, 17(2):95−97. GUAN Y G, LIU Y, WANG Y H, et al. Study on the effect of He-Ne laser on improving the laying rate of laying He-Ne [J]. Laser Journal, 1996, 17(2): 95−97. (in Chinese)
[6] 白亚乡, 胡玉才, 杨桂娟. 物理技术在水产养殖中的应用 [J]. 物理, 2002, 31(9):589−592. BAI Y X, HU Y C, YANG G J. Application of physics technology in aquaculture [J]. Physics, 2002, 31(9): 589−592. (in Chinese)
[7] 张秀华. 电离辐射生物学效应及其在农业上的应用 [J]. 安徽农业科学, 1995, 23(2):187−188. ZHANG X H. Biological effects of ionizing radiation and its application in agriculture [J]. Journal of Anhui Agricultural Sciences, 1995, 23(2): 187−188. (in Chinese)
[8] 白亚乡, 胡玉才, 迟建卫. 物理技术在农业生产中的应用进展 [J]. 沈阳农业大学学报, 2003, 34(3):232−235. DOI: 10.3969/j.issn.1000-1700.2003.03.021 BAI Y X, HU Y C, CHI J W. Application progress of phycical techniques in agriculture [J]. Journal of Shenyang Agricultural University, 2003, 34(3): 232−235. (in Chinese) DOI: 10.3969/j.issn.1000-1700.2003.03.021
[9] 刘慧娜, 张克亮, 赵大球, 等. 种子休眠与萌发综述 [J]. 分子植物育种, 2020, 18(2):621−627. LIU H N, ZHANG K L, ZHAO D Q, et al. Advances in studies of seed dormancy and germination [J]. Molecular Plant Breeding, 2020, 18(2): 621−627. (in Chinese)
[10] 朱冬雪, 窦家本, 刘平. 不同静电场对水稻种子萌发吸水和幼苗根系活力的影响 [J]. 贵州农业科学, 1997, 25(3):38−40. ZHU D X, DOU J B, LIU P. Effects of different electrostatic fields on water absorption during rice seed germination and root activity of seedlings [J]. Guizhou Agricultural Sciences, 1997, 25(3): 38−40. (in Chinese)
[11] 温伟. 电场处理对燕麦在盐胁迫下种子萌发及幼苗生长的影响[D]. 呼和浩特: 内蒙古大学, 2020. WEN W. Effects of electric field treatment on seed germination and seedling growth of oat under salt stress[D]. Hohhot: Inner Mongolia University, 2020. (in Chinese)
[12] 赵剑, 马福荣, 杨文杰, 等. 高压静电场(HVEF)预处理种子对大豆幼苗抗冷害的影响 [J]. 生物物理学报, 1997, 13(3):147−152. ZHAO J, MA F R, YANG W J, et al. Effect of high voltage electrostatic field (HVEF) pretreatment on chilling injury resistance of soybean seedlings [J]. Acta Biophysica Sinica, 1997, 13(3): 147−152. (in Chinese)
[13] 蔡兴旺, 林昌华. 高压静电场处理对黄瓜种子发芽的影响 [J]. 种子, 2002, 21(6):16−17. CAI X W, LIN C H. The influence of the process in high voltage static electricity field upon cucumber seeds [J]. Seed, 2002, 21(6): 16−17. (in Chinese)
[14] 黄洪云, 杜宁, 张璇. 高压静电处理对种子萌发的生理生化影响 [J]. 种子, 2017, 36(12):74−76. HUANG H Y, DU N, ZHANG X. Physiological and biochemical effects of HVEF on seeds during their sprouting period [J]. Seed, 2017, 36(12): 74−76. (in Chinese)
[15] 武翠卿, 武新慧, 崔清亮, 等. 高压脉冲电场对高粱种子萌发特性影响研究 [J]. 农机化研究, 2021, 43(1):138−145. WU C Q, WU X H, CUI Q L, et al. Study of effect of high pulse electric field on germination characteristics of Sorghum [J]. Journal of Agricultural Mechanization Research, 2021, 43(1): 138−145. (in Chinese)
[16] 邓秋林, 杨正明, 陈雨, 等. 基于二次通用旋转组合设计的暗紫贝母优质高产施肥研究 [J]. 中国土壤与肥料, 2022, (6):96−103. DENG Q L, YANG Z M, CHEN Y, et al. Study on the high-quality and high-yield fertilization of Fritillaria unibracteata based on quadratic general rotary unitized design [J]. Soil and Fertilizer Sciences in China, 2022(6): 96−103. (in Chinese)
[17] 金梦野, 李小华, 李昉泽, 等. 盐碱复合胁迫对水稻种子发芽的影响 [J]. 中国生态农业学报(中英文), 2020, 28(4):566−574. JIN M Y, LI X H, LI F Z, et al. Effects of mixed saline-alkali stress on germination of rice [J]. Chinese Journal of Eco-Agriculture, 2020, 28(4): 566−574. (in Chinese)
[18] 国际种子检验协会编/颜启传, 毕辛华译. 1985国际种子检验规程[M]. 北京: 农业出版社, 1988. [19] GOLBASHY M, EBRAHIMI M, MOSTAFAVI K. Research Note Effects of drought stress on germination indices of corn hybrids (Zea mays L.) [J]. Electronic Journal of Plant Breeding, 2012, 3(1): 664−670.
[20] 李玉梅, 冯颖, 姜云天, 等. 混合盐胁迫对东北薄荷种子萌发及幼苗生长的影响 [J]. 西北农林科技大学学报(自然科学版), 2019, 47(10):52−62. LI Y M, FENG Y, JIANG Y T, et al. Effects of mixed salt stress on seed germination and seedling growth of Mentha sachalinensis (Briq. ) Kudo [J]. Journal of Northwest A & F University (Natural Science Edition), 2019, 47(10): 52−62. (in Chinese)
[21] LIU Y, HOU L, LI Q. Effects of different mechanical treatments on Quercus variabilis, Q. wutaishanica and Q. robur acorn germination [J]. IForest - Biogeosciences and Forestry, 2015, 8(6): 728−734. DOI: 10.3832/ifor1423-008
[22] 武翠卿, 孙静鑫, 武新慧, 等. 高压电场预处理杂粮种子对生长势及产量的影响 [J]. 中国农机化学报, 2022, 43(8):75−81. WU C Q, SUN J X, WU X H, et al. Effects of high voltage electric field pretreatment on growth potential and yield of miscellaneous grain seeds [J]. Journal of Chinese Agricultural Mechanization, 2022, 43(8): 75−81. (in Chinese)
[23] 李美清, 吴沿友, 李青林. 高压静电场对水培番茄生理指标与产量的影响 [J]. 农业机械学报, 2015, 46(11):145−150,136. DOI: 10.6041/j.issn.1000-1298.2015.11.020 LI M Q, WU Y Y, LI Q L. Influence of high voltage electrostatic field on physiological indexes and yield of hydroponic tomato [J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(11): 145−150,136. (in Chinese) DOI: 10.6041/j.issn.1000-1298.2015.11.020
[24] 黄大星, 李丽群, 蔡兴旺. 高压静电技术在作物种子处理中的应用 [J]. 农机化研究, 2008, 30(11):183−184,196. HUANG D X, LI L Q, CAI X W. The application of high voltage static electric technology in crop seed process [J]. Journal of Agricultural Mechanization Research, 2008, 30(11): 183−184,196. (in Chinese)
[25] 丁孺牛, 易伟松, 杨国正, 等. 高压静电场对油菜种子品质的影响及机理初探 [J]. 湖北农业科学, 2004, 43(6):34−36. DOI: 10.3969/j.issn.0439-8114.2004.06.012 DING R N, YI W S, YANG G Z, et al. Effects of high voltage electrostatic field on the quality of rape seeds and microcosmic mechanism [J]. Hubei Agricultural Sciences, 2004, 43(6): 34−36. (in Chinese) DOI: 10.3969/j.issn.0439-8114.2004.06.012
[26] WHITE E, FINNAN J. Crop structure in winter oats and the effect of nitrogen on quality-related characters [J]. Journal of Crop Improvement, 2017, 31(6): 758−779. DOI: 10.1080/15427528.2017.1355344
[27] 张效明. 种子处理技术在提高种子活力上的应用 [J]. 农业开发与装备, 2021, (9):118−119. DOI: 10.3969/j.issn.1673-9205.2021.09.057 ZHANG X M. Application of seed treatment technology in improving seed vigor [J]. Agricultural Development & Equipments, 2021(9): 118−119. (in Chinese) DOI: 10.3969/j.issn.1673-9205.2021.09.057
[28] 栾欣昱, 宋智青, 杜佳欣, 等. 高压电晕电场处理紫花苜蓿的生物效应 [J]. 种子, 2019, 38(9):18−23. LUAN X Y, SONG Z Q, DU J X, et al. Biological effects on alfalfa treated by high voltage Corona field [J]. Seed, 2019, 38(9): 18−23. (in Chinese)
[29] 张俐, 申勋业, 杨方. 高压静电场对生物效应影响的研究进展 [J]. 东北农业大学学报, 2000, 31(3):307−312. ZHANG L, SHEN X Y, YANG F. Influence of high-voltage electrostatic field to the biological effect BIOLOGICAL EFFECT [J]. Journal of Northeast Agricultural University, 2000, 31(3): 307−312. (in Chinese)
[30] 王朔楠, 孙静, 郭嘉莹, 等. 种子发芽指标及其测算方法[J]. 麦类作物学报, 2022: 1-7. WANG S N, SUN J, GUO J Y, et al. Overview of Seed Germination Indices and Their Determination Methods[J]. Journal of Triticeae Crops, 2022: 1-7.
[31] 刘继宏. 物理农业技术在种子选后处理中的应用 [J]. 智慧农业导刊, 2022, 2(5):61−63. LIU J H. Application of physical agriculture technology in post-treatment of seed selection [J]. Journal of Smart Agriculture, 2022, 2(5): 61−63.
[32] 白亚乡, 胡玉才. 高压静电场对农作物种子生物学效应原发机制的探讨 [J]. 农业工程学报, 2003, 19(2):49−51. DOI: 10.3321/j.issn:1002-6819.2003.02.010 BAI Y X, HU Y C. Original mechanism of biological effects of electrostatic field on crop seeds [J]. Transactions of the Chinese Society of Agricultural Engineering, 2003, 19(2): 49−51. (in Chinese) DOI: 10.3321/j.issn:1002-6819.2003.02.010
[33] 胡建芳, 陈建中, 王玉国, 等. 优化高压电场处理提高高粱种子活力 [J]. 农业工程学报, 2015, 31(12):253−259. DOI: 10.11975/j.issn.1002-6819.2015.12.034 HU J F, CHEN J Z, WANG Y G, et al. Optimization of condition for improving sorghum seed vigor by high voltage electric field [J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(12): 253−259. (in Chinese) DOI: 10.11975/j.issn.1002-6819.2015.12.034




 下载:
下载: