Identification and VP1 Sequencing of Duck Hepatitis A Virus Type 3
-
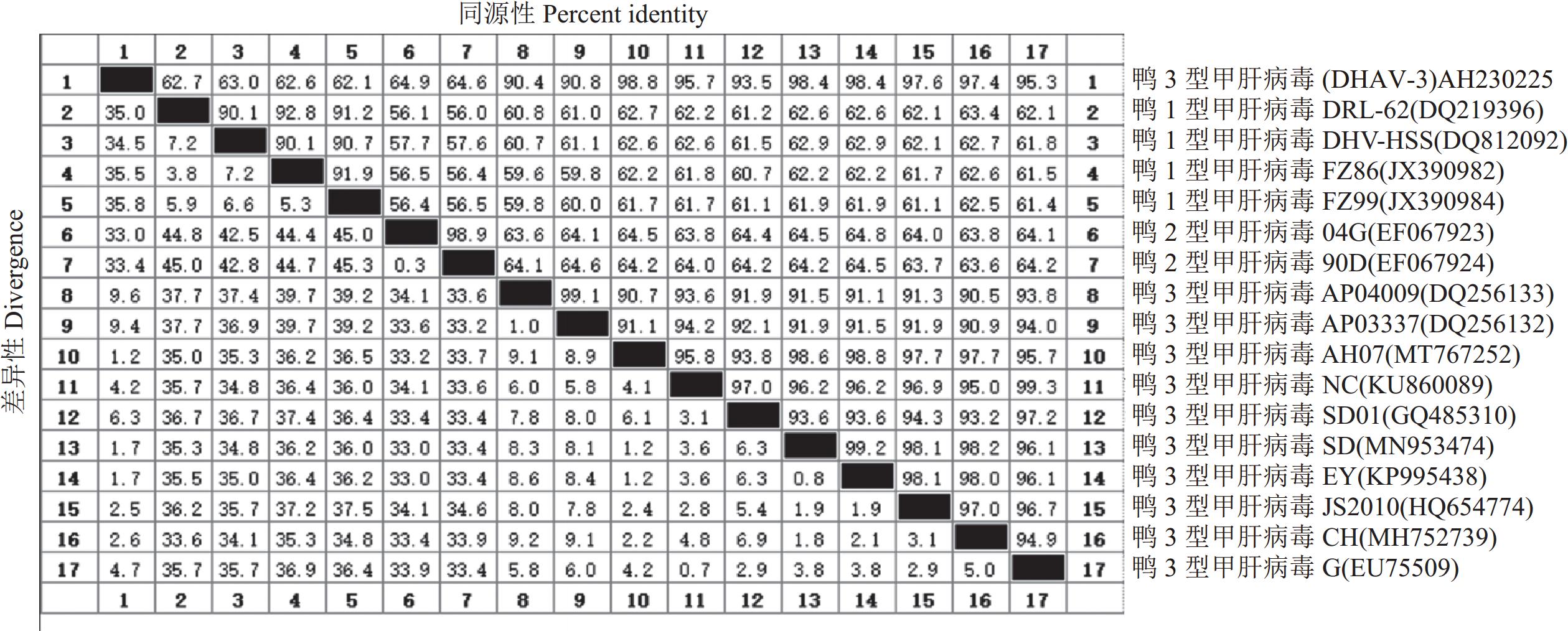
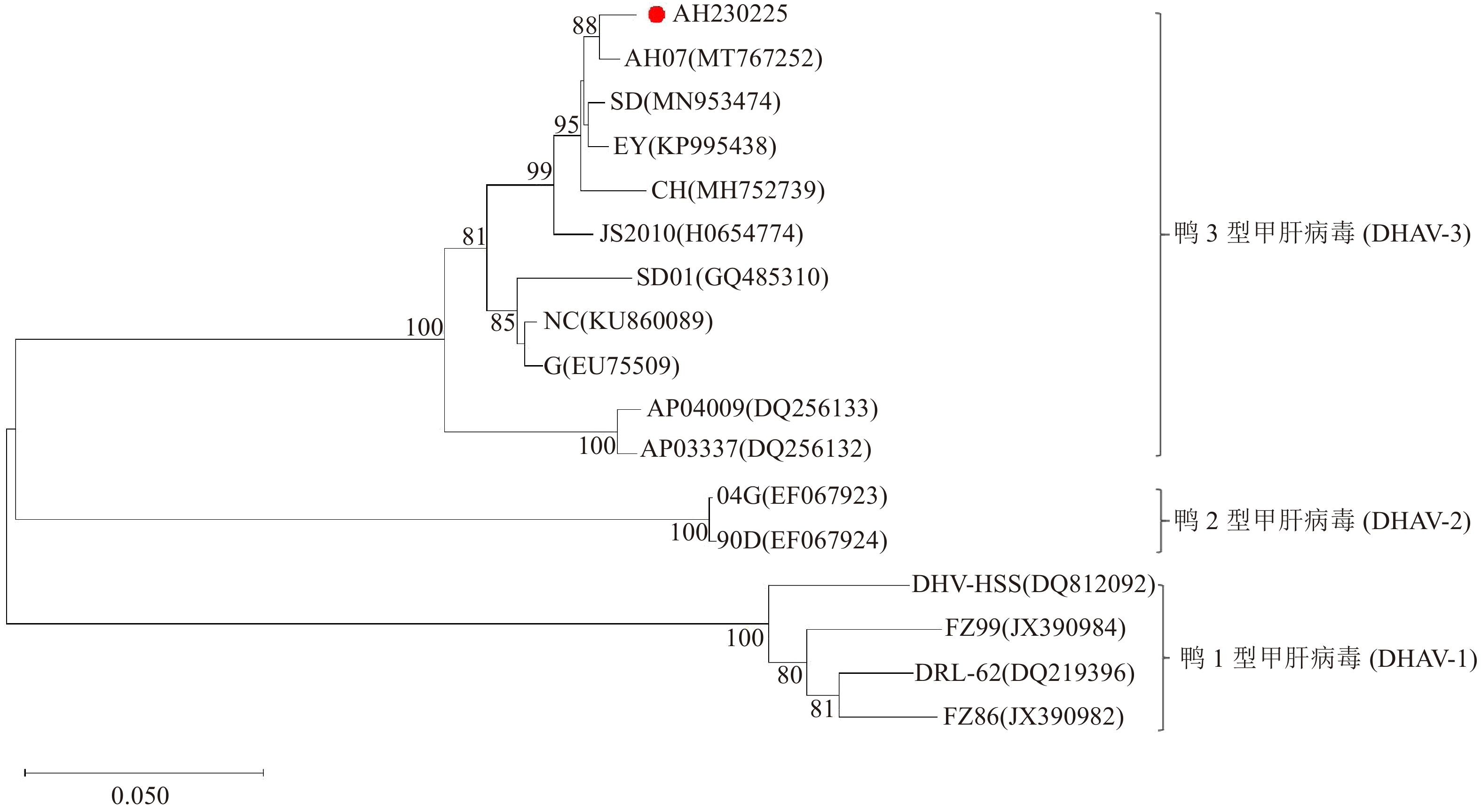
摘要:目的 探明引起安徽某鸭场雏鸭肝脏出血和大量死亡的病原及其遗传进化特征。方法 对安徽省某鸭场的病死雏鸭中采集的出血肝脏开展鸭已知病原核酸检测、病原分离鉴定和动物回归试验,在明确其病原为鸭3型甲肝病毒(Duck hepatitis A virus type 3, DHAV-3)的基础上分析其VP1基因序列分子特征。结果 细菌分离结果显示,未分离到细菌;经病毒核酸(RT-)PCR检测结果显示,鸭3型甲肝病毒(DHAV-3)核酸阳性,未检测出其他已知引起鸭肝出血的病毒核酸。将该阳性样品经鸭胚进行病毒分离与传代,发现接种后鸭胚发生死亡,胚体全身出血,对第5代尿囊液经RT-PCR检测为DHAV-3,将其命名为AH230225。经测定,该分离株的鸭胚半数致死量(Effective lethal dose 50, ELD50)为10−4.17/0.1 mL。动物回归试验表明,该毒株对樱桃谷雏鸭的致死率为80%,且攻毒死亡鸭肝脏和肾脏的剖检病变与临床典型病变相近。对该分离毒的VP1基因核苷酸序列进行同源性分析,显示AH230225株的VP1基因核苷酸序列与AH07株DHAV-3(安徽分离株)的同源性最高,为98.8%,与GenBank登录的10株DHAV-3分离株VP1基因核苷酸序列同源性为90.4%~98.8%,而与DHAV-1和DHAV-2的VP1基因核苷酸序列同源性分别为62.1%~63.0%、64.6%~64.9%;基于VP1蛋白氨基酸序列的遗传进化显示,该分离株与AH07株DHAV-3处于同一小进化分支上,亲缘关系最近;而与SD01株、G株和韩国株(AP-04009、AP-03337)等亲缘关系较远,即远离DHAV-1和DHAV-2进化分支。结论 引起安徽某鸭场雏鸭肝脏出血和大量死亡的病原为鸭3型甲肝病毒DHAV-3,同时明确了该毒株VP1基因的分子特征及遗传进化规律,为深入研究DHAV-3的致病机制和制定防控措施提供科学依据。Abstract:Objective Pathogen that caused duck liver hemorrhage in Anhui Province was identified and its genetics studied.Method A suspected virus strain was isolated from the ducks suffered from liver hemorrhage at a poultry farm in Anhui Province. Pathogenic nucleic acid and an animal regression test were employed to identify the culprit. VP1 of the confirmed duck hepatitis A virus type 3 (DHAV-3) were sequenced and analyzed using biological software.Results No bacterial pathogens were isolated from the culture of the diseased duck liver tissue. However, the specimens were tested positive for DHAV-3 but free of other viruses commonly known for duck liver hemorrhages by RT-PCR. The duck embryos inoculated with the isolate died with massive hemorrhages, and the 5th generation allantoic fluid detected presence of DHAV-3 by RT-PCR. The isolate was subsequently code-named AH230225 and determined to have the effective lethal dose 50 (ELD50) of 10−4.17/0.1 mL. In an animal regression test, the Cherry Valley ducklings had a mortality rate of 80%. The dissected lesions in the liver and kidneys of the dead ducks were similar to the typical clinical specimen. The sequenced VP1 nucleotides of AH230225 showed the greatest homology of 98.8% with the DHAV-3 of Anhui isolate, AH07. Its homologies with the 10 strains of DHAV-3 listed in GenBank were 90.4%~98.8%, with DHAV-1, 62.1%–63.0%, and with DHAV-2, 64.6%–64.9%. It appeared that the VP1 of AH230225 was genetically most closely related to that of AH07 but farther from those of SD01, G, or Korean AP-04009 and AP-03337. In other words, it was distant from DHAV-1 and DHAV-2 on the evolutionary branch.Conclusion The virus that caused the liver hemorrhage on ducks at the farm in Anhui was identified to be DHAV-3 with VP1 closely related genetically to that of AH07.
-
Keywords:
- Duck hepatitis A virus type 3 /
- isolation and identification /
- VP1
-
0. 引言
【研究意义】非洲菊(Gerbera jamesonii Bolus)隶属菊科(Asteraceae)大丁草属(Gerbera Cass.),为多年生宿根花卉,是世界五大鲜切花之一。目前已在国内的大部分地区种植,种植面积约4666.66 hm2[1]。福建省是非洲菊的主要产区之一,仅清流县种植规模就已超过400 hm2[2]。然而目前主栽品种仍为云南红、玲珑、紫灵等老品种,这些品种经多年种植,已经出现畸形花比例增多、花径变小、切花产量下降等品种衰退现象。因此选育综合性状优异、迎合市场需求的非洲菊新品种迫在眉睫。当前非洲菊新品种主要通过有性杂交及优株选择选育而得,而非洲菊为雌雄同花植物,其花序开放属雌蕊先熟型,自花授粉比较困难[3],同一无性系不同花朵间自交相对容易,自交结籽率可达46.9%[4],部分品种仍存在一定的自花授粉可育性,自交可育型品种的自花授粉可育性约为35%[5],可能造成杂交后代真假杂种混杂。而在非洲菊的遗传与育种研究中,获得具有双亲优良基因的真实杂交种是基础,为此对非洲菊杂种后代进行真实性鉴定十分必要。【前人研究进展】传统的杂种鉴定方法主要有形态学、细胞学及同工酶学等方法,鉴定周期长,鉴定结果易受环境条件影响。简单重复序列(Simple sequence repeat,SSR)分子标记具有共显性、多态性高、重复性好、简便易行等优点,广泛应用于石斛(Dendrobium Sw.)、马铃薯(Solanum tuberosum L.)、芒(Miscanthus sinensis Anderss.)等多种植物杂种F1的鉴定[6-8]。【本研究切入点】对于非洲菊SSR分子标记的研究主要集中在SSR位点分析[9,10]、遗传多样性分析[11-13]、基因定位[14]等方面,SSR标记应用于非洲菊杂种真实性鉴定的报道仍较为鲜见。【拟解决的关键问题】本研究以形态差异较大的浅色花心丝状花瓣非洲菊品种罗德里和深色花心舌状花瓣非洲菊品种热带草原及其正反交后代、部分自主选育非洲菊新品种(系)及其亲本为材料,通过从非洲菊转录组中发掘的65对SSR引物中筛选条带清晰、重复性好、亲本间无相同等位基因位点的引物,应用于非洲菊杂交后代及自主选育新品种(系)的杂种真实性鉴定,旨在明确SSR分子标记鉴定非洲菊杂交后代真实性的可行性,为提高非洲菊杂交育种效率及进一步开展非洲菊遗传研究奠定基础。
1. 材料与方法
1.1 试验材料
本试验所用的罗德里、热带草原等10个非洲菊杂交亲本均为三明市农业科学研究院花卉研究所从市场收集而来(表1),种质均保存于三明市农业科学研究院国家非洲菊种质资源库内,其花色、瓣型、花型等性状表现如图1所示。2021年11月以罗德里及热带草原为亲本进行正反交,2021年12月将正反交后代种子播种于穴盘内,并置于人工气候室培养,2022年4月将穴盘苗移栽至三明市农业科学研究院非洲菊种植大棚。2022年9月,从正反交后代中分别随机选取33个、32个单株,从自主选育非洲菊新品种(系)及其亲本中各选取1个单株(表2),剪取嫩叶样品,液氮冷冻后置于−80 ℃的超低温冰箱中保存备用。
表 1 亲本材料相关信息Table 1. Information about parent materials序号
Number种质名称
Germplasm name花色
Flower color瓣型
Petal type花型
Flower type花心颜色
Color of inflorescence center1 罗德里 Rodrigo 紫色 Purple 丝状 Spider 单瓣 Simple 浅色 Light 2 热带草原 Savannah 红色 Red 舌状 Ligulate 单瓣 Simple 深色 Dark 3 玲珑 Rosalin 粉色 Pink 舌状 Ligulate 半重瓣 Semidouble 深色 Dark 4 水粉 Ellymay 粉色 Pink 舌状 Ligulate 半重瓣 Semidouble 浅色 Light 5 红胜利 Hongshengli 红色 Red 舌状 Ligulate 半重瓣 Semidouble 深色 Dark 6 云南红 Yunnanhong 红色 Red 舌状 Ligulate 半重瓣 Semidouble 浅色 Light 7 拉丝6号 Spider No. 6 粉色 Pink 丝状 Spider 半重瓣 Semidouble 深色 Dark 8 拉丝4号 Spider No. 4 橙色 Orange 丝状 Spider 单瓣 Simple 深色 Dark 9 晨光 Chenguang 橙红复色 Orange and red 舌状 Ligulate 半重瓣 Semidouble 深色 Dark 10 菲比 Febe 橙黄复色 Orange and yellow 舌状 Ligulate 半重瓣 Semidouble 深色 Dark ![]() 图 1 10个非洲菊杂交亲本及4个非洲菊新品种(系)A:罗德里;B:热带草原;C:玲珑;D:水粉;E:红胜利;F:云南红;G:拉丝6号;H:拉丝4号;I:晨光;J:菲比;k:明卉粉黛;L:明卉红颜;M:魅粉;N:幻彩。Figure 1. Ten parents and 4 new cultivars/strains of gerberaA: Rodrigo; B: Savannah; C: Rosalin; D: Ellymay; E: Hongshengli; F: Yunnanhong; G: Spider No. 6; H: Spider No.4; I: Chenguang; J: Febe; K: Minghuifendai; L: Minghuihongyan; M: Meifen; N: Huancai.表 2 杂交亲本组合及其杂种F1代信息Table 2. Information on cross combinations and F1 hybrids
图 1 10个非洲菊杂交亲本及4个非洲菊新品种(系)A:罗德里;B:热带草原;C:玲珑;D:水粉;E:红胜利;F:云南红;G:拉丝6号;H:拉丝4号;I:晨光;J:菲比;k:明卉粉黛;L:明卉红颜;M:魅粉;N:幻彩。Figure 1. Ten parents and 4 new cultivars/strains of gerberaA: Rodrigo; B: Savannah; C: Rosalin; D: Ellymay; E: Hongshengli; F: Yunnanhong; G: Spider No. 6; H: Spider No.4; I: Chenguang; J: Febe; K: Minghuifendai; L: Minghuihongyan; M: Meifen; N: Huancai.表 2 杂交亲本组合及其杂种F1代信息Table 2. Information on cross combinations and F1 hybrids序号
Number杂交组合(♀×♂)
Hybrid combination (♀×♂)供试杂种F1代数量
Amount of tested F1 hybrids杂种F1编号/名称
F1 Hybrids number/cultivar1 罗德里×热带草原
Rodrigo×Savannah33 1、2、3、4、5、6、7、8、9、10、11、12、
13、14、15、16、17、18、19、20、21、22、23、24、
25、26、27、28、29、30、31、32、332 热带草原×罗德里
Savannah×Rodrigo32 34、35、36、37、38、39、40、41、42、43、44、
45、46、47、48、49、50、51、52、53、54、55、56、57、
58、59、60、61、62、63、64、653 玲珑×水粉
Rosalin×Ellymay1 LA14/明卉粉黛
LA14/Minghuifendai4 红胜利×云南红
Hongshengli×Yunnanhong1 50-101/明卉红颜
50-101/Minghuihongyan5 拉丝6号×拉丝4号
Spider No. 6×Spider No.41 F6-1/魅粉
F6-1/Meifen6 晨光×菲比
Chenguang×Febe1 CF-1/幻彩
CF-1/Huancai1.2 试验方法
1.2.1 DNA的提取和检测
用E.Z.N.A.TM HP Plant DNA Kit植物基因组提取试剂盒提取非洲菊基因组DNA,采用1%的琼脂糖凝胶电泳法检测DNA质量,使用BioDrop 超微量蛋白核酸分析仪测定DNA质量浓度,并将各DNA样品质量浓度稀释至20 ng·μL−1,放置于−20 ℃冰箱中保存备用。
1.2.2 SSR引物合成
从三明市农业科学研究院以非洲菊品种云南红转录组序列为基础开发的EST-SSR引物中[10],随机选取二核苷酸(20对)、三核苷酸(20对)、四核苷酸(14对)、五核苷酸(7对)、六核苷酸(4对)重复单元的SSR引物共65对(表3),引物由福州尚亚生物技术有限公司合成。
表 3 SSR引物序列Table 3. Sequence of SSR primers引物名称
Primer name重复单元
Repeat motif上游引物
Forward primer下游引物
Reverse primer片段长度
Fragment length/bpg01 (CT)14 GAATTCAATGAGCATCGCCT GGCGGGCAATACAAAACTTA 188 g02 (CT)12 TTCATTTCTCCCCTCGTCAC AATGGGTCAACATTCAGCGT 128 g03 (AC)11 GGATTTATTTGGTCTACGGTGC TTGGGAAGGGTTTGAAATTG 148 g04 (TG)18 TGCTAGGTGCTGTGAGGAGA TTGTGCACGCCTACTTTTTG 184 g05 (TC)11 TCCAATTCCAAGGTGTAAATCC GGAATTCTCCATTCCTGCAA 175 g06 (TA)8 CAAACGTCAAGAACACGCAC TCAACAGCGGTTGTGTATGAA 167 g07 (GA)15 GCGTAGGGTTTTCTGTGCAT TCTCTCTAAGATCGCCCTGC 206 g08 (TC)12 GCCAAGAAATGGATCCAAGA ACCCGCTCATTTTACGACC 134 g09 (AG)13 CGAACCTTCACAAGATCGGT TCGGAGATGTTCCTTTGACC 189 g10 (GT)12 GTGCGGGTGTGAACAACATA ATCACCTTCTCCGACACACC 159 g11 (GA)15 GTAGCGAAACACGGAGGAAA AGTACGGCCTCCTCCATTCT 194 g12 (GT)11 AACCTGGCATACACTTTGGC CGAACCAAACAATTACCATGAA 177 g13 (TC)12 GTTGCACGCCCTCCTATCT GTCGGTGTCGGAGAAATGTT 226 g14 (GA)9 TGCAATTGGATGTGAGTCGT GCAACGAGAGCAAACTACCC 179 g15 (TC)13 ACGGTTCAATTTCGAGAACG AAATTTTAGCGCAAAACAAGC 202 g16 (CT)9 GCTCTCAACCTGTCAAAGGC GCTTCCCTCGATTGTAGCTG 173 g17 (AG)10 TCCAACGTCAATTCCAATCA AACTCTGTCGTGGTGTCGGT 156 g18 (TA)12 CAATCATGGCTGCATTTCAC TTTTCCACGTCAAACCATCA 220 g19 (TA)10 GTGAGGTGCAAGAGGAAAGC TACCAGCAGAAGCAGACGAA 221 g20 (AG)10 ATTGCACCCTCGTTTTATGC TCTGCTGCATCTTCATGCTT 185 g21 (ATG)7 TGCCTTGAAAGTGACGATGA GCGTAAGATTCTCCACAGGG 223 g22 (TCT)12 CTCCATTTTGTAGCCAAGAGTG GCCACCACTACTGAGGCATT 163 g23 (CGG)8 CATCCCTTACGTTGGCACTT CACCCTTGAAACCCTCTCTG 167 g24 (GAT)8 AGTGGGAGAAGCTATGCCAA GGGTCGCCATAGCAAATAGA 187 g25 (TTA)8 GATTGGATGCTAGCTTTGCC GGGCATTTTGGACATTTGAT 162 g26 (GAA)5 AGAAGAGTCCGTGGTGGCTA GGTGACTTCGTCTTGAGGGA 185 g27 (AAG)13 AATCCTCAATGCCACCTTTG GAGGCAGGAATTGACTGGAA 160 g28 (TAA)7 CGTTTTACATGCAGCCTCAA CTTTGCTTCCTCTGCCTGAC 167 g29 (ACT)6 AACAATAGGATCAAACGCGG TCGGATTGAAGGTGAGAAGG 152 g30 (GAC)5 CACAAACCCTTGTAGCGGAT ACATTCTTCACCGGAGCAAC 150 g31 (AAG)9 ATCGGCTCAAGGTAAGGGAT GCTCAATGGCTTCAGACACA 186 g32 (GAT)11 ATTTTGAAGGGATTGGTGGG TCATGCCATATTCCCTCGAT 174 g33 (AAG)11 CAGGGGCAGTTAGGTTCAAA TAGAATTGGACCCGCTATGG 186 g34 (CAA)7 TGGCAATCGTGCTTGTTAAA CCCCAATTCTATTTGGGACT 158 g35 (TAC)7 GTCACACGTGGTCGCATATC ACAAATCGAACTTTGACCCG 194 g36 (AAC)9 AGCAAGATCAAAAGACCCGA CCTTTGTCGTCATAGCAATCAA 167 g37 (TCG)9 CGCCATTAAAGCCTTCTTTC GGAAGGCTTGTGTTGGTTGT 151 g38 (GCG)7 AATGGCAGCTACTGCGTCTT TCACCATTAACGGCTGATGA 158 g39 (AAT)12 ACAAAGAATCCGTCCACCAG GACCGTATTGGGCAGGTCTA 164 g40 (GAA)10 GAGGCGTTATCGGACTTTGA TTCTTCTTGGGACGTAACCG 168 g41 (TCTT)5 CGGTCACTGGGAAACTTCAT CGTCCTCAATAATTGCCGTT 199 g42 (TTGT)5 ACCCACTTGGCTTGGGTATT CTGCTGAGGCTTTCATCTCC 142 g43 (TACA)5 CGCAAAGTGTAAACTGAAGTGG CCCAGCTTGACTCATGGTTT 150 g44 (CTAT)8 TTAGGAGTGGAGTCGCTGCT CGAAAAGCTAGCAAATGGACA 200 g45 (AGGA)6 GGCGTCTTGTTTCTTTTTCG AGCTGGGACCTGGGAATACT 144 g46 (TTTA)6 TGTCCATAAAATGCGGTCAA TAAAAGCCCACCCTCAATCA 232 g47 (TGTT)5 GAAATCCGTGAAAGGTCGAA TGTACAAACCCACCTCCCTT 193 g48 (TCGA)5 AAGAAGCTCGGCCTCTGATT TACCTTCGCGGATTGTTTTC 204 g49 (TGTA)5 TACAACGGGTTATCCAAGCC GGTGCAAATACAAGGTTCGTG 190 g50 (TATG)5 TGGTTGGAAAAGTCATTCACTC TCAACACCGAACCGACAATA 143 g51 (TATT)8 AAATCTTTGATGAATGCGGC GAAGAATCCCAATTGAGCCA 186 g52 (TATG)5 GCCTCACCTGAAGACGGTAG TACATATGCGATTGGGCCTT 155 g53 (TCAA)5 CCGGTCACTCTCACATGCTA CCATCACAGACGACGAAAGA 148 g54 (ATTT)5 ATTAAAGAGTGTGCAGGCGG AAGCAACAACGTCGGAAAAT 153 g55 (TAAAA)5 AACGACTAGCGATTCCATGA TGTGGGATGTAACAAGGCAA 182 g56 (AAAAG)5 GAGTATTTGGAGCGAAAGCG TGAACACTTGTATCCGTCGC 119 g57 (ACCAA)5 CTCTTTCCTTTTCACCGCAC TTCGTCTAGATCTTCGCCGT 173 g58 (TAAAA)5 GGGTTCGTTTTGCATTTAACTC CAGGACCTTTGATTTTGGTCA 183 g59 (ACCCG)5 CTGCCGGAATCAAAATGAAT CTTTAATGGTGGCAATGGCT 166 g60 (CACCC)5 TGCTTACACTTCCGTGCAAC ATGTTAGCTCCAGTTGGGCA 189 g61 (AAAAG)5 CATGGATAAACCCGTTTTGG TTTTCTCTTTCTGTTTCGCCA 170 g62 (GTCAAA)6 GTCGCAAGAACTTCCAAAGC TCCACCGACTTTGACTTTCA 237 g63 (CGTCTT)6 TTGCAAATGCAAATCCAATC AAACAGCAGTGGTGGTTTCC 175 g64 (AATGGG)6 CGCTTCCTCCTACAACAAGC GTGTCCCCACCATTCAAGTT 163 g65 (TGCTCC)6 AGCTTGCCATGGTTATGGTC GGCTTAAAAGATCCCCAAGG 231 1.2.3 SSR反应体系、PCR扩增程序及电泳检测
SSR-PCR反应体系为10 μL,包括SSR上下游引物各0.5 μL,DNA模板0.8 μL,2×Taq MasterMix 5 μL,无菌水3.2 μL。PCR扩增程序为:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min,最后4 ℃保存PCR扩增产物。电泳检测:扩增产物取1 μL,加至8%的聚丙烯酰胺凝胶点样孔中,以恒定电压120 V,在1×TAE缓冲液中电泳1.5~2.0 h,Ultra GelRed核酸染料染色20 min后,置于凝胶成像系统中观察结果并进行拍照及记录条带位置。
1.2.4 SSR引物筛选
分别以不同非洲菊亲本DNA为模板,用不同的SSR引物进行PCR扩增,筛选能扩增出条带清晰、重复性好、亲本间无相同等位基因位点的引物,用于下一步杂种F1的真实性鉴定。
1.2.5 杂种F1真实性鉴定
分别以双亲和杂种F1 DNA为模板,利用筛选出的SSR引物进行PCR扩增,扩增图谱中,具有父本或兼具有父母本特征条带的为真杂种,仅有母本特征条带的为假杂种。
2. 结果与分析
2.1 SSR引物筛选
利用65对SSR引物对非洲菊杂交亲本罗德里和热带草原的DNA进行PCR扩增,结果表明:在SSR位点处,共有57对引物扩增出条带;43对引物扩增条带较清晰,可作为非洲菊杂交后代真实性鉴定的筛选用引物对;26对引物具有多态性,多态性比例为40%;g24、g64这2对引物扩增双亲均表现为条带单一、清晰可辨、位点差异明显的纯合带型,即aa×bb型;g32引物扩增双亲均为互不相同的两条带的杂合带型,即ab×cd型,4条条带清晰可辨,位点差异明显;g38引物扩增母本罗德里为两条带的杂合带型,扩增父本热带草原为位点差异明显的单一条带的纯合带型,即ab×cc型,因此筛选g24、g32、g38、g64这4对引物用于非洲菊罗德里和热带草原杂交所获得的F1代杂种的真实性鉴定。部分SSR引物对亲本组合DNA的PCR扩增结果见图2。
2.2 非洲菊杂交后代的SSR鉴定结果
引物g24、g32、g38、g64对非洲菊亲本罗德里、热带草原及其65个正反交后代DNA的PCR扩增结果如图3所示。
![]() 图 3 g24引物(A)、g32引物(B)、g38引物(C)、g64引物(D)对非洲菊亲本罗德里、热带草原及65个正反交后代DNA的PCR扩增结果M:DNA Marker;L:罗德里;R:热带草原;1~33:非洲菊正交后代单株,34~65:非洲菊反交后代单株。Figure 3. PCR amplification results of primers g24 (A), g32 (B), g38 (C), and g64 (D) on DNA of G. jamesonii parents Rodrigo, Savannah, and 65 positive and negative progeniesM: DNA marker; L: Rodrigo; R: Savannah; 1-33:Positive cross gerbera plants; 34-65:Negative cross gerbera plants.
图 3 g24引物(A)、g32引物(B)、g38引物(C)、g64引物(D)对非洲菊亲本罗德里、热带草原及65个正反交后代DNA的PCR扩增结果M:DNA Marker;L:罗德里;R:热带草原;1~33:非洲菊正交后代单株,34~65:非洲菊反交后代单株。Figure 3. PCR amplification results of primers g24 (A), g32 (B), g38 (C), and g64 (D) on DNA of G. jamesonii parents Rodrigo, Savannah, and 65 positive and negative progeniesM: DNA marker; L: Rodrigo; R: Savannah; 1-33:Positive cross gerbera plants; 34-65:Negative cross gerbera plants.在罗德里×热带草原的正交后代中,g24、g64引物扩增亲本SSR位点基因型为aa×bb型,33个正交后代扩增出的SSR位点基因型均为ab型(图3-A,3-D);g32引物扩增亲本SSR位点基因型为ab×cd型,33个正交后代均扩增出包含父本和母本其中1条带的杂合带型,即ac、ad、bc或bd型(图3-B);g38引物扩增亲本SSR位点基因型为ab×cc型,33个正交后代均扩增出包含父本和母本其中1条带的杂合带型,即ac或bc型(图3-C)。4对引物扩增正交后代均包含双亲的各一条带,均将33个正交后代鉴定为真杂种,正交后代真杂种率达100%。
在热带草原×罗德里的反交后代中,g24、g64引物扩增亲本SSR位点基因型为aa×bb型,32个反交后代扩增出的SSR位点基因型均为ab型(图3-A、D);g32引物扩增亲本SSR位点基因型为ab×cd型,32个反交后代均扩增出包含父本和母本其中1条带的杂合带型,即ac、ad、bc或bd型(图3-B);g38引物扩增亲本SSR位点基因型为aa×bc型,32个反交后代均扩增出包含母本和父本其中1条带的杂合带型,即ab或ac型(图3-C)。4对引物扩增反交后代均包含双亲的各一条带,均将32个反交后代鉴定为真杂种,反交后代真杂种率达100%。
2.3 非洲菊新品种(系)SSR标记鉴定
4个不同类型非洲菊新品种(系)及其利用双亲筛选出的鉴定引物如表4所示,鉴定结果如图4所示。在SSR位点处,g24引物扩增亲本玲珑、水粉,g04引物扩增亲本红胜利、云南红的基因型为aa×bb型,非洲菊新品种明卉粉黛、新品系明卉红颜基因型为ab型,均鉴定为真杂种;g44引物扩增亲本拉丝6号、拉丝4号,g39引物扩增亲本晨光、菲比基因型为ab×cc型,非洲菊新品系魅粉、幻彩均为含双亲各一条带的杂合带型,即ac型,均鉴定为真杂种。引物g24、g04、g44、g39扩增杂交后代均包含双亲的各一条带,分别将非洲菊新品种(系)明卉粉黛、明卉红颜、魅粉、幻彩鉴定为真杂种。
表 4 非洲菊新品种(系)及鉴定引物Table 4. SSR primers for identifying new gerbera cultivars/strains品种(系)名称
Cultivar/Strain材料
Material母本
Female parent父本
Male parent鉴定引物
Primer for identification明卉粉黛
Minghuifendai粉色花瓣、浅色花心非洲菊新品种
New cultivar with pink petal, light color in the center of inflorescence玲珑
Rosalin水粉
Ellymayg24 明卉红颜
Minghuihongyan红色花瓣、深色花心非洲菊新品系
New strains with red petal, dark color in the center of inflorescence红胜利
Hongshengli云南红
Yunnanhongg04 魅粉
Meifen粉色花瓣、深色花心、拉丝非洲菊新品系
New spider strains with pink petal, dark color in the center of inflorescence拉丝6号
Spider NO. 6拉丝4号
Spider NO. 4g44 幻彩
Huancai橙黄复色花瓣、深色花心非洲菊新品系
New strains with orange and yellow petal, dark color in the center of inflorescence晨光
Chenguang菲比
Febeg39 ![]() 图 4 基于SSR标记的非洲菊新品种(系)杂种真实性鉴定结果M:DNA marker,♀为母本,♂为父本,F1为杂交后代新品种(系),红色框部分所示为SSR位点处的差异条带;A:g24引物扩增电泳图,母本为玲珑,父本为水粉;B:g04引物扩增电泳图,母本为红胜利,父本为云南红;C:g44引物扩增电泳图,母本为拉丝6号,父本为拉丝4号;D:g39引物扩增电泳图,母本为晨光,父本为菲比Figure 4. Identification results of SSR markers in new gerbera cultivars/strainsM: DNA marker; ♀: Female parent; ♂: Male parent; F1: New cultivars/strains of hybrids; Red box shows different band at SSR position; A: Amplification electrophoresis on g24 of Rosalin as female parent and Ellymay as male parent; B: Amplification electrophoresis on g04 of Hongshengli as female parent and Yunnanhong as male parent; C: Amplification electrophoresis on g44 of Spider NO.6 as female parent and Spider NO.4 as male parent; D: Amplification electrophoresis on g39 of Chenguang as female parent and Febe as male parent.
图 4 基于SSR标记的非洲菊新品种(系)杂种真实性鉴定结果M:DNA marker,♀为母本,♂为父本,F1为杂交后代新品种(系),红色框部分所示为SSR位点处的差异条带;A:g24引物扩增电泳图,母本为玲珑,父本为水粉;B:g04引物扩增电泳图,母本为红胜利,父本为云南红;C:g44引物扩增电泳图,母本为拉丝6号,父本为拉丝4号;D:g39引物扩增电泳图,母本为晨光,父本为菲比Figure 4. Identification results of SSR markers in new gerbera cultivars/strainsM: DNA marker; ♀: Female parent; ♂: Male parent; F1: New cultivars/strains of hybrids; Red box shows different band at SSR position; A: Amplification electrophoresis on g24 of Rosalin as female parent and Ellymay as male parent; B: Amplification electrophoresis on g04 of Hongshengli as female parent and Yunnanhong as male parent; C: Amplification electrophoresis on g44 of Spider NO.6 as female parent and Spider NO.4 as male parent; D: Amplification electrophoresis on g39 of Chenguang as female parent and Febe as male parent.3. 讨论与结论
植物杂交后代的鉴定方法主要有形态学、细胞学、同工酶学以及分子标记等方法,但在实际应用中多采用简单的形态学鉴定,存在周期长、效率低等问题[15]。非洲菊因异花授粉和栽培种依靠组培繁殖,其栽培品种基因型高度杂合,杂交后代的观赏性状出现广泛分离。且由于非洲菊染色体数目多(2n=2X=50),研究其花色、瓣型、花心颜色等的遗传规律也十分困难[16],因此通过形态学的方法难以准确鉴定非洲菊的杂种后代。DNA分子标记技术在DNA水平上揭示了亲本与子代的遗传差异,具有检测快速、准确的特点,广泛应用于杂种的鉴定。目前应用于杂种鉴定的分子标记主要有SRAP[17]、RAPD[18]、SSR[19]、AFLP[19]等,其中SSR标记为共显性标记,能够区分杂合位点和纯合位点,重复性和稳定性均较好,操作简单,是杂种后代分子鉴定的常用手段[20]。相比于RAPD、AFLP显性标记,SSR标记的鉴定效率高[21],与同为共显性标记的SRAP标记相比,其扩增的谱带少、易于识别和统计[22],并已在文心兰(Oncidium flexuosum Lodd.)、卷丹百合(Lilium lancifolium Thunb.)、月季(Rosa chinensis Jacq.)等多种园艺作物中广泛应用[23-25]。本研究通过对65对SSR引物的筛选,共获得26对在非洲菊亲本间具有多态性的引物,多态性比例达40%。李永清等[6]的研究表明SSR引物在石斛亲本间多态性比例占38.1%,李文秀等[21]的研究结果显示SSR引物在橡胶树(Hevea brasiliensis Muell.Arg.)亲本间多态性频率为31.73%,本研究结果与李永清等[6]的研究结果相近,但高于李文秀等[21]的研究结果,这可能与植物基因组杂合度的差异有关。
亲本间等位基因多态性的不同SSR标记的杂种鉴定能力亦不相同,若亲本间无相同等位基因,理论上只需1个标记就可鉴定全部的杂种后代[25,26]。周宁宁等[25]的研究结果显示在二倍体月季亲本中,基因型为aa×bb型的3个纯合显性SSR标记,其杂交后代基因型均为ab型,3个纯合显性SSR标记的鉴定效率均达100%;张婧等[27]、朱骏驰等[15]的研究结果表明亲本基因型为ab×cd的SSR标记可分别准确鉴定柳枝稷(Panicum virgatum L.)与葡萄(Vitis vinifera L.)的F1代杂种;苏聪聪等[20]用亲本基因型为aa×bb的2对SSR引物准确鉴定了刺葡萄(Vitis davidii Foex.)的F1代杂种。本研究中,g24及g64引物扩增亲本基因型为aa×bb型,g32引物扩增亲本基因型为ab×cd型,g38引物扩增亲本基因型为ab×cc型,亲本间无相同等位基因位点,非洲菊杂交后代均包含双亲的各一条带,均准确鉴定了非洲菊的F1代杂种的真实性,单一引物鉴定效率均达100%,这与周宁宁[25]、张婧[27]、朱骏驰[15]、苏聪聪[20]等的研究结果一致,与理论结果一致[25,26]。此外,本研究未见仅有父本带型的真杂种,未见染色体异常植株,与苏聪聪等[20]、周宁宁等[25]的研究结果不一致,这可能与物种的差异有关。
在非洲菊杂种F1的真实性鉴定过程中,本研究通过对基于非洲菊转录组序列为基础开发的65对SSR引物的筛选,共获得在非洲菊亲本罗德里,热带草原间具有多态性的引物26对,多态性比例达40%;筛选出亲本间无相同等位基因位点的引物4对,均将65个非洲菊杂交F1代杂种鉴定为真杂种,单一引物鉴定效率达100%,表明SSR标记在不同非洲菊亲本间多态性丰富、杂种鉴定效率高。同时,本研究将SSR标记成功应用于常规舌状花瓣与丝状花瓣,浅色花心与深色花心,单色花和复色花等不同类型非洲菊种质杂交所获得的新品种(系)的杂种真实性鉴定中,分别只用1对引物就将新品种(系)进行了鉴定,进一步说明了SSR标记在非洲菊杂种鉴定中具有高效性。SSR分子标记在非洲菊育种中的应用,加速了非洲菊新品种的选育进程,为进一步开展非洲菊的遗传研究奠定基础。
-
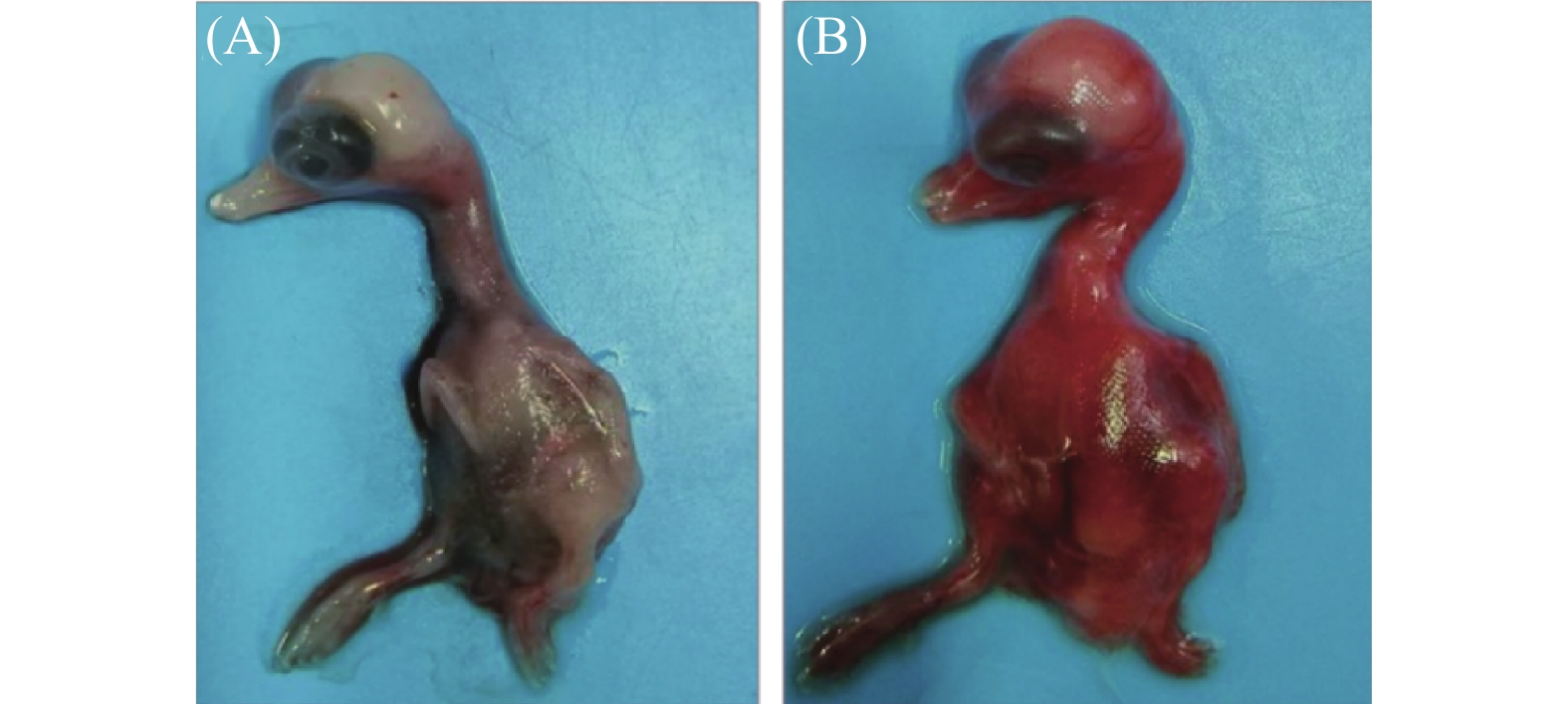
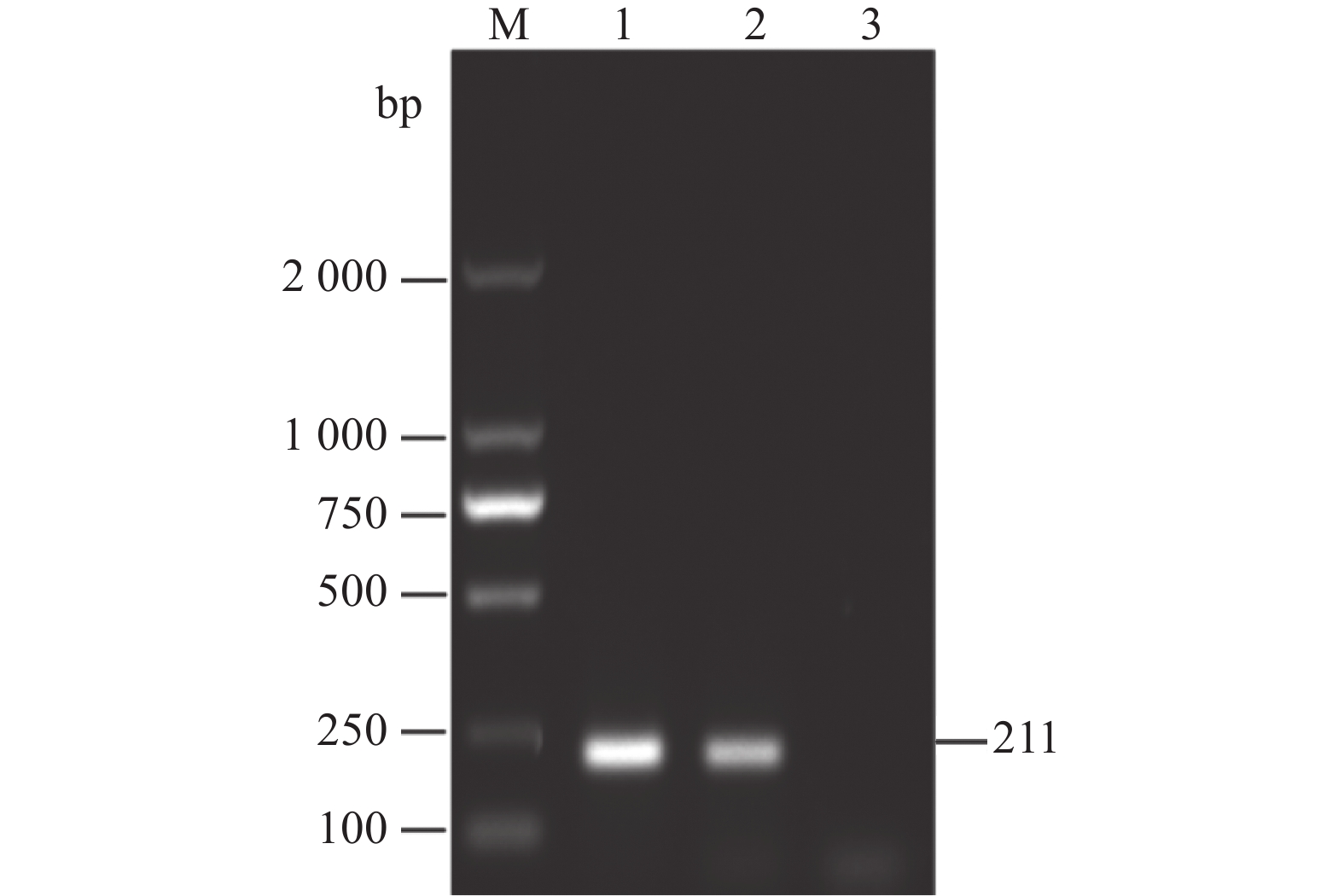
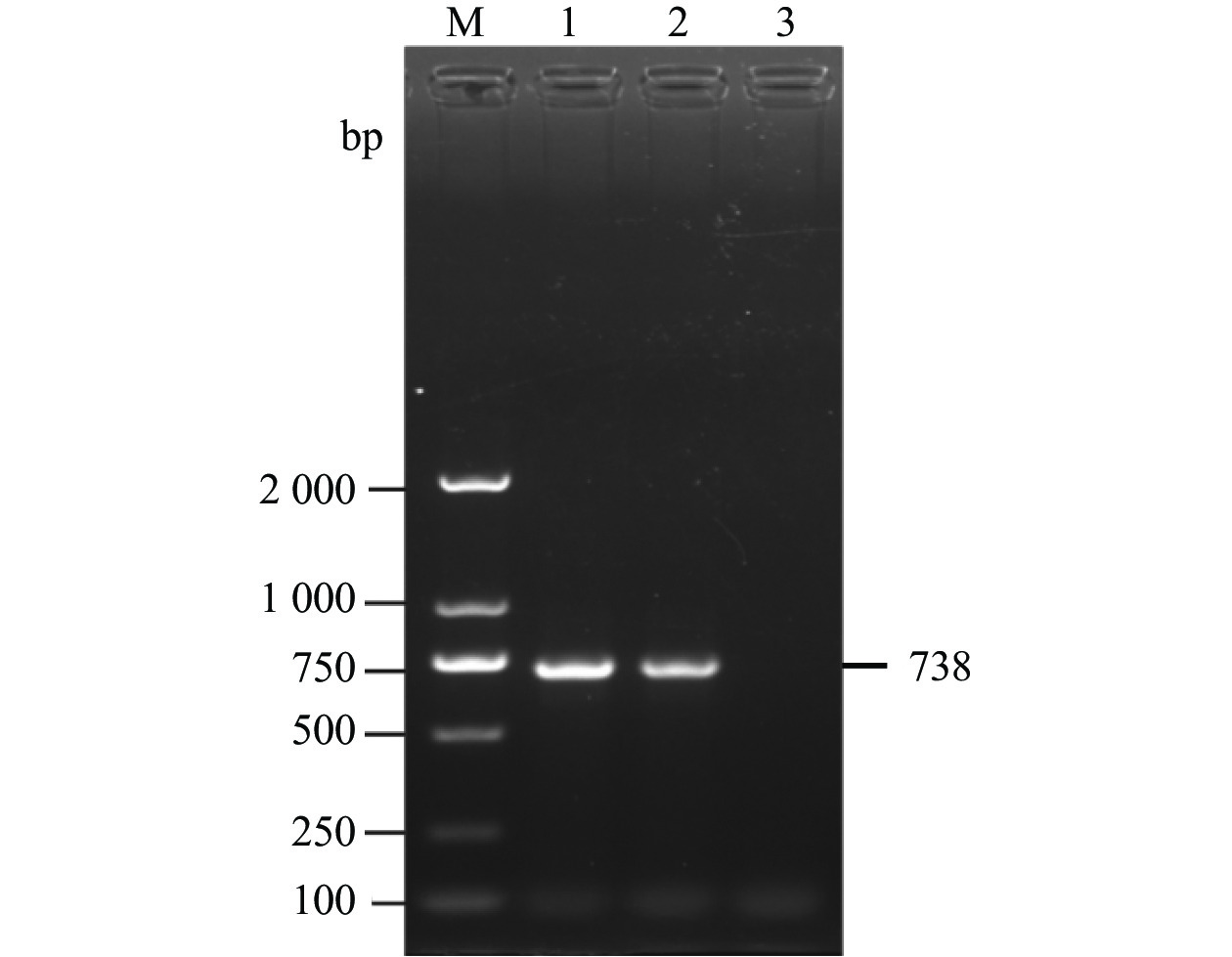
图 1 临床样品RT-PCR检测
M为2000 DNA Maker,1为鸭3型甲肝病毒,2为鸭3型腺病毒,3为禽流感病毒,4为番鸭细小病毒,5为鹅细小病毒,6为番鸭呼肠孤病毒,7为鸭1型甲肝病毒,8为鸭星状病毒,9为阴性对照。
Figure 1. RT-PCR detection on clinical samples
M: 2000 DNA marker; 1: DHAV-3; 2: duck adenovirus type 3 (DAdV-3); 3: avian influenza virus (AIV); 4: Muscovy duck parvovirus (MDPV); 5: goose parvovirus (GPV); 6: Muscovy duck reovirus (MDRV); 7: DHAV-1; 8: duck astrovirus (DAstV); 9: control.
表 1 RT-PCR扩增引物
Table 1 Primers for RT-PCR amplification
引物名称
Primers引物序列
Sequences(5′-3′)退火温度
Annealing temperature/ ℃片段长度
Product size/bpDHAV-3 VP1 F:ATGGCCGCCAATAACCAGGGTGATTC 55 738 R:TTCAATTTCCAAATGGAGCTCAAAGGCAAGTG DHAV-3 F:CACAAACAGCGTAAACGCCA 52 211 R:GCAAGCCTTGGGGATTTTGG 表 2 DHAV参考毒株
Table 2 Reference DHAV strains
登录号
Locus毒株
Virus血清型
Serotype分离时间
Time分离地
IsolateJX390982 FZ86 DHAV-1 1986年 中国福建
Fujian, ChinaDQ219396 DRL-62 DHAV-1 1962年 美国
USAJX390984 FZ99 DHAV-1 1999年 中国福建
Fujian, ChinaDQ812092 DHV-HSS DHAV-1 1995年 韩国
KoreaEF067924 90D DHAV-2 1990年 中国台湾
Taiwan, ChinaEF067923 04G DHAV-2 2004年 中国台湾
Taiwan, ChinaDQ256133 AP-04009 DHAV-3 2004年 韩国
KoreaDQ256132 AP-03337 DHAV-3 2003年 韩国
KoreaEU75509 G DHAV-3 2002年 中国广西
Guangxi, ChinaKU860089 NC DHAV-3 - - GQ485310 SD01 DHAV-3 2008年 中国山东
Shandong, ChinaHQ654774 JS2010 DHAV-3 2010年 中国江苏
Jiangsu, ChinaMH752739 CH DHAV-3 2015年 中国四川
Sichuan, ChinaKP995438 EY DHAV-3 2014年 中国山东
Shandong, ChinaMN953474 SD DHAV-3 2011年 中国山东
Shandong, ChinaMT767252 AH07 DHAV-3 2018年 中国安徽
Anhui, China表 3 樱桃谷鸭动物回归试验结果
Table 3 Animal regression test results on Cherry Valley ducks
组别
Groups数量
Number/
羽攻毒后7 d内的死亡鸭数量
Number of dead ducklings during
7 days post infectious/羽死亡率
Mortality/%1 2 3 4 5 6 7 AH230225 5 0 0 2 1 1 0 0 80 (4/5) 对照组CK 5 0 0 0 0 0 0 0 0(0/5) -
[1] 苏敬良, 张国中, 黄瑜, 等. 血清3型鸭甲型肝炎病毒弱毒疫苗株培育及免疫原性研究 [J]. 中国兽医杂志, 2009, 45(12):11−14. DOI: 10.3969/j.issn.0529-6005.2009.12.003 SU J L, ZHANG G Z, HUANG Y, et al. Development of attenuated duck hepatitis A virus serotype 3 strain and evaluation of its antigencity [J]. Chinese Journal of Veterinary Medicine, 2009, 45(12): 11−14. (in Chinese) DOI: 10.3969/j.issn.0529-6005.2009.12.003
[2] ZHANG Y Y, WU S, LIU W B, et al. Current status and future direction of duck hepatitis A virus vaccines [J]. Avian Pathology, 2023, 52(2): 89−99. DOI: 10.1080/03079457.2022.2162367
[3] FEHÉR E, JAKAB S, BALI K, et al. Genomic epidemiology and evolution of duck hepatitis A virus [J]. Viruses, 2021, 13(8): 1592. DOI: 10.3390/v13081592
[4] TSENG C H, TSAI H J. Molecular characterization of a new serotype of duck hepatitis virus [J]. Virus Research, 2007, 126(1/2): 19−31.
[5] RAJENDRAN R, SRINIVASAN J, NATARAJAN J, et al. First report of Duck Hepatitis A virus genotype 2 in India [J]. Veterinary Research Communications, 2023, 47(3): 1231−1241. DOI: 10.1007/s11259-022-10063-0
[6] 苏敬良, 黄瑜, 贺荣莲, 等. 新型鸭肝炎病毒的分离及初步鉴定 [J]. 中国兽医科技, 2002, 32(1):15−16. DOI: 10.3969/j.issn.1673-4696.2002.01.005 SU J L, HUANG Y, HE R L, et al. Isolation and preliminary identification of a new duck hepatitis virus [J]. Chinese Journal of Veterinary Science and Technology, 2002, 32(1): 15−16. (in Chinese) DOI: 10.3969/j.issn.1673-4696.2002.01.005
[7] 胡薛英, 蔡双双, 谷长勤, 等. 新型鸭肝炎病毒感染雏鸭血液生化指标的动态变化 [J]. 中国兽医学报, 2005, 25(6):628−631. DOI: 10.3969/j.issn.1005-4545.2005.06.021 HU X Y, CAI S S, GU C Q, et al. Dynamic changes of biochemical indexes of ducklings infected with new type duck hepatitis virus [J]. Chinese Journal of Veterinary, 2005, 25(6): 628−631. (in Chinese) DOI: 10.3969/j.issn.1005-4545.2005.06.021
[8] 施少华, 程龙飞, 傅光华, 等. 鸭肝炎病毒新血清型基因组序列分析 [J]. 微生物学报, 2009, 49(3):309−315. DOI: 10.3321/j.issn:0001-6209.2009.03.005 SHI S H, CHENG L F, FU G H, et al. Genomic sequence of a new serotype duck hepatitis virus [J]. Acta Microbiologica Sinica, 2009, 49(3): 309−315. (in Chinese) DOI: 10.3321/j.issn:0001-6209.2009.03.005
[9] KIM M C, KWON Y K, JOH S J, et al. Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno- and serotype when compared to duck hepatitis virus type 1 type strains [J]. Archives of Virology, 2007, 152(11): 2059−2072. DOI: 10.1007/s00705-007-1023-0
[10] DING C Y, ZHANG D B. Molecular analysis of duck hepatitis virus type 1 [J]. Virology, 2007, 361(1): 9−17. DOI: 10.1016/j.virol.2007.01.007
[11] KIM M C, KWON Y K, JOH S J, et al. Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae[J]. Journal of General Virology, 2006, 87(Pt 11): 3307-3316.
[12] LIU G Q, WANG F, NI Z, et al. Genetic diversity of the VP1 gene of duck hepatitis virus type I (DHV-I) isolates from Southeast China is related to isolate attenuation [J]. Virus Research, 2008, 137(1): 137−141. DOI: 10.1016/j.virusres.2008.04.030
[13] FU Y, PAN M, WANG X Y, et al. Complete sequence of a duck astrovirus associated with fatal hepatitis in ducklings[J]. Journal of General Virology, 2009, 90(Pt 5): 1104-1108.
[14] LI X J, ZHAO R, LIN W, et al. Evidence of VP1 of duck hepatitis A type 1 virus as a target of neutralizing antibodies and involving receptor-binding activity [J]. Virus Research, 2017, 227: 240−244. DOI: 10.1016/j.virusres.2016.10.018
[15] 傅秋玲, 傅光华, 陈红梅, 等. 胰腺炎型鸭1型甲肝病毒结构蛋白VP1基因的克隆和表达 [J]. 福建农业学报, 2014, 29(5):409−412. FU Q L, FU G H, CHEN H M, et al. Cloning and prokaryotic expression of the VP1 gene of pancreotropic duck hepatitis type 1 virus [J]. Fujian Journal of Agricultural Sciences, 2014, 29(5): 409−412. (in Chinese)
[16] 傅秋玲, 傅光华, 陈翠腾, 等. 半番鸭源鸭1型甲肝病毒亚型的分离鉴定及其VP1基因分析 [J]. 福建农业学报, 2017, 32(8):813−817. FU Q L, FU G H, CHEN C T, et al. Identification and sequencing of duck hepatitis A virus 1 subtype a isolated from mule ducklings [J]. Fujian Journal of Agricultural Sciences, 2017, 32(8): 813−817. (in Chinese)
[17] LIU R C, CHEN C T, HUANG Y, et al. Microbiological identification and analysis of waterfowl livers collected from backyard farms in Southern China [J]. Journal of Veterinary Medical Science, 2018, 80(4): 667−671. DOI: 10.1292/jvms.17-0452
[18] 程龙飞, 刘荣昌, 傅光华, 等. 鸭3型腺病毒的分离鉴定及其fiber基因分析 [J]. 中国家禽, 2019, 41(11):47−50. CHENG L F, LIU R C, FU G H, et al. Isolation and identification of duck adenovirus 3 and sequence analysis of fiber gene [J]. China Poultry, 2019, 41(11): 47−50. (in Chinese)
[19] 刘家森, 姜骞, 司昌德, 等. 番鸭细小病毒与鹅细小病毒PCR鉴别诊断方法的建立 [J]. 中国兽医科学, 2007, 37(6):469−472. LIU J S, JIANG Q, SI C D, et al. Establishment of PCR assay for differentiation of Muscovy duck parvovirus from goose parvovirus [J]. Veterinary Science in China, 2007, 37(6): 469−472. (in Chinese)
[20] 胡奇林, 林锋强, 陈少莺, 等. 应用RT-PCR技术检测番鸭呼肠孤病毒 [J]. 中国兽医学报, 2004, 24(3):231−232. HU Q L, LIN F Q, CHEN S Y, et al. Detection of Muscovy duck reovirus by RT-PCR [J]. Chinese Journal of Veterinary, 2004, 24(3): 231−232. (in Chinese)
[21] LIN Y, YANG J, HE D L, et al. Differently expression analysis and function prediction of long non-coding RNAs in duck embryo fibroblast cells infected by duck tembusu virus [J]. Frontiers in Immunology, 2020, 11: 1729. DOI: 10.3389/fimmu.2020.01729
[22] DOAN H T T, LE X T K, DO R T, et al. Molecular genotyping of duck hepatitis A viruses (DHAV) in Vietnam [J]. Journal of Infection in Developing Countries, 2016, 10(9): 988−995. DOI: 10.3855/jidc.7239
[23] HASSAN T I R, EID A A M, GHANEM I A I, et al. First report of duck hepatitis A virus 3 from duckling flocks of Egypt [J]. Avian Diseases, 2020, 64(3): 269−276.
[24] ROHAIM M A, NAGGAR R F E, ABDELSABOUR M A, et al. Insights into the genetic evolution of duck hepatitis A virus in Egypt [J]. Animals, 2021, 11(9): 2741. DOI: 10.3390/ani11092741
[25] YEHIA N, ERFAN A M, OMAR S E, et al. Dual circulation of duck hepatitis A virus genotypes 1 and 3 in Egypt [J]. Avian Diseases, 2021, 65(1): 1−9.
[26] WEN X, ZHU D, CHENG A, et al. Molecular epidemiology of duck hepatitis a virus types 1 and 3 in China, 2010-2015 [J]. Transboundary and Emerging Diseases, 2018, 65(1): 10−15. DOI: 10.1111/tbed.12741
[27] 徐倩, 陈琳琳, 张瑞华, 等. 鸭甲肝病毒3型2012年山东分离株VP1基因的序列分析 [J]. 病毒学报, 2013, 29(5):522−528. XU Q, CHEN L L, ZHANG R H, et al. Sequence analysis of VP1 gene of the duck hepatitis A virus type 3 strains isolated from Shandong Province of China in 2012 [J]. Chinese Journal of Virology, 2013, 29(5): 522−528. (in Chinese)
[28] ZHANG R, XIA L, CHEN J, et al. Molecular epidemiology and genetic diversity of duck hepatitis A virus type 3 in Shandong province of China, 2012–2014 [J]. Acta Virologica, 2017, 61(4): 463−472. DOI: 10.4149/av_2017_409
[29] YANG C T, SHAH P T, BAHOUSSI A N, et al. Duck hepatitis a virus: Full-length genome-based phylogenetic and phylogeographic view during 1986–2020 [J]. Virus Research, 2023, 336: 199216. DOI: 10.1016/j.virusres.2023.199216
[30] NIU Y J, MA H Y, DING Y H, et al. The pathogenicity of duck hepatitis A virus types 1 and 3 on ducklings [J]. Poultry Science, 2019, 98(12): 6333−6339. DOI: 10.3382/ps/pez455
[31] LIU R C, SHI S H, HUANG Y, et al. Comparative pathogenicity of different subtypes of duck hepatitis A virus in Pekin ducklings [J]. Veterinary Microbiology, 2019, 228: 181−187. DOI: 10.1016/j.vetmic.2018.11.030
[32] 管飘萍, Enkhbayar Munkhbayar, 黄紫贝, 等. 22株鸭甲型肝炎病毒的分离鉴定及其VP1基因的序列分析 [J]. 中国家禽, 2021, 43(1):105−109. GUAN P P, MUNKHBAYAR E, HUANG Z B, et al. Isolation, identification and sequening of VP1 gene of 22 isolates of duck hepatitis A virus [J]. China Poultry, 2021, 43(1): 105−109. (in Chinese)
[33] GAO J M, CHEN J H, SI X K, et al. Genetic variation of the VP1 gene of the virulent duck hepatitis A virus type 1 (DHAV-1) isolates in Shandong province of China [J]. Virologica Sinica, 2012, 27(4): 248−253. DOI: 10.1007/s12250-012-3255-8
-
期刊类型引用(5)
1. 杜俊峰,袁瑗,邓春莉,任羽. 运用SRAP和SSR分子标记鉴定铁皮石斛与金钗石斛F1代杂种的真实性. 现代园艺. 2025(02): 6-8 .  百度学术
百度学术
2. 姚姚,张浩,王秀云,夏宜平,周泓. SSR分子标记在杜鹃花属植物中的研究进展. 植物遗传资源学报. 2025(03): 405-418 .  百度学术
百度学术
3. 杨松敏,姜潇,程梦雅,王顺顺,段燕如,陈和明,彭东辉. 火焰兰属间杂交育种研究进展. 中国农学通报. 2024(13): 76-82 .  百度学术
百度学术
4. 汪阳,闫三博,张睿,黄琳凯,张新全,聂刚. 白三叶杂交F1代群体的表型鉴定及SSR分析. 草地学报. 2024(06): 1657-1664 .  百度学术
百度学术
5. 夏朝水,曹奕鸯,陈玮婷,甘玮欣,林发壮,许克正,林辉锋. 170份非洲菊种质资源遗传多样性及亲缘关系分析. 福建农业学报. 2024(10): 1120-1129 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载: