Fungal Community and C, N, P, and S Functional Genes in Rhizosphere Soil of Cassava Field Treated with a Slow-release Fertilizer
-
摘要:目的 研究木薯缓释肥对根际土壤真菌和C、N、P、S功能基因动态的影响。方法 开展木薯田间试验,设置3个处理:不施肥(T1)、双膜缓释肥C2基施(T2)和植后34 d追施(T3)。在植后77、104、134 d采集根际和非根际土样,测定高通量(Illumina Miseq PE300)真菌(ITS rRNA)多样性,C、N、P、S共72个(含总DNA)功能基因的copies(基因芯片技术)和土壤速效养分(仅用于相关分析)。结果 (1)植后104 d根际土壤被孢霉纲、银耳纲、圆盘菌纲相对丰度均为T2<T1;植后134 d,根际土壤散囊菌纲为T2>T1。T2散囊菌纲(134 d)、T3丛赤壳科(77 d)和T3粪壳菌纲(104 d)在根际相对富集。T1根际被孢霉纲相对丰度的时间大小顺序为134 d<104 d;T2根际散囊菌纲和粪壳菌纲均为134 d>77 d;T3根际的球囊菌纲为104 d>77 d。(2)Sobs、ACE、Chao1指数在T1(104 d)、T2(104 d)和T3(134 d)根际分别显著或极显著大于非根际。根际土壤Shannon指数在植后77 d为T1<T2和T3,T1和T2的时间大小顺序分别为104 d>77 d和104 d<77 d。土壤Simpson指数的大小顺序为T1根际(77 d)大于T1非根际(77 d)、T1根际(104 d)、T2根际(77 d)和T3根际(77 d)。(3)LEfSe分析结果表明,处理间根际相对富集1个纲、1个目和2个科。对比非根际,植后77 d根际相对富集2个种,植后104 d相对富集3个目、1个科、1个属,植后134 d相对富集各1个门、目、科和属。时间比较中,104 d和134 d根际分别相对富集2个目和1个纲。(4)134 d,lig等9个功能基因在T1非根际土壤中的丰度显著高于根际土壤。在T1根际土壤中,chiA和aclB的丰度均为77 d高于104 d和134 d。(5)AK在104 d与31个功能基因显著相关。银耳纲、肉座菌目、丛赤壳科和球囊菌纲分别和其他40个、15个、14个、9个功能基因显著相关。结论 缓释肥基施和追施可提高木薯根际真菌群落的多样性和丰度,施肥、时间、根际等均对真菌群落结构和少数功能基因有显著的影响,相关性分析结果暗示木薯根际真菌可能参与土壤速效养分的循环和功能基因的作用,为进一步了解木薯根际微生态过程提供科学依据。Abstract:Objective A slow-release fertilizer was applied on a cassava lot to analyze the responses of the fungal community and C, N, P, and S functional genes in the rhizosphere soil.Method A field experiment was conducted with treatments of no fertilization (T1), basal application of double-coating slow-release fertilizer C2 (T2), and C2 applied 34 d after planting (DAP) (T3). Rhizosphere and bulk soil samples were collected at 77, 104, and 134 DAP to determine fungal diversity according to ITS rRNA sequenced by a high-throughput Illumina Miseq PE300, copies of 72 functional genes of C, N, P, and S cycles (including total DNA) by the gene chip technology, and available nutrients by chemical analysis for a correlation analysis.Result (1) Significant differences on the relative abundance (RA) of Mortierellomycetes, Tremellomycetes, and Orbiliomycetes were found in the rhizosphere soils on 104 DAP showing T2<T1, while that of Scatterocysts on 134 DAP indicating T2>T1. Fungal class Scatterycetes under T2 on 134 DAP, Rubiaceae under T3 on 77 DAP, and Coprochetes under T3 on 104 DAP were relatively enriched in the rhizosphere than in the bulk soil. The RAs of the rhizosphere fungi also differed significantly on time of sampling and under different treatments. They were 134 DAP<104 DAP for Mortieromycetes under T1, 134 DAP>77 DAP for Scatterocystae and Coprochestae under T2, and 104 DAP>77 DAP for Sphaeromycetes under T3. (2) The Sobs, ACE, and Chao1 indexes under T1 on 104 DAP, T2 on 104 DAP, and T3 on 134 DAP were significantly higher in the rhizosphere than in the bulk soil (P<0.05 or P<0.01). The Shannon index of rhizosphere soil was lower under T1 than under T2 or T3 on 77 DAP. Under T1, the index was 104 DAP>77 DAP; and under T2, it was the opposite. The Simpson indexes ranked in the order of the rhizosphere soil under T1 on 77 DAP>the bulk soil under T1 on 77 DAP>the rhizosphere soil under T1 on 104 DAP>the rhizosphere soil under T2 on 77 DAP>the rhizosphere soil under T3 on 77 DAP. (3) The LEfSe analysis indicated the fertilizer applications enriched one class, one order, and two families of fungi in the rhizosphere soil, whereas the bulk soil was more abundant in two species on 77 DAP, in 3 orders, one family, and one genus on 104 DAP, and in one phylum, one order, one family, and one genus on 134 DAP. Two orders on 104 DAP and one class on 134 DAP were enriched in the rhizosphere soil. (4) On 134 DAP, the 9 functional genes, such as lig in the bulk soil under T1, had significantly more copies than in the rhizosphere soil. In the rhizosphere soil, the RAs of chiA and aclB under T1 on 77 DAP were higher than those on 104 or 134 DAP. (5) AK significantly correlated with 31 functional genes on 104 DAP. Some fungal classes, such as Tremella, Sarcoidales, Claviculaceae, and Sphaeromycetes, significantly correlated with 40, 15, 14, and 9 other functional genes, respectively.Conclusion Fertilization by ways of T2 or T3 enriched the diversity and abundance of cassava rhizosphere fungal community. Fertilizer used, application time, and rhizosphere could all significantly affect the fungal community structure and some functional genes in the soil. The correlations might lead to further studies to unveil the intricate ecosystem.
-
0. 引言
【研究意义】木薯是一种多功能经济作物,有多种用途,包括作为淀粉、牲畜饲料和相关加工食品的原料,也可通过发酵作为生物能源[1]。近年来,种植效益低是国内木薯种植面积不断减少的重要原因之一,因此低成本的木薯高效栽培管理技术是促进木薯产业持续发展的重要举措[2]。施用缓释肥可以增加肥料利用率,从而提高经济效益[3]。【前人研究进展】土壤C、N、P、S循环是生态系统中的重要元素循环,土壤微生物通过调节多种功能基因(包括与C、N、P、S代谢相关的基因)来维持生态系统的各种功能。目前,施肥处理对功能基因的影响主要集中于森林土壤、湿地和水体等不同生态环境的微生物功能研究中,如Ren等[4]研究发现施用沼液可提高杨树人工林土壤微生物的功能基因信号强度和多样性;Li等[5]研究表明施绿肥可改善土壤性质,改变参与氮循环的功能基因丰度。木薯施用缓释肥的相关研究较少,韦云东等[2]研究发现施用缓释肥比常规施肥更能促进木薯植株生长,提高鲜薯产量、淀粉产量和肥料利用率。周时艺等[6,7]研究表明,采用木薯机械化种植,木薯鲜薯产量和淀粉产量在一定的施肥范围内均随缓释肥Osmocote 1号施肥量的增加而增加,从而提高木薯种植效益。木薯根际微生物的研究主要集中在细菌,如覃锋燕等[8]研究发现木薯粉垄耕作造成根际土壤细菌群落多样性和丰富度均高于非根际土壤;蔡杰等[9]研究发现施肥方式改变木薯根际土壤细菌的多样性和相对丰度;韦云东等[10]研究发现木薯根际细菌优势菌门包括变形菌门、放线菌门、酸杆菌门、绿弯菌门等。关于木薯根际土壤真菌的相关报道较少,Li等[11]研究发现不同施氮量对半知菌纲和子囊菌门未分类纲的相对丰度有影响。Cai等[12]研究表明施肥可以改变木薯根际土壤中真菌的丰富度和多样性,增加潜在的有益真菌数量,减少潜在的有害真菌数量。韦云东等[13]研究发现施肥降低了真菌物种丰度,壶菌门和4个真菌纲、哈茨木霉受施肥或根际影响。【本研究切入点】目前关于木薯根际真菌的研究较少,木薯根际真菌与根际速效养分以及功能基因的关系尚未见报道。【拟解决的关键问题】以C、N、P、S功能基因为切入点,通过高通量测序技术和基因芯片技术探讨不同施肥方式对木薯根际土壤真菌群落和功能基因的影响,进一步了解木薯缓释肥对根际微生态的影响,以期为木薯高效施肥等提供科学依据。
1. 材料与方法
1.1 试验材料
供试木薯品种为桂热13号。
所用双膜小颗粒缓释肥(简称C2,N、P2O5、K2O含量分别为16.2%、5.4%、16.2%),由中国热带农业科学院环境与植物保护研究所提供。C2使用的硝酸铵钙、氯化铵、磷酸二氢铵、硝酸钾4种肥料原料与膨润土、硅藻土等造粒后成为小颗粒,之后以聚乳酸为原料形成一层淋膜,再使用凹凸棒粉、聚氨酸等包膜材料进行包膜,形成直径约5 mm的颗粒肥。
1.2 试验方法
1.2.1 试验设计
田间试验地位于广西壮族自治区桂平市石龙镇福平村黄寿屯(N23°19′56″,E109°54′18″)。试验地土壤为红壤,质地为黏土,耕层土壤(0~20 cm,2021年3月24日种植前采样)pH为5.12,有机质为40.95 g·kg−1,全氮、全磷、全钾分别为2.289、1.461、7.952 g·kg−1,速效氮(AN)、速效磷(AP)、速效钾(AK)、缓效钾分别为149.33、143.68、284.74、192.00 mg·kg−1。
本研究设置3个处理:不施肥(T1)、基施双膜缓释肥C2(T2)和植后34 d追施双膜缓释肥C2(T3),C2肥的N∶P2O5∶K2O比例为16.2∶5.4∶16.2,T2和T3的施肥量为N:P2O5:K2O=112.5:37.5:112.5 kg·hm-2。设置4个重复,小区采用随机区组排列。每个小区8行×6株木薯,株行距1 m×0.9 m,小区面积43.2 m2,不起垄种植。于2021年3月24~25日种植并对T2施肥,4月27日(植后34 d)对T3进行施肥。其他管理采用常规管理措施。
1.2.2 采样与测试方法
于2021年6月8~9日(植后77 d)、7月5~6日(植后104 d)、8月4~5日(植后134 d)采集根际和非根际土壤,其中根际土壤用“抖落法”采集,非根际土样用常规方法采集。其中植后77 d的根际土样由于采样量少,仅保存一份冷冻样:在液氮(−196 ℃)中速冻后在干冰中贮存(−80 ℃),之后带回室内冰柜冷冻保存(−40 ℃)。其他时间的土样采集后在15 min内用四分法分为常温样和冷冻样(如上描述)保存。
常温样风干过筛后采用常规方法测定土壤速效氮、磷、钾[14]。冷冻土样液氮下使用玛瑙研钵磨后,使用干冰(−80 ℃)运输送检,进行真菌内转录间隔区(Internal Transcribed Spacer,ITS)高通量测序和功能基因测定。
真菌(ITS)高通量测序参照Yang等[15]的方法,包括DNA提取和PCR扩增、测序、数据处理等过程,其中PCR扩增用的引物对为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′),对ITS基因V3~V4可变区进行扩增,测序使用Illumina公司的Miseq PE300平台进行(上海美吉生物医药科技有限公司)。使用Unite(Release 8.0 http://unite.ut.ee/index.php)的真菌数据库对OTU进行注释,设置97%的相似性阈值,注释后得到不同真菌分类层次的OTU数量和相对丰度。
C、N、P、S功能基因采用基因芯片技术,由广东美格基因科技有限公司进行,具体流程如下:①土壤样品DNA的提取与QMEC检测与张洁洁等[16]相同,包括按照说明书流程利用PowerSoil DNA Isolation Kit(MOBIO Laboratories, Carlsbad, CA USA)从土壤样品中提取 DNA。使用Qubit 4.0 (Thermo Fisher Scientific, Waltham, USA)和 NanoDrop 2000(Thermo Scientific,Wilmington,DE,USA)检测DNA的浓度与纯度。②采用基于高通量荧光定量PCR(qPCR)的功能基因芯片(QMEC)解析微生物的功能特征,以16S rRNA基因为内参基因,检测和量化与碳氮硫磷元素循环相关的71个功能基因[17]。采用SmartChip RealTime PCR系统(WaferGen Biosystems,USA)进行qPCR反应与荧光信号检测。每个样品均设置3个技术重复与阴性对照。③当阴性对照无扩增、扩增效率在1.8~2.2范围内且Ct值小于31时,判定该基因检测信号为阳性可用于后续的数据分析,并通过Ct值与16S rRNA基因的拷贝数计算待测液的初始基因拷贝数,从而计算获得各基因在每克干土中的拷贝数[18,19]。
土壤速效养分结果(另文发表)在本研究中仅用于基因功能的相关分析。
1.3 数据统计分析
α-多样性指标计算采用Mothur 1.30.2进行。数据使用Rstudio 1.1.463进行分析,基于R-4.2.1。重复方差分析以小区为重复对象,用R语言中的aov函数进行分析,分析指标包括真菌纲水平相对丰度、部分优势目和科水平相对丰度、属水平α-多样性,得到不同的因素(包括处理间、根际与非根际、采样时间及其交互作用)对各指标的影响是否显著,文中仅描述P值。
处理间的纲水平和部分优势目和科水平相对丰度差异比较采用非参数Kruskal-Wallis检验,用R语言中的boxplerk.R程序计算并自动标记小写字母。真菌属水平α-多样性指标和功能基因和总DNA的处理间差异的方差分析多重比较采用SSR法,在R语言中的boxplert.R程序中计算并自动标记小写字母。各种指标的根际与非根际之间的比较和不同采样时间之间的比较均采用配对t检验,用R语言自带函数t.test进行,并使用apply函数进行批量检验。
真菌纲和部分优势目和科水平Heatmap图采用Pheatmap包进行作图,其中功能基因的Heatmap图先进行对数转化,再进行作图。
LEfSe(LDA EffectSize)首先使用non-parametric factorial Kruskal-Wallis(KW)sum-ranktest(非参数因子克鲁斯卡尔-沃利斯和秩验检)检测具有显著丰度差异特征,并找到与丰度有显著性差异的类群。然后LEfSe采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小。选择LDA值大于4的物种,即组间具有统计学差异的Biomarker,在美吉生信云平台(http://majorbio.com)进行计算。本文仅对根际土壤进行LEfSe分析。
相关分析采用Pearson相关,在R语言中使用corrplot、Hmisc、tidyverse、ggsignif等软件包进行计算和作图。
2. 结果与分析
2.1 真菌群落结构和多样性
2.1.1 真菌群落结构描述
对72个样品进行高通量测序,共获得优化序列
3793920 个,926554710 bases,平均序列长度244 bp。样品中共检测出14个真菌门,其中子囊菌门(Ascomycota)占有优势地位,相对丰度75.41%±7.25%(图表略,可从图1计算);被孢霉门(Mortierellomycota, 8.22%±3.19%)、担子菌门(Basidiomycota, 8.19%±5.42%)、球囊菌门(Glomeromycota, 1.32%±1.13%)、壶菌门(Chytridiomycota, 1.08%±0.86%)、Calcarisporiellomycota(0.30%±0.36%)、梳霉门(Kickxellomycota, 0.21%±0.20%),未注释到门水平的有5.13%±3.09%。![]() 图 1 真菌纲和部分主要目和科的heatmap图(1)第一个/之前的字母表示处理间的差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异;(2)处理间/根际与非根际/时间比较,其中一个因素的比较均排除另外两个因素的差异进行。如处理间比较仅限同一采样时间和同一土壤类型(根际或非根际)的不同处理比较。不同的小写字母表示差异显著(P<0.05),不同的大写字母表示极显著(P<0.01)。(2)处理编号中,R表示根际土壤,N表示非根际土壤。Figure 1. Heatmap of fungal classes and dominant orders and families(1) Letters before first “/” indicate significant difference between treatments; those between two “/” indicate difference between rhizosphere and bulk soil; and those after second “/” indicate difference between sampling times. (2) Mutually exclusive comparisons between intertreatment/rhizosphere and bulk soil/time, e.g., a comparison between treatments is limited to treatments on either rhizosphere or bulk soil at same sampling time. Data with different lowercase letters indicate significant differences at P<0.05; those with different uppercase letters, extremely significant differences at P<0.01. (2) In the treatmet name, R: rhizosphere soil; N: bulk soil.
图 1 真菌纲和部分主要目和科的heatmap图(1)第一个/之前的字母表示处理间的差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异;(2)处理间/根际与非根际/时间比较,其中一个因素的比较均排除另外两个因素的差异进行。如处理间比较仅限同一采样时间和同一土壤类型(根际或非根际)的不同处理比较。不同的小写字母表示差异显著(P<0.05),不同的大写字母表示极显著(P<0.01)。(2)处理编号中,R表示根际土壤,N表示非根际土壤。Figure 1. Heatmap of fungal classes and dominant orders and families(1) Letters before first “/” indicate significant difference between treatments; those between two “/” indicate difference between rhizosphere and bulk soil; and those after second “/” indicate difference between sampling times. (2) Mutually exclusive comparisons between intertreatment/rhizosphere and bulk soil/time, e.g., a comparison between treatments is limited to treatments on either rhizosphere or bulk soil at same sampling time. Data with different lowercase letters indicate significant differences at P<0.05; those with different uppercase letters, extremely significant differences at P<0.01. (2) In the treatmet name, R: rhizosphere soil; N: bulk soil.由图1可知,纲水平的优势菌为粪壳菌纲(Sordariomycetes,52.97%±9.58%,属子囊菌门)、散囊菌纲(Eurotiomycetes,10.67%±4.34%,属子囊菌门)、被孢霉纲(Mortierellomycetes,8.19%±3.20%,属被孢霉门),座囊菌纲(Dothideomycetes,7.42%±3.91%,属子囊菌门),伞菌纲(Agaricomycetes,4.72%±5.12%,属担子菌门),银耳纲(Tremellomycetes,3.06%±2.12%,属担子菌门)、子囊菌门未分类纲(unclassified_p__Ascomycota, 1.58%±1.63%);酵母纲(Saccharomycetes,1.06%±1.56%,属子囊菌门)。
其中粪壳菌纲下面有两个优势目:肉座菌目(Hypocreales, 25.97%±11.61%)和粪壳菌目(Sordariales, 12.88%±7.93%),前者下属有2个主要科:丛赤壳科(Nectriacea, 18.08%±10.51%)和生赤壳科(Bionectriaceae, 4.11%±2.50%),后者下属有1个主要科:毛壳科(Chaetomiaceae, 9.53%±7.22%)。
2.1.2 真菌群落的差异分析
由图1可知,不同处理间的真菌群落相对丰度存在显著差异。植后77 d,非根际土壤球囊菌纲为T3<T1。植后104 d,非根际土壤壶菌门下属的未分类纲,根际土壤被孢霉纲、银耳纲、圆盘菌纲(Orbiliomycetes)均为T2<T1;根际土壤生赤壳科为T2和T3<T1。植后134 d,非根际土壤酵母纲为T1、T3<T2,根际土壤散囊菌纲为T2>T1。处理间的根际土壤的差异主要表现在施肥与不施肥之间,追施C2比不施肥降低了77 d根际土壤球囊菌纲,基施C2则降低了104 d根际土壤被孢霉纲、银耳纲、圆盘菌纲,提高了134 d根际土壤散囊菌纲。
不同处理的根际与非根际的差异真菌有所区别。T1散囊菌纲在77 d的非根际相对根际富集;毛壳科和壶菌门下属的未分类纲均在77 d和104 d的根际显著低于非根际。T2的根际散囊菌纲相对丰度在134 d显著高于非根际,毛壳科和酵母纲则显著低于非根际。T3则有丛赤壳科在77 d和粪壳菌纲在104 d根际显著相对富集。
采样时间之间也有少数真菌存在显著差异。T1非根际的酵母纲和散囊菌纲表现出了采样时间之间的差异,分别为134 d<104 d和104 d<77 d。T1根际被孢霉纲和生赤壳科的不同时间的相对丰度分别为134 d<104 d、134 d<104 d/77 d。T2非根际壶菌门下属的未分类纲的时间大小顺序为134 d<77 d;T2根际散囊菌纲和粪壳菌纲均为134 d>77 d,粪壳菌纲下属的肉座菌目为134 d>77 d/104 d。T3根际球囊菌纲和粪壳菌纲下属的粪壳菌目的时间大小顺序分别为104 d>77 d、104 d<77 d。
2.1.3 真菌属水平α-多样性
由表1可知,Sobs、ACE、Chao1指数均在植后104 d的T1和T2的根际分别显著或极显著大于非根际,在植后134 d T3根际则显著高于非根际。
表 1 真菌属水平α-多样性Table 1. α-diversity of fungi at family level土壤类型和时间
Soil types and time处理
TreatmentSobs Shannon Simpson ACE Chao1 T1 211.8±65.4a/a/a 3.241±0.083b/a/b 0.083±0.007a/a/A 222.6±72.9a/a/a 223.5±73.3a/a/a R77d T2 227.5±28.8a/a/a 3.562±0.205a/a/a 0.059±0.016b/a/a 232.4±31.4a/a/a 234.6±33.7a/a/a T3 239.3±29.8a/a/a 3.584±0.115a/a/a 0.057±0.009b/a/a 245.1±32.5a/a/a 249.0±34.3a/a/a T1 197.5±28.5a/a/a 3.528±0.188a/a/a 0.057±0.012a/b/a 203.5±33.9a/a/a 207.7±39.8a/a/a N77d T2 188.5±26.8a/a/a 3.559±0.131a/a/a 0.055±0.009a/a/a 191.8±27.9a/a/a 193.4±29.7a/a/a T3 206.3±18.1a/a/a 3.491±0.079a/a/a 0.066±0.016a/a/a 209.8±20.4a/a/a 211.3±19.5a/a/a T1 249.8±29.1a/a/a 3.604±0.213a/a/a 0.051±0.008a/a/B 257.9±32.3a/a/a 259.4±32.7a/a/a R104d T2 232.5±21.4a/A/a 3.412±0.217a/a/b 0.068±0.018a/a/a 241.1±23.3a/A/a 242.8±23.1a/A/a T3 254.5±39.7a/a/a 3.439±0.264a/a/a 0.084±0.058a/a/a 265.0±43.4a/a/a 265.7±44.1a/a/a T1 204.5±27.1a/b/a 3.516±0.102a/a/a 0.060±0.005a/a/a 207.5±28.3a/b/a 208.1±28.4a/b/a N104d T2 189.5±33.7a/B/a 3.141±0.619a/a/a 0.121±0.117a/a/a 195.3±35.9a/B/a 195.1±36.5a/B/a T3 192.8±28.2a/a/a 3.343±0.265a/a/a 0.073±0.020a/a/a 195.6±29.1a/a/a 196.6±29.9a/a/a T1 223.8±25.6a/a/a 3.258±0.464a/a/ab 0.110±0.067a/a/AB 236.6±32.7a/a/a 237.1±32.6a/a/a R134d T2 219.0±34.9a/a/a 3.392±0.353a/a/ab 0.069±0.027a/a/a 231.2±41.4a/a/a 237.5±46.8a/a/a T3 249.5±19.8a/a/a 3.491±0.167a/a/a 0.062±0.016a/a/a 264.7±25.8a/a/a 272.0±28.1a/a/a T1 204.8±28.1a/a/a 2.811±0.883a/a/a 0.193±0.227a/a/a 218.6±24.4a/a/a 220.0±21.4a/a/a N134d T2 180.8±32.3a/a/a 3.391±0.178a/a/a 0.065±0.014a/a/a 184.0±33.8a/a/a 184.9±34.1a/a/a T3 202.8±26.4a/b/a 3.441±0.303a/a/a 0.065±0.031a/a/a 206.8±28.4a/b/a 208.5±29.2a/b/a ①R表示根际土壤,N表示非根际土壤。R77d和N77d分别表示植后77 d的根际土壤和植后77 d的非根际土壤。②“//”及其前后的字母含义与图1相同。
①R: rhizosphere soil; N: bulk soil. R77d and N77d: rhizosphere soil and bulk soil on 77 DAP, respectively. ② Letters mean as Fig. 1.Shannon指数在植后77 d处理间有显著差异,T2和T3根际显著高于T1;该指数在根际与非根际之间无显著差异,但在根际有采样时间之间的差异,T1根际104 d显著高于77 d,T2则相反。Simpson指数在植后77 d的根际有处理间差异,具体为T1>T2/T3;植后77 d T1根际也显著高于非根际,且T1根际77 d也极显著高于104 d。说明植后77 d,不施肥处理的根际Simpson指数最大,其真菌多样性最低,不仅低于77 d的非根际,也低于77 d的另外两个施肥处理的根际,在时间上还低于104 d的根际。
2.1.4 真菌LEfSe分析结果
由表2可知,3个处理的根际对比中,植后77 d,T3的Sordariales_fam_Incertae_sedis -Ramophialophora -Ramophialophora_sp.的相对丰度最高;植后104 d,T1根际相对T2和T3根际的生赤壳科(Bionectriaceae)-枝穗孢属(Clonostachys)-Clonostachys_sp.和Chaetosphaeriales -Chaetosphaeriaceae -Codinaea- s_unclassfied_g_Codinaea的相对丰度较高。植后134 d,T2根际的散囊菌纲(Eurotiomycetes)-小囊菌目(Microascales)-小囊菌科(Microascaceae)的相对丰度最高。
表 2 土壤真菌LEfSe分析信息Table 2. LEfSe analysis information of soil fungi处理对及优势处理
The treatments for comparison
and the advantageous one生物标记物
Biomarker处理对及优势处理
The treatments for comparison
and the advantageous one生物标记物
Biomarker77 d
T1R-T2R-T3Rf_Sordariales_fam_Incertae_sedis, g_Ramophialophora, s_Ramophialophora_sp. 104 d
T2-T2Rg_Cephalotrichum, s_unclassified_g_Cephalotrichum 104 d
T1R-T2R-T3Rf_Bionectriaceae, g_Clonostachys, s_Clonostachys_sp.; o_Chaetosphaeriales, f_Chaetosphaeriaceae, g_Codinaea, s_unclassfied_g_Codinaea 134 d
T2-T2RAscomycota, c_Eurotiomycetes; o_Microascales, f_Microascaceae, g_Cephalotrichum, s_unclassified_g_cephalotrichum 134 d
T1R-T2R-T3Rc_Eurotiomycetes, o_Microascales, f_Microascaceae 134 d
T3-T3Rg_Fusarium, s_unclassified_g_Fusarium; f_Bionectraceae g_Clonostachys, s_Clonostachys_sp. 77 d
T1-T1Rs_Clonostachys_sp. 104 d
T3-T3Rf_Stachybotryaceae 77 d
T2R-T2s_Chaetomium_sp. T1R
77d-104d-134do_Branch06, f_unclassified_o_Branch06, g_unclassified_o_branch06, s_Branch06_sp.; o_Capnodiales, f_Mycosphaerellaceae 104 d
T1-T1Ro_Branch06, f_unclassified_o_Branch06, g_unclassified_o_branch06, s_Branch06_sp.; o_Capnodiales; o_Chaetosphaeriales, f_Chaetosphaeriaceae, g_Codinaea, s_unclassified_g_Codinaea T2R
77d-104d-134dc_Eurotiomycetes ①T1R-T2R-T3R单元格内的上下两行分别表示共同和异同的处理,如77d T1R-T2R-T3R表示77d的T1、T2、T3根际比较,且粗体加下划线格式表示右侧列出的真菌门类为该处理的Biomarker。R表示根际土。②真菌门类名称前的c_表示纲(class),o_表示目(order),f_表示科(family),g_表示属(genus),s_表示种(species),不标记表示门水平;“,”表示后者包含于前者的门类,“;”表示后者与前者不属于同一门类。
(1) Upper and lower rows in cells of same type represent common and different treatments, respectively. For example, 77d T1R-T2R-T3R is comparison of rhizosphere soils under T1, T2, and T3 on 77 DAP. Name with underlined bold fonts indicates fungal phyla listed on the right to be biomarker of treatment, and R, rhizosphere soil. (2) Before a fungus name, c_ represents at class level, o_, order, f_, family, g_, genus, s_, species, and unmarked, phylum. "," indicates two in same phylum; and ";" two are in different phyla.植后77 d,T1根际的Clonostachys_sp.种的相对丰度最高,T2根际s_Chaetomium_sp.种的相对丰度最高。植后104 d,T1根际的Branch06目-f_unclassified_o_Branch06-g_unclassified_o_branch06- s_Branch06_sp.、煤炱目(Capnodiales)和Chaetosphaeriales目-Chaetosphaeriaceae科-Codinaea属- s_unclassified_g_Codinaea的相对丰度最高。植后104 d,T2根际的头束霉属(Cephalotrichum)-s_unclassified_g_Cephalot的相对丰度最高;T3根际的Stachybotryaceae科相对丰度最高。
植后134 d,T2根际的子囊菌门(Ascomycota)-散囊菌纲(Eurotiomycetes)和小囊菌目(Microascales)-小囊菌科(Microascaceae)-头束霉属(Cephalotrichum)-s_unclassified_g_cephalotrichum的相对丰度最高。T3根际的镰刀菌属(Fusarium)-s_unclassified_g_Fusarium和Bionectraceae科-Clonostachys属-Clonostachys_sp.种的相对丰度最高。
不同采样时间之间的LEfSe分析也有显著差异的真菌类别,T1根际在104 d的o_Branch06 - f_unclassified_o_Branch06-g_unclassified_o_branch06-s_Branch06_sp.以及煤炱目(Capnodiales)-球腔菌科(Mycosphaerellaceae)的相对丰度最高。T2根际在134 d的散囊菌纲(Eurotiomycetes)的相对丰度最高。
2.2 C、N、P、S功能基因
2.2.1 共有和特有的功能基因
有52个基因(含16S)在每个处理中均出现,有5个基因未检测到,包括nirS2、hzo、hzsA,mcrA、exo-chi。其中nirS2基因是反硝化的最主要基因,hzo和hzsA均为厌氧氨氧化的基因,mcrA为产甲烷菌甲基辅酶M还原酶α亚基基因片段,所测样品这些基因的缺失,均说明土壤通气状况良好,未达到反硝化作用、产甲烷均所需的厌氧条件。exo-chi是产生外源性木聚糖酶的基因,exo-chi功能基因常用于对植物细胞壁进行降解,分解植物细胞壁中的木质素、纤维素、半纤维素等复杂化合物。该基因的缺失,很可能是由于采样季节木薯田间未产生落叶,土壤中的微生物活动暂时不需要激活该功能基因。
有15个基因仅在部分处理中出现(图2)。说明所测的基因大部分都存在于不同时间和不同处理中,而少数处于较活跃的存在和消失状态。其中cphy(半胱氨酸植酸酶)和pox(木质素降解酶)分别仅在77 d的T1非根际和根际的1个样品中表现出了非0值,phoD仅在77 d的T1和T2根际的1个样品中出现。
![]() 图 2 功能基因丰度(对数转化)第一个/之前的数字是表示非零值的样品个数,第一个/之前的字母表示处理间是否有显著差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异。不同小写字母表示差异显著(P<0.05)。Figure 2. Logarithmic transformed abundance of functional genesNumber before first "/" indicates count of non-zero values, while letter, significant difference between treatments; letter between two "/" indicates difference between rhizosphere and bulk soil; and letter after second "/"indicates difference between sampling times. Data with different lowercase letters indicate significant differences at P<0.05.
图 2 功能基因丰度(对数转化)第一个/之前的数字是表示非零值的样品个数,第一个/之前的字母表示处理间是否有显著差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异。不同小写字母表示差异显著(P<0.05)。Figure 2. Logarithmic transformed abundance of functional genesNumber before first "/" indicates count of non-zero values, while letter, significant difference between treatments; letter between two "/" indicates difference between rhizosphere and bulk soil; and letter after second "/"indicates difference between sampling times. Data with different lowercase letters indicate significant differences at P<0.05.naglu在104 d的T1和T2处理的2个和1个的非根际样品中出现。ppk则分别在T1R77d、T1N104d、T2N104d中的1、2、1个样品中出现。ppk为多聚磷酸盐激酶,其与生物体内poly-P代谢相关的关键酶,它催化ATP末端的磷酸基团可逆地转移到长链多聚磷酸盐(poly-P)上。cdaR则仅在T1N77d、T1R77d、T2R77d、T1N104d、T2N104d、T3N104d的分别1~2个样品中出现。hao(羟胺氧化酶)可催化NH2+OH转变为NO2−,这是硝化作用的一个环节,其在T1N77d、T1R77d、T1N104d、T2N104d、T3N104d的分别1、1、2、2、2个样品中出现。amyX(编码糖化酶)和cdaR(碳固定基因)分别在T1N77d、T1R77d、T2R77d、T1N104d、T2N104d、T3N104d的1~2个样品中出现。rbcL和nasA的非零值出现的处理和时间完全一致,分别在T1N77d、T2N77d、T1R77d、T2R77d、T1N104d、T2N104d、T3N104d的3、1、3、1、2、3、2个样品中出现。以上基因均未在134 d中出现,表明植后134 d的土壤或根际环境与前两个采样时间有一定差异。
cdh则在77 d的根际和非根际,104 d的非根际中均有出现,在104 d和134 d的根际土壤中均未出现。
amyA2(编码α-淀粉酶)在T2N77d、T1R104d、T1N134d、T2N134d、T1R134d中均未出现,在所测的其他处理中分别在1~3个样品中出现。iso-plu仅在T2R77d、T1R104d、T1N134d、T1R134d中未出现,在其他处理中分别有1~2个样品中出现。acsB仅在T1R104d、T2R104d、T3R104d、T1R134d中未出现,在其他处理中分别有1~3个样品中出现。dsrB仅在T2N77d、T3R104d、T2N134d、T2R134d中未出现,在其他处理中分别有1~3个样品中出现。
不同时间和处理下,根际和非根际共有的基因数量在53~62个(图表略),其中77 d T1的根际和非根际共有62个,为最高值,说明施肥或根际减少了根际与非根际的共有基因数量。
2.2.2 功能基因的方差分析结果
由图2可知,在非0值的基因中,134 d出现根际与非根际的显著差异,lig、manB、sga、mct、mmoX、amoA1、nirS3、amoB和gcd在T1非根际土壤中的丰度显著高于根际土壤。104 d表现出处理间的显著差异,amyA非根际土壤中T1的丰度显著高于T2和T3。T1处理共有12个非0值的基因展现出了时间的差异,在非根际土壤中,cex、sga、acsA、pccA、amoA1、napA、gdhA、pqqC、gcd和phnk的丰度均表现为134 d高于77 d和104 d;在根际土壤中,chiA和aclB的丰度均为77 d高于104 d和134 d。表现出时间差异的12个非0值基因按照功能分类,有3个基因有碳降解功能:cex、sga和chiA,3个为碳固定基因:acsA、pccA、aclB,3个氮循环基因:amoA1、napA、gdhA,3个磷循环基因:pqqC、phnk和gcd。这些基因的时间变化可能与土壤温度和水分(通气状况)有关。总DNA也在T1非根际表现出了时间上的差异,其在134 d最高,显著高于77 d和104 d。说明施肥掩盖了功能基因之间的时间差异。
2.2.3 功能基因与速效养分和真菌相对丰度的相关性
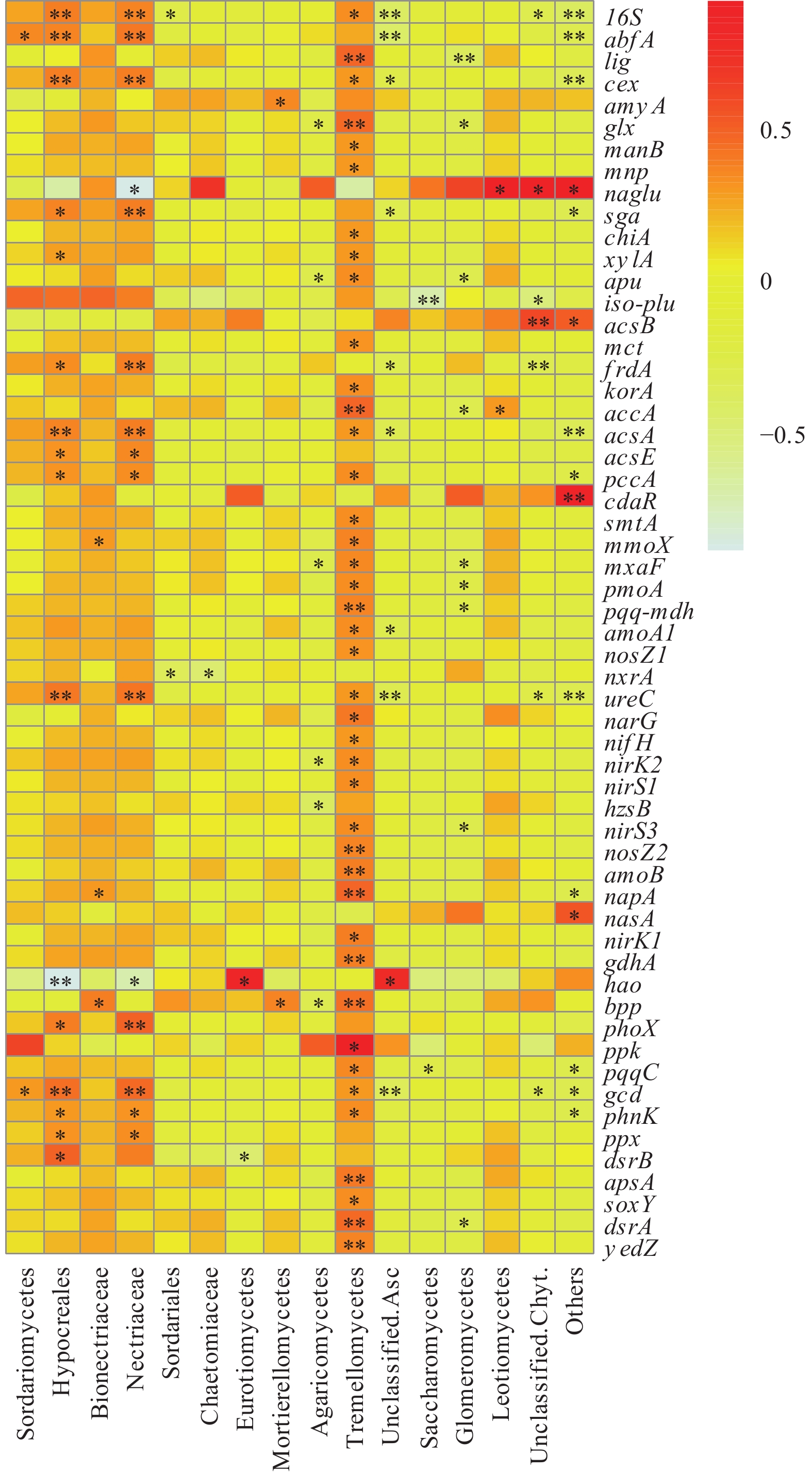
由图3可知,按时间分析,速效钾(AK)在104 d与31个功能基因显著相关,在77 d仅与1个功能基因cdh相关,在134 d与功能基因无显著相关。植后104 d,AK与31个功能基因显著相关,包括7个碳降解基因lig、amyA、apu、glx、manB、mnp、chiA,5个碳固定基因aclB、korA、mct、frdA、accA,4个甲烷代谢基因mmoX、mxaF、pmoA、pqq-mdh,11个氮循环基因narG、nifH、nirK2、nirS1、hzsB、nirS3、nosZ2、amoB、napA、nirK1、gdhA,1个磷循环基因bpp,3个硫循环基因apsA、dsrA、soxY。
筛选出非0值大于5个的64基因进行相关分析(均剔除0值),ppk和amoA2的非0值分别为5个和14个,二者仅与mxaF显著相关;nxrA与11个功能基因显著相关:cdh、frdA、korA、acsE、pmoA、nosZ2、napA、phnk、dsrB、nirK2和gcd;rbcL与16个基因显著相关:abfA、glx、sga、xylA、amyX、smtA、nirS3、amoB、gdhA、bpp、yedZ、cex、pccA、pqq-mdh、ureC和gcd。cdaR、mxaF、frdA和phoX的非0值分别有11、54、56、40个,分别与14、52、49、37个基因显著相关。
amyX、cdh、iso-plu、dsrB和nasA的非0值均仅有10、17、14、19、15个,但分别与24、40、20、43、31个基因显著相关,这些基因出现在较少的样品中,但与其他较多基因显著相关,可能出现在某一类共同的细菌中。
速效氮(AN)仅与bpp基因显著正相关(r=0.754,P=0.019),该磷循环功能基因可能受到速效氮的显著影响。
2.2.4 真菌纲、部分主要目、科和功能基因的相关性
由图4可知,银耳纲(Tremellomycetes)与16S和其他40个功能基因显著正相关,包括8个碳降解基因lig、cex、glx、manB、mnp、chiA、xylA、apu,6个碳固定基因mct、korA、accA、acsA、pccA、smtA,4个甲烷代谢基因mmoX、mxaF、pmoA、pqq-mdh,13个氮循环基因amoA1、nosZ1、ureC、narG、nifH、nirK2、nirS1、nirS3、nosZ2、amoB、napA、nirK1、gdhA,5个磷循环基因bpp、ppk、pqqC、gcd、phnK,4个硫循环基因apsA、soxY、dsrA、yedZ。
肉座菌目(Hypocreales)与16S和其他15个功能基因显著相关,其中与4个碳降解基因abfA、cex、sga、xylA,4个碳固定基因frdA、acsA、acsE、pccA,4个磷循环基因phoX、phnK、ppx、gcd,与1个硫循环基因dsrB都呈正相关,与两个氮循环基因分别正相关(ureC)和负相关(hao)。
丛赤壳科(Nectriaceae)与16S和其他14个功能基因显著相关,包括4个碳降解基因abfA、cex、naglu(负相关)、sga,4个碳固定基因frdA、acsA、acsE、pccA,2个氮循环基因ureC(正相关)、hao(负相关),4个磷循环基因phoX、phnK、ppx、gcd。
球囊菌纲(Glomeromycetes)与9个功能基因负相关,包括3个碳降解基因Lig、glx、apu,1个碳固定基因accA,3个甲烷代谢基因mxaF、pmoA、pqq-mdh,1个氮循环基因nirS3,1个硫循环基因dsrA。
3. 讨论与结论
3.1 木薯缓释肥对真菌群落组成的影响
本研究表明门水平上的优势菌门为子囊菌门,其后依次是被孢霉门、担子菌门、球囊菌门、壶菌门等。这与韦云东等[13]的研究结果类似。按营养方式的不同,可将真菌分为腐生营养型、共生营养型和病原型。子囊菌门的相对丰度较高,原因可能有两个:一是子囊菌门大多为腐生营养型,是土壤中有机物质的主要分解者,施加缓释肥会增加土壤养分含量,而丰富的养分为子囊菌门提供了适宜的生长条件,从而导致子囊菌门相对丰度增加[20]。二是子囊菌的繁殖能力极强,能产生大量无性孢子,且生长迅猛,使其在数量上占显著优势[21]。此外,子囊菌是生态系统碳氮循环的重要驱动因素,其在土壤稳定性、植物生物量分解中发挥作用,还可与植物形成共生关系[22]。担子菌门能很好地降解木质素,与植物形成菌根,促进根系对水分和矿质元素的吸收,改善土壤的物理性质,同时分泌抗菌物质抑制土壤病原菌的生长,保护宿主植物免受病原菌侵袭[23]。担子菌在土壤质量较好的环境里数量较多[24],说明本研究的土壤环境条件良好。球囊菌门可促进植物吸收土壤中的无机盐,特别是磷的吸收,在改善根系功能的同时还可提高宿主植物的抗逆性[25]。壶菌门中部分菌群可寄生在高等植物上,其游动孢子是一些土壤病毒的媒介[26]。因此,在木薯栽培过程中应增加子囊菌门、担子菌门、球囊菌门等真菌的数量,减少壶菌门等真菌的数量。
3.2 木薯缓释肥对真菌群落α-多样性的影响
通过分析Sobs、ACE、Chao1、Simpson和Shannon指数,研究发现:(1)不施肥和基施C2在104 d提高了根际真菌丰度,但植后34 d施C2提高了植后134 d根际真菌丰度,说明施肥时间影响木薯根际真菌丰度,不施肥和基施C2提高了木薯块根形成期至膨大期的根际真菌丰度,植后34 d施C2则提高了木薯块根膨大期的根际真菌丰度。(2)C2基施和植后34 d施用均在77 d比不施肥提高了根际真菌多样性,说明施肥可提高木薯块根形成期的根际真菌丰度。(3)不施肥处理植后104 d根际真菌多样性高于77 d,基施C2则在显著提高77 d的根际真菌多样性后,到104 d显著降低到与CK相同的正常水平。同样可以说明施肥会影响木薯根际真菌的多样性。
3.3 木薯缓释肥对C、N、P、S功能基因的影响
微生物是土壤磷循环的主要驱动者,phoD和phoX碱性磷酸酶基因负责催化磷酸单酯和磷酸二酯水解,其中phoD基因被认为是土壤中最重要的碱性磷酸酶基因。在本研究中,phoD仅在77 d的T1和T2根际的分别1个样品中出现,可能是跟phoD是碱性磷酸酶基因,而真菌主要通过分泌酸性磷酸酶促进有机磷矿化有关[27]。gcd是负责编码一种介导无机磷溶酶的基因,是决定土壤中生物可利用磷的主要因素[28]。本研究发现,gcd在134 d T1非根际土壤中的丰度显著高于根际土壤,说明在块根膨大期,木薯吸收利用磷的活动相对不活跃。
土壤氮循环包括生物固氮、氨同化作用、硝化作用和反硝化作用等四个过程[29]。nasA是参与氨同化作用的主要功能基因之一。参与硝化作用的主要功能基因是hao和nxrA。研究结果表明,hao仅与amoA2功能基因显著相关,是因为两者是关联基因,amoA2是催化NH4+→NH2+OH的关键基因,而hao是催化NH2+OH→NO2−的关键基因。nasA和hao在77 d和104 d出现,未在134 d的样品中出现,说明木薯的硝化作用主要发生在块根形成期,将肥料中的铵态氮转化成硝态氮。nxrA起到亚硝酸氧化的作用,与3个反硝化基因nosZ2、napA、nirK2显著相关。参与反硝化过程的主要功能基因包括:napA、narG、nirS、nirK和nosZ。根据结构不同,nirS功能基因可分为Ⅰ型(nirS1)、Ⅱ型(nirS2)和Ⅲ型(nirS3),在本试验中,nirS2在所有样品中缺失,而nirS1和nirS3可在样品中发现。陈晨等[30]研究表明长期施用有机肥会显著提高nirK、nirS、nosZ反硝化基因的丰度,但是本试验中施缓释肥对这几个功能基因丰度影响并不显著,可能跟施用肥料不同有关。参与固氮作用的主要功能基因是nifH,该关键基因常用于评估农业环境中微生物群落的固氮作用和潜力[31]。本试验中nifH在处理间无显著性差异,可能是不同施肥处理之间的氮浓度还不足以影响生物固氮,这和钱佳彤[32]的研究结果相似。
土壤中有机碳的主要来源是植物凋落物和根系分泌物,其主要化学成分包括糖类、蛋白质、纤维素、半纤维素、木质素以及脂类等[33]。真菌有突出的分解能力,其中子囊菌和担子菌是真菌门类中土壤有机碳分解的主要参与者。本研究结果表明土壤半纤维素酶有关基因abfA、木质素有关基因mnp分别与子囊菌门-粪壳菌纲-肉座菌目-丛赤壳科、担子菌门-银耳纲呈极显著正相关和显著正相关,暗示子囊菌、担子菌可能分别参与半纤维素、木质素的降解过程中。这与Bastida[34]和Yelle[35]的研究结果一致。在根际土壤中,碳固定基因aclB和碳降解基因chiA的丰度均为77 d高于104 d和134 d,说明在木薯块根形成期,碳固定和碳降解活动较为活跃,为木薯生长提供有机质。
3.4 木薯缓释肥和真菌对土壤速效养分的影响
本研究发现银耳纲与与40个功能基因显著正相关,包括碳降解基因、碳固定基因、甲烷代谢基因、氮循环基因、磷循环基因和硫循环基因;肉座菌目与15个功能基因显著相关,包括碳降解基因、碳固定基因、氮循环基因、磷循环基因和硫循环基因。这暗示银耳纲和肉座菌目等可能参与土壤养分的循环。真菌可能通过分泌有机酸影响功能基因和溶解矿物中的养分而影响土壤速效养分,例如真菌分泌导致含氮化合物解聚的外泌酶,参与土壤的氮循环[36]。土壤速效养分可能通过改变土壤pH,进而影响微生物的群落结构[37]。例如李航等[38]研究发现不同施肥处理通过改变土壤养分影响真菌群落结构。这说明银耳纲和肉座菌目等可能通过分泌有机酸而影响土壤速效养分,土壤速效养分则可能通过改变土壤pH而影响银耳纲和肉座菌目等真菌群落。
速效钾作为代谢过程中渗透稳定性的重要物质[39],在104 d与31个功能基因显著相关,可能是速效钾在木薯块根形成期至块根膨大期,木薯生理生化代谢活动较大,为维持自身渗透压的稳定性,需要大量的速效钾离子参与。速效氮仅与rbcL显著正相关,rbcL基因是编码核酮糖二磷酸羧化酶,该酶是羧化还原作用固定CO2的关键酶。这可能跟土壤碳氮循环有关基因的表达具有耦合作用有关[32]。
综上所述,双膜缓释肥C2基施(T2)和植后34 d施用(T3)可提高木薯根际真菌群落的多样性和相对丰度,施肥、时间、根际等都对真菌群落结构和功能基因有显著的影响,相关性分析结果暗示木薯根际真菌可能参与土壤速效养分的循环和功能基因的作用。
-
图 1 真菌纲和部分主要目和科的heatmap图
(1)第一个/之前的字母表示处理间的差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异;(2)处理间/根际与非根际/时间比较,其中一个因素的比较均排除另外两个因素的差异进行。如处理间比较仅限同一采样时间和同一土壤类型(根际或非根际)的不同处理比较。不同的小写字母表示差异显著(P<0.05),不同的大写字母表示极显著(P<0.01)。(2)处理编号中,R表示根际土壤,N表示非根际土壤。
Figure 1. Heatmap of fungal classes and dominant orders and families
(1) Letters before first “/” indicate significant difference between treatments; those between two “/” indicate difference between rhizosphere and bulk soil; and those after second “/” indicate difference between sampling times. (2) Mutually exclusive comparisons between intertreatment/rhizosphere and bulk soil/time, e.g., a comparison between treatments is limited to treatments on either rhizosphere or bulk soil at same sampling time. Data with different lowercase letters indicate significant differences at P<0.05; those with different uppercase letters, extremely significant differences at P<0.01. (2) In the treatmet name, R: rhizosphere soil; N: bulk soil.
图 2 功能基因丰度(对数转化)
第一个/之前的数字是表示非零值的样品个数,第一个/之前的字母表示处理间是否有显著差异,两个/之间的字母表示根际与非根际之间的差异,第二个/后的字母表示采样时间之间的差异。不同小写字母表示差异显著(P<0.05)。
Figure 2. Logarithmic transformed abundance of functional genes
Number before first "/" indicates count of non-zero values, while letter, significant difference between treatments; letter between two "/" indicates difference between rhizosphere and bulk soil; and letter after second "/"indicates difference between sampling times. Data with different lowercase letters indicate significant differences at P<0.05.
表 1 真菌属水平α-多样性
Table 1 α-diversity of fungi at family level
土壤类型和时间
Soil types and time处理
TreatmentSobs Shannon Simpson ACE Chao1 T1 211.8±65.4a/a/a 3.241±0.083b/a/b 0.083±0.007a/a/A 222.6±72.9a/a/a 223.5±73.3a/a/a R77d T2 227.5±28.8a/a/a 3.562±0.205a/a/a 0.059±0.016b/a/a 232.4±31.4a/a/a 234.6±33.7a/a/a T3 239.3±29.8a/a/a 3.584±0.115a/a/a 0.057±0.009b/a/a 245.1±32.5a/a/a 249.0±34.3a/a/a T1 197.5±28.5a/a/a 3.528±0.188a/a/a 0.057±0.012a/b/a 203.5±33.9a/a/a 207.7±39.8a/a/a N77d T2 188.5±26.8a/a/a 3.559±0.131a/a/a 0.055±0.009a/a/a 191.8±27.9a/a/a 193.4±29.7a/a/a T3 206.3±18.1a/a/a 3.491±0.079a/a/a 0.066±0.016a/a/a 209.8±20.4a/a/a 211.3±19.5a/a/a T1 249.8±29.1a/a/a 3.604±0.213a/a/a 0.051±0.008a/a/B 257.9±32.3a/a/a 259.4±32.7a/a/a R104d T2 232.5±21.4a/A/a 3.412±0.217a/a/b 0.068±0.018a/a/a 241.1±23.3a/A/a 242.8±23.1a/A/a T3 254.5±39.7a/a/a 3.439±0.264a/a/a 0.084±0.058a/a/a 265.0±43.4a/a/a 265.7±44.1a/a/a T1 204.5±27.1a/b/a 3.516±0.102a/a/a 0.060±0.005a/a/a 207.5±28.3a/b/a 208.1±28.4a/b/a N104d T2 189.5±33.7a/B/a 3.141±0.619a/a/a 0.121±0.117a/a/a 195.3±35.9a/B/a 195.1±36.5a/B/a T3 192.8±28.2a/a/a 3.343±0.265a/a/a 0.073±0.020a/a/a 195.6±29.1a/a/a 196.6±29.9a/a/a T1 223.8±25.6a/a/a 3.258±0.464a/a/ab 0.110±0.067a/a/AB 236.6±32.7a/a/a 237.1±32.6a/a/a R134d T2 219.0±34.9a/a/a 3.392±0.353a/a/ab 0.069±0.027a/a/a 231.2±41.4a/a/a 237.5±46.8a/a/a T3 249.5±19.8a/a/a 3.491±0.167a/a/a 0.062±0.016a/a/a 264.7±25.8a/a/a 272.0±28.1a/a/a T1 204.8±28.1a/a/a 2.811±0.883a/a/a 0.193±0.227a/a/a 218.6±24.4a/a/a 220.0±21.4a/a/a N134d T2 180.8±32.3a/a/a 3.391±0.178a/a/a 0.065±0.014a/a/a 184.0±33.8a/a/a 184.9±34.1a/a/a T3 202.8±26.4a/b/a 3.441±0.303a/a/a 0.065±0.031a/a/a 206.8±28.4a/b/a 208.5±29.2a/b/a ①R表示根际土壤,N表示非根际土壤。R77d和N77d分别表示植后77 d的根际土壤和植后77 d的非根际土壤。②“//”及其前后的字母含义与图1相同。
①R: rhizosphere soil; N: bulk soil. R77d and N77d: rhizosphere soil and bulk soil on 77 DAP, respectively. ② Letters mean as Fig. 1.表 2 土壤真菌LEfSe分析信息
Table 2 LEfSe analysis information of soil fungi
处理对及优势处理
The treatments for comparison
and the advantageous one生物标记物
Biomarker处理对及优势处理
The treatments for comparison
and the advantageous one生物标记物
Biomarker77 d
T1R-T2R-T3Rf_Sordariales_fam_Incertae_sedis, g_Ramophialophora, s_Ramophialophora_sp. 104 d
T2-T2Rg_Cephalotrichum, s_unclassified_g_Cephalotrichum 104 d
T1R-T2R-T3Rf_Bionectriaceae, g_Clonostachys, s_Clonostachys_sp.; o_Chaetosphaeriales, f_Chaetosphaeriaceae, g_Codinaea, s_unclassfied_g_Codinaea 134 d
T2-T2RAscomycota, c_Eurotiomycetes; o_Microascales, f_Microascaceae, g_Cephalotrichum, s_unclassified_g_cephalotrichum 134 d
T1R-T2R-T3Rc_Eurotiomycetes, o_Microascales, f_Microascaceae 134 d
T3-T3Rg_Fusarium, s_unclassified_g_Fusarium; f_Bionectraceae g_Clonostachys, s_Clonostachys_sp. 77 d
T1-T1Rs_Clonostachys_sp. 104 d
T3-T3Rf_Stachybotryaceae 77 d
T2R-T2s_Chaetomium_sp. T1R
77d-104d-134do_Branch06, f_unclassified_o_Branch06, g_unclassified_o_branch06, s_Branch06_sp.; o_Capnodiales, f_Mycosphaerellaceae 104 d
T1-T1Ro_Branch06, f_unclassified_o_Branch06, g_unclassified_o_branch06, s_Branch06_sp.; o_Capnodiales; o_Chaetosphaeriales, f_Chaetosphaeriaceae, g_Codinaea, s_unclassified_g_Codinaea T2R
77d-104d-134dc_Eurotiomycetes ①T1R-T2R-T3R单元格内的上下两行分别表示共同和异同的处理,如77d T1R-T2R-T3R表示77d的T1、T2、T3根际比较,且粗体加下划线格式表示右侧列出的真菌门类为该处理的Biomarker。R表示根际土。②真菌门类名称前的c_表示纲(class),o_表示目(order),f_表示科(family),g_表示属(genus),s_表示种(species),不标记表示门水平;“,”表示后者包含于前者的门类,“;”表示后者与前者不属于同一门类。
(1) Upper and lower rows in cells of same type represent common and different treatments, respectively. For example, 77d T1R-T2R-T3R is comparison of rhizosphere soils under T1, T2, and T3 on 77 DAP. Name with underlined bold fonts indicates fungal phyla listed on the right to be biomarker of treatment, and R, rhizosphere soil. (2) Before a fungus name, c_ represents at class level, o_, order, f_, family, g_, genus, s_, species, and unmarked, phylum. "," indicates two in same phylum; and ";" two are in different phyla. -
[1] FENG S, FU D D, HAN X R, et al. Impacts of the extension of cassava soil conservation and efficient technology on the reduction of chemical fertilizer input in China [J]. Sustainability, 2022, 14(22): 15052. DOI: 10.3390/su142215052
[2] 韦云东, 周时艺, 陈蕊蕊, 等. 木薯缓释肥和地膜/地布覆盖对木薯生长的影响 [J]. 中国农学通报, 2023, 39(22):16−22. DOI: 10.11924/j.issn.1000-6850.casb2022-0681 WEI Y D, ZHOU S Y, CHEN R R, et al. Effects of slow-release fertilizer application and film mulching on growth of cassava [J]. Chinese Agricultural Science Bulletin, 2023, 39(22): 16−22. (in Chinese) DOI: 10.11924/j.issn.1000-6850.casb2022-0681
[3] 柳玲玲, 顾小凤, 魏全全, 等. 生物有机肥配施缓释肥对连作马铃薯提质增产效果研究 [J]. 安徽农业科学, 2023, 51(17):129−131. DOI: 10.3969/j.issn.0517-6611.2023.17.028 LIU L L, GU X F, WEI Q Q, et al. Study on the effect of biological organic fertilizer with slow release fertilizer on the quality improvement of continuous potato [J]. Journal of Anhui Agricultural Sciences, 2023, 51(17): 129−131. (in Chinese) DOI: 10.3969/j.issn.0517-6611.2023.17.028
[4] REN T T, YU X Y, LIAO J H, et al. Application of biogas slurry rather than biochar increases soil microbial functional gene signal intensity and diversity in a poplar plantation [J]. Soil Biology and Biochemistry, 2020, 146: 107825. DOI: 10.1016/j.soilbio.2020.107825
[5] LI S, LIANG H, WANG Y, et al. Responses of functional genes involved in nitrogen cycling to green manuring in different paddy soils in South China [J]. Plant and Soil, 2022, 478(1): 519−532.
[6] 周时艺, 韦云东, 陈蕊蕊, 等. 不同缓释肥对木薯生长和土壤速效养分的影响 [J]. 江西农业学报, 2022, 34(4):100−104. ZHOU S Y, WEI Y D, CHEN R R, et al. Effects of different slow-release fertilizers on cassava growth and soil available nutrients [J]. Acta Agriculturae Jiangxi, 2022, 34(4): 100−104. (in Chinese)
[7] 周时艺, 韦云东, 陈蕊蕊, 等. 缓释肥不同施用深度对木薯生长的影响 [J]. 湖南农业大学学报(自然科学版), 2023, 49(2):140−144. ZHOU S Y, WEI Y D, CHEN R R, et al. Effects of fertilization depth of slow-release fertilizer on cassava growth [J]. Journal of Hunan Agricultural University (Natural Sciences), 2023, 49(2): 140−144. (in Chinese)
[8] 覃锋燕, 杨慰贤, 彭晓辉, 等. 粉垄耕作木薯根际与非根际土壤的细菌群落结构多样性差异 [J]. 西南农业学报, 2022, 35(4):729−739. QIN F Y, YANG W X, PENG X H, et al. Difference in the diversity of bacterial community structure in rhizosphere and non-rhizosphere soil of cassava in Fenlong tillage [J]. Southwest China Journal of Agricultural Sciences, 2022, 35(4): 729−739. (in Chinese)
[9] 蔡杰, 张洁, 喻珊, 等. 施肥方式对木薯根际土壤细菌多样性与群落结构特征的影响 [J]. 福建农林大学学报(自然科学版), 2022, 51(1):15−20. CAI J, ZHANG J, YU S, et al. Effect of fertilization on bacterial diversity and community structure characteristics in cassava rhizospheric soil [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2022, 51(1): 15−20. (in Chinese)
[10] 韦云东, 罗燕春, 郑华, 等. 根袋法获取木薯根际土壤及其细菌群落特征研究 [J]. 热带作物学报, 2020, 41(9):1928−1938. DOI: 10.3969/j.issn.1000-2561.2020.09.029 WEI Y D, LUO Y C, ZHENG H, et al. Cassava rhizosphere soil collected by “root bag” method and its bacteria diversity [J]. Chinese Journal of Tropical Crops, 2020, 41(9): 1928−1938. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2020.09.029
[11] LI L W, SHEN Z Y, QIN F Y, et al. Effects of tillage and N applications on the cassava rhizosphere fungal communities [J]. Agronomy, 2023, 13(1): 237. DOI: 10.3390/agronomy13010237
[12] CAI J, ZHANG J, DING Y, et al. Different fertilizers applied alter fungal community structure in rhizospheric soil of cassava (Manihot esculenta crantz) and increase crop yield [J]. Frontiers in Microbiology, 2021, 12: 663781. DOI: 10.3389/fmicb.2021.663781
[13] 韦云东, 罗燕春, 郑华, 等. 基于高通量测序的木薯根域土壤微生物群落结构研究 [J]. 农业研究与应用, 2021, 34(1):1−14. DOI: 10.3969/j.issn.2095-0764.2021.01.001 WEI Y D, LUO Y C, ZHENG H, et al. Study on soil microbial community structure in cassava rhizosphere by high-throughput sequencing techniques [J]. Agricultural Research and Application, 2021, 34(1): 1−14. (in Chinese) DOI: 10.3969/j.issn.2095-0764.2021.01.001
[14] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000. BAO S D. Soil agrochemical analysis (third edition) [M].Beijing: China Agriculture Press, 2000. (in Chinese)
[15] YANG W, ZHANG D, CAI X W, et al. Significant alterations in soil fungal communities along a chronosequence of Spartina alterniflora invasion in a Chinese Yellow Sea coastal wetland [J]. Science of the Total Environment, 2019, 693: 133548. DOI: 10.1016/j.scitotenv.2019.07.354
[16] 张洁洁, Anders Priemé, 陈显轲, 等. 基于QMEC分析的青藏高原不同类型冰川前缘地土壤微生物功能潜力 [J]. 环境科学, 2023, 44(1):512−519. ZHANG J J, PRIEMÉ A, CHEN X K, et al. QMEC-based analysis of the soil microbial functional potentials across different Tibetan Plateau glacier forelands [J]. Environmental Science, 2023, 44(1): 512−519. (in Chinese)
[17] ZHENG B X, ZHU Y G, SARDANS J, et al. QMEC: A tool for high-throughput quantitative assessment of microbial functional potential in C, N, P, and S biogeochemical cycling [J]. Science China Life Sciences, 2018, 61(12): 1451−1462. DOI: 10.1007/s11427-018-9364-7
[18] LI H Z, BI Q F, YANG K, et al. High starter phosphorus fertilization facilitates soil phosphorus turnover by promoting microbial functional interaction in an arable soil [J]. Journal of Environmental Sciences, 2020, 94: 179−185. DOI: 10.1016/j.jes.2020.03.040
[19] ZHANG Y X, LI X, XIAO M, et al. Effects of microplastics on soil carbon dioxide emissions and the microbial functional genes involved in organic carbon decomposition in agricultural soil[J]. Science of the Total Environment, 2022, 806(Pt 3): 150714.
[20] 白小龙, 张恩, 武晋民, 等. 不同改良物料对盐碱土壤真菌群落结构的影响 [J]. 环境科学, 2024, 45(6):3562−3570. BAI X L, ZHANG E, WU J M, et al. Effects of different modified materials on soil fungal community structure in SalineAlkali soil [J]. Environmental Science, 2024, 45(6): 3562−3570. (in Chinese)
[21] AL-SADI A M, AL-MAZROUI S S, PHILLIPS A J L. Evaluation of culture-based techniques and 454 pyrosequencing for the analysis of fungal diversity in potting media and organic fertilizers [J]. Journal of Applied Microbiology, 2015, 119(2): 500−509. DOI: 10.1111/jam.12854
[22] CHALLACOMBE J F, HESSE C N, BRAMER L M, et al. Genomes and secretomes of Ascomycota fungi reveal diverse functions in plant biomass decomposition and pathogenesis [J]. BMC Genomics, 2019, 20(1): 976. DOI: 10.1186/s12864-019-6358-x
[23] 刘子凡, 刘培培, 闫文静, 等. 间作木薯对橡胶树根际土壤真菌群落结构的影响 [J]. 热带作物学报, 2020, 41(3):609−614. DOI: 10.3969/j.issn.1000-2561.2020.03.026 LIU Z F, LIU P P, YAN W J, et al. Effects of rubber-cassava intercropping on soil fungal community structure in rhizosphere of rubber trees [J]. Chinese Journal of Tropical Crops, 2020, 41(3): 609−614. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2020.03.026
[24] 姚丽娟, 田春丽, 王立河, 等. 设施西瓜连作土壤生化性质及微生物群落变化 [J]. 中国土壤与肥料, 2024, (3):70−78. DOI: 10.11838/sfsc.1673-6257.23205 YAO L J, TIAN C L, WANG L H, et al. Changes of soil biochemical properties and microbial community in continuous cropping of watermelon under greenhouse cultivation [J]. Soil and Fertilizer Sciences in China, 2024(3): 70−78. (in Chinese) DOI: 10.11838/sfsc.1673-6257.23205
[25] 常芳娟, 张贵云, 张丽萍, 等. 生物炭对西瓜连作土壤真菌群落结构和功能类群的影响 [J]. 环境科学, 2024, 45(6):3553−3561. CHANG F J, ZHANG G Y, ZHANG L P, et al. Effects of biochar application on the structure and function of fungal community in continuous cropping watermelon soil [J]. Environmental Science, 2024, 45(6): 3553−3561. (in Chinese)
[26] GOULD A B. Fungi: plant pathogenic[M]//Encyclopedia of Microbiology. Amsterdam: Elsevier, 2009: 457-477.
[27] PLASSARD C, LOUCHE J, ALI M A, et al. Diversity in phosphorus mobilisation and uptake in ectomycorrhizal fungi [J]. Annals of Forest Science, 2011, 68(1): 33−43. DOI: 10.1007/s13595-010-0005-7
[28] LIANG J L, LIU J, JIA P, et al. Novel phosphate-solubilizing bacteria enhance soil phosphorus cycling following ecological restoration of land degraded by mining [J]. The ISME Journal, 2020, 14(6): 1600−1613. DOI: 10.1038/s41396-020-0632-4
[29] ZHOU J, GUAN D W, ZHOU B K, et al. Influence of 34-years of fertilization on bacterial communities in an intensively cultivated black soil in Northeast China [J]. Soil Biology and Biochemistry, 2015, 90: 42−51. DOI: 10.1016/j.soilbio.2015.07.005
[30] 陈晨, 许欣, 毕智超, 等. 生物炭和有机肥对菜地土壤N2O排放及硝化、反硝化微生物功能基因丰度的影响 [J]. 环境科学学报, 2017, 37(5):1912−1920. CHEN C, XU X, BI Z C, et al. Effects of biochar and organic manure on N2O emissions and the functional gene abundance of nitrification and denitrification microbes under intensive vegetable production [J]. Acta Scientiae Circumstantiae, 2017, 37(5): 1912−1920. (in Chinese)
[31] WAKELIN S A , COLLOFF M J , HARVEY P R , et al. The effects of stubble retention and nitrogen application on soil microbial community structure and functional gene abundance under irrigated maize[J]. Fems Microbiology Ecology, 2010(3): 661-670. DOI: 10.1111/j.1574-6941.2006.00235.x.
[32] 钱佳彤. 不同轮作与施肥方式下土壤固碳特征及碳氮转化研究[D]. 重庆: 西南大学, 2021. QIAN J T. Study on soil carbon fixation characteristics and carbon and nitrogen transformation under different rotation and fertilization [D]. Chongqing: Southwest University, 2021. (in Chinese)
[33] 裴理鑫. 黄渤海滨海湿地土壤微生物群落结构对碳循环的影响及其对增温响应[D]. 武汉: 中国地质大学, 2021. PEI L X. Effects of soil microbial community on carbon cycle and its response to warming in coastal wetlands of the Yellow-Bohai Sea [D]. Wuhan: China University of Geosciences, 2021. (in Chinese)
[34] BASTIDA F, TORRES I F, MORENO J L, et al. The active microbial diversity drives ecosystem multifunctionality and is physiologically related to carbon availability in Mediterranean semi-arid soils [J]. Molecular Ecology, 2016, 25(18): 4660−4673. DOI: 10.1111/mec.13783
[35] YELLE D J, RALPH J, LU F C, et al. Evidence for cleavage of lignin by a brown rot basidiomycete [J]. Environmental Microbiology, 2008, 10(7): 1844−1849. DOI: 10.1111/j.1462-2920.2008.01605.x
[36] LI Y C, LI Y F, CHANG S X, et al. Bamboo invasion of broadleaf forests altered soil fungal community closely linked to changes in soil organic C chemical composition and mineral N production [J]. Plant and Soil, 2017, 418(1): 507−521.
[37] YANG W H, LI C J, WANG S S, et al. Influence of biochar and biochar-based fertilizer on yield, quality of tea and microbial community in an acid tea orchard soil [J]. Applied Soil Ecology, 2021, 166: 104005. DOI: 10.1016/j.apsoil.2021.104005
[38] 李航, 苏梦迪, 黄浪平, 等. 氮磷钾配施对植烟土壤速效养分和真菌多样性的影响 [J]. 作物杂志, 2023, (3):238−245. LI H, SU M D, HUANG L P, et al. Effects of nitrogen, phosphorus and potassium application on available nutrients and fungal diversity in tobacco-growing soil [J]. Crops, 2023(3): 238−245. (in Chinese)
[39] 李鹏, 颜培栋, 杨章旗, 等. 施肥对马尾松中龄林生长、产脂量和土壤养分的短期影响 [J]. 广西科学, 2023, 30(2):239−250. LI P, YAN P D, YANG Z Q, et al. Short-term effects of fertilization on the growth, resin yield and soil nutrient characteristics of middle-aged Pinus massoniana plantation [J]. Guangxi Sciences, 2023, 30(2): 239−250. (in Chinese)





 下载:
下载: