Changes in Morphological Characteristics and Endogenous Hormone Content during Flower Bud Differentiation in Bombax ceiba
-
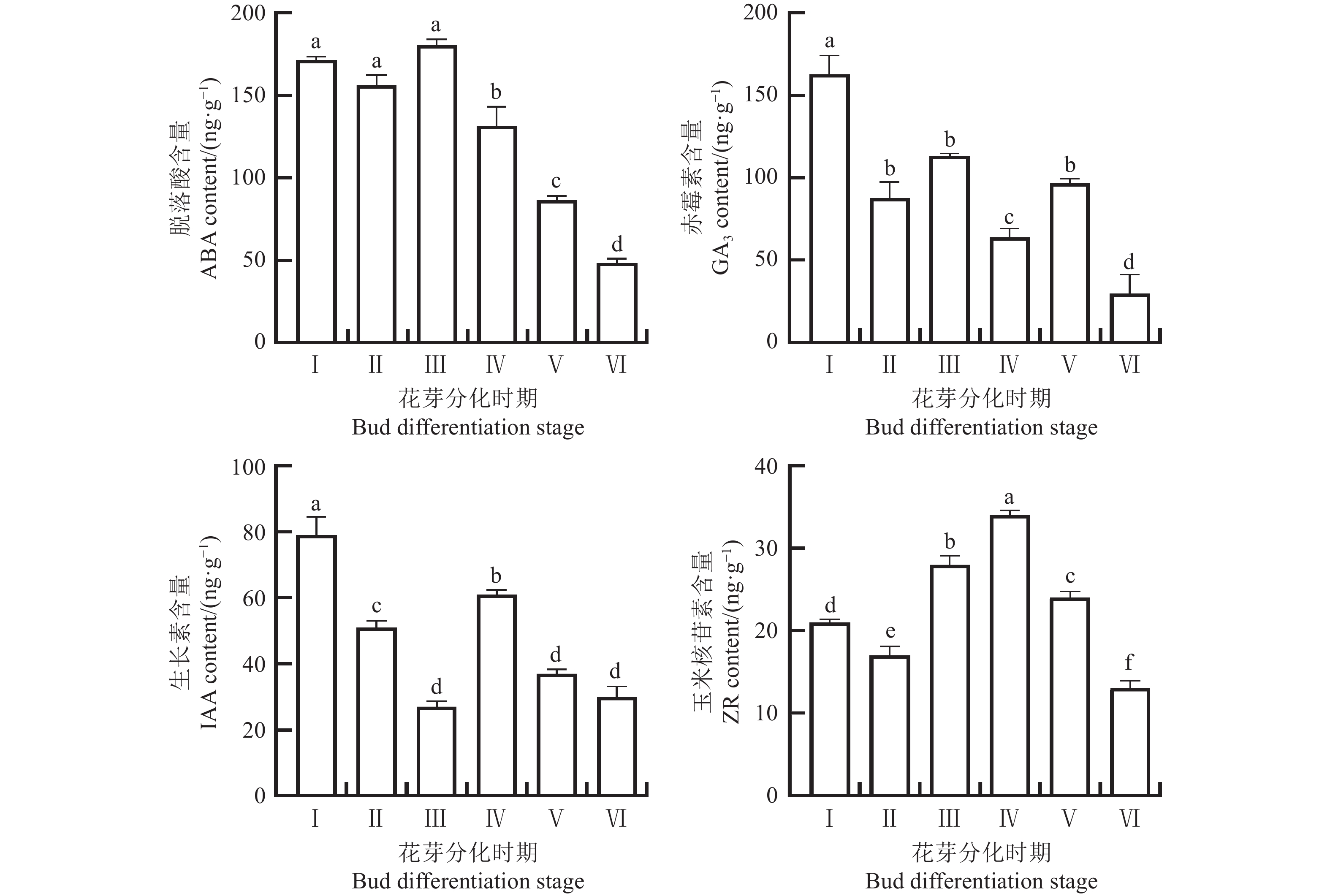
摘要:目的 木棉(Bombax ceiba)在我国华南地区被广泛应用于园林绿化,其果期飘絮会引发呼吸系统疾病、交通事故等各种问题。探究木棉花芽分化过程中的结构特征变化及主要内源激素含量变化,为利用植物生长调节剂调控其开花从而治理飞絮提供理论基础。方法 以不同时期的木棉花芽为试材,通过石蜡切片观察分化过程中的花芽形态变化,并测定花芽内源激素脱落酸(Abscisci acid, ABA)、赤霉素(Gibberellin acid, GA3)、生长素(Indoleacetic acid, IAA)、玉米核苷素(trans-zeatin riboside, ZR)的含量。结果 木棉花芽分化过程分为前分化期、花原基分化期、萼片原基分化期、花瓣原基分化期、雌雄蕊原基分化期和雌雄蕊形成期。10月上旬可检测到花原基分化,10月中旬萼片原基分化出现,花瓣原基分化在10月下旬,雌雄蕊原基分化及雌雄蕊形成分别可于11月中上旬和11月下旬检测到。木棉花芽分化过程中,ABA和GA3的含量显著高于IAA和ZR的含量,其中ABA和GA3含量整体呈下降趋势,IAA含量先下降后上升再下降,ZR含量先上升后下降;ZR/GA3、(ZR+IAA)/GA3比值整体呈上升趋势,GA3/IAA比值整体呈下降趋势,ZR/IAA比值在花芽分化过程中先上升后下降,ABA/GA3比值呈现“上升-下降-上升”的变化趋势,(GA3+ZR+IAA)/ABA比值在花芽分化过程中表现为前期下降后回升,然后再下降。结论 木棉花芽分化过程根据其形态结构可划分为六个阶段,在此过程中ABA和GA3含量远高于ZR和IAA的含量,且含量变化与花芽分化过程呈现显著负相关。因此,在花芽分化前期提高GA3水平,或花瓣原基分化期提高ABA水平可能可以起到抑制花芽分化的作用,并减轻因大量飞絮导致的过敏和交通干扰等困扰。Abstract:Objective Morphology and endogenous hormones of Bombax ceiba flower buds in differentiation were studied to aid the control of fallen debris at fruiting stage of the popular landscape plant in southern China.Methods Morphology of the flower buds of B. ceiba at differentiation phases were observed with the paraffin sections under a microscope and contents of endogenous GA3, IAA, ABA, and ZR determined.Results The flower bud development was classified in the phases of pre-differentiation, primordium differentiation, sepal primordium differentiation, petal primordium differentiation, stamen and pistil primordium differentiation, and stamen and pistil formation. The flower primordium differentiated in early October, while the sepal primordium did in mid-October, the petal primordium in late October, the female and stamen primordium in mid-early November, and the female and stamen formed in late November. During differentiation, GA3 and ABA in the buds were significantly higher than IAA and ZR. They generally decreased, but IAA declined at first, followed by an increase and another decline, whereas ZR rose initially and fell subsequently. The ratios of ZR/GA3 and (ZR+IAA)/GA3 were on an increasing trend, GA3/IAA decreasing, ZR/IAA and ABA/IAA rising at first followed by declining, ABA/GA3 rising-falling-rising, and (GA3+ZR+IAA)/ABA falling-rising-falling as the differentiation progressed.Conclusion The process of B. ceiba bud differentiation can be divided into six stages based on its morphological structure, in which the contents of ABA and GA3 are much higher than those of ZR and IAA , and the changes in the contents showed a significant negative correlation with the bud differentiation process. Consequently, applying either GA3 on the plant prior to the process begins or ABA at the petal primordial differentiation phase could deter the floral development and mitigate the nuisance of causing human allergy and traffic interference due to the massive tree falloffs.
-
Keywords:
- Bombax ceiba /
- flower bud differentiation /
- morphology /
- endogenous hormone
-
0. 引 言
【研究意义】荷叶离褶伞(Lyophyllum decastes,Lyd),又称鹿茸菇,属于离褶伞科(Lyophyllaceae),离褶伞属(Lyophyllum,Ly),是一种木腐型珍贵食药用真菌[1-2]。荷叶离褶伞子实体分叉成丛生的细枝,菌盖外观似鹿茸切片[3],广泛分布于北半球温带的山区和丛林之中[2, 4]。荷叶离褶伞口感丝滑爽脆,子实体脂肪含量低,粗纤维成分高,富含人体所需的氨基酸和微量元素[2]。荷叶离褶伞子实体含有粗蛋白22.16%,粗脂肪2.69%,多糖44.29%,粗纤维8.66%,属于高蛋白低脂肪的食用菌[5]。荷叶离褶伞富含的致密型膳食纤维可改善人体肠道的消化能力[6-7],是近年来新兴的工厂化栽培药食兼用菌品种[8-10],且在我国已实现工厂化栽培[2]。当前荷叶离褶伞工厂化栽培仍存在着发菌较慢、成活较迟、易发生有害菌污染等问题[4],获得荷叶离褶伞优良品种是栽培成功的关键[11-13]。筛选出菌种纯度高、菌丝遗传性状稳定、生长活力强和普通培养基易于栽培的品种是当下荷叶离褶伞菌株市场化规模化袋式栽培生产的关键。将本地区与其他地区引进的荷叶离褶伞菌株进行基因组序列突变比对和菌丝形态分析研究,对丰富本地区荷叶离褶伞种质资源有重要意义。【前人研究进展】在自然环境下荷叶离褶伞自身能产生基因组序列突变,且在漫长的进化过程中逐渐累积突变,形成子实体和菌丝形态差异明显的菌株[1]。不同地区的地理气候环境差异较大,对自然突变的荷叶离褶伞有着不同的筛选机制,形成地区之间基因组序列差异较大的菌株,突出表现为菌丝生长和形态的多样性和差异性。荷叶离褶伞子实体由组织化的菌丝体构成,菌丝稳定的生长速度决定子实体的大小[2]。菌丝的生长活力和遗传性状以及将优良性状稳定遗传到子代受其基因序列控制,而基因序列的突变是产生菌丝形态差异的根本原因[4,6]。通过基因序列差异性获得菌丝形态遗传稳定的荷叶离褶伞菌株,能克服由外界不利环境胁迫造成菌丝变异生长的假阳性现象,加快获得菌丝形态优良的菌株。【本研究切入点】 传统分类方法通过子实体生长和菌丝形态对不同地区来源的荷叶离褶伞菌株进行筛选和建立菌种资源库,不但进度慢且无法明确菌丝变异的原因。鉴定到基因组序列碱基突变且变异菌丝稳定遗传是有效增加荷叶离褶伞菌株资源库的关键,而采取真菌18S rRNA(V4)和ITS(ITS1~ITS4)序列结合菌丝形态对不同地区的荷叶离褶伞进行鉴定尚无相关报道。【拟解决的关键问题】通过比较从上海、云南和吉林等地引进的荷叶离褶伞与福建本地栽培的荷叶离褶伞之间基因序列和菌丝生长的差异性,获得基因序列变异大且菌丝形态稳定遗传的荷叶离褶伞,为选育菌丝生长较快且适合工厂袋式栽培的荷叶离褶伞菌株提供参考。
1. 材料与方法
1.1 试验材料
荷叶离褶伞菌株包括从云南、吉林和上海等地引进的Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17,福建省本地工厂化栽培菌株Lyd-LRX和Lyd-LRY。
1.2 试验方法
1.2.1 荷叶离褶伞的纯化培养及电镜观察
荷叶离褶伞菌株均在实验室进行多次菌丝分离和继代培养。挑取荷叶离褶伞菌丝在PDA固体培养基上连续继代培养5次,获得纯化的菌丝体用于后续的菌丝生长试验。将相同量的菌丝块(直径<5 mm)接种至PDA固体培养基上暗培养10 d 和20 d(温度恒定在30 ℃,每个菌株5次重复),用化学方法制备扫描电镜观察样品,对荷叶离褶伞菌丝的生长情况和形态特征进行观察拍照。
1.2.2 荷叶离褶伞基因组DNA的提取
挑选荷叶离褶伞菌丝体(新鲜菌丝1 g左右)到研钵,加入液氮充分碾磨破碎,选取部分粉末转入2 mL离心管中,按照真菌基因组DNA提取试剂盒步骤提取荷叶离褶伞菌丝体DNA。提取的基因组DNA 经 1.20%琼脂糖凝胶电泳检测,确定荷叶离褶伞菌丝体DNA的完整性。
1.2.3 18S rRNA和ITS区段序列的PCR扩增和测序
配制Phanta Max Super-Fidelity DNA Polymerase(诺唯赞Vazyme Biotech, Co., Ltd#P505-d1, 中国)PCR反应试剂。PCR 反应体系(50 μL): 2×Phanta Max Buffer 25 μL, dNTPs 1 μL,引物(10 μmol·L−1)各 2 μL,DNA Polymerase 1 μL, DNA 模板1 μL (<50 ng), ddH2O 18 μL。PCR反应条件:95 °C变性 3 min;95 °C 变性15 s,55 °C 退火15 s,72 °C 延伸1 min,35 个循环;72 °C 总延伸5 min。对18S rRNA的V4变量区(623~853)和ITS1~ITS4区段分别进行PCR扩增。18S rRNA的引物序列为18S_3NDF(正向引物序列):5′ -GGCAAGTCTGGTGCCAG-3′;18S_V4_euk_R2(反向引物序列): 5′-ACGGTATCT(AG)ATC(AG)TCTTCG-3′。ITS区段引物序列为ITS1(正向引物序列): 5′-TCCGTAGGTGAACCTGCGG-3′;ITS4(反向引物序列): 5′-TCCTCCGCTTATTGATATGC-3′。引物由上海生工生物工程有限公司合成。采用PCR仪Eppendorf 5331(德国eppendorf公司)进行PCR扩增,PCR产物用1%琼脂糖凝胶电泳检测,确定PCR产物的大小和特异性。PCR产物使用通用型DNA纯化回收试剂盒进行回收(TIANGEN DP214,天根生化科技有限公司,中国)。纯化的PCR产物送北京擎科生物科技有限公司进行测序分析。
1.2.4 18S rRNA和ITS序列的同源性比对
测序获得荷叶离褶伞18S rRNA的V4区序列和ITS的ITS1~ITS4区序列,去除杂峰序列后,登录NCBI Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)并选用Nucleotide BLAST进行核酸序列同源性比对,同时在NCBI GenBank获得同源性较高(>90%)的部分荷叶离褶伞菌株序列编号(Accession)及其序列信息,使用生物软件DNAMAN 9进行多重序列比对。
1.2.5 构建系统发育进化树
采用MEGA 7.0.26(MolecularEvolutionary Genetics Analysis,http://www.megasoftware.net/)软件分别对18S rRNA(V4)和ITS(ITS1~ITS4)序列同源性较高的荷叶离褶伞序列构建系统进化树。用 ClustalW 进行多序列匹配比对,重复数(Bootstrap)为1000,以Neighbor-Joining(NJ)法构建系统发育进化树。
2. 结果与分析
2.1 荷叶离褶伞菌株18S rRNA-ITS同源性分析和多重序列比对
18S rRNA(V4)序列的NCBI Blast比对结果显示,外地离褶伞菌株(Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17)、福建本地离褶伞菌株(Lyd-LRX和Lyd-LRY)与NCBI登录的荷叶离褶伞菌株(Lyd-PBM3069和Lyd-JM87/16)序列同源性为97.55%~98.88%(表1);与NCBI登录的离褶伞属菌株Ly-shimeji(D84555.1)、Ly-sp. MSG166、Ly-sp. PBM 2688、Ly-praslinense 10295、Ly-leucophaeatum HAe251和Ly-shimeji(D84553.1)的序列同源性为94.21%~100%。序列同源性均大于94%,确定试验菌株Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17菌株为荷叶离褶伞。
表 1 荷叶离褶伞菌株的18S rRNA(V4)序列同源性分析Table 1. Homology of 18S rRNA (V4) sequences in Lyd strains(单位:%) 菌株 Strain Lyd-LR1 Lyd-LR6 Lyd-LR10 Lyd-LR15 Lyd-LR17 Lyd-LRX Lyd-LRY Lyd-PBM3069 98.45 98.22 98.88 99.11 98.48 98.66 98.21 Lyd-JM87/16 98.23 97.55 98.66 98.44 97.83 97.99 97.54 Ly-shimeji(D84555.1) 97.96 97.90 98.59 98.83 97.95 98.13 97.90 Ly-sp. MSG166 96.69 96.44 97.10 97.32 96.96 96.88 96.64 Ly-sp. PBM 2688 96.47 96.21 96.88 97.10 96.75 96.65 96.42 Ly-praslinense 10295 94.92 94.65 95.31 95.54 95.23 95.09 94.85 Ly-leucophaeatum HAe251 94.48 94.21 94.87 95.09 94.79 94.64 94.41 Ly-shimeji(D84553.1) 100.00 93.44 98.36 98.36 100.00 95.08 93.22 根据18S rRNA多重序列比对结果(图1),与NCBI登录菌株Lyd-PBM3069和Lyd-JM87/16相比较,外地荷叶离褶伞菌株Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17以及福建本地荷叶离褶伞菌株Lyd-LRX和Lyd-LRY均发生4处碱基替换以及1处碱基缺失。与本地荷叶离褶伞菌株Lyd-LRX和Lyd-LRY相比较,外地荷叶离褶伞菌株Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17部分发生3处碱基缺失/插入突变。外地荷叶离褶伞菌株Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17在真菌非常保守的18S rRNA(V4)序列发生碱基替换和碱基缺失的多处突变,需继续以碱基突变概率较高的ITS(ITS1-ITS4)序列进一步分析外地荷叶离褶伞菌株的基因序列差异性。
ITS(ITS1-ITS4)序列NCBI Blast比对结果显示,与Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌株序列均高度同源(>80%)的荷叶离褶伞菌株达到45个,但序列同源性下降至80.09%~90.33%(表2),提示菌株的ITS(ITS1–ITS4)序列已发生较高比例的碱基突变。根据ITS(ITS1–ITS4)多重序列比对结果,与NCBI登录菌株Lyd-Ld418和Lyd-ywy1相比较,Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌株均发生基本相同的7处碱基替换、1处碱基缺失以及1处碱基插入。与本地荷叶离褶伞菌株Lyd-LRX和Lyd-LRY相比较,外地荷叶离褶伞菌株Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17菌株均发生相同的5处碱基替换以及1处碱基插入。与其他荷叶离褶伞菌株相比较, Lyd-LR1、Lyd-LR6菌株发生更高的碱基突变(图2)。与NCBI登录荷叶离褶伞菌株相比,外地荷叶离褶伞菌株和福建本地荷叶离褶伞菌株的ITS(ITS1–ITS4)序列均发生较高比例的碱基替换和碱基缺失,且外地荷叶离褶伞菌株Lyd-LR1和Lyd-LR6的碱基突变明显高于其他荷叶离褶伞菌株,而Lyd-LR6菌株ITS(ITS1–ITS4)序列发生碱基替换和碱基缺失的突变比例高于Lyd-LR1菌株。
表 2 荷叶离褶伞菌株的ITS(ITS1–ITS4)序列同源性分析Table 2. Homology of ITS (ITS1–ITS4) sequences in Lyd strains(单位:%) 菌株
StrainLyd-LR1 Lyd-LR6 Lyd-LR10 Lyd-LR15 Lyd-LR17 Lyd-LRX Lyd-LRY Lyd-dcy2255 89.72 83.52 90.33 84.64 89.38 86.52 82.92 Lyd-ywy1 89.42 82.76 90.05 84.33 89.06 86.06 82.49 Lyd-Ld418 89.27 82.92 89.94 84.45 89.24 85.67 82.58 Lyd-060926 89.30 82.82 90.08 84.07 88.79 85.80 82.24 Lyd-060801 89.15 82.66 89.94 83.94 88.61 85.91 82.06 Lyd-061011 88.98 82.35 89.77 83.33 88.02 85.76 81.65 Lyd-iNAT 88.34 82.37 88.99 83.26 87.95 85.23 81.26 Lyd-22/14DMRJU 88.69 81.74 88.98 83.14 88.69 85.60 80.09 2.2 荷叶离褶伞菌株的18S rRNA-ITS系统发育进化树分析
为明确外地荷叶离褶伞菌株和福建本地荷叶离褶伞菌株之间的进化关系,同时根据NCBI Blast提供的同源性分析结果,选取部分NCBI登录的荷叶离褶伞、离褶伞属菌株和其食用菌[18S rRNA(V4)同源性>80%]进行系统发育进化树分析。18S rRNA(V4区)序列的进化树分析结果显示,外地荷叶离褶伞菌株(Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17)聚为一类,再与福建本地荷叶离褶伞菌株(Lyd-LRX和Lyd-LRY)聚为一类,最后与NCBI登录的荷叶离褶伞菌株(Lyophyllum decastes PBM3069和Lyophyllum decastes JM87/16)聚合(图3),但均不与NCBI登录的其他食用菌进行聚合,说明外地荷叶离褶伞菌株在遗传距离上有着近似的亲缘关系,但与福建本地荷叶离褶伞已存在遗传进化上的差别,而与NCBI登录的荷叶离褶伞和其他食用菌有较远的遗传距离和亲缘关系。
ITS(ITS1–ITS4)序列的系统发育进化树分析结果显示,Lyd-LR1和Lyd-LR6菌株聚合在一起,而Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌株聚合在一起,再与NCBI登录的荷叶离褶伞菌株进行聚合(图4)。从遗传距离和进化关系进行分析,外地荷叶离褶伞菌株Lyd-LR10、Lyd-LR15和Lyd-LR17与福建本地离褶伞菌株Lyd-LRX和Lyd-LRY亲缘关系更接近。Lyd-LR1和Lyd-LR6菌株保持相近的亲缘关系,与其他荷叶离褶伞菌株亲缘关系较远。外地荷叶离褶伞菌株Lyd-LR1和Lyd-LR6的遗传进化距离大于其他荷叶离褶伞菌株,表现出较远的种属亲缘关系。
2.3 荷叶离褶伞的菌丝体生长和菌丝形态观察
将外地荷叶离褶伞菌株(Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17)接菌至PDA培养基暗培养10 d 和20 d(30 ℃)。在菌丝体生长的第10 天,Lyd-LR6菌株在生长圈边缘形成厚实的菌丝体且菌丝体生长的速度明显快于Lyd-LR1、Lyd-LR10、Lyd-LR15和Lyd-LR17菌株;Lyd-LR10和Lyd-LR17菌株的菌丝体生长速度基本一致;Lyd-LR1和Lyd-LR15菌株的菌丝体厚度较低且菌丝体生长速度慢于Lyd-LR6、Lyd-LR10和Lyd-LR17菌株(图5)。在菌丝体生长的第20天,Lyd-LR1菌株的菌丝体不能铺满整个培养基,菌丝呈现松散放射状且菌丝厚度较薄,生长较慢;Lyd-LR6厚实的菌丝体呈平铺状且铺满整个培养基,菌丝厚度较高且均一,生长速度较快;Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌丝体生长基本相同且菌丝体铺满整个培养基,菌丝体厚度较高且呈现突起状,生长较为迅速(图5)。荷叶离褶伞的菌丝体生长结果显示,Lyd-LR6菌丝体生长迅速,而Lyd-LR1菌丝体生长缓慢。Lyd-LR1和Lyd-LR6菌株之间的菌丝体生长速度差别明显且均不同于Lyd-LR10、Lyd-LR15和Lyd-LR17菌株的菌丝体生长。
挑取生长20 d的外地荷叶离褶伞菌株菌丝体进行扫描电镜观察,Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌株的菌丝形态基本相似,均为圆柱形的菌丝,菌丝饱满且交织在一起;Lyd-LR1菌株的菌丝呈现梭子状,菌丝生长不规则且有聚合生长的倾向;Lyd-LR6菌株的菌丝生长更加不规则且呈现凹陷状,菌丝明显聚合生长(图6)。与Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY菌株相比较,Lyd-LR1和Lyd-LR6菌株的菌丝形态发生了明显的变异,且Lyd-LR6菌株的菌丝形态变异幅度大于Lyd-LR1菌株。
3. 讨论与结论
快速鉴定外地引进的菌株是提高荷叶离褶伞品种选育效率的重要手段。目前对荷叶离褶伞菌株的研究主要集中在改良栽培技术、营养成分分析、甾类和多糖等活性物质的提取纯化[14-16],缺乏对于不同地区来源的荷叶离褶伞菌株的有效快速鉴定。随着分子生物学的发展,通过PCR扩增部分基因组序列对不同地区的食用菌菌株进行鉴定和确定其种属关系及基因组碱基序列变异情况的方法逐渐成熟,为优良菌株的筛选提供快捷方法[17]。采用传统的形态学鉴定食用菌有易于观察和比较优势,但菌丝形态多样性易受到外界因素的影响而出现假阳性。根据基因组序列同源性的特征(>95%)可确定食用菌菌株之间的序列差异性和种属亲缘关系[18]。基因组碱基序列的鉴定方法通过分析碱基序列的突变而明确菌丝形态变异和菌丝体性状能遗传稳定的本质原因。利用菌体形态学和基因组序列测序结合的方法,鉴定了蘑菇属的双孢蘑菇(Agaricus bisporus),香菇属的香菇(Lentinula edodes)和小包脚菇属的草菇(Volvariella volvacea)[19],以及快速将野生菌鉴定为Paxillus ammoniavirescens[18]。基因组部分序列测序和菌丝形态的结合是鉴定食用菌新菌株的有效方法。真菌食用菌具有物种多样性和序列保守性,其18S rRNA(V4)序列在遗传进化上较为保守,而ITS(ITS1–ITS4)序列常发生较高概率的碱基突变,常用于快速鉴定食用菌的基因序列同源性、种属关系和碱基序列突变程度,为进一步分析菌丝形态变异提供依据。
外地引进的荷叶离褶伞菌株(Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17)与福建本地的荷叶离褶伞菌株(Lyd-LRX和Lyd-LRY)以及NCBI登录的荷叶离褶伞菌株在18S rRNA-ITS序列的系统发育进化树均聚合在一起,且菌株间的18S rRNA 序列同源性大于97.55%,与离褶伞菌株的同源性也大于94.21%,确定此次从外地引进的食用菌均为荷叶离褶伞菌株。18S rRNA-ITS序列的同源性分析、多重序列比对和遗传进化树分析均显示外地荷叶离褶伞菌株(Lyd-LR1、Lyd-LR6、Lyd-LR10、Lyd-LR15和Lyd-LR17)和福建本地荷叶离褶伞菌株(Lyd-LRX和Lyd-LRY)存在较高比例的碱基序列突变,ITS序列同源性下降至80.09%~89.72%,从而明确外地荷叶离褶伞菌株已明显不同于福建本地荷叶离褶伞菌株以及NCBI登录的荷叶离褶伞菌株(45个)。这些外地引进的荷叶离褶伞菌株具有丰富本地区荷叶离褶伞菌株资源库的研究价值。ITS(ITS1–ITS4)的多重序列比对和遗传进化树显示Lyd-LR1和Lyd-LR6菌株的基因序列差异性和碱基序列突变比例明显区别于其他荷叶离褶伞菌株,且仅在Lyd-LR6菌株发生的碱基替换和碱基缺失明显高于Lyd-LR1、Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY。菌丝体生长速度和菌丝形态进一步表明,Lyd-LR1梭子状不规则菌丝和松散放射状菌丝体以及Lyd-LR6凹陷状聚合生长菌丝和边缘厚实平铺状菌丝体,均不同于Lyd-LR10、Lyd-LR15和Lyd-LR17圆柱形饱满的菌丝和突起状菌丝体,且Lyd-LR6菌丝体生长速度明显快于Lyd-LR1,Lyd-LR6菌丝形态的变异程度也高于Lyd-LR1。基因组碱基序列高比例的突变是造成Lyd-LR1和Lyd-LR6菌株菌丝体生长速度和菌丝形态明显不同于Lyd-LR10、Lyd-LR15、Lyd-LR17、Lyd-LRX和Lyd-LRY的根本原因。而与Lyd-LR1菌株相比,Lyd-LR6菌株的碱基序列突变比例更高且碱基突变位置更多变(碱基替换和碱基缺失),使得Lyd-LR6菌株的菌丝形态明显区别于Lyd-LR1菌株。
-
图 1 木棉花芽不同分化期外部形态特征及内部形态结构
A1~F1分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)植物样品外部形态;A2~F2分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)内部形态结构。GP: 生长点;FP:花原基;SE:花萼原基;PE:花瓣原基;PP:雌蕊原基;SP:雄蕊原基;PI:雌蕊;ST:雄蕊。
Figure 1. External morphology and internal structure of B. ceiba flower buds at differentiation phases
A1: external morphology of Phase I plant; B1: external morphology of Phase II plant; C1: external morphology of Phase III plant; D1: external morphology of Phase IV plant; E1: external morphology of Phase V plant; F1: external morphology of Phase VI plant; A2: internal structure of Phase I plant; B2: internal structure of Phase II plant; C2: internal structure of Phase III plant; D2: internal structure of Phase IV plant; E2: internal structure of Phase V plant; F2: internal structure of Phase VI plant; GP: growing point; FP: flower primordial; SE: sepal; PE: Petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen. GP: growing point; FP: flower primordial; SE: sepal; PE: petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen.
-
[1] 张坤, 马纪忠, 王玉成, 等. 抑絮制剂治理杨树飘絮成本控制策略 [J]. 现代园艺, 2022, (13):201−202. DOI: 10.3969/j.issn.1006-4958.2022.13.078 ZHANG K, MA J Z, WANG Y C, et al. Cost Control Strategies for Poplar Flocculation Management with Flocculation Inhibiting Agents [J]. Contemporary Horticulture, 2022(13): 201−202. (in Chinese) DOI: 10.3969/j.issn.1006-4958.2022.13.078
[2] 梁辉. 防治杨柳树飘絮措施探讨 [J]. 宁夏农林科技, 2014, 55(9):41−42. DOI: 10.3969/j.issn.1002-204X.2014.09.020 LIANG H. A discussion on measures of prevention and control of poplar and willow fluffy catkins [J]. Ningxia Journal of Agriculture and Forestry Science and Technology, 2014, 55(9): 41−42. (in Chinese) DOI: 10.3969/j.issn.1002-204X.2014.09.020
[3] 苗艺明, 覃永华, 梁小春, 等. 广西盾翅藤花芽分化过程及内源激素含量变化研究 [J]. 西部林业科学, 2023, 52(2):98−105. MIAO Y M, QIN Y H, LIANG X C, et al. The process of floral bud differentiation and endogenous hormone changes in Aspidopterys concava [J]. Journal of West China Forestry Science, 2023, 52(2): 98−105. (in Chinese)
[4] 樊卫国, 刘国琴, 安华明, 等. 刺梨花芽分化期芽中内源激素和碳、氮营养的含量动态 [J]. 果树学报, 2003, 20(1):40−43. DOI: 10.3969/j.issn.1009-9980.2003.01.010 FAN W G, LIU G Q, AN H M, et al. Study on the changes of endogenous hormones, carbohydrate and nitrogen nutrition at the flower bud differentiation stage of Rosa roxburghii [J]. Journal of Fruit Science, 2003, 20(1): 40−43. (in Chinese) DOI: 10.3969/j.issn.1009-9980.2003.01.010
[5] 刘宗莉, 林顺权, 陈厚彬. 枇杷花芽和营养芽形成过程中内源激素的变化 [J]. 园艺学报, 2007, 34(2):339−344. DOI: 10.3321/j.issn:0513-353X.2007.02.014 LIU Z L, LIN S Q, CHEN H B. Time course changes of endogenous hormone levels during the floral and vegetative buds formation in loquat (Eriobotrya japonica Lindl. ) [J]. Acta Horticulturae Sinica, 2007, 34(2): 339−344. (in Chinese) DOI: 10.3321/j.issn:0513-353X.2007.02.014
[6] 吴志祥, 周兆德, 陶忠良, 等. 妃子笑与鹅蛋荔枝花芽分化期间内源激素的变化 [J]. 热带作物学报, 2005, 26(4):42−45. DOI: 10.3969/j.issn.1000-2561.2005.04.010 WU Z X, ZHOU Z D, TAO Z L, et al. Changes of endogenous hormones in feizixiao and Edan Litchi during flower bud differentiation [J]. Chinese Journal of Tropical Crops, 2005, 26(4): 42−45. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2005.04.010
[7] 梅虎, 谈锋. 紫苏花芽生理分化期叶片内源激素含量变化的动态研究 [J]. 西南师范大学学报(自然科学版), 2002, 27(2):206−209. MEI H, TAN F. Endogenous hormones metabolism in leaves during the physhiological flower bud differentiation phase of Perilla frutescens (L.) britte [J]. Journalof Southwest China Normal University (Natural Science), 2002, 27(2): 206−209. (in Chinese)
[8] 李建安, 孙颖, 郜爱玲, 等. 油桐花芽分化期营养与激素生理变化研究 [J]. 中南林业科技大学学报, 2011, 31(3):34−37,53. DOI: 10.3969/j.issn.1673-923X.2011.03.008 LI J A, SUN Y, GAO A L, et al. Physiological nutrition and hormone variations in Vernicia fordii during flower bud differentiation [J]. Journal of Central South University of Forestry & Technology, 2011, 31(3): 34−37,53. (in Chinese) DOI: 10.3969/j.issn.1673-923X.2011.03.008
[9] 史继孔, 张万萍, 樊卫国, 等. 银杏雌花芽分化过程中内源激素含量的变化 [J]. 园艺学报, 1999, 26(3):194−195. DOI: 10.3321/j.issn:0513-353X.1999.03.012 SHI J K, ZHANG W P, FAN W G, et al. Changes in endogenous hormones during the differentiation of female flower bud of ginkgo ( G.Biloba L) [J]. Acta Horticulturae Sinica, 1999, 26(3): 194−195. (in Chinese) DOI: 10.3321/j.issn:0513-353X.1999.03.012
[10] 孔德政, 靳丹丹, 何松林, 等. 碗莲花芽分化的解剖学以及内源激素变化规律的研究 [J]. 北京林业大学学报, 2009, 31(3):42−45. DOI: 10.3321/j.issn:1000-1522.2009.03.008 KONG D Z, JIN D D, HE S L, et al. Anatomy and changes in endogenous hormones during flower bud differentiation in Nelumbo nucifera [J]. Journal of Beijing Forestry University, 2009, 31(3): 42−45. (in Chinese) DOI: 10.3321/j.issn:1000-1522.2009.03.008
[11] 林玲, 黄羽, 谢太理, 等. 3个葡萄品种花芽分化过程中内源激素含量变化初报 [J]. 南方农业学报, 2012, 43(6):806−809. DOI: 10.3969/j:issn.2095-1191.2012.06.806 LIN L, HUANG Y, XIE T L, et al. Changes of endogenous hormone content during flower bud differentiation in three grape varieties [J]. Journal of Southern Agriculture, 2012, 43(6): 806−809. (in Chinese) DOI: 10.3969/j:issn.2095-1191.2012.06.806
[12] 金洲, 卢山, 江俊浩, 等. 园艺植物花芽分化影响因素及机理研究进展 [J]. 园艺学报, 2023, 50(5):1151−1164. JIN Z, LU S, JIANG J H, et al. Research progress on influencing factors and mechanisms of flower bud differentiation in horticultural plants [J]. Acta Horticulturae Sinica, 2023, 50(5): 1151−1164. (in Chinese)
[13] 彭桂群, 王力华. 平阴玫瑰花芽分化期叶片内源激素的变化 [J]. 植物研究, 2006, 26(2):2206−2210. DOI: 10.7525/j.issn.1673-5102.2006.02.017 PENG G Q, WANG L H. Quantitative variation of endogenous hormones in Rosa rugosa leaf during flower bud differentiation [J]. Bulletin of Botanical Research, 2006, 26(2): 2206−2210. (in Chinese) DOI: 10.7525/j.issn.1673-5102.2006.02.017
[14] 蔡坤秀, 牛先前, 王龙平, 等. 叶底红花芽分化期叶片内源激素的动态变化 [J]. 福建农业学报, 2017, 32(3):278−281. CAI K X, NIU X Q, WANG L P, et al. Dynamic changes of endogenous hormone in Phyllagathis fordii leaf during flower bud differentiation [J]. Fujian Journal of Agricultural Sciences, 2017, 32(3): 278−281. (in Chinese)
[15] 倪子轶. 鸽子兰花芽分化观察研究 [J]. 中国野生植物资源, 2022, 41(8):47−50. DOI: 10.3969/j.issn.1006-9690.2022.08.007 NI Z Y. Observation and study on bud differentiation of Peristeria elata hook [J]. Chinese Wild Plant Resources, 2022, 41(8): 47−50. (in Chinese) DOI: 10.3969/j.issn.1006-9690.2022.08.007
[16] SHEN X D, HE R X, LI X, et al. Effect of shoot control on flower bud differentiation, flowering, and fruit setting in Zanthoxylum armatum DC [J]. Phyton, 2023, 92(12): 3251−3266. DOI: 10.32604/phyton.2023.042735
[17] 刘雪莲, 程文博, 朱俊义. 侧金盏花花芽分化的形态观察及生理生化变化 [J]. 东北林业大学学报, 2022, 50(9):50−55. LIU X L, CHENG W B, ZHU J Y. Flower bud morphological differentiation and physiological biochemistry of Adonis amurensis [J]. Journal of Northeast Forestry University, 2022, 50(9): 50−55. (in Chinese)
[18] 郝敬虹, 齐红岩, 阎妮, 等. 园艺作物花芽分化的研究进展 [J]. 农业科技与装备, 2008, (1):7−9. DOI: 10.3969/j.issn.1674-1161.2008.01.003 HAO J H, QI H Y, YAN N, et al. Advances in researches on flower bud differentiation of horticultural crops [J]. Agricultural Science & Technology and Equipment, 2008(1): 7−9. (in Chinese) DOI: 10.3969/j.issn.1674-1161.2008.01.003
[19] 张永强, 沈海岑, 刘念. 美丽异木棉花芽分化期形态结构初步研究[J]. 广东园林, 2017, 39(6): 68−72. ZHANG Y Q, SHEN H C, LIU N. The study on the characteristics of flower bud differentiation in Ceiba speciosa(A. St. -hil. ) Ravenna[J]. Guangdong Landscape Architecture, 2017, 39(6): 68−72. (in Chinese)
[20] 牛辉陵, 张洪武, 边媛, 等. 枣花分化发育过程及其内源激素动态研究 [J]. 园艺学报, 2015, 42(4):655−664. NIU H L, ZHANG H W, BIAN Y, et al. Flower formation and endogenous hormones dynamic in Chinese jujube [J]. Acta Horticulturae Sinica, 2015, 42(4): 655−664. (in Chinese)
[21] 温玥. 外施赤霉素和多效唑对油茶花芽形成和果实品质的影响[D]. 北京: 北京林业大学, 2019. WEN Y. Effects of gibberellin and paclobutrazol on flower bud formation and fruit quality of Camellia oleifera[D]. Beijing: Beijing Forestry University, 2019. (in Chinese)
[22] 黄洁衔, 李腾基, 黄紫钦, 等. 墨兰花芽形态分化及生理特性研究 [J]. 北方园艺, 2023, (3):56−63. DOI: 10.11937/bfyy.20222262 HUANG J X, LI T J, HUANG Z Q, et al. Morphology and physiological characteristics during flower bud differentiation in Cymbidium sinense [J]. Northern Horticulture, 2023(3): 56−63. (in Chinese) DOI: 10.11937/bfyy.20222262
[23] 喻雄, 邓全恩, 李建安. 内源激素含量与‘铁城一号’油茶开花过程的关系 [J]. 经济林研究, 2019, 37(4):149−154. YU X, DENG Q E, LI J A. Relationship between endogenous hormones contents and flowering process in Camellia oleifera ‘Tiecheng No. 1’ [J]. Non-wood Forest Research, 2019, 37(4): 149−154. (in Chinese)
[24] 易仁知, 秦俊, 黄清俊. 穗花牡荆花芽分化过程中形态和生理指标变化 [J]. 西北植物学报, 2023, 43(10):1760−1769. DOI: 10.7606/j.issn.1000-4025.2023.10.1760 YI R Z, QIN J, HUANG Q J. Study on the changes of morphological and physiological indexes during flower bud differentiation of Vitex agnus-castus [J]. Acta Botanica Boreali-Occidentalia Sinica, 2023, 43(10): 1760−1769. (in Chinese) DOI: 10.7606/j.issn.1000-4025.2023.10.1760
[25] 张宁, 黄曜曜, 敖妍, 等. 文冠果花芽分化过程及内源激素动态变化 [J]. 南京林业大学学报(自然科学版), 2019, 43(4):33−42. ZHANG N, HUANG Y Y, AO Y, et al. Flower bud differentiation and dynamic changes of endogenous hormone in Xanthoceras sorbifolium Bunge [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2019, 43(4): 33−42. (in Chinese)
[26] 宋杨, 窦连登, 张红军. 蓝莓不同品种花芽形成过程中内源激素的变化 [J]. 中国南方果树, 2014, 43(5):106−108,114. SONG Y, DOU L D, ZHANG H J. Changes of endogenous hormones during flower bud formation of different blueberry varieties [J]. South China Fruits, 2014, 43(5): 106−108,114. (in Chinese)
[27] 赵志珩, 张荣, 严蕾, 等. 板栗花芽分化中内源激素的变化规律 [J]. 广西林业科学, 2020, 49(4):518−523. DOI: 10.3969/j.issn.1006-1126.2020.04.007 ZHAO Z H, ZHANG R, YAN L, et al. Changes of endogenous hormones in Castanea mollissima flower bud differentiation [J]. Guangxi Forestry Science, 2020, 49(4): 518−523. (in Chinese) DOI: 10.3969/j.issn.1006-1126.2020.04.007
[28] 马亮, 李飞, 张金宝, 等. 不同陆地棉品种花芽分化与茎尖内源激素的关系 [J]. 江苏农业科学, 2018, 46(16):71−75. MA L, LI F, ZHANG J B, et al. Relationship between flower bud differentiation and shoot tip endogenous hormones of different upland cotton varieties [J]. Jiangsu Agricultural Sciences, 2018, 46(16): 71−75. (in Chinese)
[29] 杨光穗, 黄素荣, 王存, 等. 黄花美冠兰花芽分化过程中假鳞茎内源激素含量变化的研究 [J]. 北方园艺, 2012, (23):75−78. YANG G S, HUANG S R, WANG C, et al. Study on changes of endogenous hormone contents in pseudobulbs during the floral bud differentiation of Eulophia flava [J]. Northern Horticulture, 2012(23): 75−78. (in Chinese)
[30] 许昕, 刘佳奇, 王宇含, 等. 小叶丁香花芽分化进程及内源激素的变化 [J]. 生态学杂志, 2024, 43(1):146−152. XU X, LIU J Q, WANG Y H, et al. The differentiation process of flower bud and the changes of endogenous hormones in Syringa microphylla [J]. Chinese Journal of Ecology, 2024, 43(1): 146−152. (in Chinese)
[31] 艾星梅, 何睿宇, 胡燕芳. 马铃薯花芽分化与内源激素动态变化的关系 [J]. 西北植物学报, 2018, 38(1):87−94. DOI: 10.7606/j.issn.1000-4025.2018.01.0087 AI X M, HE R Y, HU Y F. Flower bud differentiation and their relationships with content changes of endogenous hormones in potatoes [J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(1): 87−94. (in Chinese) DOI: 10.7606/j.issn.1000-4025.2018.01.0087
[32] 谭长强, 郑威, 谢乐, 等. 红锥花芽分化过程及相关激素含量的变化 [J]. 广西林业科学, 2022, 51(6):817−822 TAN C Q, ZHENG W, XIE L, et al. Process of flower bud differentiation of Castanopsis hystrix and changes of related hormone contents [J]. Guangxi Forestry Science, 2022, 51(6): 817−822. (in Chinese)
[33] 王玉华, 范崇辉, 沈向, 等. 大樱桃花芽分化期内源激素含量的变化 [J]. 西北农业学报, 2002, 11(1):64−67. DOI: 10.3969/j.issn.1004-1389.2002.01.018 WANG Y H, FAN C H, SHEN X, et al. Changes in endogenous hormones during the flower bud differentiation of sweet cherry [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2002, 11(1): 64−67. (in Chinese) DOI: 10.3969/j.issn.1004-1389.2002.01.018




 下载:
下载: