A Rapid Method for Identifying Stem Blight Resistance of Asparagus
-
摘要:目的
建立芦笋抗茎枯病快速鉴定方法,为芦笋抗病育种及抗病品种的筛选应用提供技术支持。
方法分别采用毒素浸种法、毒素浸根法、分生孢子悬浮液浸种法、分生孢子悬浮液灌根法和田间自然诱发法测定7个芦笋品种对芦笋茎枯病的抗病性。
结果芦笋茎枯病菌毒素浸种24 h对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的种子萌发抑制率分别为3.62%、4.29%、13.98%、4.26%、2.19%、4.95%和15.00%,可将7个供试品种划分为感病和中抗2个类型,UC157F2和早佳1号为感病品种,其他品种表现为中抗。毒素原液浸根处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的根生长抑制率分别为80.94%、73.72%、82.29%、71.77%、65.86%、69.39%和82.35%,可将供试的7个芦笋品种划分为感病、中感和中抗3个类型,UC157F2、早佳1号和格兰德为感病品种,佳芦1号和丰岛1号为中感品种,TC和华淼为中抗品种。芦笋茎枯病菌分生孢子悬浮液浸种对供试芦笋种子萌发抑制作用较强,其中1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的种子萌发抑制率分别为43.88%、40.97%、41.67%、32.87%、29.59%、28.52%和61.23%,可将7个供试品种分为感病、中感和中抗3个类型,UC157F2为感病品种,格兰德、早佳1号和佳芦1号为中感品种,丰岛1号、华淼和TC为中抗品种。分生孢子悬浮液灌根后所有供试品种的发病率均在80%以上,不能有效区分供试品种的抗病性。田间自然诱发法可将7个供试品种划分为感病、中感和中抗3个类型,UC157F2为感病品种,早佳1号、格兰德和佳芦1号为中感品种,丰岛1号、华淼和TC为中抗品种。
结论病菌分生孢子悬浮液浸种法对芦笋品种的抗茎枯病鉴定结果与田间自然诱发法鉴定结果在0.01水平上显著相关,可以与田间自然诱发法相结合快速准确鉴定芦笋种质资源对茎枯病的抗性水平。
Abstract:ObjectiveA method was developed to rapidly evaluate the resistance of an asparagus cultivar to stem blight.
MethodSeven asparagus cultivars with varying degrees of resistance to stem blight were selected for the study. To artificially induce the disease, (1) the asparagus seeds and/or roots were soaked in an aqueous solution containing the mycotoxin produced by Phomopsis asparagi, (2) the asparagus seeds were submerged in P. asparagi spore suspension, or (3) the asparagus roots were irrigated with an aqueousP. asparagi spore suspension to compare with (4) the natural induction on asparagus plants in the field. Seed germination and seedling root growth were monitored to grade the disease resistance or susceptibility of each asparagus variety.
ResultAfter 24h soaking in an aqueous solution containing mycotoxin, the seeds of Grande, Jialu No. 1, Zaojia No. 1, Fengdao No. 1, Huamiao, TC and UC157F2 displayed inhibited germination at the rates of 3.62%, 4.29%, 13.98%, 4.26%, 2.19%, 4.95% and 15.00%, respectively. Accordingly, UC157F2 and Zaojia No. 1 were classified as the susceptible varieties and the remainders moderately resistant ones. As the root growth of Grande, Jialu No. 1, Zaojia No. 1, Fengdao No. 1, Huamiao, TC and UC157F2 plants affected by an exposure to mycotoxin were inhibited at the rates of 80.94%, 73.72%, 82.29%, 71.77%, 65.86%, 69.39% and 82.35%, respectively, the asparagus cultivars UC157F2, Zaojia No. 1 and Grande were grouped in the susceptible class, Jialu No. 1 and Fengdao No. 1 in the moderately susceptible class, and TC and Huamiao in the moderately resistant class. The significant inhibition on germination by soaking the seeds in suspension of 1.0×105 P. asparagi spores·mL−1 was at a rate of 43.88% on the Grande seeds, 40.97% on the Jialu No. 1 seeds, 41.67% on the Zaojia No. 1 seeds, 32.87% on the Fengdao No. 1 seeds, 29.59% on the Huamiao seeds, 28.52% on the TC seeds, and 61.23% on the UC157F2 seeds. The results placed UC157F2 in the susceptible, Grande, Zaojia No. 1 and Jialu No. 1 in the moderately susceptible, and Fengdao No. 1, Huamiao and TC in the moderately resistant classifications. When the plants were irrigated with the P. asparagi spore suspension, the disease incidence on all tested asparagus was greater than 80% and not adequate to differentiate the resistance grades. Finally, in comparison, the stem blight-induced UC157F2 plants in the field was the susceptible cultivar, whereas Zaojia No. 1, Grande, Jialu No. 1 and Fengdao No. 1 were the moderately susceptible and Huamiao and TC the moderately resistant varieties.
ConclusionOf the various methods for comparing resistance to stem blight of asparagus varieties, soaking the seeds in P. asparagi spore suspension rendered the classification closest to that obtained by the field induction (P<0.01). Therefore, along with field observation, it could be reliably applied to quickly estimate the disease resistance of an asparagus cultivar.
-
Keywords:
- Asparagus officinalis L. /
- asparagus stem blight /
- resistance /
- identification method
-
0. 引言
【研究意义】芦笋(Asparagus officinalis L.)又名石刁柏,是百合科(Liliaceae)天门冬属(Asparagus)多年生宿根植物,具有抗肿瘤和抗氧化等功效,是世界公认的高级保健蔬菜,享有“蔬菜之王”美誉[1−2]。芦笋茎枯病由天门冬拟茎点霉菌[Phomopsis asparagi(Sacc.)Bubak]侵染引起,主要为害芦笋茎秆,在中国、日本、泰国和印尼等亚洲国家芦笋种植区每年均有发生,严重影响芦笋的产量和品质[3−4]。目前,施用杀菌剂是防治芦笋茎枯病的有效手段,但面临着病原菌抗药性、食品安全和环境污染等问题[5]。利用作物品种的抗病性是防治作物病害最经济、有效和安全的措施[6]。芦笋是多年生作物,生产周期长,一次种植可采收10年,建立快速准确的芦笋抗茎枯病鉴定方法,选育抗病品种,对芦笋产业健康发展具有重要意义。【前人研究进展】开展品种抗病性鉴定是选育作物抗病品种的重要一环。我国对水稻、小麦、玉米和大豆等大宗作物的主要病害都建立了稳定可靠的抗病性鉴定方法,形成了国家作物品种抗病性鉴定技术规程[7−8]。在芦笋抗茎枯病的抗性鉴定方面,Sonoda等[9]报道了一种芦笋茎部接种的抗病性鉴定方法,但操作复杂、用时长、受环境条件影响大、重复性差。杨迎青等[10]采用苗期人工接种的方法鉴定了31份芦笋种质资源的抗病性水平,缩短了芦笋抗茎枯病鉴定的时间。阮宏椿等[11]采用苗期人工接种的鉴定方法测定了9个主栽品种对芦笋茎枯病的抗病性。苗期人工接种法具有鉴定结果稳定的优点,但仍需要完成播种、定植等繁杂工作,占用温棚面积大,耗时较长,难以针对大批量品种或育种材料开展抗病性鉴定。【本研究切入点】采用田间自然诱发或苗期人工接种法鉴定芦笋的抗病性,工作量大、耗时长,难以快速从大量种质资源中筛选出抗性材料。芦笋抗茎枯病快速准确鉴定方法还有待深入探讨。【拟解决的关键问题】本研究拟通过评价芦笋茎枯病菌毒素浸种法和浸根法、分生孢子悬浮液浸种法和分生孢子悬浮液灌根法等4种方法与田间自然诱发法对供试芦笋品种抗病性鉴定结果的一致性,建立芦笋抗茎枯病快速准确鉴定的新方法,为芦笋抗病育种和茎枯病的防治提供技术支撑。
1. 材料与方法
1.1 供试材料
供试菌株:供试芦笋茎枯病菌菌株FJ58采集自福建省莆田市涵江区庄边镇吉云村,由福建省农业科学院植物保护研究所分离鉴定,测定致病性并保存。
供试芦笋品种:格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2(感病对照品种),由福建省农业科学院植物保护研究所收集并保存。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA培养基),取200 g马铃薯进行切片,加水煮沸20 min,过滤,上清液加入葡萄糖20 g、琼脂粉16 g,加热至琼脂粉完全溶解,加水定容至
1000 mL,在121 ℃下高压湿热灭菌25 min。马铃薯葡萄糖培养基(PDB培养基),取200 g马铃薯进行切片,加水煮沸20 min,过滤,上清液加入葡萄糖20 g,加水定容至1000 mL,在121 ℃下高压湿热灭菌25 min。1.2 方法
1.2.1 芦笋茎枯病菌孢子悬浮液的制备
芦笋茎枯病菌孢子悬浮液的制备参照杨迎青等[10]的方法 ,并稍作修改。将保存于滤纸片上的芦笋茎枯病菌菌株FJ58转至PDA培养基平板上,28 ℃培养5 d,用直径5 mm的打孔器在菌落边缘打取菌饼,将菌饼转入PDA培养基平板,28 ℃培养14 d,用毛刷和适量无菌水洗下分生孢子器,用灭菌镊子捏碎分生孢子器,释放分生孢子,过滤后血球计数板测定分生孢子浓度,分别配制成1.0×103、1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液,置于4 ℃冰箱保存,备用。
1.2.2 芦笋茎枯病菌毒素的制备
参照李俊萍等[12]的方法,并稍作修改。将芦笋茎枯病菌菌株FJ58转至PDA培养基平板上,28 ℃培养5 d,用直径5 mm的打孔器在菌落边缘打取菌饼,将菌饼转入装有PDB培养基的三角瓶中,28 ℃、150 r·min−1振荡培养7 d,用灭菌滤纸过滤后收集滤液,并用细菌过滤器(0.22 μm)过滤,收集芦笋茎枯病菌粗毒素液。将芦笋茎枯病菌粗毒素液用无菌水稀释,分别配制成芦笋茎枯病菌粗毒素原液∶无菌水(体积比)=1∶0、7∶1、3∶1、1∶1、1∶3和1∶7的稀释液,置于4 ℃冰箱保存备用。
1.2.3 芦笋茎枯病菌毒素浸种法
将供试芦笋种子用10% H2O2浸泡消毒15 min,用无菌水冲洗3次后,然后分别用无菌水浸种22、20、16、8、0 h,再放入芦笋茎枯病菌FJ58的毒素中分别浸泡2、4、8、16、24 h,每个处理的浸种时间均为24 h,同时设无菌水浸种24 h的处理为对照。每处理50粒种子,3次重复。将浸种处理后的种子置于装有灭菌泥炭土的育苗盒中,将育苗盒置于28 ℃、相对湿度90%、光周期12L∶12D的培养箱内培育14 d,调查种子萌发率,计算茎枯病菌毒素对芦笋种子的萌发抑制率。采用DPS 9.5软件Duncan's新复极差法(P < 0.05)进行芦笋种子的萌发抑制率差异显著性分析,并根据试验结果以毒素浸种24 h对芦笋种子的萌发抑制率评价芦笋品种的抗病性[13]。高抗(HR):种子萌发抑制率=0%;抗病(R):0%<种子萌发抑制率≤1%;中抗(MR):1%<种子萌发抑制率≤5%;中感(MS):5%<种子萌发抑制率≤10%;感病(S):10%<种子萌发抑制率≤15%;高感(HS):15%<种子萌发抑制率。
1.2.4 芦笋茎枯病菌毒素浸根法
将供试芦笋种子用10% H2O2浸泡消毒15 min,用无菌水冲洗3次,然后放入无菌水浸泡24 h,置于28 ℃、90%相对湿度的培养箱中催芽3 d,将萌芽的种子置于育苗盒空穴中。每粒芦笋种子分别加入制备的不同芦笋茎枯病毒素稀释液2 mL,以无菌水作对照,每处理30粒种子,3次重复。将育苗盒置于28 ℃、相对湿度90%、光周期12L∶12D的培养箱内培育7 d观察并测量根长,计算不同茎枯病菌毒素稀释液对芦笋根生长的抑制率。采用DPS 9.5软件Duncan's新复极差法(P < 0.05)进行芦笋根生长的抑制率差异显著性分析,并根据试验结果以毒素原液对芦笋根生长的抑制率评价芦笋品种的抗病性。高抗(HR):芦笋根生长的抑制率≤50%;抗病(R):50%<芦笋根生长的抑制率≤60%;中抗(MR):60%<芦笋根生长的抑制率≤70%;中感(MS):70%<芦笋根生长的抑制率≤80%;感病(S):80%<芦笋根生长的抑制率≤90%;高感(HS):90%<芦笋根生长的抑制率。
1.2.5 芦笋茎枯病菌孢子悬浮液浸种法
将供试芦笋种子用10% H2O2浸泡消毒15 min,然后用无菌水冲洗3次,分别放入芦笋茎枯病菌1.0×103、1.0×104、1.0×105个孢子·mL−1分生孢子悬浮液中浸泡15 min,以无菌水浸泡为对照,每处理30粒种子,3次重复。将处理后种子置于装有灭菌泥炭土的育苗盒中,将育苗盒置于28 ℃、90%相对湿度、光周期12L∶12D的培养箱内培育14 d,调查种子萌发率。计算茎枯病菌对芦笋种子的萌发抑制率。采用DPS 9.5软件Duncan's新复极差法(P < 0.05)进行芦笋种子的萌发抑制率差异显著性分析,并根据试验结果以1.0×105个孢子·mL−1的分生孢子悬浮液浸种对种子萌发的抑制率评价芦笋品种的抗病性。高抗(HR):种子萌发抑制率=0%;抗病(R):0%<种子萌发抑制率≤20%;中抗(MR):20%<种子萌发抑制率≤40%;中感(MS):40%<种子萌发抑制率≤60%;感病(S):60%<种子萌发抑制率≤80%;高感(HS):80%<种子萌发抑制率。
1.2.6 芦笋茎枯病菌孢子悬浮液灌根法
将供试芦笋种子用10% H2O2浸泡消毒15 min,用无菌水冲洗3次,然后放入无菌水浸泡24 h,置于28 ℃、90%相对湿度的培养箱中催芽3 d,将处理后的种子置于装有灭菌泥炭土的育苗盒中,将育苗盒置于28 ℃、相对湿度90%、光周期12L∶12D的培养箱内培育14 d,分别用芦笋茎枯病菌1.0×103、1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液灌根接种,每株芦笋幼苗接种2 mL,以无菌水灌根为对照,每处理30株幼苗,3次重复。灌根处理3 d后逐日观察记载各处理的发病株数,计算发病率。采用DPS 9.5软件Duncan's新复极差法(P < 0.05)进行发病率差异显著性分析,并根据试验结果以1.0×103个孢子·mL−1分生孢子悬浮液灌根的发病率评价芦笋品种的抗病性。高抗(HR):发病率=0%;抗病(R):0%<发病率≤5%;中抗(MR):5%<发病率≤15%;中感(MS):15%<发病率≤30%;感病(S):30%<发病率≤45%;高感(HS):45%<发病率。
1.2.7 田间自然诱发法
将供试芦笋品种60 d苗龄的植株移栽种植于常年发生茎枯病的病圃中,60 d后五点取样,每点随机取10丛,观察记载各供试品种植株发病的茎秆数和调查总茎秆数,计算发病率。采用DPS 9.5软件Duncan's新复极差法(P < 0.05)进行发病率差异显著性分析,以发病率评价芦笋品种的抗病性,评价标准同1.2.6。
1.2.8 数据处理
按下列公式分别计算种子萌发率、种子萌发抑制率、根长抑制率和发病率。
种子萌发率/%=萌发的种子数/种子总数×100 (1) 种子萌发抑制率/%=(对照萌发率−处理萌发率)/对照萌发率×100 (2) 根长抑制率/%=(对照根长−处理根长)/对照根长×100 (3) 发病率/%=发病茎秆数/调查总茎秆数×100 (4) 采用SPSS 19.0分析各方法鉴定结果的相关性。
2. 结果与分析
2.1 芦笋茎枯病菌毒素浸种法
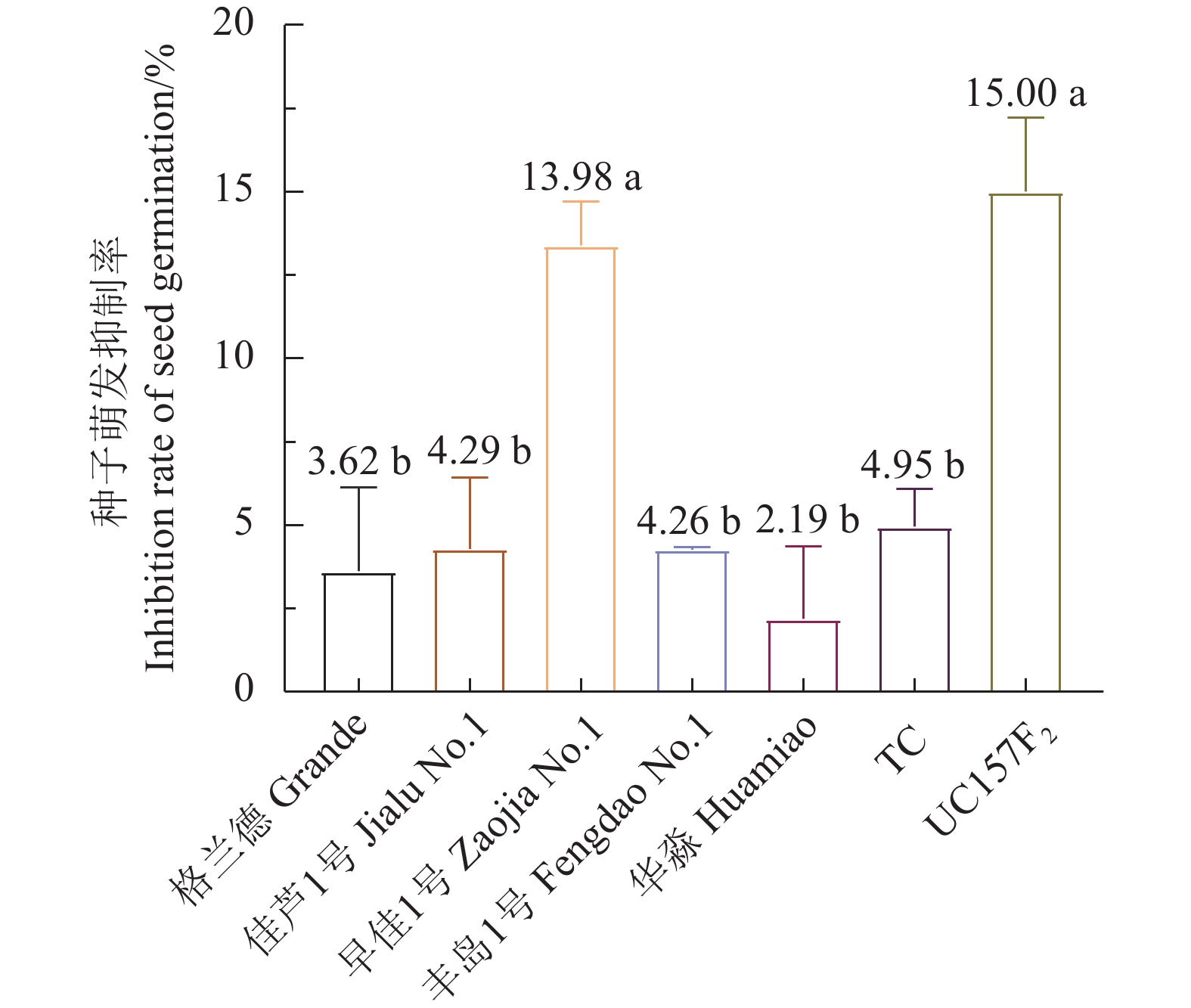
华淼、格兰德、佳芦1号和丰岛1号用芦笋茎枯病菌毒素原液浸种2、4、8、16、24 h的种子萌发率与对照差异不显著;早佳1号和UC157F2种子萌发率与芦笋茎枯病菌毒素浸种时间成反比,其中浸种4、8、16、24 h的萌发率显著低于对照;TC用茎枯病菌毒素浸种24 h的萌发率显著低于对照(表1)。芦笋茎枯病菌毒素浸种24 h对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2种子萌发抑制率分别为3.62%、4.29%、13.98%、4.26%、2.19%、4.95%和15.00%,对早佳1号和UC157F2种子萌发抑制率显著高于其他供试品种。供试的7个品种被划分为感病和中抗2个类型,感病品种为UC157F2和早佳1号;中抗品种为格兰德、佳芦1号、丰岛1号、华淼和TC(图1)。
表 1 芦笋茎枯病菌毒素不同浸种时间对芦笋种子萌发率的影响Table 1. Effect of soaking time in mycotoxin-containing solution on asparagus seed germination rate浸种时间
Soaking time/h种子萌发率
Germination rate of seed /%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 2 90.67a 92.00a 94.00a 92.00a 90.00a 92.67ab 90.67ab 4 91.33a 92.00a 91.33b 92.00a 90.67a 90.67ab 88.00bc 8 90.00a 91.33a 89.33b 92.00a 89.33a 92.00ab 85.33cd 16 88.00a 90.67a 84.67c 89.33a 90.67a 92.67ab 82.67de 24 89.33a 89.33a 82.00d 90.00a 89.33a 89.33b 79.33e 0 (CK) 92.00a 93.33a 94.67a 94.00a 91.33a 94.00a 93.33a 同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Data with different lowercase letters on a column indicate significant differences at P<0.05. Same for below.![]() 图 1 芦笋茎枯病菌毒素浸种24 h对芦笋种子萌发的抑制率不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)。下同。Figure 1. Germination inhibition rate of asparagus seeds soaked in mycotoxin-containing solution for 24 hThose with different lowercase letters indicate significant difference at P<0.05 by Duncan’s new multiple range test. Same for below.
图 1 芦笋茎枯病菌毒素浸种24 h对芦笋种子萌发的抑制率不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)。下同。Figure 1. Germination inhibition rate of asparagus seeds soaked in mycotoxin-containing solution for 24 hThose with different lowercase letters indicate significant difference at P<0.05 by Duncan’s new multiple range test. Same for below.2.2 芦笋茎枯病菌毒素浸根法
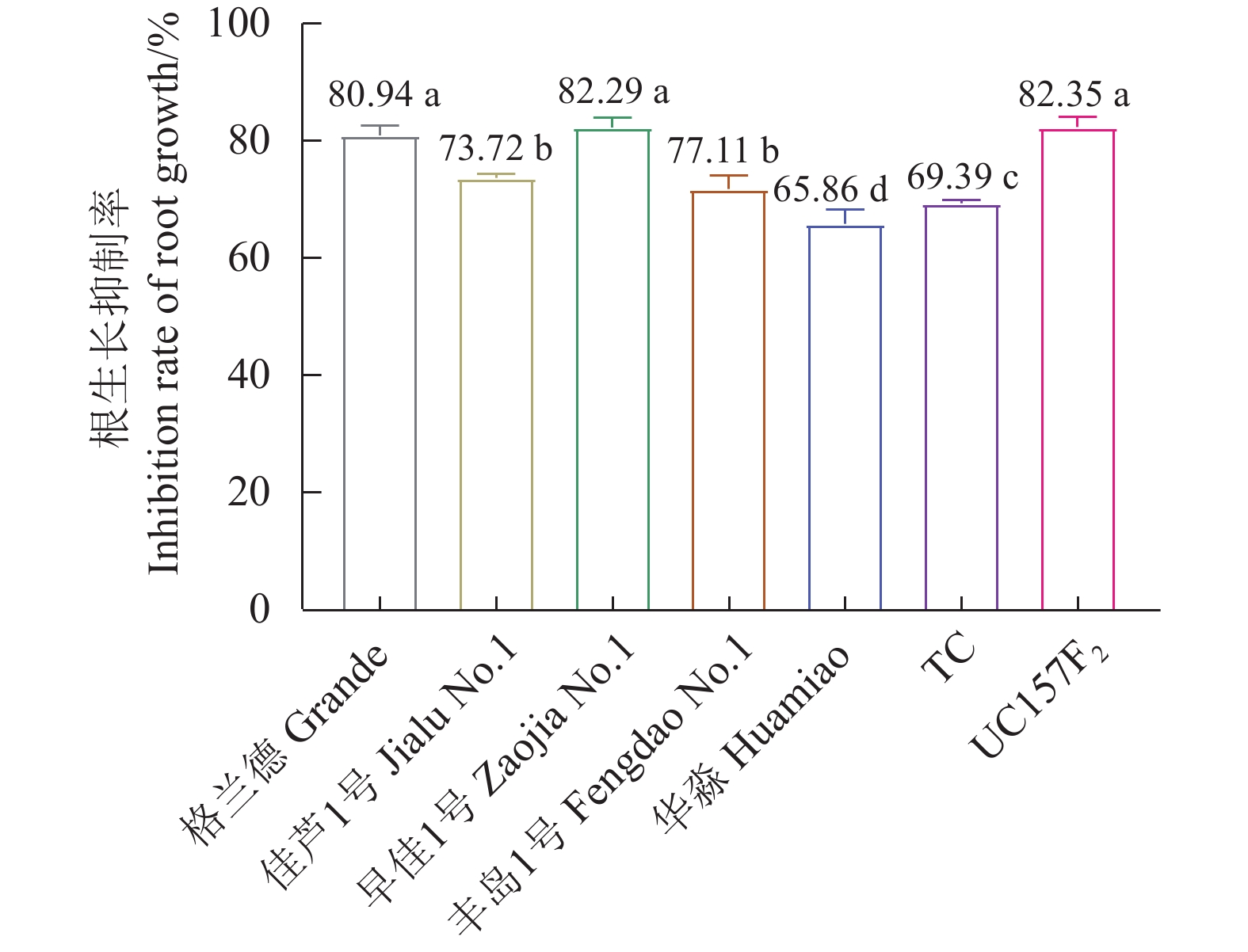
芦笋茎枯病菌毒素浸根处理对芦笋根生长的抑制率与毒素浓度成正比,粗毒素原液∶无菌水(体积比)=1∶0、7∶1、3∶1、1∶1、1∶3和1∶7等6个处理对芦笋根生长抑制率差异达显著水平,其中毒素∶无菌水=1∶0浸根处理对芦笋根生长抑制率显著强于其他处理(表2)。毒素∶无菌水=1∶0浸根处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的根生长抑制率分别为80.94%、73.72%、82.29%、71.77%、65.86%、69.39%和82.35%,对华淼和TC根生长抑制率显著低于其他供试品种,而对UC157F2、格兰德和早佳1号的根生长抑制率则显著高于其他品种。供试的7个品种被划分为感病、中感和中抗3个类型,感病品种为UC157F2、早佳1号和格兰德;中感品种为佳芦1号和丰岛1号;中抗品种为TC和华淼(图2)。
表 2 不同浓度芦笋茎枯病菌毒素浸根对芦笋根生长的影响Table 2. Effect of soaking in solutions containing varied concentrations of mycotoxin on growth of asparagus roots粗毒素原液与水体积比
Volume ratio of toxin to water根生长抑制率
The inhibition rate of root growth/%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 1∶0 80.94a 73.72a 82.29a 71.77a 65.86a 69.39a 82.35a 7∶1 74.96b 68.58b 77.12b 67.99b 62.30b 64.60b 77.78b 3∶1 68.99c 64.56c 72.83c 63.02c 58.45c 60.95c 74.75c 1∶1 65.45d 60.85d 68.32d 58.61d 54.54d 55.60d 70.22d 1∶3 60.82e 57.12e 63.80e 53.59e 49.11e 50.54e 66.54e 1∶7 57.28f 55.10f 59.58f 46.00f 43.44f 46.61f 60.77f 2.3 芦笋茎枯病菌分生孢子悬浮液浸种法
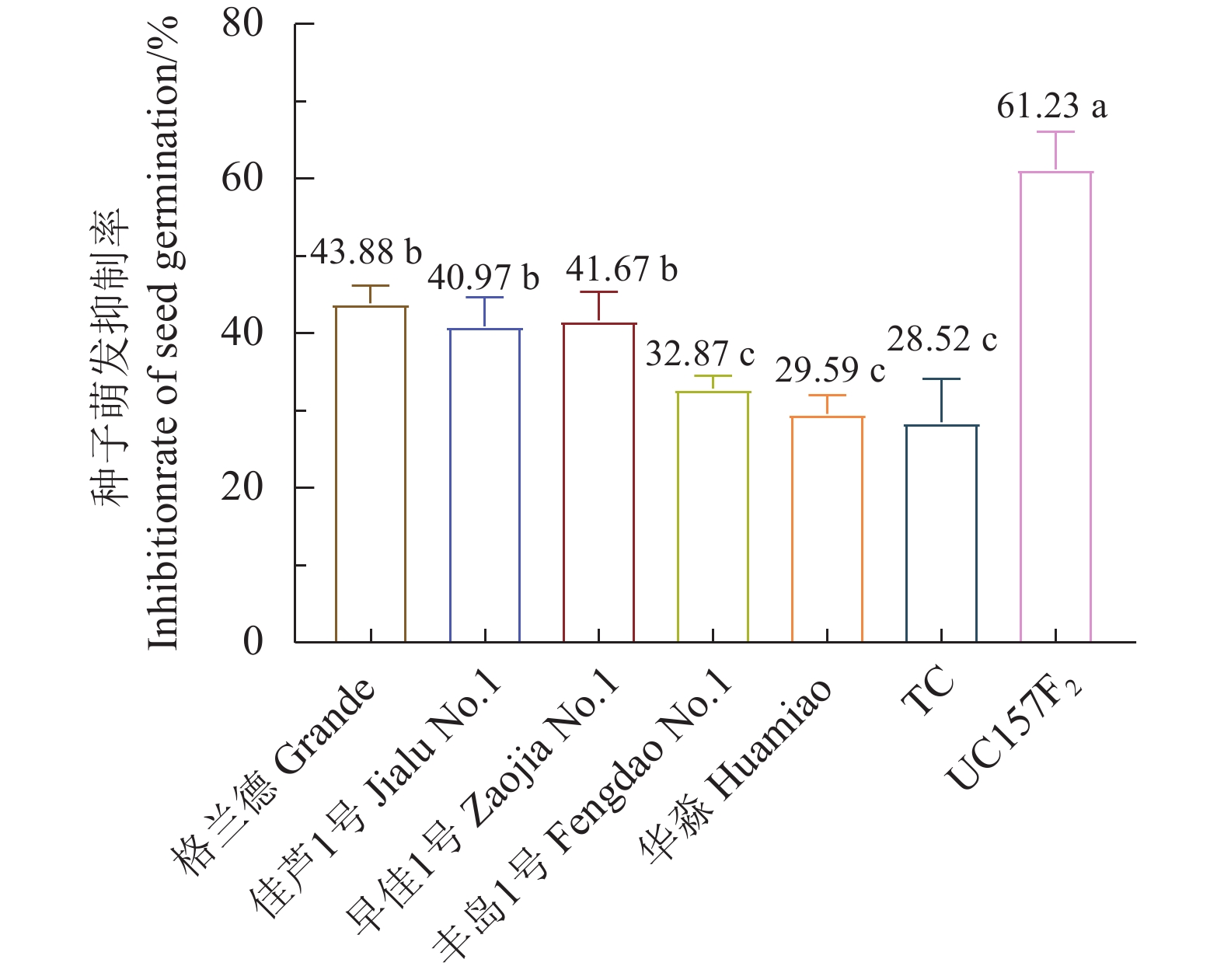
芦笋茎枯病菌1.0×103、1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对供试7个芦笋品种的种子萌发均有较强的抑制作用,种子萌发率与对照相比均达显著水平。1.0×103、1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理后格兰德和华淼种子萌发率差异均达显著水平。1.0×103、1.0×104个孢子·mL−1的分生孢子悬浮液浸种处理后对佳芦1号、早佳1号、丰岛1号和UC157F2的种子萌发率影响均不显著;1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对这4个品种种子萌发率差异影响也均不显著,而1.0×103、1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对这4个品种种子萌发率差异均达显著水平。1.0×103、1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对TC的种子萌发影响差异不显著。1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的种子萌发抑制率分别为:43.88%、40.97%、41.67%、32.87%、29.59%、28.52%和61.23%,供试的7个品种被分为感病、中感和中抗3个类型,感病品种为UC157F2;中感品种为格兰德、佳芦1号和早佳1号;中抗品种为TC、华淼和丰岛1号(表3、图3)。
表 3 不同浓度芦笋茎枯病菌分生孢子悬浮液浸种对芦笋种子萌发率的影响Table 3. Effect on germination rate of seeds soaked in varied P. asparagi spore suspensions分生孢子
悬浮液浓度
Concentration of
spore suspension
/(孢子·mL-1)种子萌发率
Germination rate of seed/%格兰德
Grande佳芦1号
Jialu
No.1早佳1号
Zaojia
No.1丰岛1号
Fengdao
No.1华淼
HuamiaoTC UC-
157F21.0×103 68.00b 68.00b 66.00b 73.33b 77.33b 80.00b 49.33b 1.0×104 60.67c 61.33bc 60.67bc 69.33bc 72.00c 72.00b 44.00bc 1.0×105 52.00d 56.67c 56.00c 62.67c 66.67d 68.67b 36.67c 0 (CK) 92.67a 96.00a 96.00a 93.33a 94.67a 96.00a 94.67a 2.4 芦笋茎枯病菌分生孢子悬浮液灌根法
用芦笋茎枯病菌1.0×103个孢子·mL−1的分生孢子悬浮液灌根处理,格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的发病率分别为87.33%、84.67%、89.33%、88.00%、83.33%、82.00%和86.00%;用1.0×104、1.0×105个孢子·mL−1的分生孢子悬浮液灌根处理,供试芦笋品种发病率均达100%,不能有效区分供试品种的抗病性(图4)。
![]() 图 4 芦笋茎枯病菌1.0×103个孢子·mL−1孢子悬浮液灌根处理的发病结果A:TC对照;B:TC分生孢子悬浮液灌根;C:UC157F2对照;D:UC157F2分生孢子悬浮液灌根。Figure 4. Disease incident of asparagus plants with roots irrigated with 1.0×103P. asparagi spores·mL−1 suspensionA: TC control; B: TC roots irrigated with P. asparagi spore suspension; C: UC157F2 control; D: UC157F2 roots irrigated with P. asparagi spore suspension.
图 4 芦笋茎枯病菌1.0×103个孢子·mL−1孢子悬浮液灌根处理的发病结果A:TC对照;B:TC分生孢子悬浮液灌根;C:UC157F2对照;D:UC157F2分生孢子悬浮液灌根。Figure 4. Disease incident of asparagus plants with roots irrigated with 1.0×103P. asparagi spores·mL−1 suspensionA: TC control; B: TC roots irrigated with P. asparagi spore suspension; C: UC157F2 control; D: UC157F2 roots irrigated with P. asparagi spore suspension.2.5 田间自然诱发鉴定法
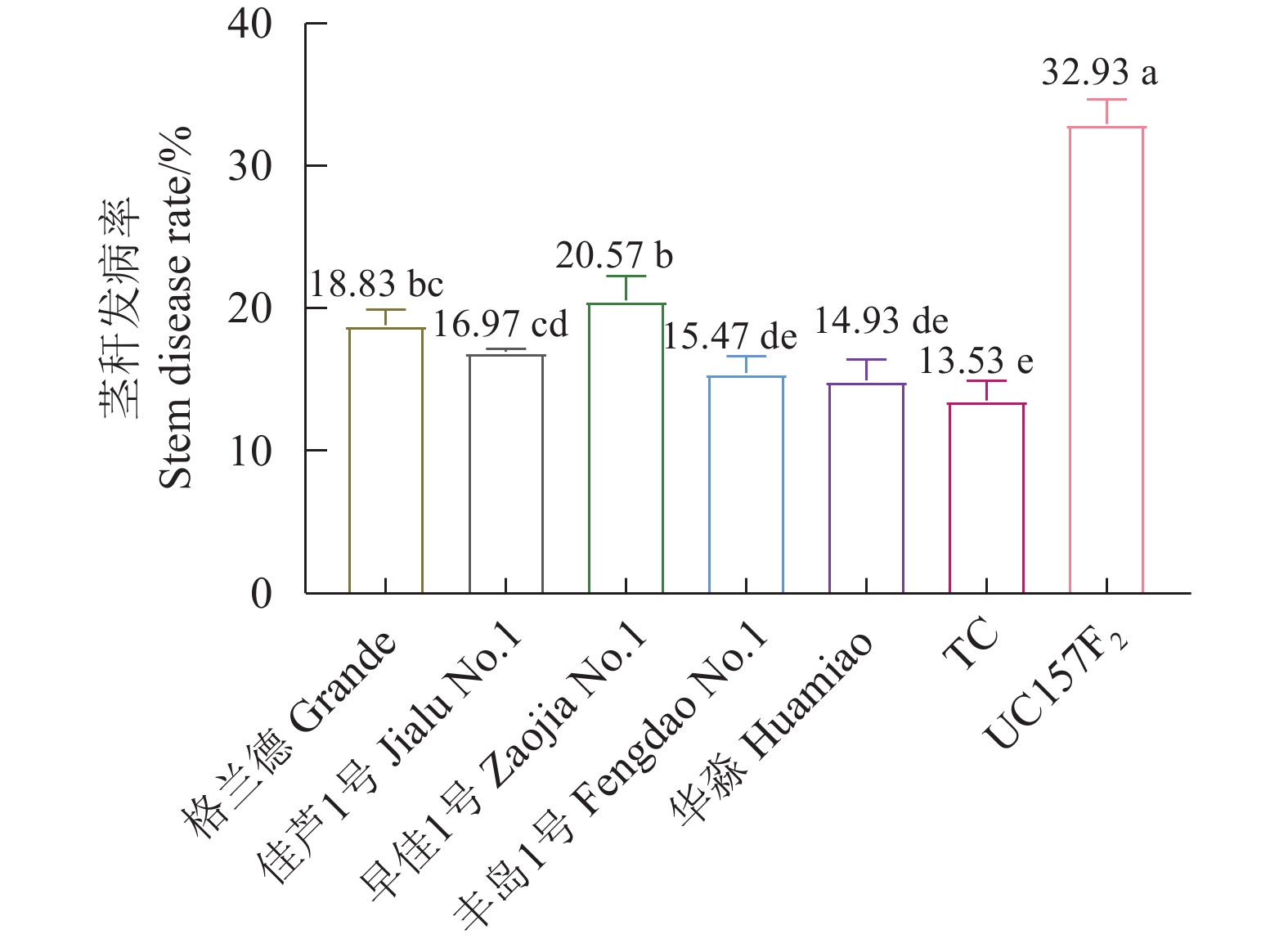
在田间自然诱发的情况下,供试品种格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的发病率分别为18.83%、16.97%、20.57%、15.47%、14.93%、13.53%和32.93%。UC157F2最感病,发病率显著高于其他品种,其后依次为早佳1号、格兰德、佳芦1号、丰岛1号、华淼和TC。根据品种发病率差异水平,将供试的7个品种划分为感病、中感和中抗3个类型,感病品种为UC157F2;中感品种为早佳1号、格兰德、佳芦1号和丰岛1号;中抗品种为华淼和TC(图5)。
2.6 不同鉴定方法相关性分析
芦笋茎枯病菌毒素浸种法、毒素浸根法和分生孢子悬浮液浸种法均与田间自然诱发法在0.01水平上显著相关,其中分生孢子悬浮液浸种法与田间自然诱发法的相关系数最大,为0.761。孢子悬浮液灌根法与自然诱发法在0.05水平上显著相关,相关系数为0.540;孢子悬浮液灌根法与毒素浸种法、毒素浸根法、孢子悬浮液浸种法的相关性均不显著。芦笋茎枯病菌毒素浸种法、毒素浸根法和孢子悬浮液浸种法的鉴定结果均在0.01水平上显著相关(表4)。
表 4 不同鉴定方法的相关性Table 4. Correlation between evaluation methods for disease resistance of asparagus抗性鉴定方法
Resistance-identification
methods毒素浸种法
Soaking seed
with mycotoxin毒素浸根法
Soaking root
with mycotoxin分生孢子悬浮液浸种法
Soaking seed
with spore suspension分生孢子悬浮液灌根法
Irrigating root
with spore suspension自然诱发法
Field natural
induction method毒素浸种法
Soaking seed with mycotoxin1 0.768** 0.911** 0.267 0.703** 毒素浸根法
Soaking root with mycotoxin0.768** 1 0.682** 0.327 0.682** 分生孢子悬浮液浸种法
Soaking seed with spore suspension0.911** 0.682** 1 0.373 0.761** 分生孢子悬浮液灌根法
Irrigating root with spore suspension0.267 0.327 0.373 1 0.540* 田间自然诱发法
Field natural induction method0.703** 0.682** 0.761** 0.540* 1 **表示在0.01水平(双侧)上显著相关;*表示在0.05水平(双侧)上显著相关。
** indicates significant correlation at P<0.01 (bilateral); * indicates significant correlation at P<0.05 (bilateral).3. 讨论与结论
芦笋茎枯病是芦笋生产上最主要的病害,造成芦笋产量和品质下降[14]。利用抗病品种是防治芦笋茎枯病的重要措施,而在抗病品种培育中,育种亲本、后代群体与新品种(系)的抗病性评判都依赖抗病性鉴定[15]。目前,国内外对芦笋茎枯病的抗病性缺乏系统性、持续性的研究。芦笋抗病性鉴定通常采用田间病圃自然诱发的方法,而田间温度、降雨、湿度等自然条件的变化会直接影响鉴定结果的准确性,且试验用地大、鉴定周期长、工作量大。因此,建立快速准确鉴定芦笋抗茎枯病的方法对筛选和利用抗性材料,培育抗病品种,有效防控芦笋茎枯病具有重要意义。
芦笋茎枯病菌毒素浸种法对芦笋种子的萌发率和出苗率有一定的影响,其中对早佳1号和UC157F2的种子萌发抑制率有较显著影响,对其他供试品种的种子萌发抑制率均在5%以下,这可能与芦笋种子有坚硬皮壳包裹,毒素难以接触胚芽有关。孙丽萍等[13]研究结果也表明,毒素浸种法不能有效鉴定烟草种质对赤星病的抗性。 丁燕芳等[16]研究表明用毒素浸种法鉴定烟草种质对黑胫病抗性简单灵活,可进行多批量的初期筛选,但需注意因种子质量问题(低发芽率)造成“假感病”现象,影响了毒素浸种法的判定效果。本研究采用病菌毒素对种子萌发抑制率评价供试品种的抗病性,消除了因种子质量差造成的“假感病”现象,但仍需注意种子皮壳厚度及坚硬程度对毒素浸种鉴定的影响,选择适宜的浸种时间。
毒素浸根法与田间病圃自然诱发法相比具有简单易行和不易受环境影响等特点[17]。本研究发现,芦笋根生长的抑制率与芦笋茎枯病菌毒素浓度成正比,毒素原液对所有供试芦笋品种根的生长抑制率均在65%以上,对有效区分品种的抗感性有一定的影响。贺红等[17]采用0.6×108 cfu·mL−1 的青枯菌液制备的毒素浸根处理广藿香植株,可较快表现出青枯病的症状,缩短抗病鉴定的过程。王铭等[18]研究表明毒素浸根法鉴定棉花抗黄萎病时最适毒素浓度为15 μg·mL−1,在此浓度下,毒素浸根法的鉴定结果与田间病圃法鉴定结果较一致。在烟草黑胫病抗性鉴定中,毒素浸根法可以初步鉴别抗、感病品种,但是存在不能区分中感和中抗烟草品种的缺陷[16]。棉花黄萎病菌和烟草青枯病菌都侵染寄主的维管束,病菌毒素通常具有较强的致病或致枯作用,病菌毒素处理后寄主快速表现病害症状。可见,毒素浸根法对病菌或毒素造成系统性病害的作物抗性鉴定比较适用,而毒素浓度是影响鉴定结果的关键因素。
本研究采用分生孢子悬浮液灌根处理,1.0×103个孢子·mL−1的分生孢子悬浮液处理下供试芦笋品种的发病率均在80%以上,而1.0×104个孢子·mL−1的分生孢子悬浮液处理下供试芦笋品种的发病率达100%,这种结果不能有效区分供试品种对茎枯病的抗病性。这与芦笋茎枯病菌具有较强的致病性有关,分生孢子悬浮液灌根后病菌孢子快速萌发侵染芦笋幼嫩的根和茎,迅速造成枯萎。周淼平等[19]采用纹枯病菌菌丝体悬浮液浸种小麦种子法测定了小麦对纹枯病的抗病性,鉴定结果与田间幼苗纹枯病抗性鉴定结果有较高的相关性,且操作简便,重复性好。兰海燕[20]认为通过向日葵种子与菌核共培养,根据种子皮壳对病原菌的抗病能力鉴定向日葵对菌核病抗性的方法准确率高,且在播种前即可在室内快速大量进行定向选择,该鉴定方法的生化依据是抗病种子的皮壳上酚的含量比不抗病的高2~3倍。本研究中,芦笋茎枯病菌分生孢子悬浮液浸种法与田间自然诱发法的抗病性鉴定结果相关系数为0.761,一致性较高,可以与田间自然诱发法相结合用于快速筛选芦笋抗茎枯病种质资源。
-
图 1 芦笋茎枯病菌毒素浸种24 h对芦笋种子萌发的抑制率
不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)。下同。
Figure 1. Germination inhibition rate of asparagus seeds soaked in mycotoxin-containing solution for 24 h
Those with different lowercase letters indicate significant difference at P<0.05 by Duncan’s new multiple range test. Same for below.
图 4 芦笋茎枯病菌1.0×103个孢子·mL−1孢子悬浮液灌根处理的发病结果
A:TC对照;B:TC分生孢子悬浮液灌根;C:UC157F2对照;D:UC157F2分生孢子悬浮液灌根。
Figure 4. Disease incident of asparagus plants with roots irrigated with 1.0×103P. asparagi spores·mL−1 suspension
A: TC control; B: TC roots irrigated with P. asparagi spore suspension; C: UC157F2 control; D: UC157F2 roots irrigated with P. asparagi spore suspension.
表 1 芦笋茎枯病菌毒素不同浸种时间对芦笋种子萌发率的影响
Table 1 Effect of soaking time in mycotoxin-containing solution on asparagus seed germination rate
浸种时间
Soaking time/h种子萌发率
Germination rate of seed /%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 2 90.67a 92.00a 94.00a 92.00a 90.00a 92.67ab 90.67ab 4 91.33a 92.00a 91.33b 92.00a 90.67a 90.67ab 88.00bc 8 90.00a 91.33a 89.33b 92.00a 89.33a 92.00ab 85.33cd 16 88.00a 90.67a 84.67c 89.33a 90.67a 92.67ab 82.67de 24 89.33a 89.33a 82.00d 90.00a 89.33a 89.33b 79.33e 0 (CK) 92.00a 93.33a 94.67a 94.00a 91.33a 94.00a 93.33a 同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Data with different lowercase letters on a column indicate significant differences at P<0.05. Same for below.表 2 不同浓度芦笋茎枯病菌毒素浸根对芦笋根生长的影响
Table 2 Effect of soaking in solutions containing varied concentrations of mycotoxin on growth of asparagus roots
粗毒素原液与水体积比
Volume ratio of toxin to water根生长抑制率
The inhibition rate of root growth/%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 1∶0 80.94a 73.72a 82.29a 71.77a 65.86a 69.39a 82.35a 7∶1 74.96b 68.58b 77.12b 67.99b 62.30b 64.60b 77.78b 3∶1 68.99c 64.56c 72.83c 63.02c 58.45c 60.95c 74.75c 1∶1 65.45d 60.85d 68.32d 58.61d 54.54d 55.60d 70.22d 1∶3 60.82e 57.12e 63.80e 53.59e 49.11e 50.54e 66.54e 1∶7 57.28f 55.10f 59.58f 46.00f 43.44f 46.61f 60.77f 表 3 不同浓度芦笋茎枯病菌分生孢子悬浮液浸种对芦笋种子萌发率的影响
Table 3 Effect on germination rate of seeds soaked in varied P. asparagi spore suspensions
分生孢子
悬浮液浓度
Concentration of
spore suspension
/(孢子·mL-1)种子萌发率
Germination rate of seed/%格兰德
Grande佳芦1号
Jialu
No.1早佳1号
Zaojia
No.1丰岛1号
Fengdao
No.1华淼
HuamiaoTC UC-
157F21.0×103 68.00b 68.00b 66.00b 73.33b 77.33b 80.00b 49.33b 1.0×104 60.67c 61.33bc 60.67bc 69.33bc 72.00c 72.00b 44.00bc 1.0×105 52.00d 56.67c 56.00c 62.67c 66.67d 68.67b 36.67c 0 (CK) 92.67a 96.00a 96.00a 93.33a 94.67a 96.00a 94.67a 表 4 不同鉴定方法的相关性
Table 4 Correlation between evaluation methods for disease resistance of asparagus
抗性鉴定方法
Resistance-identification
methods毒素浸种法
Soaking seed
with mycotoxin毒素浸根法
Soaking root
with mycotoxin分生孢子悬浮液浸种法
Soaking seed
with spore suspension分生孢子悬浮液灌根法
Irrigating root
with spore suspension自然诱发法
Field natural
induction method毒素浸种法
Soaking seed with mycotoxin1 0.768** 0.911** 0.267 0.703** 毒素浸根法
Soaking root with mycotoxin0.768** 1 0.682** 0.327 0.682** 分生孢子悬浮液浸种法
Soaking seed with spore suspension0.911** 0.682** 1 0.373 0.761** 分生孢子悬浮液灌根法
Irrigating root with spore suspension0.267 0.327 0.373 1 0.540* 田间自然诱发法
Field natural induction method0.703** 0.682** 0.761** 0.540* 1 **表示在0.01水平(双侧)上显著相关;*表示在0.05水平(双侧)上显著相关。
** indicates significant correlation at P<0.01 (bilateral); * indicates significant correlation at P<0.05 (bilateral). -
[1] DEHGHAN-SHAHREZA F, BELADI-MOUSAVI S S, RAFIEIAN-KOPAEI M. Medicinal plants and diabetic kidney disease; an updated review on the recent findings [J]. Immunopathologia Persa, 2016, 2(1): 1−6.
[2] RUSJAN D, MIKULIC-PETKOVSEK M. Double maturation raisonnée: The impact of on-vine berry dehydration on the berry and wine composition of Merlot (Vitis vinifera L. ) [J]. Journal of the Science of Food and Agriculture, 2017, 97(14): 4835−4846. DOI: 10.1002/jsfa.8354
[3] 孙强, 赵凤, 兰波, 等. 芦笋茎枯病菌致病机制的研究进展 [J]. 安徽农业科学, 2023, 51(3):6−10. DOI: 10.3969/j.issn.0517-6611.2023.03.002 SUN Q, ZHAO F, LAN B, et al. Research progress on the pathogenic mechanism of Asparagus stem blight pathogen [J]. Journal of Anhui Agricultural Sciences, 2023, 51(3): 6−10. (in Chinese) DOI: 10.3969/j.issn.0517-6611.2023.03.002
[4] 刘志恒, 孙俊, 杨红, 等. 芦笋茎枯病菌生物学特性的研究 [J]. 沈阳农业大学学报, 2008, 39(3):301−304. DOI: 10.3969/j.issn.1000-1700.2008.03.010 LIU Z H, SUN J, YANG H, et al. Biological characteristics of Phomopsis asparagi the pathogen of Asparagus stem blight [J]. Journal of Shenyang Agricultural University, 2008, 39(3): 301−304. (in Chinese) DOI: 10.3969/j.issn.1000-1700.2008.03.010
[5] SHI N N, RUAN H C, GAN L, et al. Evaluating the sensitivities and efficacies of fungicides with different modes of action against Phomopsis asparagi [J]. Plant Disease, 2020, 104(2): 448−454. DOI: 10.1094/PDIS-05-19-1040-RE
[6] 杜宜新, 阮宏椿, 石妞妞, 等. 福建省稻瘟病菌对主要抗瘟基因及主栽品种的致病性分析 [J]. 植物保护学报, 2016, 43(3):442−451. DU Y X, RUAN H C, SHI N N, et al. Pathogenicity analysis of Magnaporthe grisea against major Pi-genes and main rice varieties in Fujian Province [J]. Journal of Plant Protection, 2016, 43(3): 442−451. (in Chinese)
[7] 中华人民共和国农业部. 水稻品种试验稻瘟病抗性鉴定与评价 技术规程: NY/T 2646—2014[S]. 北京: 中国农业出版社, 2015. [8] 程蓬, 郭璇, 辛秀丽, 等. 83份西农系小麦品种(系)抗性鉴定及抗病基因分子检测 [J]. 植物保护学报, 2024, 51(1):237−248. CHENG P, GUO X, XIN X L, et al. Disease resistance evaluation and molecular detection of resistance genes of 83 Xinong wheat varieties(lines) [J]. Journal of Plant Protection, 2024, 51(1): 237−248. (in Chinese)
[9] SONODA T, URAGAMI A, KAJI K. Evaluation of Asparagus officinalis cultivars for resistance to stem blight by using a novel inoculation method [J]. HortScience, 1997, 32(6): 1085−1086. DOI: 10.21273/HORTSCI.32.6.1085
[10] 杨迎青, 李湘民, 孟凡, 等. 芦笋茎枯病抗性鉴定方法的建立及芦笋抗病种质资源的筛选 [J]. 植物病理学报, 2012, 42(6):649−654. DOI: 10.3969/j.issn.0412-0914.2012.06.014 YANG Y Q, LI X M, MENG F, et al. Establishment of a resistance-identification method on Asparagus stem blight and evaluation of Asparagus officinalis germplasms [J]. Acta Phytopathologica Sinica, 2012, 42(6): 649−654. (in Chinese) DOI: 10.3969/j.issn.0412-0914.2012.06.014
[11] 阮宏椿, 石妞妞, 杜宜新, 等. 9个芦笋品种在福建的适应性分析 [J]. 农学学报, 2017, 7(11):31−34. DOI: 10.11923/j.issn.2095-4050.cjas17010013 RUAN H C, SHI N N, DU Y X, et al. 9 Asparagus varieties in Fujian: Adaptability analysis [J]. Journal of Agriculture, 2017, 7(11): 31−34. (in Chinese) DOI: 10.11923/j.issn.2095-4050.cjas17010013
[12] 李俊萍, 乜兰春, 王珊珊, 等. 茎枯病菌毒素制备及对芦笋愈伤组织抗性诱导的研究 [J]. 植物病理学报, 2016, 46(1):140−144. LI J P, NIE L C, WANG S S, et al. Phomopsis asparagi toxin preparation and the resistance induction on Asparagus callus by the pathogen toxin [J]. Acta Phytopathologica Sinica, 2016, 46(1): 140−144. (in Chinese)
[13] 孙丽萍, 时焦, 孟坤, 等. 利用赤星病菌毒素快速高通量鉴定烟草抗性种质的方法研究 [J]. 中国烟草科学, 2014, 35(1):80−84. SUN L P, SHI J, MENG K, et al. Investigation on the method of rapid identifying resistant tobacco germplasms to Alternaria alternata by using its mycotoxins [J]. Chinese Tobacco Science, 2014, 35(1): 80−84. (in Chinese)
[14] 杨迎青, 兰波, 胡水秀, 等. 几种因素对芦笋茎枯病菌分生孢子器和分生孢子产生量的影响 [J]. 植物保护学报, 2015, 42(4):517−522. YANG Y Q, LAN B, HU S X, et al. Effects of several factors on the production of pycnidia and conidia in Asparagus stem blight pathogen [J]. Journal of Plant Protection, 2015, 42(4): 517−522. (in Chinese)
[15] 孙大元, 张景欣, 陈冠州, 等. 空间诱变选育抗稻瘟病水稻品种研究进展与展望 [J]. 核农学报, 2017, 31(2):271−279. DOI: 10.11869/j.issn.100-8551.2017.02.0271 SUN D Y, ZHANG J X, CHEN G Z, et al. Achievements and perspective outlook of space induced mutation breeding for the rice blast resistance [J]. Journal of Nuclear Agricultural Sciences, 2017, 31(2): 271−279. (in Chinese) DOI: 10.11869/j.issn.100-8551.2017.02.0271
[16] 丁燕芳, 平文丽, 孙计平, 等. 烟草黑胫病抗性鉴定方法比较及其相关性分析 [J]. 湖北农业科学, 2017, 56(18):3477−3480. DING Y F, PING W L, SUN J P, et al. Comparison of methods to identify resistance to tobacco black shank disease and their correlation analysis [J]. Hubei Agricultural Sciences, 2017, 56(18): 3477−3480. (in Chinese)
[17] 贺红, 温雁鹰, 许仕仰, 等. 广藿香抗青枯病鉴定方法的研究 [J]. 广州中医药大学学报, 2011, 28(3):301−305. HE H, WEN Y Y, XU S Y, et al. Study on bacterial-wilt-resistance identification methods for Pogostemon cablin (Blanco) Benth [J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2011, 28(3): 301−305. (in Chinese)
[18] 王铭, 臧丽丽, 范凯, 等. 黄萎病菌毒素联合法鉴定棉花对黄萎病的抗性 [J]. 中国农业科学, 2015, 48(9):1678−1688. DOI: 10.3864/j.issn.0578-1752.2015.09.02 WANG M, ZANG L L, FAN K, et al. A combined identification method for the Verticillium wilt resistance in cotton by using pathogen toxin [J]. Scientia Agricultura Sinica, 2015, 48(9): 1678−1688. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2015.09.02
[19] 周淼平, 姚金保, 张鹏, 等. 小麦幼苗纹枯病抗性评价新方法 [J]. 江苏农业学报, 2017, 33(1):61−66. DOI: 10.3969/j.issn.1000-4440.2017.01.010 ZHOU M P, YAO J B, ZHANG P, et al. New method for the resistance evaluation of wheat sharp eyespot in seedling [J]. Jiangsu Journal of Agricultural Sciences, 2017, 33(1): 61−66. (in Chinese) DOI: 10.3969/j.issn.1000-4440.2017.01.010
[20] 兰海燕. 几种向日葵菌核病抗性鉴定方法的比较 [J]. 植物保护, 2000, 26(6):26−28. DOI: 10.3969/j.issn.0529-1542.2000.06.011 LAN H Y. Comparison of several identification methods of sunflower resistance to Sclerotinia sclerotiorum [J]. Plant Protection, 2000, 26(6): 26−28. (in Chinese) DOI: 10.3969/j.issn.0529-1542.2000.06.011




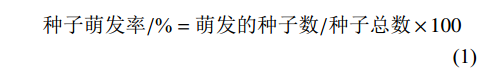
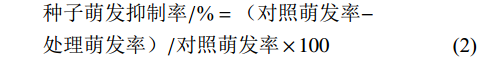
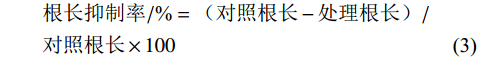
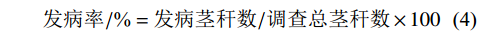
 下载:
下载: