Preparation of Monoclonal Antibodies Against CD25 of Porcine Tregs
-
摘要:目的
制备猪源CD25蛋白单克隆抗体,为猪源Treg细胞的检测及生物学研究提供基础。
方法将6×His猪源CD25基因片段通过同源重组的方法克隆至原核表达载体pET-28a,构建重组质粒pET28a-CD25。然后利用大肠杆菌表达系统和金属螯合亲和层析介质(Ni-NTA)预装柱对6×His-CD25重组蛋白进行表达和纯化。以纯化的重组蛋白作为抗原免疫雌性BALB/c小鼠,取免疫后小鼠的脾细胞与骨髓瘤细胞(SP2/0)进行细胞融合,经过间接ELISA筛选融合细胞并进行克隆化培养,并利用小鼠腹水法大量制备猪源CD25单克隆抗体。
结果成功获得一株由单一细胞生长且能够稳定分泌CD25单克隆抗体的杂交瘤细胞株。使用间接ELISA与Western blotting分析显示,CD25单克隆抗体不与其他蛋白产生免疫反应,抗体效价为1∶
4098000 ,表明CD25单克隆抗体特异性较强且效价高。间接免疫荧光和免疫印迹分析结果显示,CD25单克隆抗体不仅可以识别真核细胞表达的CD25蛋白,而且可以识别宿主脾脏和肺脏中的内源性CD25蛋白。结论成功制备了重组猪源CD25重组蛋白并筛选出特异性单克隆抗体,为定性或定量检测猪源Treg细胞CD25蛋白和研究猪源Treg细胞的功能奠定了基础。
Abstract:ObjectiveThe monoclonal antibody against CD25 in pigs was obtained to facilitate detecting and studying the regulatory T cells (Tregs).
MethodThe porcine 6×His tagged CD25 fragment was cloned into prokaryotic expression vector pET-28a via homologous recombination to construct the recombinant plasmid pET28a-CD25. Subsequently, the 6×His-CD25 recombinant protein was expressed in E. coli and purified on a metal chelating affinity chromatography medium (Ni-NTA) pre-packed column to be used as the antigen to immunize female BALB/c mice. Spleen cells of the immunized mice were hybridized with myeloma cells SP2/0 and screened by indirect ELISA prior to culture cloning. The target monoclonal antibody against CD25 was thus prepared using mouse ascites method.
ResultA single cell-derived hybridoma cell line with a stable expression of CD25 monoclonal antibody was successful obtained. ELISA and western blotting showed the antibody had a strong specificity with an exclusive reactivity towards the target protein, not the others, even at a high titer of 1:
4098000 . In the indirect immunofluorescence and western blotting assays, the antibody not only detected CD25 in the eukaryotic cells but also endogenous one in the host spleen and lung tissues.ConclusionThe recombinant porcine CD25 was successfully prepared and the specific monoclonal antibody obtained for qualitative and/or quantitative detection of the protein as well as further studies on the functions of porcine Tregs.
-
Keywords:
- pig /
- Treg cells /
- CD25 /
- monoclonal antibody
-
0. 引言
【研究意义】 白细胞介素-2受体α链(cluster of differentiation 25, CD25)主要在免疫相关细胞表面表达,包括活化的T细胞、B细胞和NK细胞[1]。CD25作为调节性T细胞(regulatory T cells)最经典的表面特征性标记分子,在自然调节性T细胞(natural Treg cells, nTreg)上的表达水平尤为显著[2] 。早在1995年,Sakaguchi等[3]研究表明,CD25不仅是调节性CD4+ T细胞的一个重要表型标志,而且它在免疫抑制和免疫调节中扮演着关键角色[4]。此外,CD25与CD122、CD132形成的高亲和受体复合物与IL-2相结合,参与多种免疫应答,对B细胞、T细胞和NK细胞的增殖和活化起着至关重要的作用[5]。【前人研究进展】 机体缺乏CD25时,Treg细胞数减少[6]。有研究表明,CD25的特异性单克隆抗体已经被广泛用作小鼠模型的研究工具[7, 8],CD25与IL-2的结合受到CD25单克隆抗体的抑制,并可以在体外功能性抑制IL-2介导的T细胞增殖[9]。CD25单克隆抗体阻断CD25期间,机体可以维持免疫稳态,但是当CD25+ Treg细胞被耗尽后,会引起异常的T细胞活化[10]。上述结果阐明CD25的单克隆抗体对Treg细胞具有重要生物学影响。另有研究表明,CD25也可以作为血液肿瘤细胞表面标记物,例如CD25在白血病干细胞表面会大量表达,进而可能使白血病干细胞中形成致癌信号通路[11, 12]。CD25的膜外区部分在断裂之后,会形成游离于细胞外的可溶性CD25(sCD25)[13],当机体感染人类免疫缺陷病毒(human immunodeficiency virus, HIV)和肺结核杆菌时,会导致血液内的sCD25水平升高[14−16]。另外在肿瘤(食管癌、白血病、多发性骨髓瘤、淋巴瘤、肺癌、头颈部癌和一些实体瘤)形成过程中,血液内的sCD25水平也会升高[17−23]。因此CD25蛋白可能成为检测血液内的sCD25水平的重要靶点。还有证据表明,在猪体内猪繁殖与呼吸综合病毒感染的早期阶段诱导宿主产生表达CD25+的细胞,这些细胞可以解释感染猪中猪繁殖与呼吸综合病毒特异性细胞免疫的延迟[24, 25]。有研究表明,猪源CD25可能是作为一种能标记不同T细胞亚群的激活分子,会在机体受到刺激后表达增加[26],CD25在猪体内的T细胞上的表达量约占T细胞亚群的2%~9% [27]。病毒(如尼帕病毒与猪瘟病毒)感染猪不仅能刺激机体产生表达CD25的T细胞[28, 29],同时猪群中有多种造成免疫抑制的传染病(如非洲猪瘟病毒、猪圆环病毒等)也会造成免疫细胞的损伤,然而在猪群中缺乏免疫细胞相关性的定量或定向检测指标。根据这些研究结果,进一步阐明猪源CD25蛋白可以对这些疾病的诊断和治疗提供重要靶点。 【本研究切入点】 鼠源CD25单克隆抗体制备出后,已被广泛应用于研究检测小鼠Treg细胞中IL-2信号传导的作用[30] 。由于还没有成熟的猪源CD25抗体,同时目前人源和鼠源的CD25氨基酸序列与猪源的CD25氨基酸序列一致性仅为74%和65%,对猪CD25蛋白的特异性不高且价格昂贵, 因此制备猪CD25蛋白的单克隆抗体十分重要。【拟解决的关键问题】采用大肠杆菌表达系统制备6×His-CD25重组蛋白,并将其乳化后用作免疫BALB/c小鼠的抗原,从而获得CD25多克隆抗体。通过将免疫反应成功的小鼠脾细胞与骨髓瘤细胞融合,筛选出猪源CD25的单克隆抗体。针对猪源CD25单克隆抗体的鉴定及其在间接ELISA、间接免疫荧光(IFA)和Western blotting等实验技术中的应用进行深入分析,为猪源Treg细胞的定性与定量研究奠定基础,为猪相关疾病的研究提供有效数据参考。
1. 材料与方法
1.1 材料与试剂
本研究中使用的大肠杆菌E.coli DH5α和pET-28a(+)质粒均由实验室保存。SPF级雌性BALB/c小鼠购自福州市仓山区吴氏实验动物服务部;E.coli Transetta(DE3)表达菌株购自北京全式金生物技术股份有限公司;限制性内切酶FastDigest Eco R I和Nco I购自赛默飞世尔科技公司;Clon Express® Ultra One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司;单组分TMB显色液和ELISA终止液购自北京索莱宝科技有限公司;Plasmid Mini Kit购自Omega Bio-Tek公司;弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司;山羊抗小鼠HRP-IgG和FITC-IgG购自武汉赛维尔生物科技有限公司。
1.2 CD25基因的扩增
根据NCBI上猪源CD25的全基因序列(登录号:NM_213835.1) ,设计猪源CD25基因胞外区片段(672 bp)引物,上游引物为CD25-F:5′-taagaaggagatataccatggcgcatcatcatcatcatcacGGGGCTTGCGTTCAGCAG-3′;下游引物为CD25-R:5′-ttgtcgacggagctcgaattcttaCTGATACTGTGTTGTAAATATGATTGGC-3′(引物中的小写字母代表载体同源臂、终止密码子、保护碱基以及6×his标签,大写字母代表目的基因的引物序列),由福州铂尚生物科技有限公司合成,可扩增出737 bp(CD25基因胞外区片段加上载体同源臂、终止密码子、保护碱基以及6×his标签)的基因片段。提取猪脾脏总RNA,以总RNA为模板进行反转录,反应体系(20 μL):5×gDNA Digester Mix 4 μL,10×Hifair® III Super Buffer 2 μL,Hifair® III RT Enzyme Mix 1 μL,随机引物 N6 (50 μmol·L−1) 1 μL,总RNA 10 pg~5 μg,加无RNA酶 H2O至20 μL。反应条件为:25 ℃ 5 min,55 ℃ 30 min,85 ℃ 5 min。将逆转录的cDNA作为PCR反应模板,PCR反应体系(50 μL) :5 × PrimeSTAR Buffer 10 μL,dNTP Mixture (2.5 mmol·L−1) 4 μL,PrimeSTAR HS DNA Polymerase 0.5 μL,上游引物 1 μL,下游引物 1 μL,模板 100~200 ng,ddH2O补充至50 μL。反应条件为:95 ℃ 5 min,95 ℃ 30 s,59 ℃ 30 s,72 ℃ 45 s,32个循环;72 ℃ 延伸10 min。扩增后用1%琼脂糖凝胶电泳进行检测。
1.3 pET-28a-CD25重组质粒的构建
使用FastDigest Eco R I和Nco I限制性核酸内切酶对pET-28a(+)质粒进行双酶切。载体酶切体系:载体pET-28a(+) 1 μg、Eco R I 1 μL、Nco I 1 μL、10 × Buffer 1 μL、ddH2O补充至20 μL。将目的片段与酶切后的pET-28a(+)载体进行同源重组,反应体系:线性化载体0.03 pmol,CD25基因片段0.06 pmol,2 × ClonExpress Mix 5 μL,ddH2O补充至10 μL,混匀后置于50 ℃水浴锅中5 min。然后将连接的产物转化至E.coli DH5α感受态细胞,并涂布于含有卡那霉素(50 μg·mL−1)的LB平板,37 ℃培养12 h,挑取单菌落接种在具有卡那霉素抗性的LB液体培养基中,37 ℃、180 r·min−1培养过夜。使用Plasmid Mini Kit试剂盒提取pET-28a-CD25重组质粒,将验证后的重组质粒通过擎科生物技术有限公司进行测序。将测序成功的重组质粒转化至表达感受态E.coli Transetta(DE3),将其命名为E.coli Transetta (DE3)-pET-28a-CD25。
1.4 6×His-CD25重组蛋白的诱导表达和可溶性分析
将构建好的表达菌株E.coli Transetta (DE3)-pET-28a-CD25接种于含卡那霉素抗性的LB液体培养基中,37 ℃、180 r·min−1培养至OD600值约为0.6时,向菌液中加入终浓度为0.2 mmol·L−1的IPTG,继续在30 ℃培养箱中培养6 h,收集菌体并用PBS重新悬浮清洗菌体。将诱导后的菌体进行超声破碎,离心后分别取沉淀和上清制备蛋白样,然后进行SDS-PAGE电泳分析。
1.5 6×His-CD25重组蛋白的纯化和复性
使用结合缓冲液(20 mmol·L−1咪唑溶液+ 8 mol·L−1尿素)平衡镍柱,将蛋白样本通过恒流泵流入镍柱。然后用洗涤缓冲液(200 mmol·L−1咪唑溶液+ 8 mol·L−1尿素)洗去杂蛋白,最后用洗脱缓冲液(300 mmol·L−1咪唑溶液+8 mol·L−1尿素)洗脱目的蛋白,通过SDS-PAGE检测蛋白的纯化情况。将纯化后的蛋白溶液转移到超滤管中,4 ℃、
4000 r·min−1离心至剩余3 mL液体。然后梯度减少加入复性缓冲液(尿素浓度0~7 mol·L−1)再次离心至剩余3 mL液体。当复性缓冲液中的尿素浓度低于2 mol·L−1并且没有沉淀时,则蛋白复性完成。1.6 单克隆抗体的制备
1.6.1 小鼠免疫
纯化并复性后的重组蛋白与免疫佐剂按体积比1∶1乳化,然后采用背部皮下多点注射的方法进行注射免疫BALB/c小鼠,每只小鼠每次免疫注射100 μg重组蛋白。免疫间隔14 d,连续免疫3次,免疫3次后通过尾静脉采血的方法制备小鼠多抗血清。在第3次免疫14 d后,使用不加佐剂的100 μg重组蛋白注射免疫阳性小鼠腹腔,进行加强免疫。加强免疫3 d后取小鼠的脾细胞与骨髓瘤细胞进行融合。
1.6.2 间接ELISA筛选方法的建立
用方阵滴定法确定抗原浓度及免疫鼠血清稀释度,将重组蛋白使用碳酸盐缓冲液进行梯度稀释:
2500 、1250 、625、312.5、156.25、78.15、39.06、19.53、9.77、4.88、2.44、1.22 ng·mL−1,按每孔100 μL加入酶标板。一抗免疫鼠血清的稀释度为1∶1000 至1∶64000 ,每个蛋白包被的浓度设 1个PBS阴性对照。二抗(HRP标记的羊抗鼠IgG)用PBST配制的浓度为3%的牛奶进行1∶5000 稀释,每孔100 μL加入酶标板内,显色后加入终止液,测定OD450值。在OD450值约为1时,其对应的浓度就是抗原包被和一抗的最佳稀释度。1.6.3 细胞融合和杂交瘤细胞的筛选
选择加强免疫后多抗血清效价最高的小鼠,将脾脏置于无血清的
1640 培养基内,用无菌的70 μm尼龙细胞筛将脾脏研磨碎,然后滴加无血清的1640 培养基过滤出脾细胞。将滤液2000 r·min−1离心10 min弃去上清,加入适量的1640 培养基并计数。将生长状况良好SP 2/0细胞与脾细胞按照1∶5~1∶10的比例混匀,2000 r·min−1,离心10 min,离心后在1 min内加入1 mL 37 ℃预热后的50% PEG 4000溶液中。然后用无血清的1640 培养基终止融合(尽量在90 s内完成),2000 r·min−1离心10 min弃去上清,加入20% FBS HAT1640 培养基将细胞数稀释至每板2×106个。最后每孔100 μL加入含饲养层细胞的96孔细胞培养皿中培养。融合后用间接ELISA法检测细胞培养液上清的抗体效价,阴性对照用SP2/0细胞的上清,3次重复。将检测阳性的孔进行亚克隆,直至上清阳性率达100%,表明成功筛选到稳定分泌单一抗体的杂交瘤细胞。1.6.4 小鼠单抗腹水的诱导
一组小鼠用弗氏不完全佐剂提前1 d注射小鼠腹腔,1 d后将杂交瘤细胞注射进小鼠的腹腔内;另一组小鼠用液体石蜡提前7 d注射小鼠腹腔,7 d后将杂交瘤细胞注射进小鼠的腹腔内。两组小鼠饲养7 d后抽取小鼠腹水,
8000 r·min−1、4 ℃离心5 min,上清即为单克隆抗体腹水。1.7 单克隆抗体的鉴定
1.7.1 单克隆抗体效价的测定
按照1.6.2中确定的最佳抗原浓度包被酶标板,将腹水上清从1∶
1000 稀释至1∶64000 ,测定OD450值。选择OD450值≥0.2、P/N值≥2.1且最高的腹水稀释倍数为抗体效价。1.7.2 单克隆抗体的稳定性分析和Western blotting验证
使用间接ELISA检测杂交瘤细胞冻存前、复苏后以及连续培养至第五代和第十代的细胞培养液上清中抗体效价是否发生变化。利用Western blotting检测单克隆抗体的特异性,用制备的重组蛋白、其他His标签签白(6×His-LAG3)和BSA蛋白作为对照,以CD25单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,验证抗体的特异性。
1.7.3 单克隆抗体的间接免疫荧光(indirect immunofluorescence assay, IFA)鉴定
将pEGFP-C1质粒用Nhe I和EcoR I内切酶将荧光片段切除,使用同源重组的方法将CD25基因片段与酶切后的线性载体连接,构建pEGFP-CD25重组质粒。构建pEΔgfp-CD25重组质粒(质粒上的荧光标签已切除) ,重组质粒转染进293T细胞后,真核表达CD25蛋白。使用间接免疫荧光试验(IFA),以2F4杂交瘤细胞产生的单克隆抗体为一抗,山羊抗鼠FITC-IgG为二抗,孵育后用PBS清洗3次,然后在倒置荧光显微镜下观察并拍照。
1.7.4 单克隆抗体的应用
取猪的脾脏、肺脏和淋巴组织制备蛋白样品,以制备的单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,使用Western blotting验证单克隆抗体能否与猪组织中的CD25蛋白结合。
2. 结果与分析
2.1 pET28a-CD25重组质粒的构建
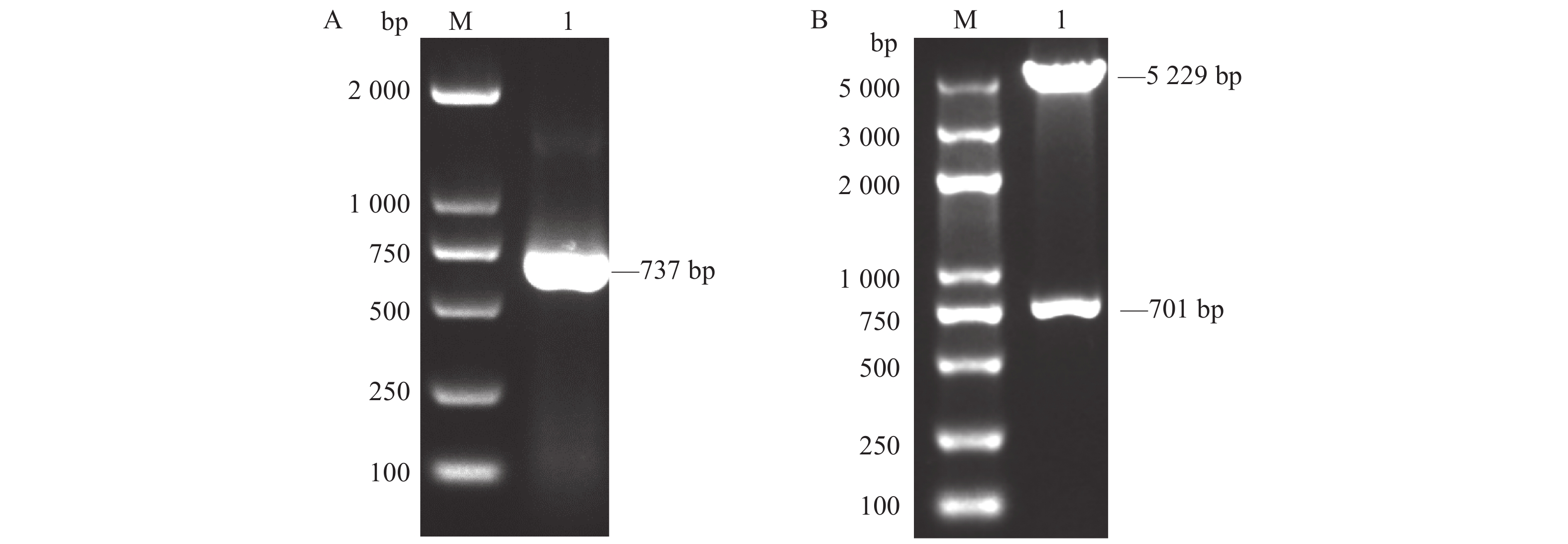
利用PCR技术扩增 CD25目的片段,PCR电泳结果如图1A所示,扩增片段大小为737 bp,电泳结果与预期相符。将扩增的CD25连接至pET-28a质粒后经EcoR Ⅰ和Nco Ⅰ双酶切后,酶切产物大小为701 bp(CD25基因胞外区片段加上终止密码子、保护碱基、6×his标签以及剩余的酶切位点部分碱基),表明pET28a-CD25重组质粒构建完成(图1B)。然后将pET28a-CD25重组质粒测序,测序结果进一步比对后发现序列与参考序列一致,表明pET28a-CD25重组质粒构建成功。
![]() 图 1 pET-28a-CD25重组质粒的构建A:CD25基因的扩增;M:DNA Marker-2000;1∶CD25基因。B:pET-28a-CD25重组质粒的双酶切鉴定;M:DNA Marker-5000;1∶pET-28a-CD25。Figure 1. Construction of pET-28a-CD25 recombinant plasmidA: amplification of CD25; M: DNA marker-2000; 1: CD25. B: identification of recombinant plasmid of pET-28a-CD25 by double enzyme digestion; M: DNA marker-5000; 1: pET-28a-CD25.
图 1 pET-28a-CD25重组质粒的构建A:CD25基因的扩增;M:DNA Marker-2000;1∶CD25基因。B:pET-28a-CD25重组质粒的双酶切鉴定;M:DNA Marker-5000;1∶pET-28a-CD25。Figure 1. Construction of pET-28a-CD25 recombinant plasmidA: amplification of CD25; M: DNA marker-2000; 1: CD25. B: identification of recombinant plasmid of pET-28a-CD25 by double enzyme digestion; M: DNA marker-5000; 1: pET-28a-CD25.2.2 6×His-CD25重组蛋白的诱导表达和可溶性分析
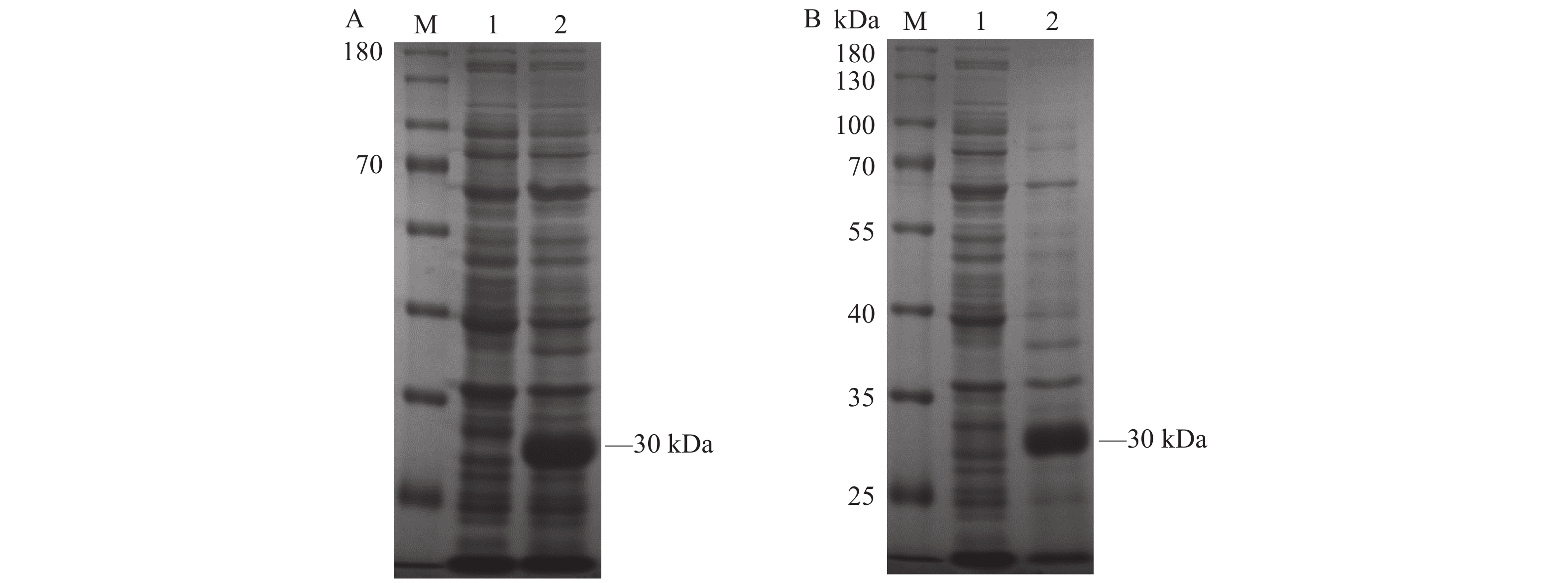
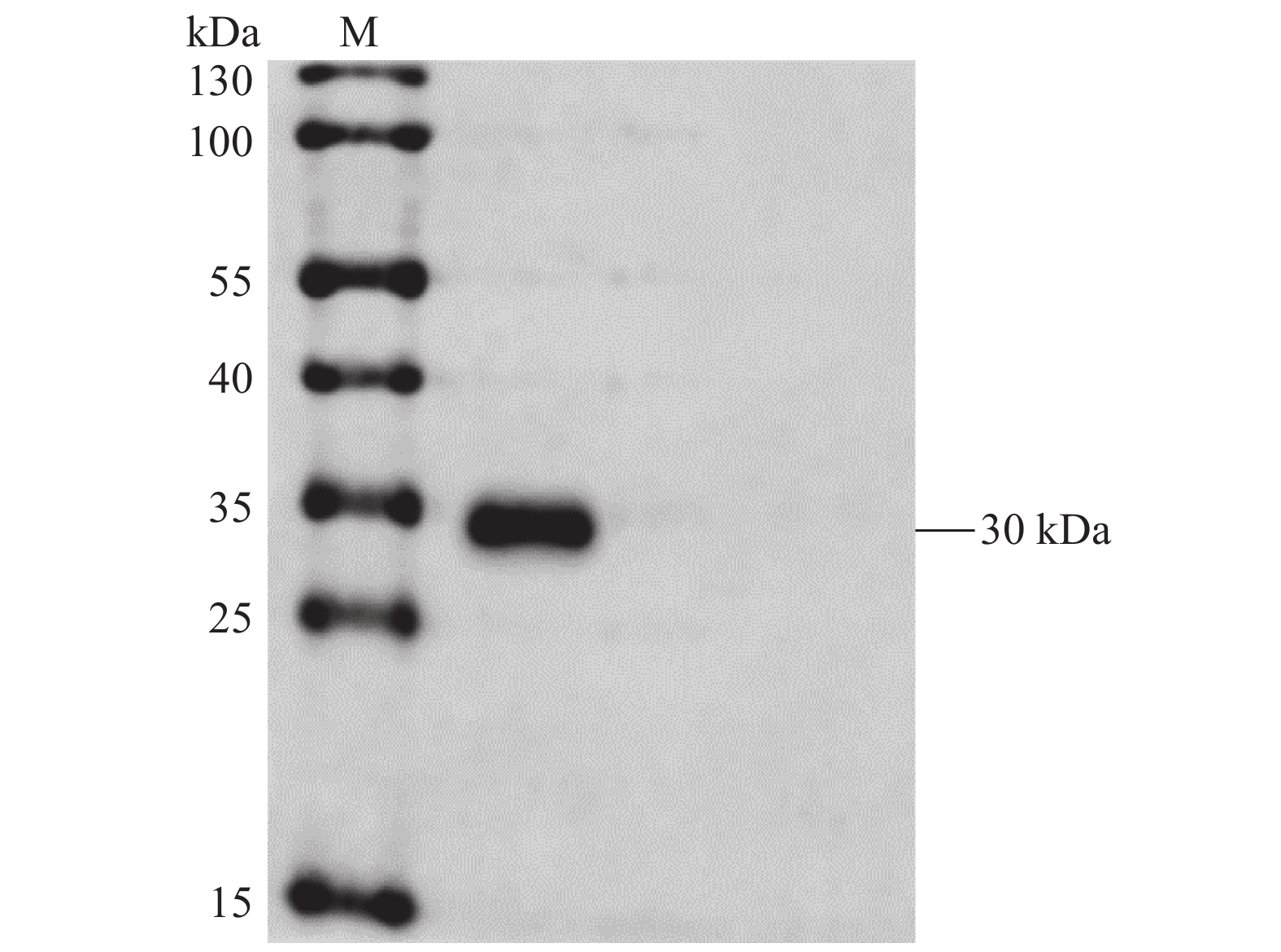
将构建的pET28a-CD25重组质粒成功转化入原核表达菌株E.coli Transetta (DE3)中,在37 ℃摇床内培养至OD600 ≈ 0.6后,向菌液中加入终浓度为0.2 mmol·L−1 IPTG诱导培养6 h,经SDS-PAGE电泳鉴定,在30 kDa处出现一条与预期大小一致的高表达目的条带(图2A),表明6×His-CD25重组蛋白诱导表达成功。选取诱导表达后的菌体进行超声破碎,分别取上清和沉淀,通过SDS-PAGE电泳分析,从图2B中可以看出6×His-CD25重组蛋白主要以包涵体的形式存在。
![]() 图 2 重组蛋白的诱导表达和可溶性分析A:6×His-CD25重组蛋白SDS-PAGE分析结果;M:蛋白Marker;1:空载体pET28a(+) 诱导后的全菌体蛋白;2:E.coli Transetta (DE3)-pET28a-CD25诱导后的全菌体蛋白。 B:6×His-CD25重组蛋白可溶性鉴定;M:蛋白Marker;1:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的上清;2:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的沉淀。Figure 2. Induced expression and solubility analysis of recombinant proteinA: SDS-PAGE analysis on 6×His-CD25 recombinant protein; M: protein marker; 1: whole cell protein induced by empty carrier pET-28a(+); 2: whole cell protein induced by E.coliTransetta (DE3)-pET28a-CD25; B: solubility identification of 6×His-CD25 recombinant protein; M: protein marker; 1: supernatant of E.coli Transetta (DE3)-pET28a-CD25 after ultrasonic crushing; 2: E.coli Transetta (DE3)-pET28a-CD25 precipitate after ultrasonic crushing.
图 2 重组蛋白的诱导表达和可溶性分析A:6×His-CD25重组蛋白SDS-PAGE分析结果;M:蛋白Marker;1:空载体pET28a(+) 诱导后的全菌体蛋白;2:E.coli Transetta (DE3)-pET28a-CD25诱导后的全菌体蛋白。 B:6×His-CD25重组蛋白可溶性鉴定;M:蛋白Marker;1:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的上清;2:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的沉淀。Figure 2. Induced expression and solubility analysis of recombinant proteinA: SDS-PAGE analysis on 6×His-CD25 recombinant protein; M: protein marker; 1: whole cell protein induced by empty carrier pET-28a(+); 2: whole cell protein induced by E.coliTransetta (DE3)-pET28a-CD25; B: solubility identification of 6×His-CD25 recombinant protein; M: protein marker; 1: supernatant of E.coli Transetta (DE3)-pET28a-CD25 after ultrasonic crushing; 2: E.coli Transetta (DE3)-pET28a-CD25 precipitate after ultrasonic crushing.2.3 6×His-CD25重组蛋白的纯化和复性
鉴于6×His-CD25重组蛋白主要以包涵体形式存在,因此利用高浓度的尿素溶液使蛋白质中的二级结构打开暴露6×His标签,然后通过镍亲和层析对6×His-CD25重组蛋白进行纯化。SDS-PAGE电泳结果(图3)显示,在预期的大小位置有明显条带,且条带单一,表明获得了纯度较高的6×His-CD25重组蛋白。为了让变性纯化后的重组蛋白恢复到天然的构象,采用尿素浓度梯度法对纯化后的组蛋白进行复性,复性后的6×His-CD25重组蛋白未产生沉淀,可作为免疫小鼠所需的抗原。
2.4 间接ELISA最佳反应条件的确定
小鼠第3次免疫后,采集小鼠尾静脉血液,制备多抗血清。将抗原和多抗血清进行倍比稀释,用间接ELISA法确定最佳抗原包被浓度和血清稀释倍数,OD450吸光度最接近1.0为最佳抗原包被浓度和血清稀释倍数。结果显示,6×His-CD25重组蛋白的最佳包被浓度为31.25 ng·mL−1,最佳阳性血清稀释倍数为1∶
16000 (表1)。表 1 6×His-CD25重组蛋白不同抗原包被浓度和血清稀释倍数下的OD450值Table 1. OD450 under optimum antigen coating concentration and serum dilution multiple of 6×His-CD25 recombinant protein血清类型
Serum type稀释倍数
Dilution times抗原包被浓度
Antigen coating concentration250/(ng·mL−1) 125/(ng·mL−1) 62.5/(ng·mL−1) 31.25/(ng·mL−1) 15.63/(ng·mL−1) 7.81/(ng·mL−1) 3.91/(ng·mL−1) 1.95/(ng·mL−1) 阳性血清稀释倍数
Positive serum dilution1∶ 2000 OVER OVER OVER OVER 3.317 3.100 2.977 2.790 1∶ 4000 OVER OVER OVER 2.573 1.873 1.723 1.417 1.227 1∶ 8000 OVER OVER 2.556 1.981 1.583 1.124 0.925 0.810 1∶ 16000 OVER 2.661 1.854 1.068 0.692 0.352 0.252 0.265 1∶ 32000 2.221 1.622 0.826 0.444 0.189 0.137 0.129 0.147 1∶ 64000 1.569 0.871 0.356 0.152 0.125 0.108 0.086 0.123 阴性血清
Negative serum0.060 0.077 0.076 0.078 0.079 0.069 0.056 0.056 OVER表示OD450处的吸光度大于4.0。表2同。
OVER: OD450 greater than 4.0. Same for Table 2.2.5 单克隆抗体的制备
2.5.1 杂交瘤细胞的筛选
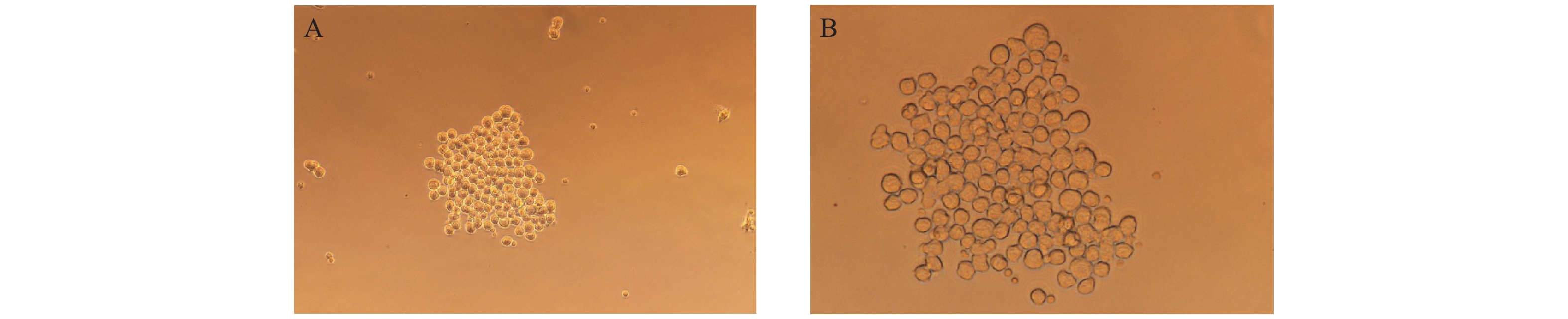
免疫阳性小鼠进行加强免疫后,取小鼠的脾细胞与骨髓瘤细胞进行细胞融合。通过间接ELISA法检测细胞培养液上清中的抗体效价,成功分选出一株阳性单克隆细胞株,将其命名为2F4。显微镜观察细胞形态如图4所示,单一的细胞经过繁殖,聚集成团状,且细胞生长良好。
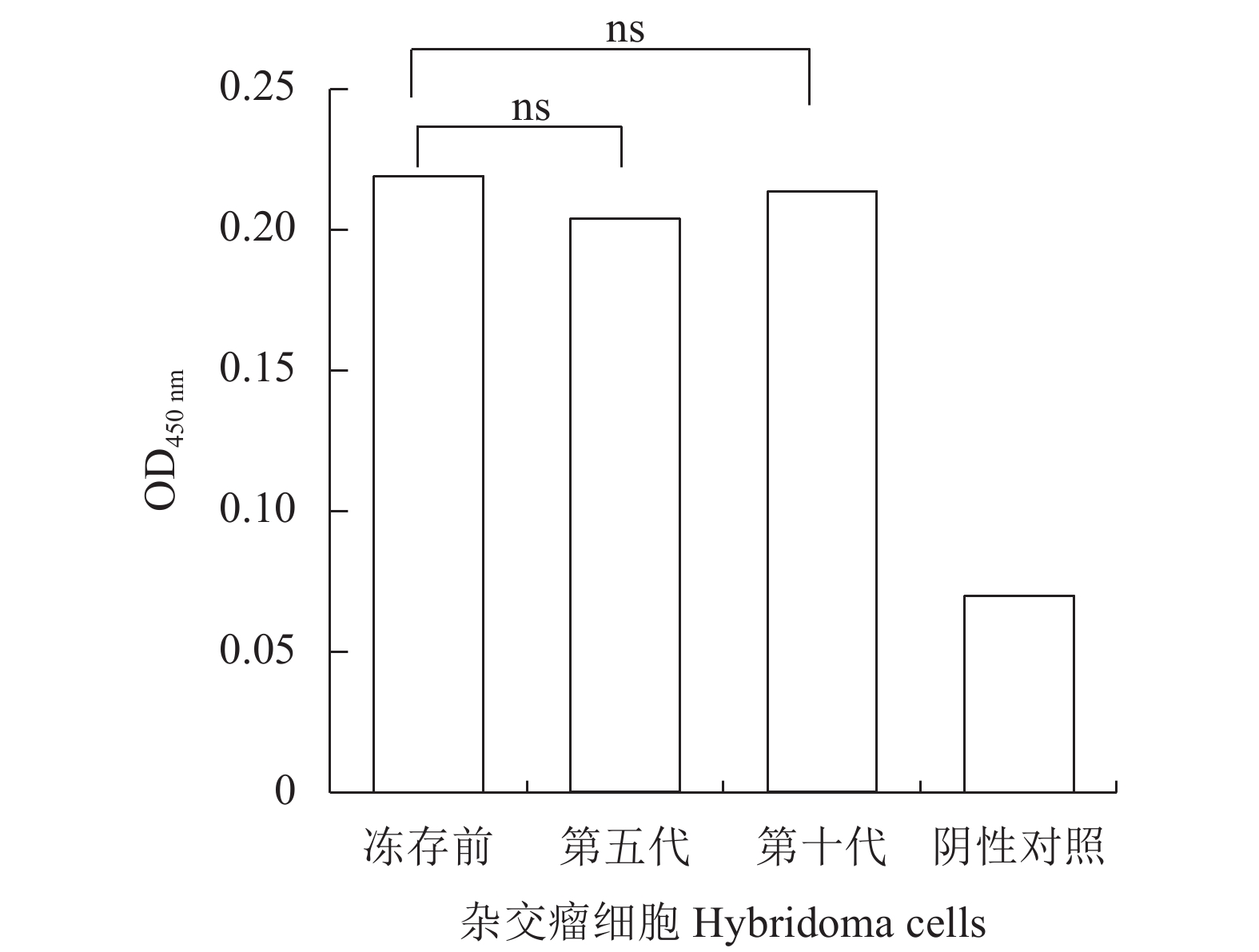
2.5.2 杂交瘤细胞株分泌的稳定性分析
杂交瘤细胞冻存以及连续传代,其分泌的抗体效价可能会发生变化。检测冻存前以及复苏后的杂交瘤细胞的抗体效价分别为1∶
64000 和1∶32000 (表2)。连续培养至第五代和第十代的细胞培养液上清稀释64000 倍,其OD450值也未表现出显著差异(图5),表明2F4杂交瘤细胞在经过冻存以及连续传代之后产生抗体的能力较稳定。表 2 杂交瘤细胞冻存前后的培养液上清抗体效价Table 2. Antibody titer of hybridoma cell supernatant before and after cryopreservation杂交瘤细胞
Hybridoma cells上清稀释倍数
Supernatant dilution factor1∶ 1000 1∶ 2000 1∶ 4000 1∶ 8000 1∶ 16000 1∶ 32000 1∶ 64000 1∶ 128000 冻存前
Before cryopreservationOVER 3.729 2.787 1.725 0.933 0.457 0.216 0.096 复苏后
After resuscitationOVER 2.912 2.188 1.287 0.742 0.293 0.177 0.087 阴性对照
Negative control0.049 0.049 0.051 0.050 0.051 0.050 0.049 0.051 2.6 不同诱导佐剂的单克隆抗体效价
收集弗氏不完全佐剂组和液体石蜡组小鼠腹水,用间接ELISA法分别检测两组小鼠腹水的效价,弗氏不完全佐剂组和液体石蜡组的小鼠腹水中单克隆抗体的效价分别为1∶
4096000 和1∶2048000 (表3)。结果表明用弗氏不完全佐剂诱导产生的腹水抗体效价比较高,而且有效缩短了诱导小鼠产生腹水的时间。表 3 小鼠腹水单克隆抗体效价Table 3. Monoclonal antibody titer of mouse ascites诱导佐剂
Adjucant type小鼠腹水稀释倍数
Ascites dilution factor in mice1∶ 128000 1∶ 256000 1∶ 512000 1∶ 1024000 1∶ 2048000 1∶ 4096000 弗氏不
完全佐剂
Freund's incomplete adjuvant3.670 3.279 2.444 1.356 0.722 0.256 液体石蜡
Liquid paraffin2.552 1.539 0.899 0.409 0.209 0.090 阴性对照
Negative control0.046 0.046 0.047 0.046 0.047 0.050 2.7 单克隆抗体的间接ELISA和Western blotting鉴定
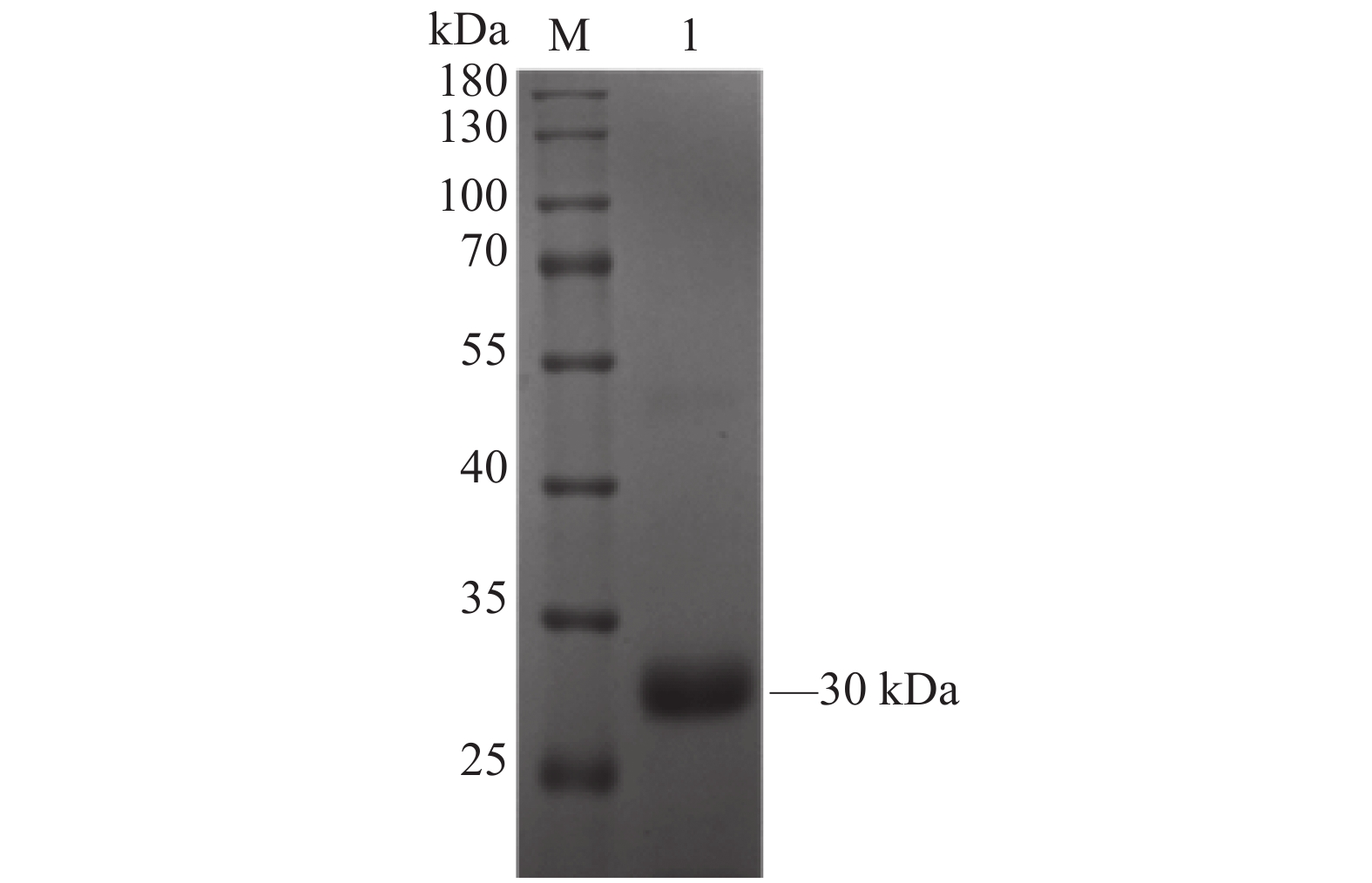
本试验中免疫小鼠的抗原和间接ELISA法包被的抗原都带有6×His标签,因此需要排除6×His标签的假阳性结果。使用其他6×His标签蛋白(6×His-LAG3)和牛血清白蛋白(BSA)作为对照,间接ELISA结果显示OD450为0.065和0.051,6×His-CD25组的OD450为3.738。Western blotting结果如图6所示,2F4杂交瘤细胞产生的抗体不与表达菌株E.coli Transetta (DE3)中的其他菌体蛋白发生反应。结合两个试验结果表明,2F4杂交瘤细胞产生的抗体可以特异性地结合CD25蛋白,不与6×His标签以及其他蛋白发生免疫反应。
![]() 图 6 Western blotting检测单克隆抗体的特异性结果M:蛋白Marker;1:CD25表达菌株诱导后全菌体蛋白;2:其他6×His标签蛋白;3:BSA(牛血清白蛋白)。Figure 6. Specificity of monoclonal antibody tested by western blottingM: protein marker; 1: whole cell protein induced by CD25 expression strain; 2. other 6×His tag proteins; 3: BSA (bovine serum albumin).
图 6 Western blotting检测单克隆抗体的特异性结果M:蛋白Marker;1:CD25表达菌株诱导后全菌体蛋白;2:其他6×His标签蛋白;3:BSA(牛血清白蛋白)。Figure 6. Specificity of monoclonal antibody tested by western blottingM: protein marker; 1: whole cell protein induced by CD25 expression strain; 2. other 6×His tag proteins; 3: BSA (bovine serum albumin).2.8 单克隆抗体的IFA鉴定
将2F4杂交瘤细胞产生的单克隆抗体为一抗,山羊抗鼠FITC-IgG为二抗进行IFA检测,结果如图7所示,2F4杂交瘤细胞产生的单克隆抗体能够与转染了pEΔgfp-CD25重组质粒的293T细胞结合使其产生荧光,且荧光强度强。由此表明,2F4杂交瘤细胞产生的单克隆抗体能够与真核细胞表达的CD25蛋白发生特异性免疫反应。
2.9 单克隆抗体的应用
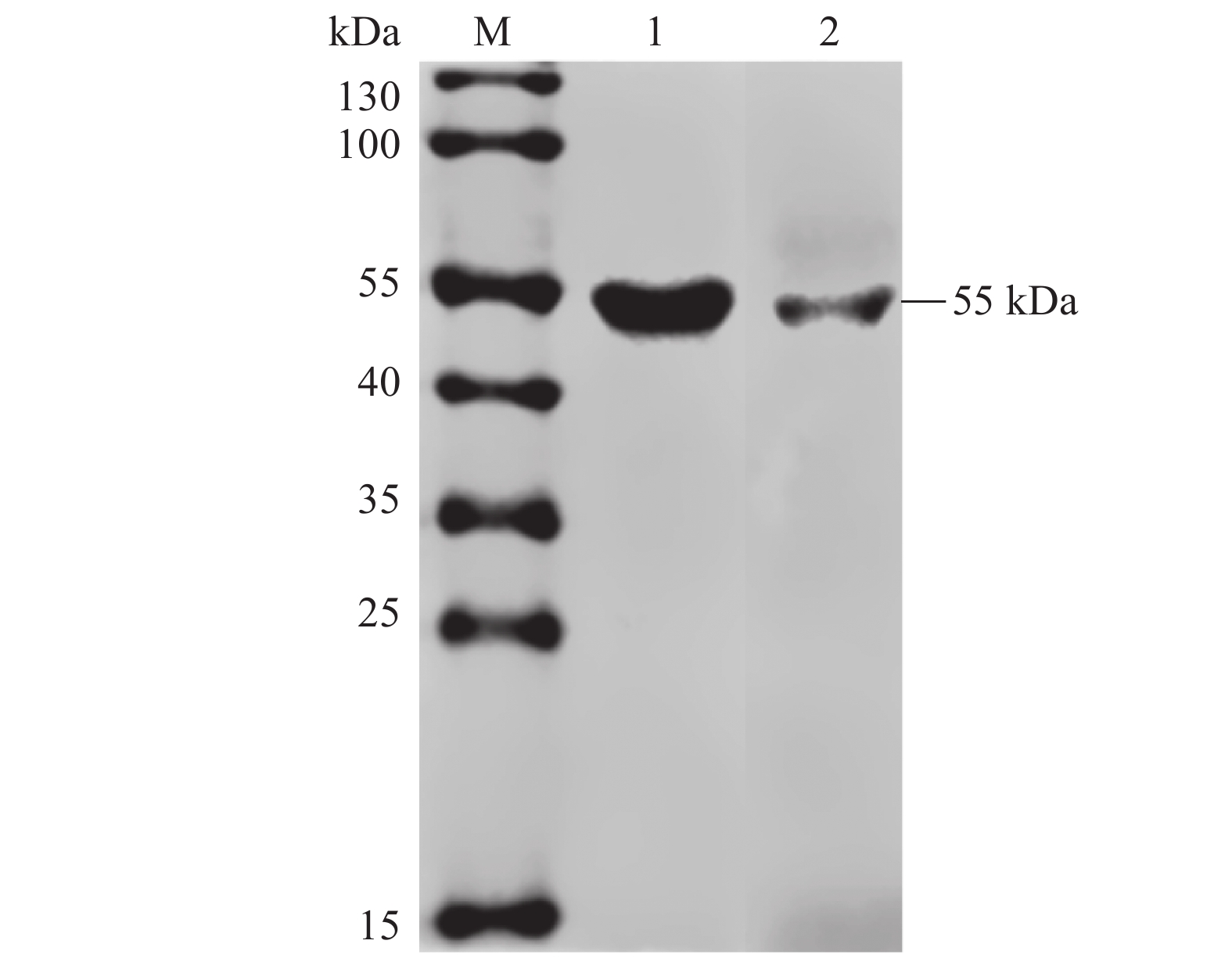
成熟的CD25蛋白是一种Ⅰ型跨膜蛋白,未成熟的CD25蛋白在高尔基体内经过修饰,与一段肽前体连接后,会定位到细胞膜上形成分子量大小约为55 kDa的IL-2受体的α链[31−34]。为了验证2F4杂交瘤细胞产生的单克隆抗体能否与猪组织中的CD25蛋白结合,取猪的脾脏和肺脏,制作组织蛋白样,2F4杂交瘤细胞产生的单克隆抗体为一抗,进行Western blotting检测分析,结果如图8显示,猪的脾脏和肺脏中均可检测出一条大小为55 kDa的条带,且没有杂带。表明2F4杂交瘤细胞产生的单克隆抗体能够特异性识别猪脾脏和肺脏中的CD25蛋白。
3. 讨论
调节性T细胞是一类与自身免疫反应相关的T细胞亚群,能够调控T细胞并参与多种免疫紊乱相关疾病的发展进程,在保持自身免疫耐受和抗感染、抗肿瘤细胞的免疫反应中起重要调节作用[35]。CD25在Treg细胞上面高度表达能够大量消耗机体内的IL-2,从而抑制CD8+ T细胞和NK细胞的炎症反应。Treg细胞可预防自身免疫性疾病的发作,对免疫稳态至关重要。若Treg细胞功能障碍会导致机体免疫功能紊乱,从而导致慢性炎症及自身免疫性疾病更加严重[36]。它们通过多种机制抑制自身反应性T细胞的活化、增殖和效应功能[37]。因此制备Treg细胞表面蛋白的抗体对于鉴定Treg细胞有着重要作用。
本研究通过RT-PCR的方法扩增猪源CD25基因,并使用同源重组构建E.coli Transetta (DE3)-pET28a-CD25重组质粒。通过原核表达系统制备6×His-CD25重组蛋白,作为抗原免疫BALB/c小鼠。然后经过杂交瘤技术,成功筛选出一株CD25单克隆抗体,其使小鼠产生腹水抗体的效价为1∶
4096000 。为了避免筛选过程中出现的非特异性,使用其他的6×His标签蛋白(6×His-LAG3)和牛血清白蛋白(BSA)作为对照,用间接ELISA和Western blotting验证,表明2F4杂交瘤细胞产生的抗体可以特异性地结合CD25蛋白。通过IFA试验,证明CD25单克隆抗体可以特异性识别体外表达的猪CD25蛋白。CD25氨基酸序列具有多个糖基化结合位点,所以经过修饰之后实际大小比预测的大。对人源、犬源和猪源的CD25氨基酸序列进行分析,结果显示三者的氨基酸大小最为接近。犬、人源CD25蛋白与猪源CD25蛋白分别有53.5%和55.2%的一致性,这就导致了人源和犬源的CD25单克隆抗体可以识别猪源CD25蛋白,并且已经研究表明,人源和犬源的CD25抗体所识别CD25蛋白大小约为55 kDa[34, 38]。Mandrioli等[39]使用其他物种的CD25抗体用来检测猪源CD25蛋白,发现该抗体会识别一个分子量大小约为55 kDa的蛋白质,然而现有针对猪源CD25蛋白的抗体在特异性和效价方面表现不佳,因此我们致力于研发一种具有更高特异性和效价的猪源CD25单克隆抗体以改善这一局限。通过Western blotting试验,使用猪脾脏和肺脏的组织蛋白样对CD25单克隆抗体进行验证,结果显示本试验制备的猪源CD25单克隆抗体在猪的脾脏和肺脏中检测到了大小约为55 kDa的条带,因此表明本试验制备的CD25单克隆抗体能够正确识别猪源的CD25蛋白。
综上,本研究利用原核表达系统成功获得了6×His-CD25重组蛋白,并制备了特异性强的CD25单克隆抗体。本研究制备的猪源CD25单克隆抗体针对猪源CD25蛋白具有更高的效价和特异性,有助于促进猪免疫抑制性传染病的研究,为定性或者定量检测猪源Treg细胞、验证猪源Treg细胞的功能奠定了基础。
-
图 1 pET-28a-CD25重组质粒的构建
A:CD25基因的扩增;M:DNA Marker-2000;1∶CD25基因。B:pET-28a-CD25重组质粒的双酶切鉴定;M:DNA Marker-5000;1∶pET-28a-CD25。
Figure 1. Construction of pET-28a-CD25 recombinant plasmid
A: amplification of CD25; M: DNA marker-2000; 1: CD25. B: identification of recombinant plasmid of pET-28a-CD25 by double enzyme digestion; M: DNA marker-5000; 1: pET-28a-CD25.
图 2 重组蛋白的诱导表达和可溶性分析
A:6×His-CD25重组蛋白SDS-PAGE分析结果;M:蛋白Marker;1:空载体pET28a(+) 诱导后的全菌体蛋白;2:E.coli Transetta (DE3)-pET28a-CD25诱导后的全菌体蛋白。 B:6×His-CD25重组蛋白可溶性鉴定;M:蛋白Marker;1:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的上清;2:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的沉淀。
Figure 2. Induced expression and solubility analysis of recombinant protein
A: SDS-PAGE analysis on 6×His-CD25 recombinant protein; M: protein marker; 1: whole cell protein induced by empty carrier pET-28a(+); 2: whole cell protein induced by E.coliTransetta (DE3)-pET28a-CD25; B: solubility identification of 6×His-CD25 recombinant protein; M: protein marker; 1: supernatant of E.coli Transetta (DE3)-pET28a-CD25 after ultrasonic crushing; 2: E.coli Transetta (DE3)-pET28a-CD25 precipitate after ultrasonic crushing.
图 6 Western blotting检测单克隆抗体的特异性结果
M:蛋白Marker;1:CD25表达菌株诱导后全菌体蛋白;2:其他6×His标签蛋白;3:BSA(牛血清白蛋白)。
Figure 6. Specificity of monoclonal antibody tested by western blotting
M: protein marker; 1: whole cell protein induced by CD25 expression strain; 2. other 6×His tag proteins; 3: BSA (bovine serum albumin).
表 1 6×His-CD25重组蛋白不同抗原包被浓度和血清稀释倍数下的OD450值
Table 1 OD450 under optimum antigen coating concentration and serum dilution multiple of 6×His-CD25 recombinant protein
血清类型
Serum type稀释倍数
Dilution times抗原包被浓度
Antigen coating concentration250/(ng·mL−1) 125/(ng·mL−1) 62.5/(ng·mL−1) 31.25/(ng·mL−1) 15.63/(ng·mL−1) 7.81/(ng·mL−1) 3.91/(ng·mL−1) 1.95/(ng·mL−1) 阳性血清稀释倍数
Positive serum dilution1∶ 2000 OVER OVER OVER OVER 3.317 3.100 2.977 2.790 1∶ 4000 OVER OVER OVER 2.573 1.873 1.723 1.417 1.227 1∶ 8000 OVER OVER 2.556 1.981 1.583 1.124 0.925 0.810 1∶ 16000 OVER 2.661 1.854 1.068 0.692 0.352 0.252 0.265 1∶ 32000 2.221 1.622 0.826 0.444 0.189 0.137 0.129 0.147 1∶ 64000 1.569 0.871 0.356 0.152 0.125 0.108 0.086 0.123 阴性血清
Negative serum0.060 0.077 0.076 0.078 0.079 0.069 0.056 0.056 OVER表示OD450处的吸光度大于4.0。表2同。
OVER: OD450 greater than 4.0. Same for Table 2.表 2 杂交瘤细胞冻存前后的培养液上清抗体效价
Table 2 Antibody titer of hybridoma cell supernatant before and after cryopreservation
杂交瘤细胞
Hybridoma cells上清稀释倍数
Supernatant dilution factor1∶ 1000 1∶ 2000 1∶ 4000 1∶ 8000 1∶ 16000 1∶ 32000 1∶ 64000 1∶ 128000 冻存前
Before cryopreservationOVER 3.729 2.787 1.725 0.933 0.457 0.216 0.096 复苏后
After resuscitationOVER 2.912 2.188 1.287 0.742 0.293 0.177 0.087 阴性对照
Negative control0.049 0.049 0.051 0.050 0.051 0.050 0.049 0.051 表 3 小鼠腹水单克隆抗体效价
Table 3 Monoclonal antibody titer of mouse ascites
诱导佐剂
Adjucant type小鼠腹水稀释倍数
Ascites dilution factor in mice1∶ 128000 1∶ 256000 1∶ 512000 1∶ 1024000 1∶ 2048000 1∶ 4096000 弗氏不
完全佐剂
Freund's incomplete adjuvant3.670 3.279 2.444 1.356 0.722 0.256 液体石蜡
Liquid paraffin2.552 1.539 0.899 0.409 0.209 0.090 阴性对照
Negative control0.046 0.046 0.047 0.046 0.047 0.050 -
[1] LUO H, ZHU Y, GUO B, et al. Causal relationships between CD25 on immune cells and hip osteoarthritis [J]. Frontiers in Immunology, 2023, 14: 1247710. DOI: 10.3389/fimmu.2023.1247710
[2] FONTENOT J D, RASMUSSEN J P, GAVIN M A, et al. A function for interleukin 2 in Foxp3-expressing regulatory T cells [J]. Nature Immunology, 2005, 6(11): 1142−1151. DOI: 10.1038/ni1263
[3] SAKAGUCHI S, SAKAGUCHI N, ASANO M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases [J]. Journal of Immunology (Baltimore, Md. : 1950), 1995, 155(3): 1151−1164. DOI: 10.4049/jimmunol.155.3.1151
[4] 刘莉, 姚军霞, 丁乾, 等. 非霍奇金淋巴瘤患者外周血CD4+CD25high调节性T细胞研究 [J]. 中国实验血液学杂志, 2006, 14(1):119−122. DOI: 10.3969/j.issn.1009-2137.2006.01.027 LIU L, YAO J X, DING Q, et al. CD4+ CD25high regulatory T cells in peripheral blood of patients with B cell non-Hodgkin’s lymphoma [J]. Journal of Experimental Hematology, 2006, 14(1): 119−122. (in Chinese) DOI: 10.3969/j.issn.1009-2137.2006.01.027
[5] HAN Y K, YU C C, YU Y, et al. CD25+ B cells produced IL-35 and alleviated local inflammation during experimental periodontitis [J]. Oral Diseases, 2022, 28(8): 2248−2257. DOI: 10.1111/odi.13939
[6] 安田丽, 李亮亮, 赵丽. 骨髓微环境影响调节性T细胞促进血液恶性肿瘤发展的研究进展 [J]. 中国免疫学杂志, 2021, 37(5):635−642. DOI: 10.3969/j.issn.1000-484X.2021.05.024 AN T L, LI L L, ZHAO L. Progress on influence of bone marrow microenvironment on regulatory T cells promoting development of hematological malignancies [J]. Chinese Journal of Immunology, 2021, 37(5): 635−642. (in Chinese) DOI: 10.3969/j.issn.1000-484X.2021.05.024
[7] TAGUCHI O, TAKAHASHI T. Administration of anti-interleukin-2 receptor alpha antibody in vivo induces localized autoimmune disease [J]. European Journal of Immunology, 1996, 26(7): 1608−1612. DOI: 10.1002/eji.1830260730
[8] MCHUGH R S, SHEVACH E M. Cutting edge: Depletion of CD4+CD25+ regulatory T cells is necessary, but not sufficient, for induction of organ-specific autoimmune disease [J]. Journal of Immunology, 2002, 168(12): 5979−5983. DOI: 10.4049/jimmunol.168.12.5979
[9] LOWENTHAL J W, ZUBLER R H, NABHOLZ M, et al. Similarities between interleukin-2 receptor number and affinity on activated B and T lymphocytes [J]. Nature, 1985, 315(6021): 669−672. DOI: 10.1038/315669a0
[10] HUSS D J, PELLERIN A F, COLLETTE B P, et al. Anti-CD25 monoclonal antibody Fc variants differentially impact regulatory T cells and immune homeostasis [J]. Immunology, 2016, 148(3): 276−286. DOI: 10.1111/imm.12609
[11] FLYNN M J, HARTLEY J A. The emerging role of anti-CD25 directed therapies as both immune modulators and targeted agents in cancer [J]. British Journal of Haematology, 2017, 179(1): 20−35. DOI: 10.1111/bjh.14770
[12] AMBROSETTI A, NADALI G, VINANTE F, et al. Soluble interleukin-2 receptor in hairy-cell leukemia: A reliable marker of disease [J]. International Journal of Clinical & Laboratory Research, 1993, 23(1): 34−37.
[13] DAMOISEAUX J. The IL-2 - IL-2 receptor pathway in health and disease: The role of the soluble IL-2 receptor [J]. Clinical Immunology, 2020, 218: 108515. DOI: 10.1016/j.clim.2020.108515
[14] ZHOU M, FANG H S, DU M, et al. The modulation of regulatory T cells via HMGB1/PTEN/β-catenin axis in LPS induced acute lung injury [J]. Frontiers in Immunology, 2019, 10: 1612. DOI: 10.3389/fimmu.2019.01612
[15] NIXON D F, AANDAHL E M, MICHAËLSSON J. CD4+CD25+ regulatory T cells in HIV infection [J]. Microbes and Infection, 2005, 7(7/8): 1063−1065.
[16] LUO Y, XUE Y, MAO L Y, et al. Activation phenotype of Mycobacterium tuberculosis-specific CD4+ T cells promoting the discrimination between active tuberculosis and latent tuberculosis infection [J]. Frontiers in Immunology, 2021, 12: 721013. DOI: 10.3389/fimmu.2021.721013
[17] WANG L S, CHOW K C, LI W Y, et al. Clinical significance of serum soluble interleukin 2 receptor-alpha in esophageal squamous cell carcinoma [J]. Clinical Cancer Research, 2000, 6(4): 1445−1451.
[18] NAKASE K, TSUJI K, TAMAKI S, et al. Elevated levels of soluble interleukin-2 receptor in serum of patients with hematological or non-hematological malignancies [J]. Cancer Detection and Prevention, 2005, 29(3): 256−259. DOI: 10.1016/j.cdp.2005.03.001
[19] ATANACKOVIC D, CAO Y R, LUETKENS T, et al. CD4+CD25+FOXP3+ T regulatory cells reconstitute and accumulate in the bone marrow of patients with multiple myeloma following allogeneic stem cell transplantation [J]. Haematologica, 2008, 93(3): 423−430. DOI: 10.3324/haematol.11897
[20] GUALCO G, CHIOATO L, WEISS L M, et al. Analysis of human T-cell lymphotropic virus in CD25+ anaplastic large cell lymphoma in children [J]. American Journal of Clinical Pathology, 2009, 132(1): 28−33. DOI: 10.1309/AJCP6Q7QMUVGMVMF
[21] YANO T, FUKUYAMA Y, YOKOYAMA H, et al. Interleukin-2 receptors in pulmonary adenocarcinoma tissue [J]. Lung Cancer, 1996, 16(1): 13−19. DOI: 10.1016/S0169-5002(96)00608-3
[22] TARTOUR E, MOSSERI V, JOUFFROY T, et al. Serum soluble interleukin-2 receptor concentrations as an independent prognostic marker in head and neck cancer [J]. Lancet, 2001, 357(9264): 1263−1264. DOI: 10.1016/S0140-6736(00)04420-2
[23] SCHWARTZ M, ZHANG Y, ROSENBLATT J D. B cell regulation of the anti-tumor response and role in carcinogenesis [J]. Journal for Immunotherapy of Cancer, 2016, 4: 40. DOI: 10.1186/s40425-016-0145-x
[24] WONGYANIN P, BURANAPRADITKUN S, CHOKESHAI-USAHA K, et al. Induction of inducible CD4+CD25+Foxp3+ regulatory T lymphocytes by porcine reproductive and respiratory syndrome virus (PRRSV) [J]. Veterinary Immunology and Immunopathology, 2010, 133(2/3/4): 170−182.
[25] SILVA-CAMPA E, MATA-HARO V, MATEU E, et al. Porcine reproductive and respiratory syndrome virus induces CD4+CD8+CD25+Foxp3+ regulatory T cells (Tregs) [J]. Virology, 2012, 430(1): 73−80. DOI: 10.1016/j.virol.2012.04.009
[26] KÄSER T, GERNER W, HAMMER S E, et al. Phenotypic and functional characterisation of porcine CD4+CD25(high) regulatory T cells [J]. Veterinary Immunology and Immunopathology, 2008, 122(1/2): 153−158.
[27] ŠTĚPÁNOVÁ K, ŠINKORA M. The expression of CD25, CD11b, SWC1, SWC7, MHC-II, and family of CD45 molecules can be used to characterize different stages of γδ T lymphocytes in pigs [J]. Developmental & Comparative Immunology, 2012, 36(4): 728−740.
[28] PICKERING B S, HARDHAM J M, SMITH G, et al. Protection against henipaviruses in swine requires both, cell-mediated and humoral immune response [J]. Vaccine, 2016, 34(40): 4777−4786. DOI: 10.1016/j.vaccine.2016.08.028
[29] SURADHAT S, SADA W, BURANAPRADITKUN S, et al. The kinetics of cytokine production and CD25 expression by porcine lymphocyte subpopulations following exposure to classical swine fever virus (CSFV) [J]. Veterinary Immunology and Immunopathology, 2005, 106(3/4): 197−208.
[30] LOWENTHAL J W, CORTHÉSY P, TOUGNE C, et al. High and low affinity IL 2 receptors: Analysis by IL 2 dissociation rate and reactivity with monoclonal anti-receptor antibody PC61 [J]. Journal of Immunology, 1985, 135(6): 3988−3994. DOI: 10.4049/jimmunol.135.6.3988
[31] ALLOUCHE M, SAHRAOUI Y , AUGERY-BOURGET Y, et al. Interleukin 2 receptors[J]. Leukemia research, 1990, 14(8): 699-703.
[32] LEONARD W J, DEPPER J M, CRABTREE G R, et al. Molecular cloning and expression of cDNAs for the human interleukin-2 receptor [J]. Nature, 1984, 311(5987): 626−631. DOI: 10.1038/311626a0
[33] KOKUHO T, HIRAIWA H, YASUE H, et al. Cloning and chromosomal assignment of the porcine interleukin-2 receptor alpha (IL-2Ralpha) gene [J]. Journal of Veterinary Medical Science, 2000, 62(8): 841−847. DOI: 10.1292/jvms.62.841
[34] ABRAMS V K, HWANG B, LESNIKOVA M, et al. A novel monoclonal antibody specific for canine CD25 (P4A10): Selection and evaluation of canine tregs [J]. Veterinary Immunology and Immunopathology, 2010, 135(3/4): 257−265.
[35] MALOY K J, POWRIE F. Regulatory T cells in the control of immune pathology [J]. Nature Immunology, 2001, 2(9): 816−822. DOI: 10.1038/ni0901-816
[36] 杨晓蓉, 杨启梅, 韩想利, 等. CD4+CD25+Foxp3+Treg细胞及其相关因子在梅尼埃病中的意义 [J]. 听力学及言语疾病杂志, 2022, 30(5):469−472. DOI: 10.3969/j.issn.1006-7299.2022.05.003 YANG X R, YANG Q M, HAN X L, et al. Clinical value of CD4+CD25+Foxp3+Treg cells and their related factors in Meniere’s disease [J]. Journal of Audiology and Speech Pathology, 2022, 30(5): 469−472. (in Chinese) DOI: 10.3969/j.issn.1006-7299.2022.05.003
[37] RONCAROLO M G, BATTAGLIA M. Regulatory T-cell immunotherapy for tolerance to self antigens and alloantigens in humans [J]. Nature Reviews Immunology, 2007, 7(8): 585−598. DOI: 10.1038/nri2138
[38] VOSS S D, SONDEL P M, ROBB R J. Characterization of the interleukin 2 receptors (IL-2R) expressed on human natural killer cells activated in vivo by IL-2: Association of the p64 IL-2R gamma chain with the IL-2R beta chain in functional intermediate-affinity IL-2R [J]. Journal of Experimental Medicine, 1992, 176(2): 531−541. DOI: 10.1084/jem.176.2.531
[39] MANDRIOLI L, SARLI G, ZENGARINI M, et al. Immunohistochemical MHC-II and interleukin 2-R (CD25) expression in lymph nodes of pigs with spontaneous postweaning multisystemic wasting syndrome (PMWS) [J]. Veterinary Pathology, 2006, 43(6): 993−997. DOI: 10.1354/vp.43-6-993




 下载:
下载: