Identification and Biological Characteristics of Pathogen of Passion Fruit Anthracnose in Guangxi
-
摘要:目的
明确广西百香果炭疽病病原菌及其生物学特性,为其防控提供理论依据。
方法采用植物组织分离法进行病原分离、致病性测定、形态特征观察,结合ITS、CAL和ApMat基因序列分析,鉴定引起广西百香果炭疽病的病原菌,并明确其生物学特性。
结果从典型症状的百香果炭疽病病斑组织中分离纯化获得一株代表性菌株tg3b1,经形态学鉴定、多基因序列分析及致病性测定,鉴定该病的病原菌为可可炭疽菌(Colletotrichum theobromicola)。该病原菌菌丝在25~28 ℃菌落直径最大,产孢量最多,显著高于其他温度条件(P<0.05,下同)。病原菌在pH为6.0时菌落直径最大,产孢量最多,显著高于其他pH条件。病原菌菌丝生长对光照条件不敏感,光照条件为光暗交替时产孢量最多,显著高于其他光照条件。菌丝在PSA培养基上菌落直径最大,显著大于其他8种培养基,在OA、PDA培养基上产孢量较多,均显著多于其他培养基。碳源为葡萄糖时菌落直径最大,菌丝生长密厚;碳源为D-果糖、葡萄糖时,其产孢量最多,显著多于除了乳糖以外的其他碳源条件。氮源为酵母粉时,其菌落直径最大,显著大于其他氮源;产孢量较多的氮源为甘氨酸、L-精氨酸,显著多于其他氮源。该病原菌菌丝致死条件为51 ℃处理10 min。
结论可可炭疽菌(C. theobromicola)是广西百香果炭疽病的病原菌,该病原菌菌丝生长最适宜的条件:温度25~28 ℃,pH 6.0,光照无要求,培养基为PSA,碳源为葡萄糖,氮源为酵母粉。最佳产孢条件:温度25~28 ℃,pH 6.0,光照为光暗交替,培养基为PSA,碳源为D-果糖、葡萄糖,氮源为甘氨酸、L-精氨酸。该病原菌的致死条件为51 ℃处理10 min。
Abstract:ObjectivePathogen causing anthracnose on Passiflora edulis in Guangxi was identified and its biological characteristics determined.
MethodTissue isolation method was employed to isolate as well as to examine the pathogenicity and colony characteristics on petri dishes of potential pathogens. Analysis on sequences of ITS, CAL, and ApMat was applied to confirm the pathogen identification.
ResultFrom the tissues of passion fruits showing typical anthracnose lesions, tg3b1 was isolated, purified, and identified to be Colletotrichum theobromicola. Statistically significant at P<0.05, the largest diameter mycelial colonies and most spores of the isolate were cultured at 25–28°C and pH 6.0; the mycelial growth was not sensitive to light conditions, but the spore production encouraged by alternated light and darkness; the colonies grew to larger diameter on a PSA medium than on 8 other media, while the spores more numerous on OA and PDA; the media using glucose for carbon produced colonies with bigger diameters and denser mycelia, as D-fructose and glucose boosted the spore production (but not so with lactose); the use of yeast powder for nitrogen rendered larger colonies, whereas the media formulated with glycine and L-arginine generated more spores; and the mycelium mortality could be induced in 10 min at 51°C.
ConclusionC. theobromicola was identified as the pathogen that caused anthracnose on passion fruits in Guangxi. In culture, it grew optimally at 25–28°C and pH 6.0 with no specific requirement for light on a PSA medium containing glucose and yeast powder. Maximal spore count was observed on a PSA medium consisting of D-fructose, glucose, glycine, and L-arginine at 25−28°C and pH 6.0 under alternated light and darkness. An exposure to 51°C for 10 min was lethal to the pathogen.
-
0. 引言
【研究意义】百香果(Passiflora edulis Sims),又名西番莲(Passiflora coerulea L.),属西番莲科(Passifloraceae)西番莲属(Passiflora),为热带、亚热带多年生常绿藤本浆果类果树[1]。百香果具有很高的营养价值和药用价值[2−4],因其果汁独特地融合了百余种水果的馥郁香气而得名百香果[5] ,深受广大消费者青睐。广西是全国最大的百香果产区,年产量达38万t[6],种植百香果已成为广西乡村振兴、农民增收的有效途径。随着百香果种植规模的不断扩大,百香果病虫害种类增加,危害程度愈发严重,项目团队成员于2022年11月首次在广西靖西百香果种植基地发现一种发生严重的果实炭疽病,后在南宁、钦州、百色、玉林等地陆续发现同样症状的病害,该病害病斑大、凹陷明显、小黑点密生,发病重时发病率高达31.6%,严重威胁百香果产业健康发展。百香果炭疽病研究虽已有相关报道,但前人所描述的病害症状与新发现的病害症状有所差异,赵晓珍等[7]认为不同地区病原菌种类存在差异。因此,鉴定广西百香果炭疽病病原菌,测定其生物学特性,对百香果炭疽病的科学防控及广西百香果产业健康快速发展具有重要意义。【前人研究进展】百香果炭疽病是一种危害严重的病害,病原菌种类多,主要有博宁炭疽菌(Colletotrichum boninense)[8]、胶孢炭疽菌(Colletotrichum gloesporioides)[9]、巴西炭疽菌(Colletotrichum brasiliense)[7,10]、短孢炭疽菌(Colletotrichum brevisporum)[11−12]、喀斯特炭疽菌(Colletotrichum karstii)[7,13] 、辣椒炭疽病菌(Colletotrichum capsici)[14]和桃炭疽病菌(Colletotrichum fructicola)[15]等。在生物学特性研究方面,冉飞等[13]的研究结果表明:百香果炭疽病病原菌喀斯特炭疽菌(C. karstii)生长最适温度为25 ℃,适宜pH为6~9,可高效利用蔗糖与甘氨酸,适宜培养基为萨氏(SDAY)培养基;在药剂防治筛选方面,冉飞等[13]研究表明:75%肟菌·戊唑醇WG对病原菌喀斯特炭疽菌C. karstii的抑制效果最好,其次为18.7%丙环·嘧菌酯SE、42.4%唑醚·氟酰胺SC、25%吡唑醚菌酯SC、50%咪鲜胺锰盐WP。【本研究切入点】目前,鲜见广西生态条件下百香果炭疽病病原菌鉴定及其生物学特性测定研究,引致广西百香果炭疽病的主要病原菌仍未明晰。【拟解决的关键问题】本研究采用形态学和多基因序列对广西百香果炭疽病的病原菌进行鉴定,同时对其生物学特性进行研究,以期明确广西百香果炭疽病病原菌及其生物学特性,为科学防控提供理论依据。
1. 材料与方法
1.1 病原菌的采集、分离与纯化
2022年11月首次在广西靖西百香果种植基地发现该病害,采集症状典型、病斑新鲜的炭疽病病果带回实验室快速进行分离。采用植物病原真菌常规分离法[16]进行病原菌分离、初步纯化,随后,通过单孢分离获得纯培养物,于PDA斜面培养基上培养后,置于4 ℃保存备用。
1.2 病原菌致病性测定
采集新鲜钦蜜9号品种百香果果实,分别选取长势一致、健康的未转黄果实和刚转黄果实,用无菌水清洗干净后置于75%酒精溶液中浸泡2 min后滤干备用,将活化后的病原菌接种至PDA培养基28 ℃培养6 d,用直径6 mm的打孔器打取菌丝块备用。
有伤接种:用一次性医用针头在果腹上轻轻扎3个孔,孔口间距离小于3 mm,将备好的菌丝块夹取至果腹刺伤位置,带菌丝面接触果实,每个果实接种2个点。无伤接种:将备好的菌丝块夹取至处理好的果腹位置,带菌丝面接触果实,每个果实接种2个点。将接种果实放在小培养皿上置于铺有多层无菌医用纱布保湿的接种磁盘,上面覆盖保鲜膜密封,置于28 ℃恒温培养箱进行培养。
试验设置3次重复,每次重复接种5个果实,以不接种菌块作为对照组,待发病后重新分离病原物,进行柯赫氏法则验证。
1.3 病原菌的鉴定
1.3.1 形态学鉴定
将直径6 mm单孢分离得到的病原菌的菌丝块接种在PDA平板上,置于28 ℃、黑暗条件下培养,定期观察并记录菌落颜色和形态,采用十字交叉法定时测量菌落生长速度,在光学显微镜下观察病原菌菌丝和孢子形态,随机选取100个分生孢子,测量其大小。根据参考文献[17],从形态上初步鉴定病原菌分类地位。
1.3.2 病原菌的分子生物学鉴定
病原菌菌株tg3b1单孢分离纯化后在PDA培养基上28 ℃恒温培养箱中培养6 d,采用杭州博日科技有限公司生产的Biospin真菌基因组DNA提试剂盒提取病原菌DNA,引物合成后对病原真菌ITS、CAL和ApMat基因序列进行PCR扩增,所用引物信息产物大小见表1;PCR扩增程序:95 ℃预变性3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 30 s,根据各引物退火温度(表1)退火15 s,35个循环;72 ℃延伸5 min,用1.2%琼脂糖凝胶电泳检测PCR产物纯度;对扩增产物进行双向测序,将所得基因序列在GenBank中进行BLAST比对,下载同时含有ITS、CAL和ApMat基因序列且相似性高的模式菌株及参考菌株序列,按照ITS、CAL和ApMat顺序依次拼接,进行同源性比较。用邻接法(NJ) 进行数据分析,通过MEGA 6.0软件构建系统发育进化树,确定分类地位。
表 1 基因序列PCR引物及扩增信息Table 1. PCR primers and amplification of gene sequence基因序列名称
Genetic sequence name引物名称
Primer name引物序列 (5′-3′)
Primer sequence产物大小
Product size/bp引物退火
Annealing temperature/ ℃CAL CL1C F:GAATTCAAGGAGGCCTTCTC 773 58 CL2C R:CTTCTGCATCATGAGGTGGAC ApMat CgDL-F6 F:AGTGGAGGTGCGGGACGTT 875 58 CgMAT1F2 R:TGATGTATCCCGACTACCG ITS ITS1 TCCGTAGGTGAACCTGCGG 500~750 56 ITS4 TCCTCCGCTTATTGATATGC 1.4 病原菌生物学特性
1.4.1 温度对病原菌菌丝生长及产孢量的影响
用光照培养箱设置5、10、15、20、25、28、30、35、40 ℃共9个温度条件。
1.4.2 pH对病原菌菌丝生长及产孢量的影响
用盐酸及氢氧化钠溶液把PDA培养基pH值调配至2.0、4.0、6.0、8.0、9.0、10.0、12.0共7个梯度。
1.4.3 光照对病原菌菌丝生长及产孢量的影响
光照条件设置为全黑暗(0 lx)、光暗交替(200 lx12 h/0 lx 12 h)、全光照(200 lx)。
1.4.4 培养基对病原菌菌丝生长及产孢量的影响
制备9种培养基:PDA(马铃薯葡萄糖)培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂20.0 g、蒸馏水
1000.0 mL;PSA(马铃薯蔗糖)培养基:马铃薯200.0 g、蔗糖20.0 g、琼脂20.0 g、蒸馏水1000.0 mL;CMA(玉米粉)培养基:玉米粉30.0 g,琼脂20.0 g,蒸馏水1000.0 mL;煎汁(百香果汁液)培养基:健康新鲜百香果枝叶200.0 g用水熬煮30 min,琼脂20.0 g,蒸馏水1000.0 mL;OA(燕麦)培养基:燕麦片30.0 g、琼脂20.0 g、蒸馏水1000.0 mL;WA (琼脂)培养基:琼脂15.0 g,蒸馏水1000.0 mL。SDA(蛋白胨沙氏琼脂)培养基:麦芽糖40.0 g、蛋白胨10.0 g、琼脂20.0 g、蒸馏水1000.0 mL。SDAY(沙氏)培养基:葡萄糖40.0 g、蛋白胨10.0 g、酵母浸出粉10.0 g、琼脂20.0 g、蒸馏水1000.0 mL。CAD(胡萝卜葡萄糖琼脂)培养基:胡萝卜100.0 g、葡萄糖20.0 g、琼脂20.0 g、蒸馏水1000.0 mL。1.4.5 碳源和氮源对病原菌菌丝生长及产孢量的影响
以Czapek为基础培养基(硝酸钠2.0 g;磷酸二氢钾1.0 g;氯化钾0.5g;硫酸镁MgSO4·7H2O 0.5 g;硫酸铁0.1 g;蔗糖30.0 g;蒸馏水
1000.0 mL,琼脂20.0 g),分别用等质量的甘油、葡萄糖、D-果糖、甘露醇、麦芽糖、乳糖、山梨醇、淀粉、D-木糖、蔗糖配制成10种含不同碳源的培养基,以不加碳源为对照;用等质量硝酸钠、L-精氨酸、氯化铵、DL-丙氨酸、磷酸二氢铵、L-赖氨酸、甘氨酸、牛肉膏、酵母粉、蛋白胨、尿素等11种氮源置换硝酸钠,配制成含不同氮源的培养基,以不加氮源为对照。挑取直径为6 mm的菌饼接种在不同培养基平板中央,每个处理重复4次,除1.4.1外其他均置于28 ℃恒温下暗培养5 d,采用十字交叉法测量菌落直径,培养11 d后血球计数板统计产孢量。
1.4.6 致死温度测定
第一阶段试验,取菌饼置于含5 mL灭菌水的离心管中,分别于40、45、50、55、60、65 ℃恒温水浴10 min,取出菌饼置PDA培养基上25 ℃倒置培养5 d,观察有无菌丝生长。第二阶段按相差1 ℃再试验,最终确定致死温度。
2. 结果与分析
2.1 病害症状及发病情况
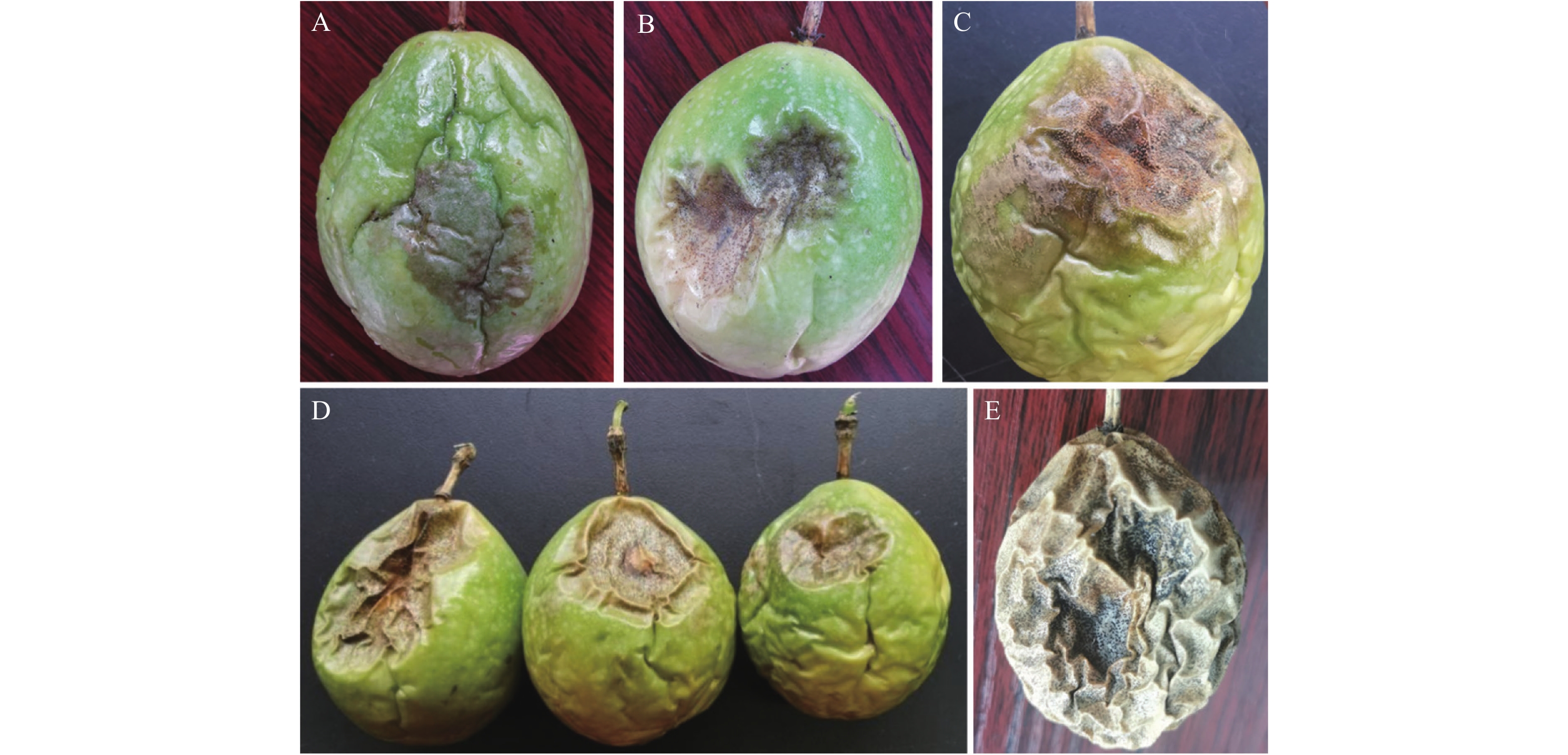
2022年9月,首次在广西靖西百香果种植基地发现一种严重的果实病害。病害发生初期,果皮表面开始出现不规则的暗墨色病斑(图1A);2~3 d后,病斑凹陷明显(图1B、D),病斑逐渐向四周扩展,暗褐色,其上密生小黑点;在潮湿条件下,长出许多朱红色胶状物(图1C);后期转变成黑色小颗物,病斑覆盖整个果皮表面,整个病果可脱水至萎缩干枯(图1E)。
2.2 病原菌致病性测定
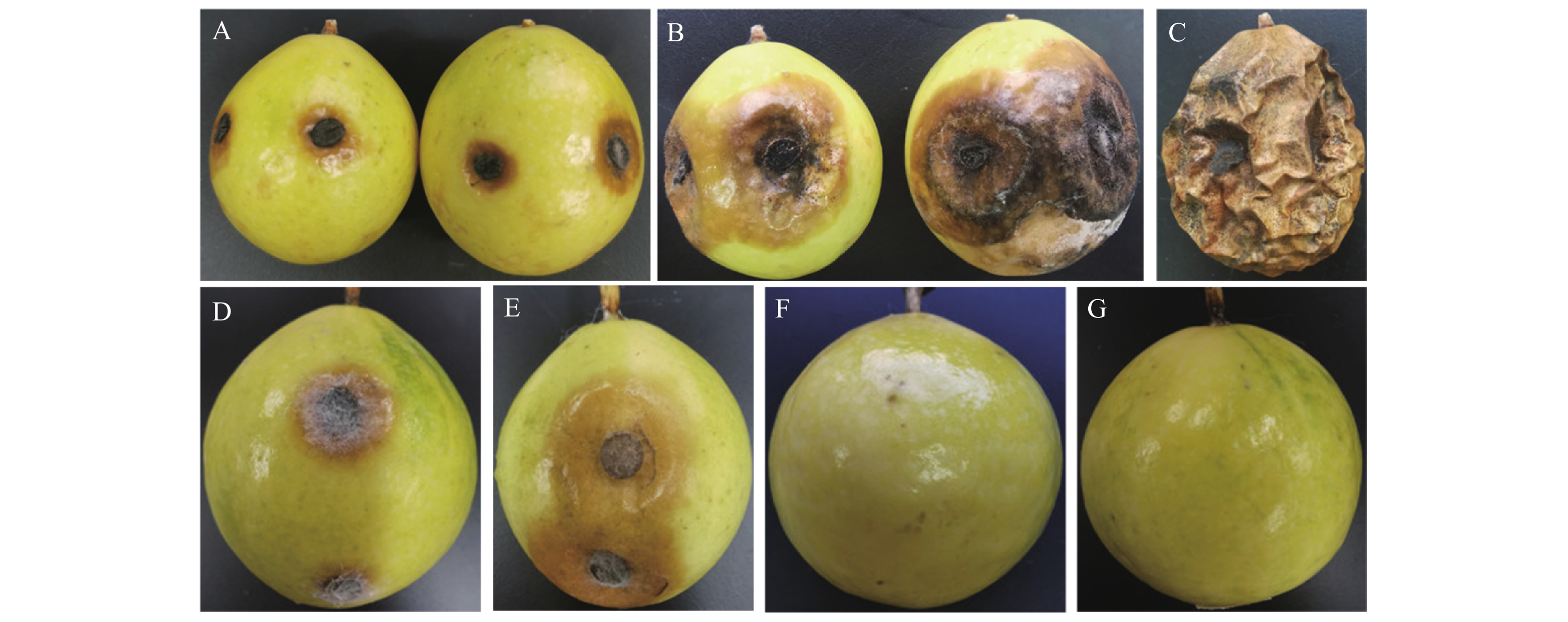
从8个病果的发病组织中共分离到10株形态特征相似的真菌分离物,经单孢纯化后,选择代表性菌株tg3b1进行致病性测定。伤口接种:恒温保湿培养3 d后接种部位出现明显的褐色凹陷病斑(图2A),随后病斑逐渐扩大;培养8 d后,病斑上产生大量许多朱红色胶状物,同时产生黑色小颗物(图2B),接种21 d后,病斑覆盖整个果皮表面,整个病果萎缩干枯(图2C)。无伤接种:其接种部位出现同样症状病斑(图2D),只是发病速度比有伤接种(图2E)发病速度稍慢;有伤接种对照、无伤接种对照均未发病(图2F、G);接种部位的果皮病斑与自然发病症状一致。从发病果实病斑上再次分离获得的病原菌形态特征与接种菌株tg3b1完全一致。根据柯赫氏法则,可以判定tg3b1菌株是百香果炭疽病的致病菌株。
![]() 图 2 百香果炭疽病致病性测定A:有伤接种后3 d;B:有伤接种后8 d;C:有伤接种后21 d;D:无伤接种后5 d;E:有伤接种后5 d ;F:有伤接种CK;G:无伤接种CK。Figure 2. Pathogenicity of anthracnose on passion fruitsA: 3 d after injury-causing inoculation; B: 8 d after injury-causing inoculation; C: 21 d after injury-causing inoculation; D: 5 d after non-injury inoculation; E: 5 d after injury-causing inoculation; F: CK of injury-causing inoculation; G: CK of non-injury inoculation.
图 2 百香果炭疽病致病性测定A:有伤接种后3 d;B:有伤接种后8 d;C:有伤接种后21 d;D:无伤接种后5 d;E:有伤接种后5 d ;F:有伤接种CK;G:无伤接种CK。Figure 2. Pathogenicity of anthracnose on passion fruitsA: 3 d after injury-causing inoculation; B: 8 d after injury-causing inoculation; C: 21 d after injury-causing inoculation; D: 5 d after non-injury inoculation; E: 5 d after injury-causing inoculation; F: CK of injury-causing inoculation; G: CK of non-injury inoculation.2.3 病原菌形态特征与分类地位
2.3.1 病原菌形态学特征
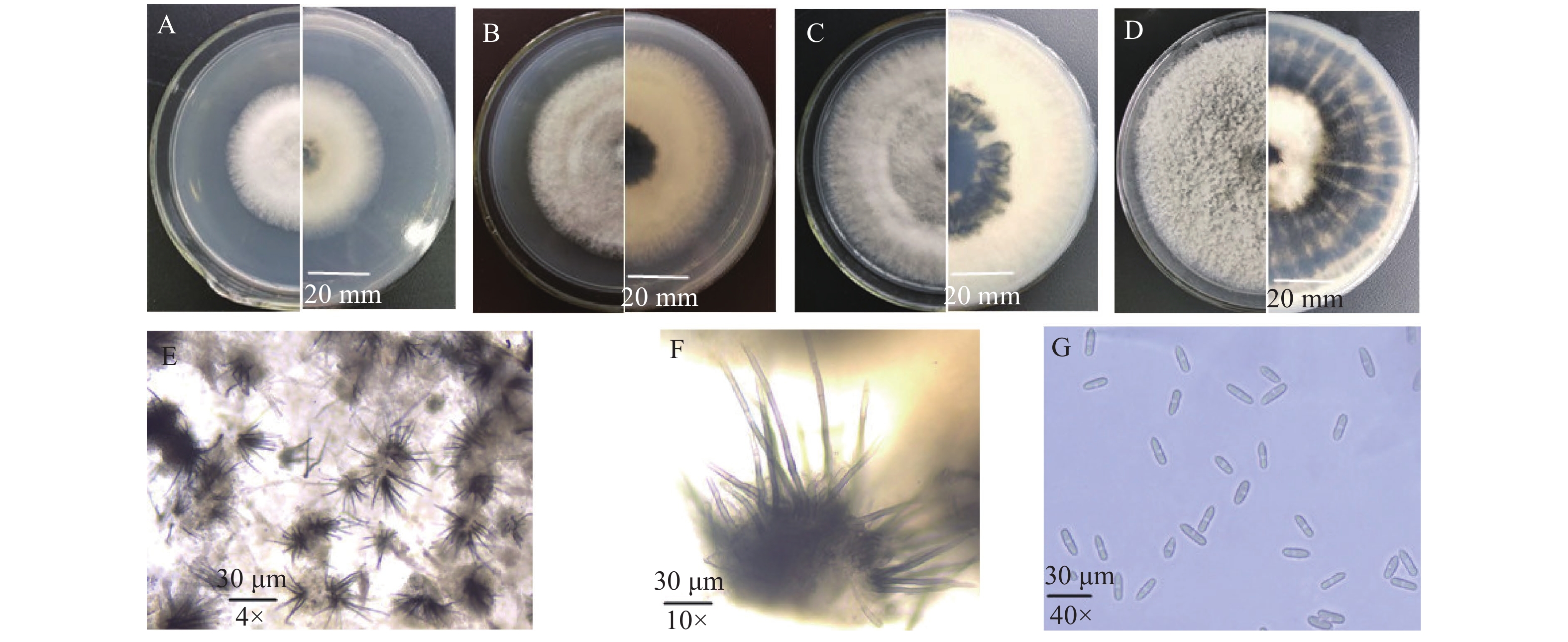
菌株tg3b1在PDA培养基上于28 ℃条件下培养,菌落生长速率为11.25~13.14 mm·d−1,气生菌丝极为茂密,菌落呈圆形,边缘整齐规则,菌落颜色随培养时间变化大,培养3 d后菌落正反面乳白色、背面中间有浅暗色小圈(图3A);培养5 d后正面浅灰色、背面淡黄色中间小圈墨绿色(图3B);培养7 d后正面灰色、背面墨绿扩大(图3C);培养10 d后正面灰色、背面皿底墨绿色(图3D)。在接种病斑上分生孢子盘黑色,有刚毛(图3E、F);分生孢子圆柱状,两端钝圆,基部常稍宽于顶端,常见具1个油球(图3G),大小为(11.73~23.4)µm×(4.2~6.9)µm,平均值X=17.24 µm×4.75 µm,n=100。tg3b1菌株分生孢子的形态学特征与田间采集样品徒手切片获得的结果相同。根据病原菌形态学特征,参考魏景超[17]的研究结果,初步判定tg3b1菌株为真菌界半知菌类腔孢纲黑盘孢目黑盘孢科Melanconiaceae 真菌。
2.3.2 病原菌分子生物学鉴定
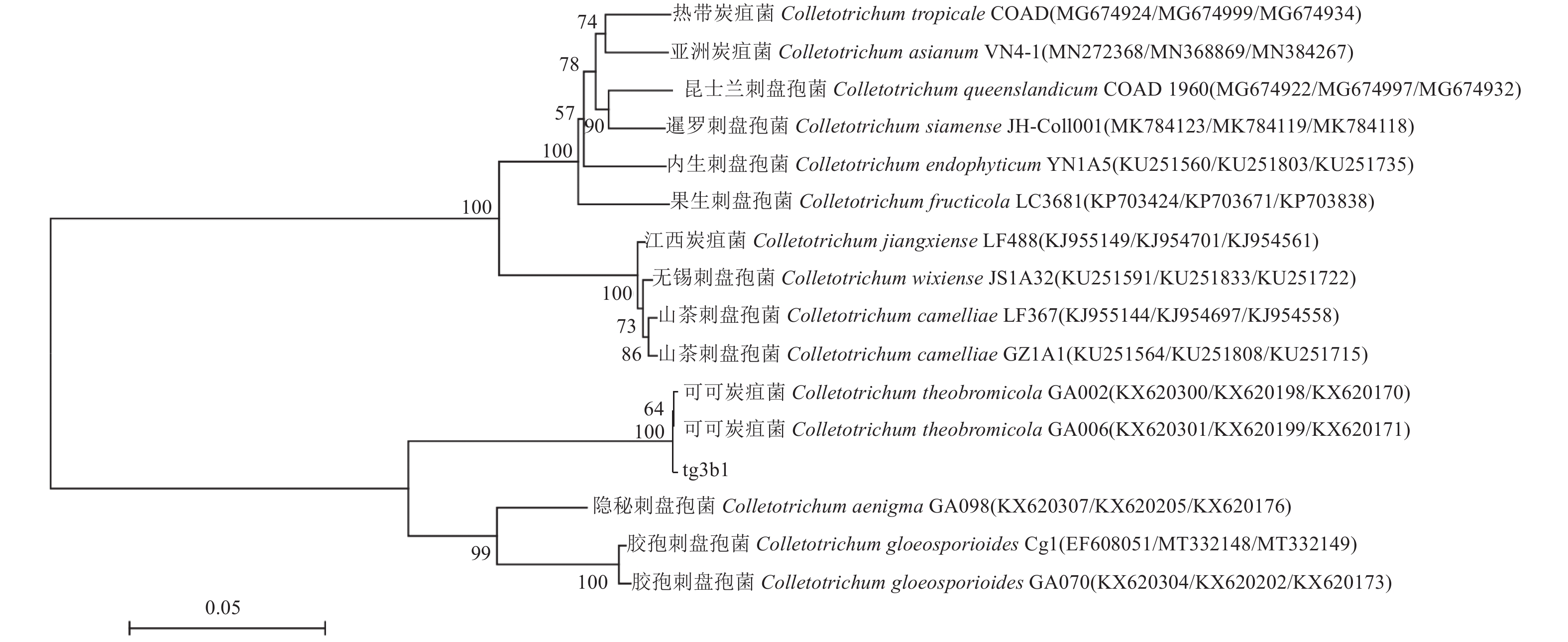
对菌株tg3b1的ITS、CAL和ApMat基因序列进行PCR扩增,采用双向测序并进行拼接,将病菌的3个基因序列测序结果在NCBI中进行BLAST比对,发现其与可可炭疽菌(Colletotrichum theobromicola)多个序列的同源性达100%。下载相似物种的同一基因序列,使用MEGA 6.0邻接法(NJ)构建多基因系统发育进化树(图4),发现tg3b1菌株与C. theobromicola GA002(KX620300/KX620198/KX620170)、C. theobromicola GA006(KX620301/KX620199/KX620171)以100 %的自展支持率聚为独立的一支,结合形态学鉴定结果,确定广西百香果炭疽病的致病菌是可可炭疽菌(C. theobromicola)。
2.4 病原菌生物学特性
2.4.1 温度对病原菌菌丝生长及产孢量的影响
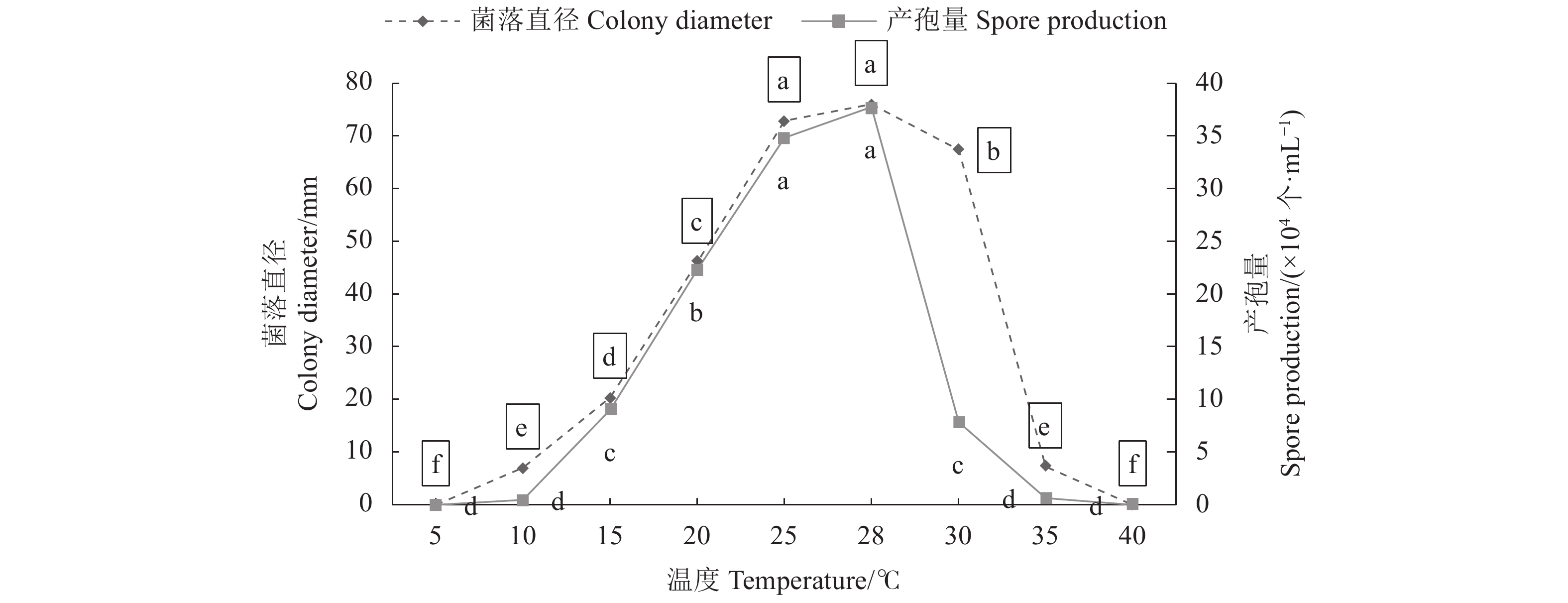
百香果炭疽病菌可可炭疽菌(C. theobromicola)菌丝在温度为15~30 ℃时均能生长良好,10 、35 ℃时生长严重受阻,5 、40 ℃时不生长;温度为10~28 ℃时生长速度随温度升高生长速度加快,温度为28~35 ℃时生长速度缓慢;温度为28 ℃和25 ℃时生长较快,菌落直径为76.00 mm和72.83 mm,两者间无显著性差异,两者显著(P<0.05,下同)高于其他温度条件下的菌落直径;温度为30 ℃时菌落直径为67.33 mm,显著高于除28 ℃和25 ℃外其他温度条件下的菌落直径(图5)。可见,百香果炭疽病菌可可炭疽菌(C. theobromicola)在温度为15~30 ℃时均能生长,较佳生长温度为25~28 ℃。
病原菌在温度为15~30 ℃时产孢量较多,10、35 ℃时产孢少,5、40 ℃时不能产孢。温度为25 ℃和28 ℃时病原菌产孢量最多,产孢量分别为37.75×104个·mL-1和34.82×104个·mL-1,两者间无显著性差异,两者显著高于其他温度条件下的产孢量;温度为20 ℃时产孢量分别为22.29×104个·mL−1,显著高于除了25、28 ℃以外的其他温度条件下的产孢量;可见,百香果炭疽病菌可可炭疽菌(C. theobromicola)在温度为15~30 ℃时产孢量较多,较佳产孢温度为25~28 ℃(图5)。
2.4.2 pH对病原菌菌丝生长及产孢量的影响
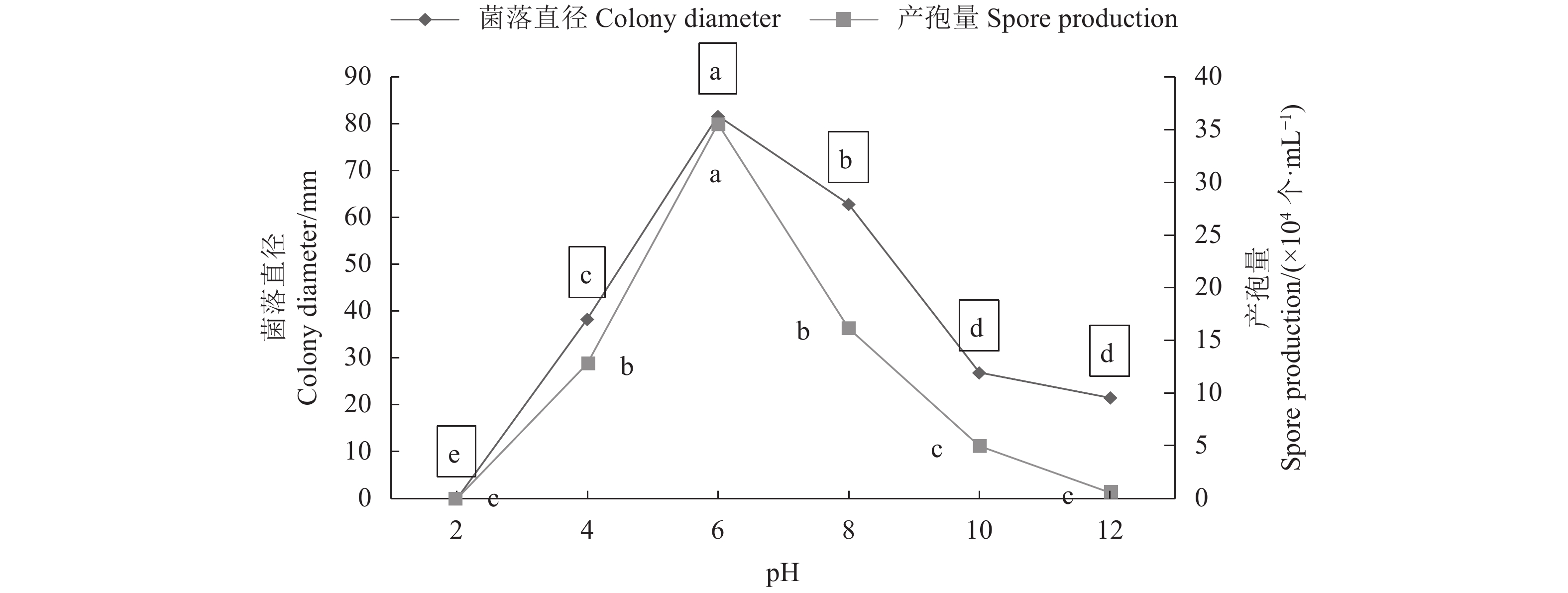
百香果炭疽病菌可可炭疽菌(C. theobromicola)菌丝在pH为2.0时不生长,pH为4.0~12.0时均能生长;在pH为6.0时菌落直径最大,为81.75 mm,显著高于其他pH条件下的菌落直径;pH为8.0时,菌落直径为62.88 mm,显著高于除了pH为6.0以外的pH条件下的菌落直径;可见,可可炭疽病菌(C. theobromicola)菌丝在pH为4.0~12.0均能生长,以pH 6.0为最佳生长条件(图6)。
病原菌在pH为2.0时不能产孢;在pH为6.0时产孢量较多,产孢量为35.54×104个·mL−1,显著高于其他pH条件下的产孢量;在pH为8.0和4.0时产孢量也较多,显著高于除pH为6.0外pH条件下的产孢量。说明病原菌可可炭疽菌(C. theobromicola)在pH 4.0~12.0均能产孢,而pH 6.0为较佳产孢条件(图6)。
2.4.3 光照对病原菌菌丝生长及产孢量的影响
由表2可知,百香果炭疽病菌可可炭疽菌(C. theobromicola) 菌丝生长对光照条件不敏感,在全黑暗、光暗交替、全光照条件下的条件下生长速度无显著性差异,但菌落颜色有变化,在有光照条件下菌落转色加快。可见,百香果炭疽病菌可可炭疽菌(C. theobromicola)菌丝生长对光照条件不敏感。
表 2 光照对病原菌菌丝生长及产孢量的影响Table 2. Effect of light exposure on mycelial growth and spore production of pathogen光照条件
Light condition菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)全黑暗
Total darkness7.52 a 35.99 b 光暗交替
Alternation of light and darkness7.43 a 43.57 a 全光照
Full light7.70 a 4.90 c 同列数据后不同小写字母表示差异显著(P<0.05),下同。
Data with different lowercase letters on same column mean significant difference at P<0.05. Same for below.病原菌在黑暗、光暗交替、全光照条件下均能产孢,光暗交替条件对病原菌产孢有利,全光照对病原菌产孢有一定抑制作用;在光暗交替条件下产孢量较大,产孢量为43.57×104个·mL−1,显著高于全黑暗和全光照的条件下产孢量;全黑暗条件下,产孢量为35.99×104个·mL−1,显著高于全光照条件下产孢量。可见,百香果炭疽病菌可可炭疽菌(C. theobromicola)最适合产孢光照条件为光暗交替。
2.4.4 培养基对病原菌菌丝生长及产孢量的影响
百香果炭疽病菌可可炭疽菌(C. theobromicola)在9种培养基中均能生长(图7),其中,在PSA培养基上培养菌丝生长最快,菌落直径达70.17 mm,显著高于其他8种培养基的菌落直径;其次为PDA和CAD培养基,其菌落直径分别为66.67 mm和64.67 mm,显著大于除PSA培养基外的其他6种培养基;WA培养基菌丝生长最慢,其菌落直径为38.33 mm,显著小于其他8种培养基(表3)。可见,百香果炭疽病菌可可炭疽菌(C. theobromicola)最适宜菌丝生长的培养基为PSA。
病原菌在OA、PDA培养基上产孢量较多(表3),分别为50.81×104、34.79×104个·mL−1,两者间没有显著差异,但均显著高于其他培养基的产孢量;煎汁、SDA、PSA、CAD、CMA、SDA、SDAY培养基产孢量较少,均低于7.74×104个·mL−1,处理间没有显著差异。综上所述,最适合百香果炭疽病菌可可炭疽菌(C. theobromicola)产孢的培养基为OA和PDA。
表 3 培养基对病原菌菌丝生长及产孢量的影响Table 3. Mycelial growth and spore production of pathogen on different culture media培养基
Medium菌落直径
Colony diameter/mm产孢量
Spore number/(×104 个·mL−1)PSA 70.17±1.15 a 5.04±1.10 b PDA 66.67±4.19 b 34.79 ±4.41 a CMA 59.17±1.53 c 1.04±0.89 b OA 53.17 ±0.29 d 50.81±9.15 a WA 38.33±1.04 e 7.74±1.50 b 煎汁 Decocted juice 57.83±0.58 c 6.77±4.33 b SDA 60.17±0.29 c 0.27±0.19 b SDAY 52.00±0.50 d 0.08±0.08 b CAD 64.67±0.29 b 1.67±1.60 b 2.4.5 碳源对病原菌菌丝生长及产孢量的影响
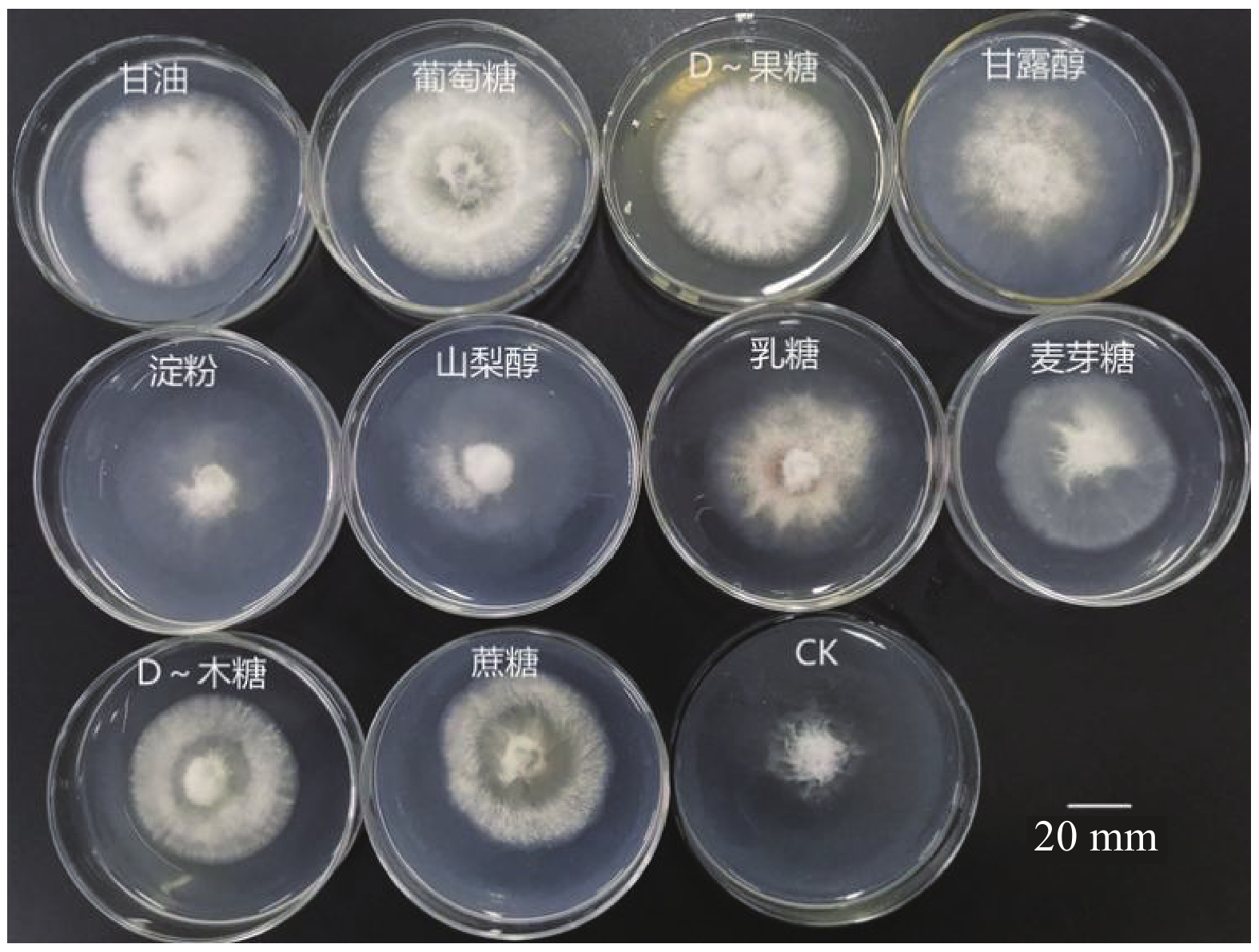
百香果炭疽病菌可可炭疽菌(C. theobromicola)在供试的10种碳源上均能生长(图8),但菌丝生长速度在不同碳源间存在差异。其中,以甘露醇、山梨醇、葡萄糖为碳源时菌丝生长较快,菌落直径分别为69.25、67.38、66.75 mm,三者间无显著性差异,但均显著高于其他碳源的菌落直径(表4)。但只有碳源为葡萄糖时菌丝生长密厚;碳源为甘露醇时菌丝厚度不均匀,外围较稀疏;碳源为山梨醇时菌丝较薄、稀疏。碳源为甘油、淀粉、乳糖、D-果糖、麦芽糖时,菌落直径分别为61.00、60.13、59.00、58.25、58.13 mm,处理间无显著性差异,但均显著高于D-木糖和对照。以D-木糖为碳源和CK菌丝生长较慢,菌落直径均低于53.25 mm,相互间无显著差异。综合上述,最适宜百香果炭疽病菌可可炭疽菌(C. theobromicola)菌丝生长的碳源为葡萄糖。
病原菌产孢量最多碳源为D-果糖和葡萄糖,产孢量分别为19.93×104、16.26×104个·mL−1,处理间产孢量无显著差异(表4),但均显著高于除了乳糖以外的其他碳源条件下的产孢量;产孢量较多的碳源依次为乳糖、山梨醇、蔗糖、D-木糖,产孢量分别为11.43×104、7.13×104、6.71×104、6.33×104个·mL−1,相互间无显著差异,三者均显著高于CK。综上,最适合百香果炭疽病菌可可炭疽菌(C. theobromicola)产孢碳源为D-果糖和葡萄糖。
表 4 碳源对病原菌菌丝生长及产孢量的影响Table 4. Effect of carbon source on mycelial growth and spore production of pathogen碳源
Carbon source菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)甘油 Glycerin 61.00±2.27 b 5.33±0.14 de 葡萄糖 Glucose 66.75±1.44 a 16.26±5.30 ab D-果糖 D-fructose 58.25±3.66 bc 19.93±6.35 a 甘露醇 Mannitol 69.25±1.44 a 5.65 ±0.65 de 麦芽糖 Maltose 58.13±4.01 bc 5.49 ±0.21 de 乳糖 Lactose 59.00±5.05 bc 11.43 ±3.79 bc 山梨醇 Sorbitol 67.38±3.75 a 7.14±0.65 cd 可溶性淀粉Soluble starch 60.13±0.85 b 2.15±0.28 de D-木糖 D-Xylose 53.25 ±2.06 d 6.33±0.65 cd 蔗糖 Sucrose 55.13±2.84 cd 6.71 ±0.80 cd 对照 CK 52.25±0.50 d 0.54±0.39 e 2.4.6 氮源对病原菌菌丝生长及产孢量的影响
百香果炭疽病菌可可炭疽菌(C. theobromicola)菌丝在供试的11种氮源上除磷酸二氢铵、氯化铵外均可良好生长(图9)。其中,以酵母粉为氮源时菌丝生长最快,菌落直径达76.13 mm,显著大于其他氮源的菌落直径,菌丝密厚;菌丝生长较快的氮源依次为牛肉膏、甘氨酸、DL-丙氨酸、硝酸钠、蛋白胨、L-赖氨酸,菌落直径分别为67.13、66.00、65.75、63.25、63.25、63.25 mm,相互间无显著差异,但均显著高于CK,其中以牛肉膏、甘氨酸为氮源时,菌丝稀薄,以DL-丙氨酸、L-赖氨酸为氮源时菌丝密厚,以硝酸钠、蛋白胨为氮源时菌丝稀疏;以磷酸二氢铵、氯化铵为氮源时菌丝生长较慢,相互间差异显著,两者均显著低于CK的菌落直径(表5)。综合上述,最适宜百香果炭疽病菌可可炭疽菌(C. theobromicola) 菌丝生长的氮源为酵母粉。
由表5可知,病原菌在供试的11种氮源上除氯化铵外均能产孢。产孢量较多的氮源为甘氨酸、L-精氨酸,产孢量分别为8.75×104、7.97×104 个·mL−1,相互间无显著差异,但均显著高于其他氮源条件下的产孢量。产孢量较多的氮源依次为蛋白胨、硝酸钠、DL-丙氨酸,产孢量分别为5.82 ×104、5.36 ×104、5.28 ×104 个·mL−1,相互间无显著差异,但显著高于除了甘氨酸、L-精氨酸以外其他氮源条件下的产孢量;以酵母粉、牛肉膏、尿素、磷酸二氢铵、氯化铵为氮源时,产孢量最少,相互间没有显著性差异,均与CK无显著性差异。综合上述,最适宜百香果炭疽病菌可可炭疽菌(C. theobromicola)产孢的氮源为甘氨酸、L-精氨酸。
表 5 氮源对病原菌菌丝生长及产孢量的影响Table 5. Effect of nitrogen source on mycelial growth and spore production of pathogen氮源
Carbon source菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)硝酸钠 sodium nitrate 63.25±2.33 bc 5.36±0.47 b L-精氨酸 L-arginine 60.50±3.49 cd 7.97±0.69 a 氯化铵
Ammonium chloride chloride19.13 ±2.66 g 0.00±0.00 d L-丙氨酸 L-alanine 65.75±2.02 b 5.28±1.13 b 磷酸二氢铵
Ammonium dihydrogen phosphate23.13±1.80 f 0.03±0.02 d L-赖氨酸 L -lysine 63.13 ±2.78 bc 1.86±0.35 c 甘氨酸 Glycine 66.00±3.14 b 8.75±0.49 a 牛肉浸膏 Beef extracts 67.13±3.15 b 0.59±0.26 d 酵母粉 Yeast powder 76.13 ±2.72 a 0.62±0.60 d 蛋白胨 Peptone 63.25±3.50 bc 5.82±0.57 b 尿素 Urea 47.75±3.18 e 0.46±0.41 d 对照 CK 58.00 ±0.82 d 0.08±0.08 d 2.4.7 病原菌致死温度
百香果炭疽病菌可可炭疽菌(C. theobromicola)菌株tg3b1在不同温度处理10 min后在PDA培养基上28 ℃条件下培养5 d,40、45、50 ℃处理病原菌菌丝仍能生长,55 ℃及其以上的处理不能生长。再以50、51、52、53、54 ℃进行测试,结果52、53、54 ℃的培养皿不能长出菌丝。因此,该病原菌致死温度条件为51 ℃处理10 min。
3. 讨论
本研究通过病原菌分离、形态学鉴定、致病性测试及分子序列分析,确认了可可炭疽菌(C. theobromicola )为广西百香果炭疽病的病原菌,这是国内首次将该菌株与百香果炭疽病关联的报道。可可炭疽菌最初在可可树(Theobroma cacao )上被发现,其危害范围已扩展至包括富贵竹、咖啡、棉花、草莓等多种作物在内的植物[18−21],并在全球范围内影响如黄杨、橄榄、人心果及仙客来等多种植物[22−25],显示出其广泛的寄主范围和潜在的危害性。
本研究还对可可炭疽菌(C. theobromicola)的生物学特性进行了系统测定。结果显示,该病菌在15~30 ℃范围内均能生长,最适生长温度为25~28 ℃,且对pH值的适应范围较宽,最适pH为6.0。此外,病原菌对光照条件不敏感,但在光暗交替条件下产孢效果最佳。这些特性与冉飞等[13]和周平兰等[26]报道的喀斯特炭疽菌(C. karstii)和博宁炭疽菌(C. boninense)相似,但与廖旺姣等[27]报道的杉木炭疽病病原菌核果炭疽菌(C. fructicola)在部分条件上存在差异。在不同的培养基和营养源上,可可炭疽菌(C. theobromicola)均能生长和产孢,其中PSA培养基和葡萄糖碳源对其生长最为有利。这些发现为进一步研究该病原菌的生态适应性和致病机制提供了依据。
可可炭疽菌(C. theobromicola)的一些生物学特性与前人报道的其他炭疽病菌存在差异,这些差异的产生可能受到不同寄主植物或种间差异等因素的影响。因此,未来的研究需要进一步探讨这些差异的具体原因,关于该病原菌的发生规律和防治技术仍需进一步深入研究。
4. 结论
广西百香果炭疽病病原菌为可可炭疽菌(C. theobromicola),该病原菌菌丝生长适宜温度为25~28 ℃,pH为6.0,光照无要求,培养基为PSA,碳源为葡萄糖,氮源为酵母粉;该病原菌适宜产孢温度为25~28 ℃,pH为6.0,光照为光暗交替,培养基为PSA,碳源为D-果糖、葡萄糖,氮源为甘氨酸、L-精氨酸;致死条件为51 ℃处理10 min。
-
图 2 百香果炭疽病致病性测定
A:有伤接种后3 d;B:有伤接种后8 d;C:有伤接种后21 d;D:无伤接种后5 d;E:有伤接种后5 d ;F:有伤接种CK;G:无伤接种CK。
Figure 2. Pathogenicity of anthracnose on passion fruits
A: 3 d after injury-causing inoculation; B: 8 d after injury-causing inoculation; C: 21 d after injury-causing inoculation; D: 5 d after non-injury inoculation; E: 5 d after injury-causing inoculation; F: CK of injury-causing inoculation; G: CK of non-injury inoculation.
表 1 基因序列PCR引物及扩增信息
Table 1 PCR primers and amplification of gene sequence
基因序列名称
Genetic sequence name引物名称
Primer name引物序列 (5′-3′)
Primer sequence产物大小
Product size/bp引物退火
Annealing temperature/ ℃CAL CL1C F:GAATTCAAGGAGGCCTTCTC 773 58 CL2C R:CTTCTGCATCATGAGGTGGAC ApMat CgDL-F6 F:AGTGGAGGTGCGGGACGTT 875 58 CgMAT1F2 R:TGATGTATCCCGACTACCG ITS ITS1 TCCGTAGGTGAACCTGCGG 500~750 56 ITS4 TCCTCCGCTTATTGATATGC 表 2 光照对病原菌菌丝生长及产孢量的影响
Table 2 Effect of light exposure on mycelial growth and spore production of pathogen
光照条件
Light condition菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)全黑暗
Total darkness7.52 a 35.99 b 光暗交替
Alternation of light and darkness7.43 a 43.57 a 全光照
Full light7.70 a 4.90 c 同列数据后不同小写字母表示差异显著(P<0.05),下同。
Data with different lowercase letters on same column mean significant difference at P<0.05. Same for below.表 3 培养基对病原菌菌丝生长及产孢量的影响
Table 3 Mycelial growth and spore production of pathogen on different culture media
培养基
Medium菌落直径
Colony diameter/mm产孢量
Spore number/(×104 个·mL−1)PSA 70.17±1.15 a 5.04±1.10 b PDA 66.67±4.19 b 34.79 ±4.41 a CMA 59.17±1.53 c 1.04±0.89 b OA 53.17 ±0.29 d 50.81±9.15 a WA 38.33±1.04 e 7.74±1.50 b 煎汁 Decocted juice 57.83±0.58 c 6.77±4.33 b SDA 60.17±0.29 c 0.27±0.19 b SDAY 52.00±0.50 d 0.08±0.08 b CAD 64.67±0.29 b 1.67±1.60 b 表 4 碳源对病原菌菌丝生长及产孢量的影响
Table 4 Effect of carbon source on mycelial growth and spore production of pathogen
碳源
Carbon source菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)甘油 Glycerin 61.00±2.27 b 5.33±0.14 de 葡萄糖 Glucose 66.75±1.44 a 16.26±5.30 ab D-果糖 D-fructose 58.25±3.66 bc 19.93±6.35 a 甘露醇 Mannitol 69.25±1.44 a 5.65 ±0.65 de 麦芽糖 Maltose 58.13±4.01 bc 5.49 ±0.21 de 乳糖 Lactose 59.00±5.05 bc 11.43 ±3.79 bc 山梨醇 Sorbitol 67.38±3.75 a 7.14±0.65 cd 可溶性淀粉Soluble starch 60.13±0.85 b 2.15±0.28 de D-木糖 D-Xylose 53.25 ±2.06 d 6.33±0.65 cd 蔗糖 Sucrose 55.13±2.84 cd 6.71 ±0.80 cd 对照 CK 52.25±0.50 d 0.54±0.39 e 表 5 氮源对病原菌菌丝生长及产孢量的影响
Table 5 Effect of nitrogen source on mycelial growth and spore production of pathogen
氮源
Carbon source菌落直径
Colony diameter/
mm产孢量
Spore number/
(×104 个·mL−1)硝酸钠 sodium nitrate 63.25±2.33 bc 5.36±0.47 b L-精氨酸 L-arginine 60.50±3.49 cd 7.97±0.69 a 氯化铵
Ammonium chloride chloride19.13 ±2.66 g 0.00±0.00 d L-丙氨酸 L-alanine 65.75±2.02 b 5.28±1.13 b 磷酸二氢铵
Ammonium dihydrogen phosphate23.13±1.80 f 0.03±0.02 d L-赖氨酸 L -lysine 63.13 ±2.78 bc 1.86±0.35 c 甘氨酸 Glycine 66.00±3.14 b 8.75±0.49 a 牛肉浸膏 Beef extracts 67.13±3.15 b 0.59±0.26 d 酵母粉 Yeast powder 76.13 ±2.72 a 0.62±0.60 d 蛋白胨 Peptone 63.25±3.50 bc 5.82±0.57 b 尿素 Urea 47.75±3.18 e 0.46±0.41 d 对照 CK 58.00 ±0.82 d 0.08±0.08 d -
[1] 周红玲, 郑云云, 郑家祯, 等. 百香果优良品种及配套栽培技术 [J]. 中国南方果树, 2015, 44(2):121−124. ZHOU H L, ZHENG Y Y, ZHENG J Z, et al. Excellent varieties of passion fruit and their supporting cultivation techniques [J]. South China Fruits, 2015, 44(2): 121−124. (in Chinese)
[2] 许晓静, 陶志华. 黄色和紫色百香果籽油抗氧化作用的对比研究 [J]. 食品工业科技, 2016, 37(11):49−52,57. XU X J, TAO Z H. A comparative study on antioxidant properties of yellow and purple passion fruit seed oil [J]. Science and Technology of Food Industry, 2016, 37(11): 49−52,57. (in Chinese)
[3] 梁倩, 李咏富, 龙明秀, 等. 百香果化学成分及药理活性研究进展 [J]. 食品工业科技, 2018, 39(20):343−347. LIANG Q, LI Y F, LONG M X, et al. Research progress on chemical constituents and pharmacological effects of Passiflora edulis Sims [J]. Science and Technology of Food Industry, 2018, 39(20): 343−347. (in Chinese)
[4] 刘纯友, 殷朝敏, 黄永春, 等. 百香果皮多糖的分离纯化、结构特性及生物活性研究进展 [J]. 食品工业科技, 2018, 39(8):335−340,351. LIU C Y, YIN C M, HUANG Y C, et al. Progress in extraction, separation and purification, structural characteristics and bioactivities of polysaccharides of Passiflora edulis peel [J]. Science and Technology of Food Industry, 2018, 39(8): 335−340,351. (in Chinese)
[5] 郭艳峰, 李晓璐, 杨得坡, 等. 不同品种百香果的挥发性成分分析研究 [J]. 中国南方果树, 2019, 48(6):59−63,71. GUO Y F, LI X L, YANG D P, et al. Analysis of volatiles of three varieties of Passiflora edulia Sims juice [J]. South China Fruits, 2019, 48(6): 59−63,71. (in Chinese)
[6] 康安, 罗继梅. 广西自培百香果种苗“钦蜜9号”香飘八方[N]. 广西日报, 2023-09-28: 001. [7] 赵晓珍, 王红, 王红林, 等. 贵州百香果果实炭疽病病原菌分离及鉴定 [J]. 中国南方果树, 2023, 52(3):50−54,58. ZHAO X Z, WANG H, WANG H L, et al. Isolation and identification of anthracnose pathogen from passion fruit in Guizhou province [J]. South China Fruits, 2023, 52(3): 50−54,58. (In Chinese).
[8] MORIWAKI J, SATO T, TSUKIBOSHI T. Morphological and molecular characterization of Colletotrichum boninense sp. nov. from Japan [J]. Mycoscience, 2003, 44(1): 47−53. DOI: 10.1007/S10267-002-0079-7
[9] CAMPO-ARANA R O, URANGO-ESQUIVEL N, PÉREZ-POLO D. Integrated management of Colletotrichum gloesporioides in yellow passion fruit (Passiflora edulis f. flavicarpa Degener) [J]. Revista de Ciencias Agrícolas, 2019, 36(2): 87−94.
[10] SHI G Y, ZENG Q, WEI Y W, et al. First report of anthracnose caused by Colletotrichum brasiliense on violet passion fruit in China[J]. Plant Disease, 2022: PDIS11202485PDN.
[11] QIU F, LI X, XIE C P, et al. Identification of Colletotrichum brevisporum causing fruit rot in yellow passion fruit (Passiflora edulis f. flavicarpa) in China [J]. Australasian Plant Pathology, 2021, 50(2): 229−232. DOI: 10.1007/s13313-020-00766-w
[12] DU Y X, SHI N N, CHEN W L, et al. Identification of Colletotrichum brevisporum causing anthracnose on passion fruit [J]. Canadian Journal of Plant Pathology, 2017, 39(4): 527−532. DOI: 10.1080/07060661.2017.1367725
[13] 冉飞, 陈佳, 莫飞旭, 等. 百香果炭疽病菌生物学特性及室内药剂筛选 [J]. 热带作物学报, 2021, 42(4):1080−1085. DOI: 10.3969/j.issn.1000-2561.2021.04.025 RAN F, CHEN J, MO F X, et al. Biological characteristics of the pathogen and fungicides screening in laboratory for anthracnose of Passiflora edulia Sims [J]. Chinese Journal of Tropical Crops, 2021, 42(4): 1080−1085. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2021.04.025
[14] CHEN Y H, HUANG T P. First report of anthracnose caused by Colletotrichum capsici on passion fruit in Taiwan [J]. Plant Disease, 2018, 102(12): 2648.
[15] LI W Z, RAN F, LONG Y H, et al. Evidences of Colletotrichum fructicola causing anthracnose on Passiflora edulis Sims in China [J]. Pathogens, 2021, 11(1): 6. DOI: 10.3390/pathogens11010006
[16] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998. [17] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. [18] 刘霄. 珠江三角洲地区园林花卉炭疽菌种类鉴定[D]. 广州: 仲恺农业工程学院, 2016. LIU X. Identification of anthracnose species in garden flowers in pearl river delta region[D]. Guangzhou: Zhongkai University of Agriculture and Engineering, 2016. (in Chinese)
[19] 陆英, 贺春萍, 吴伟怀, 等. 我国咖啡炭疽病菌致病力分化 [J]. 西南农业学报, 2021, 34(5):1008−1014. LU Y, HE C P, WU W H, et al. Pathogenicity differentiation of coffee anthracnose in China [J]. Southwest China Journal of Agricultural Sciences, 2021, 34(5): 1008−1014. (in Chinese)
[20] 杨友联, 刘永翔, 刘作易. 棉花炭疽病的病原鉴定 [J]. 贵州农业科学, 2014, 42(8):86−91,95. DOI: 10.3969/j.issn.1001-3601.2014.08.024 YANG Y L, LIU Y X, LIU Z Y. Identification of Colletotrichum species associated with cotton anthracnose [J]. Guizhou Agricultural Sciences, 2014, 42(8): 86−91,95. (in Chinese) DOI: 10.3969/j.issn.1001-3601.2014.08.024
[21] 黄军凯, 张国珍. 促进草莓炭疽病菌大量产孢的方法 [J]. 植物保护, 2014, 40(4):107−111. DOI: 10.3969/j.issn.0529-1542.2014.04.021 HUANG J K, ZHANG G Z. A method for inducing sporulation of Colletotrichum pathogen from strawberry [J]. Plant Protection, 2014, 40(4): 107−111. (in Chinese) DOI: 10.3969/j.issn.0529-1542.2014.04.021
[22] SINGH R, GRANEY L, WILLIAMSON M. First report of boxwood dieback caused by Colletotrichum theobromicola in the United States [J]. Plant Disease, 2015, 99(9): 1274.
[23] LIMA N B, PASTOR S E, MAZA C E, et al. First report of anthracnose of olive fruit caused by Colletotrichum theobromicola in Argentina [J]. Plant Disease, 2020, 104(2): 589.
[24] MARTINS M V V, LIMA J S, ARAÚJO F S A, et al. First report of Colletotrichum theobromicola causing leaf spot in sapote (Manilkara zapota) seedlings in Brazil [J]. Plant Disease, 2018, 102(12): 2641.
[25] SHARMA G, MAYMON M, FREEMAN S. First report of Colletotrichum theobromicola causing leaf spot of Cyclamen persicum in Israel [J]. Plant Disease, 2016, 100(8): 1790.
[26] 周平兰, 唐新科, 龙岳林, 等. 春兰炭疽病致病菌Colletotrichum boninense的鉴定及生物学特性分析 [J]. 园艺学报, 2015, 42(10):1993−2001. ZHOU P L, TANG X K, LONG Y L, et al. Identification of pathogen Colletotrichum boninense from Cymbidium goeringii and its biological characteristics [J]. Acta Horticulturae Sinica, 2015, 42(10): 1993−2001. (in Chinese)
[27] 廖旺姣, 邹东霞, 罗辑, 等. 广西杉木炭疽病病原鉴定及生物学特性测定 [J]. 南方农业学报, 2022, 53(4):1040−1048. DOI: 10.3969/j.issn.2095-1191.2022.04.017 LIAO W J, ZOU D X, LUO J, et al. Identification and biological characteristics of the pathogens of Chinese fir anthracnose in Guangxi [J]. Journal of Southern Agriculture, 2022, 53(4): 1040−1048. (in Chinese) DOI: 10.3969/j.issn.2095-1191.2022.04.017




 下载:
下载: