Breeding and Application of Aromatic Restorer Line Minglunzhenzhan
-
摘要:目的
选育香型优质恢复系,为培育香型优质杂交稻新品种提供优异的种质资源。
方法2011年,利用三明显性核不育水稻构建轮回选择群体中的显性核不育单株,与抗稻瘟病中间稳定材料明恢
1101 进行杂交配组,对后代可育株进行定向系谱选择,选择过程中利用咀嚼法鉴定香味,结合田间自然诱发方法鉴定稻瘟病抗性,筛选出具有香味的恢复系。结果2016年选育出香型优质恢复系明轮臻占。明轮臻占具有米质优、香味浓、配合力强等优点。明轮臻占于2019年荣获第二届全国优质稻品种食味品质鉴评(籼稻)金奖;同年通过福建省品种审定委员会审定(闽审稻20190040)。目前利用明轮臻占配组出明1优臻占等多个杂交稻新品种,均具有米质优、有香味等特性,并通过国家、省级品种审定。其中明1优臻占、野香优臻占多次在米质鉴评活动中荣获金奖。
结论明轮臻占是香型优质恢复系,具有米质优、配合力好、香味浓等优点,既可作为高档优质米进行开发利用,也可作为恢复系进行香型优质杂交稻配组利用。
Abstract:ObjectiveBreeding high-quality restorer lines with fragrant characteristics to provide excellent germplasm resources for cultivating new varieties of fragrant and high-quality hybrid rice.
MethodA recurrent selective population including a dominant male sterile rice was constructed in 2011 using the Sanming dominant male sterile rice to cross with the blast-resistant restorer Minghui 1101 in hybridization. Progenies of the fertile strains were subjected to directional pedigree selection with their aromatic quality examined by a sensory panel. The selected restorer lines were tested on blast-resistance by natural field induction.
ResultA high-quality, aromatic restorer line with excellent general combining ability, Minglunzhenzhan, was obtained in 2016. It won the prestigious Gold Award at the Second National Quality Rice Variety Taste Quality Evaluation (on indica rice) and was certified by Fujian Province Crop Variety Approval Committee in 2019. Subsequently, a series of hybrid varieties, such as Ming 1 You Zhenzhan and Yexiang You Zhenzhan, derived from it exhibited similar characteristic high grain quality and attractive aroma. They all received national and provincial variety approvals. Among them, Ming 1 You Zhenzhan and Yexiang You Zhenzhan were awarded with first prizes at numerous quality evaluation events on rice.
ConclusionMinglunzhenzhan, an aromatic restorer line with excellent grain quality and general combining ability, was successfully bred to become a new market-demanding rice as well as a restorer line for further breeding.
-
Keywords:
- aromatic rice /
- high-quality /
- restorer /
- Minglunzhenzhan /
- breeding
-
0. 引言
【研究意义】 白细胞介素-2受体α链(cluster of differentiation 25, CD25)主要在免疫相关细胞表面表达,包括活化的T细胞、B细胞和NK细胞[1]。CD25作为调节性T细胞(regulatory T cells)最经典的表面特征性标记分子,在自然调节性T细胞(natural Treg cells, nTreg)上的表达水平尤为显著[2] 。早在1995年,Sakaguchi等[3]研究表明,CD25不仅是调节性CD4+ T细胞的一个重要表型标志,而且它在免疫抑制和免疫调节中扮演着关键角色[4]。此外,CD25与CD122、CD132形成的高亲和受体复合物与IL-2相结合,参与多种免疫应答,对B细胞、T细胞和NK细胞的增殖和活化起着至关重要的作用[5]。【前人研究进展】 机体缺乏CD25时,Treg细胞数减少[6]。有研究表明,CD25的特异性单克隆抗体已经被广泛用作小鼠模型的研究工具[7, 8],CD25与IL-2的结合受到CD25单克隆抗体的抑制,并可以在体外功能性抑制IL-2介导的T细胞增殖[9]。CD25单克隆抗体阻断CD25期间,机体可以维持免疫稳态,但是当CD25+ Treg细胞被耗尽后,会引起异常的T细胞活化[10]。上述结果阐明CD25的单克隆抗体对Treg细胞具有重要生物学影响。另有研究表明,CD25也可以作为血液肿瘤细胞表面标记物,例如CD25在白血病干细胞表面会大量表达,进而可能使白血病干细胞中形成致癌信号通路[11, 12]。CD25的膜外区部分在断裂之后,会形成游离于细胞外的可溶性CD25(sCD25)[13],当机体感染人类免疫缺陷病毒(human immunodeficiency virus, HIV)和肺结核杆菌时,会导致血液内的sCD25水平升高[14−16]。另外在肿瘤(食管癌、白血病、多发性骨髓瘤、淋巴瘤、肺癌、头颈部癌和一些实体瘤)形成过程中,血液内的sCD25水平也会升高[17−23]。因此CD25蛋白可能成为检测血液内的sCD25水平的重要靶点。还有证据表明,在猪体内猪繁殖与呼吸综合病毒感染的早期阶段诱导宿主产生表达CD25+的细胞,这些细胞可以解释感染猪中猪繁殖与呼吸综合病毒特异性细胞免疫的延迟[24, 25]。有研究表明,猪源CD25可能是作为一种能标记不同T细胞亚群的激活分子,会在机体受到刺激后表达增加[26],CD25在猪体内的T细胞上的表达量约占T细胞亚群的2%~9% [27]。病毒(如尼帕病毒与猪瘟病毒)感染猪不仅能刺激机体产生表达CD25的T细胞[28, 29],同时猪群中有多种造成免疫抑制的传染病(如非洲猪瘟病毒、猪圆环病毒等)也会造成免疫细胞的损伤,然而在猪群中缺乏免疫细胞相关性的定量或定向检测指标。根据这些研究结果,进一步阐明猪源CD25蛋白可以对这些疾病的诊断和治疗提供重要靶点。 【本研究切入点】 鼠源CD25单克隆抗体制备出后,已被广泛应用于研究检测小鼠Treg细胞中IL-2信号传导的作用[30] 。由于还没有成熟的猪源CD25抗体,同时目前人源和鼠源的CD25氨基酸序列与猪源的CD25氨基酸序列一致性仅为74%和65%,对猪CD25蛋白的特异性不高且价格昂贵, 因此制备猪CD25蛋白的单克隆抗体十分重要。【拟解决的关键问题】采用大肠杆菌表达系统制备6×His-CD25重组蛋白,并将其乳化后用作免疫BALB/c小鼠的抗原,从而获得CD25多克隆抗体。通过将免疫反应成功的小鼠脾细胞与骨髓瘤细胞融合,筛选出猪源CD25的单克隆抗体。针对猪源CD25单克隆抗体的鉴定及其在间接ELISA、间接免疫荧光(IFA)和Western blotting等实验技术中的应用进行深入分析,为猪源Treg细胞的定性与定量研究奠定基础,为猪相关疾病的研究提供有效数据参考。
1. 材料与方法
1.1 材料与试剂
本研究中使用的大肠杆菌E.coli DH5α和pET-28a(+)质粒均由实验室保存。SPF级雌性BALB/c小鼠购自福州市仓山区吴氏实验动物服务部;E.coli Transetta(DE3)表达菌株购自北京全式金生物技术股份有限公司;限制性内切酶FastDigest Eco R I和Nco I购自赛默飞世尔科技公司;Clon Express® Ultra One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司;单组分TMB显色液和ELISA终止液购自北京索莱宝科技有限公司;Plasmid Mini Kit购自Omega Bio-Tek公司;弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司;山羊抗小鼠HRP-IgG和FITC-IgG购自武汉赛维尔生物科技有限公司。
1.2 CD25基因的扩增
根据NCBI上猪源CD25的全基因序列(登录号:NM_213835.1) ,设计猪源CD25基因胞外区片段(672 bp)引物,上游引物为CD25-F:5′-taagaaggagatataccatggcgcatcatcatcatcatcacGGGGCTTGCGTTCAGCAG-3′;下游引物为CD25-R:5′-ttgtcgacggagctcgaattcttaCTGATACTGTGTTGTAAATATGATTGGC-3′(引物中的小写字母代表载体同源臂、终止密码子、保护碱基以及6×his标签,大写字母代表目的基因的引物序列),由福州铂尚生物科技有限公司合成,可扩增出737 bp(CD25基因胞外区片段加上载体同源臂、终止密码子、保护碱基以及6×his标签)的基因片段。提取猪脾脏总RNA,以总RNA为模板进行反转录,反应体系(20 μL):5×gDNA Digester Mix 4 μL,10×Hifair® III Super Buffer 2 μL,Hifair® III RT Enzyme Mix 1 μL,随机引物 N6 (50 μmol·L−1) 1 μL,总RNA 10 pg~5 μg,加无RNA酶 H2O至20 μL。反应条件为:25 ℃ 5 min,55 ℃ 30 min,85 ℃ 5 min。将逆转录的cDNA作为PCR反应模板,PCR反应体系(50 μL) :5 × PrimeSTAR Buffer 10 μL,dNTP Mixture (2.5 mmol·L−1) 4 μL,PrimeSTAR HS DNA Polymerase 0.5 μL,上游引物 1 μL,下游引物 1 μL,模板 100~200 ng,ddH2O补充至50 μL。反应条件为:95 ℃ 5 min,95 ℃ 30 s,59 ℃ 30 s,72 ℃ 45 s,32个循环;72 ℃ 延伸10 min。扩增后用1%琼脂糖凝胶电泳进行检测。
1.3 pET-28a-CD25重组质粒的构建
使用FastDigest Eco R I和Nco I限制性核酸内切酶对pET-28a(+)质粒进行双酶切。载体酶切体系:载体pET-28a(+) 1 μg、Eco R I 1 μL、Nco I 1 μL、10 × Buffer 1 μL、ddH2O补充至20 μL。将目的片段与酶切后的pET-28a(+)载体进行同源重组,反应体系:线性化载体0.03 pmol,CD25基因片段0.06 pmol,2 × ClonExpress Mix 5 μL,ddH2O补充至10 μL,混匀后置于50 ℃水浴锅中5 min。然后将连接的产物转化至E.coli DH5α感受态细胞,并涂布于含有卡那霉素(50 μg·mL−1)的LB平板,37 ℃培养12 h,挑取单菌落接种在具有卡那霉素抗性的LB液体培养基中,37 ℃、180 r·min−1培养过夜。使用Plasmid Mini Kit试剂盒提取pET-28a-CD25重组质粒,将验证后的重组质粒通过擎科生物技术有限公司进行测序。将测序成功的重组质粒转化至表达感受态E.coli Transetta(DE3),将其命名为E.coli Transetta (DE3)-pET-28a-CD25。
1.4 6×His-CD25重组蛋白的诱导表达和可溶性分析
将构建好的表达菌株E.coli Transetta (DE3)-pET-28a-CD25接种于含卡那霉素抗性的LB液体培养基中,37 ℃、180 r·min−1培养至OD600值约为0.6时,向菌液中加入终浓度为0.2 mmol·L−1的IPTG,继续在30 ℃培养箱中培养6 h,收集菌体并用PBS重新悬浮清洗菌体。将诱导后的菌体进行超声破碎,离心后分别取沉淀和上清制备蛋白样,然后进行SDS-PAGE电泳分析。
1.5 6×His-CD25重组蛋白的纯化和复性
使用结合缓冲液(20 mmol·L−1咪唑溶液+ 8 mol·L−1尿素)平衡镍柱,将蛋白样本通过恒流泵流入镍柱。然后用洗涤缓冲液(200 mmol·L−1咪唑溶液+ 8 mol·L−1尿素)洗去杂蛋白,最后用洗脱缓冲液(300 mmol·L−1咪唑溶液+8 mol·L−1尿素)洗脱目的蛋白,通过SDS-PAGE检测蛋白的纯化情况。将纯化后的蛋白溶液转移到超滤管中,4 ℃、
4000 r·min−1离心至剩余3 mL液体。然后梯度减少加入复性缓冲液(尿素浓度0~7 mol·L−1)再次离心至剩余3 mL液体。当复性缓冲液中的尿素浓度低于2 mol·L−1并且没有沉淀时,则蛋白复性完成。1.6 单克隆抗体的制备
1.6.1 小鼠免疫
纯化并复性后的重组蛋白与免疫佐剂按体积比1∶1乳化,然后采用背部皮下多点注射的方法进行注射免疫BALB/c小鼠,每只小鼠每次免疫注射100 μg重组蛋白。免疫间隔14 d,连续免疫3次,免疫3次后通过尾静脉采血的方法制备小鼠多抗血清。在第3次免疫14 d后,使用不加佐剂的100 μg重组蛋白注射免疫阳性小鼠腹腔,进行加强免疫。加强免疫3 d后取小鼠的脾细胞与骨髓瘤细胞进行融合。
1.6.2 间接ELISA筛选方法的建立
用方阵滴定法确定抗原浓度及免疫鼠血清稀释度,将重组蛋白使用碳酸盐缓冲液进行梯度稀释:
2500 、1250 、625、312.5、156.25、78.15、39.06、19.53、9.77、4.88、2.44、1.22 ng·mL−1,按每孔100 μL加入酶标板。一抗免疫鼠血清的稀释度为1∶1000 至1∶64000 ,每个蛋白包被的浓度设 1个PBS阴性对照。二抗(HRP标记的羊抗鼠IgG)用PBST配制的浓度为3%的牛奶进行1∶5000 稀释,每孔100 μL加入酶标板内,显色后加入终止液,测定OD450值。在OD450值约为1时,其对应的浓度就是抗原包被和一抗的最佳稀释度。1.6.3 细胞融合和杂交瘤细胞的筛选
选择加强免疫后多抗血清效价最高的小鼠,将脾脏置于无血清的
1640 培养基内,用无菌的70 μm尼龙细胞筛将脾脏研磨碎,然后滴加无血清的1640 培养基过滤出脾细胞。将滤液2000 r·min−1离心10 min弃去上清,加入适量的1640 培养基并计数。将生长状况良好SP 2/0细胞与脾细胞按照1∶5~1∶10的比例混匀,2000 r·min−1,离心10 min,离心后在1 min内加入1 mL 37 ℃预热后的50% PEG 4000溶液中。然后用无血清的1640 培养基终止融合(尽量在90 s内完成),2000 r·min−1离心10 min弃去上清,加入20% FBS HAT1640 培养基将细胞数稀释至每板2×106个。最后每孔100 μL加入含饲养层细胞的96孔细胞培养皿中培养。融合后用间接ELISA法检测细胞培养液上清的抗体效价,阴性对照用SP2/0细胞的上清,3次重复。将检测阳性的孔进行亚克隆,直至上清阳性率达100%,表明成功筛选到稳定分泌单一抗体的杂交瘤细胞。1.6.4 小鼠单抗腹水的诱导
一组小鼠用弗氏不完全佐剂提前1 d注射小鼠腹腔,1 d后将杂交瘤细胞注射进小鼠的腹腔内;另一组小鼠用液体石蜡提前7 d注射小鼠腹腔,7 d后将杂交瘤细胞注射进小鼠的腹腔内。两组小鼠饲养7 d后抽取小鼠腹水,
8000 r·min−1、4 ℃离心5 min,上清即为单克隆抗体腹水。1.7 单克隆抗体的鉴定
1.7.1 单克隆抗体效价的测定
按照1.6.2中确定的最佳抗原浓度包被酶标板,将腹水上清从1∶
1000 稀释至1∶64000 ,测定OD450值。选择OD450值≥0.2、P/N值≥2.1且最高的腹水稀释倍数为抗体效价。1.7.2 单克隆抗体的稳定性分析和Western blotting验证
使用间接ELISA检测杂交瘤细胞冻存前、复苏后以及连续培养至第五代和第十代的细胞培养液上清中抗体效价是否发生变化。利用Western blotting检测单克隆抗体的特异性,用制备的重组蛋白、其他His标签签白(6×His-LAG3)和BSA蛋白作为对照,以CD25单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,验证抗体的特异性。
1.7.3 单克隆抗体的间接免疫荧光(indirect immunofluorescence assay, IFA)鉴定
将pEGFP-C1质粒用Nhe I和EcoR I内切酶将荧光片段切除,使用同源重组的方法将CD25基因片段与酶切后的线性载体连接,构建pEGFP-CD25重组质粒。构建pEΔgfp-CD25重组质粒(质粒上的荧光标签已切除) ,重组质粒转染进293T细胞后,真核表达CD25蛋白。使用间接免疫荧光试验(IFA),以2F4杂交瘤细胞产生的单克隆抗体为一抗,山羊抗鼠FITC-IgG为二抗,孵育后用PBS清洗3次,然后在倒置荧光显微镜下观察并拍照。
1.7.4 单克隆抗体的应用
取猪的脾脏、肺脏和淋巴组织制备蛋白样品,以制备的单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,使用Western blotting验证单克隆抗体能否与猪组织中的CD25蛋白结合。
2. 结果与分析
2.1 pET28a-CD25重组质粒的构建
利用PCR技术扩增 CD25目的片段,PCR电泳结果如图1A所示,扩增片段大小为737 bp,电泳结果与预期相符。将扩增的CD25连接至pET-28a质粒后经EcoR Ⅰ和Nco Ⅰ双酶切后,酶切产物大小为701 bp(CD25基因胞外区片段加上终止密码子、保护碱基、6×his标签以及剩余的酶切位点部分碱基),表明pET28a-CD25重组质粒构建完成(图1B)。然后将pET28a-CD25重组质粒测序,测序结果进一步比对后发现序列与参考序列一致,表明pET28a-CD25重组质粒构建成功。
![]() 图 1 pET-28a-CD25重组质粒的构建A:CD25基因的扩增;M:DNA Marker-2000;1∶CD25基因。B:pET-28a-CD25重组质粒的双酶切鉴定;M:DNA Marker-5000;1∶pET-28a-CD25。Figure 1. Construction of pET-28a-CD25 recombinant plasmidA: amplification of CD25; M: DNA marker-2000; 1: CD25. B: identification of recombinant plasmid of pET-28a-CD25 by double enzyme digestion; M: DNA marker-5000; 1: pET-28a-CD25.
图 1 pET-28a-CD25重组质粒的构建A:CD25基因的扩增;M:DNA Marker-2000;1∶CD25基因。B:pET-28a-CD25重组质粒的双酶切鉴定;M:DNA Marker-5000;1∶pET-28a-CD25。Figure 1. Construction of pET-28a-CD25 recombinant plasmidA: amplification of CD25; M: DNA marker-2000; 1: CD25. B: identification of recombinant plasmid of pET-28a-CD25 by double enzyme digestion; M: DNA marker-5000; 1: pET-28a-CD25.2.2 6×His-CD25重组蛋白的诱导表达和可溶性分析
将构建的pET28a-CD25重组质粒成功转化入原核表达菌株E.coli Transetta (DE3)中,在37 ℃摇床内培养至OD600 ≈ 0.6后,向菌液中加入终浓度为0.2 mmol·L−1 IPTG诱导培养6 h,经SDS-PAGE电泳鉴定,在30 kDa处出现一条与预期大小一致的高表达目的条带(图2A),表明6×His-CD25重组蛋白诱导表达成功。选取诱导表达后的菌体进行超声破碎,分别取上清和沉淀,通过SDS-PAGE电泳分析,从图2B中可以看出6×His-CD25重组蛋白主要以包涵体的形式存在。
![]() 图 2 重组蛋白的诱导表达和可溶性分析A:6×His-CD25重组蛋白SDS-PAGE分析结果;M:蛋白Marker;1:空载体pET28a(+) 诱导后的全菌体蛋白;2:E.coli Transetta (DE3)-pET28a-CD25诱导后的全菌体蛋白。 B:6×His-CD25重组蛋白可溶性鉴定;M:蛋白Marker;1:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的上清;2:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的沉淀。Figure 2. Induced expression and solubility analysis of recombinant proteinA: SDS-PAGE analysis on 6×His-CD25 recombinant protein; M: protein marker; 1: whole cell protein induced by empty carrier pET-28a(+); 2: whole cell protein induced by E.coliTransetta (DE3)-pET28a-CD25; B: solubility identification of 6×His-CD25 recombinant protein; M: protein marker; 1: supernatant of E.coli Transetta (DE3)-pET28a-CD25 after ultrasonic crushing; 2: E.coli Transetta (DE3)-pET28a-CD25 precipitate after ultrasonic crushing.
图 2 重组蛋白的诱导表达和可溶性分析A:6×His-CD25重组蛋白SDS-PAGE分析结果;M:蛋白Marker;1:空载体pET28a(+) 诱导后的全菌体蛋白;2:E.coli Transetta (DE3)-pET28a-CD25诱导后的全菌体蛋白。 B:6×His-CD25重组蛋白可溶性鉴定;M:蛋白Marker;1:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的上清;2:E.coli Transetta (DE3)-pET28a-CD25超声破碎后的沉淀。Figure 2. Induced expression and solubility analysis of recombinant proteinA: SDS-PAGE analysis on 6×His-CD25 recombinant protein; M: protein marker; 1: whole cell protein induced by empty carrier pET-28a(+); 2: whole cell protein induced by E.coliTransetta (DE3)-pET28a-CD25; B: solubility identification of 6×His-CD25 recombinant protein; M: protein marker; 1: supernatant of E.coli Transetta (DE3)-pET28a-CD25 after ultrasonic crushing; 2: E.coli Transetta (DE3)-pET28a-CD25 precipitate after ultrasonic crushing.2.3 6×His-CD25重组蛋白的纯化和复性
鉴于6×His-CD25重组蛋白主要以包涵体形式存在,因此利用高浓度的尿素溶液使蛋白质中的二级结构打开暴露6×His标签,然后通过镍亲和层析对6×His-CD25重组蛋白进行纯化。SDS-PAGE电泳结果(图3)显示,在预期的大小位置有明显条带,且条带单一,表明获得了纯度较高的6×His-CD25重组蛋白。为了让变性纯化后的重组蛋白恢复到天然的构象,采用尿素浓度梯度法对纯化后的组蛋白进行复性,复性后的6×His-CD25重组蛋白未产生沉淀,可作为免疫小鼠所需的抗原。
2.4 间接ELISA最佳反应条件的确定
小鼠第3次免疫后,采集小鼠尾静脉血液,制备多抗血清。将抗原和多抗血清进行倍比稀释,用间接ELISA法确定最佳抗原包被浓度和血清稀释倍数,OD450吸光度最接近1.0为最佳抗原包被浓度和血清稀释倍数。结果显示,6×His-CD25重组蛋白的最佳包被浓度为31.25 ng·mL−1,最佳阳性血清稀释倍数为1∶
16000 (表1)。表 1 6×His-CD25重组蛋白不同抗原包被浓度和血清稀释倍数下的OD450值Table 1. OD450 under optimum antigen coating concentration and serum dilution multiple of 6×His-CD25 recombinant protein血清类型
Serum type稀释倍数
Dilution times抗原包被浓度
Antigen coating concentration250/(ng·mL−1) 125/(ng·mL−1) 62.5/(ng·mL−1) 31.25/(ng·mL−1) 15.63/(ng·mL−1) 7.81/(ng·mL−1) 3.91/(ng·mL−1) 1.95/(ng·mL−1) 阳性血清稀释倍数
Positive serum dilution1∶ 2000 OVER OVER OVER OVER 3.317 3.100 2.977 2.790 1∶ 4000 OVER OVER OVER 2.573 1.873 1.723 1.417 1.227 1∶ 8000 OVER OVER 2.556 1.981 1.583 1.124 0.925 0.810 1∶ 16000 OVER 2.661 1.854 1.068 0.692 0.352 0.252 0.265 1∶ 32000 2.221 1.622 0.826 0.444 0.189 0.137 0.129 0.147 1∶ 64000 1.569 0.871 0.356 0.152 0.125 0.108 0.086 0.123 阴性血清
Negative serum0.060 0.077 0.076 0.078 0.079 0.069 0.056 0.056 OVER表示OD450处的吸光度大于4.0。表2同。
OVER: OD450 greater than 4.0. Same for Table 2.2.5 单克隆抗体的制备
2.5.1 杂交瘤细胞的筛选
免疫阳性小鼠进行加强免疫后,取小鼠的脾细胞与骨髓瘤细胞进行细胞融合。通过间接ELISA法检测细胞培养液上清中的抗体效价,成功分选出一株阳性单克隆细胞株,将其命名为2F4。显微镜观察细胞形态如图4所示,单一的细胞经过繁殖,聚集成团状,且细胞生长良好。
2.5.2 杂交瘤细胞株分泌的稳定性分析
杂交瘤细胞冻存以及连续传代,其分泌的抗体效价可能会发生变化。检测冻存前以及复苏后的杂交瘤细胞的抗体效价分别为1∶
64000 和1∶32000 (表2)。连续培养至第五代和第十代的细胞培养液上清稀释64000 倍,其OD450值也未表现出显著差异(图5),表明2F4杂交瘤细胞在经过冻存以及连续传代之后产生抗体的能力较稳定。表 2 杂交瘤细胞冻存前后的培养液上清抗体效价Table 2. Antibody titer of hybridoma cell supernatant before and after cryopreservation杂交瘤细胞
Hybridoma cells上清稀释倍数
Supernatant dilution factor1∶ 1000 1∶ 2000 1∶ 4000 1∶ 8000 1∶ 16000 1∶ 32000 1∶ 64000 1∶ 128000 冻存前
Before cryopreservationOVER 3.729 2.787 1.725 0.933 0.457 0.216 0.096 复苏后
After resuscitationOVER 2.912 2.188 1.287 0.742 0.293 0.177 0.087 阴性对照
Negative control0.049 0.049 0.051 0.050 0.051 0.050 0.049 0.051 2.6 不同诱导佐剂的单克隆抗体效价
收集弗氏不完全佐剂组和液体石蜡组小鼠腹水,用间接ELISA法分别检测两组小鼠腹水的效价,弗氏不完全佐剂组和液体石蜡组的小鼠腹水中单克隆抗体的效价分别为1∶
4096000 和1∶2048000 (表3)。结果表明用弗氏不完全佐剂诱导产生的腹水抗体效价比较高,而且有效缩短了诱导小鼠产生腹水的时间。表 3 小鼠腹水单克隆抗体效价Table 3. Monoclonal antibody titer of mouse ascites诱导佐剂
Adjucant type小鼠腹水稀释倍数
Ascites dilution factor in mice1∶ 128000 1∶ 256000 1∶ 512000 1∶ 1024000 1∶ 2048000 1∶ 4096000 弗氏不
完全佐剂
Freund's incomplete adjuvant3.670 3.279 2.444 1.356 0.722 0.256 液体石蜡
Liquid paraffin2.552 1.539 0.899 0.409 0.209 0.090 阴性对照
Negative control0.046 0.046 0.047 0.046 0.047 0.050 2.7 单克隆抗体的间接ELISA和Western blotting鉴定
本试验中免疫小鼠的抗原和间接ELISA法包被的抗原都带有6×His标签,因此需要排除6×His标签的假阳性结果。使用其他6×His标签蛋白(6×His-LAG3)和牛血清白蛋白(BSA)作为对照,间接ELISA结果显示OD450为0.065和0.051,6×His-CD25组的OD450为3.738。Western blotting结果如图6所示,2F4杂交瘤细胞产生的抗体不与表达菌株E.coli Transetta (DE3)中的其他菌体蛋白发生反应。结合两个试验结果表明,2F4杂交瘤细胞产生的抗体可以特异性地结合CD25蛋白,不与6×His标签以及其他蛋白发生免疫反应。
![]() 图 6 Western blotting检测单克隆抗体的特异性结果M:蛋白Marker;1:CD25表达菌株诱导后全菌体蛋白;2:其他6×His标签蛋白;3:BSA(牛血清白蛋白)。Figure 6. Specificity of monoclonal antibody tested by western blottingM: protein marker; 1: whole cell protein induced by CD25 expression strain; 2. other 6×His tag proteins; 3: BSA (bovine serum albumin).
图 6 Western blotting检测单克隆抗体的特异性结果M:蛋白Marker;1:CD25表达菌株诱导后全菌体蛋白;2:其他6×His标签蛋白;3:BSA(牛血清白蛋白)。Figure 6. Specificity of monoclonal antibody tested by western blottingM: protein marker; 1: whole cell protein induced by CD25 expression strain; 2. other 6×His tag proteins; 3: BSA (bovine serum albumin).2.8 单克隆抗体的IFA鉴定
将2F4杂交瘤细胞产生的单克隆抗体为一抗,山羊抗鼠FITC-IgG为二抗进行IFA检测,结果如图7所示,2F4杂交瘤细胞产生的单克隆抗体能够与转染了pEΔgfp-CD25重组质粒的293T细胞结合使其产生荧光,且荧光强度强。由此表明,2F4杂交瘤细胞产生的单克隆抗体能够与真核细胞表达的CD25蛋白发生特异性免疫反应。
2.9 单克隆抗体的应用
成熟的CD25蛋白是一种Ⅰ型跨膜蛋白,未成熟的CD25蛋白在高尔基体内经过修饰,与一段肽前体连接后,会定位到细胞膜上形成分子量大小约为55 kDa的IL-2受体的α链[31−34]。为了验证2F4杂交瘤细胞产生的单克隆抗体能否与猪组织中的CD25蛋白结合,取猪的脾脏和肺脏,制作组织蛋白样,2F4杂交瘤细胞产生的单克隆抗体为一抗,进行Western blotting检测分析,结果如图8显示,猪的脾脏和肺脏中均可检测出一条大小为55 kDa的条带,且没有杂带。表明2F4杂交瘤细胞产生的单克隆抗体能够特异性识别猪脾脏和肺脏中的CD25蛋白。
3. 讨论
调节性T细胞是一类与自身免疫反应相关的T细胞亚群,能够调控T细胞并参与多种免疫紊乱相关疾病的发展进程,在保持自身免疫耐受和抗感染、抗肿瘤细胞的免疫反应中起重要调节作用[35]。CD25在Treg细胞上面高度表达能够大量消耗机体内的IL-2,从而抑制CD8+ T细胞和NK细胞的炎症反应。Treg细胞可预防自身免疫性疾病的发作,对免疫稳态至关重要。若Treg细胞功能障碍会导致机体免疫功能紊乱,从而导致慢性炎症及自身免疫性疾病更加严重[36]。它们通过多种机制抑制自身反应性T细胞的活化、增殖和效应功能[37]。因此制备Treg细胞表面蛋白的抗体对于鉴定Treg细胞有着重要作用。
本研究通过RT-PCR的方法扩增猪源CD25基因,并使用同源重组构建E.coli Transetta (DE3)-pET28a-CD25重组质粒。通过原核表达系统制备6×His-CD25重组蛋白,作为抗原免疫BALB/c小鼠。然后经过杂交瘤技术,成功筛选出一株CD25单克隆抗体,其使小鼠产生腹水抗体的效价为1∶
4096000 。为了避免筛选过程中出现的非特异性,使用其他的6×His标签蛋白(6×His-LAG3)和牛血清白蛋白(BSA)作为对照,用间接ELISA和Western blotting验证,表明2F4杂交瘤细胞产生的抗体可以特异性地结合CD25蛋白。通过IFA试验,证明CD25单克隆抗体可以特异性识别体外表达的猪CD25蛋白。CD25氨基酸序列具有多个糖基化结合位点,所以经过修饰之后实际大小比预测的大。对人源、犬源和猪源的CD25氨基酸序列进行分析,结果显示三者的氨基酸大小最为接近。犬、人源CD25蛋白与猪源CD25蛋白分别有53.5%和55.2%的一致性,这就导致了人源和犬源的CD25单克隆抗体可以识别猪源CD25蛋白,并且已经研究表明,人源和犬源的CD25抗体所识别CD25蛋白大小约为55 kDa[34, 38]。Mandrioli等[39]使用其他物种的CD25抗体用来检测猪源CD25蛋白,发现该抗体会识别一个分子量大小约为55 kDa的蛋白质,然而现有针对猪源CD25蛋白的抗体在特异性和效价方面表现不佳,因此我们致力于研发一种具有更高特异性和效价的猪源CD25单克隆抗体以改善这一局限。通过Western blotting试验,使用猪脾脏和肺脏的组织蛋白样对CD25单克隆抗体进行验证,结果显示本试验制备的猪源CD25单克隆抗体在猪的脾脏和肺脏中检测到了大小约为55 kDa的条带,因此表明本试验制备的CD25单克隆抗体能够正确识别猪源的CD25蛋白。
综上,本研究利用原核表达系统成功获得了6×His-CD25重组蛋白,并制备了特异性强的CD25单克隆抗体。本研究制备的猪源CD25单克隆抗体针对猪源CD25蛋白具有更高的效价和特异性,有助于促进猪免疫抑制性传染病的研究,为定性或者定量检测猪源Treg细胞、验证猪源Treg细胞的功能奠定了基础。
-
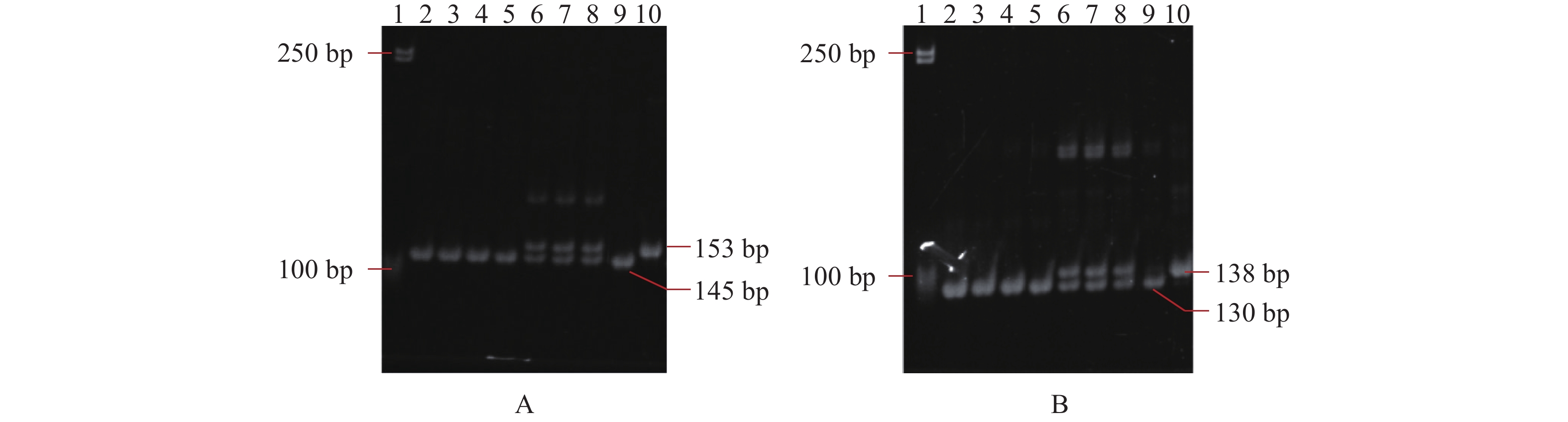
图 2 功能标记FMbadh2-E7A(A)与FMbadh2-E7B(B)对明轮臻占及其所配杂交组合F1代香味基因的鉴定
1~10分别为DL2000 DNA marker、明轮臻占、明1优臻占、野香优臻占、福兴优臻占、明德两优臻占、赣73优臻占、山两优臻占、泰国小香占(阳性对照)、日本晴(阴性对照)。
Figure 2. Identification of aroma genes in Minglunzhenzhan and F1 hybrids by functional markers FMbadh2-E7A (A) and FMbadh2-E7B (B)
1–10: DL2000 DNA marker, Minglunzhenzhan, Ming 1 You Zhenzhan, Yexiang You Zhenzhan, Fuxing You Zhenzhan, Mingdeliang You Zhenzhan, Gan 73 You Zhenzhan, Shanliang You Zhenzhan, Taiguo Xiaoxiangzhan (positive), and Nipponbare (negative).
表 1 明轮臻占配组选育品种表现
Table 1 Performance of rice varieties in Minglunzhenzhan combination group
品种名称
Name of variety试验类型
Type of test参试年份
Year of test产量
Yield/(kg·hm−2)比CK±
Compared with CK/%全生育期
Growth period/d米质等级
Grade of rice quality明1优臻占
Ming 1 You Zhenzhan福建区试 2019年 7634.3 1.9 127.6 2 2020年 7623.6 3.0 130.5 3 平均 7629.0 2.5 129.1 2 长江中下游区试 2019年 9959.0 5.3 136.1 3 2020年 9367.5 4.3 133.9 2 平均 9663.3 4.8 135.0 2 泸优臻占
Lu You Zhenzhan云南区试 2019年 11277.5 4.3 152.5 普通 2020年 10963.5 3.1 154.8 3 平均 11120.6 3.7 153.7 3 福兴优臻占
Fuxing You Zhenzhan福建区试 2020年 7922.3 3.1 125.9 1 2021年 8040.9 2.1 122.4 1 平均 7981.5 2.6 124.1 1 野香优臻占
Yexiang You Zhenzhan长江上游区试 2020年 9864.0 3.2 154.1 2 2021年 9669.0 4.4 153.8 普通 平均 9766.5 3.8 154.0 2 山两优臻占
Shanliang You Zhenzhan长江中下游区试 2020年 9508.5 5.8 133.7 3 2021年 9738.0 6.4 134.2 普通 平均 9622.5 6.1 134.0 3 -
[1] 郭震华,张淑华,刘传雪,等. 水稻稻米香味基因的遗传研究及其在育种中应用的研究进展[J]. 黑龙江农业科学,2013(3) :143−146. DOI: 10.3969/j.issn.1002-2767.2013.03.046 GUO Z H,ZHANG S H,LIU C X,et al. Research progress of genetic studies of rice fragrance gene and its application in breeding[J]. Heilongjiang Agricultural Sciences,2013(3) :143−146. (in Chinese) DOI: 10.3969/j.issn.1002-2767.2013.03.046
[2] 白德朗,魏薇,韦燕萍,等. 杂交香稻研究现状与展望[J]. 广西农业科学,2008,39(6) :717−724. BAI D L,WEI W,WEI Y P,et al. Status and prospect of aromatic hybrid rice[J]. Journal of Southern Agriculture,2008,39(6) :717−724. (in Chinese)
[3] 陈传华,李虎,刘广林,等. 广西香稻育种现状及发展策略[J]. 中国稻米,2017,23(6) :117−120. DOI: 10.3969/j.issn.1006-8082.2017.06.029 CHEN C H,LI H,LIU G L,et al. Breeding status and development strategy of fragrant rice in Guangxi Province[J]. China Rice,2017,23(6) :117−120. (in Chinese) DOI: 10.3969/j.issn.1006-8082.2017.06.029
[4] 周坤炉. 优质、高产、抗病的香型杂交稻组合香优63[J]. 杂交水稻,2004(S1) :29−30. ZHOU K L. Xiangyou 63,a quasi-aromatic hybrid rice with good quality,high yield and good disease resistance[J]. Hybrid Rice,2004(S1) :29−30. (in Chinese)
[5] 黄庭旭,江文清,游晴如,等. 籼型香稻恢复系大粒香-15的选育与利用[J]. 福建农业学报,2006,22(2) :83−88. DOI: 10.3969/j.issn.1008-0384.2006.02.001 HUANG T X,JIANG W Q,YOU Q R,et al. Breeding and utilization of fragrant restoring line Dalixiang 15 of indica hybrid rice[J]. Fujian Journal of Agricultural Sciences,2006,22(2) :83−88. (in Chinese) DOI: 10.3969/j.issn.1008-0384.2006.02.001
[6] 黄庭旭,陈美容,谢从寿,等. 高产、抗病香型杂交水稻Ⅱ优15的选育及开发利用[J]. 杂交水稻,2002,17(1) :4−6. DOI: 10.3969/j.issn.1005-3956.2002.01.002 HUANG T X,CHEN M R,XIE C S,et al. Breeding and utilization of quasi-aromatic hybrid rice Ⅱ you 15 with high yield and good blast resistance[J]. Hybrid Rice,2002,17(1) 4−6. (in Chinese) DOI: 10.3969/j.issn.1005-3956.2002.01.002
[7] 黄显波,邓则勤,唐江霞,等. 香型软米两系不育系明香10S选育研究[J]. 福建农业学报,2008,23(2) :163−167. DOI: 10.3969/j.issn.1008-0384.2008.02.010 HUANG X B,DENG Z Q,TANG J X,et al. Breeding of aromatic soft rice two-line GMS line,Mingxiang 10S[J]. Fujian Journal of Agricultural Sciences,2008,23(2) :163−167. (in Chinese) DOI: 10.3969/j.issn.1008-0384.2008.02.010
[8] 唐江霞,黄显波,邓则勤,等. 香型软米两系优质稻明香1027[J]. 福建稻麦科技,2008,26(1) :23. DOI: 10.3969/j.issn.1008-9799.2008.01.012 TANG J X,HUANG X B,DENG Z Q,et al. Mingxiang 1027,a two-line aroma,soft and good quality hybrid rice combination[J]. Fujian Science and Technology of Rice and Wheat,2008,26(1) :23. (in Chinese) DOI: 10.3969/j.issn.1008-9799.2008.01.012
[9] 陈培峰,乔中英,谢裕林,等. 优质多抗香稻新品种‘苏香粳100’的选育与应用[J]. 作物研究,2017,31(1) :15−17. CHEN P F,QIAO Z Y,XIE Y L,et al. Breeding and application of a new aromatic rice variety ‘suxiangjing 100’ with good quality and multi-resistance[J]. Crop Research,2017,31(1) :15−17. (in Chinese)
[10] 李宏,周少川,黄道强,等. 优质香稻美香占2号的选育及启示[J]. 福建稻麦科技,2021,39(2) :1−6. DOI: 10.3969/j.issn.1008-9799.2021.02.001 LI H,ZHOU S C,HUANG D Q,et al. The breeding and enlightenment of Meixiangzhan 2,a aromatic rice variety with good eating quality[J]. Fujian Science and Technology of Rice and Wheat,2021,39(2) :1−6. (in Chinese) DOI: 10.3969/j.issn.1008-9799.2021.02.001
[11] 彭波,孙艳芳,陈报阳,等. 水稻香味基因及其在育种中的应用研究进展[J]. 植物学报,2017,52(6) :797−807. DOI: 10.11983/CBB16197 PENG B,SUN Y F,CHEN B Y,et al. Research progress of fragrance gene and its application in rice breeding[J]. Chinese Bulletin of Botany,2017,52(6) 797−807. (in Chinese) DOI: 10.11983/CBB16197
[12] 邓力喜,刘丹,陈银华,等. 贵州省优质水稻‘大粒香’香味基因分子标记的开发[J]. 分子植物育种,2021,19(18) :6059−6063. DENG L X,LIU D,CHEN Y H,et al. Development of molecular marker for fragrance gene of high quality Rice ‘Dalixiang’ in Guizhou Province[J]. Molecular Plant Breeding,2021,19(18) :6059−6063. (in Chinese)
[13] 曾跃辉,韦新宇,黄建鸿,等. ‘泰国小香占’香味基因的鉴定和功能分子标记的开发[J]. 分子植物育种,2021,19(13) :4409−4417. ZENG Y H,WEI X Y,HUANG J H,et al. Identification of the fragrance allele and development of the functional markers for fragrance in ‘Taiguoxiaoxiangzhan’[J]. Molecular Plant Breeding,2021,19(13) 4409−4417. (in Chinese)
[14] 刘文静,胡文彬,周政,等. 一种新的水稻香味基因功能标记的开发与应用[J]. 热带作物学报,2022,43(4) :675−683. DOI: 10.3969/j.issn.1000-2561.2022.04.003 LIU W J,HU W B,ZHOU Z,et al. Development and application of a new functional marker of fragrant gene in rice (Oryza sativa L.) [J]. Chinese Journal of Tropical Crops,2022,43(4) :675−683. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2022.04.003
[15] 杜雪树,夏明元,李进波,等. 分子标记辅助选择选育香稻恢复系[J]. 华中农业大学学报,2009,28(6) :651−654. DU X S,XIA M Y,LI J B,et al. Breeding of restore lines with fragrance gene by marker-assisted selection in rice[J]. Journal of Huazhong Agricultural University,2009,28(6) :651−654. (in Chinese)
[16] 罗世友,胡兰香,熊焕金,等. 应用分子标记辅助选育香型优质稻九香粘[J]. 江西农业学报,2020,32(9) :18−22. LUO S Y,HU L X,XIONG H J,et al. Breeding of fragrant rice variety Jiuxiangzhan with good quality by marker-assisted selection[J]. Acta Agriculturae Jiangxi,2020,32(9) :18−22. (in Chinese)
[17] 郑景生,江良荣,黄荣裕,等. 应用香型分子标记辅助选育优质香稻新品种佳福香占[J]. 福建稻麦科技,2021,39(2) :7−10. DOI: 10.3969/j.issn.1008-9799.2021.02.002 ZHENG J S,JIANG L R,HUANG R Y,et al. A new good quality fragrant rice cultivar jiafuxiangzhan by molecular marker-assisted breeding[J]. Fujian Science and Technology of Rice and Wheat,2021,39(2) :7−10. (in Chinese) DOI: 10.3969/j.issn.1008-9799.2021.02.002
[18] 闫影,张丽霞,胡泽军,等. 利用分子标记辅助选育早熟优质香稻新品种‘沪早香软1号’[J]. 分子植物育种,2019,17(22) :7408−7413. YAN Y,ZHANG L X,HU Z J,t al. Breeding of a new Japonica rice variety with early-maturity,high quality and fragrance by molecular marker-assisted selection[J]. Molecular Plant Breeding,2019,17(22) :7408−7413. (in Chinese)
[19] 郑家团,杨德卫,董炼飞,等. 香型水稻的遗传和育种现状[J]. 福建农业学报,2012,27(10) :1134−1138. DOI: 10.3969/j.issn.1008-0384.2012.10.020 ZHENG J T,YANG D W,DONG L F,et al. Inheritance and breeding actuality of new quasi-aromatic rice (Oryza sativa. L) [J]. Fujian Journal of Agricultural Sciences,2012,27(10) :1134−1138. (in Chinese) DOI: 10.3969/j.issn.1008-0384.2012.10.020
[20] 黄显波,田志宏,邓则勤,等. 水稻三明显性核不育基因的初步鉴定[J]. 作物学报,2008,34(10) :1865−1868. DOI: 10.3321/j.issn:0496-3490.2008.10.026 HUANG X B,TIAN Z H,DENG Z Q,et al. Preliminary identification of a novel Sanming dominant male sterile gene in rice (Oryza sativa L.) [J]. Acta Agronomica Sinica,2008,34(10) :1865−1868. (in Chinese) DOI: 10.3321/j.issn:0496-3490.2008.10.026
[21] 李铮友,师常俊,李晓艾,等. 香软米滇屯502的选育[J]. 云南农业大学学报,1999,14(1) :28−32. LI Z Y,SHI C J,LI X A,et al. Breeding of Diantun502:Fragrant ant Soft Rice[J]. Journal of Yunnan Agricultural University (Natural Science) ,1999,14(1) :28−32. (in Chinese)
[22] 张婷. 分子标记辅助选择Pi9基因改良水稻不育系三香A稻瘟病抗性[D]. 长沙:湖南农业大学,2022. ZHANG T. Improving Blast Resistance of Rice CMS Line Sanxiang A Through Markerassisted Selection of the Pi9 Gene[D]. Changsha:Hunan Agricultural University,2022. (in Chinese)
[23] 王如意,刘杰,冯琴,等. 稻瘟病抗性分子机制及抗病育种策略研究进展[J]. 植物保护,2023,49(5) :32−42,70. WANG R Y,LIU J,FENG Q,et al. Deciphering the molecular mechanism of rice blast resistance and research progress of resistance breeding strategy[J]. Plant Protection,2023,49(5) :32−42,70. (in Chinese)
[24] 李连国. 水稻种质资源的稻瘟病抗性鉴定与抗菌谱测定[D]. 重庆:西南大学,2020. LI L G. Identification and Antibacterial Spectrum of Rice Blast Resistance in Rice Germplasm Resources[D]. Chongqing:Southwest University,2020. (in Chinese)
[25] 龙厚志. 水稻种质资源稻瘟病抗性的鉴定与评价[D]. 长沙:湖南农业大学,2017. LONG H Z. Identification and evaluation of rice blast resistance in Rice Germplasm Resources[D]. Changsha:Hunan Agricultural University,2017. (in Chinese)
[26] 朱速松,张玉珊. 轮回选择在水稻育种中的应用研究进展[J]. 贵州农业科学,2004,32(2) :62−64. ZHU S S,ZHANG Y S. Situation of recurrent selection applied in rice breeding[J]. Guizhou Agricultural Sciences,2004,32(2) :62−64. (in Chinese)
[27] 王倩. 贵州禾AC92香味基因的遗传分析[D]. 贵阳:贵州师范大学,2022. WANG Q. Genetic analysis of aroma gene of Guizhouhe AC9[D]. Guiyang:Guizhou Normal University,2022. (in Chinese)
[28] 吴子帅,麻东进,李虎,等. 香型优质常规稻品种‘广粮香2号’的选育与应用[J]. 中国农学通报,2022,38(36) :6−11. WU Z S,MA D J,LI H,et al. A conventional rice variety‘Guangliangxiang 2’ with fragrance and high quality:Breeding and utilization[J]. Chinese Agricultural Science Bulletin,2022,38(36) :6−11. (in Chinese)
[29] 黄娟,刘开强,邓国富,等. 水稻香味基因荧光分子标记开发及育种应用[J]. 植物生理学报,2020,56(5) :1015−1022. HUANG J,LIU K Q,DENG G F,et al. Development and breeding application of fluorescent molecular marker for rice fragrance gene[J]. Plant Physiology Journal,2020,56(5) :1015−1022. (in Chinese)





 下载:
下载: