Species, Growth-promoting, and Disease-resistance of Antagonistic Microbes in Passion Fruit Rhizosphere Soil
-
摘要:目的
从健康百香果根际土壤中筛选获得对百香果茎基腐病菌(Fusarium solani)具有拮抗活性的细菌菌株并进行相关特性研究,为该病害生物防治提供新的菌种资源和理论依据。
方法通过分离百香果健康根际土壤样品,采用对峙培养法,以F. solani为靶标菌筛选拮抗细菌,对所得拮抗菌株进行形态学观察、分子生物学鉴定,确定其分类地位。同时采用胞外酶检测平板测定拮抗细菌生防能力及通过番茄种子验证其促生能力。
结果从7份不同土壤样品中分离获得8株具有拮抗作用的细菌,其中NN-Q03-10、SL-Q02-05、SL-Q02-06对病原菌抑制效果最好,抑制率分别为57.81%、57.34%、57.34%。菌株分类地位属枯草芽胞杆菌Bacillus subtilis(4株)、贝莱斯芽胞杆菌Bacillus velezensis(4株)。8个菌株均具有产蛋白酶、纤维素酶、β-1,3-葡聚糖酶、木聚糖酶的能力,其基因组中含有bacA、FenB、yanJ抗生素基因,SL-Q02-05、NN-Q03-01、NN-Q03-09、NN-Q03-10菌株同时含有MycB、ifuA抗生素基因。使用番茄种子进行促生作用验证,结果显示6个菌株(SL-Q02-04、SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-01、NN-Q03-10)可促进胚根生长,其中SL-Q02-04促进作用最为明显,胚根长度为7.32 cm。
结论获得8株具有拮抗活性的菌株,能产蛋白酶、纤维素酶、β-1,3-葡聚糖酶、木聚糖酶,部分菌株基因组检测到了与抗生素相关的mycB、ituA、fenB、bacA和yndJ基因,具有良好的生防潜力。
Abstract:ObjectiveMicroorganisms antagonistic to Fusarium solani were isolated from the rhizosphere soil of healthy passion fruit plants and studied for potential application as a biocontrol agent.
MethodRhizosphere oil at the field of healthy passion fruit plants was sampled to isolate microbes antagonistic to F. solani using the confrontational culture method. Morphological observation and molecular identification were performed to determine the species and biological characteristics of the isolates. Potential as a biocontrol agent of the identified strains was evaluated on the extracellular enzyme detection plates, while possible growth promoting effect examined on tomato seeds.
ResultEight microbial strains antagonistic to F. solani were isolated from 7 soil specimens. Among them, NN-Q03-10, SL-Q02-05, and SL-Q02-06 exhibited the greatest inhibition rates of 57.81%, 57.34%, and 57.34%, respectively. Four of them belonged to Bacillus subtilis, and 4 to B. velezensis. All could produce proteases, cellulases, β-1,3-glucanases, and xylanases with genomes consisting of antibiotic bacA, FenB, and yanJ. In addition to those genes, SL-Q02-05, NN-Q03-01, NN-Q03-09, and NN-Q03-10 also contained MycB and ifuA.Validation of growth promoting effects using tomato seeds, and the results showed that six strains (SL-Q02-04、SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-01、NN-Q03-10) could promote embryonic root growth, among them, SL-Q02-04 had the most significant promoting effect with a embryonic root length of 7.32 cm.
ConclusionThe 8 Bacillus strains antagonistic to F. solani were identified. Their ability in producing protease, cellulase, β-1,3-glucanase, and xylanase and some of them having genomes containing mycB, ifuA, FenB, bacA, and yndJ related to antibiotic property strongly suggested a potential in serving as a biocontrol agent for F. solani infection on plants.
-
Keywords:
- Passion fruit /
- base stem rot /
- Fusarium solani /
- isolation and identification /
- biocontrol agent
-
0. 引言
【研究意义】百香果(Passiflora edulis Sims)属西番莲科(Passifloraceae)西番莲属(Passiflora)植物,是广西的特色水果之一。茎基腐病是百香果主要真菌病害之一,其病原为Fusarium solani,该病发生在植株茎基部,与地面有20~30 cm的距离,幼苗、成株均会被病菌侵染,造成植株褪绿萎蔫或枯萎死亡[1],严重影响百香果的产量和品质。目前百香果茎基病的生产防治技术还是以化学防治为主[2]。化学防治虽简便快速,但化学药剂长期使用易造成环境污染、生态失衡等问题,甚至威胁人类生命安全,因此,植物病害生物防治被认为是一种更安全和可持续发展的战略[3]。生物防治是推动农业可持续发展的重要组成,其借助自然界中不影响植物生长的微生物发挥其重寄生、竞争等多种生防作用,以直接或间接作用的方式影响病原物的生存或活动;同时可诱导植物的抗病性或促进植株生长,从而达到保护植株的目的[4]。与化学防治药剂相比,拮抗菌产生的抑菌物质具有毒性低、对环境友好,降低病原微生物耐药性的优点,可安全地应用于植物病害防治[5]。但菌株在实际应用过程中,其在土壤中的稳定性和在植物中的定植能力问题有待进一步研究和解决[6],才能提高菌株的存活和增殖能力,确保菌株在可持续农业中的商业化应用推广。【前人研究进展】Wang等[7]从土壤中分离得到贝莱斯芽胞杆菌(Bacillus velezensis)HNAH
17806 ,并从其发酵液中纯化出一种分子量约为 1.5 kDa 的抗真菌肽(BVAP),对菌丝抑制的 IC50 为 5.58 μg·mL−1,其作用机制为增加菌丝的通透性、导致菌丝尖端肿胀。Chen 等对分别从香蕉和茶树根际土壤中分离得到的枯草芽胞杆菌 YBC 和 151B1 进行研究,结果表明菌株在 SYB 培养基的无菌发酵液影响了 F. solani 细胞膜的完整性、抑制分生孢子的萌发和菌丝生长[8]。这些研究表明,拮抗菌在防治百香果茎基腐病中展现了广泛的应用前景及为研究拮抗菌与病原菌互作机制提供了理论参考。拮抗菌通过产生胞外酶水解病原菌细胞壁以破坏菌丝,抑制菌丝生长,常见的细胞壁降解酶类主要有纤维素酶、蛋白酶、几丁质酶,β-1,3-葡聚糖酶等[9]。除了直接抑制病原菌,拮抗菌还表现出显著的植物促生作用。例如,贝莱斯芽胞杆菌W-1对花椒根腐病的抑菌率高达89%,其通过生物固氮、磷酸盐溶解以及分泌植物激素如吲哚-3-乙酸(IAA)、细胞分裂素(CTK)和赤霉素(GA),有效促进植物生长[10,11],为芽胞杆菌在多种作物病害防治中的应用提供了理论支持。此外,杨东亚等[12]发现菌株XY-1、XY-13、XY-53不仅对腐皮镰刀菌抑制效果显著,还能通过产蛋白酶、固氮等途径,显著提高黄瓜幼苗的生物量,进一步证实了拮抗菌在病害防治和植物促生中的双重作用。油茶根部内生的芽胞杆菌AF9和AH6则被发现具有诱导植物产生系统抗性(ISR)的能力[13]。李丽丽等[13]研究表明,这些菌株不仅能有效降低油茶根腐病的发生,还能通过增强植物的抗病性和促进生长,展现出广泛的生防潜力。【本文切入点】尽管前人研究已经表明芽胞杆菌在植物病害生物防治中具有显著的潜力,但关于百香果茎基腐病的生物防治研究较少,特别是在高效生防菌株的筛选和其作用机制方面的研究还不够深入。【拟解决的关键问题】从健康的百香果根际土壤中筛选鉴定拮抗细菌,并进行初步的生防、促生作用研究,进一步明确拮抗菌与病原菌的作用机制,以期为百香果茎基腐病生物防治提供新的菌种资源和理论依据,最终推动生防制剂的开发和应用。1. 材料与方法
1.1 试验材料
1.1.1 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)[14]:葡萄糖20 g、琼脂20 g 、土豆粉6 g,去离子水定容至1 000 mL。
LB培养基(luria-bertani medium)[15]:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g。(LB固体培养基在LB培养基的基础上加入18 g琼脂)。
1.1.2 根际土壤样品采集
广西南宁市上林县白圩镇(108°48′ 28.54″E, 23°26′ 17.25″N)健康黄金、维蜜、钦蜜百香果根际土各2份,广西南宁市良庆区那马镇(108°26′ 43.13″E, 22°38′ 40.82″N)健康台农一号百香果根系土1份。
1.2 试验方法
1.2.1 根际土壤细菌分离
采用稀释涂布法[16]分离土壤中的细菌,称取1 g根际土壤样品,加入9 mL无菌水,并稀释至10−5倍液,分别吸取10−3、10−4、10−5倍液各100 µL涂板,每个浓度重复3次,置于28 ℃培养箱中培养。根据菌落大小、颜色、质地、光泽及表面形态等特征挑选形态差异显著的单菌落用平板划线法纯化,转接至新的LB固体培养基平板上培养,4 ℃保存备用。
1.2.2 拮抗细菌的筛选
采用平板对峙法对分离纯化的菌株进行初筛和复筛,以F. solani为靶标菌,当菌落直径培养至6~7 cm后,从菌丝边缘打取菌饼接种至PDA培养基中央,并在距病原菌2.2 cm的四周接种4种不同的待测菌株,对照为只接种病原菌,设3次重复,置于28 ℃培养箱中培养,待对照菌丝长满平板,测量各处理的菌落直径大小,计算抑制率 [17]。抑制率/%=[(对照菌落直径−菌饼直径)−(处理菌落直径−菌饼直径)]/(对照菌落直径−菌饼直径)×100。将初筛具有明显抑制作用的菌株进行复筛,在距病原菌2.2 cm的两侧接种同种菌株,其余步骤参照初筛。
1.2.3 拮抗菌鉴定
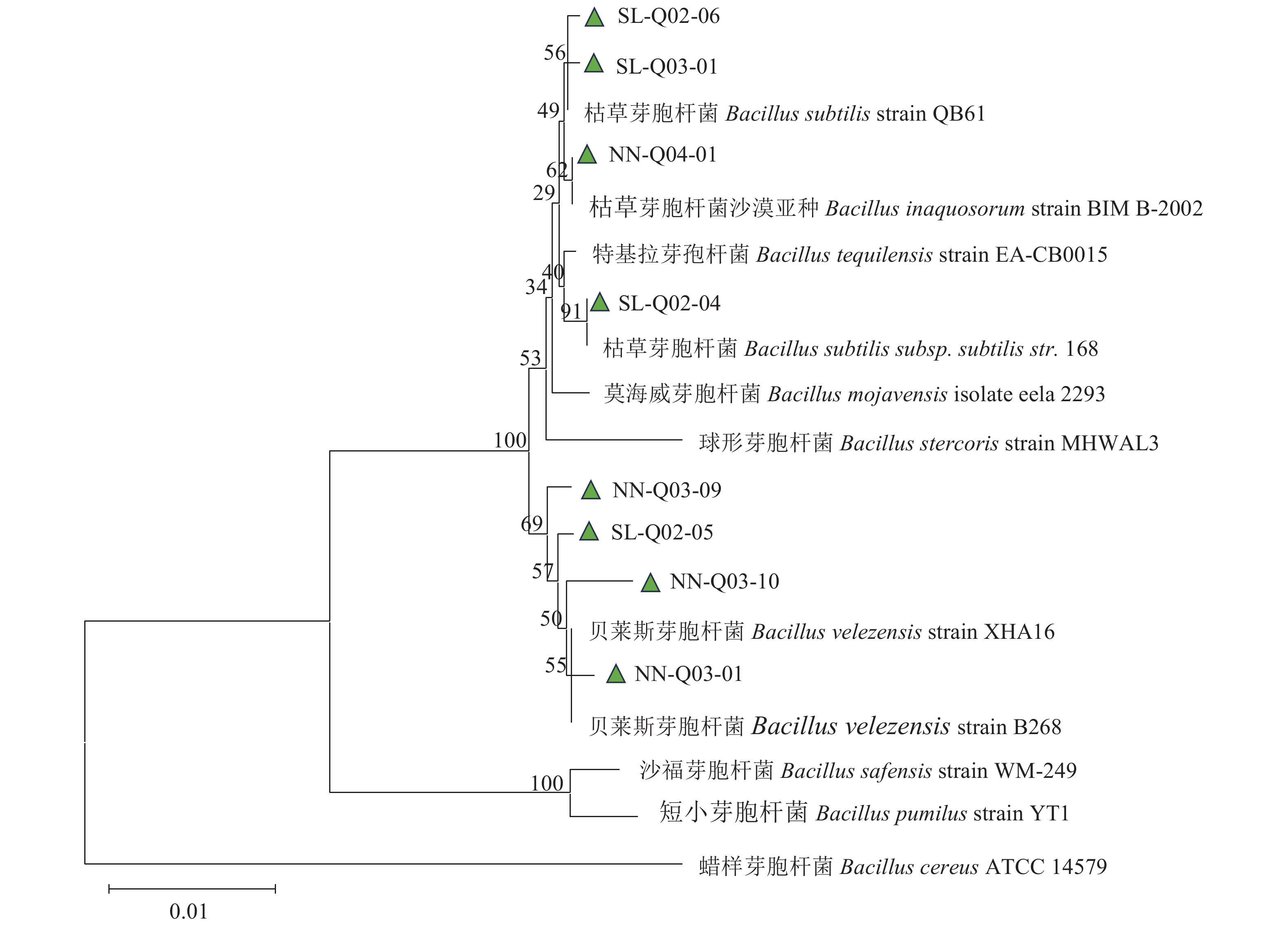
将菌株划线培养于LB固体培养基后置于28 ℃培养箱中培养5 d 后观察不同菌株单菌落的形态特征。采用菌落PCR的方法,以通用引物27F/1492R[18]进行PCR扩增,PCR反应体系(50.0 μL):2×Taq MasterMix 25.0 μL,上、下游引物各2.0 μL,DNA模板为少量菌体,ddH2O 19.0 μL;反应程序:预变性95 ℃、5 min;变性95 ℃、30 s,退火56 ℃、30 s,延伸72 ℃、1 min,33个循环;终延伸72 ℃、10 min。扩增产物纯化回收,并克隆至载体pUC-19T上(具体步骤参照Takara TA克隆试剂盒说明书),送至上海生工生物有限公司进行测序,并将测序结果在National Center for Biotechnology Information(https://www.ncbi.nlm.nih.gov/BLAST/)数据库中进行比对,利用 MAGA11.0软件中的邻接法构建菌株与其相关近缘属种的系统发育树。
1.2.4 拮抗菌抗生素相关基因检测
参照宋文欣[19]的引物进行抗生素基因引物合成。以拮抗菌株的总DNA为模板,以表1所示引物进行PCR扩增,对mycB(抗霉枯草菌素)、ifuA(伊枯草菌素)、yndj、fenB(丰原素)和bacA(溶杆菌素)5种抗生素产生相关基因进行检测,扩增产物经1.0%琼脂糖凝胶电泳检测。
表 1 检测抗生素产生相关基因的引物序列Table 1. Primers for detecting genes related to antibiotic production基因名称
Genes引物名称
Primer引物序列(5′→3′)
Primer sequences退火温度
Annealing temperature/ ℃mycB MycB-F ATGTCGGTGTTTAAAAATCAAGTAACG 55 MycB-R TTAGGACGCCAGCAGTTCTTCTATTGA fenB FenB-F CTATAGTTTGTTGACGGCTC 55 FenB-R CAGCACTGGTTCTTGTCGCA ifuA IfuA-F ATGTATACCAGTCAATTCC 55 IfuA-R GATCCGAAGCTGACAATAG bacA BacA-F CAGCTCATGGGAATGCTTTT 58 BacA-R CTCGGTCCTGAAGGGACAAG yndj 147-F CAGAGCGACAGCAATCACAT 55 147-R TGAATTTCGGTCCGCTTATC 1.2.5 拮抗菌胞外酶检测
参考宋文欣[19]的方法,将拮抗菌株点接至10 mL LB培养基置于28 ℃、200 r·min−1的摇床培养12 h后吸取500 μL至新的20 mL LB培养基中扩大培养至OD600=0.6,吸取菌液1 μL均匀的点接在距蛋白酶、纤维素酶、几丁质酶、β,1-3-葡聚糖酶、木聚糖酶检测平板中心2.2 cm处,CK为点接等量的LB培养基,重复3次,置于28 ℃培养箱中培养3 d,观察菌落周围是否产生透明圈,若产生透明圈,测量菌株直径和透明圈直径的大小。而纤维素酶活性检测在培养相同时间后加入10 mL的1 mg·mL−1刚果红静置30 min后,倒掉该溶液,加入等量的1 mol·L−1 NaCl静置30 min后倒掉,观察菌落周围是否产生透明圈,若产生透明圈,测量菌株及透明圈直径的大小。
1.2.6 拮抗细菌菌株对番茄种子的促生作用研究
参考杨晓云[20]的方法并稍改动,先用无菌水浸泡番茄的种子(品种为抗枯番茄)12 h,接着用1%次氯酸钠溶液浸泡消毒10 min,再用无菌水清洗3次后置于无菌培养皿中待用;将拮抗菌培养至OD600=0.8,吸取5 mL菌液浸泡12 h,对照为等量的LB培养基,经菌液浸泡过的种子用无菌水清洗表面菌体,吸干表面水分,将种子置于有湿润滤纸的瓶子中,每处理20颗,设3次重复。48 h记录种子的发芽率,7 d后测量种子的胚根长、胚芽长等生物量,计算种子的平均发芽率,胚根和胚芽的均值和标准差。
1.2.7 拮抗菌相容性研究
于同一LB固体培养基平板上接种不同菌株研究其相容性,将拮抗细菌划线接种至LB固体培养基上并两两相交,置于28 ℃培养箱中培养5 d,试验重复3次,观察菌株间是否存在抑菌带或抑菌圈,上述两种现象均无表示菌株相容,反之则不相容[21]。
1.3 数据统计与分析
使用软件IBM SPSS Statistics 25进行统计学分析,采用Duncan新复极差法进行多重比较。
2. 结果与分析
2.1 拮抗菌分离与筛选
采用平板对峙法对分离纯化菌株进行筛选,共分离得到52株菌株,其中8株具有拮抗作用,对病原菌的抑制率介于42.18%~57.81%(图1),其中NN-Q01-10、SL-Q02-05、SL-Q02-06对病原菌抑制效果最好,抑制率分别为57.81%、57.34%、57.34%。
2.2 拮抗菌鉴定
2.2.1 形态学观察
拮抗细菌形态学观察结果(图2)显示SL-Q02-04、SL-Q02-06、SL-Q03-01、NN-Q04-01菌落近圆形,表面干燥,易挑起,不凸起,表面有少量杆状褶皱,菌落米白色,边缘不光滑,不透明。SL-Q02-05、NN-Q03-01菌落圆形,表面干燥,易挑起,不凸起,表面有杆状褶皱,质地较粗糙,菌落米白色,边缘不光滑,不透明。NN-Q03-09菌落圆形,表面干燥,凸起,易挑起,有褶皱,菌落白色,边缘不光滑,不透明。NN-Q03-10菌落圆形,表面干燥,凸起,不易挑起,有褶皱,菌落白色,边缘不光滑,不透明。
2.2.2 分子鉴定
分别以8个拮抗菌株的DNA为模板扩增16S rDNA,得到
1514 bp大小的片段,测序结果提交至NCBI获得登录号(PP917510~PP917517)。在NCBI中进行Blast比对,并基于16S rDNA基因构建进化树,以蜡样芽胞杆菌(B. cereus)为外群(图3)。其中,SL-Q02-04与Bacillus subtilis subsp. subtilis str. 168聚为一支,SL-Q02-06、SL-Q03-01与Bacillus subtilis strain QB61聚为一支,NN-Q04-01与Bacillus inaquosorum strain BIM B-2002聚为一支,SL-Q02-05、NN-Q03-01、NN-Q03-09、NN-Q03-10与Bacillus velezensis strain XHA16聚为一支,表明分离菌株主要属枯草芽胞杆菌(B. subtilis)、贝莱斯芽胞杆菌(B. velezensi)、枯草芽胞杆菌沙漠亚种(B. subtilis subsp. inaquosorum)。2.3 拮抗菌抗生素相关基因检测
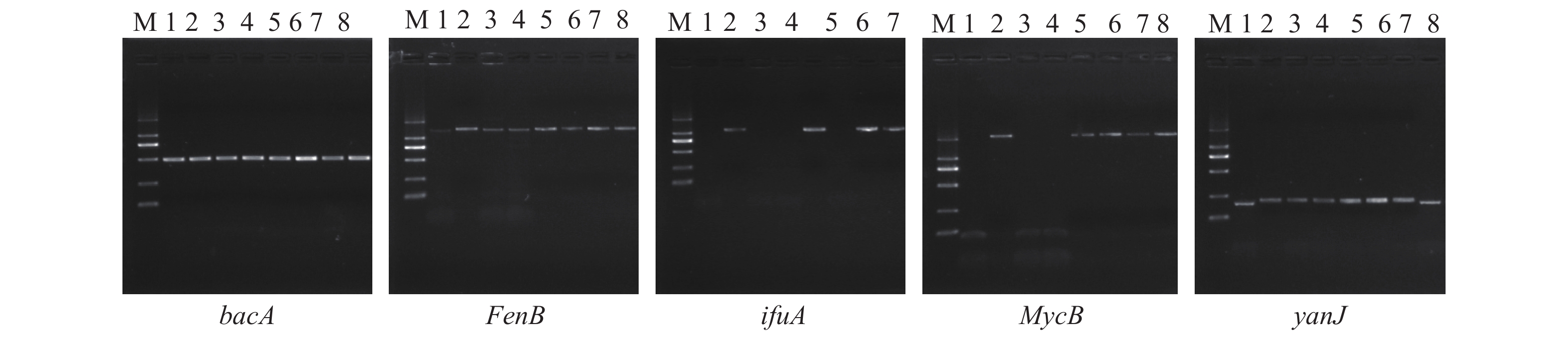
由抗生素合成相关基因PCR产物电泳结果(图4)可以看出8个菌株均具有bacA、FenB、yanJ抗生素基因,推测其基因组具有可产生相应的抗生素类物质的基因,此外,SL-Q02-05、NN-Q03-01、NN-Q03-09、NN-Q03-10扩增得到MycB(抗霉枯草菌素)、ifuA(伊枯草菌素)相应的单一条带。根据抗生素相关基因检测结果推测拮抗菌株可能在发酵培养条件下产生相关抗生素,可进一步进行抗生素合成基因簇预测,及抗生素提取、纯化、鉴定等试验验证。
2.4 拮抗细菌胞外酶活性
通过蛋白酶、纤维素酶、β-1,3-葡聚糖酶及木聚糖酶的检测平板测定8个拮抗菌株的胞外酶活性。结果显示,所有菌株均可分泌这四种胞外酶,NN-Q03-09产蛋白酶能力最强,同时拮抗菌株在β-1,3-葡聚糖酶检测平板上产生的透明圈边界不清晰,证明产生β-1,3-葡聚糖酶的能力较弱,而在木聚糖平板上可产生相对明显的透明圈(图5)。
2.5 拮抗细菌菌株对番茄种子促生作用研究
番茄种子在不同拮抗菌液处理后,结果显示番茄种子的长势较好,有6个菌株(SL-Q02-04、SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-01、NN-Q03-10)对胚根生长具有明显的促进作用,其中SL-Q02-04最为明显,该菌株菌液处理后番茄幼苗的胚根最长为7.32 cm;所有菌株对番茄发芽率和胚芽生长均没有促进作用(图6、表2)。
表 2 不同拮抗菌处理下番茄种子的生物量统计Table 2. Statistics on tomato seed biomass under antagonistic treatments处理
Treatment发芽率
Germination percentage/%胚根长
Embryo root
length/cm胚芽长
Embryo length/cmCK 0.87±0.03 a 4.76±0.24 d 5.31±0.11 a SL-Q02-04 0.75±0.00 abc 7.32±0.06 a 5.39±0.61 a SL-Q02-05 0.83±0.07 ab 6.03±0.04 bc 5.77±0.17 a SL-Q02-06 0.72±0.02 bc 6.65±0.12 ab 5.16±0.33 a SL-Q03-01 0.87±0.08 abc 6.17±0.24 b 5.83±0.10 a NN-Q03-01 0.77±0.07 c 6.67±0.14 ab 4.50±0.13 a NN-Q03-09 0.85±0.03 ab 5.07±0.51 d 4.70±1.02 a NN-Q03-10 0.87±0.05 a 6.63±0.16 ab 5.83±0.25 a NN-Q04-01 0.77±0.02 abc 5.29±0.21 cd 5.33±0.11 a 表中数据为平均数±标准误。同列不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。
Data are average ± standard error; those with different lowercase letters on same column indicate significant difference by Duncan's new complex range test (P<0.05).2.6 拮抗菌相容性
对8个拮抗菌株进行相容性测定,结果显示菌株接种培养5 d后(图7),NN-Q04-01与剩余菌株均不相容,SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-09间不相容,SL-Q02-06与NN-Q03-01不相容,SL-Q03-01与NN-Q03-01不相容,部分相容性较好的拮抗菌株可用于后续的复合使用。
3. 讨论与结论
生物防治是农业生产上安全、有效的防控方法,近年来研究应用较为广泛。然而,关于百香果茎基腐病的生物防治研究相对较少,主要以化学防治为主,尽管已有部分拮抗真菌和细菌被筛选出来,但其应用范围仍然有限。菌株筛选和鉴定是拮抗菌开发和应用的基础[22],本研究从健康的百香果根际土壤分离筛选出8株具有抑制作用的拮抗菌株,主要包括枯草芽胞杆菌、贝莱斯芽胞杆菌、枯草芽胞杆菌沙漠亚种。这表明健康植株根际土壤是有效生防材料的来源之一。
Wang等[7]从贝莱斯芽胞杆菌B. velezensis HNAH
17806 发酵液中分离得到抗真菌肽BVAP,并鉴定为丰原素,其通过增加真菌膜通透性,诱导菌丝膨胀,导致核酸和几丁质在膨胀部位异常积累。本研究中贝莱斯芽胞杆菌B. velezensis菌株NN-Q03-01、NN-Q03-09、NN-Q03-10可检测到FenB抗生素基因,这与Wang等[7]的研究结果一致,为后续进一步验证该抗生素基因的功能提供了基础。Chen等[8]研究发现枯草芽胞杆菌菌株151B1和YBC的发酵菌液可影响腐皮镰刀菌F. solani的膜完整性并诱导其凋亡。同时151B1菌株还能产生iturin A化合物,推测该脂肽可诱导病原菌的凋亡。此外,Ntushelo等[23]指出,iturins与真菌细胞膜接触后可形成离子传导孔,破坏质膜,导致细胞内含物渗漏。本研究发现,枯草芽胞杆菌SL-Q02-05能够扩增出ifuA抗生素基因,与前人研究结果一致,后续研究将进一步验证该菌株的抗菌活性。植物病原菌细胞壁主要由纤维素、葡聚糖、蛋白质组成,胞外酶的产生有利于破坏病原菌细胞壁结构,从而发挥抑菌作用[24]。本研究通过胞外酶检测证实, 8个菌株均具有产生蛋白酶、纤维素酶、β-1,3-葡聚糖酶、木聚糖酶的能力,尤其是产蛋白酶与纤维素酶的能力较强,因而表现较好的抑制效果,推测为拮抗菌与病原菌的作用机制之一,后续可进行病原菌与拮抗菌作用机制相关研究。前人研究表明枯草芽胞杆菌YB-04、LY-1,能分泌胞外蛋白酶、淀粉酶、纤维素和β-1,3-葡聚糖酶等胞外酶,分解植物病原菌细胞壁抑制其生长[25,26],与本研究结果相符。上述研究结果证实拮抗菌通过分泌胞外酶抑制病原菌生长,为进一步明确拮抗菌与病原菌的作用机制奠定了理论基础。此外,研究发现可通过相容性试验筛选复配菌株,实现菌株之间的优势互补,增强生防效果和稳定性[27]。枯草芽胞杆菌菌株EPCO16、 EPC5与荧光假单胞菌菌株Pf1联合使用可有效抑制F. solani的生长,并提高β-1,3-葡聚糖酶、几丁质酶、酚类酶的活性,表明复配菌株间具有协同作用,增强了防治效果[28]。这一结果为探究不同菌株的协同防治效应及其在开发混合菌剂的应用研究提供理论参考。
-
表 1 检测抗生素产生相关基因的引物序列
Table 1 Primers for detecting genes related to antibiotic production
基因名称
Genes引物名称
Primer引物序列(5′→3′)
Primer sequences退火温度
Annealing temperature/ ℃mycB MycB-F ATGTCGGTGTTTAAAAATCAAGTAACG 55 MycB-R TTAGGACGCCAGCAGTTCTTCTATTGA fenB FenB-F CTATAGTTTGTTGACGGCTC 55 FenB-R CAGCACTGGTTCTTGTCGCA ifuA IfuA-F ATGTATACCAGTCAATTCC 55 IfuA-R GATCCGAAGCTGACAATAG bacA BacA-F CAGCTCATGGGAATGCTTTT 58 BacA-R CTCGGTCCTGAAGGGACAAG yndj 147-F CAGAGCGACAGCAATCACAT 55 147-R TGAATTTCGGTCCGCTTATC 表 2 不同拮抗菌处理下番茄种子的生物量统计
Table 2 Statistics on tomato seed biomass under antagonistic treatments
处理
Treatment发芽率
Germination percentage/%胚根长
Embryo root
length/cm胚芽长
Embryo length/cmCK 0.87±0.03 a 4.76±0.24 d 5.31±0.11 a SL-Q02-04 0.75±0.00 abc 7.32±0.06 a 5.39±0.61 a SL-Q02-05 0.83±0.07 ab 6.03±0.04 bc 5.77±0.17 a SL-Q02-06 0.72±0.02 bc 6.65±0.12 ab 5.16±0.33 a SL-Q03-01 0.87±0.08 abc 6.17±0.24 b 5.83±0.10 a NN-Q03-01 0.77±0.07 c 6.67±0.14 ab 4.50±0.13 a NN-Q03-09 0.85±0.03 ab 5.07±0.51 d 4.70±1.02 a NN-Q03-10 0.87±0.05 a 6.63±0.16 ab 5.83±0.25 a NN-Q04-01 0.77±0.02 abc 5.29±0.21 cd 5.33±0.11 a 表中数据为平均数±标准误。同列不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。
Data are average ± standard error; those with different lowercase letters on same column indicate significant difference by Duncan's new complex range test (P<0.05). -
[1] 滕峥,杨翠凤,林有林. 西番莲茎基腐病主要致病菌及其防治研究进展[J]. 安徽农学通报,2021,27(20) :100−102. TENG Z,YANG C F,LIN Y L. Research progress on main pathogenic bacteria of stem-base rot of Passiflora coerulea L. and its control[J]. Anhui Agricultural Science Bulletin,2021,27(20) :100−102. (in Chinese)
[2] 陈圆,赵志祥,严婉荣,等. 百香果茎基腐病病原鉴定及室内毒力测定[J]. 中国南方果树,2022,51(6) :90−94. CHEN Y,ZHAO Z X,YAN W R,et al. Identification of stem base rot pathogen of passion fruit and its indoor toxicity test[J]. South China Fruits,2022,51(6) :90−94. (in Chinese)
[3] SHAFI J,TIAN H,JI M S. Bacillusspecies as versatile weapons for plant pathogens:A review[J]. Biotechnology & Biotechnological Equipment,2017,31(3) :446−459.
[4] 陈学新,杜永均,黄健华,等. 我国作物病虫害生物防治研究与应用最新进展[J]. 植物保护,2023,49(5) :340−370. CHEN X X,DU Y J,HUANG J H,et al. Recent progresses in biological control of crop pathogens and insect pests in China[J]. Plant Protection,2023,49(5) :340−370. (in Chinese)
[5] 许沛冬,易剑锋,陈迪,等. 贝莱斯芽孢杆菌生防次级代谢产物研究进展[J]. 生物技术通报,2024,40(3) :75−88. XU P D,YI J F,CHEN D,et al. Research progress in the biocontrol secondary metabolites of Bacillus velezensis[J]. Biotechnology Bulletin,2024,40(3) :75−88. (in Chinese)
[6] DE MORAES A C P,DA SILVA RIBEIRO L,DE CAMARGO E R,et al. The potential of nanomaterials associated with plant growth-promoting bacteria in agriculture[J]. 3 Biotech,2021,11(7) :318. DOI: 10.1007/s13205-021-02870-0
[7] WANG C C,YE X J,NG T B,et al. Study on the biocontrol potential of antifungal peptides produced by Bacillus velezensis against Fusarium solani that infects the passion fruit Passiflora edulis[J]. Journal of Agricultural and Food Chemistry,2021,69(7) :2051−2061. DOI: 10.1021/acs.jafc.0c06106
[8] CHEN Y H,LEE P C,HUANG T P. Biological control of collar rot on passion fruits via induction of apoptosis in the collar rot pathogen by Bacillus subtilis[J]. Phytopathology,2021,111(4) :627−638.
[9] LIU Y F,CHEN Z Y,NG T B,et al. Bacisubin,an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J]. Peptides,2007,28(3) :553−559. DOI: 10.1016/j.peptides.2006.10.009
[10] 田凤鸣,陈强,何九军,等. 一株花椒根腐病拮抗菌的筛选、发酵条件及其抑菌物质的初步分析[J]. 微生物学通报,2023,50(7) :2950−2969. TIAN F M,CHEN Q,HE J J,et al. A biocontrol bacterial strain against Zanthoxylum bungeanum root rot:Screening,fermentation condition optimization,and preliminary identification of antimicrobial ingredients[J]. Microbiology China,2023,50(7) :2950−2969. (in Chinese)
[11] RATNANINGSIH H R,NOVIANA Z,DEWI T K,et al. IAA and ACC deaminase producing-bacteria isolated from the rhizosphere of pineapple plants grown under different abiotic and biotic stresses[J]. Heliyon,2023,9(6) :e16306. DOI: 10.1016/j.heliyon.2023.e16306
[12] 杨东亚,祁瑞雪,李昭轩,等. 黄瓜茄病镰刀菌拮抗芽胞杆菌的筛选、鉴定及促生效果[J]. 生物技术通报,2023,39(2) :211−220. YANG D Y,QI R X,LI Z X,et al. Screening,Identification and Growth-promoting Effect of Antagonistic Bacillus spp. Against Cucumber Fusarium solani[J]. Biotechnology Bulletin,2023,39(2) :211−220. (in Chinese)
[13] 李丽丽,曾广宇,王继春,等. 油茶根腐病内生拮抗促生细菌筛选及诱导系统抗性研究[J]. 中国油料作物学报:2024,46(6) :1390−1397. LI L L,ZENG G Y,WANG J C,et al. Screening and systematic resistance induction of endogenous antagonistic growth-promoting bacteria against camellia oleifera root rot[J]. Chinese Journal of Oil Crop Sciences:2024,46(6) :1390−1397. (in Chinese)
[14] 尚笑男,刘君昂,冯福山,等. 油茶内生拮抗细菌的筛选、鉴定及防效[J]. 中国生物防治学报,2021,37(3) :575−583. SHANG X N,LIU J A,FENG F S,et al. Screening,identification and antagonistic effect of endophytic antagonistic bacterial strains from Camellia oleifera[J]. Chinese Journal of Biological Control,2021,37(3) :575−583. (in Chinese)
[15] 兰成忠,甘林,代玉立,等. 黄瓜枯萎病菌拮抗菌的筛选、鉴定和防效测定[J]. 中国生物防治学报,2023,39(1) :184−193. LAN C Z,GAN L,DAI Y L,et al. Screening,identification and biocontrol effect of antagonistic strain against Fusarium oxysporum f. sp. cucumerinum[J]. Chinese Journal of Biological Control,2023,39(1) :184−193. (in Chinese)
[16] 黄秀梨. 微生物学实验指导[M]. 北京:高等教育出版社,1999. [17] 魏靖宇,韩雨桐,翟文旭,等. 黄瓜土传病害拮抗细菌的筛选、鉴定及生防特性研究[J]. 中国生物防治学报,2022,38(6) :1582−1591. WEI J Y,HAN Y T,ZHAI W X,et al. Screening,identification and biocontrol characteristics of antagonistic bacteria against cucumber soil-borne diseases[J]. Chinese Journal of Biological Control,2022,38(6) :1582−1591. (in Chinese)
[18] 张玉丹,谭琳,任佐华,等. 茶炭疽病拮抗链霉菌的筛选鉴定与拮抗能力测定[J]. 中国生物防治学报,2023,39(3) :646−656. ZHANG Y D,TAN L,REN Z H,et al. Screening,identification and determination of antagonistic actinomycetes strain against tea anthracnose[J]. Chinese Journal of Biological Control,2023,39(3) :646−656. (in Chinese)
[19] 宋文欣. 六株拮抗芽胞杆菌对土传病害病原菌的抑制作用及其生物学特性的初步研究[D]. 南宁:广西大学,2020. SONG W X. Study on the inhibiyion of antagonistic bacillus on the pathogens of soilborne diseases and their biological characteristics[D]. Nanning:Guangxi University,2020. (in Chinese)
[20] 杨晓云,陈志谊,蒋盼盼,等. 解淀粉芽孢杆菌B1619对番茄的促生作用[J]. 中国生物防治学报,2016,32(3) :349−356. YANG X Y,CHEN Z Y,JIANG P P,et al. Growth-promotion effect of Bacillus amyloliquefaciens B1619 on tomato plant[J]. Chinese Journal of Biological Control,2016,32(3) :349−356. (in Chinese)
[21] 宋新娜,梅凤珍,李香风,等. 草莓枯萎病拮抗细菌的筛选及其防治效果[J]. 中国生物防治学报,2022,38(3) :653−661. SONG X N,MEI F Z,LI X F,et al. Screening and control effect of antagonistic bacteria against strawberry Fusarium wilt[J]. Chinese Journal of Biological Control,2022,38(3) :653−661. (in Chinese)
[22] 姚锦爱,黄鹏,赖宝春,等. 链霉菌ZZSP-7的鉴定及其对草莓炭疽病的防效[J]. 中国生物防治学报,2021,37(1) :178−183. YAO J A,HUANG P,LAI B C,et al. Identification and control efficacy of Streptomyces sp. ZZSP-7 against strawberry anthracnose[J]. Chinese Journal of Biological Control,2021,37(1) :178−183. (in Chinese)
[23] NTUSHELO K,LEDWABA L K,RAUWANE M E,et al. The mode of action of Bacillus species against Fusarium graminearum,tools for investigation,and future prospects[J]. Toxins,2019,11(10) :606. DOI: 10.3390/toxins11100606
[24] 黄勋,丰加文,金春林,等. 侧孢短芽胞杆菌JYC 688鉴定及抑菌促生特性研究[J]. 植物保护,2024,50(2) :153−162. HUANG X,FENG J W,JIN C L,et al. Identification of Brevibacillus laterosporus JYC 688 against potato common scab and its growth promoting characteristics[J]. Plant Protection,2024,50(2) :153−162. (in Chinese)
[25] XU W,YANG Q,YANG F,et al. Evaluation and genome analysis of Bacillus subtilis YB-04 as a potential biocontrol agent against Fusarium wilt and growth promotion agent of cucumber[J]. Frontiers in Microbiology,2022,13:885430. DOI: 10.3389/fmicb.2022.885430
[26] LI Y,ZHANG X,HE K,et al. Isolation and identification of Bacillus subtilis LY-1 and its antifungal and growth-promoting effects[J]. Plants,2023,12(24) :4158. DOI: 10.3390/plants12244158
[27] 陶正朋,刘艳霞,李想,等. 烟草青枯病拮抗菌的高通量筛选及其复配菌群防效评估[J]. 中国烟草科学,2024,45(2) :35−45. TAO Z P,LIU Y X,LI X,et al. High-throughput screening of antagonistic bacteria against tobacco bacterial wilt and biocontrol effects of compound microbial agents[J]. Chinese Tobacco Science,2024,45(2) :35−45. (in Chinese)
[28] SUNDARAMOORTHY S,RAGUCHANDER T,RAGUPATHI N,et al. Combinatorial effect of endophytic and plant growth promoting rhizobacteria against wilt disease of Capsicum annum L. caused by Fusarium solani[J]. Biological Control,2012,60(1) :59−67.




 下载:
下载: