Accumulation, subcellular distribution, and chemical forms of zinc in Myriophyllum spicatum L.
-
摘要:目的
探讨锌在狐尾藻(Myriophyllum spicatum L.)体内的富集性及分布特征。
方法通过水培试验研究不同锌浓度(0、50、200 mg·L−1)对狐尾藻生物量、株高、叶片表皮细胞变化和抗氧化酶活性的影响,分析各器官中锌积累含量及亚细胞分布和化学形态。
结果狐尾藻在各浓度锌处理下均能存活,当锌浓度50 mg·L−1时,狐尾藻株高和生物量相较于对照组(锌浓度0 mg·L−1)分别显著增加了22.87%和10.06%,根、叶中SOD活性也显著高于对照,而叶绿素和根、叶中MDA含量与对照无明显差异;当锌浓度为200 mg·L−1时,狐尾藻的株高、生物量相比对照无显著差异,而其叶绿素含量显著低于对照处理,根、叶中MDA和SOD活性显著高于对照,其叶片表皮细胞有部分损伤。锌处理后,狐尾藻根、茎和叶锌含量分别为55.48~242.44、14.78~31.02 mg·kg−1和18.01~69.79 mg·kg−1,Z1和Z2处理后各器官中锌含量显著高于对照处理,且根部中锌含量显著高于叶片和茎部。狐尾藻叶和茎中锌主要分布于细胞壁,分别占32.56%~49.50%和41.21%~43.52%;根中锌主要分布于可溶性组分,占比为32.10%~50.48%。狐尾藻叶和茎中锌的化学形态以氯化钠提取态、醋酸提取态、盐酸提取态为主,所占比例分别为77.00%~86.00%和81.00%~86.38%,根部中锌主要以水提取态、氯化钠提取态为主,占59.71%~63.65%。
结论由此可知,狐尾藻对锌具有较好的富集能力,其根部的富集能力大于茎叶。细胞壁沉积固定、液泡(可溶组分)区隔化及锌以多种低活性形态存在是狐尾藻积累与耐受锌的重要机制。
Abstract:ObjectiveTo explore the enrichment and distribution characteristics of zinc in the body of Myriophyllum spicatum L.,
Methoda hydroponic experiments was conducted to investigate its biomass, height, leaf epidermal cell variation and antioxidant enzyme activities. The subcellular distribution and chemical form of Zn in roots, stems and leaves were further analyzed.
ResultThe results showed that M. spicatum can survive under different concentrations of Zn treatments. At a zinc concentration of 50 mg·L−1, both plant height and biomass significantly increased by 22.87% and 10.06%, respectively, compared to the control group, while there was no significant difference in chlorophyll content and MDA content in roots and leaves compared to the control. However, the SOD activity in roots and leaves was significantly higher than that of the control. Under a zinc concentration of 200 mg·L−1, there was no significant difference in the plant height and biomass of M. spicatum compared to the control. However, the chlorophyll content was significantly lower than that of the control treatment. Additionally, the roots and leaves exhibited significantly higher MDA content and SOD activity than the control. The leaf epidermal cells of M. spicatum exhibited partial damage. After Zn treatment, the Zn contents in the roots, stems and leaves of M. spicatum were 55.48~242.44, 14.78~31.02 mg·kg−1 and 18.01~69.79 mg·kg−1, respectively. The zinc contents in various organs of Z1 and Z2 treatments were significantly higher than those of the control, and the zinc content in the roots was significantly higher than that in the leaves and stems. The subcellular distribution of Zn in M. spicatum is mainly located in the cell wall parts of leaves and stems, accounting for 32.56%~49.50% and 41.21%~43.52%, respectively. Under exogenous Zn treatment, the Zn in the roots of M. spicatum was mainly present in soluble fractions, comprising 32.10%~50.48% of the total. The Zn existed in NaCl-, HAc-, and HCl-extracted forms in leaves and stems of M. spicatum accounting for 77.00%~86.00% and 81.00%~86.38%, respectively.And Zn mainly existed in water and NaCl-extracted forms in roots, accounting for 59.71%~63.65%.
ConclusionTherefore, M. spicatum is a plant with better Zn accumulation, with roots having a stronger capacity than stems and leaves. The main resistance mechanism underlying Zn accumulation and tolerance in M. spicatum might involve cell wall retention, vacuoles segregation (soluble components) and the presence of Zn in various low-reactivity forms.
-
Keywords:
- Myriophyllum spicatum L. /
- Zn /
- subcellular distribution /
- chemical forms /
- tolerance mechanism
-
0. 引言
【研究意义】锌是动物生命活动和生长发育的关键微量元素,它是动物体内众多关键酶的必要组成部分或激活因子,在维持机体生长发育、稳定免疫功能等方面发挥着不可或缺的作用,素有“生命元素”之称[1−2]。自上世纪九十年代以来,众多养殖户利用高锌促进动物生长,致使出现锌微量元素过量使用甚至滥用的情况。由于动物机体对锌元素利用率较低(不足5%),未被吸收的锌元素(95%以上)主要随动物粪便及尿液排出体外[3]。据统计,我国每年饲料中添加的锌约7万吨,因浓缩效应,畜禽粪便中的锌含量常高于饲料中的锌含量数倍甚至数十倍,其中猪粪中锌含量还以每年约55.9 mg·kg−1速率持续增长,这将对生态环境构成严重的威胁[4]。朱建春等[5]研究表明畜禽粪污中重金属以铜、锌为主;袁凯等[6]调查显示不同畜禽粪便中锌含量普遍高于铜,90%的猪粪样品锌含量在2 138.5 mg·kg−1左右。过量的锌进入水体,不仅会造成环境重金属污染,还会影响植物生长,甚至危害人体健康[7−8]。【前人研究进展】目前主要通过物理、化学和生物修复技术治理环境中的重金属污染。相比于传统的物理、化学方法,生物修复技术具有成本低、易管理、二次污染风险小等优点,同时具有美观作用而被广泛应用[9−10]。受水体锌浓度、环境条件的影响,不同的水生植物对水体锌的富集能力不同。何芳芳等[11]对6种水生植物对模拟污水中锌的去除情况进行研究,结果表明菖蒲对锌的去除效果最好,经20 d培养,对初始浓度2 mg·L−1锌去除率达60.3%。郭超超[12]对7种水生植物修复重金属污染的研究发现,美人蕉对锌去除效果最好,对5 mg·L−1锌去除率达89.21%。慕凯等[13]研究发现水生植物中芦苇和狐尾藻对受重金属污染的三里七湖水体的锌有较强的迁移能力,迁移系数远>1,具备了重金属锌的超富集植物特性。因此,针对不同的水体选择合适的锌富集植物对水体锌污染修复效果至关重要[14]。植物富集重金属有离子交换、细胞壁固定、配体螯合作用、转运蛋白主动运输和液泡区隔化等作用机制。黑藻对锌的富集主要通过细胞壁固定[15];再力花则主要通过细胞质中有机酸、蛋白等物质螯合重金属,以降低重金属活性[16]。研究表明,重金属以低活性形态存在也是植物拥有重金属强富集能力的原因之一[17]。朱光旭等[18]发现菊科植物对锌具有较高的积累,锌主要以氯化钠提取态、醋酸提取态等迁移性较低的化学形态存在。吴箐等[19]研究锌在长柔毛委陵菜中的化学形态时发现,锌以氯化钠和水提取态为主。不同植物对锌的富集能力不同,其亚细胞组分分布和化学形态也存在差异,因此需要深入研究对锌具有强积累能力植物的富集特征和体内分布情况,以了解植物对重金属锌的耐受机制。【本研究切入点】相比于黑藻菹草、黑藻、龙须眼子菜,狐尾藻对锌的富集能力最强,可达242.42 mg·kg−1,富集系数1 515[20]。我们课题组的前期研究同样揭示了沉水植物狐尾藻具有较强的耐污能力,并且对锌表现出优异的富集性能[21]。狐尾藻对锌富集能力强这一观点已初步达成共识,近年来狐尾藻常被用于养殖废水处理中。然而,前人对狐尾藻去除重金属的研究多集中于不同种类植物在湿地环境中对重金属富集能力的比较[20],对于污染物多且浓度高的畜禽养殖废水研究较为少见。因此探讨狐尾藻去除养殖水体锌的作用机理,对养殖废水重金属污染治理及富集植物狐尾藻的资源化利用具有重要意义。【拟解决的关键问题】本研究通过水培试验,探讨不同浓度锌处理后狐尾藻体内的锌富集,分析狐尾藻对锌的生长响应、细胞超微结构变化及亚细胞分布和化学形态特征,揭示狐尾藻对锌的积累和富集机制,为狐尾藻在养殖废水生态修复中的实际应用提供数据支撑。
1. 材料与方法
1.1 试验材料
试验采用净水先锋植物狐尾藻(Myriophyllum spicatum L.),采自福清市某养殖基地生物塘,选择根茎健壮、生长相近的植株作为试验材料。将采集到的狐尾藻洗净后用去离子水培养一周,进行适应性培养。
1.2 试验设计
锌胁迫狐尾藻生长试验参考本课题前期狐尾藻水培试验方法[21]:配置模拟养殖废水(NH4+-N:64.23 mg·L−1、TP:8.16 mg·L−1、COD:200.37 mg·L−1和硫酸锌:0~200 mg·L−1)培育狐尾藻。狐尾藻:截取统一驯化后狐尾藻顶枝(20 cm,每培养箱20株);培养容器:12 L塑料培养箱,尺寸为:长25 cm、宽25 cm及高30 cm,每个培养箱装10 L模拟养殖废水,水深为20 cm。基于本课题组前期试验结果[21−23],试验设置3种处理锌浓度0 mg·L−1为对照CK、50 mg·L−1为Z1和200 mg·L−1为Z2,每个处理设置5个重复。实验时间为2022年4月至5月,周期为49 d。环境温度为20±5 ℃,自然光照,相对湿度为45%左右。每隔3 d补给因蒸发作用而损失的水分,确保各处理水深一致,每周观察记录狐尾藻的生长状况。
1.3 指标测定
狐尾藻及各器官鲜重与干重:试验期间,每7 d测定一次狐尾藻株高和生物量。采集时间为上午9:00至10:00之间。采样方法:每组随机选取5株狐尾藻,并将狐尾藻置于沥水篮中,待无明显水滴时,用去离子水清洗各株狐尾藻,去除附着物后用吸水纸吸干,用称重法测定整株生物量、直尺测量其株高并记录;试验结束后,用去离子水冲洗收获植株并用吸水纸吸干水分,分别称量其叶片、茎部和根系的鲜重。而后在恒温鼓风干燥箱中杀青105±2 ℃半小时后经60±2 ℃烘干至恒重,称重。
参照昌梦雨等[24]的80%丙酮(Arnon)研磨法测定叶片叶绿素含量;参照李玲等[25]的硫代巴比妥酸(thiobarbituric acid,TBA)法测定丙二醛(malondialdehyde,MDA);采用氮蓝四唑(nitroblue tetrazolium chloride,NBT)法[26]测定超氧化物歧化酶(Superoxide dismutase,SOD)活性。
狐尾藻叶片细胞微观形态:先用浓度2.5%的预冷戊二醛固定液固定面积为5~8 mm2的狐尾藻新鲜叶片,再利用透射电子显微镜(美国FEI Tecnai F20)扫描观察叶片,利用能谱仪(美国赛默飞RIIDEye)对叶片进行点扫。
植株锌含量:采用HNO3/H2O2混合液消解[27],消解定容后利用原子吸收光谱仪(日本岛津AA-6300C)测定锌的浓度。试验利用标准物质(茶叶标准样,GBW07605)作为质控标准。
亚细胞结构分级参考李冬香等[16]和Yang等[28]的差速离心法。不同形态锌的逐步提取参考许嘉琳等[29]的化学试剂逐步提取法。上述经差速离心法与化学试剂逐步提取法获得的上清液和沉淀分别存放在锥形瓶中。随后放于电热板上蒸发近干后,加入硝酸-高氯酸(4∶1)消煮[30]。消解定容后,采用原子吸收光谱仪(日本岛津AA-6300C)测定锌含量。
1.4 数据处理
实验结果以平均值±标准差表示。数据统计分析采用了Origin 2023和SPSS 19.0软件进行处理。本研究采用了单因素方差分析(ANOVA),最小显著差数法(LSD)进行多重比较,并设定了显著性水平为P<0.05。
2. 结果与分析
2.1 不同锌浓度对狐尾藻生长的影响
图1a为不同锌浓度处理下狐尾藻株高的变化,随着时间增加,各处理的狐尾藻株高均呈增加趋势。试验结束时,CK、Z1和Z2处理的狐尾藻株高分别为75.19±6.50、92.39±3.06 cm及66.07±5.89 cm,Z1处理株高显著高于CK和Z2处理,而CK与Z2处理株高无显著差异。从图1b可知,不同浓度锌处理的狐尾藻生物量都有所增加,在试验前期(1~4周)各处理生物量增长趋势较快,在后期(4~7周)增速放缓。试验结束,不同浓度处理单株狐尾藻生物量为Z1(9.63±0.18 g)>CK(8.75 ±0.12 g)>Z2(8.50±0.14 g),相比初始生物量分别提高了5.38、4.28和4.38倍,Z1处理单株生物量显著高于CK、Z2处理,而Z2与CK处理之间无明显差异。狐尾藻根、茎的生物量随着锌浓度的增加,呈现先增后减的趋势,如图1c所示。在锌浓度为50 mg·L−1时,狐尾藻根、茎生物量最大,为1.74 g和6.60 g,分别为CK的1.25倍和1.14倍,显著高于CK、Z2处理。而Z2处理单株狐尾藻各器官生物量与CK没有显著差异。各处理的狐尾藻叶片叶绿素含量为1.44~1.59 mg·g−1(图1d),Z2处理叶绿素含量显著低于CK与Z1处理,CK与Z1处理叶绿素含量无明显差异但降低幅度不大。结合狐尾藻生物量、株高、叶绿素等指标,可说明狐尾藻在0~200 mg·L−1锌浓度范围均能正常生长。
![]() 图 1 不同锌浓度胁迫下狐尾藻株高、生物量与叶绿素含量不同小写字母表示相同器官不同处理间差异显著(P<0.05)。下同。Figure 1. The Influence of different zinc concentrations on the height, biomass and content of chlorophyll of M. spicatumDifferent small letters indicate significant differences among different treatments for the same organ (P<0.05). Same for below.
图 1 不同锌浓度胁迫下狐尾藻株高、生物量与叶绿素含量不同小写字母表示相同器官不同处理间差异显著(P<0.05)。下同。Figure 1. The Influence of different zinc concentrations on the height, biomass and content of chlorophyll of M. spicatumDifferent small letters indicate significant differences among different treatments for the same organ (P<0.05). Same for below.2.2 狐尾藻对锌的胁迫响应
狐尾藻根系和叶片中MDA含量随着锌处理浓度的增加而增加(图2a)。狐尾藻根系和叶片MDA含量在锌浓度为200 mg·L−1时显著高于CK处理,分别为CK处理的1.16倍与1.27倍,且根系中MDA含量增幅小于叶片。随着锌浓度的增加,狐尾藻根和叶的SOD活性均显著增加(图2b)。Z1、Z2处理的狐尾藻根部SOD活性相比CK分别显著提高了7.71%和18.46%,而叶片SOD活性相比CK处理分别显著提高了12.79%和35.23%。
2.3 锌胁迫前后狐尾藻叶片表皮细胞状态
在试验过程,狐尾藻在不同锌浓度(0~200 mg·L−1)处理下均可正常生长,未观察到大片叶子发黄、掉落,根系发黑等中毒现象。在Z1处理下,狐尾藻的叶片外观与CK无显著差异,但其茎部产生了更多的侧枝,且根部具有较长的须根。而在Z2处理中,狐尾藻的叶片边缘呈淡黄色,茎部相较于其他处理组略显纤细,根系的主根则相对较短且粗壮。如图3所示,对照处理的叶片表皮细胞呈现出饱满的状态,细胞壁平滑且排列整齐。然而,在暴露于高浓度锌(200 mg·L−1)处理后,细胞内外发生了离子交换,导致狐尾藻部分叶片细胞出现干瘪和凹陷的现象,显示出明显的损伤迹象。
由图4可知,狐尾藻含碳、氧、钠、钾及钙等元素。其中,碳和氧元素是羟基、羧基等含氧官能团的重要组成部分,这些官能团能够与重金属形成络合物。Z2处理狐尾藻受高浓度锌胁迫后,其矿质元素(如钠、钾和钙)的含量降低,而锌含量升高,这可能是因为在离子交换过程中锌被转化并吸收。
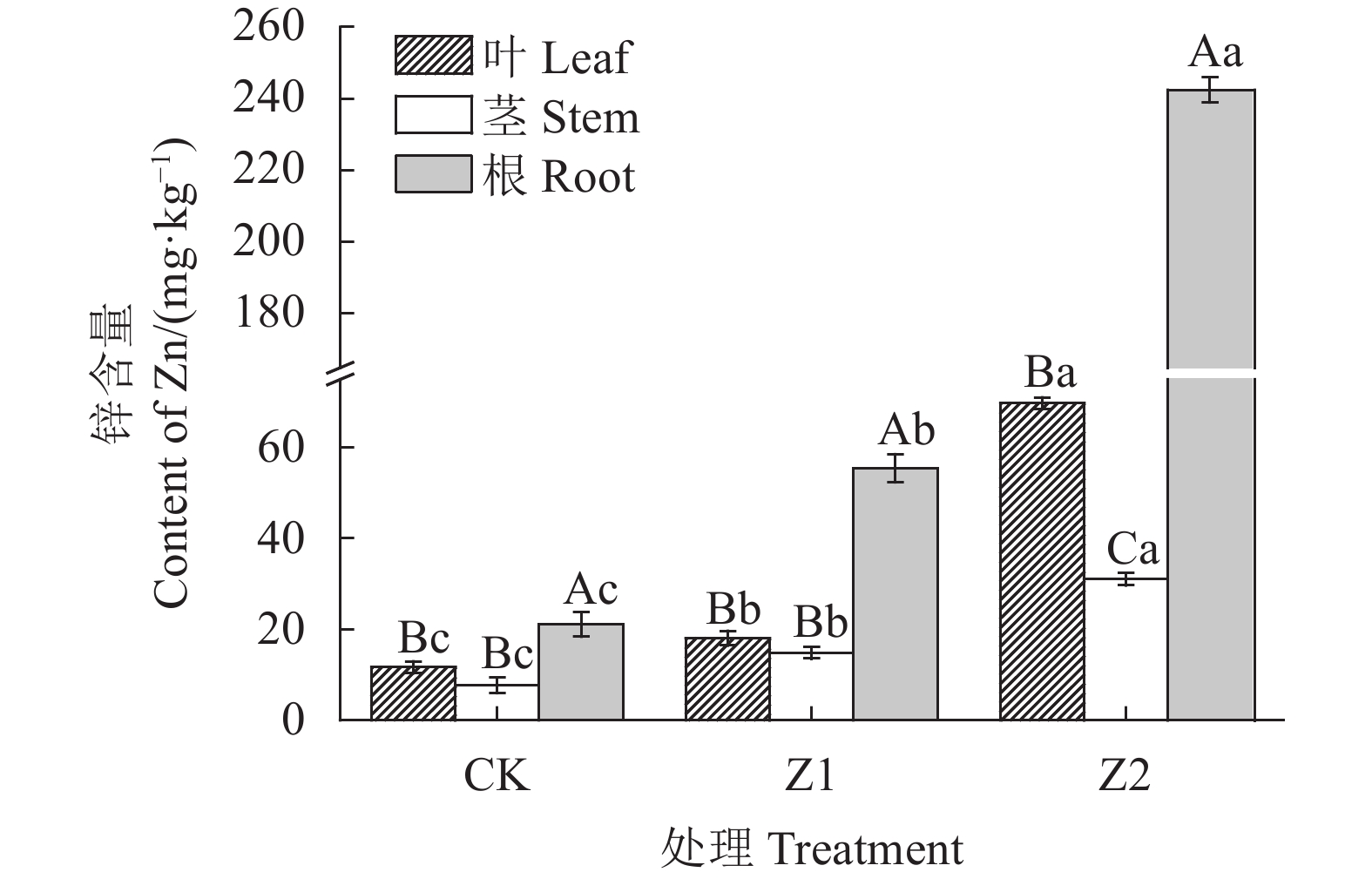
2.4 狐尾藻各器官中锌含量分布
从图5可知,随着锌浓度增加,狐尾藻叶片、茎部和根部中锌含量均呈上升趋势,试验后各处理狐尾藻根、茎和叶中锌含量分别为:55.48~242.44、14.78~31.02 mg·kg−1和18.01~69.79 mg·kg−1。各组处理狐尾藻器官中锌含量分布整体趋势为:根>叶>茎,狐尾藻根部中锌含量显著高于其叶片和茎部。Z2处理的狐尾藻根部、叶片和茎部锌含量显著高于CK与Z1处理,分别为242.44±3.45、69.79±1.25 g与31.02±1.33 g,是CK的11.52倍、6.00倍和4.07倍,分别是Z1处理的4.37倍、2.10倍和3.87倍。
2.5 锌在狐尾藻亚细胞中的分布
狐尾藻叶片中,锌主要分布在细胞壁,占32.56%~49.50%;可溶性组分、线粒体和原生质体中锌分布比例分布为11.32%~32.81%、16.75%~27.53%和13.17%~28.61%,其中可溶性组分比例随着锌浓度提高而上升,线粒体和原生质体比例则反之(图6)。对于狐尾藻茎部,随着锌处理浓度增加,线粒体和原生质体中锌分布比例降低,而可溶性组分和细胞壁中占比提高,各处理细胞壁中锌分布比例差异不显著,Z2处理可溶性组分比例显著高于其他处理。狐尾藻茎中锌分布格局为细胞壁(41.21%~43.52%)>可溶性组分(30.08%~39.91%)>原生质体(8.4%~16.93%)>线粒体(8.1%~11.81%),茎中锌分布情况与叶相似,以细胞壁为主。在狐尾藻根系中,随着锌浓度增加,细胞壁和原生质体中锌分布比例降低,而可溶性组分中锌占比显著提高,线粒体中的锌分布比例没有明显差异。根中锌分布以可溶性组分(32.10%~50.48%)和细胞壁(37.86%~40.08%)为主,两者比例合计超过75%。线粒体和原生质体中锌含量均较低,分别占总量的7.28%~9.23%和4.38%~12.39%。
2.6 锌在狐尾藻体内的化学形态特征
狐尾藻叶片中锌不同化学形态含量表现:CK处理为氯化钠提取态>醋酸提取态>盐酸提取态>乙醇提取态>水提取态;Z1和Z2处理组为醋酸提取态>盐酸提取态>氯化钠提取态>乙醇提取态>水提取态(图7)。随着锌处理浓度增加,醋酸提取态、水提取态占比增加,氯化钠提取态所占比例降低,而盐酸提取态和乙醇提取态含量变化不大。狐尾藻茎部中盐酸提取态锌含量最高,占总量的34.00%~45.51%,其次是氯化钠提取态含量,占总量的21.00%~25.20%;醋酸提取态锌占总量的17.00%~22.00%;乙醇提取态锌占总量的9.52%~16.00%;水提取态锌含量最低,占总量的3.00%~3.80%。随着锌浓度增加,水提取态含量无明显变化,而氯化钠提取态和醋酸提取态含量占比提高。狐尾藻根部中水提取态含量最高,占总量的33.23%~38.77%;氯化钠提取态含量占比次之,其占总量的21.53~30.42%;醋酸提取态和盐酸提取态含量分别占总量的15.30%~19.78%和10.62%~16.56%;乙醇提取态含量最低,仅占总量的4.50%~9.30%。随着锌处理浓度增加,水提取态、乙醇提取态和醋酸提取态锌含量占比提高,而盐酸提取态与氯化钠提取态锌分布比例降低。
3. 讨论
3.1 不同浓度锌对狐尾藻的生长影响与氧化胁迫作用
锌是植物生长不可或缺的微量元素,是一些酶的构成成分与活化剂,参与植物蛋白质、色氨酸和吲哚乙酸的合成,与植物的生长代谢有着密切的关系[31]。研究表明,适量的锌能够促进植物生长,并提高如桉树[32]、长柔毛委陵菜[33]及马缨丹[34]等植物的生物量。但是过量的锌也会对植物产生毒害作用,影响植物叶绿素合成,进而干扰光合作用,导致植物叶片黄化掉落,生物量减少,如黑藻[35]、栾树[36]和芫菜[36]。不同的植物对锌的耐受能力不同,本研究中狐尾藻在不同锌浓度(0~200 mg·L−1)培养下都能正常生长,生物量和株高相比初始状态都有不同程度的增加。在锌浓度为50 mg·L−1时,狐尾藻株高、生物量达到最大,分别是对照处理的1.23倍和1.10倍。锌浓度达200 mg·L−1时,狐尾藻株高、生物量降为对照处理的87.87%和97.14%,叶绿素含量有所降低,叶片表皮细胞有部分受损,这说明低浓度锌(50 mg·L−1)可促进狐尾藻生长,而高浓度锌(200 mg·L−1)胁迫,狐尾藻的生长受到抑制,尤其是植株茎部的生物量积累显著减少,这与Marichali等[37]研究结果相近。其原因可能是高浓度锌(200 mg·L−1)引起叶片细胞水分减少,细胞脱水萎缩,叶绿素合成受阻,进而影响植物的光合作用和蒸腾作用;也可能是锌含量的增加,引起各器官中极性态锌占比升高,影响到狐尾藻的生长代谢。
重金属对植物毒害作用主要表现为破坏细胞内活性氧物质(Reactive oxygen species,ROS)的代谢平衡,引起细胞功能受损,导致植株内MDA含量、细胞质膜透性显著增加[38],最终导致植物生长发育受阻甚至死亡。MDA是一种可与氨基酸、核酸等活性物质发生交联形成不溶性化合物的高活性的植物细胞膜过氧化产物,会破坏细胞正常的生命活动。众多学者研究发现[39−40],重金属离子浓度与MDA含量密切相关,重金属离子浓度增加时,植物体内MDA积累量也会上升。因此,MDA含量能够表征植物在逆境中受到氧化损伤的程度[41]。本研究结果表明,在锌胁迫条件下,狐尾藻各处理组中的丙二醛(MDA)含量均呈现上升趋势,其中根部的MDA含量显著高于叶片,高浓度处理组根部和叶片中MDA含量显著高于对照组,生物量、叶绿素含量降低,说明锌浓度为200 mg·L−1时,会影响狐尾藻体内ROS的平衡,引起细胞过氧化损伤。为了降低过量ROS对植物造成的氧化损伤,一些耐性较强的植物会启动自身的抗氧化酶保护系统系统,如SOD(超氧化物歧化酶)[42]。SOD作为一种超氧自由基清除剂,能够有效地去除植物体内的活性氧。SOD的活性水平与植物对逆境胁迫的抗性程度存在一定的相关性。在适当的逆境胁迫下,SOD活性的增加有助于提升植物的适应性。本研究结果发现狐尾藻根部和叶片中SOD活性随着锌浓度增加而增加,与Uruc等[43]青萍和紫萍在锌处理下的抗氧化酶活性变化趋势一致。当锌处理浓度增加[44],狐尾藻激活了其内在的抗氧化防御机制,叶片和根部的活性氧清除与具有抗性特征的生理活动被诱导而加快,使SOD活性逐步增强,表明其清除自由基的能力有所提高,特别是根部,其SOD活性和MDA含量都高于叶片,反映狐尾藻根部对锌抗氧化响应更为敏感,是狐尾藻对锌的一种保护性应激反应,这也是狐尾藻根部对锌浓度具有较强耐性的原因。
3.2 狐尾藻各器官锌含量分布
重金属在植物组织器官中的含量分布是植物对重金属吸收及转移能力的体现,不同的植物对重金属的吸收转运途径存在差异。对于完全淹水的水生植物如黑藻、苦草,植物的根、茎和叶都可能从水溶液中直接吸收重金属;而对于部分淹水的水生植物狐尾藻,其根系和部分茎部被水淹没,水下组织器官成为吸收和转运重金属的主要部位。狐尾藻在不同锌浓度处理下,根、茎和叶中锌的浓度分别为:21.04~242.44、7.62~31.02 g和11.64~69.79 g,根部中锌浓度显著高于茎和叶,且浓度越高根部中锌浓度越高,Z2处理根部锌含量相比CK和Z1处理分别提高了10.52倍和3.37倍。说明锌主要富集于狐尾藻根系,该研究结果与Ozdener等[45]对芸芥研究结论相似。狐尾藻根部对锌具有更强的富集能力,可能是因为狐尾藻根系发达,在外源锌作用下,会分泌有机酸、胞外酶等物质,影响根际酸碱环境和微生物活性[46],降低有效锌含量,减少锌对狐尾藻的毒害;而且狐尾藻根系的分泌物能够通过络合作用与重金属离子结合形成可溶性复合物,从而促进重金属在植物体内的积累和富集[47]。
3.3 锌在狐尾藻亚细胞中的分布
植物主要通过细胞壁固定和细胞内区隔化分布两种途径来降低重金属对植物重要细胞的毒害[48]。植物细胞壁含有丰富的羟基、羧基、氨基或磷酸基等配位基团,这些基团能够与重金属离子配位结合,沉淀于细胞壁,进而阻碍重金属的迁移,保护植物细胞内的重要器官[15]。当细胞壁上的金属离子结合位点饱和时,超出结合能力的金属离子将进入细胞质,并随后被转运至液泡进行储存[34]。植物体内的有机酸和蛋白质等有机配体能够与重金属离子形成络合物,络合物经转移并储存在液泡内,实现细胞内重金属离子的区隔化,从而降低其生物毒性[16]。研究发现,长柔委陵菜[19]、再力花[16]和蓖麻[49]等植物在外源锌的处理下,其体内大部分锌分布在细胞壁和可溶性组分中,这可能是富锌植物对锌的耐性机理之一。狐尾藻在外源锌处理试验中取得与之相似的研究结果,在狐尾藻体内大部分锌分布在细胞壁(32.56%~49.50%)和可溶性组分(11.32%~50.48%),且随着外源锌浓度增加,狐尾藻体内的锌表现出向可溶性组分转移的特点。由此说明,细胞壁是狐尾藻富集锌的重要部位之一;同时可溶性组分中蛋白质、有机酸和糖等物质也发挥重要作用,降低重金属锌对植物的毒害。原生质体和线粒体中锌分布比例较小,既可满足细胞器(如叶绿体)对锌的需求,又能减缓过量锌对细胞器的损伤,进而维持狐尾藻细胞正常的生理代谢,这些可能也是狐尾藻对锌的耐受机制之一。
3.4 锌在狐尾藻体内的化学形态特征
重金属在植物体内被吸收后,通常会以多种不同的化学形态存在[50]。利用锌在不同提取剂中溶解度不同,按照溶液极性(乙醇、去离子水、氯化钠、醋酸和盐酸)依次提取不同形态锌[28]。不同化学形态锌在植物中的迁移性和生物毒性顺序为乙醇提取态FE>水提取态FW>氯化钠提取态FNaCl>醋酸提取态FHAc>盐酸提取态FHCl。在植物体内,重金属的活性、毒性及其对植物的耐受性与其赋存形态紧密相关。本试验中,狐尾藻叶片和茎部中以氯化钠提取态、醋酸提取态和盐酸提取态为主导,这同吴箐等[19]和龙新宪等[51]的研究结论相似。氯化钠提取的是和蛋白质、果胶酸盐等结合的锌,该部分与细胞壁沉淀固定作用有关。醋酸和盐酸提取的是同磷酸盐、草酸盐作用的结合态,这两种重金属形态移动性与毒性较低,可能与液泡中的有机酸络合作用相关[18]。狐尾藻根部中锌以水提取态和氯化钠提取态存在,表明狐尾藻体内的水溶性盐、果胶酸盐、有机酸等多种重金属配位体可与大量锌结合,促进锌在细胞壁的沉积和细胞内液泡区隔化,该过程也可解释锌在根部大量富集的现象。由此可推测狐尾藻中锌以低活性赋存形态存在是其具有较强耐受能力的机制之一。狐尾藻茎、叶和根中锌以氯化钠提取态、醋酸提取态、盐酸提取态、水提取态为主,这表明狐尾藻体内锌可能也是与多种金属配位体结合,有利于锌在液泡区隔化,使狐尾藻对锌有较强的耐受性。但是狐尾藻体内的锌主要同哪一种配位体作用,还待进一步研究。
4. 结论
(1)通过狐尾藻生长情况和叶片表皮细胞观察,发现狐尾藻对水体锌具有较强的耐受能力。当锌浓度为200 mg·L−1时,狐尾藻根相比茎叶具有更高的锌含量,根部对锌抗氧化能力较强,是狐尾藻根部对锌耐性更强的原因之一。
(2)狐尾藻各器官中的锌主要分布于细胞壁和可溶性组分中,其中根、茎和叶中两者比例之和分别达77.87%~88.34%、71.28%~83.42%和43.88%~66.77%,说明狐尾藻中细胞壁的固定作用和液泡区隔化都是狐尾藻积累锌的重要机制。
(3)狐尾藻叶片和茎部中以氯化钠提取态、醋酸提取态、盐酸提取态为主,根中以水提取态、氯化钠提取态为主,多元重金属配位体的结合作用降低了锌的迁移性和毒性,也是狐尾藻富集锌的作用机制。
-
图 1 不同锌浓度胁迫下狐尾藻株高、生物量与叶绿素含量
不同小写字母表示相同器官不同处理间差异显著(P<0.05)。下同。
Figure 1. The Influence of different zinc concentrations on the height, biomass and content of chlorophyll of M. spicatum
Different small letters indicate significant differences among different treatments for the same organ (P<0.05). Same for below.
-
[1] KASPRZYK A, KILAR J, CHWIL S, et al. Content of selected macro- and microelements in the liver of free-living wild boars (Sus scrofa L. ) from agricultural areas and health risks associated with consumption of liver [J]. Animals, 2020, 10(9): 1519. DOI: 10.3390/ani10091519
[2] 李广鑫, 赵鹏, 睢福庆, 等. 螯合–缓冲营养液培养条件下添加外源锌对小麦幼苗生长和TaZIPs基因表达的影响 [J]. 植物营养与肥料学报, 2022, 28(3):470−481. DOI: 10.11674/zwyf.2021384 LI G X, ZHAO P, SUI F Q, et al. Effects of exogenous zinc supplementation on growth and TaZIPs gene expression in wheat under chelation-buffer nutrient solution culture [J]. Journal of Plant Nutrition and Fertilizers, 2022, 28(3): 470−481. (in Chinese) DOI: 10.11674/zwyf.2021384
[3] 王瑾. 饲料添加剂在土壤和蔬菜中的迁移及残留研究[D]. 杭州: 浙江工商大学, 2009. WANG J. Study on transfer and residue of feed additives in soil and vegetables [D]. Hangzhou: Zhejiang Gongshang University, 2009. (in Chinese)
[4] 许俊香, 邹国元, 孙钦平, 等. 畜禽粪便Cu、Zn含量特征研究 [J]. 江苏农业科学, 2024, 52(11):254−259. XU J X, ZOU G Y, SUN Q P, et al. Study on characteristics of Cu and Zn contents in livestock and poultry manure [J]. Jiangsu Agricultural Sciences, 2024, 52(11): 254−259. (in Chinese)
[5] 朱建春, 张增强, 樊志民, 等. 中国畜禽粪便的能源潜力与氮磷耕地负荷及总量控制 [J]. 农业环境科学学报, 2014, 33(3):435−445. DOI: 10.11654/jaes.2014.03.005 ZHU J C, ZHANG Z Q, FAN Z M, et al. Biogas potential, cropland load and total amount control of animal manure in China [J]. Journal of Agro-Environment Science, 2014, 33(3): 435−445. (in Chinese) DOI: 10.11654/jaes.2014.03.005
[6] 袁凯, 熊苏雅, 梁静, 等. 畜禽粪便中铜和锌污染现状及风险分析 [J]. 农业环境科学学报, 2020, 39(8):1837−1842. DOI: 10.11654/jaes.2020-0142 YUAN K, XIONG S Y, LIANG J, et al. Status and risk analysis of copper and zinc pollution in livestock manure [J]. Journal of Agro-Environment Science, 2020, 39(8): 1837−1842. (in Chinese) DOI: 10.11654/jaes.2020-0142
[7] 梁雅雅, 易筱筠, 党志, 等. 某铅锌尾矿库周边农田土壤重金属污染状况及风险评价 [J]. 农业环境科学学报, 2019, 38(1):103−110. DOI: 10.11654/jaes.2018-0252 LIANG Y Y, YI X Y, DANG Z, et al. Pollution and risk assessment of heavy metals in agricultural soils around a Pb-Zn tailing pond [J]. Journal of Agro-Environment Science, 2019, 38(1): 103−110. (in Chinese) DOI: 10.11654/jaes.2018-0252
[8] 赵晓东, 谢英荷, 李廷亮, 等. 植物对污灌区土壤锌形态的影响 [J]. 应用与环境生物学报, 2015, 21(3):477−482. ZHAO X D, XIE Y H, LI T L, et al. Effects of plants on forms of zinc in sewage irrigated soil [J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(3): 477−482. (in Chinese)
[9] CHANDRASEKHAR C, RAY J G. Lead accumulation, growth responses and biochemical changes of three plant species exposed to soil amended with different concentrations of lead nitrate [J]. Ecotoxicology and Environmental Safety, 2019, 171: 26−36. DOI: 10.1016/j.ecoenv.2018.12.058
[10] JIANG M Y, LIU S L, LI Y F, et al. EDTA-facilitated toxic tolerance, absorption and translocation and phytoremediation of lead by dwarf bamboos [J]. Ecotoxicology and Environmental Safety, 2019, 170: 502−512. DOI: 10.1016/j.ecoenv.2018.12.020
[11] 何芳芳, 陈雅顺, 张德刚, 等. 六种观赏型水生植物对水体中铜、锌、铅的净化研究 [J]. 湖北农业科学, 2016, 55(2):327−328,332. HE F F, CHEN Y S, ZHANG D G, et al. Reaserch on phytoremediation of Cu, Zn, Pb contaminated water by six macrophytes [J]. Hubei Agricultural Sciences, 2016, 55(2): 327−328,332. (in Chinese)
[12] 郭超超. 水生植物组合对重金属富集能力和积累特征研究[D]. 郑州: 河南农业大学, 2024. GUO C C. Research on the enrichment capability and accumulation characteristics of aquatic plant assemblages for heavy metals [D]. Zhengzhou: Henan Agricultural University, 2024. (in Chinese)
[13] 慕凯, 罗明良. 三里七湖水生植物重金属富集作用研究 [J]. 生态科学, 2017, 36(3):82−89. MU K, LUO M L. Heavy metals enrichment of aquatic plants in Sanliqi Lake, Huangshi City of Hubei Province [J]. Ecological Science, 2017, 36(3): 82−89. (in Chinese)
[14] 邢丹, 刘鸿雁, 于萍萍, 等. 黔西北铅锌矿区植物群落分布及其对重金属的迁移特征 [J]. 生态学报, 2012, 32(3):796−804. DOI: 10.5846/stxb201106220925 XING D, LIU H Y, YU P P, et al. The plant community distribution and migration characteristics of heavy metals in tolerance dominant species in lead/zinc mine areas in Northwestern Guizhou Province [J]. Acta Ecologica Sinica, 2012, 32(3): 796−804. (in Chinese) DOI: 10.5846/stxb201106220925
[15] XU Q S, CHU W Y, QIU H, et al. Responses of Hydrilla verticillata (l. f.) royle to zinc: in situ localization, subcellular distribution and physiological and ultrastructural modifications [J]. Plant Physiology and Biochemistry, 2013, 69: 43−48. DOI: 10.1016/j.plaphy.2013.04.018
[16] 李冬香, 陈清西. 锌在再力花体内的富集性及亚细胞分布和化学形态研究 [J]. 中国生态农业学报, 2013, 21(9):1114−1118. DOI: 10.3724/SP.J.1011.2013.01114 LI D X, CHEN Q X. Determinating zinc accumulation, sub-cellular distribution and chemical forms of Thalia dealbata Fraser [J]. Chinese Journal of Eco-Agriculture, 2013, 21(9): 1114−1118. (in Chinese) DOI: 10.3724/SP.J.1011.2013.01114
[17] 赵玉红, 敬久旺, 王向涛, 等. 藏中矿区先锋植物重金属积累特征及耐性研究 [J]. 草地学报, 2016, 24(3):598−603. ZHAO Y H, JING J W, WANG X T, et al. Study on heavy metals bioaccumulation characteristics and tolerance of pioneer plants from central Tibet mining area [J]. Acta Agrestia Sinica, 2016, 24(3): 598−603. (in Chinese)
[18] 朱光旭, 肖化云, 郭庆军, 等. 铅锌尾矿污染区3种菊科植物体内重金属的亚细胞分布和化学形态特征 [J]. 环境科学, 2017, 38(7):3054−3060. ZHU G X, XIAO H Y, GUO Q J, et al. Subcellular distribution and chemical forms of heavy metals in three types of Compositae plants from lead-zinc tailings area [J]. Environmental Science, 2017, 38(7): 3054−3060. (in Chinese)
[19] 吴箐, 杜锁军, 曾晓雯, 等. 锌在长柔毛委陵菜细胞内的分布和化学形态研究 [J]. 生态环境, 2006, 15(1):40−44. WU Q, DU S J, ZENG X W, et al. Subcellular distribution and chemical forms of Potentilla grifithii Hook [J]. Ecology and Environment, 2006, 15(1): 40−44. (in Chinese)
[20] 高海荣, 陈秀丽, 赵爱娟, 等. 5种沉水植物对重金属富集能力的对比研究 [J]. 环境保护科学, 2016, 42(4):101−105. GAO H R, CHEN X L, ZHAO A J, et al. Comparison of heavy metal accumulation by five submerged macrophytes [J]. Environmental Protection Science, 2016, 42(4): 101−105. (in Chinese)
[21] 吴晓梅, 叶美锋, 吴飞龙, 等. 狐尾藻对生猪养殖场沼液Cu、Zn的富集与净化效果[J]. 福建农业学报, 2018, 33(11): 1195-1200. WU X M, YE M F, WU F L, et al. Cu and Zn Accumulations in Myriophyllum spicatum L. for purification of pig farm biogas slurry[J]. Fujian Journal of Agricultural Sciences, 2018, 33(11): 1195-1200. (in Chinese)
[22] 吴晓梅, 叶美锋, 吴飞龙, 等. 沉水植物对生猪养殖场沼液废水的净化效果研究 [J]. 中国沼气, 2020, 38(6):44−49. DOI: 10.3969/j.issn.1000-1166.2020.06.007 WU X M, YE M F, WU F L, et al. Purification effect of submerged macrophytes on biogas slurry wastewater from pig farm [J]. China Biogas, 2020, 38(6): 44−49. (in Chinese) DOI: 10.3969/j.issn.1000-1166.2020.06.007
[23] 吴晓梅, 叶美锋, 吴飞龙, 等. 狐尾藻净化生猪养殖场沼液的研究 [J]. 农业环境科学学报, 2018, 37(4):796−803. DOI: 10.11654/jaes.2017-1188 WU X M, YE M F, WU F L, et al. Purification capacity of Myriophyllum spicatum for biogas slurry from pig farms [J]. Journal of Agro-Environment Science, 2018, 37(4): 796−803. (in Chinese) DOI: 10.11654/jaes.2017-1188
[24] 昌梦雨, 魏晓楠, 王秋悦, 等. 植物叶绿素含量不同提取方法的比较研究 [J]. 中国农学通报, 2016, 32(27):177−180. DOI: 10.11924/j.issn.1000-6850.casb16010102 CHANG M Y, WEI X N, WANG Q Y, et al. A comparative study on different extraction methods for plant chlorophyll [J]. Chinese Agricultural Science Bulletin, 2016, 32(27): 177−180. (in Chinese) DOI: 10.11924/j.issn.1000-6850.casb16010102
[25] 李玲. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009: 87–90. [26] LI H S. Experiental principle and technique for plant physiology and biochemistry[M]. Beijing: Beijng Higher Education Press, 2000.
[27] 黄晓纯, 刘昌弘, 张军, 等. ICP-MS测定蔬菜样品中重金属元素的两种微波消解前处理方法 [J]. 岩矿测试, 2013, 32(3):415−419. DOI: 10.3969/j.issn.0254-5357.2013.03.010 HUANG X C, LIU C H, ZHANG J, et al. Two microwave digestion pretreatment methods for determination of heavy metals in vegetable samples [J]. Rock and Mineral Analysis, 2013, 32(3): 415−419. (in Chinese) DOI: 10.3969/j.issn.0254-5357.2013.03.010
[28] YANG L P, ZHU J, WANG P, et al. Effect of Cd on growth, physiological response, Cd subcellular distribution and chemical forms of Koelreuteria paniculata [J]. Ecotoxicology and Environmental Safety, 2018, 160: 10−18. DOI: 10.1016/j.ecoenv.2018.05.026
[29] 许嘉琳, 鲍子平, 杨居荣, 等. 农作物体内铅、镉、铜的化学形态研究 [J]. 应用生态学报, 1991, 2(3):244−248. DOI: 10.3321/j.issn:1001-9332.1991.03.010 XU J L, BAO Z P, YANG J R, et al. Chemical form of Pb, Cd and Cu in crop [J]. Chinese Journal of Applied Ecology, 1991, 2(3): 244−248. (in Chinese) DOI: 10.3321/j.issn:1001-9332.1991.03.010
[30] 王芳权. 植株中铜锌铁锰微量元素的测定方法研究 [J]. 杭州化工, 2002, 32(1):21−22. DOI: 10.3969/j.issn.1007-2217.2002.01.007 WANG F Q. Determination of Cu, Zn, Fe and Mn in plants [J]. Hangzhou Chemical Industry, 2002, 32(1): 21−22. (in Chinese) DOI: 10.3969/j.issn.1007-2217.2002.01.007
[31] URUÇ PARLAK K, DEMIREZEN YILMAZ D. Response of antioxidant defences to Zn stress in three duckweed species [J]. Ecotoxicology and Environmental Safety, 2012, 85: 52−58. DOI: 10.1016/j.ecoenv.2012.08.023
[32] 李磊. 桉树对外源锌的生理响应和解毒机理研究[D]. 南宁: 广西大学, 2018. LI L. Study on phiysiological response and the detoxification mechanism of zinc stress in Eucalyptus[D]. Nanning: Guangxi University, 2018. (in Chinese)
[33] QIU R L, THANGAVEL P, HU P J, et al. Interaction of cadmium and zinc on accumulation and sub-cellular distribution in leaves of hyperaccumulator Potentilla griffithii [J]. Journal of Hazardous Materials, 2011, 186(2/3): 1425−1430.
[34] 张春梅. 马缨丹对锌、铜的生理响应和富集特征研究[D]. 雅安: 四川农业大学, 2016. ZHANG C M. Study on physiological response and enrichment characteristics of zinc, copper in Lantana camara L. [D]. Yaan: Sichuan Agricultural University, 2016. (in Chinese)
[35] TODESCHINI V, LINGUA G, D’AGOSTINO G, et al. Effects of high zinc concentration on poplar leaves: A morphological and biochemical study [J]. Environmental and Experimental Botany, 2011, 71(1): 50−56. DOI: 10.1016/j.envexpbot.2010.10.018
[36] 唐敏, 张欣, 谭欣蕊, 等. 锌在3种乔木中的积累及其亚细胞分布和化学形态 [J]. 应用生态学报, 2021, 32(12):4298−4306. TANG M, ZHANG X, TAN X R, et al. Accumulation, subcellular distribution, and chemical forms of zinc in three tree species [J]. Chinese Journal of Applied Ecology, 2021, 32(12): 4298−4306. (in Chinese)
[37] MARICHALI A, DALLALI S, OUERGHEMMI S, et al. Germination, morpho-physiological and biochemical responses of coriander (Coriandrum sativum L. ) to zinc excess [J]. Industrial Crops and Products, 2014, 55: 248−257. DOI: 10.1016/j.indcrop.2014.02.033
[38] TIWARI S, LATA C R. Heavy metal stress, signaling, and tolerance due to plant-associated microbes: An overview [J]. Frontiers in Plant Science, 2018, 9: 452. DOI: 10.3389/fpls.2018.00452
[39] 陈怀宇, 李裕红, 韦炜, 等. Pb2+对桐花树幼苗抗氧化酶活性及脂质过氧化的影响 [J]. 泉州师范学院学报, 2006, 24(2):94−99. DOI: 10.3969/j.issn.1009-8224.2006.02.020 CHEN H Y, LI Y H, WEI W, et al. Effects of lead stress on activities of antioxidant enzymes and lipid peroxidation in Aegiceras corniculatum seedling [J]. Journal of Quanzhou Normal University, 2006, 24(2): 94−99. (in Chinese) DOI: 10.3969/j.issn.1009-8224.2006.02.020
[40] 黄运湘, 廖柏寒, 王志坤. 超积累植物的富集特征及耐性机理 [J]. 湖南农业大学学报(自然科学版), 2005, 31(6):693−697. HUANG Y X, LIAO B H, WANG Z K. The characteristics of bioaccumulation and tolerance mechanism of hyperaccumulator [J]. Journal of Hunan Agricultural University, 2005, 31(6): 693−697. (in Chinese)
[41] 陈柳君, 冯海峰, 朱雪梅, 等. 铜锌复合污染对铜富集植物大聚藻抗氧化酶活性的影响 [J]. 西北植物学报, 2014, 34(10):2056−2062. DOI: 10.7606/j.issn.1000-4025.2014.10.2056 CHEN L J, FENG H F, ZHU X M, et al. Effect of Cu and Zn compound pollution on antioxidant enzyme activity of Cu-enrichment plant Myriophyllum aquaticum [J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(10): 2056−2062. (in Chinese) DOI: 10.7606/j.issn.1000-4025.2014.10.2056
[42] AHAMMED G J, RUAN Y P, ZHOU J, et al. Brassinosteroid alleviates polychlorinated biphenyls-induced oxidative stress by enhancing antioxidant enzymes activity in tomato [J]. Chemosphere, 2013, 90(11): 2645−2653. DOI: 10.1016/j.chemosphere.2012.11.041
[43] URUÇ PARLAK K, DEMIREZEN YILMAZ D. Response of antioxidant defences to Zn stress in three duckweed species [J]. Ecotoxicology and Environmental Safety, 2012, 85: 52−58. DOI: 10.1016/j.ecoenv.2012.08.023
[44] LIN W J, XIAO T F, WU Y Y, et al. Hyperaccumulation of zinc by Corydalis davidii in Zn-polluted soils [J]. Chemosphere, 2012, 86(8): 837−842. DOI: 10.1016/j.chemosphere.2011.10.060
[45] OZDENER Y, AYDIN B K. The effect of zinc on the growth and physiological and biochemical parameters in seedlings of Eruca sativa (L.) (Rocket) [J]. Acta Physiologiae Plantarum, 2010, 32(3): 469−476. DOI: 10.1007/s11738-009-0423-z
[46] 杨忠臣. 人工湿地植物根系泌氧和分泌物影响污染物去除的机制研究[D]. 济南: 山东大学, YANG Z C. Study on the mechanism of radial oxygen loss and root exudates affected pollutant removal in constructed wetlands[D]. Jinan: Shandong University, 2016. (in Chinese)
[47] 李晶, 栾亚宁, 孙向阳, 等. 水生植物修复重金属污染水体研究进展 [J]. 世界林业研究, 2015, 28(2):31−35. LI J, LUAN Y N, SUN X Y, et al. Research advances in remediation of heavy metal contaminated water bodies by aquatic plants [J]. World Forestry Research, 2015, 28(2): 31−35. (in Chinese)
[48] BRUNE A, URBACH W, DIETZ K J. Compartmentation and transport of zinc in barley primary leaves as basic mechanisms involved in zinc tolerance[J]. Plant, Cell & Environment, 1994, 17(2): 153–162.
[49] 易诗明. 铅锌胁迫对蓖麻根系形态结构及元素吸收的影响[D]. 长沙: 中南林业科技大学, 2017. YI S M. Effect of Lead & Zinc on roots morphology and anatomy absorption of Ricinus communis L. [D]. Changsha: Central South University of Forestry & Technology, 2017. (in Chinese)
[50] 吴晓梅, 叶美锋, 吴飞龙, 等. 铜在狐尾藻中的积累及亚细胞分布和化学形态 [J]. 农业环境科学学报, 2024, 43(5):1114−1122. DOI: 10.11654/jaes.2023-0899 WU X M, YE M F, WU F L, et al. Accumulation, subcellular distribution, and chemical forms of copper in Myriophyllum spicatum L [J]. Journal of Agro-Environment Science, 2024, 43(5): 1114−1122. (in Chinese) DOI: 10.11654/jaes.2023-0899
[51] 龙新宪. 东南景天(Sedum alfredii hance)对锌的耐性和超积累机制研究[D]. 杭州: 浙江大学, 2002. LONG X X. Mechanisms of zinc tolerance and hyperaccumulation by Sedum Alfredii Hance [D]. Hangzhou: Zhejiang University, 2002. (in Chinese)





 下载:
下载: