Effects of Red to Far-red Light Ratios on Photosynthetic Fluorescence Characteristics and PIFs of Tea Plants under Low Temperature Conditions
-
摘要:目的
探究低温条件下茶树在不同红光与远红光比值(red to far-red light ratio, R/FR)光环境中的生理与分子响应,为工厂化光设施育苗冬季补光提供理论指导。
方法以茶树品种‘谷雨春’为材料,设置远红光处理(FR,R/FR=4.1)和白光处理(CK,R/FR=10.4),研究低温条件(10 ℃)下不同R/FR比值光环境对茶树气体交换参数、荧光参数及光敏色素互作因子(phytochrome interacting factors, PIFs)表达量的影响。
结果低温条件下添加远红光、降低R/FR比值会导致茶树叶片蒸腾速率(Tr)、净光合速率(Pn)与电子传递速率(electron transport rate, ETR)下降,非调节性能量耗散的量子产量Y(NO)所占的比例升高,实际量子产量(YⅡ)和调节性能量耗散的量子产量Y(NPQ)所占的比例下降,叶绿素合成的重要调节因子CsPIF3a基因下调表达。
结论低温条件下低比值的R/FR光环境削弱了茶树叶片的光合电子传递能力,抑制叶绿素合成相关基因的表达,降低光合能力,叶片受到光损伤。
Abstract:ObjectiveThe physiological and molecular responses of tea plants under different red/far-red light ratio ( R/FR ) light environments under low-temperature conditions were explored to provide theoretical guidance for winter light supplementation in factory light facilities.
Method‘Guyuchun’ was used as the material, and far red light treatment (FR, R/FR=4.1) and white light treatment (CK, R/FR=10.4) were set up to study the effects of different R/FR ratio light environments on gas exchange parameters, fluorescence parameters, and the expression of phytochrome interaction factors (PIFs) of tea plants under low-temperature conditions (10 ℃).
ResultThe transpiration rate (Tr), net photosynthetic rate (Pn), and electron transport rate (ETR) of tea leaves decreased. The proportion of non-regulated energy dissipation quantum yield Y (NO) increased, the proportion of actual quantum yield (YⅡ) and regulated energy dissipation quantum yield Y (NPQ) decreased, and the important regulator of chlorophyll synthesis CsPIF3a gene was down-regulated.
ConclusionThe low ratio of R/FR light environment under low-temperature conditions weakens the photosynthetic electron transport capacity of tea leaves, inhibited the expression of chlorophyll synthesis related genes, reduces the photosynthetic capacity, and leaves are subjected to light damage.
-
0. 引言
【研究意义】茶[Camellia sinensis (L.) O. Kuntze]内含物质丰富,富含茶多酚、生物碱、多糖、黄酮和氨基酸等多种次生代谢产物,具有防癌、抗氧化、降压、降脂、降糖、减肥、抑菌、防龋齿以及减少心血管疾病发生等多重保健功效,是全球最受欢迎的饮料之一[1−4]。茶树作为一种生长在不同农业气候区的木本植物[5],其产量与品质主要受光照、温度和水分等因子影响[6],其中光照通过光照强度和光质组成影响茶树的生长与品质形成,但是茶树光能利用率低,对光照强度要求低,对光质要求高[7]。研究光质对茶树光合响应与信号传导的机制对生产中调控茶树生长发育与品质形成具有重要意义。【前人研究进展】光质对茶树的生长发育产生不同的生理效应[8]和复杂的叠加效应与剂量效应[9]。单独的远红光(λ>700 nm)对光合作用的贡献较小[10],但综合研究表明,远红光与光合有效辐射光具有协同活性[11−12],其中红光与远红光比值(red to far-red light ratio, R/FR)是植物感知外界光环境变化的重要信号,参与调控光形态建成、植物发育等过程[13−14]。低比值的R/FR光环境能够提高茶树品种‘中茶108’的净光合速率、光饱和点与叶绿素的含量,降低光补偿点,而利于植株的生长[8],同时还能够响应非生物胁迫,提高植株抗性[15−17]。例如在低温、低比值R/FR环境条件下,依赖于C-重复结合因子(C-repeat binding factor, CBF)信号通路进行光温信号转导,大麦(Hordeum vulgare)CBF家族基因HvCBF14及其调节子基因HvCOR14b 上调表达[16],拟南芥(Arabidopsis thaliana)CBF家族基因AtCBF1、AtCBF2、AtCBF3则以依赖于生物钟的方式上调表达[18],协同调控,增强了植株的耐寒性。红光和远红光(600~750 nm)信号由光敏色素(phytochrome, PHY)感知到光刺激后,与光敏色素互作因子(phytochrome interacting factors, PIFs)互作,进行光信号传递,参与植物的种子萌发、光形态建成、避荫反应、昼夜节律和叶绿素代谢等过程[19]。PIFs不仅参与光信号响应,还作为温度感受器响应温度信号,如PIF3可以直接与CBF 基因家族的启动子结合,负调控拟南芥的冷驯化[20],PIF4能在高温条件下直接结合到生长素合成基因TAA1和YUC8的启动子上,调节生长素的合成,诱导拟南芥下胚轴的伸长[21−22],因此PIFs在光温信号转导中起着重要作用。在茶树中鉴定出PIFs 有4个类群7个基因:PIF1(CsPIF1)、PIF3(CsPIF3a, CsPIF3b)、PIF7(CsPIF7a, CsPIF7b)和PIF8(CsPIF8a, CsPIF8b),其中CsPIF3a被证明可以作为转录激活因子激活叶绿素代谢途径中CsHEMA和CsPOD的表达,从而调控叶绿素代谢[23]。【本研究切入点】虽然植物光温信号转导机制已经有较为深入的研究,但是有关于远红光对低温条件下茶树光合荧光特性的影响和PIFs的分子响应研究还未见系统的研究报道,有待深入研究。【拟解决的关键问题】本研究以茶树品种‘谷雨春’为试材,设置10 ℃模拟冬季低温条件,在普通白色LED灯的光环境中添加远红光LED灯,实现对光环境中R/FR比值的控制,探究不同R/FR值对茶树叶片气体交换参数、荧光参数以及未萌发芽光敏色素互作因子表达量的影响,以期阐明低温条件不同R/FR比值光环境下茶树的庇荫机制,为工厂化光设施育苗冬季补光提供理论指导。
1. 材料与方法
1.1 试验材料
供试茶树品种谷雨春,2年生未萌发盆栽苗,于2023年2月14日放置光照培养箱中适应培养7 d,设置培养温度10 ℃模拟冬季低温条件,光合光子通量密度约为90 μmol·m−2·s−1,光照周期14 h·d−1,湿度(70±10)%。
1.2 试验方法
1.2.1 试验处理
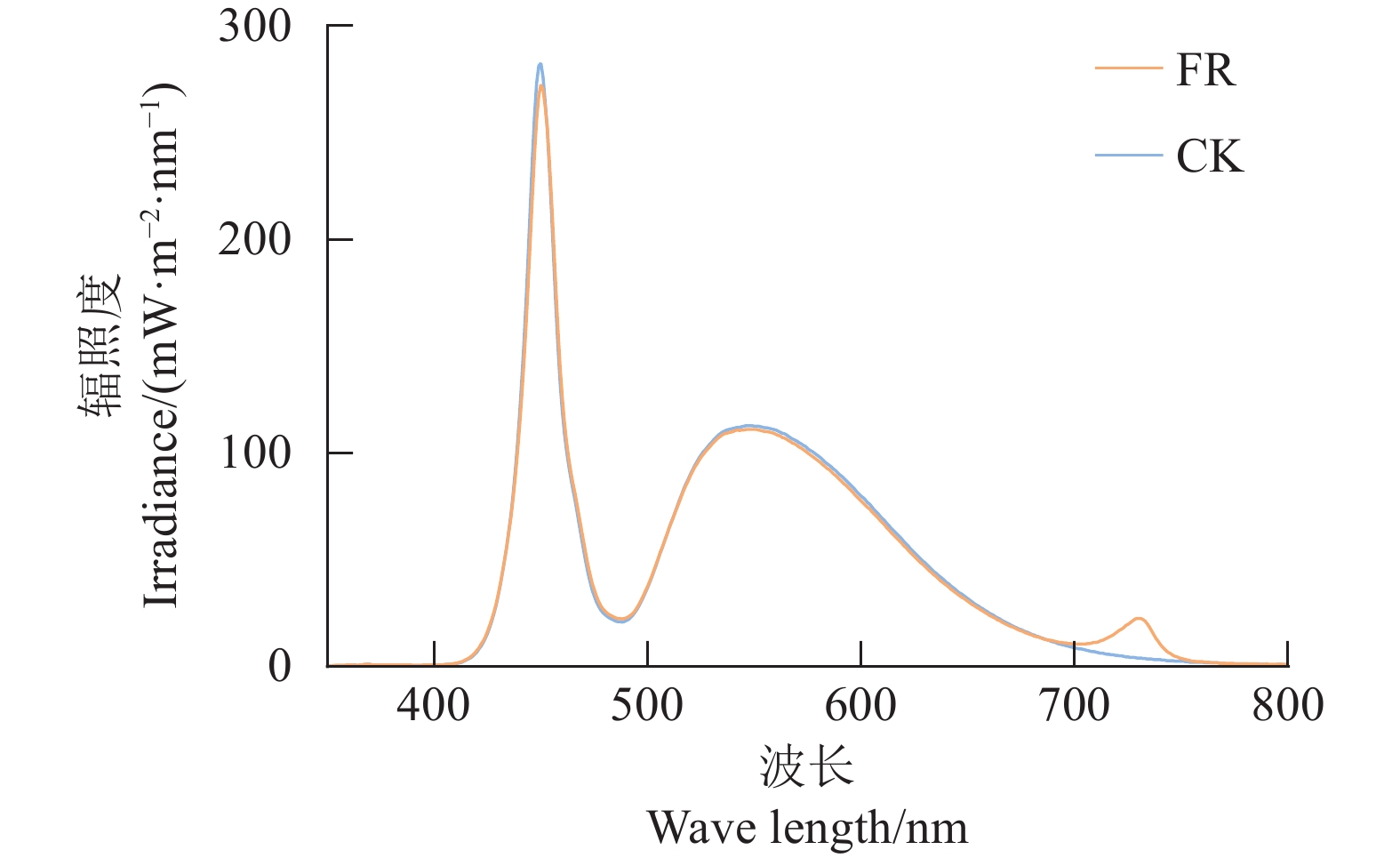
在适应培养7 d后,通过调节LED灯管数量,进行不同R/FR比值处理。参考王加真等[24]关于茶树LED光源设施栽培的理想光照强度研究,使用Hopocolor OHSP-350P植物光照分析仪进行总的光照强度和各处理红光与远红光照强度的测定、校准(图1)。设置远红光处理(FR)光质组成:85.5 μmol·m−2·s−1白光+4.5 μmol·m−2·s−1远红光,远红光占比5%,R/FR=4.1;白光处理(CK)光质组成:90 μmol·m−2·s−1白光,R/FR=10.4。光照周期为14 h·d−1,每个处理8盆,每盆2株茶苗。不同R/FR比值处理48 h后,取5.0 g腋芽用锡箔纸包好,立即放入液氮中冷冻3 min,然后快速放入−80 ℃冰箱中保存备用,用于总RNA的提取,每个处理设 3 个生物学重复。
1.2.2 光合特性测定
选取顶芽往下第3张全展功能叶,使用Walz GFS-
3000 光合仪测定叶片气体交换参数。测量叶室设置:光合光子通量密度800 μmol·m−2·s−1、叶室流速550 μmol·s−1、CO2浓度500 μmol·mol−1,叶室温度25 ℃,相对湿度60%。光合仪开机后进行ZP和MP调零,在排除外界与仪器对测量结果的影响后,测定净光合速率(Pn)、气孔导度(Gs)、细胞间二氧化碳浓度(Ci)、蒸腾速率(Tr),叶片水分利用效率(water use efficiency, WUE)计算公式为:WUE = Pn/Tr。1.2.3 叶绿素荧光参数测定
选取顶芽往下第3张全展功能叶,避开叶片中脉,使用Walz PAM-
2500 叶绿素荧光成像系统测定荧光动力学参数,叶片暗适应30 min后,打开暗适应夹,先打开测量光,再打开一次饱和脉冲光,测定初始荧光Fo、最大荧光Fm、实际量子产量(YⅡ)、非调节性能量耗散的量子产量Y (NO)、调节性能量耗散的量子产量Y(NPQ)、光化学淬灭系数(qL、qP)、非光化学淬灭系数(qN、NPQ)。同时测定不同光强设置下光合电子传递速率(electron transport rate, ETR),光合光子通量密度梯度为0、26、60、110、174、254、356、470、606、884、1006 μmol·m−2·s−1,每步20 s。1.2.4 总RNA提取及qRT-PCR检测
参照天根 RNAprep Pure 植物总 RNA 提取试剂盒说明,以离心柱法抽提茶树叶片中的总RNA,利用超微量核酸分析仪检测其浓度和纯度,1.0%琼脂糖凝胶电泳检测其完整性。采用天根FastKing RT Kit逆转录合成cDNA,采用天根SuperReal PreMix Plus试剂对光敏色素A(phytochrome A, PHYA)和PIFs基因表达情况进行检测。目的基因的特异性引物参考Zhang 等[23]和莫晓丽等[25]的研究报道(表1)。以CsACTIN为内参基因,反应体系20.0 μL:SYBR Green Master Mix 10.0 μL,正、反向引物各0.8 μL,灭菌水7.4 μL,cDNA模板1.0 μL。扩增程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,40个循环。
表 1 qRT-PCR特异性引物Table 1. qRT-PCR specific primers基因
Gene name登录号
Gene ID上游引物(5'-3')
Forward primer sequence (5'-3')下游引物(5'-3')
Reverse primer sequence (5'-3')CsPIF1 TEA006532 TGGAGGACTAAGGGGACA TTTACGCCTGAGATTTGC CsPIF3a TEA033210 CAACAAGGTGGACAAAGC AACATCATCGGTGGCATA CsPIF3b TEA007077 GCAACAAGGTGGACAAAGC TAACATCATCGGCGGCAT CsPIF7a TEA025875 CTCGGTCCCTTTTCCTGA GTTGGCTGCGTTGTTTGA CsPIF7b TEA011633 GATGTGGTCAGAATCCGAAAA GAATCCTCATCCGTGGTTTTA CsPIF8a TEA032260 CCTCTTCTCCACCCTACAGC GAAACAATGCAGCCATCCTA CsPIF8b TEA023842 ACTCCGTTTCTCACAGCA CAGCAGCCCTACATCTTT CsPHY2 TEA002223 TGTTCCCTTCCCTCTTCGTT TCCATTACATTCGGGCTCTG CsPHY4 TEA005460 AGTCTTCAGGCAGTTCAGGG GGATGTGATGGAGGTAAGCG CsACTIN KA280216 GCCATCTTTGATTGGAATGG GGTGCCACAACCTTGATCTT 1.3 统计分析
采用2−△△Ct计算相对表达量,采用SPSS 23.0进行单因素方差分析(ANOVA),经Turkey法进行差异显著性检验,所有图片采用GraphPad Prism 9.5.1软件绘制。
2. 结果与分析
2.1 不同R/FR比值处理茶树叶片光合特性
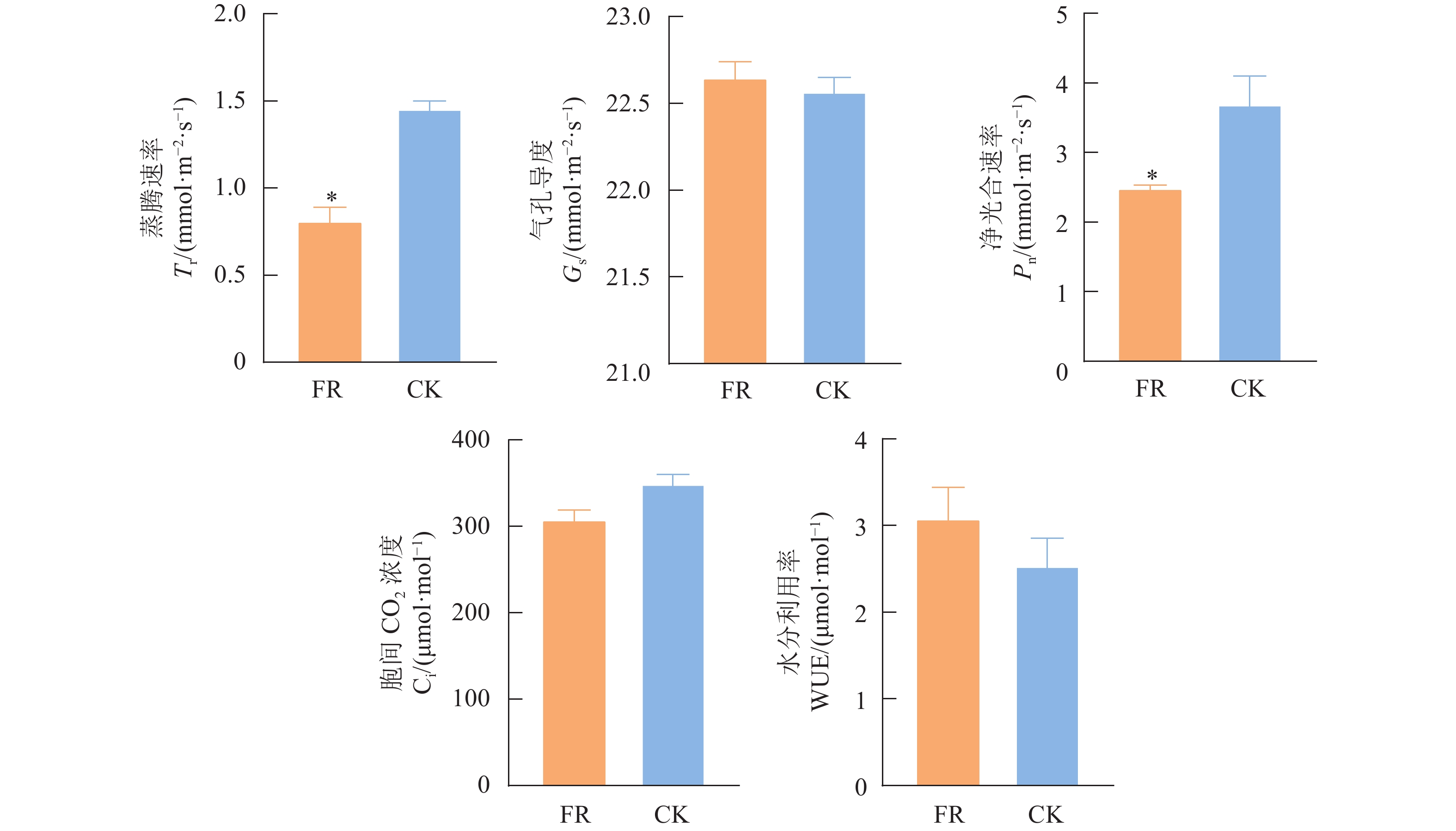
光质通过影响两个光系统(Photosystem Ⅰ and Photosystem Ⅱ,PSⅠ和 PSⅡ)的不平衡激发来影响光合作用。由图2可知,在相同的光量子密度条件下,FR处理显著降低了茶树的Tr与Pn,较CK处理分别降低了44.06%和32.65%,而Ci较CK处理下降了11.96%,这可能是造成FR处理Pn显著下降的直接原因,表明10 ℃低温条件下添加5%的远红光产生了严重的庇荫效应,显著抑制了茶树叶片的光合作用。
2.2 不同R/FR比值处理茶树叶片荧光参数
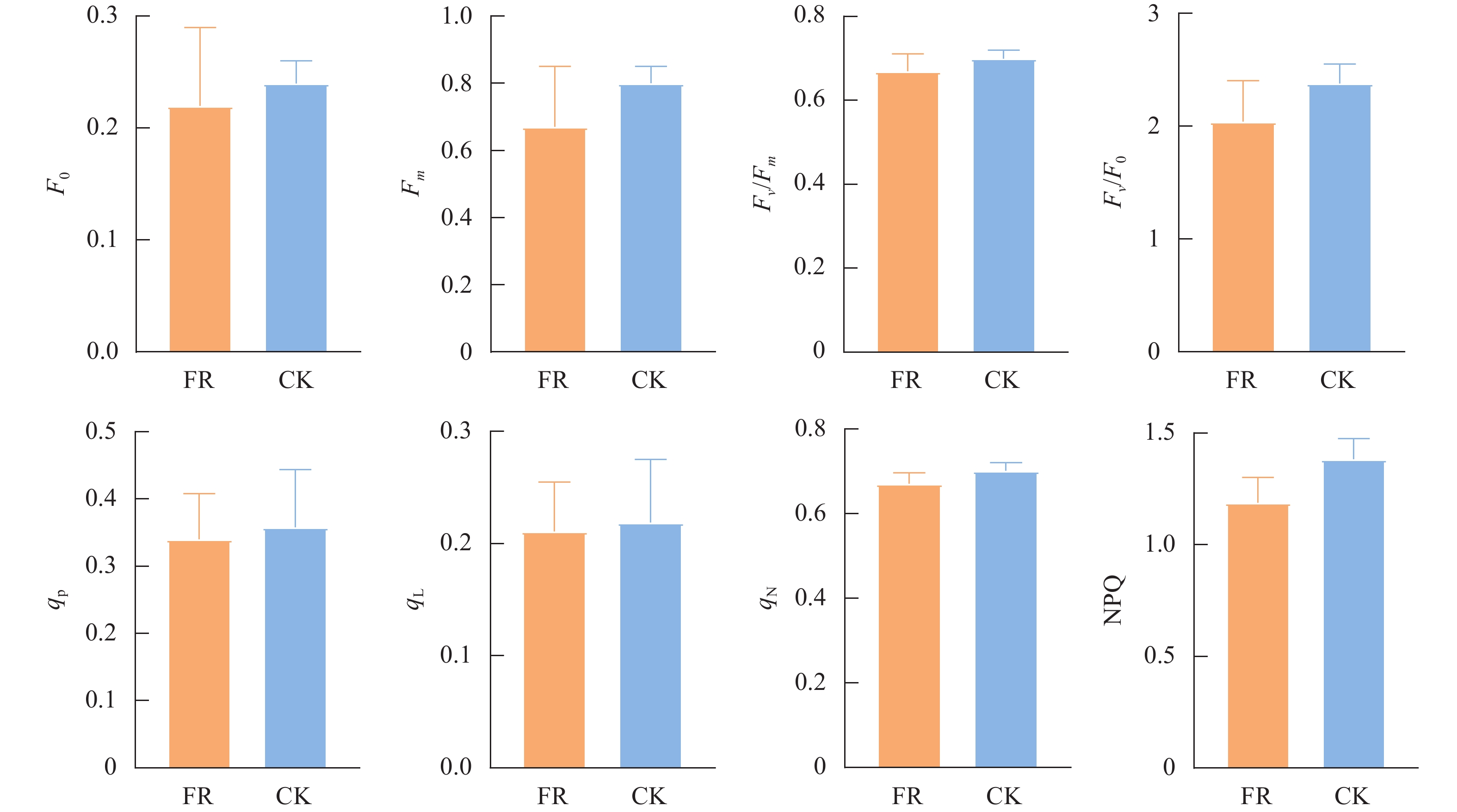
叶绿素荧光是胁迫环境下描述叶绿体状态的重要指标。由图3可知,FR处理荧光参数Fo、Fm、Fv/Fm、Fv/Fo均减小,较CK分别减小6.33%、16.42%、5.06%、14.19%,同时光化学淬灭系数(qL、qP)、非光化学淬灭系数(qN、NPQ)均减小,较CK减小5.03%、3.80%、4.37%、14.10%,但是差异均不显著(P>0.05)。
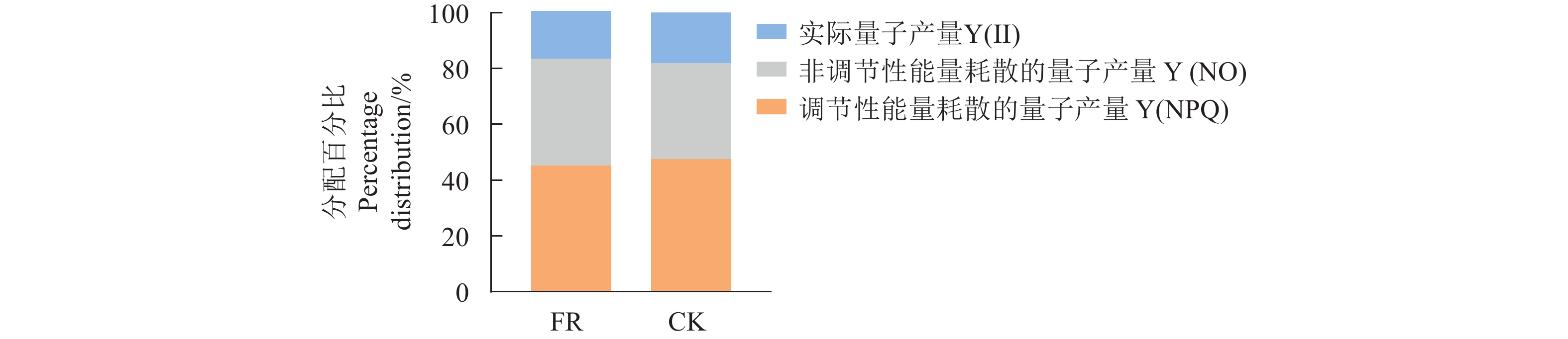
FR处理下,茶树叶片Y(NO)所占的比例较CK处理升高了11.23%,Y(Ⅱ)和Y(NPQ)所占的比例分别下降了8.68%和4.84%(图4),表明茶树在受到远红光的庇荫效应后,PSⅡ吸收的激发能用于电子传递的份额降低,通过能量耗散的份额增加,叶片的光保护能力下降,即只能通过非调节性能量耗散的方式将过剩的光能耗散。因此,低温条件下FR处理可能对茶树产生了一定程度的光损伤。
2.3 不同R/FR比值处理茶树叶片快速响应曲线
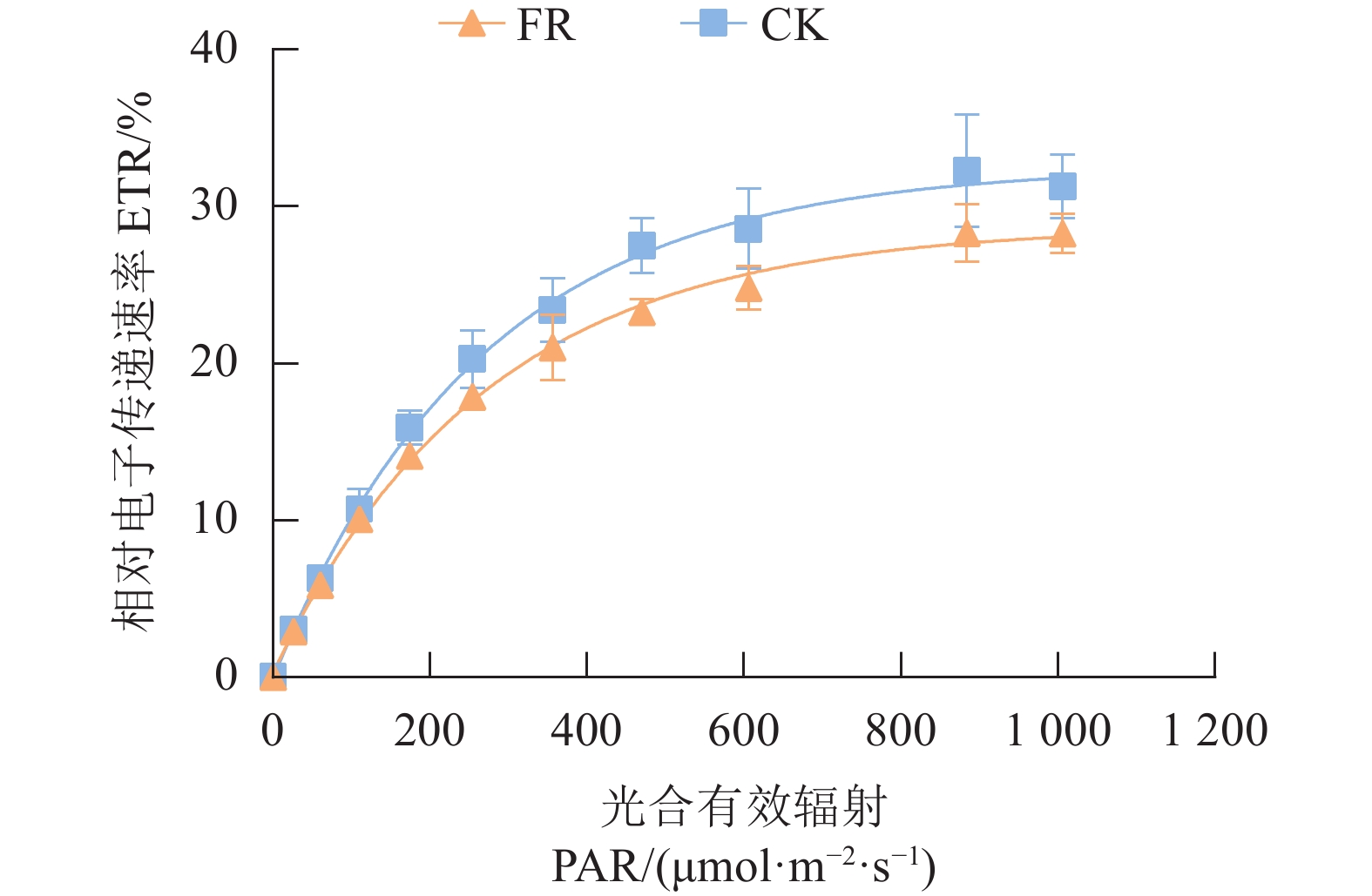
电子传递速率(ETR)是叶绿体光合作用强度的重要指标。由图5可知,在达到光饱和前,相同光合有效辐射(PAR)条件下, FR处理的ETR均小于CK处理,表明FR处理导致茶树光合作用受到抑制。在ETR和PAR的拟合曲线中,两个处理的初始斜率相同,且变化趋势类似,当PAR约为100 μmol·m−2·s−1时斜率开始下降,而FR处理下降速度(即快速光响应曲线斜率)明显大于CK处理,综合表明FR处理降低了茶树光合电子传递速率及可接受的最大光合有效辐射。
2.4 不同R/FR比值处理茶树休眠芽PHYA和PIFs基因的相对表达量
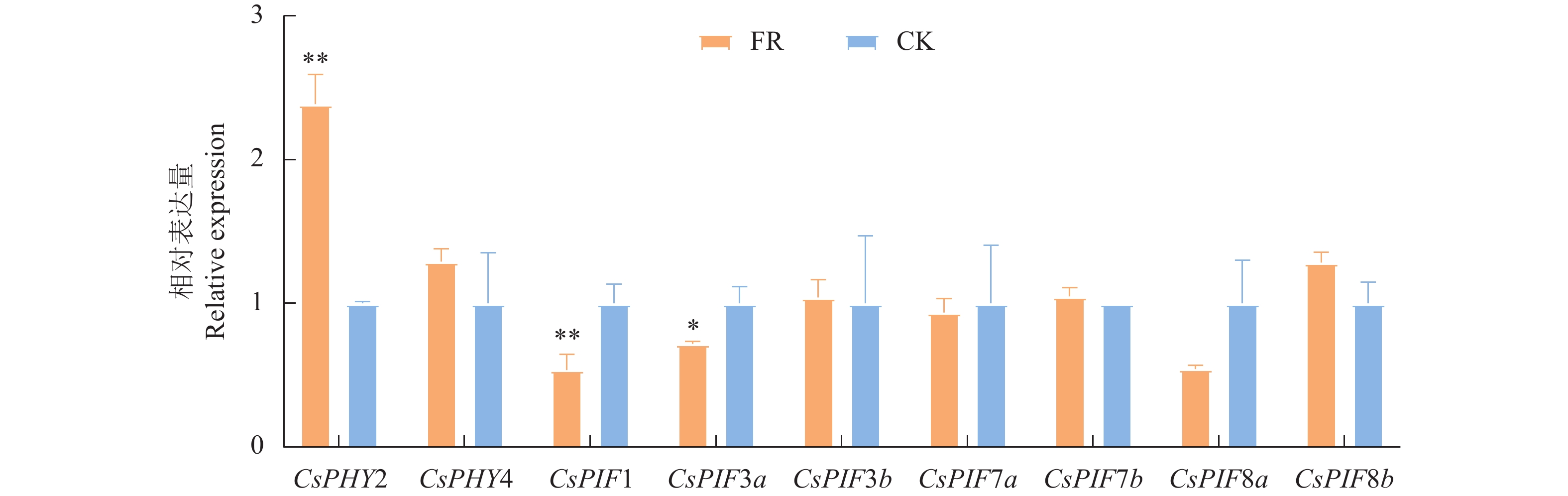
为研究茶树芽对远红光刺激的分子响应机制,本研究测定了不同R/FR处理48 h后未萌发芽PHYA和PIFs基因的相对表达量,由图6结果可知,FR处理茶树休眠越冬芽中远红光受体PHYA家族基因CsPHY2、CsPHY4均上调表达,分别为CK处理的2.39和1.29倍,CsPIFs家族基因CsPIF1、CsPIF3a、CsPIF8a下调表达,分别为CK处理的54%、72%、54%,CsPIF8b上调表达,为CK处理的1.28倍。结果表明CsPHY2和CsPHY4作为远红光受体参与远红光刺激的响应,CsPIFs家族基因CsPIF1、CsPIF3a、CsPIF8a可能负调控植株的庇荫反应。
3. 讨论
3.1 低温条件下降低R/FR比值对茶树产生庇荫效应
遮阴会导致光照强度减弱,光质组成发生变化[26],远红光和绿光波段会在反射和透射光中富集,导致红光与远红光的比值降低。植物通过光敏色素感受环境中R/FR的比例变化,从而感知遮阴环境,启动包括茎与叶柄伸长、叶角抬高、抑制分枝、加速开花等庇荫综合征(shade avoidance syndrome, SAS)的发育反应[27−29]。这些反应影响植物光形态建成,促进植物冠层的光截获,作为植物响应遮阴胁迫的适应性策略,以维持其在光环境中的竞争优势[30]。因此,降低R/FR的比例会触发SAS。在前人研究中,相同光量子密度条件下,降低R/FR比值,导致生菜(Lactuca satva)[31]、冰草(Agropyron cristatum)[32]、大豆(Glycine max)[26]等均表现出茎秆长度、叶面积以及生物量增加的庇荫效应。但是不同植物对降低R/FR比值后的光合荧光特性的响应不一致,如大豆幼苗在正常光与弱光条件下,添加远红光、降低R/FR比值后,均导致Pn、光饱和点和PSⅡ最大量子产量Fv/Fm的升高[26];盐胁迫下的番茄(Solanum lycopersicum)在降低R/FR比值后,也会导致Pn升高[33];莴苣(Lactuca sativa)添加远红光可提高YⅡ、Pn,降低Y(NPQ)[34];本研究中茶树品种谷雨春与生菜[31]、冰草[32]在降低R/FR比值后,导致Pn下降的趋势一样。由于在光能的吸收、传输和转化过程中叶绿素起着重要作用,其含量与组成直接影响叶片的光合能力[35]。因此,研究结果的差异可能与总叶绿素及光合氮含量有关[31,36],还可能与两个光系统的不平衡激发有关。优先激发PSⅠ的远红光(λ>700 nm)能够降低叶片的吸收能力和光合作用量子产率。因此,降低R/FR的比值后,远红光对两个光系统的不平衡激发,导致ETR与Pn的下降。综合表明,降低R/FR比值虽然降低了叶片Pn,但SAS会导致茎秆的伸长,叶面积的增大,使得冠层的光截获能力提升,最终增加了生物量。
3.2 低温条件下降低R/FR比值降低了茶树叶片叶绿素含量
叶绿素在植物光合作用光吸收阶段起着核心作用,光作为叶绿素合成的重要条件,其与相应的光受体作用调控色素的合成[37],远红光通过影响叶绿素的含量以及叶绿素a与叶绿素b的比值来影响叶片的光合能力与光合活性[38]。与光合荧光特性类似,随R/FR比值的降低,不同植物叶绿素含量呈现出不同的变化趋势。如大豆 [26, 39−40]、菊花(Chrysanthemum morifolium)[41]等降低R/FR比值,叶绿素含量升高,而玉米(Zea mays)[42] 、黄瓜(Cucumis sativus)[43]和马铃薯(Solanum tuberosum)[44]则随着R/FR比值的降低,叶绿素含量降低。在本研究中,降低R/FR比值降低了CsPIF3a的表达量。由于茶树CsPIF3a基因是叶绿素合成的重要调节因子,CsPIF3a可以与叶绿素合成途径中编码谷氨酰-tRNA 还原酶基因CsHEMA和原叶绿素酸酯还原酶基因CsPOR启动子上的G-box作用元件结合,激活启动子的转录,参与叶绿素的生物合成,同时在拟南芥过表达株系CsPIF3a-OE中AtHEMA、AtHEME、AtCHLI和AtPORC等叶绿素生物合成的基因显著上调表达,叶片色泽更绿且叶绿素含量更高,表明CsPIF3a通过正向激活叶绿素合成相关基因的表达,诱导叶绿素在茶树叶片中的积累[23]。因此,CsPIF3a的表达量降低可能会导致叶绿素含量降低,而叶片的光吸收率与单位叶面积的叶绿素含量呈正相关[45],这与降低R/FR比值会导致光合能力下降的结果相一致,所以长时间低R/FR比值的光环境可能会导致茶树叶片叶绿素含量的降低,降低叶片的光合能力。有研究表明,添加15%的远红光后,中茶108叶片中叶绿素a、叶绿素b等含量均显著高于未添加远红光处理的叶片含量[8]。通过遮阴处理14 d后均能提高茶树叶片的叶绿素相对含量值[46],这与本研究结果不一致,推测可能是因为不同R/FR比值对植株叶绿素含量和光合能力的影响趋势不一致,例如在相同光照强度下,菊花叶片光合速率由大到小的R/FR值顺序依次为2.5、4.5、0.5、6.5[47],也可能是遮阴处理导致光照强度减弱以及品种间差异等因素导致[8],还可能是由于低温条件下光温互作调控的结果。
4. 结论
在低温条件下,低R/FR比值的光环境导致茶树叶片ETR、Pn、YⅡ和Y(NPQ)所占的比例下降,Y(NO)所占的比例升高,表明茶树叶片受到光抑制和光损伤,影响了光合机构的作用,导致光合电子传递能力下降。在此过程中,CsPIF1、CsPIF3a、CsPIF8a作为庇荫反应的负调控因子响应远红光刺激,其中叶绿素合成的重要调节因子CsPIF3a基因表达量降低,进一步削弱了茶树叶片的光合能力。
-
表 1 qRT-PCR特异性引物
Table 1 qRT-PCR specific primers
基因
Gene name登录号
Gene ID上游引物(5'-3')
Forward primer sequence (5'-3')下游引物(5'-3')
Reverse primer sequence (5'-3')CsPIF1 TEA006532 TGGAGGACTAAGGGGACA TTTACGCCTGAGATTTGC CsPIF3a TEA033210 CAACAAGGTGGACAAAGC AACATCATCGGTGGCATA CsPIF3b TEA007077 GCAACAAGGTGGACAAAGC TAACATCATCGGCGGCAT CsPIF7a TEA025875 CTCGGTCCCTTTTCCTGA GTTGGCTGCGTTGTTTGA CsPIF7b TEA011633 GATGTGGTCAGAATCCGAAAA GAATCCTCATCCGTGGTTTTA CsPIF8a TEA032260 CCTCTTCTCCACCCTACAGC GAAACAATGCAGCCATCCTA CsPIF8b TEA023842 ACTCCGTTTCTCACAGCA CAGCAGCCCTACATCTTT CsPHY2 TEA002223 TGTTCCCTTCCCTCTTCGTT TCCATTACATTCGGGCTCTG CsPHY4 TEA005460 AGTCTTCAGGCAGTTCAGGG GGATGTGATGGAGGTAAGCG CsACTIN KA280216 GCCATCTTTGATTGGAATGG GGTGCCACAACCTTGATCTT -
[1] WEI C L,YANG H,WANG S B,et al. Draft genome sequence of Camellia sinensis var. sinensis provides insights into the evolution of the tea genome and tea quality[J]. Proceedings of the National Academy of Sciences of the United States of America,2018,115(18) :E4151−E4158.
[2] 刘仲华,张盛,刘昌伟,等. 茶叶功能成分利用“十三五” 进展及“十四五” 发展方向[J]. 中国茶叶,2021,43(10) :1−9. DOI: 10.3969/j.issn.1000-3150.2021.10.001 LIU Z H,ZHANG S,LIU C W,et al. Tea functional ingredients utilization progress during the 13th Five-Year Plan period and development direction in the 14th Five-Year Plan[J]. China Tea,2021,43(10) :1−9. (in Chinese) DOI: 10.3969/j.issn.1000-3150.2021.10.001
[3] 欧阳建,周方,卢丹敏,等. 茶多糖调控肥胖作用研究进展[J]. 茶叶科学,2020,40(5) :565−575. DOI: 10.3969/j.issn.1000-369X.2020.05.001 OUYANG J,ZHOU F,LU D M,et al. Research progress of tea polysaccharides in regulating obesity[J]. Journal of Tea Science,2020,40(5) :565−575. (in Chinese) DOI: 10.3969/j.issn.1000-369X.2020.05.001
[4] 王越鹏,耿战辉,郑志强,等. 抹茶研究热点的可视化分析及其功效研究进展[J]. 食品科学,2024,45(23) :367−376. DOI: 10.7506/spkx1002-6630-20240411-102 WANG Y P,GENG Z H,ZHENG Z Q,et al. Visual analysis of research hotspots in matcha and research progress in its efficacy[J]. Food Science,2024,45(23) :367−376. (in Chinese) DOI: 10.7506/spkx1002-6630-20240411-102
[5] CHANG N,ZHOU Z W,LI Y Y,et al. Exogenously applied Spd and Spm enhance drought tolerance in tea plants by increasing fatty acid desaturation and plasma membrane H+-ATPase activity[J]. Plant Physiology and Biochemistry,2022,170:225−233. DOI: 10.1016/j.plaphy.2021.12.008
[6] ZHANG X C,JIANG H G,WAN X C,et al. The effects of different types of mulch on soil properties and tea production and quality[J]. Journal of the Science of Food and Agriculture,2020,100(14) :5292−5300. DOI: 10.1002/jsfa.10580
[7] LIU L L,LIN N,LIU X Y,et al. From chloroplast biogenesis to chlorophyll accumulation:The interplay of light and hormones on gene expression in Camellia sinensis cv. Shuchazao leaves[J]. Frontiers in Plant Science,2020,11:256. DOI: 10.3389/fpls.2020.00256
[8] ZHANG X C,CHEN K Y,ZHAO Z Y,et al. A novel LED light radiation approach enhances growth in green and albino tea varieties[J]. Plants,2023,12(5) :988. DOI: 10.3390/plants12050988
[9] 肖富良,翟秀明,李解,等. 光质调控茶树生长发育与品质形成的研究进展[J]. 激光生物学报,2023,32(2) :111−117. DOI: 10.3969/j.issn.1007-7146.2023.02.002 XIAO F L,ZHAI X M,LI J,et al. Research progress on the regulation of light quality on the growth development and quality formation of tea plant[J]. Acta Laser Biology Sinica,2023,32(2) :111−117. (in Chinese) DOI: 10.3969/j.issn.1007-7146.2023.02.002
[10] MCCREE K J. The action spectrum,absorptance and quantum yield of photosynthesis in crop plants[J]. Agricultural Meteorology,1971,9:191−216. DOI: 10.1016/0002-1571(71)90022-7
[11] ZHEN S Y,BUGBEE B. Far-red photons have equivalent efficiency to traditional photosynthetic photons:Implications for redefining photosynthetically active radiation[J]. Plant,Cell &;Environment,2020,43(5) :1259–1272.
[12] ZHEN S Y,VAN IERSEL M,BUGBEE B. Why far-red photons should be included in the definition of photosynthetic photons and the measurement of horticultural fixture efficacy[J]. Frontiers in Plant Science,2021,12:693445. DOI: 10.3389/fpls.2021.693445
[13] DEMOTES-MAINARD S,PÉRON T,COROT A,et al. Plant responses to red and far-red lights,applications in horticulture[J]. Environmental and Experimental Botany,2016,121:4−21. DOI: 10.1016/j.envexpbot.2015.05.010
[14] HOLALU S V,FINLAYSON S A. The ratio of red light to far red light alters Arabidopsis axillary bud growth and abscisic acid signalling before stem auxin changes[J]. Journal of Experimental Botany,2017,68(5) :943−952.
[15] HAYES S,PANTAZOPOULOU C K,VAN GELDEREN K,et al. Soil salinity limits plant shade avoidance[J]. Current Biology,2019,29(10) :1669–1676. e4.
[16] AHRES M,GIERCZIK K,BOLDIZSÁR Á,et al. Temperature and light-quality-dependent regulation of freezing tolerance in barley[J]. Plants,2020,9(1) :83. DOI: 10.3390/plants9010083
[17] GURURANI M A,VENKATESH J,TRAN L S P. Regulation of photosynthesis during abiotic stress-induced photoinhibition[J]. Molecular Plant,2015,8(9) :1304−1320. DOI: 10.1016/j.molp.2015.05.005
[18] FRANKLIN K A,WHITELAM G C. Light-quality regulation of freezing tolerance in Arabidopsis thaliana[J]. Nature Genetics,2007,39(11) :1410−1413. DOI: 10.1038/ng.2007.3
[19] 江薇,肖宁,陆怡,等. 植物光敏色素作用因子PIFs的生物学功能[J]. 植物生理学报,2014,50(6) :698−706. JIANG W,XIAO N,LU Y,et al. Biological function of phytochrome-interacting factors in plant[J]. Plant Physiology Journal,2014,50(6) :698−706. (in Chinese)
[20] JIANG B C,SHI Y T,ZHANG X Y,et al. PIF3 is a negative regulator of the CBF pathway and freezing tolerance in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(32) :E6695−E6702.
[21] FRANKLIN K A,LEE S H,PATEL D,et al. Phytochrome-interacting factor 4 (PIF4) regulates auxin biosynthesis at high temperature[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(50) :20231−20235.
[22] GANGAPPA S N,BERRIRI S,KUMAR S V. PIF4 coordinates thermosensory growth and immunity in Arabidopsis[J]. Current Biology,2017,27(2) :243−249. DOI: 10.1016/j.cub.2016.11.012
[23] ZHANG X N,XIONG L G,LUO Y,et al. Identification,molecular characteristic,and expression analysis of PIFs related to chlorophyll metabolism in tea plant (Camellia sinensis) [J]. International Journal of Molecular Sciences,2021,22(20) :10949. DOI: 10.3390/ijms222010949
[24] 王加真,金星,熊云梅,等. 红蓝LED光照强度对茶树生长及生物化学成分的影响[J]. 分子植物育种,2020,18(5) :1656−1660. WANG J Z,JIN X,XIONG Y M,et al. Effects of red-blue LED light intensity on growth and biochemical components of tea plants[J]. Molecular Plant Breeding,2020,18(5) :1656−1660. (in Chinese)
[25] 莫晓丽,周子维,把熠晨,等. 茶树光敏色素基因家族成员的生物信息学及其表达量与黄酮含量的相关性分析[J]. 南方农业学报,2019,50(6) :1173−1182. DOI: 10.3969/j.issn.2095-1191.2019.06.03 MO X L,ZHOU Z W,BA Y C,et al. Bioinformatics of phytochrome gene family members of tea,its expression and correlation with flavonoid content[J]. Journal of Southern Agriculture,2019,50(6) :1173−1182. (in Chinese) DOI: 10.3969/j.issn.2095-1191.2019.06.03
[26] YANG F,LIU Q L,CHENG Y J,et al. Low red/far-red ratio as a signal promotes carbon assimilation of soybean seedlings by increasing the photosynthetic capacity[J]. BMC Plant Biology,2020,20(1) :148. DOI: 10.1186/s12870-020-02352-0
[27] FRANKLIN K A. Shade avoidance[J]. New Phytologist,2008,179(4) :930−944. DOI: 10.1111/j.1469-8137.2008.02507.x
[28] SMITH H,WHITELAM G C. The shade avoidance syndrome:Multiple responses mediated by multiple phytochromes[J]. Plant,Cell &Environment,1997,20(6) :840–844.
[29] HALLIDAY K J,KOORNNEEF M,WHITELAM G C. Phytochrome B and at least one other phytochrome mediate the accelerated flowering response of Arabidopsis thaliana L. to low red/far-red ratio[J]. Plant Physiology,1994,104(4) :1311−1315. DOI: 10.1104/pp.104.4.1311
[30] FANKHAUSER C,BATSCHAUER A. Shadow on the plant:A strategy to exit[J]. Cell,2016,164(1/2) :15−17.
[31] 李源源,吴翠南,吴雪,等. 植物工厂红光与远红光配比对生菜产量和品质的影响[J]. 西北农林科技大学学报(自然科学版) ,2024,52(11) :73−83. LI Y Y,WU C N,WU X,et al. Effects of red light to far-red light ratio on yield and quality of lettuce in a plant factory[J]. Journal of Northwest A & F University (Natural Science Edition) ,2024,52(11) :73−83. (in Chinese)
[32] 孟力力,曹凯,孙倩,等. 不同红光远红光配比对冰草生长发育、光合特性及品质的影响[J]. 核农学报,2022,36(1) :226−235. DOI: 10.11869/j.issn.100-8551.2020.01.0226 MENG L L,CAO K,SUN Q,et al. Effects of different ratios of red light and far red light on growth,photosynthetic characteristics and quality of Mesembryanthemum crystallinum L[J]. Journal of Nuclear Agricultural Sciences,2022,36(1) :226−235. (in Chinese) DOI: 10.11869/j.issn.100-8551.2020.01.0226
[33] 艾楷棋,苏华,周海将,等. 不同红光与远红光对盐胁迫下番茄叶绿素合成的影响[J]. 北方园艺,2019(1) :14−22. DOI: 10.11937/bfyy.20181267 AI K Q,SU H,ZHOU H J,et al. Effects of different R:FR ratio on chlorophyll biosynthesis in tomato leaves under salt stress[J]. Northern Horticulture,2019(1) :14−22. (in Chinese) DOI: 10.11937/bfyy.20181267
[34] ZHEN S Y,VAN IERSEL M W. Far-red light is needed for efficient photochemistry and photosynthesis[J]. Journal of Plant Physiology,2017,209:115−122. DOI: 10.1016/j.jplph.2016.12.004
[35] TAN T T,LI S L,FAN Y F,et al. Far-red light:A regulator of plant morphology and photosynthetic capacity[J]. The Crop Journal,2021,10(2) :300−309.
[36] 邹洁. 远红光对植物工厂生菜生长和品质生理的影响及其应用策略研究[D]. 北京:中国农业科学院,2022. ZOU J. Effects of far-red light on growth,quality and physiology of lettuce in plant factory and its application strategy[D]. Beijing:Chinese Academy of Agricultural Sciences,2022. (in Chinese)
[37] STUEFER J F,HUBER H. Differential effects of light quantity and spectral light quality on growth,morphology and development of two stoloniferous Potentilla species[J]. Oecologia,1998,117(1/2) :1−8.
[38] ZIENKIEWICZ M,DROŻAK A,WASILEWSKA W,et al. The short-term response of Arabidopsis thaliana (C3) and Zea mays (C4) chloroplasts to red and far red light[J]. Planta,2015,242(6) :1479−1493. DOI: 10.1007/s00425-015-2392-3
[39] 鲁兆宏,谭婷婷,滕一鸣,等. 大豆和花生表型及光合特性对荫蔽的响应[J]. 浙江大学学报(农业与生命科学版) ,2023,49(4) :526−534. LU Z H,TAN T T,TENG Y M,et al. Phenotypes and photosynthetic characteristics of soybeans and peanuts in response to shading[J]. Journal of Zhejiang University (Agriculture and Life Sciences) ,2023,49(4) :526−534. (in Chinese)
[40] YANG F,FENG L Y,LIU Q L,et al. Effect of interactions between light intensity and red-to-far-red ratio on the photosynthesis of soybean leaves under shade condition[J]. Environmental and Experimental Botany,2018,150:79−87. DOI: 10.1016/j.envexpbot.2018.03.008
[41] 邸秀茹,焦学磊,崔瑾,等. 新型光源LED辐射的不同光质配比光对菊花组培苗生长的影响[J]. 植物生理学通讯,2008,44(4) :661−664. DI X R,JIAO X L,CUI J,et al. Effects of different light quality ratios of LED on growth of Chrysanthemum plantlets in vitro[J]. Plant Physiology Communications,2008,44(4) :661−664. (in Chinese)
[42] 韦宝,宋朝玉,王圣健,等. 施氮时期和R/FR比值对玉米生长生理性状和产量的影响[J]. 中国农学通报,2018,34(3) :10−18. DOI: 10.11924/j.issn.1000-6850.casb17010003 WEI B,SONG C Y,WANG S J,et al. Nitrogen application time and R/FR ratio:Effect on growth physiological characters and yield of maize[J]. Chinese Agricultural Science Bulletin,2018,34(3) :10−18. (in Chinese) DOI: 10.11924/j.issn.1000-6850.casb17010003
[43] 李雪,赵士文,张冠智,等. 添加不同强度的远红光对黄瓜幼苗生长及光合作用的影响[J]. 中国农业大学学报,2024,29(2) :66−76. DOI: 10.11841/j.issn.1007-4333.2024.02.07 LI X,ZHAO S W,ZHANG G Z,et al. Effects of adding different intensities of far-red light on the growth and photosynthesis of cucumber seedlings[J]. Journal of China Agricultural University,2024,29(2) :66−76. (in Chinese) DOI: 10.11841/j.issn.1007-4333.2024.02.07
[44] 金彦君,祝洪沙,王金禹,等. 不同光质对马铃薯生长及光合特性的影响[J]. 甘肃农业大学学报,2024,59(2) :45−53. JIN Y J,ZHU H S,WANG J Y,et al. Effects of different light qualities on the growth and photosynthetic properties of potatoes[J]. Journal of Gansu Agricultural University,2024,59(2) :45−53. (in Chinese)
[45] EVANS J R,POORTER H. Photosynthetic acclimation of plants to growth irradiance:The relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain[J]. Plant,Cell &Environment,2001,24(8) :755–767.
[46] GE S B,WANG Y M,SHEN K Y,et al. Effects of differential shading on summer tea quality and tea garden microenvironment[J]. Plants,2024,13(2) :202. DOI: 10.3390/plants13020202
[47] 杨再强,张静,江晓东,等. 不同R:FR值对菊花叶片气孔特征和气孔导度的影响[J]. 生态学报,2012,32(7) :2135−2141. DOI: 10.5846/stxb201106240942 YANG Z Q,ZHANG J,JIANG X D,et al. The effect of red:Far red ratio on the stomata characters and stomata conductance of Chrysanthemum leaves[J]. Acta Ecologica Sinica,2012,32(7) :2135−2141. (in Chinese) DOI: 10.5846/stxb201106240942




 下载:
下载: