Establishment and Monitoring Analysis of Fluorescence RT-PCR for Detection of Bovine Viral Diarrhea Virus in Swine
-
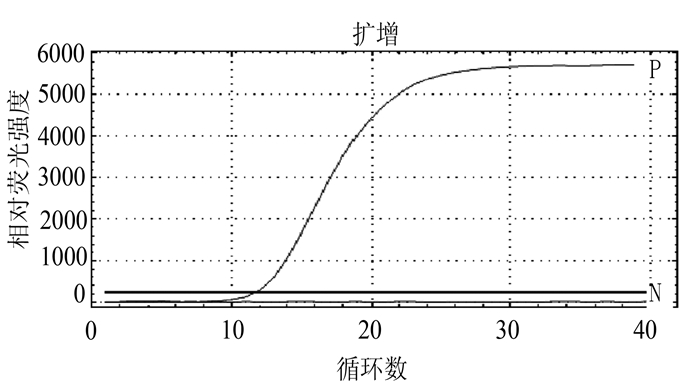
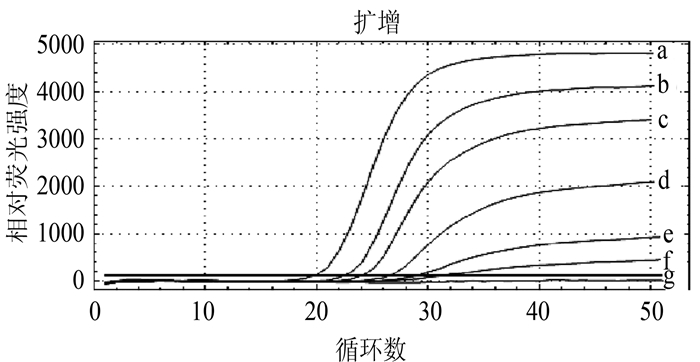
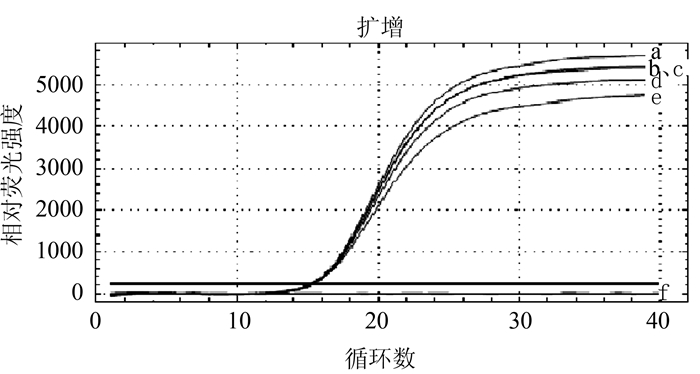
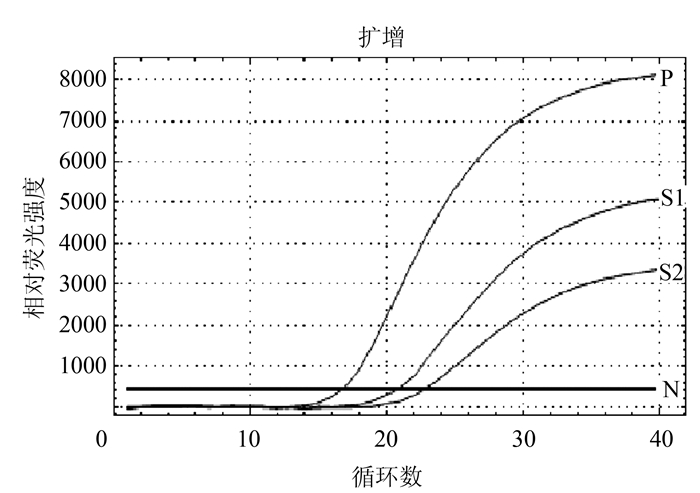
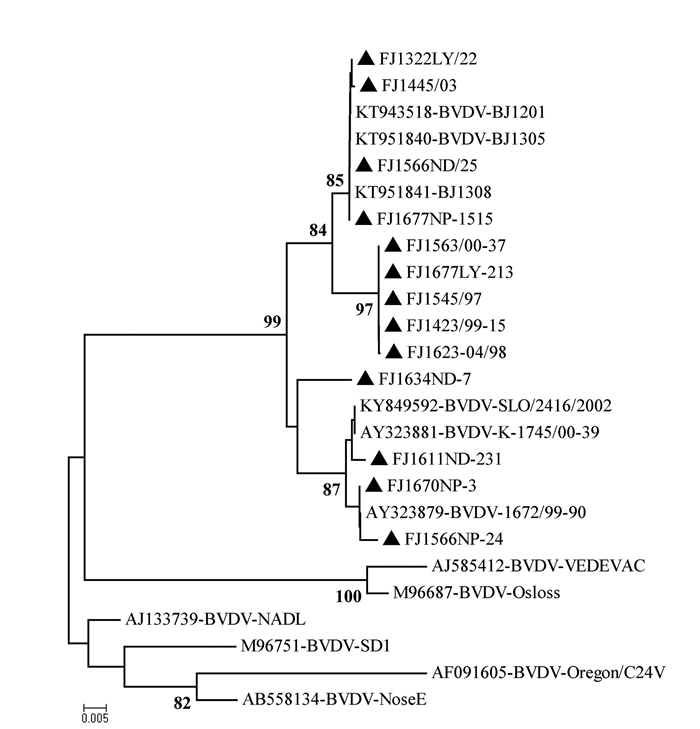
摘要: 根据牛病毒性腹泻病毒(BVDV)5'-UTR保守序列建立的特异性荧光RT-PCR,对采自福州市周边屠宰场的359份屠宰猪血清进行BVDV感染的病原学检测。结果待检的359份血清样品BVDV阳性52份,阳性率为14.5%(52/359)。对其中13份BVDV阳性样品5'端UTR片段进行序列测定分析,发现所测13份BVDV阳性样品5'端UTR片段均与VEDEVAC进化谱系较为密切,均为基因Ⅰ型。以上结果表明以牛源BVDV建立的特异性荧光RT-PCR方法适用于猪源BVDV感染的监测,并揭示福州市屠宰猪存在BVDV感染。
-
关键词:
- 猪源牛病毒性腹泻病毒 /
- 荧光RT-PCR /
- 屠宰猪 /
- 病原学检测
Abstract: The study was aimed at developing a quantitative real-time fluorescence reverse transcriptase PCR(qRT-PCR) assay according to the conserved gene sequence of BVDV 5'-UTR for detection of bovine viral diarrhea virus(BVDV) obtained from 359 slaughtered swine serum samples of slaughterhouses in Fuzhou Prefecture. The results showed that the BVDV positive rate of slaughtered swines was 14.5%(52 positive samples out of 359 ones). Sequence analysis on 5'-UTR fragments of 13 BVDV positive samples showed that 5'-UTR fragments of all tested samples were closely related to VEDEVAC evolution lineages, all of which were genotype I. It was indicated that the specific qRT-PCR method established based on BVDV was suitable for detection of BVDV in swines. And the BVDV infection was common in slaughtered swines of Fuzhou Prefecture.-
Keywords:
- BVDV in swine /
- fluorescence RT-PCR /
- slaughtered swine /
- pathogenic detection
-
0. 引言
【研究意义】RNA干扰(RAN interference, RNAi)技术广泛应用于动物、植物和微生物等基因功能的研究。利用转基因技术在植物体表达dsRNA,当昆虫取食带有dsRNA的植物,dsRNA随食物进入到昆虫体内,使昆虫某些功能丧失造成损伤或者死亡,从而达到防治害虫的效果。利用RNAi防治害虫的设想已经在鳞翅目和鞘翅目昆虫上实现[1-2]。西花蓟马Frankliniella occidentalis (Pergande)是一种危险的入侵害虫,对蔬菜和观赏性植物危害严重,并且其传播的番茄斑萎病毒对寄主植物造成重大损失[3]。西花蓟马虫体小,隐蔽性强,目前常用的防治方法很难有效控制。因此,建立快速有效的西花蓟马RNA干扰技术,对研究西花蓟马的基因功能以及防治蓟马类害虫有重要意义。【前人研究进展】目前将外源dsRNA导入昆虫体内的方式有很多,如饲喂法、注射法、浸泡法、转基因植物表达后昆虫取食等,但是饲喂法和注射法是最常用的两种方法。对于有些昆虫,采用饲喂和注射两种方法都取得较好效果。如烟粉虱通过饲喂dsRNA和显微注射伪蛹和成虫都能有效抑制靶基因的表达[4-5];以Pxbursα部分序列的双链RNA(dsRNA)饲喂小菜蛾4龄末期幼虫,发现蛹期Pxbursα的表达受到了显著抑制,小菜蛾的发育停滞在蛹期而无法正常羽化,并最终死亡;利用合成的VgR siRNA注射小菜蛾雌蛹,结果显示16 h内VgR的表达受到明显抑制,证明RNAi对小菜蛾有效[6-7]。饲喂法也在桔小实蝇[8]、柑橘全爪螨[9]、褐飞虱[10]、白背飞虱[11]等昆虫上成功应用,注射法在桔小实蝇[12]、柞蚕[13]、中华按蚊[14]、豌豆长管蚜[15]等昆虫上行之有效。但对有些昆虫饲喂法没有效果,如喂食黑腹果蝇表达dsRNA的酵母没有获得成功[16];饲喂法也不能有效沉默东亚飞蝗V-ATPase A/E、CHS1、Kr-h1和Verm基因的表达[17]。应用RNAi抑制害虫靶基因表达在害虫防治中表现出巨大潜力,目前在刺吸式口器的同翅目昆虫蚜虫、叶蝉和粉虱防治上都已得到应用[18]。【本研究切入点】国内外对西花蓟马RNAi的研究成熟经验很少[19],国内没有关于蓟马RNAi的研究。【拟解决的关键问题】本研究选用膜饲喂法和显微注射法干扰西花蓟马的Actin基因,明确蓟马RNA干扰的合适方法,为小型昆虫基因功能的研究和验证提供依据。
1. 材料与方法
1.1 供试昆虫
西花蓟马由云南省农业科学院生物技术与种质资源研究所提供,用四季豆饲养于人工气候箱(MGC-350HP-2,上海一恒科技有限公司)。饲养条件为温度25℃,相对湿度60%~70%,光照L∶D = 14∶10 h。
1.2 西花蓟马Actin基因的扩增验证
根据NCBI西花蓟马Actin基因序列(GenBank登录号:XM_026432071.1)设计Actin引物(表1)。西花蓟马总RNA的提取采用Trizol(Ambion公司)法,然后用EasyScript Reverse Transcriptase反转录试剂盒(北京全式金生物科技有限公司)反转成cDNA[20]。再以西花蓟马cDNA为模板扩增Actin基因[20],PCR产物回收纯化(TransGen Biotech, catalog number: DP209)后连接到T载体上,挑选单菌落进行PCR鉴定,并送上海铂尚生物技术有限公司测序。
表 1 引物信息Table 1. Primers applied引物名称
Primer name序列(5′-3′)
Sequence (5′-3′)Actin/F ATGTGTGACGACGATGTTGC Actin/R TTAGAAGCACTTGCGGTGGACG T7Actin/F TAATACGACTCACTATAGGGTTCGTGGGCATGGAATC
TTGCGGTATT7Actin/R TAATACGACTCACTATAGGGCGGACTCGTCGTACTCG
TCCTTGGAGAT7GFP/F TAATACGACTCACTATAGGGCGAGGAGCTGTTCACC
GGT7GFP/R TAATACGACTCACTATAGGGTCCTCGATGTTGTGGCGG q18S/F TTTTATGGTGGTGTTGTTGTGG q18S/R CAAGGGCTTTGGGTAATGG qActin /F TGGTCGGTATGGGACAGAAGGA qActin/R TCGGTGAGCAGGACAGGGTG 1.3 dsRNA的合成
根据已扩增验证的西花蓟马Actin基因序列设计合成dsRNA引物,然后在引物的5'端加上T7启动子序列(表1)。用HiScribeTM T7 Quick High Yield RNA Synthesis Kit(New England Biolabs,美国)先扩增5'端均含有T7启动子序列的DNA片段,随后以获得的DNA片段为模板,用T7转录酶进行体外转录以合成目的基因的dsRNA[21],用琼脂糖凝胶电泳检测dsRNA的质量、紫外分光光度计检测浓度,合成的dsRNA置于−80 ℃备用。
1.4 dsRNA稳定性的检测
为了保证dsRNA在膜饲喂和注射过程中的完整性,先将dsRNA分别置于室温12 h和24 h,然后通过凝胶电泳检测dsRNA的降解情况。
1.5 膜饲喂
首先将一块小Parafilm拉伸至很薄覆盖在直径约30 mm的饲喂装置上,Parafilm膜的厚薄程度要保证蓟马可以刺破取食液体。在第一层膜上添加饲喂液体50 µL(20%蜂蜜水∶dsRNA = 1∶1,dsRNA质量浓度为0.5 µg·µL−1[11]),再覆盖上第二层膜以保护液体不挥发和不受污染,第二层膜上放上四季豆以吸引蓟马到膜附近取食。然后分别将100只蜕皮12 h的二龄西花蓟马若虫放置于膜饲喂装置,每隔24 h重新更换dsActin。同时对照组饲喂dsGFP。24、48 和72 h后各取20只活的西花蓟马检测dsRNA的沉默效果。试验重复3次。
1.6 显微注射
利用油压式手动微量注射仪(CellTramoil, Eppendorf)将质量浓度为0.5 µg·µL−1的dsActin和dsGFP分别注射到200只蜕皮12 h的2龄西花蓟马若虫体腔。注射后24、48、72 h分别取出20只活虫检测dsRNA的沉默效果。另外,在注射后12 h,取30只活虫,单头饲养于放置四季豆的饲养管中,每天观察存活情况和形态变化,共观察5 d,统计死亡率、体长和畸形率。同时,羽化后12 h在体视镜(型号DMSZ7)下测量体长。试验重复3次。
1.7 Real-time PCR检测dsRNA沉默效率
Trizol法提取西花蓟马的总RNA,然后用EasyScript Reverse Transcriptase反转录试剂盒(北京全式金生物科技有限公司)反转录为cDNA。以西花蓟马18S rRNA(GenBank登录号:XM_026420069.1)作为内参基因,分别设计RT-qPCR引物(表1)。参照GoTaq® qPCR Master Mix (2X)试剂盒(Promega公司,美国)操作说明配制反应体系,每个样品设3个重复,在BIO-RAD CFX96实时定量PCR仪(Bio-Rad,美国)检测目标基因的表达量。获得的CT值利用2−△△CT计算目的基因的相对表达水平[11]。
1.8 数据分析
不同干扰时间dsRNA处理之间的多重比较采用单因素方差分析(One-way ANOVA, Tukey HSD test)(SPSS 21.0),差异显著性检验水平标准P<0.05。
2. 结果与分析
2.1 西花蓟马Actin基因克隆验证
根据NCBI上西花蓟马的Actin序列(GenBank登录号:XM_026432071.1)设计引物,PCR扩增及测序结果表明,Actin基因完整的开放性阅读框长度为1 131 bp,编码376个氨基酸(图1-2),与已经报道的西花蓟马Actin基因序列一致。
2.2 dsRNA稳定性
琼脂糖凝胶电泳检测结果表明,dsRNA放置24 h后仍然保持较好的完整性(图3)。因此膜饲喂进入蓟马体内的dsRNA是完整的。
2.3 膜饲喂和显微注射dsActin对西花蓟马Actin基因表达的影响
RT-qPCR检测结果表明,与对照组饲喂dsGFP相比,膜饲喂dsActin24 h、48 h和72 h后,Actin基因的相对表达量分别为对照组的97%、91%和98%,这表明通过膜饲喂dsActin对西花蓟马Actin基因表达抑制作用不显著(图4)。相反,通过显微注射将dsActin注入西花蓟马体腔,在注射后24、48和72 h,Actin基因的表达量分别为对照组的68%、56%和53%(图5),与对照组均有显著差异(P<0.05)。
2.4 注射dsActin对西花蓟马存活率和形态的影响
由2.3可知,显微注射质量浓度为0.5 µg·μL−1的dsActin可显著抑制西花蓟马Actin基因的表达,观察发现,注射dsGFP的西花蓟马在第24-120 h后的死亡率为29%-52%,而注射dsActin基因的西花蓟马死亡率在第24-120 h达44%-98%(图5-A);同时,注射dsActin的西花蓟马成虫翅膀或胸腹部畸形率为41%(图5-B~C),且个体体长只有注射dsGFP的对照组的90%左右(图5-D)。说明注射dsActin成功干扰了西花蓟马的Actin基因,并对其生长发育产生了影响。
3. 讨论与结论
RNA干扰是由双链RNA介导、引起目的基因mRNA序列特异性降解的基因沉默的一个过程。通过RNAi沉默靶标基因是当前研究昆虫基因功能的重要手段[22]。饲喂法、注射法、浸泡法、直接取食转基因植物等是将外源dsRNA导入昆虫体内的常用方式[11,22]。已有研究表明,饲喂dsRNA的干扰效率明显低于将其注射到昆虫体腔,如在棉铃虫的RNAi试验中,仅饲喂一次很难产生明显的RNAi效应,连续饲喂才与注射一次的RNAi效果相当[23]。本研究通过比较膜饲喂和微针注射dsActin两种方式沉默西花蓟马Actin基因,结果表明,微针注射方式成功实现了对目的基因的干扰;尽管通过增加膜饲喂次数来增加摄入昆虫体内dsRNA的量,但是72 h后仍然不能有效沉默目的基因。因此,微针注射dsRNA是沉默西花蓟马目的基因的有效方式,该结果为后续西花蓟马及小型昆虫基因功能的研究提供了技术手段。
基于注射法的RNA干扰方法能减小昆虫表皮或者中肠障碍,使dsRNA快速进入体腔或者血淋巴,同时还能准确控制进入虫体的dsRNA剂量[12]。本研究表明,显微注射方式虽然具有干扰效果好的优点,但是注射会对昆虫造成直接的物理损伤,增加昆虫死亡率。因此,在注射时要选择合适的针头、注射体积、注射位置,尽量避免损伤昆虫。此外,显微注射前较常用的麻醉方法有乙醚麻醉法、二氧化碳麻醉法和冰冻麻醉法等,选择合适的麻醉方法能降低昆虫死亡率。本研究发现在蓟马麻醉过程中,二氧化碳麻醉法具有速度快、损伤小的优点。
综上所述,显微注射dsRNA是沉默蓟马目的基因的有效方式,适于开展蓟马类小型昆虫基因功能分析,筛选防控靶标基因,同时在应用过程中,还需要综合考虑各种因素,从而提高RNA干扰效果。
-
表 1 荧光RT-PCR反应体系
Table 1 The reaction system of Fluorescence RT-PCR
成分 用量/μL 10×RT-PCR buffer solution 2.5 MgCl2(25 mmol·L-1) 5.0 dNTP(10 mmol·L-1) 2.5 RNasin(40 U·μL-1) 0.5 AMV reverse transcriptase (5 U·μL-1) 0.5 Taq DNA polymerase(5 U·μL-1) 0.5 upstream primers(10 μmol·L-1) 0.5 downstream primers(10 μmol·L-1) 0.5 TaqMan probe(5 μmol·L-1) 0.5 RNA 5.0 RNase-Free water 7.0 -
[1] FAUQUET C. Virus taxonomy:classification and nomenclature of viruses:eighth report of the International Committee on the Taxonomy of Viruses[M]. Academic Press, 2005.
[2] FERNELIUS A L, AMTOWER W C, LAMBERT G, et al. Bovine Viral Diarrhea Virus in swine:characteristics of virus recovered from naturally and experimentally infected swine[J]. Can J Comp Med, 1973, 37(1):13-20. http://www.ncbi.nlm.nih.gov/pubmed/4265548
[3] 朱礼倩, 周艳君, 于海, 等.牛病毒性腹泻在中国的流行现状分析[J].中国动物传染病学报, 2011, 19(5):83-86. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSJB201105017.htm [4] 徐磊, 曾亮明, 王玉玲, 等.福建省猪群感染牛病毒性腹泻病毒的病原学检测与分析[J].畜牧兽医学报, 2014, 45(12):2006-2012. http://www.cnki.com.cn/Article/CJFDTOTAL-XMSY201412014.htm [5] 曾亮明, 徐磊, 王玉玲, 等.猪血清中牛病毒性腹泻病毒抗体ELISA检测方法的建立与应用[J].中国兽医科学, 2014, 44(09):944-950. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGSY201409011.htm [6] 吴文辉. 猪群BVDV感染状况调查及成因初步分析[D]. 上海: 上海交通大学, 2011. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sytx201104014&dbname=CJFD&dbcode=CJFQ [7] 邓宇, 张荣, 丛雁方, 等.猪源牛病毒性腹泻病毒实时荧光定量PCR检测方法的建立[J].畜牧兽医学报, 2011, 42(7):1046-1050. http://www.cnki.com.cn/Article/CJFDTOTAL-XMSY201107023.htm [8] 王新平, 涂长春, 李红卫, 等.从可疑猪瘟病料中检出牛病毒性腹泻粘膜病病毒[J].中国兽医学报, 1996, 16(4):341-345. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zsyx604.007&dbname=CJFD&dbcode=CJFQ [9] 孙泉云, 张苏华, 沈悦, 等.奶牛和猪血清中牛病毒性腹泻-粘膜病抗体的检测[J].畜牧与兽医, 2004, 36(2):30-31. http://www.cnki.com.cn/Article/CJFDTOTAL-XMYS200402018.htm [10] 宋永峰, 张志, 张燕霞, 等.猪源牛病毒性腹泻病毒的流行初探[J].中国动物检疫, 2008, 25(7):25-27. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGDW200807018.htm [11] TERPSTRA C, WENSVOORT G. Natural infections of pigs with bovine viral diarrhea virus associated with signs resembling swine fever[J]. Res Vet Sci, 1988, 45(2):137-142. http://www.ncbi.nlm.nih.gov/pubmed/2848298
[12] TOPLAK I, SANDVIK T, BARLI-MAGANJA D, et al. Genetic typing of bovine viral diarrhoea virus:most Slovenian isolates are of genotypes 1d and 1f[J]. Veterinary Microbiology, 2004, 99(3-4):175. DOI: 10.1016/j.vetmic.2003.12.004
[13] CAI D, SONG Q, WANG J, et al. Genomic characterization of three bovine viral diarrhea virus isolates from cattle.[J]. Archives of Virology, 2016, 161(12):1-4. http://www.ncbi.nlm.nih.gov/pubmed/27613287
-
期刊类型引用(1)
1. 袁兵杰,张奕菲,刘佩,王娜,郑腾飞,祁艳霞. 鹌鹑MITF基因多态性与羽色性状的关联性分析. 中国畜禽种业. 2022(12): 15-18 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: