Heterogeneity of Tomato Metabolites induced by Ralstonia solanacearum with Varied Pathogenicity
-
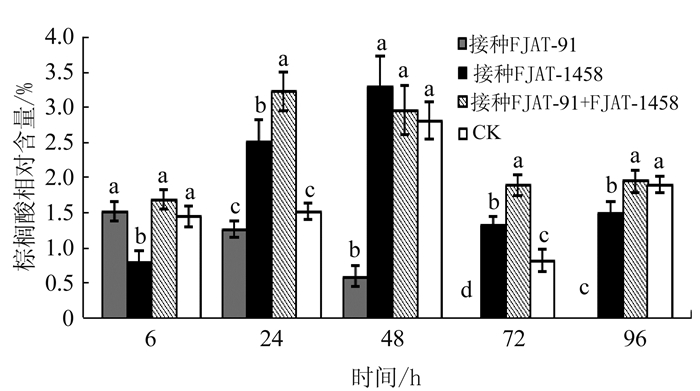
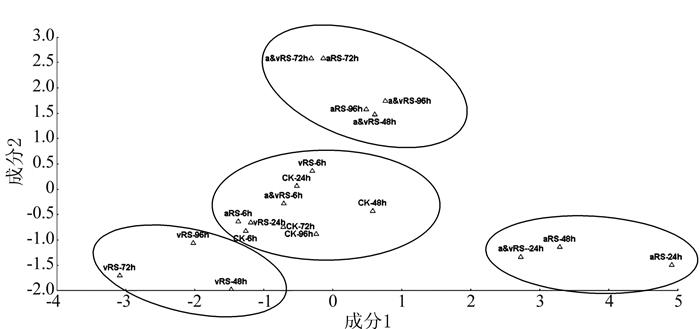
摘要: 采用基于气相色谱-质谱联用技术的代谢组学方法,研究不同致病性青枯雷尔氏菌诱导番茄植株代谢物变化的异质性。将青枯雷尔氏菌强致病力菌株FJAT-91和无致病力菌株FJAT-1458分别单独接种和混合接种番茄植株,以清水为对照,接种后6、24、48、72、96 h取样,测定番茄植株代谢产物的变化。结果表明,检测到的代谢物种类主要为醇类、酯类、酸类、醛类、吡啶类和烷烃类。不同处理番茄代谢产物组成变化的时间动态结果表明,FJAT-91单独接种处理48 h、FJAT-1458单独接种处理48 h、同时接种FJAT-91和FJAT-1458处理96 h及对照处理72、96 h的番茄中检测到代谢物种类最多,分别为12、18、15和15种。邻苯二甲酸二丁酯在不同处理不同时间的番茄中均检测到,为完全分布类型,其他代谢物为不完全分布类型。FJAT-91单独接种处理能诱导番茄代谢产物棕榈酸消亡,而FJAT-1458单独接种或与菌株FJAT-91混合接种及对照处理的番茄植株该代谢物维持在相当含量,说明该代谢物可能与植株免疫抗病有关。主成分分析表明,不同接种处理诱导番茄植株的代谢谱存在一定的差异,主成分一和主成分二基本上能将其区分开来。Abstract: Gas chromatography-mass spectrometry was employed for the investigation on the heterogeneity of metabolites in tomato plants infected by strains of Ralstonia solanacearum with varied pathogenicity. The plants were inoculated with the virulent FJAT-91 and/or avirulent FJAT-1458, as well as water as control. After 6, 24, 48, 72 and 96 h, metabolites in the plants were analyzed. The results showed the metabolites were mostly alcohols, esters, acids, aldehydes, pyridines, and alkanes. The compositional differences on the plants infected by different pathogenic strains were compared. It was found that the number of metabolite varieties in the plants varied by the treatments and time. The tomato plants treated by FJAT-91 for 48 h had 12 different metabolites; those treated by FJAT-1458 for 48 h, 18;those treated by both strains simultaneously for 96 h, 15;and, control treated for 72 or 96 h, 15. Dibutyl phthalate was the only metabolite present in all samples. n-hexadecanoic acid was absent in the plants inoculated with FJAT-91, but was detected at considerable amounts in those infected with FJAT-1458 or combined strains, and control. The discrepancy might be due to a variation in the immunology of the tomato plants. A principal component analysis on the metabolites revealed discernible differences among the tomato plants that received different treatments. It suggested that the viral infections could be identified by comparing the two most abundant metabolites in a plant.
-
Keywords:
- tomato /
- bacterial wilt disease /
- Ralstonia solanacearum /
- GC-MS
-
0. 引言
【研究意义】荞麦(Fagopyrum Miller)起源于中国,在世界上分布广泛,遍及亚洲和欧洲,主要有苦荞和甜荞2个栽培种。其中苦荞(Fagopyrum tataricum),又名鞑靼荞麦(Tartary buckwheat),为我国的主要栽培种。Rout[1]、Li and Zhang[2]和陈庆富[3] 等的研究表明:苦荞含有丰富的黄酮类物质、D-手性肌醇(D-CI)、活性蛋白及活性多肽、丰富的矿质元素等[4],“三降”功能明显,还对癌症等疾病有较好的预防效果[5]。苦荞具有较高的研究和开发价值。但生产上苦荞的产量较低[6],实现苦荞的高产亟待解决[7]。研究表明,四倍体苦荞是由二倍体苦荞加倍而成,隐含着更高的增产潜力和更广的适应性[8-9],但是实际生产上四倍体苦荞的产量较低,其主要原因是籽粒充实度较差。因此,明确四倍体苦荞充实差的生理机理,对于提出切实可行的栽培调控措施、提高苦荞的产量等有重要的理论和实际意义。【前人研究进展】赵钢等[10]的研究发现,四倍体苦荞的细胞和组织器官比二倍体明显增大,且根系发达,茎秆粗壮,叶面积增大,叶厚度增加,籽粒增大,产量明显超过原种二倍体。廉立坤等[8]的研究发现,四倍体苦荞与二倍体苦荞相比具有生长势强、生物学产量高、籽粒大、籽粒品质好和抗逆性强等特点。李振宙等[9]的研究发现,四倍体苦荞的充实度较差,一般在20%~30%,严重影响了其在生产上的推广和利用,适宜的钾肥施用量,能促进四倍体苦荞的生长发育,同时还能提高其籽粒的充实度,促进了四倍体苦荞产量的提高。【本研究切入点】有关四倍体苦荞充实较差的生理机制还未有明确定论。【拟解决的关键问题】为了明确四倍体苦荞充实差的生理原因,本研究以二倍体苦荞品种小黄荞和六苦2081及其四倍体TB193和TB198为试验材料,比较分析了四倍体和二倍体苦荞间灌浆特性、根系形态生理、农艺性状、充实度及产量的差异,以期明确四倍体苦荞充实差的生理机制,为指导苦荞的高产栽培等提供理论和实践意义。
1. 材料与方法
1.1 试验材料
供试苦荞品种为二倍体苦荞品种小黄荞和六苦2081,及其对应的四倍体苦荞材料TB193和TB198(利用秋水仙素对二倍体苦荞品种进行加倍而获得),分别以E1、E2和S1、S2表示,上述材料由贵州师范大学荞麦产业技术研究中心提供。
1.2 试验方法
试验于2018年4月10日在贵州师范大学荞麦产业技术研究中心黄泥塘试验基地进行。池栽,池子长5 m,宽2 m,深0.3 m。池中装有新移的黄壤土,前作空闲,土壤有机质34.45 g·kg−1,全氮1.10 g·kg−1,水解氮118 mg·kg−1,有效磷21.46 mg·kg−1,速效钾112.28 mg·kg−1,pH5.77。氮磷钾肥分别以100 kg·hm−2(尿素)、69 kg·hm−2(过磷酸钙)和5.1 kg·hm−2(氯化钾)的最适施用量混匀后作为基肥1次施入[11]。每份苦荞资源种植3个水泥池,每个水泥池作为1次重复,共计12个水池。条播,行距0.33 m,播种量为3.65 g·m−2,基本苗约90~100株·m−2。各小区中有70%籽粒成熟时采收(2018年7月12日)。
1.3 取样方法
从苦荞开花起选择相似的典型植株进行挂牌标记,第1次取样为开花后第5 d,此后每隔5 d取样1次,直到籽粒成熟。将所取的苦荞籽粒去壳后,取其中1/2籽粒置液氮冷冻1 min后放入−70 ℃冰箱保存,用于测定淀粉合成酶活性,另1/2置105 ℃烘箱中杀青10 min后,于60 ℃烘干至恒重,用于测定苦荞的灌浆特性。参考李振宙等[9]的方法取样,用于测定苦荞的根系形态、根系活力、伤流液及农艺性状。
1.4 指标测定
1.4.1 灌浆特性测定
参照朱庆森等[12]的方法利用Richards方程对籽粒生长过程进行拟合:W=A(1+Be−Kt)(−1/N)。参考杨志远等[13]的方法计算灌浆前、中、后期时间段内灌浆物质对总灌浆物质的贡献率。
1.4.2 淀粉合成相关酶活性的测定
参考Yang等[14]的方法测定腺苷二磷酸葡萄糖焦磷酸化酶(ADP- glucose pyrophosphorylase, AGPase)、可溶性淀粉合酶(Soluble starch synthase, SSS)和淀粉分支酶(Starch branching enzyme, SBE)的活性。
1.4.3 根系形态生理测定
参考李振宙等[9]的方法测定根系形态指标;参考金成忠等[15]的方法测定苦荞一昼夜伤流强度的变化情况。采用TTC法测定根系活力[16]。
1.4.4 农艺性状及产量的测定
参考张宗文等[17]的方法测量株高、主茎分枝数、主茎节数、1~2节节间粗度、1~2节节间长度、子叶节高度;参照李振宙等[9]的方法测定籽粒的充实度和产量。
1.5 数据分析
采用Excel 2003软件进行数据处理,SPSS 20.0软件对数据进行差异性分析。
2. 结果与分析
2.1 四倍体和二倍体苦荞的百粒重
由表1可以看出,4个供试苦荞材料的百粒干重随生育期的推进呈持续增加的变化趋势,花后15 d之前增幅较大,其后增幅有所下降,花后30 d以后4个苦荞材料的百粒重趋于稳定。苦荞材料间比较,同时期四倍体苦荞的百粒干重均低于二倍体苦荞,其中花后5、10、15 d的差异达到显著水平。
表 1 籽粒的百粒重Table 1. Hundred-grain weight of Tartary buckwheat(单位:g) 品种 Variety 5 d 10 d 15 d 20 d 25 d 30 d E1 0.07±0.01 a 0.76±0.07 a 1.37±0.06 a 1.57±0.07 a 1.79±0.03 a 1.80±0.03 a S1 0.04±0.02 b 0.41±0.02 b 1.12±0.07 b 1.54±0.06 a 1.71±0.02 a 1.77±0.05 a E2 0.13±0.02 a 0.99±0.03 a 1.63±0.04 a 1.76±0.07 a 1.92±0.05 a 1.96±0.03 a S2 0.11±0.03 b 0.82±0.05 b 1.40±0.03 b 1.74±0.04 a 1.79±0.03 b 1.83±0.02 a 注:同列数据后不同小写字母表示同一品种不同材料之间差异显著(P<0.05),表2~6同。
Note: Different letter means significant difference of each level (P<0.05). The same as table 2-6.2.2 Richards方程模拟苦荞籽粒的灌浆过程
由表2可以看出,各苦荞材料的曲线方程的决定系数R2=0.995~1.000,说明用Richards方程拟合苦荞的灌浆过程是可行的。四倍体苦荞的A值均低于二倍体苦荞。4个苦荞的N值均小于1,且以四倍体苦荞的N值高于二倍体苦荞。四倍体苦荞的灌浆起始势(R0)显著低于二倍体苦荞,E1和S1的最大灌浆速率(Gmax)和平均灌浆速率(Gmean)无明显差异,E2的Gmax和Gmean显著高于S2;达最大灌浆速率的时间(Tmax.G)则明显高于二倍体苦荞;灌浆速率为最大时的生长量与籽粒生长终值量比值(I)苦荞材料间的差异不显著。
表 2 籽粒灌浆的Richards方程参数Table 2. Parameters in Richards equation for evaluating grain-filling of Tartary buckwheat品种
Variety生长终值量
A初值参数
B生长速率参数
K形状参数
N决定系数
R2灌浆起始势
R0灌浆速率
最大时间
Tmax.G/d最大灌浆
速率
Gmax/
(g·d−1)平均灌浆
速率
Gmean/
(g·d−1)灌浆速率
最大生长量/
籽粒生长
终值量
I/%E1 1.80±0.11 0.51±0.02 0.24±0.03 0.05±0.01 0.995±0.052 4.41±0.42 a 9.48±0.87 b 0.15±0.01 a 0.10±0.02 a 37.76±3.12 a S1 1.79±0.13 1.73±0.09 0.24±0.02 0.10±0.02 1.000±0.021 2.28±0.21 b 11.92±1.12 a 0.15±0.01 a 0.10±0.01 a 38.61±2.97 a E2 1.92±0.14 1.09±0.10 0.29±0.01 0.08±0.01 0.996±0.034 3.45±0.27 a 8.80±0.80 b 0.20±0.01 a 0.13±0.01 a 38.29±2.11 a S2 1.85±0.09 1.13±0.98 0.24±0.01 0.12±0.01 0.998±0.042 1.99±0.28 b 9.64±1.02 a 0.15±0.02 b 0.10±0.01 b 38.86±2.07 a 注:A:生长终值量;B:初值参数;K:生长速率参数;N:形状参数;t:开花后的时间;R2:判断系数;R0:灌浆起始势;Tmax.G:达最大灌浆速率的时间;Gmax:最大灌浆速率;Gmean:平均灌浆速率;I为灌浆速率为最大时的生长量与籽粒最终质量比值。
A: The final grain weight at harvest; B: The initial value of parameter; K: The constant growth rate; N: The shape parameter; R2 : The compatibility; R0: The initial growth power; Tmax.G : The time with maximum grain-filling rate; Gmax: The maximum grain-filling rate; Gmean: The mean grain-filling rate; I: the ratio of the growth at the maximum grain filling rate to the final grain dry weight.2.3 四倍体和二倍体苦荞籽粒灌浆阶段划分
由表3可以看出,灌浆前期持续的时间E1显著小于S1,E2和S2间则无显著差异;灌浆中期和灌浆后期持续的时间则都以二倍体苦荞显著小于四倍体苦荞。灌浆前期的平均速率S1显著小于E1,E2和S2间无明显差异;灌浆中期和后期总体以四倍体苦荞显著小于二倍体苦荞。籽粒灌浆前期对籽粒粒重的贡献率二倍体苦荞显著小于四倍体苦荞,灌浆中期对籽粒粒重的贡献率以四倍体苦荞小于二倍体苦荞,但差异不显著,灌浆后期对籽粒粒重的贡献率则以四倍体苦荞显著小于二倍体苦荞。由表3还可以看出,各灌浆时期对苦荞籽粒粒重的贡献率存在差异,表现为灌浆中期>灌浆后期>灌浆前期。
表 3 籽粒灌浆阶段的划分Table 3. Grain-filling stages of Tartary buckwheat品种
Variety灌浆前期 Early filling stage 灌浆中期 Middle filling stage 灌浆后期 Later filling stage 天数
Days/d平均速率
Average rate/(g·d−1)贡献率
Contribution/%天数
Days/d平均速率
Average rate/(g·d−1)贡献率
Contribution/%天数
Days/d平均速率
Average rate/(g·d−1)贡献率
Contribution/%E1 5.33±0.47 b 0.03±0.01 a 8.17±0.48 b 13.63±1.21 b 0.13±0.02 a 60.95±5.21 a 28.85±1.27 b 0.04±0.01 a 29.88±1.38 a S1 7.66±0.49 a 0.02±0.01 b 8.97±0.69 a 16.19±1.09 a 0.13±0.01 a 60.90±4.23 a 31.41±2.34 a 0.03±0.02 b 29.12±2.03 b E2 5.36±0.34 a 0.03±0.02 a 8.67±0.57 b 12.24±1.57 b 0.17±0.03 a 60.92±5.28 a 24.62±2.10 b 0.05±0.03 a 29.41±2.14 a S2 5.32±0.36 a 0.03±0.02 a 9.21±0.61 a 13.96±1.02 a 0.13±0.01 b 60.88±1.20 a 29.25±3.02 a 0.04±0.02 b 28.91±2.07 b 2.4 四倍体和二倍体苦荞淀粉合成酶活性
由表4可以看出,苦荞籽粒的AGPase活性随生育期的推进呈先增加后降低的趋势,其中二倍体苦荞的AGPase活性在花后10 d 达最大,四倍体苦荞的AGPase活性则在花后15 d达最大;灌浆前期(花后10 d之前)以二倍体苦荞的AGPase活性较大,灌浆中后期(15 d以后)则以四倍体苦荞的AGPase活性较大。4个苦荞材料的SSS活性在花后10 d达最大,其后快速下降;花后10 d之前以二倍体苦荞的SSS活性高于四倍体,其后则低于四倍体苦荞。苦荞籽粒的SBE活性随生育期的推进呈先增加后降低的趋势,以二倍体苦荞的SBE活性显著高于四倍体。
表 4 苦荞籽粒的淀粉合成酶活性Table 4. Starch synthase activity of Tartary buckwheat指标
Item品种
Variety时期 Period 5 d 10 d 15 d 20 d 25 d 30 d ADPG 焦磷酸化酶AGPase/(U ·g−1·min−1) E1 0.31±0.02 a 0.55±0.03 a 0.46±0.04 b 0.36±0.03 b 0.27±0.02 b 0.26±0.02 b S1 0.20±0.01 b 0.36±0.02 b 0.49±0.05 a 0.43±0.05 a 0.33±0.04 a 0.30±0.02 a E2 0.26±0.03 a 0.46±0.03 a 0.36±0.04 b 0.27±0.03 b 0.20±0.01 b 0.20±0.03 a S2 0.15±0.0.2 b 0.32±0.02 b 0.41±0.02 a 0.32±0.01 a 0.23±0.02 a 0.20±0.02 a 可溶性淀粉合酶SSS/(U ·mg−1 ·min−1) E1 6.56±0.28 a 10.03±1.07 a 4.97±0.36 b 2.47±0.17 b 2.01±0.11 b 1.03±0.09 b S1 4.92±0.39 b 8.55±0.38 b 5.98±0.32 a 3.38±0.25 a 2.98±0.23 a 1.53±0.11 a E2 3.72±0.34 a 9.28±0.59 a 4.24±0.51 b 2.16±0.19 b 1.68±0.10 b 0.97±0.01 b S2 3.41±0.16 b 7.54±0.46 b 4.74±0.40 a 2.38±0.20 a 2.00±0.25 a 1.33±0.20 a 淀粉分支酶SBE/(U ·g−1·min−1) E1 2.37±0.18 a 4.55±0.32 a 4.39±0.29 a 3.97±0.45 a 3.45±0.27 a 3.17±0.28 a S1 1.33±0.09 b 3.31±0.17 b 4.07±0.24 b 3.71±0.31 b 3.22±0.18 b 2.95±0.32 b E2 2.29±0.17 a 4.45±0.35 a 4.32±0.38 a 3.87±0.28 a 3.25±0.41 a 2.53±0.24 a S2 1.12±0.11 b 3.13±0.21 b 3.96±0.21 b 3.49±0.24 b 2.54±0.20 b 1.93±0.17 b 2.5 四倍体和二倍体苦荞的根系形态生理比较
由表5可以看出,苗期S1的根系长度、根系表面积、根系体积显著高于E1,根系平均直径、根系伤流液、根系活力及根冠比则无明显差异;S2的根系形态生理指标则均显著高于E2。开花期,四倍体苦荞的根系长度、根系表面积、根系体积、根系伤流液显著高于二倍体苦荞,根系平均直径无明显差异;根系活力以四倍体苦荞高于二倍体苦荞,其中S1和E1的差异达到显著水平。灌浆期,四倍体苦荞的根系长度显著低于二倍体苦荞,而根系表面积、根系体积、根系伤流液和根系活力则显著高于二倍体苦荞;四倍体苦荞的根系平均直径高于二倍体,其中S2和E2的差异达到显著水平。成熟期,四倍体苦荞的根系长度、根系表面积、根系体积、根系伤流液均显著高于二倍体苦荞,根系平均直径和根系活力以四倍体苦荞较高,S1的根系活力显著高于E1。
表 5 二倍体和四倍体苦荞的根系形态及生理指标比较Table 5. Root morphology and physiology of diploid and tetraploid Tartary buckwheat时期
Stage品种
Variety根系长度
Length/cm根系表面积
Surface
area/cm2根系体积
Volume/cm3根系平均直径
Average
diameter/mm根系伤流液
Root system
fluid/(g·h−1)根系活力
Root activity/
(μg·g−1·h−1)苗期 Seedling stage E1 44.91±1.49 b 5.03±0.16 b 0.10±0.01 b 0.42±0.02 a 0.044±0.003 a 21.71±1.21 a S1 55.50±1.34 a 6.46±0.21 a 0.12±0.01 a 0.43±0.0.3 a 0.041±0.002 a 21.23±1.06 a E2 43.57±1.27 b 4.31±0.20 b 0.07±0.03 b 0.37±0.02 b 0.025±0.001 b 13.91±0.98 b S2 55.08±1.12 a 6.36±0.18 a 0.13±0.04 a 0.44±0.01 a 0.033±0.003 a 17.16±1.13 a 开花期 Anthesis stage E1 168.49±9.45 b 31.06±1.34 b 1.28±0.03 b 0.53±0.06 a 0.026±0.001 b 3.31±0.11 b S1 200.85±8.69 a 35.95±1.26 a 1.50±0.04 a 0.54±0.05 a 0.035±0.002 a 6.40±0.28 a E2 156.79±9.12 b 25.48±1.33 b 0.78±0.02 b 0.51±0.02 a 0.025±0.001 b 3.92±0.32 a S2 300.07±9.34 a 55.29±1.06 a 2.53±0.16 a 0.54±0.04 a 0.052±0.002 a 3.94±0.40 a 灌浆期 Grain filling stage E1 264.61±8.37 a 31.28±1.25 b 0.96±0.01 b 0.42±0.02 a 0.004±0.002 b 4.79±0.29 b S1 220.99±8.67 b 36.72±2.26 a 1.23±0.17 a 0.44±0.03 a 0.006±0.004 a 7.90±0.47 a E2 254.45±9.61 a 23.09±1.63 b 0.58±0.03 b 0.40±0.02 b 0.010±0.001 b 7.49±0.51 b S2 186.76±6.47 b 36.50±1.71 a 1.21±0.11 a 0.44±0.04 a 0.016±0.002 a 5.35±0.20 a 成熟期 Mature stage E1 229.37±10.55 b 29.49±0.99 b 0.85±0.04 b 0.44±0.03 a 0.005±0.001 b 2.98±0.37 b S1 245.02±9.91 a 36.04±1.01 a 1.31±0.03 a 0.46±0.02 a 0.006±0.002 a 5.37±0.31 a E2 171.82±7.34 b 27.21±1.13 b 0.94±0.05 b 0.44±0.03 a 0.009±0.002 b 3.55±0.26 a S2 230.18±10.25 a 34.38±1.08 a 1.38±0.02 a 0.46±0.04 a 0.016±0.004 a 3.57±0.29 a 2.6 四倍体和二倍体苦荞的农艺性状及产量
由表6可以看出,四倍体苦荞的株高、主茎节数、主茎分枝数、1~2节节间长度、1~2节节间粗度均显著高于二倍体苦荞;四倍体苦荞和二倍体苦荞的子叶节高度无明显差异;二倍体苦荞的充实度和产量均显著高于四倍体苦荞。
表 6 二倍体和四倍体苦荞的农艺性状及产量比较Table 6. Agronomic traits and yield of Tartary buckwheat品种
Variety株高
Plant height/cm主茎节数
Number of main
stem nodes/个主茎分枝数
Main stem branch
number/个子叶节高度
Cotyledon node
height/cm1~2节节间长度
1-2 internode
length/cm1~2节节间粗度
1-2 internode
thickness/mm充实度
Plumpness/%产量
Yield/(kg·hm−2)E1 112.3±1.3 b 12.2±1.1 b 7.1±1.2 b 1.6±0.1 a 1.7±0.1 b 4.7±0.4 b 74.2±1.4 a 2452.1±102.2 a S1 125.0±1.1 a 17.6±1.1 a 9.6±1.1 a 1.8±0.2 a 3.3±0.2 a 6.3±0.5 a 27.7±0.8 b 2058.1±112.3 b E2 119.4±1.35 b 15.3±1.7 b 5.0±1.0 b 1.7±0.2 a 1.7±0.1 b 4.7±0.4 b 85.2±1.2 a 2305.8±106.3 a S2 127.0±1.0 a 18.2±1.3 a 7.7±1.3 a 1.6±0.2 a 3.0±0.2 a 6.2±0.5 a 26.2±0.7 b 1807.3±99.4 b 3. 讨论与结论
3.1 四倍体与二倍体苦荞的根系形态生理差异
根系的形态影响植物对水分和养分的吸收,进而影响植株地上部的生长、养分供应[18]、产量和品质[19]形成。潘晓华等[20]、张成良等[21]的研究发现水稻根数、根长、根系表面积、根系体积、根系活力、根系伤流量与籽粒灌浆强度、充实度、千粒重和产量呈显著或极显著的正相关关系。本试验的研究发现,四倍体苦荞的根系长度、根系表面积、根系体积、根系直径、根系活力和根系伤流量总体均明显大于二倍体苦荞,但四倍体苦荞的充实度和产量则显著低于二倍体苦荞,这与杨建昌等[22]和Samejima等[23]在水稻上的研究结果一致,可能是因为根系虽然是水分和养分的吸收器官,但同时又要为根系的建成而消耗地上部提供的光合产物以维持生长,如果根量过大反而会造成无效消耗而对产量形成产生不利的影响[24-25]。也有可能是因为四倍体苦荞相对二倍体苦荞来说,根系的干物质积累量大、根系活力高、根系代谢旺盛会形成与籽粒灌浆物质竞争的“次库”,从而影响籽粒的增重[26],导致充实度较差,产量较低。具体机制有待于进一步的研究证实。
3.2 四倍体与二倍体苦荞的灌浆特性与淀粉合成酶活性的差异
Richards方程生长曲线是由N值大小决定的一簇曲线,当0<N<1时,灌浆速率达到最大的位置(即曲线拐点)在0.367~0.500A,灌浆速率曲线左偏;当N=1时,即为Logistic方程,曲线拐点在0.500 A处;当N>1时,曲线拐点大于0.500 A,并随N的增大而逐渐接近于A,灌浆速率曲线右偏[27-28]。本试验的研究结果发现参试苦荞品种的N值均<1,表明其灌浆受库容的限制较大,即灌浆物质相对充分[12,29],表现为灌浆前期生长迅速,其后逐渐减弱。从本试验的研究结果还可以看出,四倍体苦荞的灌浆起始势(R0)均明显低于二倍体苦荞品种,这可能与四倍体苦荞相对于二倍体苦荞而言,籽粒具有较大的库容(即籽粒大小),灌浆初期生长速率较慢,胚乳细胞分裂周期较长,分裂速度较慢有关[12]。四倍体苦荞的R0较低,暗示着籽粒灌浆启动较晚,得到的光合产物不足,导致开花后仍需较长的时间才能达到最大灌浆速率,充实较差。结合四倍体苦荞具有较低的最大灌浆速率和平均灌浆速率,以及具有较高的达最大灌浆速率天数的研究结果,认为这些可能是导致四倍体苦荞充实较差的主要生理原因。
苦荞籽粒中的淀粉含量在75%左右[30],因此,苦荞籽粒的充实过程,其实就是淀粉的累积过程。源器官的光合同化物以蔗糖的形式经韧皮部运输到籽粒,之后在一系列酶的作用下形成淀粉[31-32]。焦磷酸化酶(ADPG)、可溶性淀粉合酶(SSS)、淀粉分支酶(SBE)等是淀粉合成代谢过程中的关键酶,这些酶对籽粒淀粉的合成、积累起着重要的调节作用。从本试验的研究结果可以看出,灌浆前期二倍体苦荞的AGPase和SSS活性高于四倍体苦荞,灌浆中后期则低于四倍体苦荞,这可能与四倍体苦荞灌浆前期光合同化物从“源”输送到“库”的转运能力弱于二倍体苦荞有关,致使四倍体苦荞灌浆前期籽粒的生理活性较低,蔗糖降解的速度慢,导致籽粒淀粉合成慢、累积少,最后籽粒充实不良[33]。结合四倍体苦荞具有较低灌浆速率的研究结果,认为四倍体苦荞在灌浆前期具有较低的淀粉合成酶活性是其灌浆速率小、粒重轻的一个重要原因[34]。
综上,较低的灌浆起始势、灌浆速率,以及灌浆前期较低的淀粉合成酶活性是四倍体苦荞充实较差的重要生理原因。
-
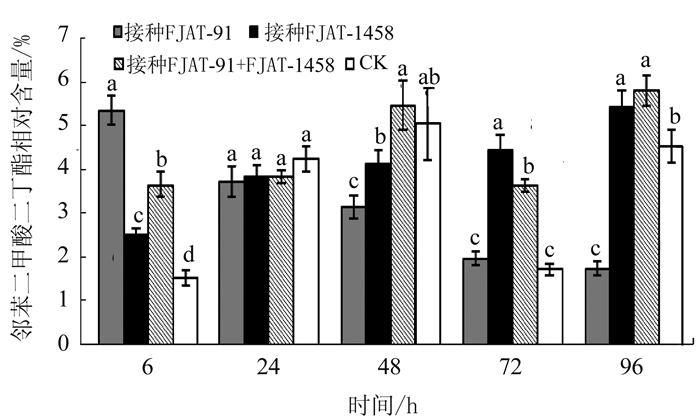
图 1 邻苯二甲酸二丁酯在不同处理不同时间番茄中的相对含量
注:图中数据为平均数±标准差,不同字母表示同一时间不同处理之间差异达显著水平(P<0.05),图 2同。
Figure 1. Dibutyl phthalate in tomato plants induced by treatments with varied durations
表 1 不同接种处理下番茄代谢产物的种类和数量
Table 1 Types and numbers of detected compounds under different treatments
处理 化合物类型 化合物种类数目/种 6 h 24 h 48 h 72 h 96 h 只接种FJAT-91 醇类 ND 2 1 3 2 酯类 1 1 3 1 1 酸类 2 2 3 ND ND 醛类 ND ND ND ND ND 哌啶类 ND ND ND 1 1 烷烃类 2 2 1 1 2 只接种FJAT-1458 醇类 1 2 ND 1 2 酯类 1 4 3 2 1 酸类 1 2 7 1 2 醛类 ND ND 1 1 1 哌啶类 ND ND 1 1 1 烷烃类 3 2 1 1 3 同时接种FJAT-91和FJAT-1458 醇类 2 1 ND 4 2 酯类 1 4 2 3 5 酸类 1 2 3 2 2 醛类 ND 1 1 1 1 哌啶类 1 ND 1 ND 2 烷烃类 2 2 3 1 3 清水对照 醇类 1 ND ND 2 1 酯类 1 1 2 4 1 酸类 1 1 2 2 1 醛类 ND ND 2 1 1 哌啶类 ND ND 1 1 1 烷烃类 2 2 2 1 3 注:ND表示未检测到该类化合物。 -
[1] ALLEN C, PRIOR P, HAYWARD A C. Bacterial wilt disease and the Ralstonia solanacearum species complex[M]. Saint Paul:American Phytopathological Society (APS Press), 2005.
[2] VAMITHA S C, NIRANJANA S R, UMESHA S. Role of phenylalanine ammonia lyase and polyphenol oxidase in host resistance to bacterial wilt of tomato[J]. Journal of Phytopathology, 2009, 157(9):552-557. DOI: 10.1111/jph.2009.157.issue-9
[3] JACOBS M J, BABUJEE L, MENG F, et al. The In Planta transcriptome of Ralstonia solanacearum:conserved physiological and virulence strategies during bacterial wilt of tomato[J]. American Society for Microbiology, 2012, 3(4):1-11. http://www.ncbi.nlm.nih.gov/pubmed/22807564
[4] 郑雪芳, 刘波, 林乃铨, 等.青枯雷尔氏菌无致病力突变菌株的构建及其防效评价模型分析[J].植物病理学报, 2013, 43(5):518-531. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWBL201305010.htm [5] 许国旺, 杨军.代谢组学及其研究进展[J].色谱, 2003, 21(4):316-320. http://youxian.cnki.com.cn/yxdetail.aspx?filename=ZYHS201710009&dbname=CJFDPREP [6] 刘峥颢, 赵志磊, 夏立娅.市场中食品添加剂明胶及添加明胶的食品中铬含量本底调查[J].食品科技, 2010, 35(2):224-227. http://www.cnki.com.cn/Article/CJFDTOTAL-SSPJ201002063.htm [7] FIEHN O. Metabolic networks of Cucurbita maxima phloem[J]. Phytochemistry, 2002, 62(6):875-886. http://www.ncbi.nlm.nih.gov/pubmed/12590115
[8] 周宝利, 尹玉玲, 李云鹏.嫁接茄根系分泌物与抗黄萎病的关系及组分分析[J].生态学报, 2010, 30(11):3073-3079. http://www.cnki.com.cn/Article/CJFDTOTAL-STXB201011032.htm [9] DETTMER K, ARONOV P A, HAMMOCK B D. Mass spectrometry-based metabolomics[J]. Mass Spectrometry Reviews, 2007, 26(1):51-78. DOI: 10.1002/(ISSN)1098-2787
[10] DUNN W B, ELLIS D I. Metabolomics:current analytical platforms and methodologies[J]. TrACL:Trends Analytical Chemistry, 2005, 24(4):285-294. DOI: 10.1016/j.trac.2004.11.021
[11] GLINSKI M, WECKWERTH W. The role of mass spectrometry in plant systems biology[J]. Mass Spectrometry Reviews, 2006, 25(2):173-214. DOI: 10.1002/(ISSN)1098-2787
[12] JAN L, NICOLAS S, JOACHIM K, et al. Gas chro-matogramphy mass spectrometry-based metabolite profiling in plants[J]. Nature Protocols, 2006, 1(1):387-396. DOI: 10.1038/nprot.2006.59
[13] MAJOR H J, WILLIAMS R, WILSON A J, et al. A meta-bonomic analysis of plasma from Zucker rat strains using gas chromatography/mass spectrometry and pattern recognition[J]. Mass Spectrometry, 2006, 20(22):3295-3302. http://www.ncbi.nlm.nih.gov/pubmed/17044115
[14] ERIKSSONN L, ANTTI H, GOTTFRIES J, et al. Using chemometrics for navigating in the large data sets of genomics, proteomics, and metabonomics (gpm)[J]. Analytical and Bioanalytical chemistry, 2004, 380(3):419-429. DOI: 10.1007/s00216-004-2783-y
[15] 尹玉玲, 刘圆, 汤泳萍, 等.豆蔻酸和棕榈酸诱导茄子根系拮抗菌与黄萎菌数量消长的关系[J].生态学报, 2015, 35(20):6728-6733. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=stxb201520018&dbname=CJFD&dbcode=CJFQ [16] 张恩平, 衣宁宁, 李亮亮.番茄自毒物质对土壤养分的影响[J].西北农业学报, 2010, 23(3):820-823. http://www.cnki.com.cn/Article/CJFDTOTAL-XNYX201003046.htm [17] BAILEY N J, OVEN M, HOLMES E, et al. Metabolomic analysis of the consequences of cadmium exposure in Silene cucubalus cell cultures via 1H NMR spectroscopy and chemometrics[J]. Phytochemistry, 2003, 62(6):851-858. DOI: 10.1016/S0031-9422(02)00719-7
[18] PSIHOGIOS N G, KALAITZIDIS R G, DIMOU S, et al. Evaluation of tubulointerstitial lesions' severity in patients with glomerulonephritides:an NMR-based metabonomic study[J]. Journal of Proteome Research, 2007, 6(9):3760-3770. DOI: 10.1021/pr070172w
[19] WECKWERTH W, FIEHN O. Can we discover novel pathways using metabolomic analysis[J]. Current Opinion in Biotechnology, 2002, 13(2):156-160. DOI: 10.1016/S0958-1669(02)00299-9
[20] 段礼新, 漆小泉.基于GC-MS的植物代谢组学研究[J].生命科学, 2015, 27(8):971-977. http://www.cnki.com.cn/Article/CJFDTOTAL-SMKX201508002.htm -
期刊类型引用(2)
1. 廉立坤,张培,吴晓芬,陈庆富,张以忠. 二倍体及其同源四倍体苦荞种子表型与发芽特性研究. 贵州农业科学. 2024(11): 1-7 .  百度学术
百度学术
2. 张余,郭溶誉,李振东,张新月,王晓静,黄小燕,黄凯丰. 外源2, 4-表油菜素内酯对苦荞灌浆及产量形成的影响. 应用与环境生物学报. 2022(06): 1437-1443 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: