Optimization of Flavonoids Extraction from Leaves of Helianthus tuberosus L. by Response Surface Methodology and Determination of Antimicrobial Activity of Resulting Extract
-
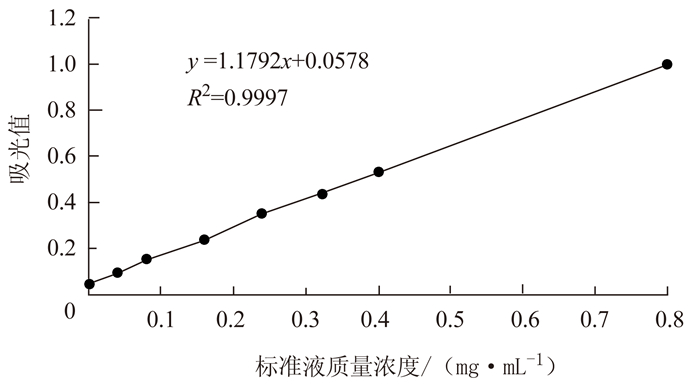
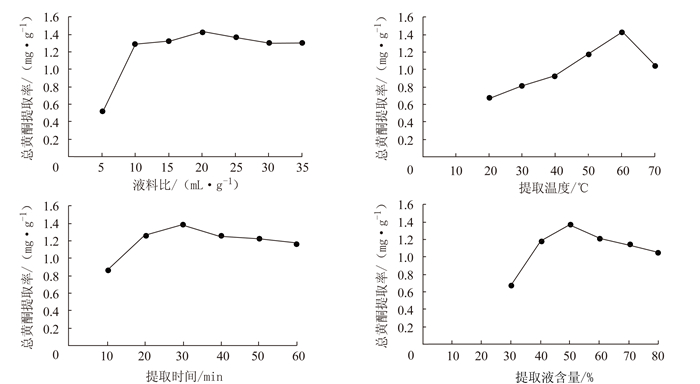
摘要: 探索组培菊芋叶中总黄酮超声辅助提取最佳工艺条件,并对其抑菌活性进行评价。在单因素试验基础上,以总黄酮提取率为指标,应用响应面法优化其超声提取条件;并考察其总黄酮的抗菌活性。结果表明,响应面优化组培菊芋叶总黄酮提取的最佳工艺参数为:液料比1:40,提取时间20 min,乙醇含量(体积分数)40%,提取温度64℃,测得总黄酮提取率为1.47 mg·g-1。组培菊芋叶总黄酮对大肠杆菌的抑制效果良好,但对金黄色葡萄球菌和枯草芽孢杆菌的抑制效果不明显。结论:利用响应面法分析得到了组培菊芋叶总黄酮超声提取的最佳工艺条件,提取的总黄酮对大肠杆菌具有良好的抑菌活性,可为进一步研究开发组培菊芋奠定实验基础。Abstract: The ultrasound-assisted extraction of flavonoids from leaves of Helianthus tuberosus L. was optimized. The extract obtained was evaluated for its antimicrobial activity.Based on the results from single-factor tests, the extraction conditions were further optimized using the response surface methodology. It was found that when 40% ethanol was applied as the solvent in a substrate:solvent ratio of 1:40 to extract the leaves for 20 min at 64℃, the yield and efficiency of the process could be maximized to reach a flavonoid extraction rate of 1.47 mg·g-1. The flavonoids obtained showed an excellent antibacterial activity on Escherichiacoli, but not on Staphylococcus aureus or Bacillus subtilis.
-
红花夹竹桃(Nerium indicum Mill)为夹竹桃科夹竹桃属多年生植物,花色鲜红,枝叶繁茂,在南方作为一种常见的绿化观赏植物进行种植和栽培。夹竹桃枝、叶和根中含有黄酮、甾体、生物碱、强心苷等多种化合物,近代临床用于心力衰竭、喘息咳嗽、癫痫等疾病的治疗。文静等[1]采用色谱技术对夹竹桃叶的化学成分进行研究,从中分离鉴定出5种化合物;方访等[2]采用柱层析法和气相色谱/质谱(GC-MS)技术从夹竹桃中分离鉴定出107种化合物。植物体内的次生代谢产物与植物的药用活性有着密切的联系。随着绿色农药理念的提出,具有高效、低毒、容易降解等优点的植物源农药成为现代抑菌农药研究和开发的热点[3]。夹竹桃属植物分布范围广,枝条生长速度快,材料来源丰富,其独特的毒理活性也越来越引起人们的关注。关于夹竹桃的抑菌和抗虫活性已开展了较多研究。翟兴礼等[4]发现夹竹桃叶的水提取物对枯草芽孢杆菌和巨大芽孢杆菌的生长具有一定的抑制作用;郭春雨[5]研究了夹竹桃叶中的甾体类化合物,并进行了细胞毒性的测定;郑许松等[6]对夹竹桃叶乙醇提取物进行了抗虫活性试验,发现夹竹桃叶乙醇提取物对茭白二化螟幼虫有较强的拒食作用和生长发育抑制作用。目前,对夹竹桃的研究主要集中于粗提物的抗虫、抑菌和抗肿瘤研究[7],对植物病原真菌的抑制作用研究相对较少[8-9]。为研究红花夹竹桃对植物病原真菌的抑菌活性,本试验通过制备红花夹竹桃不同萃取物,研究各萃取物的不同浓度抑菌培养基对5种植物病原真菌的抑菌活性,为红花夹竹桃的进一步开发和利用提供依据。
1. 材料与方法
1.1 试验材料
1.1.1 红花夹竹桃材料
红花夹竹桃采自西南林业大学,树龄约为11年,选取生长状况良好的夹竹桃枝条(直径1.0~2.0 cm),用枝剪将枝叶剪下来后带回实验室备用。
1.1.2 供试病源菌株
供试菌株为小麦雪腐病菌Gerlachia nivalis W. Games es E.、小麦全蚀病菌Gaeumannomyces graminis Var. tritici、梨黑星病菌Venturia nashicola Tanaka et Yamamoto、辣椒炭疽病菌Colletotrichum capsici (Syd.) Butl & Bisby、稻瘟病菌Magnaporthe oryzae,来源于西南林业大学生命科学学院生物化学教研室,菌种保存于4℃冰箱,活化后备用。
1.1.3 抑菌物质的萃取
夹竹桃枝叶砍成小段(长1~2 cm)后用3倍体积的80%乙醇水溶液浸提3次,每次4 d。合并提取液,减压蒸馏得到红花夹竹桃粗提物浸膏,用2倍质量的蒸馏水溶解后,分别用3倍体积的石油醚、乙酸乙酯、正丁醇对粗提物分别萃取3次,萃取后的有机试剂合并后经减压蒸馏浓缩后备用。
1.2 试验方法
1.2.1 萃取物抑菌母液的配制
试验采用不同浓度的抑菌培养基对5种病原菌进行抑菌活性研究,抑菌培养基的质量浓度分别为0.5、1.5、2.5、5.0、10.0 mg·mL-1。按照总体积100 mL的抑菌培养基计算,分别称取不同用量夹竹桃萃取物于小三角瓶中,10 mL 80%的乙醇水溶液分溶解,溶解后的萃取物抑菌溶液放入无菌台中,紫外灯灭菌30 min后作为抑菌母液备用。
1.2.2 抑菌培养基的制备
灭菌后的普通PDA培养基在无菌台中冷却至50℃左右,迅速添加灭菌后的夹竹桃萃取物抑菌母液,充分混匀后配制成不同浓度的抑菌培养基,对照培养基加入相同体积的80%乙醇水溶液,保证培养基最后总体积为100 mL。把含有不同浓度萃取物的抑菌培养基均匀倒入玻璃培养皿中(直径为9 cm),每皿20 mL培养基,冷却后备用。
1.2.3 抑菌试验
采用生长速率法[10]测定不同浓度抑菌培养基对病原菌菌丝体生长的抑制作用。用灭菌后的打孔器将供试菌种制成“菌碟”(直径0.5 cm)后接种到抑菌培养基质的中央,每个浓度设置3个重复。同时,以未添加抑菌物质的培养基为对照进行接种。接种后的培养皿置于25℃的恒温培养箱中培养,观察5种病原真菌在不同培养基上的萌发情况及菌丝体生长情况。采用十字交叉法[11-12]每隔2 d测量菌丝体的生长速率,待对照菌丝体长满培养皿边缘,结束测量试验。
抑菌率X/%=[(D1-D2)/D1]×100%
式中,D1为对照组菌落直径,D2为处理组菌落直径(单位cm)。
1.2.4 半抑制率(EC50)和毒力回归方程的计算
采用SPSS 19软件开展毒力回归方程的模拟和EC50的计算。抑菌率、浓度、总数为变量,以软件“回归”分析中的“Probit”模型进行“10”为对数底的“logit”模型转换,计算出不同抑菌物质的EC50值;参数估计值中的“PROBIT模型”即为不同抑菌物质的毒力回归方程,采用卡方(χ2)对回归方程的拟合度进行检验。
1.3 数据处理
采用SPSS 19软件进行统计分析,用Duncan方法对数据进行显著性比较。
2. 结果与分析
2.1 不同萃取物对供试病源菌株的抑菌效果
由表 1可知,随着萃取物质量浓度的增加,红花夹竹桃萃取物对5种病源真菌的抑菌效果均显著增强,且不同浓度间抑制效果差异显著。
表 1 不同萃取物对5种病原菌的抑制效果Table 1. Inhibitory effects of 3 extracts on 5 fungi萃取物 质量浓度/(mg·mL-1) 小麦雪腐病菌 小麦全蚀病菌 梨黑星病菌 辣椒炭疽病菌 稻瘟病菌 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 菌落直径/cm 抑菌率/% 石油醚 0.0 8.60±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 0.5 8.60±0.00Aa 0.00±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60 ±0.00Ba 0.00 ±0.00Aa 1.5 7.25±0.13Bb 15.67 ±1.53Bb 7.97 ±0.06Bb 7.37 ±0.64Bb 7.88 ±0.10Bb 8.33 ±1.19Ab 8.22 ±0.10Bb 4.83 ±1.19Ab 8.25 ±0.05Bb 4.10 ±0.6Ab 2.5 5.25 ±0.05Bc 38.80 ±0.61Bc 6.93 ±0.10Bc 19.27 ±1.17Bc 7.03 ±0.06Bc 18.20 ±0.69Bc 7.30 ±0.10Bc 15.17 ±1.2Bc 7.87 ±0.06Bc 8.50 ±0.69Bc 5.0 3.27 ±0.06Bd 62.00 ±0.69Bd 5.0 ±0.09Ad 42.43 ±0.98Bd 5.15 ±0.15Bd 40.13 ±1.75Bd 5.17 ±0.06Bd 39.90±0.69Bd 5.68 ±0.08Bd 33.90 ±0.92Bd 10.0 1.97 ±0.08Be 77.13 ±0.86Be 4.29 ±0.01Be 50.07 ±0.12Be 3.23 ±0.08Be 62.40 ±0.92Be 3.93 ±0.08Be 54.27 ±0.86Be 4.30 ±0.11Be 50.27 ±1.25Be 乙酸乙酯 0.0 8.60±0.00Aa 0.00±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.0 ±0.00Aa 8.60 ±0.00Aa 0.00 ±0.00Aa 0.00 ±0.00Aa 0.00 ±0.00Aa 0.5 6.83 ±0.06Bb 20.53 ±0.64Bb 7.97 ±0.15Ab 7.37 ±1.78Bb 8.00 ±0.30Ab 7.00 ±3.50Bb 7.72 ±0.10Ab 10.27 ±1.19Bb 7.67 ±0.15Ab 10.87 ±1.78Bb 1.5 4.90 ±0.10Ac 43.47 ±1.36Cc 7.00 ±0.26Ac 18.60 ±3.08Cc 7.17 ±0.15Ac 16.67 ±1.78Bc 7.17 ±0.06Ac 16.67 ±0.64Bc 6.98 ±0.28Ac 18.77 ±3.19Bc 2.5 3.87 ±0.0A6d 55.07 ±0.64Cd 6.52 ±0.10Ad 24.23 ±1.21Cd 6.50 ±0.17Ad 24.43 ±2.02Cd 6.60 ±0.10Ad 23.27 ±1.15Cd 6.40 ±0.20Ad 25.60 ±2.30Cd 5.0 2.81 ±0.04Ae 67.73 ±0.85Ce 4.92 ±0.08Ae 42.83 ±0.86Be 4.33 ±0.15Ae 49.63 ±1.78Ce 4.63 ±0.21Ae 46.10 ±2.40Ce 4.17 ±0.25Ae 51.57 ±1.33Ce 10.0 1.28 ±0.08Af 85.07 ±0.86Cf 3.07 ±0.15Af 64.37 ±1.78Cf 2.75 ±0.15Af 68.03 ±1.75Cf 2.53 ±0.15Af 70.53 ±1.78Cf 2.77 ±0.12Af 67.83 ±2.90Cf 正丁醇 0.0 8.60± 0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 0.5 8.60 ±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 8.60±0.00Aa 0.00 ±0.00Aa 1.5 8.37 ±0.15Cb 2.73 ±1.79Ab 8.33 ±0.06Cb 3.10 ±0.69Ab 7.90 ±0.10Bb 8.13 ±1.15Ab 8.07 ±0.12Bb 6.23 ±1.33Ab 8.10 ±0.10Bb 5.83 ±1.15Ab 2.5 7.43 ±0.16Cc 13.57 ±1.79Ac 7.97 ±0.06Cc 7.37 ±0.64Ac 7.60 ±0.10Cc 11.63 ±1.15Ac 7.77 ±0.06Cc 9.70 ±0.69Ac 7.55 ±0.05Cc 12.20 ±0.60Ac 5.0 5.27 ±0.06Cd 38.77 ±0.64Ad 6.57 ±0.06Bd 23.67 ±0.64Ad 6.48 ±0.13Cd 24.63 ±1.46Ad 7.07 ±0.12Cd 17.83 ±1.33Ad 6.80 ±0.10Cd 20.93 ±1.15Ad 10.0 2.35 ±0.09Ce 74.30 ±1.04Ae 4.73 ±0.15Ce 44.93 ±1.78Ae 4.10 ±0.10Ce 52.33 ±1.15Ae 4.37 ±0.21Ce 49.23 ±2.44Ae 4.50 ±0.20Be 47.67 ±2.35Ae 注:表中不同大写字母表示同一质量浓度不同萃取物的抑菌率在0.05水平上差异显著,不同小写字母表示同一种萃取物不同质量浓度的抑菌率在0.05水平上差异显著。 不同萃取物之间比较发现,低质量浓度时(0.5 mg·mL-1),石油醚和正丁醇萃取物对供试病原菌均没有表现出明显的抑菌活性,抑制率均为0,而乙酸乙酯萃取物对5种病原菌抑菌效果显著,且对小麦雪腐病原菌抑制率最强达到了20.53%。随着萃取物质量浓度的升高,石油醚和乙酸乙酯萃取物对5种病原菌的抑制作用迅速增加,2.5 mg·mL-1和5.0 mg·mL-1的石油醚、乙酸乙酯萃取物的抑制作用显著高于正丁醇萃取物;高质量浓度(10.0 mg·mL-1)时,3种萃取物对5种病原菌的抑制率均大于40%,其中乙酸乙酯萃取物对5种植物病原菌的抑制作用最强,最高达85.07%,显著高于其他2种萃取物。综合比较可知,红花夹竹桃的乙酸乙酯萃取物对供试病原菌的抑菌活性显著高于其余2种萃取物,石油醚萃取物次之,正丁醇萃取物的抑制率相对较弱,除了对小麦雪腐和梨黑星病原菌的抑菌率分别达到74.3%和52.33%外,对其余3种植物病原菌的抑菌效果均小于50%。
3种萃取物对不同植物病原菌的抑制效果比较发现,石油醚萃取物对小麦雪腐病原菌的抑制效果最明显,质量浓度为10 mg·mL-1时的菌丝生长仅1.97 cm,抑制率最高达77.13%(图 1-A);对梨黑星和辣椒炭疽病原菌的抑制效果次之,抑制率分别为62.4%和54.27%;对稻瘟和小麦全蚀病原菌的抑制效果均较弱,抑制率分别为50.27%和50.07%。正丁醇萃取物对小麦雪腐病原菌的抑制效果最明显,质量浓度为10 mg·mL-1时菌丝生长仅2.35 cm,抑制率最高达74.3%(图 1-B);对梨黑星病原菌的抑制率次之,抑制率为52.33%;对稻瘟和小麦全蚀病原菌的抑制效果均小于50%。乙酸乙酯萃取物对5种病原菌的抑制情况均较好,浓度为10.0 mg·mL-1时对供试的病原菌抑制率都大于60%,其中对小麦雪腐病原菌的抑制效果最强,菌丝生长仅1.28 cm,抑制率达85.7%(图 1-C);对辣椒炭疽病原菌的抑制率次之,抑制率为70.53%;对小麦全蚀病原菌的抑制效果最弱,抑制率为64.37%。
2.2 不同萃取物对供试病原真菌抑制率的毒力回归方程
通过SPSS 19软件对不同浓度的抑制率进行毒力回归方程的模拟[13],采用卡方检验(χ2)验证回归方程的拟合度(表 2)。
表 2 不同萃取物对5种病原菌的毒力回归方程分析Table 2. Toxicity regression equations of 5 fungi affected by 3 extracts萃取物 供试菌株 毒力回归方程 χ2 χ0.052 dfa P 石油醚 小麦雪腐病菌 y=2.262x-1.360 6.417 7.815 3 0.093 小麦全蚀病菌 y=1.948x-1.720 4.729 7.815 3 0.193 梨黑星病菌 y=2.037x-1.757 1.856 7.815 3 0.603 辣椒炭疽病菌 y=2.064x-1.894 4.732 7.815 3 0.193 稻瘟菌病菌 y=2.129x-2.088 3.817 7.815 3 0.282 乙酸乙酯 小麦雪腐病菌 y=3.031x-2.380 0.429 7.815 3 0.934 小麦全蚀病菌 y=2.207x-2.029 0.314 7.815 3 0.957 梨黑星病菌 y=1.949x-1.939 2.689 7.815 3 0.441 辣椒炭疽病菌 y=1.999x-2.111 4.167 7.815 3 0.244 稻瘟菌病菌 y=1.910x-2.010 2.033 7.815 3 0.566 正丁醇 小麦雪腐病菌 y=1.411x-0.438 0.8 7.815 3 0.85 小麦全蚀病菌 y=1.554x-1.172 4.071 7.815 3 0.252 梨黑星病菌 y=1.828x-1.231 6.676 7.815 3 0.083 辣椒炭疽病菌 y=1.399x-1.101 5.634 7.815 3 0.131 稻瘟菌病菌 y=1.694x-1.149 5.079 7.815 3 0.166 注:表中“χ2”为卡方值,“χ0.052”为临界值,(dfa)为自由度,“P”为5%显著性差异。 由上述毒力回归方程表格可知,χ2测定值均小于检验的临界值7.815(χ0.052)(自由度为3时),且P值都大于0.05,表明实际测定结果与理论测定结果差异不显著,卡方(χ2)检验结果说明毒力回归方程拟合度良好。
2.3 不同萃取物对供试病原菌的半抑制率(EC50)
夹竹桃不同萃取物对5种病原真菌半抑制率(EC50)结果如图 2所示。EC50反映了药物对供试病原菌的抑制能力,EC50值越低,抑菌培养基的抑菌活性越好。结果显示,夹竹桃3种有机溶剂萃取物对5种病原真菌都有抑菌活性,并且呈现了不同的半抑制率(EC50),乙酸乙酯萃取物对小麦雪腐病原菌的EC50值最小,仅为2.03 mg·mL-1,显著低于对其他4种病原真菌的EC50值。石油醚萃取物对小麦雪腐病菌的抑制作用最强,其次是梨黑心病原菌,对小麦全蚀病和辣椒炭疽病的抑制效果较差,对稻瘟病的抑制效果最弱,差异显著。正丁醇萃取物对稻瘟病原菌的EC50值最大,为11.12 mg·mL-1,显著高于对小麦雪腐病原菌和梨黑心病原菌的EC50。乙酸乙酯萃取物对5种植物病原真菌菌丝生长的抑制效果均较好,特别是对小麦雪腐病原真菌的抑制效果最为明显;石油醚萃取物对5种病原真菌的抑制效果次之;正丁醇萃取物对5种病原真菌的抑制效果最差,尤其对稻瘟病原真菌。与上述抑制率分析结果相对应。
3. 讨论与结论
夹竹桃的总提取物对不同细菌和真菌的抑菌研究[1, 14-16]表明,夹竹桃总提取物对不同的细菌和真菌都有一定的抑制活性。本研究利用极性不同的有机溶剂对红花夹竹桃的总提取物进行萃取,石油醚为非极性溶剂,萃取物中的主要成分为色素、挥发油、甾醇等弱极性化合物;乙酸乙酯为中等极性溶剂,萃取物中主要成分为黄酮、小极性的甙类等化合物;正丁醇极性较大,萃取物中主要化合物为皂甙、蒽酮甙、糖甙等大极性的化合物。本研究表明乙酸乙酯萃取物对5种供试病原菌的最小抑菌浓度(MIC)为0.5 mg·mL-1,石油醚和正丁醇的萃取物对供试菌株的最小抑菌浓度(MIC)为1.5 mg·mL-1,乙酸乙酯萃取物在较小浓度时对供试病原菌就表现出了一定的抑制作用,抑菌效果较为明显。5种病原真菌半抑制率(EC50)的计算结果也显示乙酸乙酯萃取物对5种供试的植物病原真菌的EC50值均较小,进一步说明该萃取物中的化合物对供试病原菌菌丝体生长的抑制效果较好,抑制率比其他两种萃取物更高。其原因可能是3种萃取物中化合物的种类和含量的不同对供试病原菌的菌丝体生长产生了不同的抑制效果;此外,活性化合物对病原菌的作用机理的不同也可能是造成抑菌率差异的原因。本研究说明利用乙酸乙酯作为萃取剂开展红花夹竹桃的病原菌抑菌活性筛选效果更好,特别是后期开展夹竹桃抑菌活性化合物的活性追踪时,可以选择乙酸乙酯对夹竹桃的提取物进行萃取。此外,3种夹竹桃萃取物对小麦雪腐病原真菌均表现出了更明显的抑菌活性,说明夹竹桃中的多种化合物能够对小麦雪腐病原真菌菌丝体生长形成抑制作用,可用于小麦雪腐病原真菌的生物防治。其具体作用原理还需对夹竹桃萃取物进行单体化合物的分离和结构鉴定,确定抑菌活性是单一化合物的作用还是由多个化合物对病原菌协同作用产生的抑制效果,从而明确其抑制机理。
-
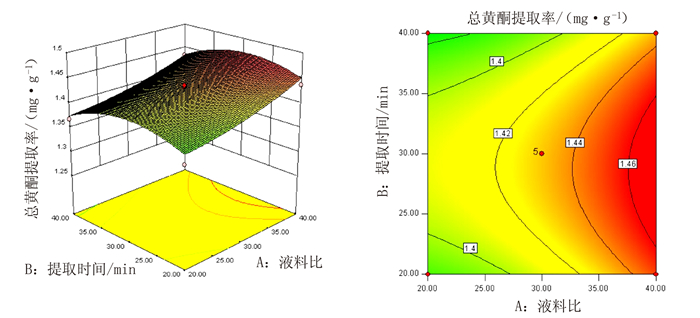
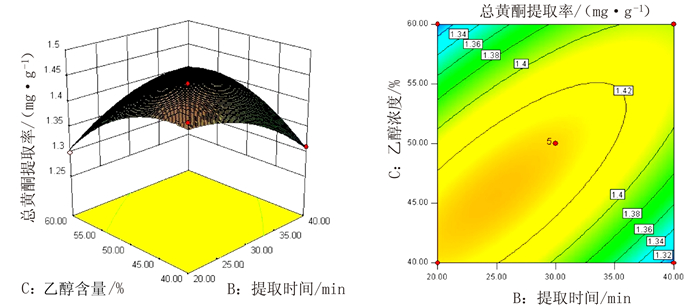
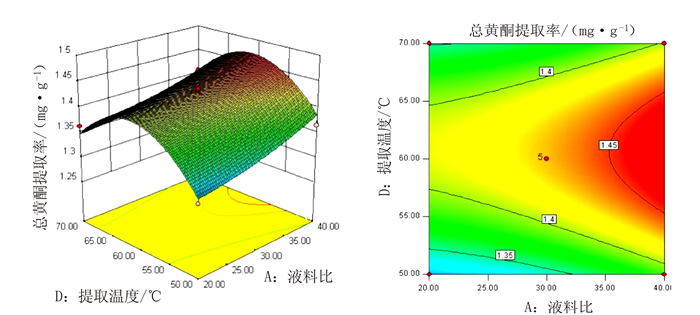
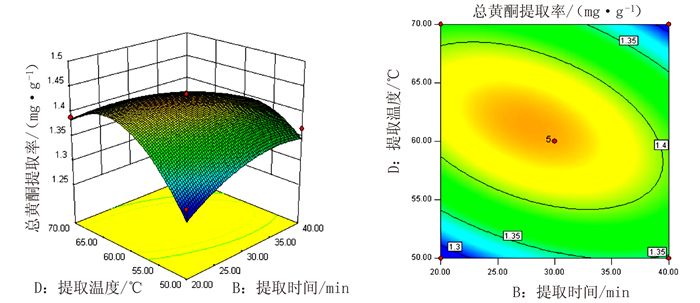
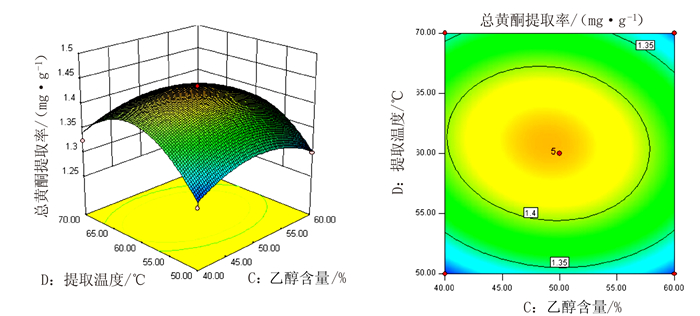
表 1 响应面分析的因素及水平
Table 1 Factors and levels of response surface analysis
水平 A液料比/
(mL·g-1)B提取时间
/minC提取液含量
/%D提取温度
/℃-1 20 20 40 50 0 30 30 50 60 1 40 40 60 70 表 2 响应面试验结果
Table 2 Experimental results of response surface analysis
试验号 A
液料比/
(mL·g-1)B
提取时间
/ minC
提取液含量
/%D
提取温度
/℃R
总黄酮提
取率/%1 30 40 40 60 1.31 2 30 30 40 50 1.29 3 30 30 50 60 1.43 4 40 40 50 60 1.43 5 40 30 50 70 1.41 6 20 30 50 70 1.36 7 20 40 50 60 1.37 8 40 30 50 50 1.37 9 30 30 40 70 1.32 10 30 40 50 50 1.37 11 20 30 50 50 1.31 12 30 20 60 60 1.30 13 20 20 50 60 1.37 14 40 30 60 60 1.43 15 30 30 50 60 1.44 16 30 20 50 70 1.39 17 30 30 50 60 1.44 18 20 30 60 60 1.39 19 30 30 60 50 1.30 20 30 20 50 50 1.30 21 30 30 50 60 1.43 22 30 40 60 60 1.38 23 30 30 50 60 1.42 24 20 30 40 60 1.37 25 30 40 50 70 1.29 26 30 20 40 60 1.44 27 40 30 40 60 1.46 28 40 20 50 60 1.44 29 30 30 60 70 1.30 表 3 响应面试验方差分析
Table 3 Variance analysis of response surface test
方差来源 平方和 自由度 均方 F值 P值 模型 0.085 14 6.04×10-3 19.49 <0.0001 A(液料比) 0.011 1 0.011 36.74 <0.0001 B(提取时间) 5.74×10-4 1 5.74×10-4 1.85 0.195 C(乙醇含量) 6.28×10-4 1 6.28×10-4 2.03 0.1765 D(提取温度) 1.75×10-3 1 1.75×10-3 5.65 0.0322 AB 9.92×10-6 1 9.92×10-6 0.032 0.8605 AC 7.78×10-4 1 7.78×10-4 2.51 0.1353 AD 5.55×10-5 1 5.55×10-5 0.18 0.6786 BC 0.012 1 0.012 37.99 <0.0001 BD 6.80×10-3 1 6.80×10-3 21.94 0.0004 CD 3.46×10-4 1 3.46×10-4 1.12 0.3086 A2 5.88×10-4 1 5.88×10-4 1.9 0.1898 B2 5.61×10-3 1 5.61×10-3 18.09 0.0008 C2 0.011 1 0.011 34.63 <0.0001 D2 0.039 1 0.039 125.49 <0.0001 残差 4.34×10-3 14 3.10×10-4 - - 失拟项 4.05×10-3 10 4.05×10-4 5.55 0.0564 纯误差 2.91×10-4 4 7.29×10-5 - - 总和 0.089 28 - - - 表 4 总黄酮对菌种的抑菌圈直径
Table 4 Diameters of inhibition zones on bacteria by flavonoid extract, mm
(单位/mm) 大肠杆菌 金黄色葡萄球菌 枯草芽孢杆菌 空白 菊芋总黄酮 18.48±0.69 8.34±0.29 8.53±0.34 - 18.21±0.90 8.53±0.35 8.56±0.34 18.05±0.88 8.57±0.27 8.43±0.23 阳性对照 19.00±0.22 18.18±0.28 17.00±0.25 - 18.76±0.31 18.07±0.25 16.94±0.25 18.81±0.45 18.11±0.16 16.98±0.22 表 5 总黄酮对大肠杆菌的最低抑菌质量浓度(MIC)
Table 5 Minimal inhibitory concentration (MIC) of flavonoid extract against E.coli
抑菌液质量浓度
/(mg·mL-1)大肠杆菌 40 无长菌 20 无长菌 10 长菌 5 大量长菌 2.5 大量长菌 阳性对照 大量长菌 阴性对照 无长菌 -
[1] 中国植物志编辑委员会.中国植物志[M].北京:科学出版社, 1980:359. [2] 刘海伟, 刘兆普, 刘玲, 等.菊芋叶片提取物抑菌活性与化学成分的研究[J].天然产物研究与开发, 2007, 19(3):405-409. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW200703010.htm [3] 张海娟, 刘玲, 郑晓涛, 等.菊芋叶片绿原酸的提取工艺条件优化研究[J].食品工业科技, 2011, 32(5):261-262, 265. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ201105058.htm [4] JAISWAL RAKESH, DESHPANDE SAGAR, KUHNERT NIKOLAI. Profiling the chlorogenic acids of Rudbeckia hirta, Helianthus tuberosus, Carlina acaulis and Symphyotrichum novae-angliae leaves by LC-MS(n).[J]. Phytochemical Analysis, 2011, 22(5):432-441. DOI: 10.1002/pca.v22.5
[5] 延玺, 刘会青, 邹永青, 等.黄酮类化合物生理活性及合成研究进展[J].有机化学, 2008, 28(9):1534. http://www.cnki.com.cn/Article/CJFDTOTAL-YJHU200809006.htm [6] NASIR TAJUDDEEN, MUHAMMAD SANI SALLAU, ALIYU MUHAMMAD MUSA, et al. Flavonoids with antimicrobial activity from the stem bark of Commiphora pedunculata (Kotschy & amp; Peyr.) Engl.[J].Natural Product Research, 2014, 28(21):1915. DOI: 10.1080/14786419.2014.947488
[7] ZOU Z X, XU P S, WU C R, et al. Carboxymethyl flavonoids and a chromone with antimicrobial activity from Selaginella moellendorffii Hieron[J]. Fitoterapia, 2016, 111:124. DOI: 10.1016/j.fitote.2016.04.022
[8] 刘玲玲, 孔涛, 王海英, 等.菊芋总黄酮提取工艺研究[J].山西农业科学, 2008, (09):62-65. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW201211030.htm [9] 郑晓涛, 隆小华, 刘玲, 等.菊芋叶总黄酮提取工艺优化及含量动态变化[J].天然产物研究与开发, 2012, 24(11):1642-1645, 1689. http://www.cnki.com.cn/Article/CJFDTOTAL-TRCW201211030.htm [10] 杨明俊, 王亮, 吴婧, 等.菊芋叶黄酮类化合物的体外抗氧化活性研究[J].贵州农业科学, 2011, 39(4):52-54. http://www.cnki.com.cn/Article/CJFDTOTAL-GATE201104019.htm [11] 李淑红, 王京仁, 成钢, 等.12种中草药对金黄色葡萄糖球菌体外抑菌作用的研究[J].黑龙江畜牧兽医, 2014, (13):148-149. [12] 吴婧. 菊芋叶黄酮类化合物的提取及其抗氧化性、抗肿瘤和抑菌性的研究[D]. 兰州: 兰州理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10731-1011134194.htm -
期刊类型引用(5)
1. 申朝霞,井西宽,陈元. 桃红四物汤口服合清热解毒利湿方溻渍治疗下肢丹毒的临床研究. 中华中医药学刊. 2023(04): 202-205 .  百度学术
百度学术
2. 李永春,赵美荣,张智. 臭椿生物碱对5种植物病原真菌的抑制作用. 福建农业学报. 2021(01): 53-58 .  本站查看
本站查看
3. 姚玉仙,张明泽,刘荣,陈志,江荣,韦梅,高雪静. 茶轮斑病病原菌鉴定及其对茶皂素和茶多酚的敏感性. 湖南农业科学. 2021(04): 78-81 .  百度学术
百度学术
4. 曹乃馨,罗阳兰,解修超,阎勇,邓百万. 夹竹桃花不同溶剂提取物的GC-MS分析及其抗氧化、抑菌活性. 中成药. 2021(12): 3512-3517 .  百度学术
百度学术
5. 孔阳,马养民,王佳运,易军军,王丽红. 一株烟曲霉抗植物病原菌活性次生代谢产物的研究. 东北农业科学. 2019(02): 34-38 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: