Antioxidant Activity of Polysaccharides from Loaches
-
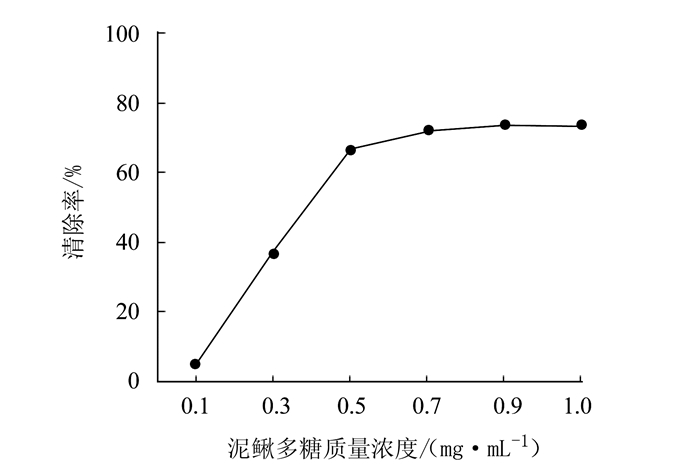
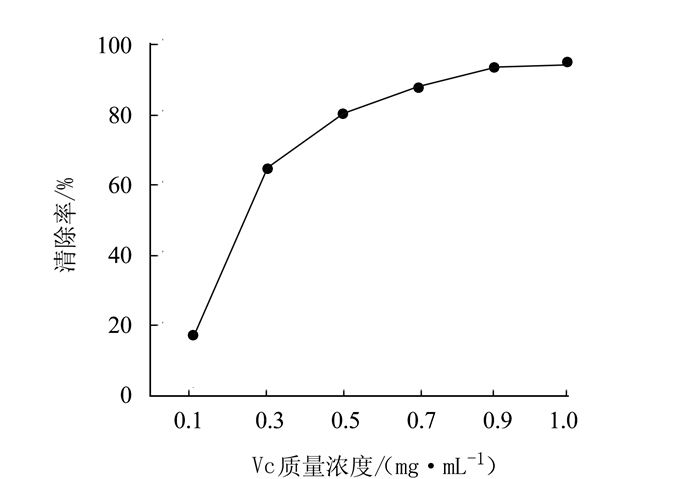
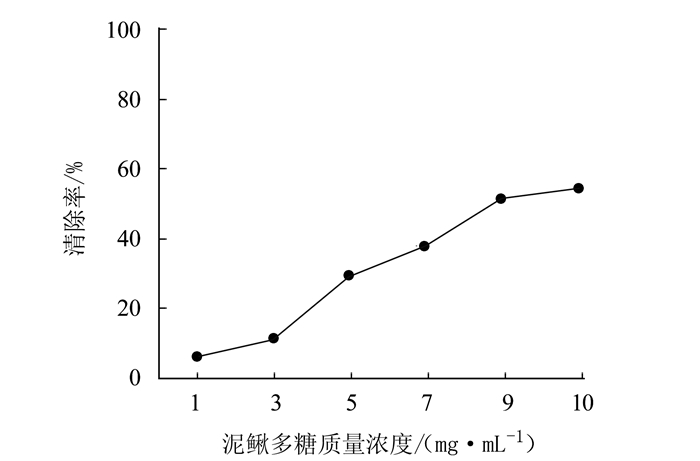
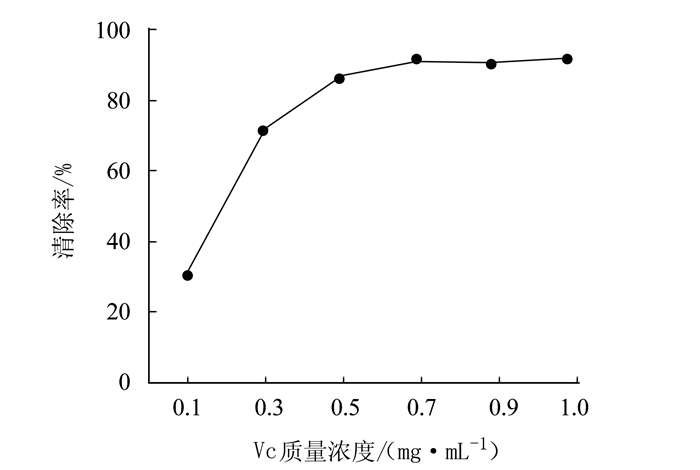
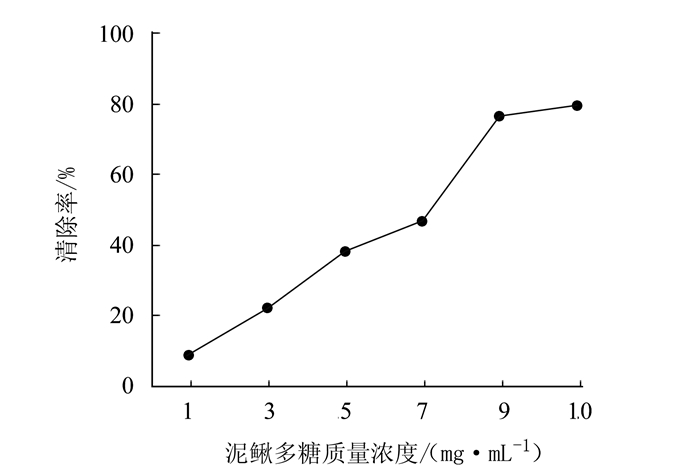
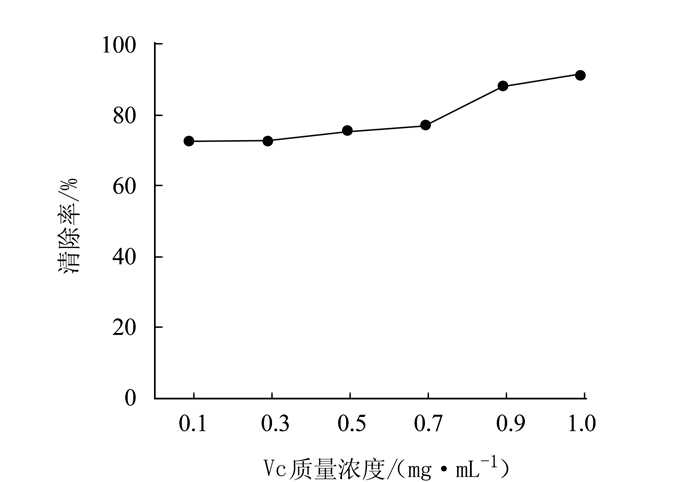
摘要: 为研究泥鳅多糖的抗氧化作用,采用生化试验检测泥鳅多糖的体外抗氧化能力。结果表明,泥鳅多糖对羟自由基、超氧阴离子和过氧化氢均具有清除能力,其中对羟自由基和过氧化氢的清除能力较强,最高分别达到73.38%和88.22%。对超氧阴离子的清除能力也达到57.99%,总抗氧化能力达到8.42 U·mL-1,表明泥鳅多糖具有较强的抗氧化能力。Abstract: Polysaccharidesin loaches were extracted by an ultrasound-assisted enzymatic method to determine the antioxidant activityusing an in vitro biochemical assay. The results showed that the polysaccharides had strong scavenging capacities toward hydroxyl radicals, superoxide anions, and hydrogen peroxide.Theremoval rate of the extract onhydroxyl radicals reached as high as 73.38%, while 88.22% on hydrogen peroxide and 57.99% onsuperoxide anions.Atotal antioxidant capacity of 8.42 units·mL-1 of the loach polysaccharides was considered high and desirable.
-
Keywords:
- loach /
- polysaccharides /
- antioxidant
-
连城白鸭又称白鹜鸭,是中国极为稀少宝贵的水禽资源之一,因其具有白羽、乌嘴、青脚等特征而著名,2013年被列为国家地理标志保护产品[1]。因其肉质具有开胃健脾、清热降火、滋阴补肾等效用,也被评为“中国唯一的药用鸭”。
黑色素是一种广泛分布于动物、植物和微生物中的无定形小颗粒状的生物多聚体,它不溶于水和几乎所有的溶剂。动物的黑色素细胞主要生成真黑色素和褐黑素两种黑色素[2],真黑色素主要存在于家禽的皮肤、眼、黑羽或蓝羽及人的黑发、牛的眼睛等组织中。褐黑素主要表现于人的红头发、蓝眼睛、动物的红毛色和家禽红羽、浅黄色羽毛等。动物黑色素的合成是一个极其复杂的过程,受诸多信号转录因子的调控,因其具有重要的生物学功能(黑色素能预防紫外线诱导的DNA损伤和细胞损害;可吸收有毒的阳离子、结合有害的药物和保护肝脏;能清除自由基及参与H2O2还原成H2O的过程而具有抗氧化作用,能消除超氧阴离子、防止脂质氧化而具有类似SOD的功能等),近年来被广泛用于皮肤生物学、毛发颜色等生物学领域的研究[3-5]。黑色素细胞最重要的转录因子——刺参小眼畸形相关转录因子(microphthalmia-associtated transcription factor,MITF),可通过α-MSH诱导,与cAMP应答原件结合蛋白(cAMP responsive element binding protein,CREB)结合作用于cAMP,激活MITF基因在黑色素细胞中的特异性表达,在黑色素的合成过程中起到了至关重要作用[6-7]。除此之外,研究也显示MITF能够有效介入调控黑色素合成关键酶酪氨酸基因家族(TYR、TYRP1、TYRP2)的表达,对黑色素的形成具有很大作用,并对黑色素细胞的存活、增殖、迁移和分化过程产生影响[8-13]。MITF具有bHLHZip(basic-helix-loop-helix-leucine zipper)结构,是黑色素细胞发育过程中的重要调节因子,对黑色素干细胞的维持也起到关键作用[14-15]。目前,MITF基因的相关功能研究大都在哺乳动物上。在人类与鼠群中,MITF基因突变将造成人与鼠黑色素细胞的相关功能障碍或者发育的缺陷,会影响眼睛、皮肤、头发的色素形成及耳蜗的听功能[16-19],致使虹膜异质、白色额发、听觉障碍等病症出现。Hauswirth等[20]研究表明马毛色的白色斑点(Splashed White)可能是由MITF基因启动子的一个短小核苷酸片段的插入突变引起的。在鸟类中,鹦鹉、绿头鸭、白绒乌鸡、原鸡等MITF基因cDNA序列已经克隆,研究证实MITF基因与羽色性状密切相关。Minvielle等[21]研究表明MITF基因第11外显子2 bp的缺失会导致杂合子的日本鹌鹑表现为灰白羽色,纯合子的日本鹌鹑表现为银白羽色。Wang等[22]研究显示MITF基因编码区1 109 bp位点上的C→T碱基突变与浙东白鹅的白羽性状呈极显著相关。Sultana等[23]研究表明MITF基因的2个突变(c.114T>G和c.147T>C)和内含子7上14 bp(GCTGCAAACAGATG)插入缺失与鸭的黑羽和白羽性状呈极显著相关。连城白鸭体表特征中,除了乌嘴、青脚,其他部位未见色素沉积。连城白鸭体内是否有黑色素沉积,其药用价值是否与黑色素有关未见相关报道。本研究通过对连城白鸭各组织MITF基因的表达特性进行分析,为之后继续探究MITF基因能否用作调控连城白鸭黑色素沉积的主效候选基因和能否充当连城白鸭黑色素性状的辅助选择提供科研依据。
1. 材料与方法
1.1 试验动物与组织样品采集
试验鸭为福建省农业科学院畜牧兽医研究所动物实验基地饲养的连城白鸭。选取同一批出雏的1日龄健康连城白鸭雏鸭80只进行饲养,自由采食和饮水,基础饲粮由东南饲料有限公司配制提供,具体基础饲粮组成及营养水平见表 1。饲养至130日龄,选取10只个体均匀健康的连城白鸭,颈动脉放血处死,取肌肉、皮肤(腹部)、肌胃、肾脏、肝脏等组织,立即投入液氮中保存备用。
表 1 基础饲粮组成及营养水平(饲喂基础)Table 1. Composition and nutrients in basal diet for ducks (as-fed basis)饲粮组成 1~21 d含量 22~130 d含量 营养水平 1~21 d含量 22~130 d含量 玉米/% 54.00 50.00 粗蛋白质/% 18.50 16.00 次粉/% 12.00 11.80 代谢能/(MJ·kg-2) 12.12 11.72 去皮豆粕/% 21.00 12.00 赖氨酸/% 0.95 0.70 菜粕/% 2.00 2.00 蛋氨酸+胱氨酸/% 0.78 0.65 米糠粕/% 0.00 12.00 钙/% 0.85 0.80 干酒糟及其可溶物/% 6.00 7.00 有效磷/% 0.40 0.35 豆油/% 1.00 1.20 预混料/% 4.00 4.00 合计/% 100.00 100.00 注:(1)预混料可为每千克饲粮提供:1~21 d: VA 7 000 IU,VD3 2 000 IU,VE 30 mg,VK3 4.0 mg,VB1 3.0 mg,VB2 7.0 mg,VB6 9.0 mg,VB12 0.03 mg,胆碱450 mg,烟酸35 mg,泛酸20 mg,叶酸1.0 mg,生物素0.2 mg,Fe 60 mg,Cu 8 mg,Mn 85 mg,Zn 80 mg,I 0.35 mg,Se 0.3 mg。22~130 d:VA 6 000 IU,VD 2 000 IU,VE 10 mg,VK3 1.0 mg,VB1 2.0 mg,VB2 4.0 mg,VB6 3.0 mg,VB12 0.02 mg,胆碱400 mg,烟酸20 mg,泛酸10 mg,叶酸0.6 mg,生物素0.1 mg,Fe 55 mg,Cu 5 mg,Mn 80 mg,Zn 75 mg,I 0.3 mg, Se 0.2 mg。(2)营养水平为计算值。 1.2 MITF基因的克隆与序列分析
1.2.1 RNA提取、cDNA合成
利用总RNA提取试剂盒(Invitrogen, USA)提取连城白鸭不同组织中的总RNA,加入DNase I(TaKaRa,Japan)进行消化,RNA的含量和纯度用凝胶电泳和Nanodrop 2000紫外分光光度计(Thermo Scientific, USA)进行检测,并调整总RNA质量浓度至1 μg·μL-1。取出2 μL总RNA,利用SuperScriptTM Ⅱ反转录酶(Invitrogen,USA)和Oligo(dT)18反转录成cDNA,具体步骤:在20 μL RNase-free的离心管中分别加入Total RNA 2 μg、Oligo(dT)18 1 μL、dNTPs (10 μmol·L-1) 1 μL、加DEPC处理水至15 μL;70℃,5 min变性,立即放到冰上;然后依次加入5×First-strand Buffer 4 μL、0.1 mol·L-1 DTT 2 μL、RNase inhibitor 25 units、SuperScriptTM Ⅱ Rtase 200 units,混合上述成分,离心,42℃温育1 h,-20℃保存。
1.2.2 MITF基因的扩增
用于巢式PCR扩增的引物根据原鸡(Gallus gallus)MITF序列(GenBank号:NM_205029.1)设计(表 2)。PCR反应体系(25 μL):模板(其中第一轮为cDNA原液,第二轮为第一轮PCR产物) 0.5 μL、2×PCR Buffer 12.5 μL、1.0 μL(10 μmol·L-1)上下游引物、dNTP Mixture 5 μL、KODFX 0.5 μL、ddH2O 4.5 μL。反应条件:94℃预变性5 min;94℃ 30 s、60℃ 30 s、72℃ 2 min,30个循环;72℃总延伸10 min。在1.0%~1.5%的琼脂糖凝胶中电泳所得到的PCR产物,对其进行切胶回收和高效Taq扩增,连结pUCm-T载体,感受态细胞JM109转化,挑选阳性菌培养鉴定,最后送至大连TAKARA公司进行测序。
表 2 RT-PCR扩增引物Table 2. RT-PCR Primers引物 引物序列(5′-3′) 扩增长度/bp 熔解温度/℃ L1 Forward CTCTTCCCACAGCAATTCCGAGCA 1431 60 Reverse GGGCTACTGATGAAGCACAAGA L2 Forward CCCTCTAGATGCATGCTCGAGGCTCC TCCAGCATGACCTCAC 1323 60 Reverse CTTGGTACCGAGCTCGGATCCGTATT TGCTAACAAGCATGGTCG 1.3 MITF基因序列分析
采用DNAstar8.0中的SeqMan软件对克隆序列进行BLAST分析,拼接符合预期的核苷酸序列,获得连城白鸭MITF基因序列,推算其编码区的氨基酸序列(MITF蛋白)并进行遗传进化分析。
1.3.1 基本理化特征分析
利用在线工具ProtParam(http://web.expasy.org/protparam/)分析连城白鸭MITF蛋白的不稳定指数、等电点、亲水性平均系数和脂肪族氨基酸指数。
1.3.2 同源性比对
将获得的连城白鸭MITF基因和数据库中其他物种的MITF基因编码区进行氨基酸同源性比对。
1.3.3 遗传进化分析
利用遗传进化软件Mega 6.0,对获得的连城白鸭MITF基因编码蛋白和绿头鸭、鸿雁、原鸡等其他物种MITF基因编码的蛋白进行遗传进化分析。采用NJ法(Neighbor-Joining Methods)进行遗传进化分析,计算重复1 000次(Bootstrap = 1 000),绘制遗传进化树。
1.3.4 连城白鸭MITF蛋白质结构预测
分别利用SOPMA软件、SWISS-MODEL软件预测连城白鸭蛋白质的二级、三级结构,利用BioEdit软件对连城白鸭MITF蛋白的亲水性、疏水性进行预测。
1.4 不同组织MITF基因mRNA相对表达与分析
据鸡持家基因磷酸甘油醛脱氢(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)和得到的连城白鸭的MITF基因序列设计定量PCR引物(表 3),选择荧光定量PCR检测连城白鸭的MITF基因在肌肉、皮肤、肌胃、肾脏和肝脏等组织的mRNA表达水平。反应体系(25 μL): 12.5 μL 2×Power SYBR® Master Mix,1.0 μL模板cDNA,0.5 μL 10 μmol·L-1 PCR-F,0.5 μL 10 μmol·L-1 PCR-R,10.5 μL ddH2O。反应条件:95℃ 1 min;95℃ 10 s,64℃ 25 s(收集荧光),40个循环;熔点曲线分析55~95℃。为确保试验结果可靠性,每个样品重复3次。选择2-△△Ct定量方法[24]对连城白鸭各组织中MITF基因的相对表达量进行分析计算。
表 3 荧光定量PCR引物信息Table 3. Information on qRT-PCR primers基因名称 基因序列号 引物序列(5′-3′) 扩增长度/bp 熔解温度/℃ 小眼畸形相关转录因子 NM_205029.1 F: GGTCAACAGGGTCATCAAACAAGAA 135 64 R: CCGAGGTTGTCACTGAAGGTGAT 3-磷酸甘油醛脱氢酶 NM_204305.1 F: GGGTAGTGAAGGCTGCTGCTGAT 114 64 R: CCGCATCAAAGGTGGAGGAAT 2. 结果与分析
2.1 MITF基因的克隆
利用RT-PCR技术对连城白鸭的皮肤组织cDNA进行扩增,电泳结果如图 1所示,扩增产物长度1 323 bp,其扩增片段特异性较好,且不含非特异性条带,与预期片段大小一致(图 1)。
2.2 MITF氨基酸序列分析、同源性比较和遗传进化分析
2.2.1 MITF氨基酸序列分析和同源性比较
用DNAstar8.0软件对测序结果进行拼接,得到1 323 bp长度的cDNA序列,序列包含一个完整的CDS区(34~1 323 bp),编码429个氨基酸(AA),分子量47.892 kDa,不稳定指数63.8,亲水性平均系数为-0.693,理论等电点为6.03,脂肪族氨基酸指数77.30。
连城白鸭通过克隆所得的MITF基因序列在Genbank中的登录号为MG516570。分别利用BioEdit7.0和Clustal X 2.0两种生物学软件对连城白鸭MITF CDS区氨基酸序列与其他物种(绿头鸭、原鸡、白绒乌鸡、火鸡、鹌鹑、鸿雁、鹦鹉、黑猩猩、家鼠、野猪、人、绵羊和兔)的MITF CDS区氨基酸进行同源性比对(图 2),结果显示连城白鸭的MITF CDS区氨基酸序列与绿头鸭的同源性达到100%,且与鹌鹑、原鸡等鸟类的氨基酸同源性达95%以上,和其他物种的同源性均为85%以上(表 4)。另外,经多序列比对发现,连城白鸭与绿头鸭、原鸡、火鸡等物种MITF基因的氨基酸序列进行比较,缺失28个氨基酸(第132~159位)。为了验证该差异,重新设计引物进行扩增,发现连城白鸭MITF基因的氨基酸序列确实存在缺失(图 2)。
表 4 MITF基因编码氨基酸序列(14个物种)的遗传距离和同源性Table 4. Homology and genetic distance of amino acid sequence encoded by MITF gene in 14 species1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 0.0000 0.0163 0.0287 0.0164 0.0205 0.0205 0.0164 0.1397 0.1397 0.1936 0.1889 0.1486 0.1974 2 100.0 0.0150 0.0264 0.0150 0.0188 0.0188 0.0188 0.1441 0.1441 0.1994 0.1950 0.1524 0.1969 3 99.1 99.1 0.0416 0.0302 0.0339 0.0339 0.0340 0.1601 0.1601 0.2183 0.2139 0.1685 0.2133 4 98.4 98.5 97.6 0.0188 0.0226 0.0226 0.0226 0.1482 0.1482 0.2141 0.2048 0.1482 0.2015 5 99.1 99.1 98.3 98.9 0.0038 0.0038 0.0038 0.1400 0.1400 0.1995 0.1992 0.1483 0.1930 6 98.8 98.9 98.1 98.7 99.8 0.0000 0.0075 0.1439 0.1439 0.2041 0.1949 0.1522 0.1970 7 98.8 98.9 98.1 98.7 99.8 100.0 0.0075 0.1439 0.1439 0.2041 0.1949 0.1522 0.1970 8 99.1 98.9 98.1 98.7 99.8 99.6 99.6 0.1442 0.1442 0.2014 0.1952 0.1505 0.1947 9 92.1 91.9 91.0 86.3 92.1 91.9 91.9 91.9 0.0000 0.0700 0.0884 0.0380 0.0966 10 92.1 91.9 91.0 91.7 92.1 91.9 91.9 91.9 100.0 0.0700 0.0884 0.0380 0.0966 11 89.6 89.3 88.4 88.6 89.3 89.1 89.1 89.3 96.1 96.1 0.0435 0.0916 0.1462 12 89.6 89.3 88.4 88.9 89.6 89.3 89.3 89.3 95.2 95.2 97.6 0.0837 0.1674 13 91.4 91.2 90.4 91.5 91.5 91.2 91.2 91.4 97.9 97.9 95.0 95.4 0.1035 14 88.8 88.9 88.0 85.1 89.1 88.9 88.9 89.0 90.9 94.7 91.9 91.0 94.3 注:上三角为遗传距离,下三角为同源性,%。1为连城白鸭,2为绿头鸭,3为鸿雁,4为鹦鹉,5为火鸡,6为原鸡,7为白绒乌鸡,8为鹌鹑,9为人,10为黑猩猩,11为猪,12为绵羊,13为兔,14为家鼠。 利用在线工具SMART (http://smart.embl-heidelberg.de/)对连城白鸭MITF蛋白结构域进行分析,结果显示,连城白鸭的MITF蛋白与其他物种的MITF蛋白一样,同样具有基础螺旋-环-螺旋-拉链(bHLH-Zip)结构,此结构包含90个氨基酸,基础部分由11个氨基酸构成。该结构的第一个螺旋由20个氨基酸构成;环状区由13个氨基酸构成;21个氨基酸组成第二个螺旋,末尾由3个氨基酸结尾,衔接4个亮氨酸构成亮氨酸拉链(图 2)。此外,从图 2发现螺旋区域和基础区域部分均具有比较高的保守性。哺乳动物和鸟类MITF蛋白的亮氨酸拉链的组成成分为4个亮氨酸残基,且每个亮氨酸残基中间间隔6个氨基酸残基,亮氨酸残基聚集在α-螺旋一侧。bHLH区域的保守性相较亮氨酸拉链结构的保守性要好。
2.2.2 遗传进化分析
利用MEGA6.0软件测定14个物种的遗传距离,得出连城白鸭与绿头鸭遗传距离最近,为0.000 0,家鼠与连城白鸭遗传距离最大,为0.1974。
选择绿头鸭、鸿雁、原鸡、白绒乌鸡等14物种的序列,采用Neighbor- Joining法(MEGA6.0),进行1 000次重复,构建系统进化树(图 3),结果表明,连城白鸭与鸿雁、绿头鸭遗传距离最近;其次为与鹌鹑、火鸡、白绒乌鸡、原鸡等其他鸟类;与人、绵羊、猪等哺乳动物的遗传距离最远。
2.3 连城白鸭MITF蛋白质二级结构预测
连城白鸭蛋白质二级结构的预测(SOPMA软件)如图 4所示。42.19%为α螺旋(Alpha helix,181个AA),11.19%为β折叠(Extended strand,48个AA),6.53%为β转角(Beta turn,28个AA),40.09%为无规则卷曲(Random coil,172个AA),所以形成此蛋白质二级结构的结构元件以无规则卷曲和α螺旋为主。用BioEdit软件对连城白鸭的MITF蛋白进行疏水性、亲水性的预测,结果(图 5)显示,连城白鸭氨基酸残基比例的预测结果为亲水性残基大于疏水性残基(Hphob.Kyte-Doolittle方案),推测该蛋白为亲水性。
2.4 连城白鸭MITF蛋白质三级结构预测
选择SWISS-MODEL软件预测分析连城白鸭MITF基因编码蛋白序列的三级结构,结果如图 6。通过此基因编码蛋白的三级结构可以明显看出,连城白鸭MITF蛋白的一个环状结构间隔开两个螺旋,从而形成连城白鸭MITF蛋白的基础螺旋-环-螺旋-拉链结构(图 6)。
2.5 各组织MITF基因mRNA表达水平分析
连城白鸭MITF基因在其肝脏、肌胃、肾脏、皮肤、肌肉等5个组织中的表达水平不同。MITF在皮肤组织的表达明显高于其他组织(图 7)。RT-PCR进一步印证,连城白鸭的MITF基因在皮肤组织mRNA相对表达量极显著高于肌肉、肾脏等组织(P < 0.01),连城白鸭的MITF基因在肝脏组织与肌肉组织mRNA相对表达量差异不显著(P>0.05),而MITF基因在其他各组织间的表达均差异极显著(P < 0.01)。综上可得出在连城白鸭各组织中MITF基因的相对表达量的大致趋向呈现为:皮肤>肾脏>肌胃>肝脏>肌肉。
3. 讨论与结论
3.1 MITF基因的克隆及生物信息学分析
目前,绿头鸭、人、小鼠、鹌鹑、原鸡等多个物种的MITF基因的CDS序列均被克隆,通过研究分析发现上述物种的MITF基因CDS序列具有较高的同源性,都含有1个基本螺旋-环-螺旋-亮氨酸拉链(bHLHzip)结构,为蛋白质的功能区,对黑色素细胞的发育、分化以及功能调节起到关键作用[12,25-26]。采用简并引物和巢式PCR的方法顺利克隆连城白鸭MITF基因的完整编码区cDNA序列,序列长度为1 323 bp,包含1个完整的CDS区(34~1 323 bp),编码429个氨基酸。本研究发现连城白鸭与绿头鸭、鸿雁、鹌鹑等的MITF基因编码的蛋白质序列具有高度的相似性,表明MITF基因在生化进化上的保守性。同时也体现出MITF基因在生物体的功能重要性以及在不同物种上的结构稳定性。聚类结果发现,连城白鸭与雁形目的绿头鸭、鸿雁关系最近,与鸡形目的鹌鹑、火鸡、白绒乌鸡、原鸡的关系其次,这不但在分子水平上证实了连城白鸭是由绿头鸭演变而来,同时也反映了鸟类相当保守的进化过程。经多序列比对发现,连城白鸭的MITF基因的氨基酸序列与绿头鸭、原鸡等其他物种相比,缺失第132~159位的28个氨基酸,该缺失是否对连城白鸭MITF基因的功能造成影响尚不清楚,后续将针对这一缺失对连城白鸭MITF基因做进一步的研究。张丽英等[27]深入研究了原鸡、野猪、人等12个物种的MITF氨基酸序列,其结论也表明这些物种的MITF都含有一个保守的螺旋结构域(HLH),对于真核转录因子的不同发展路径尤其是该结构域对色素细胞的存活、增殖和分化过程起关键性作用。郑嫩珠等[28]成功克隆了白绒乌鸡MITF基因,发现白绒乌鸡MITF蛋白与原鸡一样,具有HLH结构域和相似的生物学功能。本研究分析发现,与其他动物一样,连城白鸭MITF也含有一个保守的基础螺旋-环-螺旋-亮氨酸拉链(bHLHZip)蛋白功能区。与其他的物种类似,连城白鸭MITF蛋白所具有的这些结构也是一类进化保守的转录因子。据此推测,连城白鸭MITF在黑色素细胞的发育、分化和功能调节过程中起到了极为重要的影响作用,同时也为深入探究分析连城白鸭MITF基因的表达和功能鉴定提供了重要理论基础。
3.2 MITF基因的组织表达分析
基因表达差异作为生物体各种性状间差异的形成原因之一,研究差异表达的基因为揭开性状差异的内部机制提供了依据[29]。本研究选择RT-PCR分析MITF基因mRNA在连城白鸭的肾脏、肝脏、肌胃、肌肉、皮肤等5个组织的表达情况,结果显示,连城白鸭的皮肤组织中的MITF基因mRNA表达量最高,极显著高于其他各组织(P < 0.01),表达量依次为:皮肤>肾脏>肌胃>肝脏>肌肉。郑嫩珠等[28]研究MITF基因在白绒乌鸡各组织中的表达,结果表明皮肤组织的表达水平最高,最低的是肌肉组织。Zhu等[30]研究表明miRNAs通过调控MITF基因的表达量差异影响羊驼的被毛色泽,羊驼白色被毛皮肤MITF基因表达量显著低于棕色被毛皮肤。Kingo等[31]在检测白癜风患者与健康者皮肤的mRNA表达中发现白癜风患者皮肤MITF mRNA表达水平比健康者低,并认为MITF mRNA表达的减少可能是白癜风发生机制之一。以上研究结果均与本试验的研究结果大致相符,表明MITF基因参与了连城白鸭体内黑色素的合成过程,并起到了重要作用。本研究为之后继续探究MITF基因能否用作调控连城白鸭黑色素沉积的主效候选基因和能否作为连城白鸭黑色素性状的辅助选择提供科研依据。
-
[1] 张锐昌, 蒋秋燕, 张应龙, 等.泥鳅的综合开发利用[J].食品与药品, 2010, 12(3):197-201. http://www.cnki.com.cn/Article/CJFDTOTAL-SDPK201005016.htm [2] 党晓妍, 王茵, 吴成业, 等.泥鳅高值化开发利用研究进展[J].食品安全质量检测学报, 2017, 8(1):20-26. http://www.cnki.com.cn/Article/CJFDTOTAL-SPAJ201701004.htm [3] 姚东瑞, 周鸣谦, 盘赛昆.泥鳅深加工现状与发展展望[J].渔业科学进展, 2010, 31(6):122-126. http://www.cnki.com.cn/Article/CJFDTOTAL-HYSC201006023.htm [4] 吴骏, 甘世雄, 于永洲.泥鳅多糖的研究进展[J].东南国防医药, 2004, 6(5):399-400. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-YYGL200400001432.htm [5] QIN C, HUANG K, XU H.Isolation and characterizatuion of a novel polysaccharide from the mucus of the loach[J].Misgurnus anguillicaudatus Carbohydrate Polymers, 2002, 49:367-371. DOI: 10.1016/S0144-8617(01)00335-6
[6] 钦传光, 周军, 赵文, 等.泥鳅多糖清除活性氧和保护DNA链的作用[J].生物化学与生物物理学报, 2001, 33(2):215-218. http://www.cnki.com.cn/Article/CJFDTOTAL-SHWL200102012.htm [7] QIN C, HUANG K, XU H.Protective effect of polysaccharide from the loach on the in vitro and in vivo peroxidative damage of hepatocyte[J].Journal of Nutritional Biochemistry, 2002, (13):592-597. http://www.ncbi.nlm.nih.gov/pubmed/12550070
[8] 钦传光, 黄开勋, 徐辉碧.泥鳅多糖抗炎作用的实验研究[J].中国药理学通报, 2001, 17(6):715-716. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yaol200106033&dbname=CJFD&dbcode=CJFQ [9] 钦传光, 黄开勋, 徐辉碧.泥鳅多糖对实验性糖尿病小鼠血糖血脂的影响[J].中国药理学与毒理学杂志, 2002, 16(2):124-127. http://www.cnki.com.cn/Article/CJFDTOTAL-YLBS200202008.htm [10] 党晓研, 王茵, 苏永昌, 等.响应面优化酶法提取泥鳅多糖工艺的研究[J].福建农业学报, 2016, 31(7):752-757. http://www.fjnyxb.cn/CN/abstract/abstract2974.shtml [11] 俞慧红, 竺巧玲, 戴飞, 等.多糖抗氧化作用的研究现状[J].食品研究与开发, 2008, (3):172-176. http://youxian.cnki.com.cn/yxdetail.aspx?filename=SPKX2017092702J&dbname=CAPJ2015 [12] 陈瑞平, 陈瑞战, 张敏, 等.复合酶法提取大蒜多糖及其抗氧化活性研究[J].分子科学学报, 2012, (1):47-52. http://www.cnki.com.cn/Article/CJFDTOTAL-FZKB201201009.htm [13] GAO Y N, TIAN C R, ZHAO L L.Extraction, purification and antioxidant activity of polysaccharides from bamboo leaves[J]. Journal of Forestry Research, 2012, 23(1):139-143. DOI: 10.1007/s11676-012-0223-y
[14] 何钊. 白蜡虫多糖分离纯化与抗氧化、免疫活性研究[D]. 北京: 中国林业科学研究院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-82201-1014331713.htm [15] 鲍素华. 铁皮石斛多糖体外抗氧化活性的研究[D]. 合肥: 合肥工业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10359-2009155327.htm [16] 许桂芹. 福寿螺多糖的分离纯化及其生物活性研究[D]. 福州: 福建农林大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10389-2008141469.htm [17] 葛霞, 陈婷婷, 蔡教英, 黄明圈, 许文凤, 王文君.青钱柳多糖抗氧化活性的研究[J].中国食品学报, 2011, (5):59-64. http://youxian.cnki.com.cn/yxdetail.aspx?filename=YTCT2017102300S&dbname=CAPJ2015 [18] 何念武, 杨兴斌, 田灵敏, 等.黄瓜多糖的体外抗氧化活性[J].食品科学, 2011, (19):70-74. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201119016.htm [19] 邢晓旭. 扁玉螺多糖的提取分离及结构分析[D]. 上海: 中国海洋大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013368653.htm [20] WANG H, ZHANG X, CHENG A F.Antioxidant Activity of Bioactive Polysaccharides Isolated from Natural Sources[J]. Journal of Animal Science and Biotechnology, 2011, 2(4):230-238. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=xmsw201104008&dbname=CJFD&dbcode=CJFQ
[21] 孟繁磊, 陈瑞战, 张敏, 等.刺五加多糖的提取工艺及抗氧化活性研究[J].食品科学, 2010, (10):168-174. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201010035.htm -
期刊类型引用(1)
1. 袁兵杰,张奕菲,刘佩,王娜,郑腾飞,祁艳霞. 鹌鹑MITF基因多态性与羽色性状的关联性分析. 中国畜禽种业. 2022(12): 15-18 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: