Conditions for Germination of Mycogone perniciosa Chlamydospores
-
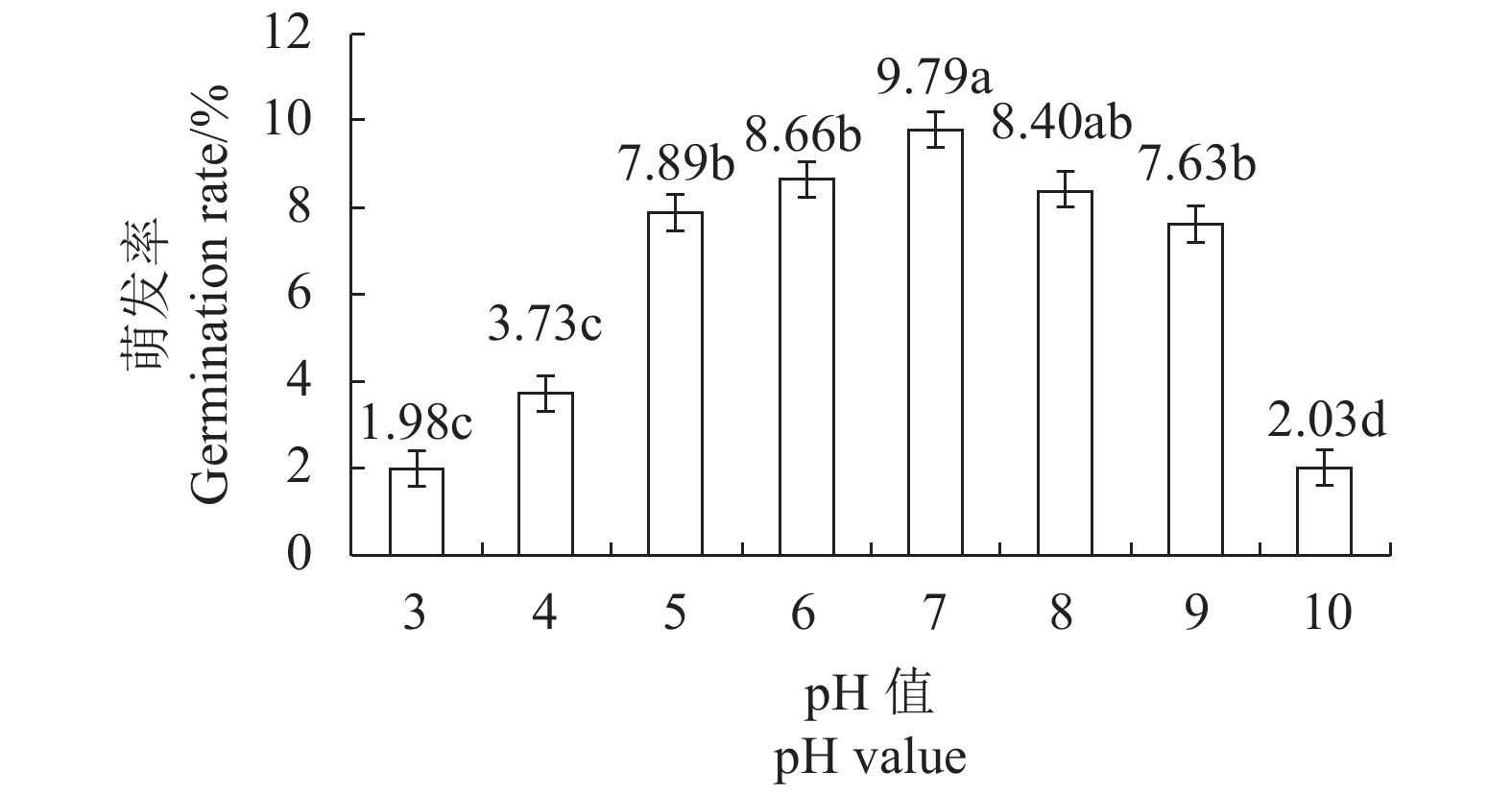
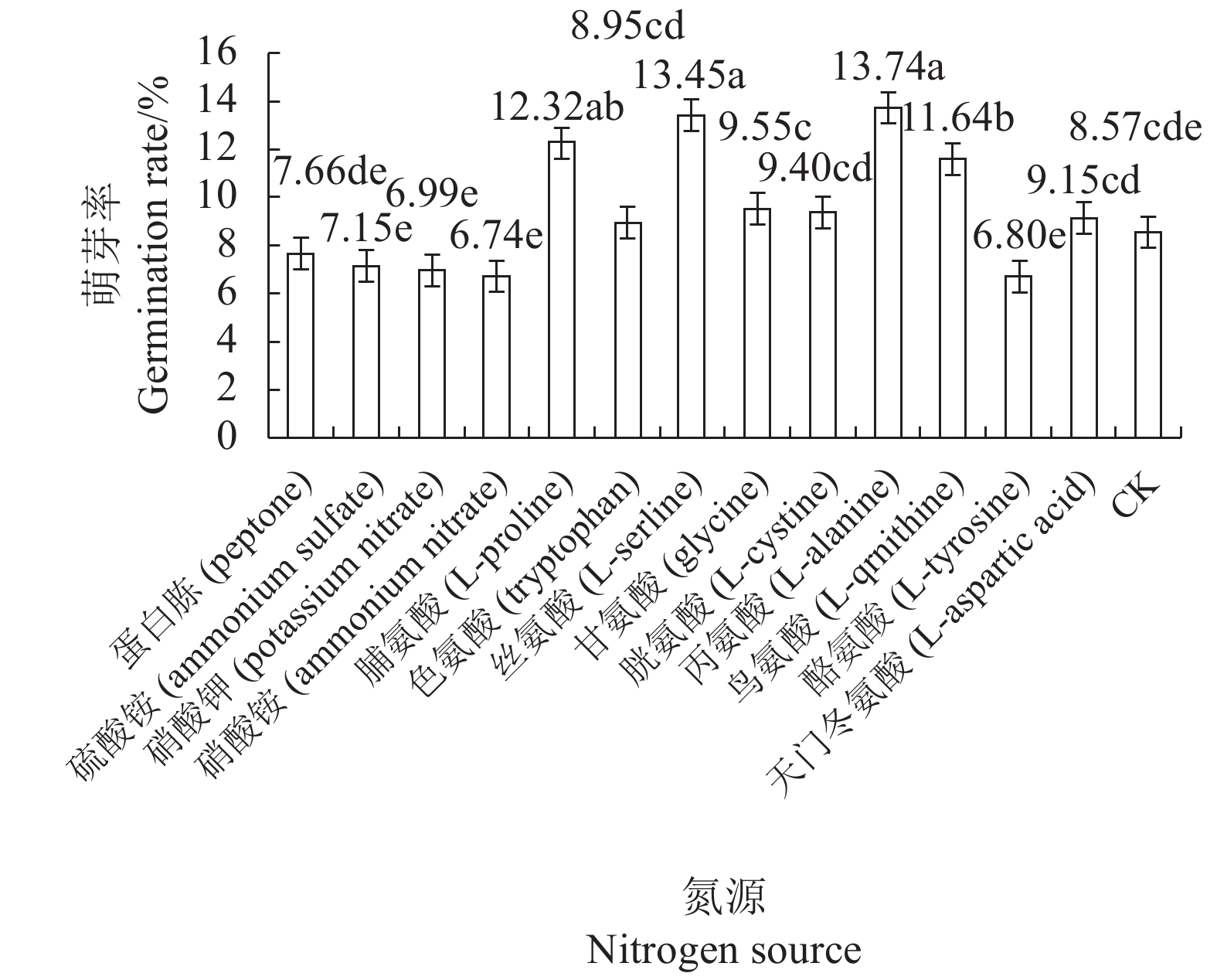
摘要:目的 研究影响有害疣孢霉厚垣孢子萌发的因素,为进一步开展有害疣孢霉生物学特性研究以及筛选可有效抑制其萌发的杀菌剂提供依据。方法 在−80℃、−20℃、0℃、4℃、10℃、15℃、20℃和25℃处理有害疣孢霉厚垣孢子,然后25℃培养,测定温度对破除有害疣孢霉厚垣孢子休眠的影响;测定不同培养基、pH值、碳源和氮源对有害疣孢霉厚垣孢子萌发的影响。结果 0℃、4℃处理12 h、24 h和48 h可破除有害疣孢霉厚垣孢子休眠,促进萌发;适合有害疣孢霉厚垣孢子萌发的pH值为6、7和8,其萌发率分别为8.66%、9.79%和8.40%;有害疣孢霉厚垣孢子在水琼脂培养基(WA)、双孢蘑菇浸出液培养基(MuEA)、双孢蘑菇煎汁培养基(MuDA)、马铃薯葡萄糖培养基(PDA)和V8培养基上的萌发率分别为0.00%、6.38%、8.43%、1.33%和6.23%,在MuDA培养基上萌发率最好,显著优于其他供试培养基;葡萄糖、蔗糖和山梨糖有利于有害疣孢霉厚垣孢子萌发,其萌发率分别为10.77%、9.96%和9.85%;在MuDA培养基中加入脯氨酸、丝氨酸、丙氨酸和鸟氨酸后有害疣孢霉厚垣孢子的萌发率分别为12.32%、13.45%、13.74%和11.64%,显著优于不加氮源的萌发率。结论 0℃、4℃处理12 h以上可破除有害疣孢霉厚垣孢子的休眠;适合有害疣孢霉厚垣孢子萌发的pH值为6、7和8;MuDA培养基是适宜有害疣孢霉厚垣孢子萌发的培养基;葡萄糖、蔗糖、D-乳糖、山梨糖和D-棉子糖是适宜有害疣孢霉厚垣孢子萌发的碳源;脯氨酸、丝氨酸、丙氨酸和鸟氨酸是适宜有害疣孢霉厚垣孢子萌发的氮源。Abstract:Objective To identify conditions that facilitate germination of Mycogone perniciosa chlamydospores for further research on effective control of the fungal disease on edible mushrooms.Method Chlamydospores were kept at −80℃, −20℃, 0℃, 4℃, 10℃, 15℃, 20℃ or 25℃ for various durations prior to culture on media at 25℃ to determine the effects of dormancy-breaking temperatures. And effects of varied pHs, culture conditions, carbon source and nitrogen source on the chlamydospores germination were detected.Result Dormancy of the chlamydospores was broken and germination promoted under 0℃ or 4℃ for 12 h, 24 h or 48 h. pH 6, 7 and 8 were conducive to the spore germination at the rates of 8.66%, 9.79%, and 8.40%, respectively. The germination rate varied according to the medium the spores grew on. It was 0.00% on WA, 6.38% on MuEA, 8.43% on MuDA, 1.33% on PDA, and 6.23% on V8. Thus, MuDA appeared significantly better than other media tested in this study. The chlamydospores showed a germination rate of 10.77% with glucose, 9.96% with sucrose or 9.85% with sorbose in the medium, indicating a significantly advantage of the presence of a carbon source. In so far as nitrogen is concerned, the addition of proline in MuDA delivered a 12.32% germination rate, serine 13.45%, alanine 13.74%, and ornithine 11.64%, which were significantly improved over control without the addition.Conclusion By keeping M. perniciosa chlamydospores at 0℃ or 4℃ for more than 12 h could break the spore dormancy. On MuDA of pH 6, 7 or 8, the chlamydospores germinated well. With the presences of glucose, sucrose, D-lactose, sorbic sugar or D-raffinose as carbon source and L-proline, L-serline, L-alanine or L-qrnithine as nitrogen source, the spore germination was further enhanced.
-
Keywords:
- Mycogone perniciosa /
- chlamydospore /
- germination /
- Agaricus bisporus
-
0. 引 言
【研究意义】百合叶烧病是一种生理性病害,国内外百合种植过程中普遍发生,严重影响切花百合和盆栽百合生产质量。其发病症状表现为百合生长至30~40 cm,花蕾出现前,顶部6~10片新叶离叶尖约2 cm处出现灰白色病斑,后期逐渐向叶尖蔓延,最后变成焦枯状。百合叶烧病具有显著的品种特异性,但目前尚未发现与叶烧病存在紧密联系的品种特征[1],因此探索百合叶烧病发病机理,对百合新种质创制和栽培技术创新具有重要意义。【前人研究进展】前人研究发现,通过剪掉一半刚展开的下部叶片[2]、在发病之前喷施氯化钙和硝酸钙溶液[3]、通过手动展开尚未展开的新叶和降低栽培环境的湿度[4]等方法能够降低叶烧病的发生率,同时施用生根剂、微生物菌肥和使用合适的栽培基质均能有效地降低叶烧病的发生[5-7]。【本研究切入点】目前,百合叶烧病发病原因及防治方法等相关研究已较为深入,其中由缺钙导致叶烧病发生已被确认,但由于钙参与多项植物生理调节过程,如何确定叶烧病发生分子机理,以及缺钙导致哪些代谢途径受阻从而产生叶烧病,是今后选育抗叶烧病品种的重要研究基础。【拟解决的关键问题】通过扫描电镜和投射电镜观察东方百合Tarrango正常叶片、轻度叶烧叶片和重度叶烧叶片超微结构的差异,并通过比较东方百合Tarrango正常叶片、叶烧叶片、正常叶片喷钙和叶烧叶片喷钙4种处理的转录组测序数据,以期探索与叶烧病发病相关的分子机理和关键调控基因。
1. 材料与方法
1.1 试验材料
以荷兰进口的Tarrango百合种球为试验材料,种植于连云港市农业科学院东辛农场实验基地日光温室,Tarrango百合生长至现蕾期,对部分百合叶烧叶片和正常叶片喷施30 mmol·L−1 硝酸钙叶面肥一次,其余百合喷施等量清水。24 h后分别取正常叶片(TarCK)、叶烧叶片(TNCK)、叶面喷钙正常叶片(TarCa)和叶面喷钙叶烧叶片(TNCa)4个处理,干冰冷藏送样检测,每个处理生物学重复3次。
1.2 转录组测序及分析试验方法
1.2.1 RNA提取及处理
上述4个处理中,取每个处理叶片混合样品1 g,参照TaKaRA全RNA提取试剂操作说明进行叶片总RNA提取。
1.2.2 文库构建及测序
百合叶片cDNA文库构建及测序均委托苏州金唯智生物科技有限公司完成。
1.2.3 转录组数据组装及基因功能注释
百合叶片转录组测序及对获得的数据库 Unigene 的全面分析和注释,均委托苏州金唯智生物科技有限公司完成。
1.3 百合叶片扫面电镜及透射电镜观察
采集Tarrango正常叶片、轻度发病叶烧叶片和重度发病叶烧叶片(图1),无菌水漂洗干净后,手术刀裁成3 mm×3 mm大小,置于电镜固定液中固定2 h,再转移至4 ℃保存,4 ℃冰袋运输送样至武汉赛维尔生物科技有限公司。
2. 结果与分析
2.1 百合叶片叶烧病扫描电镜分析
如图2所示,近轴面表皮层均无气孔分布,其中Tarrango正常叶片和Tarrango轻微叶烧叶片的上表皮细胞横直径为500 μm。而Tarrango重度叶烧叶片上表皮细胞发生严重皱缩,其上皮细胞的横直径只有312.5 μm。轻度叶烧时,百合叶片上表皮细胞出现轻微的收缩,重度叶烧时,百合叶片表皮细胞表面出现褶皱痕迹。
如图3所示,百合叶片远轴面表皮层分布了大量气孔,气孔数量最多的是Tarrango重度叶烧叶片(图3-A),其次为Tarrango轻度叶烧叶片(图3-B)和Tarrango正常叶烧叶片(图3-C)叶片。Tarrango正常叶片、Tarrango轻微叶烧叶片和Tarrango重度叶烧叶片气孔直径大小基本一致,均在400 μm左右。Tarrango轻度叶烧叶片下表皮层便发生皱缩现象,重度叶烧叶片皱缩程度更加严重。
2.2 百合叶片透射电镜分析
正常叶片叶肉细胞(图4-A、B)和轻度叶烧叶肉细胞(图4-C、D)液泡较大,叶绿体分布在边缘。重度叶烧叶片的叶肉细胞由于液泡失水,叶绿体分布在整个细胞,细胞较为规则;重度叶烧细胞由于失水,整个细胞皱缩,形状不规则(图4-E、F)。在叶烧病发展过程中,叶绿体结构未发生太大变化,基粒垛叠层数较多且排列规律,3个处理中叶绿体均含有数量不等的淀粉粒。但重度叶烧叶片叶肉细胞中,线粒体数量明显较少。
2.3 转录组测序组装及unigene注释分析
使用软件Cutadapt对测序原始数据(Pass filter data)去除接头以及低质量序列,获得后续信息分析用的过滤数据(Clean data)。4个处理12个文库产生了541 393 662条序列,约80.68 Gb转录组数据,Unigene平均长度在148.63 ~149.00 bp,GC含量变化范围为49.17%~52.32%(表1)。由表2可以看出,转录组数据经组装产生了19 585 575个重叠群,349537条unigenes,平均长度为513.25 bp。在所有unigenes序列中,序列长度小于500 bp的占75.92%(表3)。Unigene注释分析显示有124 405 unigenes获得注释,占unigenes总数的35.59%,其中获得注释较多的数据库分别是Nr注释121 501(34.76%)、COG注释49 594条(14.19%)、Swissport注释72 421条(20.72%)和KEGG注释17 051条(4.88%)。
表 1 12个cDNA文库的过滤数据Table 1. Clean data of 12 cDNA library样品
Sample平均长度
Average length/bp总序列数
The total number of sequences总碱基数
Total base number /bpQ20含量
Q20 content /%Q30含量
Q30 content /%GC含量
GC /%TarCK1 148.70 46691744 6943031355 98.11 94.32 50.55 TarCK2 148.77 49717384 7396527911 98.26 94.67 49.80 TarCK3 148.63 40433794 6009572727 98.15 94.35 52.27 TarCa1 148.74 47758784 7103493445 98.15 94.44 51.41 TarCa2 148.87 40229314 5988834979 98.07 94.30 52.04 TarCa3 149.00 46500744 6928790175 98.07 94.28 51.59 TNCK1 148.98 43959714 6549244364 98.15 94.42 50.78 TNCK2 148.79 40479744 6022881697 98.23 94.59 49.17 TNCK3 148.87 45992514 6846847661 98.08 94.21 49.91 TNCa1 149.00 44762836 6669452846 98.10 94.41 52.32 TNCa2 148.96 46342564 6903233715 98.04 94.15 51.03 TNCa3 148.89 48524526 7224858395 98.09 94.31 52.03 合计 Total 541393662 80686769270 表 2 转录组序列组装分析Table 2. Summary of transcriptome assembly序列类型
Sequence type重叠群
Contig序列
Unigene最短序列长度 Minimum sequence Length/bp 25 201 最长序列长度 Maximum sequence length/bp 15 734 11 377 序列平均长度 Mean sequence length/bp 53.76 513.25 N50长度 N50 length/bp 48 686 (A+T)/% 51.94 55.72 (C+G)/% 48.06 44.28 序列总数 The total number of sequences 19 585 575 349 537 总碱基数量 Total base number/bp 1 052 959 813 179 400 360 表 3 Unigene 的长度及数量统计Table 3. Unigene length and quantity statistics长度
Length/bp数量
Number比例
Percentage/%<200 0 0.00 200~500 265 367 75.92 500~1 000 44113 12.62 1 000~1 500 17 752 5.08 1 500~2 000 10 495 3.00 ≥2 000 11 809 3.38 总数 Total 349 537 100 2.4 差异表达基因筛选及分析
对4组处理转录组数据进行层次聚类(Hierarchical clustering)分析,喷钙2个处理TarCa与TNCa基因表达模式相近,并且与喷清水2个处理TarCK与TNCK基因表达模式存在显著区别,通过基因表达量可以将差异表达基因划分成A、B两个簇(图5-A),同时通过对转录组数据分组对比分析发现,TarCK/TarCa比较中差异表达基因最多,总数为4 816个,其中上调表达基因2 419个,下调表达基因2 397个;其次TNCK/TNCa比较中差异表达基因2 782个,其中上调表达基因1 090个,下调表达基因1 692个;TarCK/TNCK比较中差异表达基因822个,其中上调表达基因399个,下调表达基因423个;TarCa/TNCa比较中差异表达基因最少,总数为113个,其中上调表达基因56个,下调表达基因57个(图5-B)。
![]() 图 5 差异表达基因的表达谱分析注:A,差异表达基因的聚类分析;B,差异表达基因的数量;C,差异表达基因的主成分分析;D,差异基因维恩图分析。Figure 5. Expression profiling of differentially expressed genesNote: A: Cluster analysis on differentially expressed genes; B: Number of differentially expressed genes; C: Principal component analysis on differentially expressed genes; D: Venn diagram of differential genes.
图 5 差异表达基因的表达谱分析注:A,差异表达基因的聚类分析;B,差异表达基因的数量;C,差异表达基因的主成分分析;D,差异基因维恩图分析。Figure 5. Expression profiling of differentially expressed genesNote: A: Cluster analysis on differentially expressed genes; B: Number of differentially expressed genes; C: Principal component analysis on differentially expressed genes; D: Venn diagram of differential genes.通过PCA(Principal Component Analysis)分析发现,TarCa与TNCa两个处理的重复组间的变异较小,并且两个处理间的差异性也较小,而TarCK与TNCK两个处理间不但处理间的差异性较大,重复组间的变异也比较大(图5-C)。同时,在4组对照分析中,发现了特异的和共同的差异表达基因,共发现7 185个差异表达基因,包括5 860个特异差异表达基因和1 325个共同差异表达基因(图5-D)。其中TarCK/TarCa与TNCK/TNCa共差异表达基因最多,为991个;其次为TarCK/TNCK与TarCK/TarCa共差异表达基因为230个和TNCK/TNCa与TarCK/TNCK共差异表达基因为96个,TarCa/TNCa与TarCK/TNCK共差异表达基因最少,只有1个,通过上述数据表明,喷钙处理能显著降低叶烧叶片与正常叶片的差异表达基因数量。
2.5 差异基因GO富集分析
通过GO富集分析对差异表达基因进行生物学功能研究,在错误发现率FDR<0.01时,25个GO条目富集在TarCa/TNCa,25个GO条目富集在TarCK/TNCK,31个GO条目富集在TarCK/TarCa,31个GO条目富集在TNCK/TNCa。有18个GO条目在4组对比分析中均有富集,其中,“催化活性” “结合”和“代谢过程”是富集基因最多的GO条目。在4组对比分析中有5个特异性GO条目,其中“多细胞生物过程”和“繁殖”GO条目仅在TarCK/TarCa中富集,“突触部分”GO条目仅在TNCK/TNCa中富集,“细胞外基质”和“细胞外基质成分”GO条目仅在TarCa/TNCa中富集,TarCK/TNCK无特异性GO条目(图6)。
![]() 图 6 差异表达基因的GO富集分析注:1,催化活性;2,结合;3,转运活性;4,结构分子活性;5,电子载体;6,核酸结合转录因子活性;7,酶调节活性;8,抗氧化活性;9,分子传感器活性;10,细胞组分;11,细胞器;12,膜部分;13,细胞器部分;14,细胞膜;15,高分子复合物;16,胞外区;17,类核;18,细胞连接;19,代谢过程;20,细胞过程;21,单一生物过程;22,生物调节;23,应激反应;24,定位;25,发育过程;26,多生物过程;27,免疫系统过程;28,组织细胞组成或生物起源;29,生殖过程;30,多细胞生物过程;31,繁殖;32,细胞外区域部分;33,细胞外基质;34,细胞外基质成分;35,运动;36,生长;37,突触部分。Figure 6. GO enrichment analysis on differentially expressed genesNote: 1: catalytic activity; 2: binding; 3: transporter activity; 4: structural molecule activity; 5: electron carrier activity; 6: nucleic acid binding transcription factor activity; 7: enzyme regulator activity; 8: antioxidant activity; 9: molecular transducer activity; 10: cell part; 11: organelle; 12: membrane part;13: organelle part; 14: membrane; 15: macromolecular complex; 16: extracellular region; 17: nucleoid; 18: cell junction; 19: metabolic process; 20: cellular process; 21: single-organism process; 22: biological regulation; 23: response to stimulus; 24: localization; 25: developmental process; 26: multi-organism process; 27: immune system process; 28: cellular component organization or biogenesis; 29: reproductive process; 30: multicellular organismal process; 31: reproduction; 32: extracellular region part; 33: extracellular matrix; 34: extracellular matrix component; 35: locomotion; 36: growth; 37: synapse part.
图 6 差异表达基因的GO富集分析注:1,催化活性;2,结合;3,转运活性;4,结构分子活性;5,电子载体;6,核酸结合转录因子活性;7,酶调节活性;8,抗氧化活性;9,分子传感器活性;10,细胞组分;11,细胞器;12,膜部分;13,细胞器部分;14,细胞膜;15,高分子复合物;16,胞外区;17,类核;18,细胞连接;19,代谢过程;20,细胞过程;21,单一生物过程;22,生物调节;23,应激反应;24,定位;25,发育过程;26,多生物过程;27,免疫系统过程;28,组织细胞组成或生物起源;29,生殖过程;30,多细胞生物过程;31,繁殖;32,细胞外区域部分;33,细胞外基质;34,细胞外基质成分;35,运动;36,生长;37,突触部分。Figure 6. GO enrichment analysis on differentially expressed genesNote: 1: catalytic activity; 2: binding; 3: transporter activity; 4: structural molecule activity; 5: electron carrier activity; 6: nucleic acid binding transcription factor activity; 7: enzyme regulator activity; 8: antioxidant activity; 9: molecular transducer activity; 10: cell part; 11: organelle; 12: membrane part;13: organelle part; 14: membrane; 15: macromolecular complex; 16: extracellular region; 17: nucleoid; 18: cell junction; 19: metabolic process; 20: cellular process; 21: single-organism process; 22: biological regulation; 23: response to stimulus; 24: localization; 25: developmental process; 26: multi-organism process; 27: immune system process; 28: cellular component organization or biogenesis; 29: reproductive process; 30: multicellular organismal process; 31: reproduction; 32: extracellular region part; 33: extracellular matrix; 34: extracellular matrix component; 35: locomotion; 36: growth; 37: synapse part.2.6 差异基因KEGG富集分析
在植物体内,Ca2+参与的代谢调控十分复杂,通过KEGG代谢通路分析,在本次转录组测序中“剪接体” “代谢途径” “丙酮酸代谢” “次生代谢产物的生物合成”和“光合作用生物的碳固定作用”代谢途径在4组试验处理对比分析中都有基因富集,经过差异基因COG分析,4组试验处理对比分析共有25个COG分组,其中4组试验处理共有COG功能分类22个,包括“细胞外结构” “信号转导机制” “未知功能基因” “细胞内运输、分泌和囊泡运输” “翻译、核糖体结构和生物发生” “细胞壁/膜/信封生源论” “一般功能预测基因” “复制、重组和修复” “碳水化合物运输和代谢” “无机离子的转运和代谢” “细胞骨架” “氨基酸的运输和代谢” “脂质运输与代谢” “细胞周期控制,细胞分裂,染色体分裂” “能源生产与转换” “染色质结构和动力学” “翻译后修饰,蛋白质转换,伴侣” “辅酶运输和代谢” “RNA加工和修饰” “次级代谢产物生物合成、运输和分解代谢”。
2.7 显著差异基因分析
结合扫描电镜和透射电镜分析,本研究重点关注叶烧病发病过程和喷施钙处理中,细胞膜通透性相关基因的表达变化。如表4所示,在百合叶烧病发病过程中即TarCK/TNCK对比分析中,显著下调基因有参与脱落酸信号的负调控的FOLK基因(Farnesol kinase 法呢醇激酶)[8]、影响脂类物质生物合成和细胞膜稳定性的PLD1_2基因(phospholipase D1/2 磷脂酶D1/2)[9]、ATPeF1B基因(F-type H+-transporting ATPase subunit bet膜上ATP合酶)和KCS基因(3-ketoacyl-CoA synthase 3-酮脂酰辅酶A合酶)[10]。同时CALM基因(Calmodulin 钙调蛋白)[11]、ENO基因(enolase 烯醇酶)[12]和pel基因(Pectate lyase 果胶酸裂解酶)[13]等响应钙离子信号和影响木质素和果胶生物合成的基因下调。在百合叶烧病发病过程中表达量上调的基因有促进生成脱落酸的AAO基因(abscisic-aldehyde oxidase 脱落醛氧化酶)[14]。
表 4 显著差异表达基因Table 4. Significantly differentially expressed genes对照组
Group基因编号
Gene ID差异倍数
Log2 fold
change基因名称
KO_name基因定义
KO_definitionTarCK/TNCK DN74111_c0_g1_i2 −6.76 FOLK 法呢醇醇激酶 Farnesol kinase TarCK/TNCK DN42826_c0_g2_i2 −6.56 PLD1_2 磷脂酶D1/2 Phospholipase D1/2 TarCK/TNCK DN73032_c0_g2_i1 −3.14 ATPeF1B 膜上ATP合酶 F-type H+-transporting ATPase subunit beta TarCK/TNCK DN59908_c0_g1_i2 −1.88 KCS 3-酮脂酰辅酶A合成酶基因 3-ketoacyl-CoA synthase TarCK/TNCK DN88233_c0_g1_i2 −1.08 ENO 烯醇酶 Enolase TarCK/TNCK DN45172_c0_g1_i1 −1.00 CALM 钙调蛋白 Calmodulin TarCK/TNCK DN75575_c0_g1_i1 6.00 AAO3 脱落醛氧化酶 Abscisic-aldehyde oxidase TNCK/TNCa DN75425_c0_g1_i6 −4.83 ABF ABA响应元件结合因子 ABA responsive element binding factor TNCK/TNCa DN89025_c0_g1_i3 −2.34 MFP2 烯酰辅酶A水合酶/3-羟酰辅酶A脱氢酶 Enoyl-CoA hydratase/3-hydroxyacyl-CoA dehydrogenase TNCK/TNCa DN10149_c0_g1_i1 1.09 AUX1 生长素流入载体蛋白 Auxin influx carrier TNCK/TNCa DN36010_c0_g1_i1 1.20 CALM 钙调蛋白 Calmodulin TNCK/TNCa DN81084_c0_g4_i2 1.29 CPK 钙依赖性蛋白激酶 Calcium-dependent protein kinase TNCK/TNCa DN132576_c0_g1_i1 1.64 CML 钙结合蛋白CML Calcium-binding protein CML TNCK/TNCa DN55671_c1_g1_i8 2.01 PLD1_2 磷脂酶D1/2 Phospholipase D1/2 TNCK/TNCa DN1778_c0_g3_i1 2.45 SORD L-艾杜糖醇-2-脱氢酶 L-iditol 2-dehydrogenase TNCK/TNCa DN48191_c0_g1_i1 2.61 EIN2 乙烯不敏感蛋白2 Ethylene-insensitive protein 2 而在叶烧叶片喷钙后即TNCK/TNCa对比分析中,表达量上调的基因有CALM基因、CPK基因(Calcium-dependent protein kinase 钙依赖性蛋白激酶)、EIN2基因 (ethylene-insensitive protein 2 乙烯不敏感蛋白2)[15]、AUX1基因(Auxin influx carrier 生长素流入载体)[16]、PLD1_2基因和果糖和甘露糖的代谢途径的SORD基因(L-iditol 2-dehydrogenase L-艾杜糖醇-2-脱氢酶)[17]。与此同时下调表达的基因有ABF基因(ABA responsive element binding factor ABA响应元件结合因子)[18]和参与脂肪酸降解途径的MFP2基因 (Enoyl-CoA hydratase/3-hydroxyacyl-CoA dehydrogenase烯酰辅酶A水合酶/3-羟酰辅酶A脱氢酶)[19]。
3. 讨论与结论
通过百合叶片扫描电镜分析,叶片近轴面表皮细胞大小随叶烧程度的加深而减小,重度叶烧时,表皮细胞发生皱缩,表明此时表皮细胞失水。叶片远轴面表皮细胞在轻度叶烧时发生皱缩,而近轴面表皮细胞在重度叶烧时才发生皱缩,说明叶烧症状先出现在远轴面一侧。通过透射电镜分析,百合叶片在发生叶烧的过程中,液泡失水是导致表皮细胞体积缩小的原因。因此,推测细胞膜和液泡膜的通透性发生改变是导致百合叶片叶烧病症状的原因。
差异表达基因的PCA分析发现,正常叶片3个重复处理和叶烧叶片3个重复处理之间的差异性都很大,而正常叶片喷钙后3各处理和叶烧叶片喷钙后3个处理之间差异性较小。同时在对比分析中也发现,TarCa/TNCa比较组差异表达基因显著少于TarCK与TNCK,都说明喷钙处理能降低正常叶片和叶烧叶片之间的差异表达基因数量,甚至喷钙处理能够降低正常叶片和叶烧叶片之间差异表达基因数量,说明喷钙处理能缓解叶烧病的发病过程,这与白菜干烧心[20-21]、莴苣[22]等缺钙生理性病害的一致。
在分析单个基因表达中发现,在叶烧病发病过程中,响应钙离子信号CALM基因显著下调,而喷钙处理后CALM和CPK基因显著上调,说明CALM基因是叶烧病发病过程中的主要信号传导基因。同时,叶烧病发病过程中促进生成脱落酸的AAO基因显著上调,叶烧叶片喷钙后乙烯信号调控基因EIN2和生长素输入载体基因AUX1表达量上调,表明叶烧病发病可能受脱落酸、乙烯和生长素的调控。同时,叶烧病发病过程中,在细胞膜和液泡膜稳定相关基因phospholipase D1/2、ATPeF1B 、KCS等表达均显著下调。而喷钙后phospholipase D1/2 显著上调,这与拟南芥中PLD及其产物磷脂酸(PA)调控ABA响应的负调控因子[23-24]结果一致。
钙在植物生理活动中,既起着结构成分的作用,也具有酶的辅助因素功能,它能维持细胞壁、细胞膜及膜结合蛋白的稳定性,参与细胞内各种生长发育的调控作用。因此目前虽然基本证实百合叶烧病是由缺钙导致,但其具体的致病分子机理仍不能十分明晰,今后仍需开展相关基因分析验证工作,为百合分子育种提供理论支撑。
-
表 1 温度对有害疣孢霉厚垣孢子萌发率的影响
Table 1 Effect of temperature on germination rate of M. perniciosa chlamydospores
(单位: %) 温度
Temperature萌发率 Germination rate 萌发率 Germination rate 萌发率 Germination rate 12 h/12 h 12 h/24 h 12 h/48 h 24 h/12 h 24 h/24 h 24 h/48 h 48 h/12 h 48 h/24 h 48 h/48 h −80 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k −20 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0 ℃/25 ℃ 0.00 k 2.75 gh 6.40 de 0.00 k 4.70 f 7.36 c 0.00 k 5.76 e 7.44 c 4 ℃/25 ℃ 0.71 jk 2.68 gh 6.77 cd 1.45 ij 8.40 b 9.23 a 1.40 ij 9.79 a 9.62 a 10 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 15 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 20 ℃/25 ℃ 0.00 k 0.00 k 0.72 jk 0.00 k 0.66 jk 0.95 jk 0.96 j 1.24 ij 1.43 ij 25 ℃/25 ℃ 0.00 k 0.00 k 1.38 ij 0.00 k 1.25 ij 2.36 h 1.53 ij 1.98 hi 3.25 g 注:数据后不同小写字母分别表示在5%水平上差异显著。
Note: Data with lowercase letters indicate significant difference at P<0.05. -
[1] TU C C, LIAO Y M. Major diseases of cultivated mushroom and their control in Taiwan [J]. Mushroom Science, 1989, 12: 615−626.
[2] FORER L B, WUEST P J, WAGNER V R. Occurrence and economic impact of fungal diseases of mushrooms in Pennsylvania [J]. The Plant Disease Reporter, 1974, 58: 987−991.
[3] 吴菊芳, 支月娥, 康素珍, 等. 蘑菇褐腐病菌生物学特性和防治 [J]. 植物保护学报, 1996, 23(3):235−240. DOI: 10.3321/j.issn:0577-7518.1996.03.009 WU J F, ZHI Y E, KANG S Z., et al Study on the biological characters and the control of Mycogone perniciosa Magn. [J]. Journal of plant protection, 1996, 23(3): 235−240.(in Chinese) DOI: 10.3321/j.issn:0577-7518.1996.03.009
[4] 周春元. 双孢蘑菇湿泡病病原学及其致病机理研究[D]. 长春: 吉林农业大学, 2014. ZHOU C Y. The Etiology and pathogenic mechanisms of mycogone perniciosa causing wet bubble disease on Agaricus bisporus[D]. Changchun: Jilin agricultural university, 2014.
[5] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 521-522. [6] GERRITE J P G. The influence of water in the preparation of mushroom compoat and its control [J]. Mushroom Science, 1972, 8: 43−47.
[7] 黄清铧, 王松, 张扬, 等. 有害疣孢霉菌与双孢蘑菇的互作关系 [J]. 菌物学报, 2014, 33(2):440−448. HUANG Q H, WANG S, ZHANG Y, et al. The interactions between mycogone perniciosa and Agaricus bisporus [J]. Mycosystema, 2014, 33(2): 440−448.(in Chinese)
[8] 周春元, 李玉. 双孢蘑菇不同品种感染有害疣孢霉后防御酶活性变化 [J]. 菌物学报, 2015, 34(3):504−510. ZHOU C Y, LI Y. Changes of defensive enzyme activities in different Agaricus bisporus varieties after inoculation with Mycogone perniciosa [J]. Mycosystema, 2015, 34(3): 504−510.(in Chinese)
[9] 张春兰, 徐济责, 李丹, 等. 有害疣孢霉与不同食用菌的培养关系 [J]. 西北农林科技大学学报, 2017, 45(1):112−118. ZHANG C L, XU J Z, LI D, et al. Cultivating relationship between Mycogone perniciosa and edible mushrooms [J]. Journal of Northwest A&F University(Natural Science Edition), 2017, 45(1): 112−118.(in Chinese)
[10] 张春兰, 徐济责, 柿岛真, 等. 双孢蘑菇疣孢霉病的发病过程及病原菌的核相研究 [J]. 微生物学报, 2017, 57(3):422−433. ZHANG C L, XU J Z, MAKOTO K, et al. The development of Agaricus bisporus wet bubble disease and the nuclear phase of pathogen [J]. Acta Microbiologica sinica, 2017, 57(3): 422−433.(in Chinese)
[11] ZHANG L, JIANG X L, YANG X Y, et al. Inhibition of chlamydospore germination and mycelial growth of Trichoderma spp. by chemical fungicides [J]. Agricultural Science & Technology, 2015, 16(7): 1494−1499.
[12] UMAR M H, GEELS F P, VAN GRIENSVEN L J L D. Pathology and pathogenesis of Mycogone perniciosa infection of Agaricus bisporus [J]. Mushroom Science, 2000, 15: 561−567.
[13] 王玉霞, 温志强, 林秋萍, 等. 福建省主要蘑菇产区疣孢霉菌生物学特性研究 [J]. 菌物学报, 2007, 26(S1):448−454. WANG Y X, WEN Z Q, LIN Q P, et al. Studies on biological characteristices of Mycogone perniciosa from main production areas of mushroom in Fujian [J]. Mycosysterna, 2007, 26(S1): 448−454.(in Chinese)
[14] 曾宪森, 李开本, 林兴生. 蘑菇疣孢霉病发生及综合防治研究 [J]. 福建农业学报, 2001, 16(4):13−17. DOI: 10.3969/j.issn.1008-0384.2001.04.004 ZENG X S, LI K B, LIN X S. Occurrence and integrated control of the Agaricus bisporus wet bull caused by Mycogone perniciosa magn [J]. Fujian Journal of Agricultural Sciences, 2001, 16(4): 13−17.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2001.04.004
[15] FLETCHER J T, JAFFE B, MUTHUMEENASKSHI S, et al. Variations in isolates of Mycogone perniciosa and in disease symptoms in Agaricus bisporus [J]. Plant Pathol, 1995, 44: 130−140. DOI: 10.1111/j.1365-3059.1995.tb02725.x
[16] MANNING K, WOOD D A. Production and regulation of extracellular endocellulase by Agaricus bisporus [J]. Journal of General Microbiology, 1983, 129: 1839−1847.
[17] GEA F J, TELLO J C, NAVARRO M J. Efficacy and effects on yield of different fungicides for control of wet bubble disease of mushroom caused by mycoparasite Mycogone perniciosa [J]. Crop Prot, 2010, 29: 1021−1025. DOI: 10.1016/j.cropro.2010.06.006
[18] DIANA M H, MARY L P, COOKE R C, et al. Germination of bicellular conidia of mycogone perniciosa, the wet bubble pathogen of the cultivated mushroom [J]. Transactions of the british mycological society, 1985, 85(4): 730−735. DOI: 10.1016/S0007-1536(85)80272-2
[19] 侯颖, 徐建强, 宋宇州, 等. 三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响 [J]. 植物保护学报, 2014, 41(3):367−371. HOU Y, XU J Q, SONG Y Z, et al. Effects of carbendazim' difenoconazole and azoxystrobin on mycelial growth and conidial germination of Alternaria suffruticosae [J]. Journal of plant protection, 2014, 41(3): 367−371.(in Chinese)
[20] 任海英, 戚行江, 梁森苗, 等. 环境因子对杨梅凋萎病菌分生孢子萌发及侵染的影响 [J]. 果树学报, 2015, 32(3):474−480. REN H Y, QI X J, LIANG S M, et al. Effects of environmental factors on conidial germination and infection of Pestalotiopsis spp. causing twig blight disease of bayberry(Myrica rubra) in China [J]. Journal of Fruit Science, 2015, 32(3): 474−480.(in Chinese)
[21] URBEZ-TORRES J R, BRUEZ E, HURTADO J, et al. Effect of temperature on conidial germination of Botryosphaeriaceae species infecting grapevines [J]. Plant disease, 2010, 94(12): 1476−1484. DOI: 10.1094/PDIS-06-10-0423
[22] 董佩佩, 孙漫红, 李世东, 等. 粉红螺旋聚孢霉67-1厚垣孢子生物学特性的研究 [J]. 菌物学报, 2014, 33(6):1242−1252. DONG P P, SUN M H, LI S D, et al. Biological characteristics of chlamydospores of Clonostachys rosea 67-1 [J]. Mycosystema, 2014, 33(6): 1242−1252.(in Chinese)
[23] BEAGLE-RISTAINO J E, PAPAVIZAS G C. Survival and proliferation of Trichoderma spp. and Gliocladium virens in soil and in plant rhizospheres [J]. Phytopathology, 1985, 75(6): 729−732. DOI: 10.1094/Phyto-75-729
[24] 李卫平, 王洪凯, 林福呈. 稻曲病菌厚垣孢子的萌发特性 [J]. 浙江农业学报, 2008, 20(4):278−281. DOI: 10.3969/j.issn.1004-1524.2008.04.013 LI W P, WANG H K, LIN F C. Germination characteristics of chlamydospore of Usilaginoidea virens [J]. Acta Agriculturae Zhejiangensis, 2008, 20(4): 278−281.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2008.04.013
[25] 王国良. 影响稻曲病菌厚垣孢子萌发因素的研究 [J]. 植物保护学报, 1988, 15(4):241−245. WANG G L. Studies on the factors influencing the germination of the chlamydospores of Ustilaginoides virens [J]. Journal of plant protection, 1988, 15(4): 241−245.(in Chinese)
[26] 樊荣辉, 王永强, 刘兵, 等. 稻绿核菌无性孢子形成过程及厚垣孢子萌发率测定 [J]. 菌物学报, 2010, 29(2):188−192. FAN R H, WANG Y Q, LIU B, et al. The process of asexual spore formation and examination of chlamydospore germination of Ustilaginoidea virens [J]. Mycosystema, 2010, 29(2): 188−192.(in Chinese)
[27] 邹勇. 木霉厚垣孢子的产生、萌发和保存条件研究[D]. 雅安: 四川农业大学, 2006. ZOU Y. Study on the conditions of production germination and storage of chlamydospore of Trichoderma spp.[D]. Ya’an: Sichuan agricultural university, 2006.
[28] 王松. 有害疣孢霉菌(Mycogone perniciosa Magn)对双孢蘑菇致病机制的研究[D]. 福州: 福建农林大学, 2012. WANG S. Preliminary research of the pathogenicity mechanism of Mycogone perniciosa Magn to Agaricus bisporus[D]. Fuzhou: Fujian agriculture and forestry university, 2012.
[29] VINCENT-DAVIES, STEPHEN. Relationships between Mycogone perniciosa (Magnus) and its host Agaricus bisporus (Sing.), the cultivated mushroom[D]. Bath: University of Bath, 1973.
[30] SMITH, F E V, B. SC Three diseases of cultivated mushrooms [J]. Transactions of the british mycological society, 1924(10): 81−97.





 下载:
下载: