Effects of Biochar Addition on Phenolic Acids and Microbial Community in Rhizosphere Soil at Continuous Cropping Field of Tobacco
-
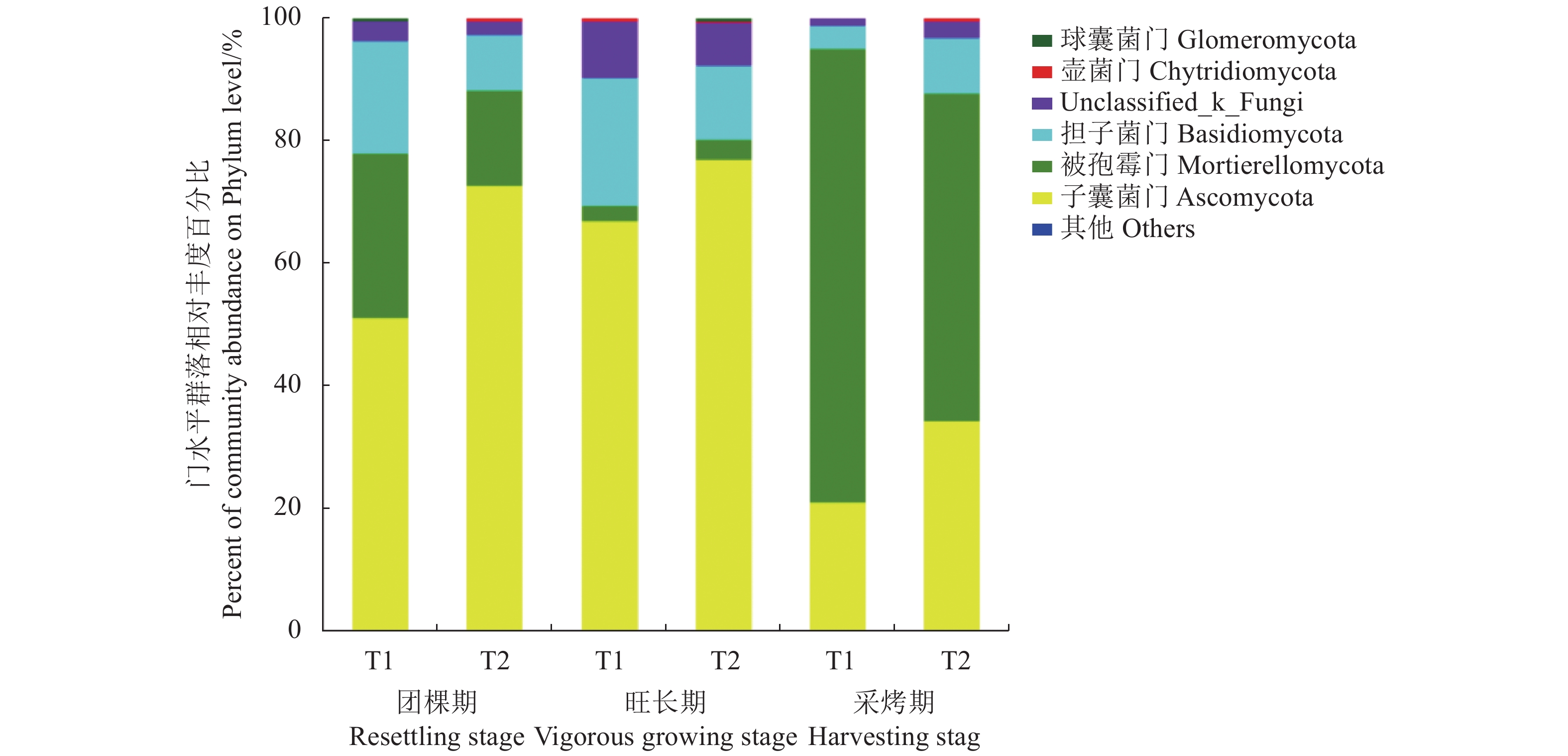
摘要:目的 以连作植烟根际土壤为研究对象,探明生物炭对不同生育期烤烟根际土壤中与化感自毒密切相关的7种酚酸(阔马酸、对羟基苯甲酸、香草酸、丁香酸、4-香豆酸、阿魏酸、肉桂酸)及土壤微生物群落结构的影响,为缓解化感自毒引起的烟草连作障碍提供理论依据。方法 采用HPLC检测和高通量测序技术分析了不同施肥处理烤烟各生育时期根际土壤中酚酸物质含量和土壤微生物的变化情况。结果 不同施肥处理后烤烟各生育时期根际土壤中均检测出6种酚酸类物质,除肉桂酸变化不明显外,对羟基苯甲酸、香草酸、丁香酸、4-香豆酸、阿魏酸的含量在各生育期均表现为生物炭处理低于常规施肥处理;且施用生物炭后酚酸物质的总量在团棵期、旺长期和采烤期较常规施肥处理分别降低了1.86%、11.36%和40.44%。生物炭能在一定程度上提升烤烟根际土壤微生物群落的多样性与丰富度,旺长期生物炭处理细菌、真菌OTU丰度分别是常规施肥处理的1.23倍和1.07倍;与常规施肥处理相比,生物炭处理的细菌Shannon、ACE和Chao1指数旺长期分别提升了12.43%、23.0%和23.0%,采烤期分别提升了0.32%、2.40%和1.25%;真菌Shannon、ACE和Chao1指数旺长期分别提升了6.54%、6.67%和7.43%,采烤期分别提升了57.93%、8.60%和26.37%。结论 生物炭对植烟土壤有一定的改良与提质效应,有利于创造健康的根际微生态环境,缓解化感自毒引起的连作障碍。Abstract:Objective Effects of biochar addition on the microbial community and phenolic acids in rhizosphere soil at site of continuous-cropping of tobacco at various growth stages were investigated.Method The changes on the contents of 7 phenolic acids and microbial communities in the rhizosphere soil under conventional and biochar-added fertilizations were determined by HPLC and high-throughput sequencing techniques for the analysis.Result Six out of the 7 phenolic acids were detected in the soil specimens at all tobacco growth stages. With the addition of biochar in the fertilizer, aside from cinnamic acid that showed no significant variation, the contents of p-hydroxybenzoic acid, vanillic acid, syringic acid, 4-coumaric acid, and ferulic acid in the soil were lower than those under the control treatment of conventional fertilization. Compared to control, the total phenolic acid in the soil fertilized with added biochar decreased at the resettling, vigorous growing, and harvesting tobacco stages by 1.86%, 11.36%, and 40.44%, respectively. Biochar improved the diversity and richness of rhizosphere microbial community as well. At the vigorous tobacco growing stage, the bacteria and fungi OTU abundance under biochar treatment were 1.23 times and 1.07 times of control, respectively. Compared with the conventional fertilization, the biochar addition increased the Shannon, ACE and Chao1 indices on bacteria by 12.43%, 23.0%, and 23.0%, respectively, during the vigorous growing stage; and, by 0.32%, 2.40%, and 1.25%, respectively, during the harvesting stage. On fungi, the Shannon, ACE and Chao1 indices were raised by 6.54%, 6.67%, and 7.43%, respectively, in the vigorous growing stage; and, by 57.93%, 8.60%, and 26.37%, respectively, in the harvesting stage.Conclusion It appeared that biochar significantly improved and upgraded the tobacco-growing soil by creating a healthy micro-ecological rhizosphere. The addition also alleviated some of the detrimental effects of the allelopathic autotoxicity generated from continuous cropping.
-
Keywords:
- tobacco /
- obstacles in continuous cropping /
- phenolic acid /
- soil microbes
-
0. 引言
【研究意义】木棉(Bombax ceiba)为木棉科(Bombaceae)木棉属(Bombax)落叶大乔木,在华南地区被广泛应用于园林绿化。但每年6月前后,木棉果实成熟之际,果实中的絮毛爆裂而出,四处飘散,给市民的生活和健康带来了严重困扰。通过在适宜的生长阶段注射或喷施植物生长调节剂调节开花、结果和飘絮已在杨树[1]、柳树[2]上开展了相关研究,而对于木棉开花或结果的调节研究鲜见报道。探究木棉花芽分化过程及此过程中的内源激素水平,可为人工利用植物生长调节剂进行飞絮防控的治理提供科学参考与理论依据。【前人研究进展】在植物学领域中,花芽的形成和发育是一个复杂而精妙的过程,其调控机制涉及多种内源性植物激素的相互作用,这些激素在花芽分化的进程中扮演着关键角色。研究表明,包括赤霉素(Gibberellin Acid, GA3)、生长素(Indoleacetic acid, IAA)、玉米核苷素(trans-Zeatin riboside, ZR)和脱落酸(Abscisci acid, ABA)在内的植物激素,对于花芽的诱导和成熟具有不可忽视的影响[3]。有研究表明低水平的GA3,以及高水平的ZR含量在花芽分化过程中起积极正面的作用。例如刺梨(Rosa roxburghii)[4]和枇杷(Eriobotrya japonica)[5]花芽分化过程中GA3含量均保持在较低水平,而荔枝(Litchi chinensis)[6]和紫苏(Perilla frutescens)[7]花芽分化过程中高水平ZR促进了花芽分化。然而,在植物的花芽发育进程中,ABA与IAA的功能因物种和发育阶段的不同而存在差异。例如,在油桐(Vernicia fordii)[8]中,高水平的ABA含量有利于由花芽生理分化期向花芽形态分化期的转变,而相对低水平的ABA含量有助于其花芽形态分化;在银杏(Ginkgo biloba)雌花芽[9]和莲花(Nelumbo nucifera)[10]花芽分化进程中,高含量IAA促进成花,但在葡萄(Vitis vinifera)[11]中起到的作用与之相反。除了单一激素的影响外,各激素之间的相互作用与调节也影响着植物的花芽分化进程[12],例如,高水平的ABA/GA3在平阴玫瑰(Rosa rugosa cv. Plena)[13]花芽分化过程中起正向作用,高比值的ABA/IAA、ZR/IAA、ZR/GA3对于叶底红(Phyllagathis fordii)[14]花芽分化起到促进作用。【本研究切入点】尽管在多种物种中的研究已表明GA3、IAA、ZR、ABA等内源激素在植物花芽分化过程中起到的重要作用,但关于木棉的花芽分化过程的相关研究则鲜见报道,也未见关于木棉开花与内源激素关系的研究报道。【拟解决的关键问题】探究木棉花芽分化过程主要内源激素GA3、IAA、ZR、ABA含量的变化,为了解木棉开花规律、调控其开花结果提供理论基础,从而为治理果实飘絮提供参考。
1. 材料与方法
1.1 试验地及植物材料
试验地位于福建省福州市三江口生态公园(119°39′E, 26°01′N),地处亚热带,温和湿润气候。该地年平均气温19.7 ℃,温度变化幅度适中,其中最冷月(1月份)的平均气温约为10.6 ℃,而最热月(8月份)的平均气温可达到28.8 ℃。试验材料为8年生木棉植株,株高约20 m,生长状况良好,无病虫害。
1.2 试验方法
1.2.1 样品采集与处理
2023年10月上旬至2024年3月上旬,对福州市三江口生态公园中生长的木棉进行取样,随机选取样株树冠外围不同方向的枝条采集花芽,采集部位多集中于枝端和叶腋。每7 d进行1次采集,持续20次。每次采集样品30个混合后均分为3份,1份保鲜带回实验室,用于外部形态观察;1份投放入FAA固定液(70% 乙醇∶冰乙酸∶38% 甲醛=18∶1∶1)保存固定,于−4 ℃低温保存;1份采集后立即用锡箔纸包裹,放在液氮中速冻后置于干冰盒内保存,于−80 ℃冰箱,用于内源激素测定。
1.2.2 花芽外部形态与内部结构观察
对保鲜带回的花芽进行外部形态的观察记录,并用数码相机进行拍摄记录。花芽内部结构的观察参照倪子轶[15]的方法,具体内容包括材料酒精脱水、二甲苯透明、变温浸蜡、包埋、切片。切片厚度为10 μm。切片后续经脱蜡、染色、封片后在显微镜下观察和拍照。
1.2.3 GA3、ZR、IAA、ABA含量测定
以花芽石蜡切片显示的花芽分化阶段为基础,选取相对应时期超低温保存的植物样品,采用酶联免疫吸附法(ELLSA)(上海酶联生物科技有限公司)测定植物样品中GA3、ZR、IAA、ABA的含量,具体方法参照试剂盒说明书进行。
1.3 数据分析
试验数据使用Excel 2016软件进行初步处理,使用SPSS 26软件进行方差分析,采用Graph Prism Pad9作图。
2. 结果与分析
2.1 木棉花芽分化过程外部形态与内部结构
通过石蜡切片观察木棉花芽的内部结构,发现木棉的花芽分化开始于10月下旬,结束于11月下旬。石蜡切片结果显示,木棉的花芽分化过程可分为前分化期、花原基分化期、萼片原基分化期、花瓣原基分化期、雌雄蕊原基分化期、雌雄蕊形成期(图1)。
![]() 图 1 木棉花芽不同分化期外部形态特征及内部形态结构A1~F1分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)植物样品外部形态;A2~F2分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)内部形态结构。GP: 生长点;FP:花原基;SE:花萼原基;PE:花瓣原基;PP:雌蕊原基;SP:雄蕊原基;PI:雌蕊;ST:雄蕊。Figure 1. External morphology and internal structure of B. ceiba flower buds at differentiation phasesA1: external morphology of Phase I plant; B1: external morphology of Phase II plant; C1: external morphology of Phase III plant; D1: external morphology of Phase IV plant; E1: external morphology of Phase V plant; F1: external morphology of Phase VI plant; A2: internal structure of Phase I plant; B2: internal structure of Phase II plant; C2: internal structure of Phase III plant; D2: internal structure of Phase IV plant; E2: internal structure of Phase V plant; F2: internal structure of Phase VI plant; GP: growing point; FP: flower primordial; SE: sepal; PE: Petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen. GP: growing point; FP: flower primordial; SE: sepal; PE: petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen.
图 1 木棉花芽不同分化期外部形态特征及内部形态结构A1~F1分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)植物样品外部形态;A2~F2分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)内部形态结构。GP: 生长点;FP:花原基;SE:花萼原基;PE:花瓣原基;PP:雌蕊原基;SP:雄蕊原基;PI:雌蕊;ST:雄蕊。Figure 1. External morphology and internal structure of B. ceiba flower buds at differentiation phasesA1: external morphology of Phase I plant; B1: external morphology of Phase II plant; C1: external morphology of Phase III plant; D1: external morphology of Phase IV plant; E1: external morphology of Phase V plant; F1: external morphology of Phase VI plant; A2: internal structure of Phase I plant; B2: internal structure of Phase II plant; C2: internal structure of Phase III plant; D2: internal structure of Phase IV plant; E2: internal structure of Phase V plant; F2: internal structure of Phase VI plant; GP: growing point; FP: flower primordial; SE: sepal; PE: Petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen. GP: growing point; FP: flower primordial; SE: sepal; PE: petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen.前分化期(I):在前分化期,花芽的芽点从木棉枝端或者叶腋处萌发,从外部形态看与叶芽无明显区别(图1A1),从石蜡切片来看,未出现凸起的生长锥(图1A2)。
花原基分化期(II):十月上旬木棉进入花芽的形态分化期。花芽开始分化,此时从外部形态来看枝端生长点无明显凸起,表面有即将脱落叶片组织覆被(图1B1)。切片显示出现凸起的生长锥,生长锥所在横径增宽,生长锥附近的细胞排列紧密,生长速度快(图1B2)。
萼片原基分化期(III):十月中旬,采集的植物样品从外部可观察到类似芽或茎尖组织样的形态(图1C1)。切片显示生长锥继续增宽,且在生长锥附近(两侧)会出现2个明显的凸起(图1C2),即萼片原基。凸起组织细胞密度大且生长迅速,逐渐向上伸长并向中间内部弯曲(图1C2),当萼片原基组织生长弯曲至能够覆盖住生长点时表明花萼分化结束。
花瓣原基分化期(IV):10月下旬,枝端生长点逐渐膨大,出现花苞片,颜色为红褐色(图1 D1)。随着萼片原基的发育,其内侧在生长点附近又出现了新的凸起,即花瓣原基。花瓣原基分化较快,其纵向生长快于横向生长,长大于宽,最后形成花瓣(图1D2)。
雌雄蕊原基分化期(V):在11月中上旬,木棉枝端进一步膨大,形状为尖圆,红褐色变淡,木棉进入花器官原基分化期(图1E1)。在花瓣原基发育完成的后期,雌雄蕊原基开始出现。雌雄蕊原基分化的形成分为前期和后期。在雌雄蕊原基分化的前期,生长点向上继续生长,并且在生长点的两侧出现了小的凸起。在雌雄蕊原基分化的后期,生长点的纵向生长不明显,四周的凸起增多。中间比较大的为雌蕊原基,四周小而多的为雌蕊原基,后期明显形成了多层雄蕊围绕着雌蕊生长。雌雄蕊原基形成后,花芽分化过程完成,进入花器官发育阶段(图1E2)。
雌雄蕊形成期(VI):11月下旬开始,木棉花芽继续膨大,形状变化为钝圆,花苞逐渐变绿,进入雌雄蕊成熟期(图1F1)。在这一阶段花柱继续伸长,雄蕊及花药也在不断发育。木棉花芽雌、雄蕊成熟所需时间较长,次年的3月才会发育成熟(图1F2)。
2.2 花芽分化过程中内源激素含量的变化
木棉花芽分化过程中,ABA和GA3的含量明显高于IAA和ZR的含量。脱落酸ABA含量整体呈现下降的趋势,但在第III阶段的含量相比第I和第II阶段有轻微上升,但无显著差异(图2A)。随着花芽分化进程的继续,ABA鲜重含量在IV、V、VI阶段持续显著下降(图2A),在花器官形成期降至最低(48.43 ng·g−1),相比第I阶段下降了122.97 ng·g−1(图2A)。
赤霉素GA3鲜重含量总体也呈现下降趋势,第II和III阶段相比第I阶段有显著下降(图2B),在第IV阶段继续显著下降,在第V阶段时有回升,但与第II和III阶段相比无显著变化(图2B)。随后在最后VI阶段又显著下降至最低(29.66 ng·g−1),相比第I阶段下降了133.47 ng·g−1(图2B)。
生长素IAA含量在木棉花芽分化过程中呈现先下降后上升再下降的变化趋势,从第I阶段到第III阶段IAA含量持续显著下降(图2C)。第V阶段IAA含量有回升,但相比第I阶段仍有差距(图2C)。在接下来的分化过程中,IAA含量继续下降,但第V和VI阶段的含量与第III阶段相比无显著差异。IAA含量在第I阶段前分化期最高(79.12 ng·g−1),在第III阶段萼片原基分化期最低(26.97 ng·g−1)。
ZR含量在木棉花芽分化前期呈上升趋势,而后下降(图2D),从花原基分化开始到花瓣原基分化含量逐渐上升,第IV阶段花瓣原基分化期达到最高,随后ZR含量开始显著下降(图2D),在花器官形成期降至最低(13.06 ng·g−1)。
2.3 木棉花芽分化过程中内源激素比值的变化
木棉花芽分化过程中ABA/GA3比值呈现“上升-下降-上升”的变化趋势,从第I阶段到第IV阶段花瓣原基分化期上升,在第V阶段雌雄蕊分化期显著下降,而雌雄蕊形成期又出现显著回升(图3A)。GA3/IAA比值花芽分化过程中整体呈下降趋势,但在第III阶段萼片原基分化期和第V阶段雌雄蕊分化期显著上升,在雌雄蕊形成期达到最低值(图3B)。ZR/GA3比值整体呈升高趋势,但中间有波动。从第I阶段前分化期到第IV阶段花瓣原基分化阶段持续显著上升(图3C),但在第V阶段雌雄蕊分化期出现回落,第VI阶段又显著上升(图3C)。ZR/IAA比值在花芽分化过程中先上升后下降,第I阶段前分化期到第III阶段萼片原基分化期持续上升(图3D),在第III阶段的萼片原基分化期达到最大,随后逐渐下降(图3D)。
(GA3+ZR+IAA)/ABA比值在分化过程中呈现“下降-上升-下降”的变化趋势(图3E),从第I阶段前分化期到第III阶段萼片原基分化期逐渐下降(图3E),到第V阶段雌雄蕊分化期达最大值,随后在第VI阶段雌雄蕊形成期又出现显著下降(图3E)。(ZR+IAA)/GA3总体呈上升趋势,第II、IV、VI阶段的比值相比第I阶段均有显著增加,但在第III阶段萼片原基分化期和第V阶段雌雄蕊分化期出现显著下降(图3F)。
3. 讨论与结论
3.1 木棉花芽分化形态结构变化
花芽分化是一个比营养器官分化更为复杂的过程,在植物的开花结果的发育进程中起着至关重要的作用[16]。明确花芽分化的时期,了解木棉花芽分化的全过程,不仅可以为掌握木棉生物学特性提供基础资料,也可以为木棉引种栽培、花期调控提供理论依据[17]。对于不同植物,花芽分化的时期划分会存在一定差异[18]。美丽异木棉(Ceiba speciosa)的花芽分化被分为前分化期、萼片分化期、花瓣形成期、雄蕊附属物及子房形成期、雌雄蕊形成期、胚珠形成期6个时期[19],这与本研究的木棉的花芽分化时期存在区别,但也有着一定的重叠。枣(Ziziphusjujuba Mill.)的花芽分化进程则被分为未分化期、分化初期、萼片分化期、花瓣分化期、雄蕊分化期和雌蕊分化期[20]。目前对于木棉花芽分化的研究还未见报道。本研究按照各原基出现的先后顺序,并参考其他物种的研究结果,将木棉的花芽分化分为前分化期、花原基分化期、萼片原基分化期、花瓣原基分化期、雌雄蕊原基分化期以及雌雄蕊形成期。
3.2 内源激素含量变化与木棉花芽分化的关系
GA3是一种重要的植物激素,可促进植物节间伸长、萌发,对花和果实的发育也起到了重要的调控作用[21]。有研究认为GA3参与植物的成花调控,在植物的花芽分化进程中表现为高水平抑制,反之低浓度则能够促进花芽分化。本研究中GA3在木棉花芽中含量相较IAA和ZR更高,且随着花芽分化的进程推进总体持续降低,其含量变化与花芽分化过程呈现负相关,表明低水平GA3有利于诱导木棉花芽的形成,这与墨兰[Cymbidium sinense(Jackson ex Andr.)Willd.][22]和广西盾翅藤(Aspidopterys concava)[3]花芽分化过程中GA3含量变化趋势相似,说明在花芽分化前期提高GA3含量可能可以抑制木棉花芽的分化,从而影响其后续的开花及结果过程。
IAA既可以促进植物生长、促进植物器官的建成,也具有抑制植物生长的作用[23]。易仁知等[24]研究认为IAA含量高有利于花芽分化;张宁等[25]、宋杨等[26]则认为低浓度IAA有利于花芽分化。在本研究中,木棉花芽中IAA含量在木棉花芽分化进程中整体呈现下降趋势,但在分化IV期出现较显著的回升,相关原因还需进一步研究。但本研究的结果表明低水平的IAA水平可能有利于木棉花芽分化。
脱落酸(ABA)具有引起芽的休眠、促进叶片的脱落和抑制细胞生长等生理作用。ABA在花芽分化中起到的作用一直存在争议。赵志珩等[27]在对板栗的研究中发现,高水平ABA促进休眠,低水平ABA有利于花芽分化的启动;马亮等[28]在对不同陆地棉品种的研究中发现,在花芽分化过程中,随着生长发育的进行,ABA含量逐渐增高,高浓度的ABA有利于花芽分化。本研究中,木棉分化的前3个阶段(I~III)花芽中ABA含量无显著变化,但从花瓣原基分化阶段(IV)开始,ABA开始显著持续下降,与后续花芽分化过程呈明显负相关。说明对木棉而言,低水平的ABA有利于木棉花瓣原基及后续雄蕊和雌蕊的分化。这个结果也表明,在木棉花芽花瓣原基分化时期提高ABA含量可能可以抑制木棉花芽的后续分化,从而影响其开花及结果过程。
ZR能促进细胞分裂,还能起到促进细胞分化和形态建成以及推迟衰老等作用。前人在对黄花美冠兰(Eulophia flava)[29]和小叶丁香(Syringa microphylla)[30]的研究中发现较高的ZR水平有利于花芽分化进程的完成;艾星梅等[31]研究结果表明在马铃薯(Solanum tuberosum)花芽分化进程中,ZR含量高既有利于其成花诱导,也能促进花原基形态的建成。本研究中,ZR含量在木棉花芽分化过程中先上升后下降,表明高浓度的ZR可能有利于木棉花芽分化中期器官原基(萼片原基和花瓣原基)的分化,这与在小叶丁香[30]中的研究结果一致,但在花芽分化的整个进程中未表现出明显的相关性。
木棉花芽分化过程中,GA3和ABA的含量相比IAA和ZR更高,且与花芽分化过程呈现明显负相关关系,在花芽分化前期提高GA3水平,或花瓣原基分化期提高ABA水平可能可以起到抑制花芽分化的作用,从而抑制后期木棉的开花和结果进程。
3.3 内源激素平衡与木棉花芽分化的关系
植物花芽分化过程不仅仅受单一激素含量变化的影响,与各内源激素之间的相互调节与平衡也是息息相关的,各种激素的相互作用也能对花芽分化起到促进作用[32]。大樱桃(Prunus avium L.)[33]花芽在孕育过程中ABA/GA3、ZR/GA3、ZR/IAA值增大,促进了芽体由营养生长转向生殖生长。枣(Ziziphus jujuba Mill.)[20]花芽分化发育过程中较高的ABA/GA3值能有效促进花芽孕育及其后续的发育;低水平的IAA/GA3则可提高花芽的形成效率。本研究中, ABA/GA3、ZR/GA3、(ZR+IAA)/GA3比值在木棉花芽分化过程中波动上升,与GA3含量在花芽分化过程中持续下降的结果相对应。此结果与其在广西盾翅藤(Aspidopterys concava)[3]花芽分化中的变化规律一致,说明该比值升高有利于木棉花芽的膨大与花器官的分化。 GA3/IAA和ZR/IAA比值在中期达到较高水平,表明GA3/IAA和ZR/IAA比值增高有利于木棉花芽器官原基的分化,但其比值变化在花芽分化过程中无明显上升或下降趋势,无显著规律性。(GA3+IAA+ZR)/ABA比值的变化表现为先下降后上升又下降的趋势,可能是由于GA3和ABA含量在此过程中均下降,而ZR含量则先上升后下降,这种变化趋势与花芽分化过程也未表现出明显的规律性。
ZR/GA3、(ZR+IAA)/GA3在木棉花芽分化过程中整体呈现波动上升的变化趋势,其他不同激素的比值在木棉花芽分化过程中未表现明显规律性,说明木棉不同的分化时期对各激素的要求各异,相比多激素水平的调节,单一激素含量的调控可能在实践中更可行。
-
表 1 6种酚酸类对照品的线性关系
Table 1 Linear relationships between 6 phenolic acids and their reference standards
酚酸类物质 Phenolic acids 线性方程 Linear equation R2 阔马酸 Caramelic acid Y=7.23×105X+2.19×104 0.999 6 对羟基苯甲酸 p-hydroxybenzoic acid Y=7.68×106X 1.000 0 香草酸 Vanillic acid Y=3.86×106X 1.000 0 丁香酸 Syringic acid Y=1.33×106X 1.000 0 4-香豆酸 4-Coumaric acid Y=9.51×105X+5.25×103 0.999 2 阿魏酸 Ferulic acid Y=1.49×106X 1.000 0 肉桂酸 Cinnamic acid Y=1.19×108X−2.41×105 0.999 3 表 2 不同施肥处理后烤烟各生育时期根际土壤中酚酸类物质的含量变化
Table 2 Changes of phenolic acids in rhizosphere soil at tobacco growth stages after fertilization treatments
生长时期
Growth period处理
Treatment酚酸类物质种类 Species of phenolic acid /(μg·g−1) 阔马酸
Caramelic acid对羟基苯甲酸
p-hydroxybenzoic acid香草酸
Vanillic acid丁香酸
Syringic acid4-香豆酸
4-Coumaric acid阿魏酸
Ferulic acid肉桂酸
Cinnamic acid总量
Total amount团棵期
Resettling stageT1 - 0.82±0.035 d 0.24±0.036 c 1.00±0.058 d 6.99±0.151 d 0.25±0.045 d 0.39±0.055 a 9.69±0.275 d T2 - 0.81±0.005 d 0.29±0.012 b 0.87±0.023 e 6.91±0.015 d 0.23±0.006 d 0.40±0.015 a 9.52±0.032 d 旺长期
Vigorous growing stageT1 - 1.2±0.072 a 0.47±0.032 a 1.57±0.025 a 12.15±0.086 a 0.45±0.049 c 0.36±0.047 a 16.21±0.206 a T2 - 0.97±0.031 b 0.45±0.029 a 1.38±0.026 b 10.86±0.070 b 0.36±0.047 c 0.34±0.049 a 14.36±0.147 c 采烤期
Harvesting stageT1 - 0.90±0.006 c 0.31±0.021 b 1.31±0.021 c 9.96±0.066 c 2.55±0.079 a 0.35±0.038 a 15.38±0.026 b T2 - 0.46±0.030 e 0.07±0.006 d 0.68±0.057 f 6.30±0.025 e 1.3±0.035 b 0.35±0.015 a 9.16±0.083 e 注:T1为常规施肥处理,T2为生物炭处理;“-”表示该类物质未被检出;同列数字后不同字母表示差异显著 (P<0.05)。
Note: T1 is conventional fertilization; T2, fertilization with added biochar; “-” indicates substance not detected; data with different letters indicate significant difference between treatments at P<0.05.表 3 细菌OTU丰度和Alpha多样性
Table 3 Bacteria OTU abundance and alpha diversity index
生长时期
Growth period处理
Treatment原始序列数
Raw number有效序列数
Effective numberOTU丰度
OTU abundanceAlpha多样性 Alpha diversity 覆盖度
Coverage/%Shannon Simpson ACE Chao1 团棵期 Resettling stage T1 40 641 34 217 2 396 6.10 0.006 2 2 290.60 2 333.31 98.62 T2 47 715 38 864 2 494 5.94 0.008 0 2 343.31 2 336.02 98.77 旺长期 Vigorous growing stage T1 39 969 31 587 2 258 5.09 0.036 2 2 219.44 2 231.73 98.29 T2 42 595 32 361 2 782 5.72 0.019 0 2 729.95 2 740.30 98.01 采烤期 Harvesting stage T1 38 873 29 074 2 651 6.19 0.005 9 2 504.00 2 532.72 98.09 T2 34 332 25 847 2 655 6.21 0.006 4 2 564.08 2 564.33 97.75 注:T1为常规施肥处理,T2为生物炭处理,表4同。
Note: T1 is conventional fertilization; T2, fertilization with added biochar. Same for Table 4.表 4 真菌OTU丰度和Alpha多样性
Table 4 Fungi OTU abundance and alpha diversity index
生长时期
Growth period处理
Treatment原始序列数
Raw number有效序列数
Effective numberOTU丰度
OTU abundanceAlpha多样性 Alpha diversity 覆盖度Coverage/% Shannon Simpson ACE Chao1 团棵期 Resettling stage T1 63 560 62 976 1 243 3.56 0.100 4 838.31 826.40 99.77 T2 67 763 66 909 1 111 3.32 0.088 5 804.76 797.89 99.75 旺长期 Vigorous growing stage T1 56 003 54 716 1 649 3.82 0.056 6 1 325.78 1 314.58 99.41 T2 69 341 67 164 1 771 4.07 0.045 6 1 414.15 1 412.23 99.51 采烤期 Harvesting stage T1 62 965 62 697 808 1.64 0.488 1 846.60 710.98 99.71 T2 65 160 64 659 1 171 2.59 0.275 9 919.37 898.43 99.68 -
[1] 石秋环, 焦枫, 耿伟, 等. 烤烟连作土壤环境中的障碍因子研究综述 [J]. 中国烟草学报, 2009, 15(6):81−84. DOI: 10.3969/j.issn.1004-5708.2009.06.017 SHI Q H, JIAO F, GENG W, et al. An overview on research into factors hindering continuous cropping in flue-cured tobacco [J]. Acta Tabacaria Sinica, 2009, 15(6): 81−84.(in Chinese) DOI: 10.3969/j.issn.1004-5708.2009.06.017
[2] 晋艳, 杨宇虹, 段玉琪, 等. 烤烟连作对烟叶产量和质量的影响研究初报 [J]. 烟草科技, 2002, 35(1):41−45. DOI: 10.3969/j.issn.1002-0861.2002.01.016 JIN Y, YANG Y H, DUAN Y Q, et al. Influence of continuous cropping on yield and quality of flue-cured tobacco [J]. Tobacco Science & Technology, 2002, 35(1): 41−45.(in Chinese) DOI: 10.3969/j.issn.1002-0861.2002.01.016
[3] 刘艳霞, 李想, 蔡刘体, 等. 烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响 [J]. 植物营养与肥料学报, 2016, 22(2):418−428. DOI: 10.11674/zwyf.14493 LIU Y X, LI X, CAI L T, et al. Identification of phenolic acids in tobacco root exudates and their role in the growth of rhizosphere microorganisms [J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 418−428.(in Chinese) DOI: 10.11674/zwyf.14493
[4] 李雪萍, 李建宏, 漆永红, 等. 青稞根腐病对根际土壤微生物及酶活性的影响 [J]. 生态学报, 2017, 37(17):5640−5649. LI X P, LI J H, QI Y H, et al. Effects of naked barley root rot on rhizosphere soil microorganisms and enzyme activity [J]. Acta Ecologica Sinica, 2017, 37(17): 5640−5649.(in Chinese)
[5] 杜家方, 尹文佳, 李娟, 等. 连作地黄根际土壤中酚酸类物质的动态变化 [J]. 中国中药杂志, 2009, 34(8):948−952. DOI: 10.3321/j.issn:1001-5302.2009.08.004 DU J F, YIN W J, LI J, et al. Dynamic change of phenolic acids in soils around rhizosphere of replanted Rehmannia glutinosa [J]. China Journal of Chinese Materia Medica, 2009, 34(8): 948−952.(in Chinese) DOI: 10.3321/j.issn:1001-5302.2009.08.004
[6] 田给林, 毕艳孟, 孙振钧, 等. 酚酸类物质在作物连作障碍中的化感效应及其调控研究进展 [J]. 中国科技论文, 2016, 11(6):699−705. DOI: 10.3969/j.issn.2095-2783.2016.06.022 TIAN G L, BI Y M, SUN Z J, et al. Progressin allelopathic effect and regulation of phenolic acids for continuous cropping obstacle system [J]. China Sciencepaper, 2016, 11(6): 699−705.(in Chinese) DOI: 10.3969/j.issn.2095-2783.2016.06.022
[7] 马云华, 王秀峰, 魏珉, 等. 黄瓜连作土壤酚酸类物质积累对土壤微生物和酶活性的影响 [J]. 应用生态学报, 2005, 16(11):145−149. MA Y H, WANG X F, WEI M, et al. Accumulation of phenolic acids in continuously cropped cucumber soil and their effects on soil microbes and enzyme activities [J]. Chinese Journal of Applied Ecology, 2005, 16(11): 145−149.(in Chinese)
[8] 郑军辉. 大豆连作障碍中自毒作用的研究[D]. 杭州: 浙江大学, 2003. ZHENG J H. Study on the autotoxicity of soybean continuous cropping obstacles[D]. Hangzhou: Zhejiang University, 2003.(in Chinese)
[9] 田给林.连作草莓土壤酚酸类物质的化感作用及其生物调控研究[D].北京: 中国农业大学, 2015. TIAN G L. Allelopathic effects and biological regulation of phenolic acids in strawberry soils[D]. Beijing: China Agricultural University, 2015.(in Chinese)
[10] 吴立洁. 三七根际土壤中酚酸类物质化感作用及其干预措施研究[D]. 北京: 北京中医药大学, 2014. WU L J. Study on allelopathic effects of phenolic acids in the rhizosphere soil of Panax notoginseng and its intervention measures[D]. Beijing: Beijing University of Chinese Medicine, 2014.(in Chinese)
[11] 白羽祥, 杨成翠, 史普酉, 等. 连作植烟土壤酚酸类物质变化特征及其与主要环境因子的Mantel Test分析 [J]. 中国生态农业学报(中英文), 2019, 27(3):369−379. BAI Y X, YANG C C, SHI P Y, et al. Correlation analysis of main environmental factors and phenolic acids in continuous tobacco cropping soils using Mantel Test [J]. Chinese Journal of Eco-Agriculture, 2019, 27(3): 369−379.(in Chinese)
[12] 柯文辉. 烟草连作障碍的根际微生态研究[D]. 福州: 福建农林大学, 2009. KE W H. Studies on rhizospheric microecology of continuous tobacco cropping obstacle[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009.(in Chinese)
[13] 万海涛, 刘国顺, 田晶晶, 等. 生物炭改土对植烟土壤理化性状动态变化的影响 [J]. 山东农业科学, 2014, 46(4):72−76. DOI: 10.3969/j.issn.1001-4942.2014.04.019 WAN H T, LIU G S, TIAN J J, et al. Effect of biochar for soil amendment on dynamic variation of tobacco soil physical and chemical properties [J]. Shandong Agricultural Sciences, 2014, 46(4): 72−76.(in Chinese) DOI: 10.3969/j.issn.1001-4942.2014.04.019
[14] 邵慧芸, 张阿凤, 李紫玥, 等. 生物炭对烤烟生长、根际土壤性质及叶片重金属含量的影响 [J]. 西北农林科技大学学报(自然科学版), 2019, 47(8):56−53, 64. SHAO H Y, ZHANG A F, LI Z Y, et al. Effects of biochar amendment on tobacco growth, rhizosphere soil properties and heavy metals contents in tobacco leaf [J]. Journal of Northwest A&F University (Natural Science Edition), 2019, 47(8): 56−53, 64.(in Chinese)
[15] WANG Y F, PAN F B, WANG G S, et al. Effects of biochar on photosynthesis and antioxidative system of Malus hupehensis Rehd. seedlings under replant conditions [J]. Scientia Horticulturae, 2014, 175: 9−15. DOI: 10.1016/j.scienta.2014.05.029
[16] ELMER W H, PIGNATELLO J J. Effect of biochar amendments on mycorrhizal associations and Fusarium crown and root rot of asparagus in replant soils [J]. Plant Disease, 2011, 95(95): 960−966.
[17] 吴立洁, 刘杰, 王文祎, 等. 三七根际土壤中酚酸类物质的鉴定及含量测定 [J]. 世界科学技术-中医药现代化, 2014, 16(4):825−829. WU L J, LIU J, WANG W Y, et al. Identification and content determination of phenolic acids of rhizosphere soil of Panax notoginseng [J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2014, 16(4): 825−829.(in Chinese)
[18] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4516−4522. DOI: 10.1073/pnas.1000080107
[19] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10): 996−998. DOI: 10.1038/nmeth.2604
[20] WANG Q, GARRITY G M, TIEDJE J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy [J]. Applied and Environmental Microbiology, 2007, 73(16): 5261−5267. DOI: 10.1128/AEM.00062-07
[21] ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool [J]. Journal of Molecular Biology, 1990, 215(3): 403−410. DOI: 10.1016/S0022-2836(05)80360-2
[22] 白羽祥, 杨焕文, 徐照丽, 等. 连作植烟土壤中酚酸物质与土壤因子的关系分析 [J]. 浙江农业学报, 2018, 30(11):1907−1914. DOI: 10.3969/j.issn.1004-1524.2018.11.14 BAI Y X, YANG H W, XU Z L, et al. Relationship within phenolic acids and soil properties in continuous cropping tobacco soil [J]. Acta Agriculturae Zhejiangensis, 2018, 30(11): 1907−1914.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2018.11.14
[23] 王成己, 唐莉娜, 黄毅斌. 生物质炭调控烟草连作障碍的研究进展 [J]. 福建农业科技, 2018(4):7−12. WANG C J, TANG L N, HUANG Y B. Progress in the regulation effects of biochar on continuous cropping obstacles in tobacco [J]. Fujian Agricultural Science and Technology, 2018(4): 7−12.(in Chinese)
[24] 张相锋, 杨晓绒, 焦子伟. 生物炭在连作障碍治理中的应用综述 [J]. 现代园艺, 2018(19):82−85. DOI: 10.3969/j.issn.1006-4958.2018.19.046 ZHANG X F, YANG X R, JIAO Z W. Review on the application of biochar in the treatment of continuous cropping obstacles [J]. Xiandai Horticulture, 2018(19): 82−85.(in Chinese) DOI: 10.3969/j.issn.1006-4958.2018.19.046
[25] 杨宇虹, 陈冬梅, 晋艳, 等. 不同肥料种类对连作烟草根际土壤微生物功能多样性的影响 [J]. 作物学报, 2011, 37(1):105−111. YANG Y H, CHEN D M, JIN Y, et al. Effects of different fertilizers on functional diversities of microbial flora in rhizospheric soil of monoculture tobacco [J]. Acta Agronomica Sinica, 2011, 37(1): 105−111.(in Chinese)
[26] 马艳, 王光飞. 生物炭防控植物土传病害研究进展 [J]. 中国土壤与肥料, 2014(6):14−20. DOI: 10.11838/sfsc.20140603 MA Y, WANG G F. Review of biochar utilization on soil-borne disease control [J]. Soil and Fertilizer Sciences in China, 2014(6): 14−20.(in Chinese) DOI: 10.11838/sfsc.20140603
[27] 李成江, 李大肥, 周桂夙, 等. 不同种类生物炭对植烟土壤微生物及根茎病害发生的影响 [J]. 作物学报, 2019, 45(2):289−296. DOI: 10.3724/SP.J.1006.2019.01105 LI C J, LI D F, ZHOU G S, et al. Effects of different types of biochar on soil microorganism and rhizome diseases occurrence of flue-cured tobacco [J]. Acta Agronomica Sinica, 2019, 45(2): 289−296.(in Chinese) DOI: 10.3724/SP.J.1006.2019.01105
[28] 孙敬国, 孙光伟, 王昌军, 等. 生物质炭对植烟土壤改良及烟叶品质的影响 [J]. 山西农业科学, 2017, 45(9):1557−1560. DOI: 10.3969/j.issn.1002-2481.2017.09.38 SUN J G, SUN G W, WANG C J, et al. Effects of biochar on soil improvement and tobacco leaf quality [J]. Journal of Shanxi Agricultural Sciences, 2017, 45(9): 1557−1560.(in Chinese) DOI: 10.3969/j.issn.1002-2481.2017.09.38





 下载:
下载: